La insuficiencia cardíaca (IC) es uno de los problemas de salud de mayor importancia en el mundo occidental en cuanto a número creciente de pacientes afectados, tasa de hospitalización y costes. A pesar de la optimización en el tratamiento médico, la mortalidad permanece elevada. El incremento del volumen ventricular tras un infarto de miocardio (IM) forma parte del proceso de remodelado. la cirugía de restauración ventricular (SVR) se introdujo como una opción terapéutica con el objetivo de reducir los volúmenes ventriculares y restaurar la geometría. Hasta ahora, se ha demostrado que la SVR mejora la función cardíaca, el estadio clínico y la supervivencia en pacientes con miocardiopatía dilatada isquémica e IC. la técnica, desde su descripción inicial, se ha refinado en los últimos 10 años en un esfuerzo para estandarizar el procedimiento y optimizar los resultados. En esta revisión se discuten las razones de revertir quirúrgicamente el remodelado de ventrículo izquierdo (VI) , la técnica, el impacto de la SVR en la función cardíaca y la supervivencia, y una información actualizada sobre los ensayos clínicos actuales y las nuevas guías clínicas.
Heart failure is one of the major health care issues in the Western world in terms of increasing number of patients affected, rate of hospitalization, and costs. Despite optimal medical treatment, mortality remains high. The increase in left ventricular volume after a myocardial infarction is a component of the remodeling process. Surgical ventricular restoration (SVR) has been introduced as an optional therapeutic strategy aimed to reduce left ventricular volumes and restore geometry. So far, it has been established that SVR improves cardiac function, clinical status, and survival in patients with ischemic, dilated cardiomyopathy and heart failure. The technique, since its first description, has been refined in the last ten years in an effort to standardize the procedure and to optimize the results. This review will discuss the rationale to surgically reverse lV remodeling, the technique, the impact of SVR on cardiac function and survival, and an up-to-date information regarding the current trials and the new guidelines.
La IC es uno de los problemas mayores de salud pública por su repercusión social, económica y sobre todo humana. La prevalencia en EE.UU. es de 5 millones de personas, y del 30–40% de los pacientes mueren por IC dentro del primer año después de ser diagnosticados1. La IC es la principal causa de hospitalización en las personas mayores de 65 años de edad, y de tasa de reingreso hospitalario en los primeros 6 meses, en un rango del 25–50%, con la consecuente repercusión económica y social2,3. El trasplante cardíaco sigue siendo el tratamiento de elección para los pacientes con IC en fase terminal que no han respondido al tratamiento médico4,5. Sin embargo, la necesidad de inmunosupresión y el número limitado de donantes han restringido los criterios de selección, obligando a investigar otras opciones terapéuticas. El tratamiento médico enfocado a bloquear la vía neurohormonal ha mejorado la supervivencia, al frenar la progresión de la enfermedad6–8. Sin embargo, a pesar de una estrategia médica óptima, el porcentaje de pacientes con signos y síntomas de IC sigue siendo alto, lo que apoya el concepto de que la IC progresa de forma independiente de la activación neurohormonal, debido a un aumento anormal y excesivo del volumen del VI, de acuerdo con el modelo biomecánico expresado por Mann y Bristow9. Este concepto de un modelo biomecánico introduce la necesidad de plantear estrategias opcionales destinadas a reducir los volúmenes del VI y restaurar su geometría. La SVR se introdujo para restaurar la forma, tamaño y función del VI en pacientes con miocardiopatía isquémica e IC. La técnica, introducida inicialmente por Dor10 y Jatene11, se ha refinado en los últimos 10 años en un esfuerzo por estandarizar el procedimiento y optimizar los resultados. En este artículo se discuten los argumentos que aconsejan revertir quirúrgicamente tanto el remodelado del ventrículo como la técnica y el impacto de la SVR en la función cardíaca y la supervivencia, y las expectativas futuras.
El remodelado del ventrículo izquierdoEl remodelado del VI es el proceso mediante el cual factores mecánicos, neurohormonales y, posiblemente, genéticos alteran el tamaño, la forma y la función ventricular. El remodelado se produce en varias situaciones clínicas, incluyendo el IM, la miocardiopatía, la hipertensión y la enfermedad valvular.
En el IM, particularmente en infartos transmurales, se produce un conjunto de cambios estructurales que afectan tanto a las zonas infartadas como a las no infartadas12. Como regla general, el remodelado comienza en las primeras horas después de un IM, y puede prolongarse en el tiempo. El anormal adelgazamiento y dilatación de la zona necrótica, que inicialmente se considera una compensación para mantener el volumen sistólico a medida que disminuye la fracción de eyección (FE), se acompaña de una segunda fase de hipertrofia excéntrica por sobrecarga de volumen de las zonas no infartadas, regiones remotas que deberían contrarrestar el aumento de tensión de la pared y reducir los estímulos que hacen que se siga dilatando el ventrículo13,14. Sin embargo, hay un balance negativo relacionado con el tamaño del infarto y el grado de pérdida de células miocárdicas, lo cual puede dar lugar a una serie de condiciones que promueven la dilatación y la disfunción global del VI12. Los cambios estructurales y geométricos del ventrículo proceden, junto con otros factores, como el estrés de los miocitos, el aumento de la activación neurohormonal, la síntesis de colágeno, la fibrosis y el remodelado de la matriz extracelular, con un mayor deterioro de la función cardíaca15.
Las razones de la cirugía de restauración ventricularLa SVR se ha desarrollado con el objetivo de mejorar la función cardíaca a través de una reducción de la tensión de la pared del VI, de acuerdo con el principio de la Ley de Laplace. Dado que la tensión de la pared del VI es directamente proporcional al radio inter-no del VI y a la presión, e inversamente proporcional al espesor de la pared, cualquier intervención para optimizar esta relación es beneficiosa para mejorar la distensibilidad de la pared y reducir la presión de llenado o, debido a que el estrés de la pared es un determinante crucial de la poscarga, mejora el rendimiento contráctil del VI al aumentar el alcance y la velocidad de acortamiento sistólico de las fibras16.
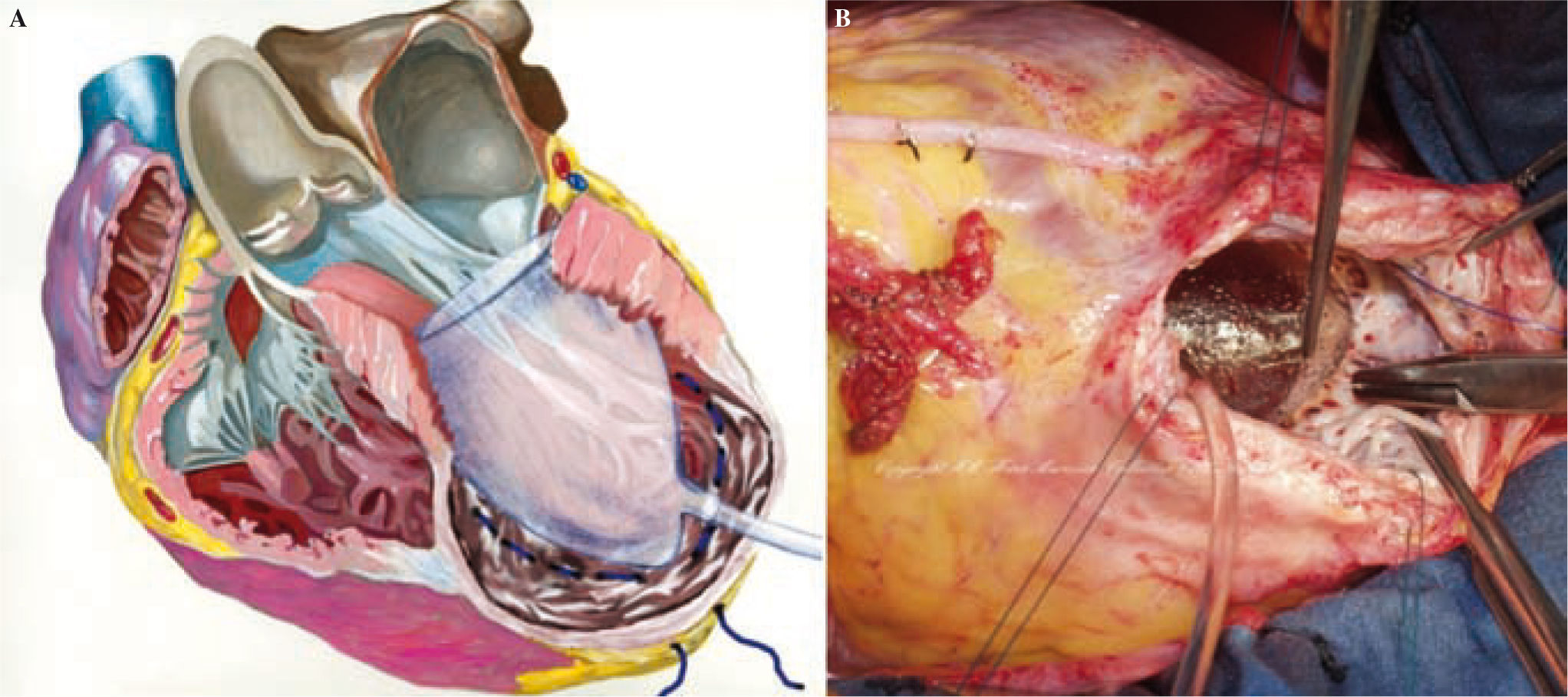
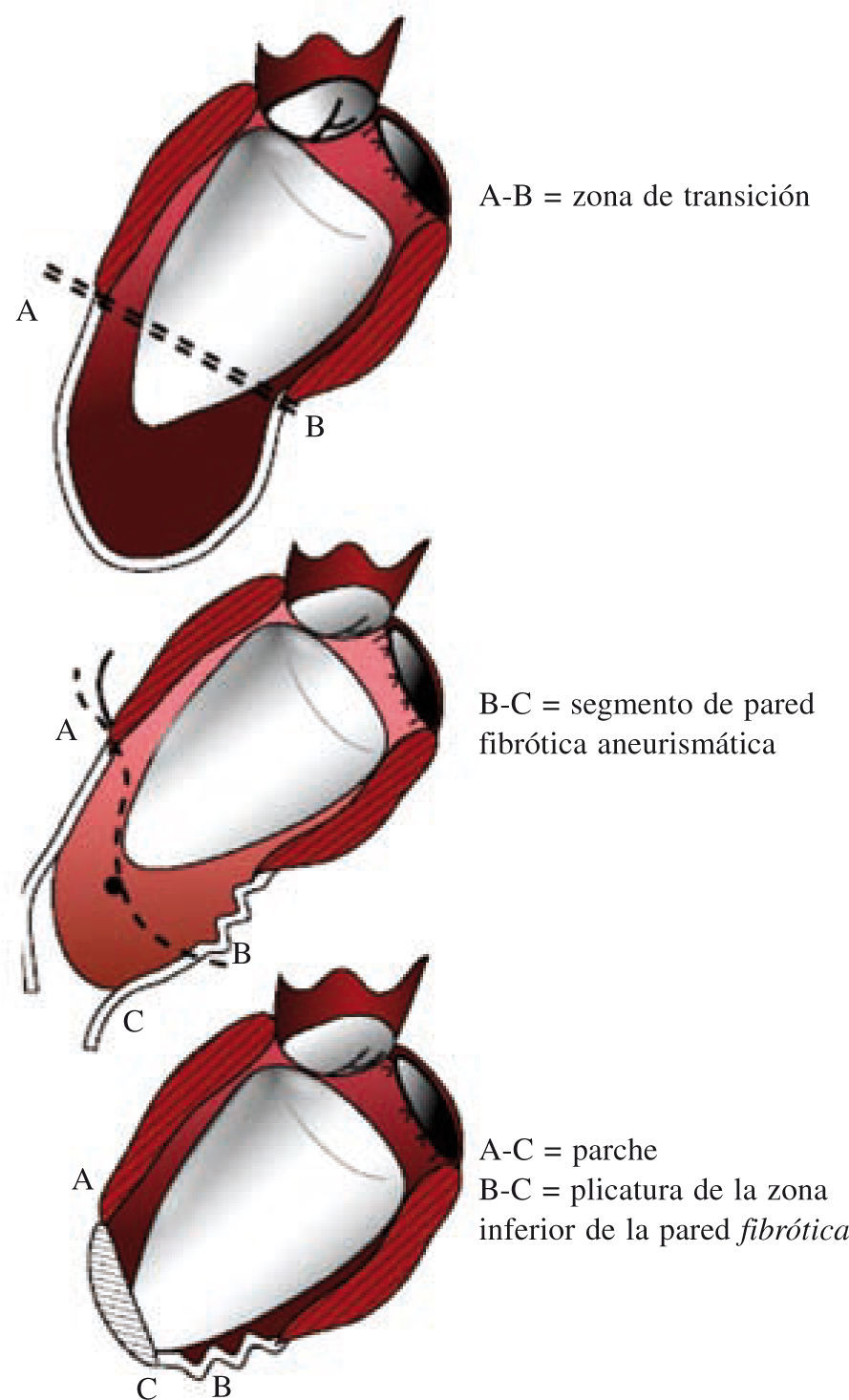
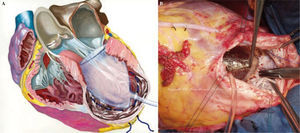
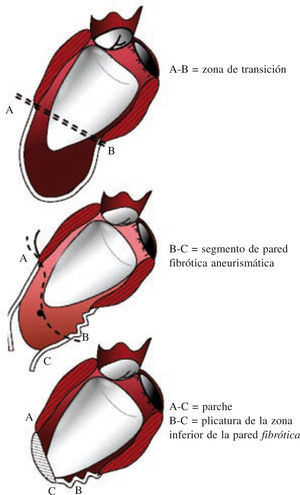
Técnica de la cirugía de restauración ventricularDespués de la primera descripción de la sutura lineal realizada por Cooley en 195817 y de la sutura externa circular descrita por Jatene en 198411, Dor comenzó a usar un parche circular para reconstruir el VI («plastia circular endoventricular»)10,18. La técnica, realizada con clampaje aórtico, conlleva la apertura del ventrículo en el centro de la zona deprimida, la trombectomía, cuando esté indicado, y la resección de la zona discinética o acinética de la pared libre del VI mediante una sutura circular endoventricular apoyada en el tejido fibroso por encima de la zona de transición. En el caso de arritmias ventriculares recurrentes, se aplica crioterapia en los límites de la resección. Se asegura, además, un parche de dacrón alineado con pericardio en la unión del músculo endocárdico y el tejido cicatricial, lo que excluye las porciones no contráctiles del VI y del tabique ventricular. La zona cicatricial excluida se pliega sobre el parche para asegurar la hemostasia. Tiene una importancia especial la revascularización del segmento proximal de la arteria descendente anterior, así como la corrección de la insuficiencia mitral. Además, para evitar un exceso de resección, lo cual llevaría a un volumen residual muy pequeño y a una miocardiopatía restrictiva, Dor introdujo el uso de un balón intraventricular con un volumen de 60ml/m2 para un volumen telediastólico de ventrículo izquierdo (VTDVI) preoperatorio inferior a 150ml/m2, o 70ml/m2 para un VTDVI preoperatorio superior a 150ml/m2; el balón se retira antes del cierre del ventrículo. Más tarde, el procedimiento ha sido adoptado por muchos cirujanos expertos y creativos dejando, sin embargo, la técnica lejos de una estandarización real, lo cual hace que los resultados sean difíciles de comparar. McCarthy describió una doble sutura en bolsa de tabaco19, y Mickleborough una resección a medida a través de la escara, junto con septoplastia, cuando hay discinesia del tabique, y un cierre lineal modificado20. Menicanti ha adoptado una técnica que no difiere sustancialmente del procedimiento de Dor, excepto por el uso, desde julio de 2001, de un molde preformado (TRISVR™ TRISUR™. Chase Medical, Richardson, TX, USA), como se ilustra en la figura 121. El molde es útil cuando el ventrículo no es muy grande (para reducir el riesgo de una cavidad residual muy pequeña y una miocardiopatía restrictiva), o cuando la zona de transición entre el tejido sano y el cicatricial no está claramente delimitada, como ocurre en la miocardiopatía dilatada y el IM reciente. El molde se retira antes del cierre del VI, y el ventrículo se cierra con una sutura directa, si es menor de 3cm de ancho, o con un parche sintético en forma de elipse, si es mayor de 3cm. Sin embargo, el molde es útil para mostrar al cirujano la posición correcta de la punta y evitar que el ventrículo tome forma esférica. La reconstrucción de la punta puede ser difícil cuando las regiones apicales e inferiores están muy dilatadas; en este caso, Menicanti aplica una modificación del procedimiento de Dor, que consiste en la plicatura de la pared distal inferior antes de la colocación del parche, lo que desplaza la punta a una posición más anterior, como se ilustra en la figura 221,22.
Cuando es necesario, la insuficiencia mitral se repara a través de la apertura del ventrículo con una sutura continua desde un trígono al otro, integrando la sutura en el anillo posterior de la válvula mitral. La sutura se anuda para reducir el tamaño del orificio mitral23.
Cirugía de restauración ventricular: función cardíaca y supervivenciaLos primeros resultados consistentes en SVR han sido expuestos por Dor, et al., y muestran que el procedimiento mejora la función del VI, la clase funcional de la New York Association (NYHA) y la supervivencia. Estos resultados se correlacionan con una reducción del volumen ventricular y un incremento de la FE, no sólo en pacientes con aneurisma discinético, sino también en los ventrículos con grandes áreas de asinergia y disfunción sistólica grave del VI24–26. Nuestro grupo ha demostrado, en una serie de sus pacientes tratados con el procedimiento de Dor, que los resultados quirúrgicos se relacionan con la extensión de la asinergia del VI en lugar de con el tipo de asinergia (acinesia vs discinesia). La mortalidad oscila entre 12,2-12,5% en grandes aneurismas ventriculares, frente al 4,8 y 0% en los pequeños aneurismas, con una mortalidad global del 6,8% en los primeros 562 pacientes de la experiencia de Dor27. Varios años más tarde, el grupo RESTORE (primer registro internacional) confirmó la seguridad y la eficacia de la SVR en 1.198 pacientes tratados durante el periodo 1998–200328. La acinesia estuvo presente en el 66% de los casos, llegando hasta el 73,3% entre los pacientes con volumen telesistólico del ventrículo izquierdo (VTSVI) igual o superior a 80ml/m2. Los resultados mostraron una mejoría de la FE del 29,6 ± 11,0% en el preoperatorio al 39,5 ± 12,3% después del tratamiento quirúrgico (p < 0,001), y una reducción del VTSVI de 80,4 ± 51,4ml/m2 en el preoperatorio, a 56,6 ± 34,3ml/m2 después de la intervención (p < 0,001). La mortalidad hospitalaria después de la SVR fue del 5,3%, y fue mayor en los pacientes en que se asoció corrección de la insuficiencia mitral (8,7%), si lo comparamos con los pacientes que no precisaron ninguna actuación sobre la válvula mitral (4,0%; p < 0,001). La supervivencia global a 5 años fue de 68,6 ± 2,8%. El porcentaje de pacientes libres de reingreso por IC a los 5 años fue del 78%. Mickleborough publicó en 2004 una serie de 245 pacientes con una mortalidad hospitalaria menor (2,8%) y super-vivencia al año, 5 y 10 años del 92, 82 y 62%, respectivamente20. Sin embargo, junto al hecho de que la técnica es diferente del procedimiento de Dor, cabe señalar que la insuficiencia mitral asociada grave fue considerada una contraindicación relativa; sólo seis pacientes (2%) recibieron cirugía sobre la válvula mitral. O’Neill, et al., en la Cleveland Clinic, han publicado excelentes resultados después de SVR en una serie consecutiva de 220 pacientes. El 17% tenía implantado un desfibrilador antes de la cirugía; en el 49% se había asociado cirugía de la válvula mitral, y el 7% requirió un balón intraaórtico de contrapulsación en el postoperatorio29. La mortalidad hospitalaria fue del 1%, y la supervivencia al año, 3 y 5 años fue del 92, 90 y 80%, respectivamente. Sin embargo, la falta de información sobre el tipo de asinergia, o al menos sobre su extensión, hace que los resultados sean difíciles de comparar con las series anteriores. Más recientemente, nuestro grupo recogió la mayor experiencia de un solo centro en la SVR anterior (1.161 pacientes), que muestra una mortalidad hospitalaria por causa cardíaca del 4,7%30. Los pacientes que requirieron reparación o sustitución de la válvula mitral (18%) tuvieron una mortalidad operatoria significativamente mayor (13 vs 3,0%; p < 0,001), de acuerdo con los resultados del RESTORE31–39. En un subgrupo de 254 pacientes publicamos que la insuficiencia mitral por sí sola no aumenta significativamente el riesgo de mortalidad operatoria; por el contrario, si se asocia con una clase NYHA III/IV determina un aumento significativo de la mortalidad, y si se asocia a una disfunción diastólica grave, el riesgo es aún mayor, lo que demuestra, por primera vez, que la disfunción diastólica grave puede ser un factor de riesgo para la SVR.
La cirugía de restauración ventricular y la insuficiencia mitralLa cuestión de la insuficiencia mitral, en lo que se refiere a cuándo y cómo debe ser corregida durante la SVR, es todavía objeto de debate. En la IC, la insuficiencia mitral es secundaria a la dilatación anular, a la modificación de la geometría del VI y a la disfunción de los músculos papilares40,41. La sobrecarga de volumen genera la progresiva dilatación del VI y del anillo valvular, empeora la regurgitación mitral, y reduce la supervivencia42,43. Está aceptado que la insuficiencia mitral de moderada-grave (grado III/IV) es una indicación para la reparación quirúrgica junto con la SVR; sin embargo, se ha publicado que la asociación de reparación mitral y SVR ± cirugía de revascularización coronaria o cirugía de revascularización coronaria aislada aumenta el riesgo quirúrgico44–47. Sartipy, et al. confirmaron una mortalidad operatoria mayor (16%) en pacientes con insuficiencia mitral de leve-grave sometidos a reparación mitral junto con SVR46. La supervivencia global fue significativamente menor en estos pacientes en comparación con pacientes sometidos a SVR sin actuación sobre la válvula mitral. Por otra parte, en las series de Sartipy31, el grado de insuficiencia mitral reparada fue de grado leve-moderado (2+) en la mayoría de los pacientes (18/31).
De hecho, la SVR tiene la capacidad de mejorar el funcionamiento mitral mediante la reducción de los volúmenes del VI, la distancia de los músculos papilares (que es un determinante principal de la insuficiencia mitral funcional) y la reconstrucción de una geometría más normal21,48,49. Hasta ahora, nuestro grupo, en un artículo reciente, ha abordado la efectividad de la SVR en insuficiencia mitral isquémica leve no reparada, demostrando que mejora el funcionamiento mitral mediante la mejora de las anomalías de la geometría50. La supervivencia a medio plazo, incluida la mortalidad precoz, fue de 93% al año y 88% a los 3 años; mayor de lo que cabría esperar en pacientes con ventrículos dilatados postinfarto y con depresión sistólica de la función ventricular izquierda, lo que induce a pensar que la reparación mitral junto con la SVR sería innecesaria en estos pacientes. Aún es necesario analizar un número mayor de pacientes con un seguimiento a largo plazo para que los resultados sean concluyentes.
La cirugía de restauración ventricular y la función diastólicaA pesar de las excelentes contribuciones que defienden la SVR como una estrategia terapéutica óptima para los pacientes con IC isquémica, hay pocos datos disponibles sobre la función diastólica del VI en pacientes sometidos a SVR. El remodelado ventricular tras un IM viene acompañado de cambios en las propiedades diastólicas del VI, debido a la formación de cicatrices, lo que, a su vez, aumenta la rigidez de la cavidad y la hipertrofia compensatoria de la zona remota, las cuales son responsables de un retraso en la relajación51. El aumento resultante de la presión de llenado en el ventrículo puede ser responsable, a su vez, de la dilatación del VI. Los estudios experimentales sugieren un efecto adverso en la función diastólica inducido por la cirugía de reducción de volumen52,53. Tulner, et al. presentaron resultados, obtenidos del análisis de las curvas presión-volumen antes y después de la SVR, que sugieren una mejora en la función sistólica y que contrarrestan los cambios en las propiedades diastólicas, como lo demuestra el constante aumento de la rigidez54. Sin embargo, el estudio se llevó a cabo utilizando cardioplejía en las intervenciones, lo que, en parte, podría ser responsable del edema intersticial y del aumento de la rigidez diastólica del ventrículo; es lo que opinaban también Ratcliffe y Guy55. Anteriormente, nuestro grupo publicó los resultados obtenidos de la medición simultánea de presión-volumen en 30 pacientes consecutivos antes y aproximadamente 10 días después de la cirugía56. Mostramos una mejoría de la función diastólica después de la SVR apoyada por un aumento significativo de la tasa máxima de llenado (PFR) y una disminución de la constante de caída de presión (t). Ese tipo de discrepancia podría deberse al diferente intervalo de tiempo de la evaluación invasiva postoperatoria o al perfil del paciente: en el grupo de estudio de Tulner los pacientes eran mayores, el 100% en clase funcional III-IV y con FE inferior al 30%, mientras que en nuestro grupo de estudio los pacientes eran más jóvenes; el 43,3% de ellos estaban en clase funcional I-II y, más importante, el 63,3% tenía una escara discinética, que es un tejido con más complianza, y cuya resección o exclusión no afecta a la función diastólica, que a largo plazo puede mejorar57.
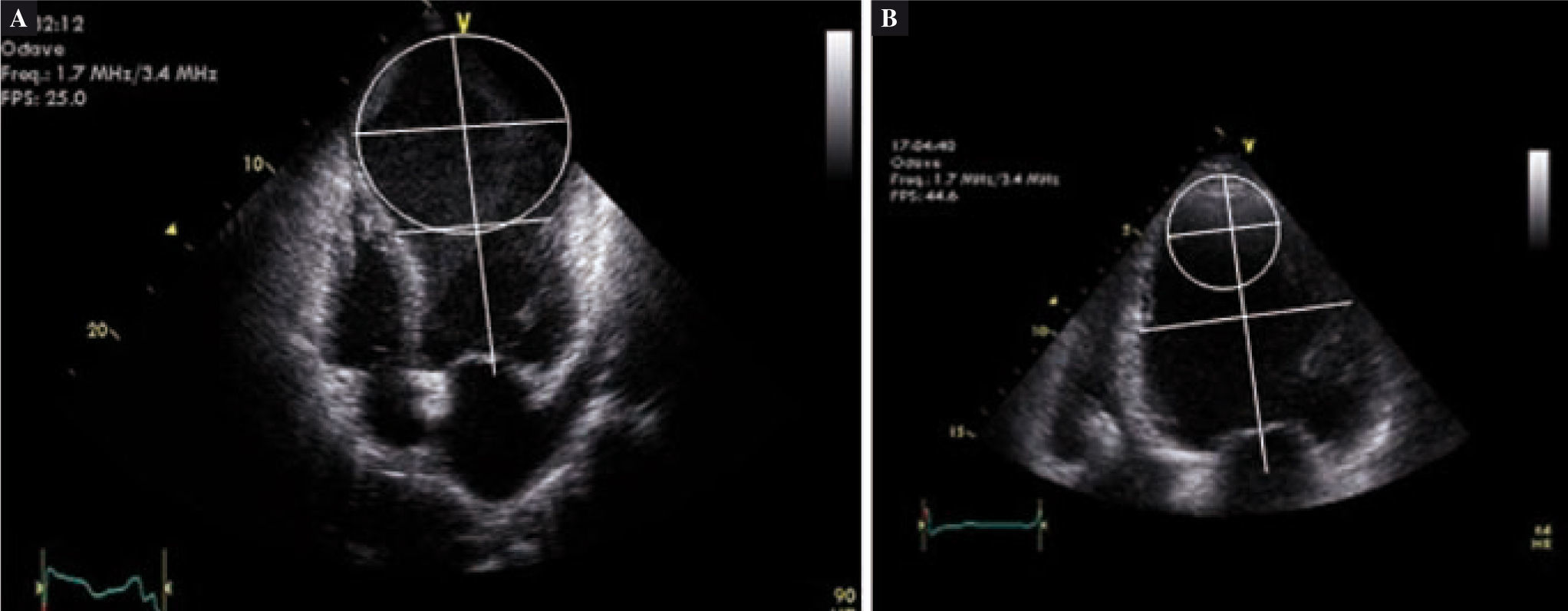
Es razonable pensar que las implicaciones geométricas, así como el volumen residual de la cavidad del VI, pueden afectar a la función diastólica en pacientes sometidos a la SVR. Hemos abordado esta cuestión en un artículo reciente58. Ciento cuarenta y seis pacientes fueron sometidos a un examen ecocardiográfico completo antes de la SVR y de 7–10 días después de la cirugía, en el momento del alta. La función diastólica se estudió utilizando el modelo de velocidad de flujo transmitral, y se establecieron cuatro clases: normal, relajación anormal, seudonormal, y patrón restrictivo. La función diastólica se manifestó sin cambios (sin diferencia en el patrón diastólico), con mejoría (por lo menos una clase funcional menos) o como empeoramiento (al menos una clase más o, en el caso de un patrón restrictivo preoperatorio, un incremento de la relación E/A de al menos un 20%). Después de la SVR, el patrón de llenado se mantuvo sin cambios en 105 casos (72%), mejoró en 14 (9,6%) y empeoró en 27 (18,4%). Basándonos en el análisis univariante, el índice preoperatorio de conicidad, obtenido mediante la relación entre el ápex, y el eje corto en la vista de cuatro cámaras (Fig. 3)59 y la diferencia de volumen diastólico final (el resultado de la cirugía de reducción de volumen) se asociaron con un patrón diastólico de empeoramiento, en el sentido de que, cuando hay una dilatación global de cavidades (índice de conicidad < 1), es más probable que empeore la función diastólica en comparación con cavidades del VI igualmente dilatadas, sobre todo a nivel apical (índice de conicidad > 1) por la presencia de una escara discinética.
La cirugía de restauración ventricular y la asincronía del ventrículo izquierdoLa compleja secuencia de acontecimientos que conducen al remodelado del VI implica la presencia de las zonas con escaras que no son eléctricamente excitables, y predispone a la falta de homogeneidad eléctrica que, a su vez, induce una contracción, una relajación, y un relleno sin uniformidad, con un mayor deterioro de la función global sistólica y diastólica. La terapia de resincronización cardíaca ha dado lugar a una mejoría tanto de la calidad de vida como de los síntomas y de la supervivencia en pacientes con IC refractaria debida a disfunción sistólica y a disincronía mecánica definida por la presencia de QRS ancho60,61. Sin embargo, a pesar de la enorme recopilación de datos procedentes de varios documentos, todavía hay una enorme controversia en torno a esta estrategia terapéutica opcional para los pacientes con IC. Las razones son diferentes: a) el porcentaje de los que no responden (34% en el ensayo MILAGRO [Multicenter InSync Randomized Clinical Evaluation]62), aunque no hay una definición uniforme de «respuesta» o «no respuesta», y b) la falta de parámetros ecocardiográficos estandarizados de disincronía para la selección de los pacientes, ya sea por limitaciones técnicas o teóricas (viabilidad miocárdica en la zona estimulada, las condiciones subyacentes como la fibrosis miocárdica y la hipertrofia, y la ubicación del lugar de establecimiento del ritmo)63.
Teniendo en cuenta que el objetivo de la SVR es excluir el tejido cicatricial, nuestro grupo publicó los datos de un estudio prospectivo realizado en 30 pacientes sometidos a SVR en el Centro Cardiotorácico de Mónaco56. Los pacientes fueron evaluados con un protocolo que incluye mediciones simultáneas de los volúmenes y la presión ventricular para la construcción de curvas de presión/volumen y de presión/longitud. La duración media del QRS fue normal (100 ± 17ms). Demostramos que: a) la disincronía intraventricular y la contracción no uniforme se desarrollan como consecuencia del remodelado del VI y es independiente del retraso de la conducción eléctrica, ya que ningún paciente tenía bloqueo de rama izquierda y la duración media preoperatoria del QRS era inferior a 120ms, y b) la SVR produce una resincronización intraventricular mecánica que mejora la eficiencia mecánica y el rendimiento global del VI a través de una distribución mejor de la sinergia del estrés regional durante la contracción isovolumétrica y las fases de relajación. Los resultados sobre la eficacia de la SVR en la disincronía del VI han sido confirmados por otros estudios54,64.
La cirugía de restauración ventricular y las arritmiasEl elevado riesgo de arritmias malignas después de un IM se relaciona con la compleja secuencia de eventos que conducen al remodelado del VI, incluyendo la dilatación que a su vez aumenta el estrés de la pared, la tensión (la tensión es arritmogénica per se), y la presencia de unas cicatrices eléctricamente excitables. Nuestro grupo ha demostrado previamente que los pacientes con arritmias ventriculares (espontáneas o inducidas) tienen unos volúmenes telediastólicos y telesistólicos significativamente mayores que los observados en pacientes sin arritmias65,66. La SVR tiene el potencial de reducir las arritmias ventriculares mediante la exclusión de la escara, la reducción de volúmenes y, por lo tanto, el estrés intraventricular y el estiramiento, el alivio de la isquemia a través de una revascularización coronaria completa, y la mejora de la resincronización mecánica. Hasta ahora, los diferentes grupos han informado de una marcada reducción de las arritmias inducibles y una muy baja incidencia de muerte súbita después de la SVR20,65–67, lo que les lleva a la conclusión de que la SVR podría limitar la necesidad de implantación de un desfibrilador en pacientes adecuados para este tipo de cirugía. La única contribución «negativa», que en realidad no es absolutamente negativa en la «era del desfibrilador», ha sido publicada por O’Neill, et al., de la Cleveland Clinic: después de la SVR de la miocardiopatía isquémica, o la acinesia o discinesia, los pacientes pueden permanecer en riesgo de arritmias ventriculares malignas y, por lo tanto, pueden beneficiarse de la implantación profiláctica de un desfibrilador68. Los autores describen una alta incidencia residual de taquicardia ventricular inducible después de la cirugía (42%), habiéndose implantado un desfibrilador a casi el 50% de su serie. Afirman que la implantación pudo haber salvado 15 vidas, porque se registraron 15 descargas de desfibrilador adecuadas. Según se publica en el ensayo clínico MADIT II (Multi-center Automatic Defibrillator Implantation Trial II), una descarga adecuada de un desfibrilador identifica a los pacientes con mayor riesgo de IC posterior y evita la muerte súbita cardíaca69. A esto hay que ponerle algunas limitaciones, entre ellas, la cuestionable validez del estudio del PE como estratificador de riesgo (protocolo diferente de la estimulación ventricular programada, contraindicación para llevar a cabo en pacientes con trombos intraventriculares, con enfermedad del tronco común izquierdo y/o con disfunción de VI muy grave) y el uso de diferentes técnicas, lo que hace necesaria mucha cautela a la hora de interpretar los resultados.
La cirugía de restauración ventricular y el estrés de los miocitosEl péptido natriurético cerebral (BNP) y su precursor, el NT-pro-BNP, se sintetizan en los miocitos y se liberan durante el estrés hemodinámico, es decir, cuando los ventrículos están dilatados, hipertróficos, o sujetos a aumento de la tensión de la pared70. La prohormona se escinde entonces por una endoproteasa circulante. El BNP provoca vasodilatación arterial, diuresis, natriuresis, y reduce la actividad del sistema renina-angiotensina-aldosterona y del sistema nervioso simpático, en un esfuerzo para equilibrar las alteraciones fisiológicas que se producen en la IC15.
Estudios previos han demostrado que el BNP es un marcador biológico útil para la remodelación del VI, que su activación es más pronunciada en pacientes con IM funcional –más que en aquellos con IM orgánico–, y que puede predecir la mortalidad y la morbilidad en pacientes con IC crónica71–74. Teniendo esto en cuenta, los cambios, a lo largo del tiempo, en los niveles de BNP y NT-pro-BNP podrían ser utilizados para monitorizar estrategias quirúrgicas encaminadas a reducir el remodelado del VI. El primer trabajo que aborda este tema fue publicado por Schenk, et al. de la Fundación de la Cleveland Clinic75. Los autores mostraron una disminución de los niveles plasmáticos de BNP en un 46% del valor basal en el periodo que va desde el momento anterior a la SVR hasta los 3 meses después de la operación. Más recientemente, Sartipy, et al. publicaron un trabajo en el que se muestra una tendencia similar en los péptidos natriuréticos de tipo B después de la SVR76. En concreto, el NT-pro-BNP se redujo significativamente en un 37 y 51%, 6 meses después de la cirugía y en el seguimiento tardío, respectivamente (p=0,03). Una reducción similar se observó para los niveles de BNP en los mismos espacios de tiempo (20 y 34%, respectivamente), aunque no es estadísticamente significativa. La mejora de la clase NYHA se relacionó significativamente con la reducción en los niveles de BNP y NT-pro-BNP 6 meses después de la SVR (r=0,61 y 0,58, respectivamente), así como con el aumento de la FE (r=–0,58 y –0,51, respectivamente) y con la disminución del volumen telesistólico del VI (r=0,65 y 0,62, respectivamente). Se requieren estudios más amplios y con mayor tiempo de seguimiento para investigar si los niveles reducidos de péptidos natriuréticos después de la SVR se asocian con una mejor supervivencia a largo plazo.
Cara a cara con el ensayo stich (tratamiento quirúrgico de la insuficiencia cardíaca isquémica): desde la medicina basada en evidencia a las nuevas directricesEl ensayo STICH, patrocinado por el Instituto Nacional de la Salud, es un ensayo multicéntrico internacional, aleatorio, diseñado para evaluar la superioridad potencial de la cirugía de revascularización aislada sobre el tratamiento médico intensivo para mejorar la supervivencia a largo plazo («la hipótesis de la revascularización, 1») y el beneficio de la restauración quirúrgica del ventrículo, combinada con la cirugía coronaria en orden a la mejora de las tasas de hospitalización por causa cardíaca en comparación con la cirugía de revascularización aislada sola en pacientes con disfunción del VI (FE < 35%) y enfermedad de las arterias coronarias adecuada para la revascularización quirúrgica («la hipótesis de reconstrucción, 2»)77. Los resultados de la hipótesis 2 del ensayo STICH no mostraron ninguna diferencia en la aparición del objetivo primario (un resultado que se refiere tanto a la muerte por cualquier causa como a la hospitalización por causa cardíaca) entre el grupo de cirugía de revascularización y el grupo del procedimiento combinado. Las tasas de muerte a los 30 días de la revascularización sola (5%) y las que se dieron en el caso del procedimiento combinado (6%) fueron similares y bajas en general, y no se observó ninguna diferencia en la tasa de muerte por cualquier causa en una media de seguimiento de 48 meses. Ambos procedimientos tuvieron el mismo éxito en la mejora postoperatoria de la clase Canadian Cardiac Society (CCS) para angina y la clase funcional de la NYHA; también hubo mejoras similares en la ergometría a los 6min con reducciones similares en los síntomas. Sin embargo, hubo una mayor reducción en el índice de volumen sistólico final en el caso de la utilización del procedimiento combinado (16ml/m2, una reducción del 19%, inferior al porcentaje de la reducción publicado en series de observaciones anteriores, que van desde 29–44%), en comparación con cirugía de revascularización sola (5ml/m2, una reducción del 6%); la diferencia entre los dos grupos en los cambios basales fue significativa (p < 0,001). Esta mejora en el volumen ventricular no se tradujo en un beneficio mensurable para los pacientes en términos de supervivencia; de hecho, el volumen telesistólico de ventrículo izquierdo (VTSVI) postoperatorio seguía siendo de gran tamaño (> 60ml/m2) en ambos grupos. Esta observación, junto con el porcentaje relativamente pequeño en la reducción del volumen diastólico ventricular observado en el grupo combinado, expresó la preocupación sobre el alcance del procedimiento de la SVR que se aplicó en este ensayo clínico. Más tarde, para entender mejor los resultados del ensayo STICH, nuestro grupo publicó el impacto sobre la supervivencia de un VTSVI residual superior o inferior a 60ml/m2. Basándonos en estudios previos sobre el papel de un VTSVI superior a 60ml/m2 en la predicción de un aumento de la mortalidad después de un IM, demostramos que el VTSVI posterior a la SVR tiene impacto en la probabilidad de muerte, siendo significativamente mayor en los pacientes que permanecen con un VTSVI postoperatorio igual o superior a 60ml/m2. Formulamos la hipótesis de que la falta de mejoras adicionales en términos de supervivencia en el grupo de la SVR observada en el ensayo STICH podría ser debida a una inadecuada reducción de volumen, lo que dejó a los pacientes de los dos grupos con un riesgo idéntico. En las Sesiones Científicas del American College of Cardiology (ACC) en 2010 en Atlanta, se presentó un análisis de subgrupos del STICH. Se recuperó una serie observacional de la población aleatorizada de 595 pacientes identificados con estudios básicos de laboratorio, definida por el VTSVI preoperatorio (grupo 1 igual o inferior a 60ml/m2, grupo 2=60–90ml/m2, grupo 3 igual o superior a 90ml/m2). La reducción de volumen del VI fue significativamente mayor en todos los grupos combinados (cirugía de revascularización coronaria + SVR), y los pacientes con un VTSVI preoperatorio inferior a 90ml/m2 mostraron una tendencia hacia una menor mortalidad al ser tratados con revascularización + SVR. Sorprendentemente, se observó una reducción significativa de volumen con cirugía de revascularización sola (18ml/m2) en el grupo 3, plan-teándose la cuestión de la extensión de miocardio viable que, si es superior a la cantidad de escara, es una contraindicación clara para la SVR. Por otra parte, se publicó un amplio rango de valores de VTSVI basales en los pacientes del STICH (22–231ml/m2), aumentando así el interrogante de qué ventrículos se han aleatorizado. La decisión de añadir la SVR a la revascularización coronaria debe basarse en una evaluación cuidadosa de los pacientes que tenga en cuenta los síntomas (los síntomas de la IC deben predominar sobre la angina), las mediciones de los volúmenes del VI, la evaluación de la extensión transmural del tejido miocárdico cicatricial, y el hecho de que se debe realizar sólo en los centros con un alto nivel de experiencia quirúrgica78. En este contexto, la resonancia magnética es la técnica de imagen estándar para evaluar la anatomía de miocardio, la función regional y global, la viabilidad y, más importante, la extensión del infarto y el porcentaje de afectación transmural determinado por el realce tardío de gadolinio. Los ensayos clínicos aleatorizados engloban un porcentaje relativamente pequeño de la población. Aunque los datos de los registros observacionales son potencialmente más susceptibles a la aparición de factores de confusión conocidos y desconocidos que los de los ensayos aleatorios, la consistencia de sus resultados es, sin embargo, bastante notable78. El grupo de trabajo sobre la revascularización miocárdica de la Sociedad Europea de Cardiología (ESC) y la Asociación Europea de Cirugía Cardiotorácica (EACTS)79 reconoció el mérito de este procedimiento, que se ha incluido como una opción quirúrgica combinada a la cirugía de revascularización coronaria en pacientes seleccionados con IC y una escara en el territorio de la DA y un VTSVI basal igual o superior a 60ml/m2 (clase de recomendación IIb, nivel de evidencia B).