En pacientes jóvenes y adultos con cardiopatías congénitas y fallo ventricular grave refractarios al tratamiento médico intenso con fármacos vasoactivos y en aquellos pacientes con fallo primario del injerto postrasplante cardíaco, la asistencia circulatoria, bien mediante extracorporeal membrane oxygenation (ECMO), asistencia centrífuga, o asistencia ventricular mecánica (AVM) representan la últimas terapias posibles disponibles en el protocolo de actuación estratégica para mantener al paciente con vida en espera de un corazón donante idóneo para el trasplante, existiendo, no obstante, una mortalidad elevada durante el tiempo de lista de espera.
No obstante, a pesar de los grandes avances y excelentes resultados de la asistencia circulatoria (ECMO) y de la AVM en adultos y niños con cardiopatías congénitas, el ECMO presenta un mayor porcentaje de morbimortalidad, y la AVM dificultades y limitaciones en los niños muy pequeños, por debajo de los 10 kg de peso.
La estrategia del momento de implantación de la asistencia circulatoria (ECMO y AVM), la anticoagulación y su monitorización siguen siendo uno de los factores más problemáticos, especialmente en niños pequeños.
Although heart transplantation has been established as definitive therapy for end-stage cardiac failure in infants, children and adults with congenital heart disease, there continues to be significant mortality during the waiting interval between listing and transplantation.
Centrifugal pumps, extracorporeal membrane oxygenation (ECMO) or ventricular assist devices (VAD) of various design and function principles are in use for temporary support of the failing heart, either aiming at recovery of the heart or more successfully for keeping the patient alive until later transplantation, in the so-called bridge-to-transplant concept.
Extracorporeal membrane oxygenation and centrifugal pump ventricular assist were suitable for only very short-term application and were associated with significant morbidity, mortality and limitations, especially as the duration of the support extends beyond 2–3 weeks.
Anticoagulant treatment and coagulation monitoring and more importantly, earlier decision-making in favor of pump implantation before irreversible shock has set in. despite the remarkable advances with the use of VAD in adults, it is still limited in very small children (less than 10 kg of body weight).
Desde el primer implante en España de una asistencia mecánica biventricular (BIAVD) en edad pediátrica como apoyo vital y puente al trasplante realizado con éxito en el Hospital Universitario La Paz, en octubre de 20061,2, dentro de un programa iniciado con la colaboración del Deutsches Herzzentrum Berlin (DHZB), el número de implantes de dispositivos de asistencia mecánica en niños en España se ha ido incrementando con el tiempo, y 4 años después (junio de 2010) en España se habían implantado 17 dispositivos de AVM como apoyo cardíaco, con una supervivencia del 67%, existiendo dicho programa establecido en la cartera de servicios en dos hospitales de Madrid (La Paz y Gregorio Marañón), uno de Barcelona (Vall d’Hebron) y uno de Córdoba (Reina Sofía).
Asistencia ventricular en cardiopatías congénitasLa asistencia ventricular en pacientes jóvenes y adultos con cardiopatías congénitas está hoy en día considerada como una alternativa más dentro de la estrategia de tratamiento de aquellos pacientes con fallo ventricular grave, refractario al tratamiento médico intenso como puente, bien a la recuperación (menor número de casos) o al trasplante cardíaco (mayor proporción de casos), con una mortalidad cada vez menor, pasando del 40% de mortalidad de media en las series iniciales3–5 a un 25% en la actualidad en los centros con más experiencia, y una morbilidad cada vez menor a partir de una selección adecuada de pacientes y una elección idónea del momento de implantación. Es importante tener claros dos conceptos en la asistencia ventricular: a) la asistencia ventricular no hace milagros, y b) la «regla de las 7 y media»: ni indicarla muy pronto, es decir, cuando «todavía no está indicada», ni muy tarde, cuando la indicación «ya no exista» por fallo multiorgánico.
A pesar de los grandes avances y excelentes resultados de la AVM en adultos y niños con cardiopatías congénitas, la AVM neumática y pulsátil presenta todavía sus dificultades y limitaciones en los niños muy pequeños, por debajo de los 10 kg de peso6. En revisiones recientes de la literatura se puede observar como la supervivencia de los pacientes con AVM ha mejorado sustancialmente con respecto a los primeros implantes, comunicándose una supervivencia media del 77% y una media de tiempo de asistencia en torno a los 3 meses7. Imamura8, en un estudio comparativo entre la AVM con el Berlin Heart y el ECMO, comunica una supervivencia con la AVM del 86%. No obstante, la mortalidad sigue siendo elevada en los niños con AVM por debajo de los 10 kg de peso6–8. En esta franja de peso, el número de implantes es mucho menor y la incidencia de morbimortalidad más elevada. En una serie reciente del grupo de Roma del Bambino Gesù, Brancaccio, et al.6 comunican su experiencia de 10 casos con edad media de 10 meses y un peso medio de 6,4 kg con AVM con el Berlin Heart como puente al trasplante, implantados en un periodo de 8 años, con 4 muertes (supervivencia del 60%) y 5 trasplantes cardíacos realizados. La duración de la asistencia fue de una media de 61 días (2–168 días) y no hubo complicaciones hemorrágicas.
Asistencia ventricular y trasplante cardíacoEn pacientes en fallo cardíaco grave candidatos a trasplante y refractarios al tratamiento médico intenso con fármacos vasoactivos, y en aquellos pacientes con fallo primario del injerto postrasplante cardíaco9, la asistencia circulatoria bien mediante el ECMO, asistencia centrífuga, o mediante la AVM son las últimas terapias posibles disponibles en el protocolo de actuación estratégica en espera de un corazón donante idóneo. Incluso muchos de los pacientes con ECMO previo requieren posteriormente del paso (bridge to bridge) a la AVM, una vez transcurridas las 2 semanas, a lo sumo 3 semanas de apoyo circulatorio con el ECMO9–11.
Desde la aparición en el mercado de la «AVM germana», el Berlin Heart EXCOR, con el pionero implante, en el año 1990, del primer dispositivo por Hertzer10 en el DHZB a un niño de 8 años, con un ventrículo del tamaño adulto, ha supuesto un cambio de paradigma en la estrategia del manejo de los pacientes con cardiopatías congénitas y niños en edad pediátrica con insuficiencia cardíaca terminal. La AVM, además de presentar menor índice de complicaciones que el ECMO, permite una asistencia circulatoria más eficaz, con una descompresión real y efectiva ventricular, y durante un periodo de tiempo mucho más prolongado que con el ECMO.
Está demostrada la eficacia del empleo de la AVM como puente al trasplante. A pesar de una elevada sensibilización inmunológica en los pacientes con AVM previa al trasplante, la supervivencia a largo plazo postrasplante es similar que en los pacientes trasplantados sin AVM. Una de las complicaciones recientemente encontradas en los pacientes con AVM y posterior trasplante cardíaco es la presencia de anticuerpos con un tratamiento efectivo mediante plasmaféresis e inmunoadsorción12–15.
En un estudio comparativo de Imamura, et al.8, de la Universidad de Arkansas, entre 21 casos de ECMO y 21 casos de AVM con el Berlin Heart EXCOR, en pacientes de edades y pesos similares, el grupo de la AVM obtuvo mejores resultados (supervivencia del 86% en AVM vs 57% en ECMO) y la duración del apoyo circulatorio fue mucho mayor en el grupo de AVM (43 días de media vs 15 días en el ECMO).
En la experiencia más reciente de nuestro centro, Hospital Universitario La Paz, con 7 AVM realizadas con Berlin Heart EXCOR, desde la inicial del año 2006, que permitieron 4 de los 37 trasplantes cardíacos en edad pediátrica realizados en nuestro centro y la experiencia del DHZB con 82 implantes en el periodo 1990–2008 (Fig. 1), la AVM permitió un apoyo más prolongado que el ECMO y una supervivencia también mayor, siendo considerado el tratamiento de elección para aquellos casos de fallo ventricular refractario al tratamiento médico máximo, pacientes con bajo gasto cardíaco, perfusión periférica crítica, acidosis metabólica, índice cardíaco inferior a 2,0 l/min/m2, mezcla de saturación venosa inferior a 40%, oliguria (< 1 ml/kg/min), función ventricular muy deprimida y niveles elevados del factor natriurético cerebral, bien directamente en los casos con previsión de necesitar un tratamiento más prolongado, o bien después de una asistencia circulatoria inicial con ECMO o centrífuga en aquellos casos en que esté indicado9,11.
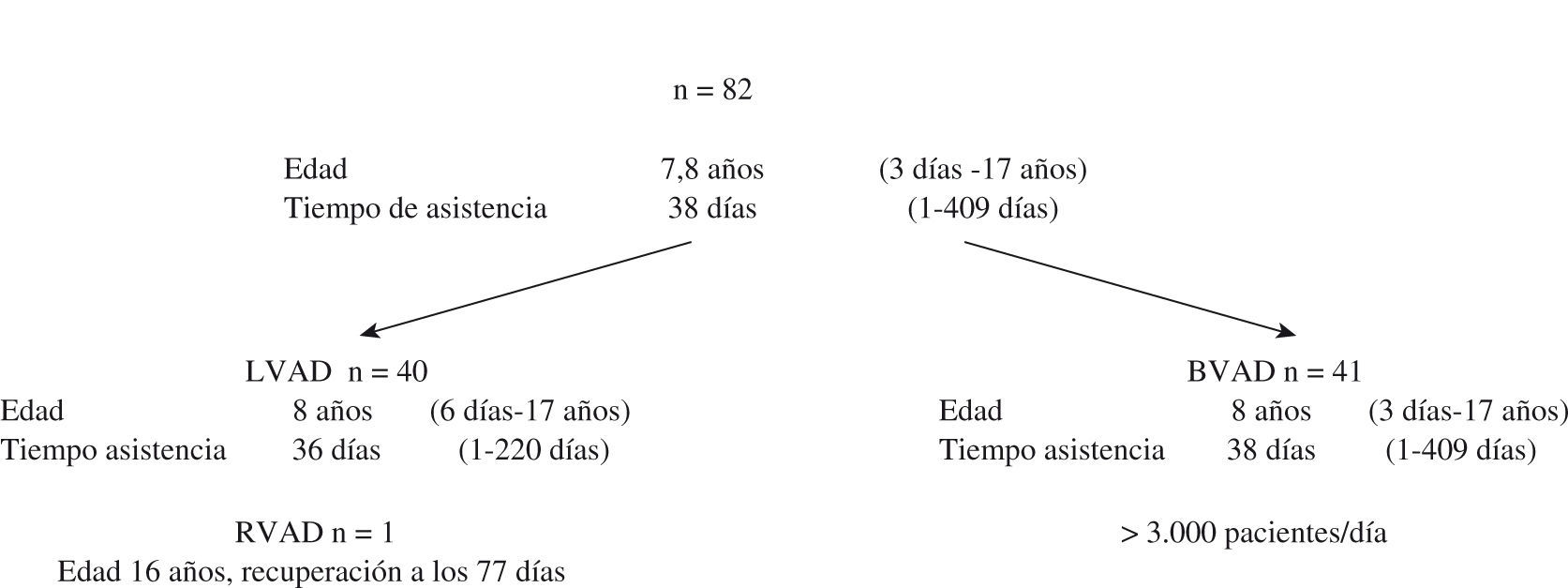
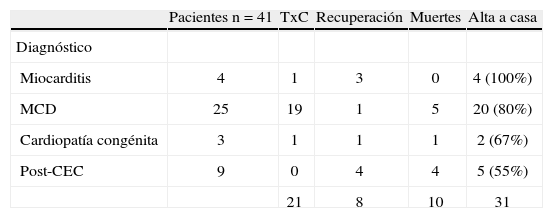
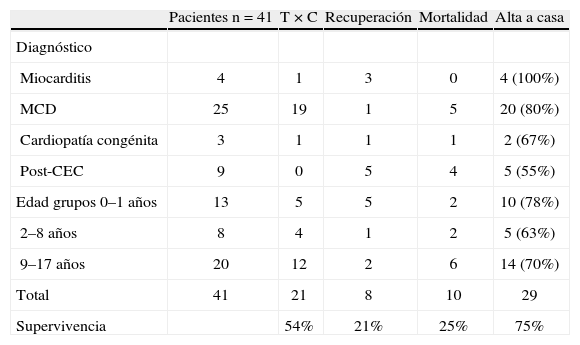
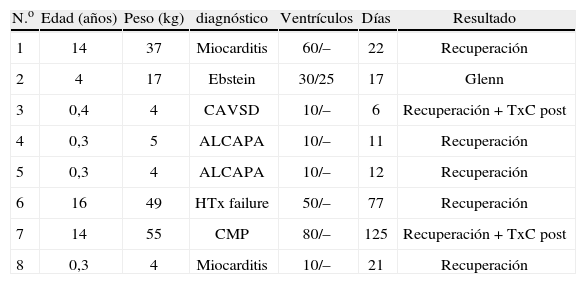
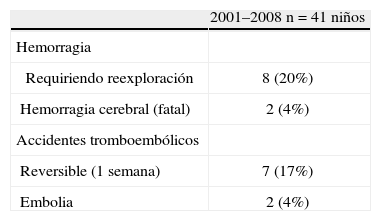
Experiencia clínica con la asistencia ventricular mecánica (Berlin heart excor) en cardiopatías congénitasLa experiencia del DHZB, con 82 asistencias en edad pediátrica, en pacientes con una edad media de 7,8 años, oscilando entre 3 días y 17 años, el tiempo medio de asistencia fue de 38 días, oscilando entre 1–409 días. De los 82 casos, en 41 la asistencia fue en modalidad univentricular, izquierda (LVAD) en 40 y derecha (RVAD) en un caso. Dentro del grupo de LVAD la edad media fue de 8 años, oscilando entre 6 días y 17 años, con una asistencia media de 36 días (1–220 días). En el paciente con RVAD la edad fue de 16 años, con recuperación a los 77 días de asistencia. En modalidad BIAVD hubo 41 casos, con edad media de 8 años (rango: 3 días a 17 años), con tiempo de asistencia media de 38 días (1–409 días) (Fig. 1). La AVM permitió un apoyo más prolongado en el tiempo (media de 38 días oscilando entre 1–409 días, 36 días de media (1–220) en la LVAD y 38 días de media (1–409) en la BIAVD (Fig. 1). Dentro de las indicaciones, en el grupo de pacientes más recientes (periodo 2001–2008) de 41 casos, en 4 la causa de implantación de AVM fue por miocarditis, en 25 por miocardiopatía dilatada (MCD), en 3 cardiopatía congénita y en 9 casos por fallo poscardiotomía, poscirculación extracorpórea (CEC). De los 41 casos, en 21 se pudo realizar trasplante, en 8 hubo recuperación sin necesidad de trasplante, 10 casos de mortalidad y 31 casos de supervivencia (75,6%) (Tabla I). De los 41 pacientes con AVM, 13 eran niños menores de 1 año, con 5 casos de trasplante y 10 casos de super-vivencia (78%) (Tabla II). Dentro de los casos de recuperación con 8 casos, en 5 hubo recuperación sin necesidad de cirugía; en un caso con un Ebstein requirió de un Glenn y sustitución tricúspide, y en dos casos fue posteriormente necesaria la realización de un trasplante cardíaco (Tabla III). La supervivencia postrasplante fue ligeramente inferior en los casos con AVM previa que en los pacientes con trasplante urgente o electivo16 (Fig. 2). Como complicaciones durante la asistencia hubo, de los 41 casos: 10 con hemorragia, de ellos 8 que requirieron exploración quirúrgica (20%) y 2 con hemorragia cerebral (4%); accidentes tromboembólicos en 9 casos, de ellos 7 totalmente reversibles en 1 semana y en 2 con embolia y secuelas (4%) (Tabla IV).
Deutsches herzzentrum berlin. experiencia berlin heart. resultados 2001–2008
| Pacientes n=41 | TxC | Recuperación | Muertes | Alta a casa | |
| Diagnóstico | |||||
| Miocarditis | 4 | 1 | 3 | 0 | 4 (100%) |
| MCD | 25 | 19 | 1 | 5 | 20 (80%) |
| Cardiopatía congénita | 3 | 1 | 1 | 1 | 2 (67%) |
| Post-CEC | 9 | 0 | 4 | 4 | 5 (55%) |
| 21 | 8 | 10 | 31 |
MCD: miocardiopatía dilatada; CEC: circulación extracorpórea; TxC: trasplante cardíaco.
Deutsches herzzentrum berlin. experiencia berlin heart. resultados 2001–2008
| Pacientes n=41 | T × C | Recuperación | Mortalidad | Alta a casa | |
| Diagnóstico | |||||
| Miocarditis | 4 | 1 | 3 | 0 | 4 (100%) |
| MCD | 25 | 19 | 1 | 5 | 20 (80%) |
| Cardiopatía congénita | 3 | 1 | 1 | 1 | 2 (67%) |
| Post-CEC | 9 | 0 | 5 | 4 | 5 (55%) |
| Edad grupos 0–1 años | 13 | 5 | 5 | 2 | 10 (78%) |
| 2–8 años | 8 | 4 | 1 | 2 | 5 (63%) |
| 9–17 años | 20 | 12 | 2 | 6 | 14 (70%) |
| Total | 41 | 21 | 8 | 10 | 29 |
| Supervivencia | 54% | 21% | 25% | 75% |
MCD: miocardiopatía dilatada; CEC: circulación extracorpórea; TxC: trasplante cardíaco.
Deutsches herzzentrum berlin. experiencia berlin heart resultados recuperación (2001–2008) DHZB
| N.o | Edad (años) | Peso (kg) | diagnóstico | Ventrículos | Días | Resultado |
| 1 | 14 | 37 | Miocarditis | 60/– | 22 | Recuperación |
| 2 | 4 | 17 | Ebstein | 30/25 | 17 | Glenn |
| 3 | 0,4 | 4 | CAVSD | 10/– | 6 | Recuperación + TxC post |
| 4 | 0,3 | 5 | ALCAPA | 10/– | 11 | Recuperación |
| 5 | 0,3 | 4 | ALCAPA | 10/– | 12 | Recuperación |
| 6 | 16 | 49 | HTx failure | 50/– | 77 | Recuperación |
| 7 | 14 | 55 | CMP | 80/– | 125 | Recuperación + TxC post |
| 8 | 0,3 | 4 | Miocarditis | 10/– | 21 | Recuperación |
En nuestra experiencia el ECMO y la asistencia centrífuga son de elección en pacientes con fallo cardíaco y/o fallo respiratorio en el inmediato postoperatorio cardiovascular, en aquellos pacientes con dificultad de desconexión de la CEC convencional por síndrome poscardiotomía, en aquellos con trasplante cardíaco y fallo primario del injerto con instauración de manera rápida y eficaz, y la AVM de elección en los casos de miocarditis viral o miocardiopatías en lista de espera para trasplante con signos claros de deterioro de la función ventricular previamente a la instauración de fallo multiorgánico, y en aquellos pacientes con fallo cardíaco grave y previsión de necesidad de un largo periodo de tiempo de apoyo circulatorio y necesidad de descompresión real ventricular.
El ECMO conlleva una problemática distinta y más complicaciones que la AVM, sobre todo problemas hemorrágicos (incluida la hemorragia cerebral), insuficiencia renal, infarto cerebral y fallo multiorgánico. El ECMO y la AVM no son terapias competitivas sino todo lo contrario, son terapias complementarias, y aunque es cierto que en los casos con ECMO que se prolongan la modalidad ECMO se transforma en modalidad AVM (puente al puente) para continuar con el apoyo circulatorio, también es cierto que la instauración de un ECMO o una centrífuga es mucho más rápida y de ejecución más simple, con menor consumo de recursos sanitarios y menor coste, pudiendo realizarse directamente, sin desplazamientos del paciente al quirófano (con ahorro de tiempos), pudiendo instaurarse directamente en la cama de cuidados intensivos, aspecto importante sobre todo en pacientes inestables con insuficiencia cardíaca grave con múltiples apoyos inotrópicos y que empiezan a deteriorarse con arritmias y manifestaciones clínicas-analíticas de desarrollo incipiente de fallo multiorgánico.
Uno de los puntos de diferenciación entre el apoyo circulatorio con ECMO o centrífuga y la AVM es la necesidad o no de apoyo respiratorio asociado. El desarrollo de fallo respiratorio en pacientes subsidiarios de AVM o con AVM implantada limita el empleo de ésta. No obstante, en estos casos se pueden realizar varias opciones terapéuticas:
- –
Un procedimiento híbrido asociado, intercalando un oxigenador de membrana al circuito de salida arterial de la AVM, procedimiento realizado por nosotros de forma pionera en octubre de 2006 en el contexto de una asistencia programada en un paciente de 5 años con fallo ventricular grave por miocarditis. Se instauró una asistencia circulatoria con ECMO y posteriormente, por deterioro e inicio de fallo multiorgánico, se le implantó una AVM Berlin Heart EXCOR, con dificultades en la salida de CEC por hemorragia masiva pulmonar y atelectasia refractaria, por lo que se le intercaló un oxigenador de membrana a la salida de la bomba ventricular izquierda en el lado arterial. El paciente estuvo con el oxigenador intercalado durante 3 días; posteriormente el paciente se mantuvo en AVM durante 210 días y se le pudo realizar un trasplante cardíaco, siendo dado de alta en perfecto estado1,2.
- –
Asociación de un Novalung a la AVM (experiencia de laboratorio)17.
- –
Asociación de un ECMO venovenoso a la AVM18.
Las alternativas terapéuticas para los niños que requieren asistencia circulatoria como puente al trasplante cardíaco son: ECMO, asistencia con bomba centrífuga y AVM. Las dos primeras se emplean para apoyo circulatorio de poca duración (2–3 semanas) y con limitaciones y complicaciones importantes, y la tercera, la AVM para asistencias ventriculares a largo plazo.
En la experiencia del grupo de Arkansas19, de 17 niños con AVM mediante el dispositivo Berlin Heart como puente al trasplante, 6 de ellos con ECMO previo, y 1 con bomba centrífuga, 11 recibieron corazón donante y se trasplantaron, y 1 recuperó su función ventricular. En total hubo 4 exitus, 3 durante el apoyo con AVM y 1 postrasplante. Como complicaciones se detectaron accidentes cerebrovasculares en 7 ocasiones, y en 5 casos fue necesaria la reintervención por hemorragia.
La AVM en niños es una terapia muy reciente, y comienza con la experiencia de Frazier20 en el año 1989 implantando una AVM con corazón de tamaño adulto en un niño de 9 años, seguida de la experiencia del DHZB10 con la implantación de un Berlin Heart también de tamaño adulto a un niño de 8 años. Hasta el año 1992 no existían dispositivos ventriculares de tamaño reducido y adecuados para la implantación en niños de cortas edades. A partir de esta fecha, la AVM ya se ha venido empleando como apoyo temporal en casos de fallo ventricular grave bien con fines de recuperación, sobre todo en la miocarditis, o bien con más éxito como puente al trasplante.
El ECMO o las bombas centrífugas lesionan más los componentes sanguíneos y alteran más el sistema de coagulación que la AVM. El ECMO está indicado como método de elección en aquellos casos de síndrome poscardiotomía en los que no se puede suprimir la CEC, pero se espera una recuperación en horas o días, y en aquellos casos con fallo ventricular asociado con shunt intracardíaco persistente e insuficiencia respiratoria grave, por la dificultad de regulación del flujo de la bomba ventricular. Asimismo, el ECMO está más indicado en los pacientes pediátricos con anatomía compleja y fisiología univentricular y en las resucitaciones tras una parada cardiorrespiratoria con recuperación tras masaje.
La asistencia circulatoria mediante ECMO o AVM es una terapia y opción muy adecuada en los niños con fallo ventricular y/o pulmonar grave, sobre todo en casos de miocarditis aguda con fallo ventricular y respiratorio con un número documentado elevado de recuperaciones postasistencia. En estos casos de miocarditis aguda existe una rápida progresión hacia el deterioro clínico fulminante con fallo ventricular refractario al tratamiento médico intenso. En la serie de Duncan21, recopilando 15 casos de tres hospitales (Washington, Toronto y Boston), 10 con ECMO y 3 con AVM con Berlin Heart comunica 12 supervivientes (80%), de los cuales 9 se recuperaron. La complicación más frecuente del ECMO fue la hemorragia en la zona de canulación en 9 casos (60%).
La necesidad de inotrópicos a dosis terapéuticas máximas, acompañado de extrasístoles ventriculares abundantes, es una combinación muy peligrosa indicativa de necesidad de asistencia ventricular inminente. Las elevaciones de creatinina, enzimas hepáticas y el lactato, tanto preapoyo ventricular como en el inmediato post-AVM, son signos predictivos de mal pronóstico y elevada mortalidad. En estos casos, es ideal instaurar una AVM de manera precoz antes de prolongar el tiempo de permanencia en bajo gasto. También son signos predictivos el factor natriurético elevado y los marcadores inflamatorios22.
En la experiencia reciente del Reino Unido, en el hospital Great Ormond Street23, se comunican 22 casos de niños con edad media de 5,7 años con miocardiopatía terminal a los que se implantó una AVM Berlin Heart como puente al trasplante con una supervivencia del 77%.
En la experiencia inicial del DHZB, de 62 casos con Berlin Heart implantados entre el año 1990 - enero de 2005, Hetzer11 divide la experiencia en dos grupos: grupo A, de 1990–1998, con 34 casos, y grupo B, de 1999–2004, con 28 casos. El tiempo de apoyo fue más largo en B que en A (53,2 vs 17,9 días), la supervivencia fue asimismo superior en B que en A (68 vs 35%). En el grupo de menores de 1 año, de 8 casos en el periodo A no hubo supervivientes, y de 8 casos en el periodo B hubo 7 supervivientes (87,5%). De las complicaciones, la reoperación por sangrado fue necesaria en 8 ocasiones en el grupo A (23,5%), y en 7 del B (25%).
Una de las grandes ventajas de la AVM es la posibilidad de extubación precoz, movilización del paciente y su alimentación oral precoz, también precozmente, aspectos muy importantes en la recuperación posterior. Es necesario destacar también la necesidad menor de transfusiones, el menor riesgo de infecciones y la presencia de anticuerpos antígeno humano leucocitario (HLA)24,25.
La estrategia del momento de implantación de la asistencia circulatoria (ECMO y AVM) es de vital importancia. No debe ser implantada demasiado tarde en niños con vasoplejía sin respuesta a los α-estimulantes y en presencia de fallo multiorgánico irreversible con shock cardiogénico26–28. En nuestras indicaciones está el rápido deterioro, perfusión periférica crítica, acidosis metabólica, índice cardíaco inferior a 2 l min/m2, saturación venosa inferior al 40%, signos de comienzo de insuficiencia renal (incremento de la creatinina) y hepática (incremento de glutámico oxalacelato transaminasa [GOT], transaminasa glutámico pirúvico [GPT], γ-GT) y mala función sistólica ventricular en la ecocardiografía.
La anticoagulación y su monitorización siguen siendo uno de los factores más problemáticos, especialmente en niños pequeños29–33. Nuestra recomendación es seguir las pautas de anticoagulación del DHZB con monitorización de la anticoagulación con el tiempo parcial de tromboplastina activado (60–80s); empleo del tromboelastógrafo para conocer el impacto de la heparina; monitorización de la antitrombina III y reemplazo si el nivel es inferior al 70% en el postoperatorio inmediato. Si es dado de alta, la anticoagulación con dicumarínicos debe mantener un índice internacional normalizado (INR) entre 3-3,5.
Nosotros, en presencia de pacientes con AVM en lista de espera para trasplante, dejamos un tiempo prudente para que se recuperen del fallo multiorgánico y del sistema inmunitario antes de proceder al trasplante9,34. El uso de apoyo circulatorio mecánico AVM en niños como puente al trasplante cardíaco presenta unos retos y unas dificultades diferentes a las encontradas en el adulto debido a la anatomía y fisiología de los pacientes con cardiopatías congénitas35.
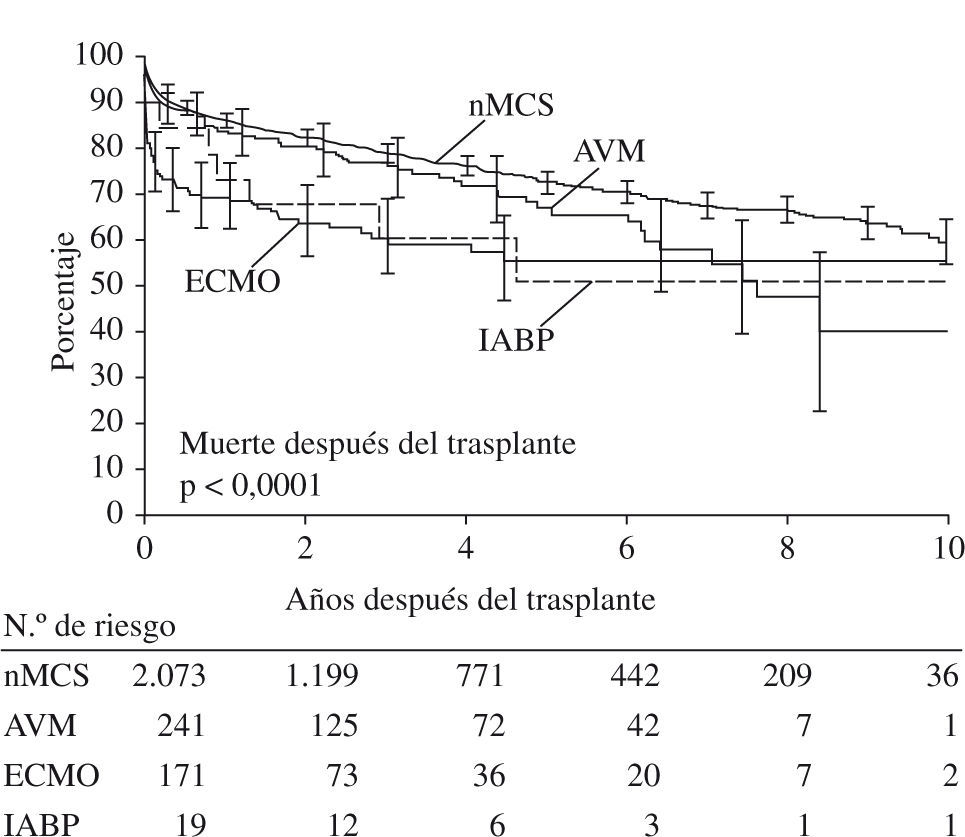
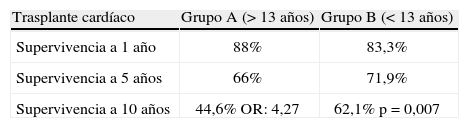
En el año 2008, la United Network for Organ Sharing (UNOS)36 comunicó 2.532 trasplantes cardíacos realizados a nivel mundial en menores de 19 años entre 1995 - diciembre 2005. La edad media fue de 5 años. De éstos, 431 casos tuvieron asistencia circulatoria pretrasplante (18,32%), 241 casos AVM (9,5%), 171 ECMO (6,8%), 19 balones de contrapulsación intraaórticos (IABP) (0,8%). En el estudio se observa que los pacientes con AVM tuvieron similares días de estancia en cuidados intensivos y días de hospitalización postrasplante y menores necesidades de apoyo inotrópico que los casos sin asistencia (p < 0,0002). Aquellos que recibieron ECMO tienen mayor incidencia de complicaciones postoperatorias que los que recibieron AVM (15,4 vs 12,7%), más necesidad de diálisis (17,2 vs 9,1%), y más infecciones (48,2 vs 32,1%). En relación con la mortalidad precoz (30 días postrasplante), los niveles predictivos encontrados fueron: menores de 1 año (odds ratio [OR]: 1,72), superficie corporal inferior a 1 m2 (OR: 1,64), diagnóstico de cardiopatía congénita (OR: 2,15), ECMO pretrasplante (OR: 3,75), necesidad de infusión de prostaglandinas E (OR: 1,73), ventilación mecánica (OR: 2,62), transfusiones recientes (OR: 2,05). En relación con la mortalidad tardía y la supervivencia a largo plazo, la supervivencia a 10 años fue sólo del 56,8%, encontrando mejor supervivencia en los pacientes sin ECMO o con AVM pretrasplante, y peores resultados los pacientes con ECMO previo o los trasplantes en mayores de 13 años (OR: 4,27). Comparativamente, la supervivencia a 1, 5 y 10 años de los pacientes trasplantados con edad superior a los 13 años (grupo A) fue peor que la supervivencia en menores de dicha edad (grupo B) (Tabla V) (fuente UNOS 2008), siendo una de las potenciales razones el hecho de que los pacientes mayores de 13 años tienen más riesgo de desarrollo de ateroesclerosis postrasplante que los más pequeños, y por lo tanto mayor fallo del injerto a largo plazo. También se especula sobre la escasa compliance con los fármacos inmunosupresores en la población mayor de 13 años, fenómeno ya descrito previamente en el trasplante de órganos9.
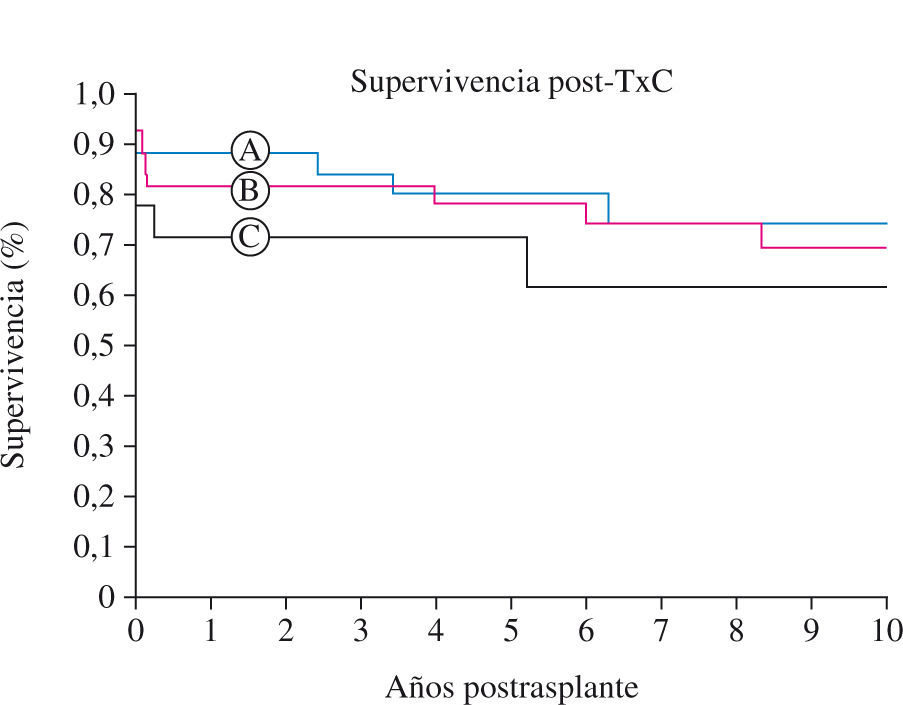
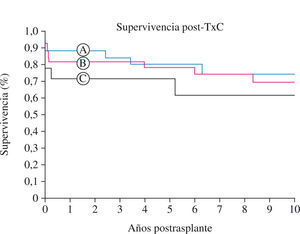
Un dato muy importante y relevante (diferente al comunicado por el grupo del DHZB previamente16) ha sido que la supervivencia postrasplante a los 5 y 10 años es mayor en los pacientes con AVM pretrasplante que en los pacientes que o bien no necesitaron asistencia o en los que la asistencia pretrasplante fue ECMO o IABP (p < 0,0001). De los pacientes con AVM, los de peor resultado son aquellos con superficie corporal inferior a 0,30. Las conclusiones de este estudio son que los pacientes pediátricos que requieren una AVM pretrasplante tienen a largo plazo una supervivencia igual o mayor que los que no la requieren, y que los que requieren ECMO previo y los más pequeños tienen una supervivencia menor a largo plazo. En el subgrupo de los pacientes trasplantados requiriendo apoyo circulatorio, la superficie corporal inferior a 0,30 m2 y los que necesitan ECMO o IABP tienen peores resultados postrasplante. Blume37, comparando la supervivencia a 10 años de los pacientes con y sin AVM, observó que el mayor riesgo de mortalidad era en el inmediato postoperatorio, sin tener incidencia luego a largo plazo.
Los peores resultados en los pacientes con ECMO ya habían sido comunicados previamente por Fiser38, en 2003, con sólo un 34% de pacientes con ECMO superando el trasplante. El grupo de Michigan39 comunicó en el mismo año similares resultados (supervivencia del 57% en pacientes con ECMO pretrasplante). El ECMO tiene más morbilidad y una mortalidad más elevada, sobre todo en duraciones de apoyo superiores a las 2 semanas40.
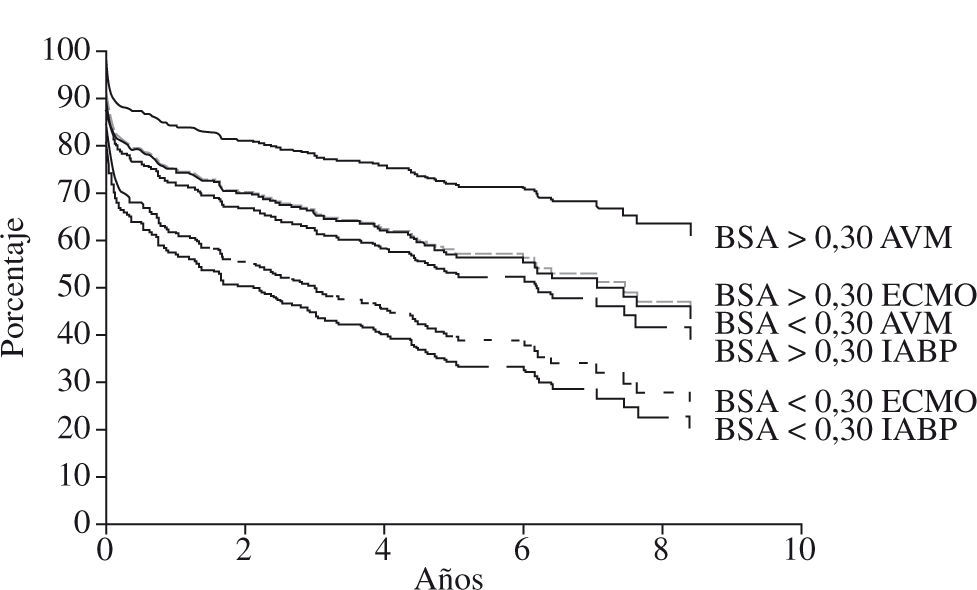
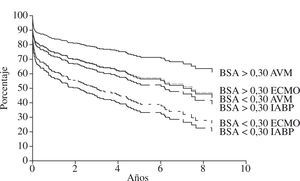
Los pacientes con ECMO tienen mayores probabilidades de fallo renal y un incremento en la mortalidad inmediata (30 días de hospitalización). Después de los 30 días las curvas de supervivencia, tanto de los casos sin apoyo, casos con ECMO o casos con AVM, van paralelas, aunque los pacientes con ECMO necesitaron mayor aporte inotrópico y apoyo de ventilación mecánica41. La necesidad de más inotrópicos demuestra la pobre descarga de volumen y trabajo ventricular que proporciona el ECMO venoarterial. Los pacientes con AVM necesitan menos inotrópicos, con menos días de estancia en unidad de cuidados intensivos (UCI) y posteriormente en planta, con una recuperación mejor, similar a los pacientes sin apoyo circulatorio previo al trasplante. No obstante, en los pacientes pequeños, ya sea con ECMO o con AVM, el pronóstico es peor. La mayoría de pacientes con superficie corporal inferior a 0,30 m2 fueron asistidos con bombas centrífugas en vez de ser asistidos con AVM pulsátil (Figs. 3 y 4).
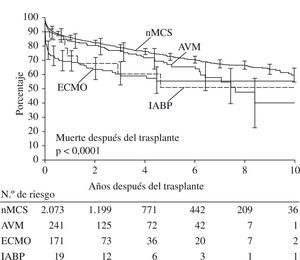
Curva actuarial de supervivencia a 10 años (Kaplan-Meier) estratificada de acuerdo con la necesidad de apoyo circulatorio y el tipo de apoyo. IABP; AVM; apoyo circulatorio mecánico (nMCS). Las barras verticales indican intervalo de confianza del 95%. La parte inferior de la figura muestra el número de pacientes en riesgo, en cada año de valoración (p < 0,0001) (adaptado de UNOS 2008).
La experiencia de la AVM tipo Berlin Heart en EE.UU.7 es bastante similar a la comunicada en Europa11 (experiencia del DHZB). Entre 2000–2007 se implantaron, de acuerdo con la Investigational Device Exemption (IDE), un total de 97 Berlin Heart EXCOR en Norteamérica en 29 centros hospitalarios en pacientes pediátricos. De estos 97, se analizan 73 casos (edad media 2,1 años y peso 11 kg). Los diagnósticos fueron similares: MCD 42 (58%), cardiopatías congénitas 19 (26%), miocarditis 7 (10%), otras miocardiopatías 5 (7%). En 22 casos (30%) se había implantado un ECMO de manera previa a la AVM. Dentro de la AVM, en 42 casos (57%) se instauró LVAD y en 31 casos (43%) BVAD. El implante fue como puente al trasplante en 69 casos (94%) y como puente a la recuperación en 2 casos (3%). Es de destacar entre los resultados que en más del 50% de las ocasiones el implante fue en situación urgente, en estado de shock cardiogénico, y el 48% en pacientes con comienzo ya de fallo multiorgánico. El 33% estaban ya en ECMO previo a la implantación de la AVM. Entre los resultados es de destacar que hubo 5 casos con recuperación sin necesidad de trasplante (7%) y una supervivencia del 77% (mayor en la LVAD con 86%, que en la BVAD con un 65%). En un análisis multivariable realizado, los factores de riesgo de mortalidad durante la AVM fueron la edad inferior a 1 año y la necesidad de AVM en modalidad BVAD.
Trasplante cardíaco y asistencia ventricularEl trasplante cardíaco es la terapia definitiva en presencia de un fallo cardíaco terminal en los niños. No obstante, la mortalidad en espera de un corazón donante en este rango de edad es muy elevada. La disponibilidad actual de medios de apoyo circulatorio en nuestro entorno como el ECMO y la AVM ayudan a mejorar estos resultados. No obstante, los resultados comunicados con el ECMO a nivel de supervivencia, como vemos, son peores a los comunicados con la AVM. Imamura8 comunica un 43% de mortalidad en pacientes con ECMO como puente al trasplante. En el informe de la Extracorporeal Life Support Organizations (ELSO) se observa un 51% de mortalidad en pacientes menores de 16 años con ECMO como puente al trasplante36. En series previas la supervivencia oscila entre el 39–64%, dependiendo de la serie publicada, en los pacientes pediátricos con ECMO como puente al trasplante38–47. Está aceptado que el ECMO es efectivo en un grupo seleccionado de pacientes y para asistencias circulatorias a corto plazo (10–14 días). En asistencias más largas las complicaciones se disparan.
Otra de las grandes ventajas de la AVM es la posibilidad de poder prolongar la asistencia mecánica durante tiempos largos (hasta 409 días en la experiencia del DHZB y 210 en nuestra experiencia en el Hospital Universitario Infantil La Paz), siendo esto de gran valor en el caso de receptores sensibilizados para el que un cross-match selectivo prospectivo es lo más adecuado.
A pesar de la mayor mortalidad encontrada en el estudio IDE7 en pacientes con asistencia BVAD (35%) que en la LVAD (14%), Gandhi48 propone una estrategia de elección de implante de modalidad BVAD en todos los casos de manera rutinaria para evitar el riesgo del potencial fallo derecho post-LVAD, permitiendo una recuperación en teoría más rápida y mejorando la movilidad del paciente de manera precoz.
Hetzer11 comunica un 14% de recuperación y explante de la AVM, sin necesidad de trasplante en la casuística del DHZB, porcentaje mayor que el estudio IDE7 americano, que comunica un 7% de recuperación. Probablemente, la diferencia puede estribar en el porcentaje de miocarditis (13% en la serie del DHZB) y 10% en la serie del IDE7, y a que en EE.UU. muchos de los casos con miocarditis y fallos primarios poscardiotomía o fallo del injerto son tratados previamente con asistencia centrífuga de levitación magnética (Levitronix®), Tamden Heart® o ECMO.