Valorar los resultados obtenidos por una red de vigilancia epidemiológica y asistencial de arbovirosis compuesta por médicos y profesionales de enfermería de hospital y atención primaria (AP) formados en su identificación, confirmación diagnóstica y manejo clínico.
EmplazamientoZona Sanitaria Metropolitana Norte de Barcelona (1.400.000 habitantes; Cataluña, España) durante un año natural.
ParticipantesDiecisiete médicos (7 de AP y 10 hospitalarios) más 4 enfermeros/as de AP.
Tipo de estudioEstudio observacional prospectivo.
Mediciones principalesSe definieron variables demográficas, epidemiológicas (caso autóctono/importado, sospechoso/probable/confirmado) y asistenciales (síntomas, perfil serológico, periodo virémico).
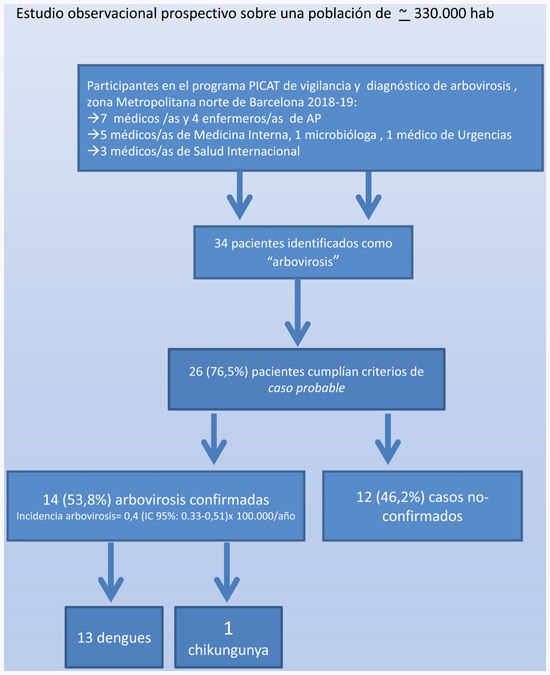
ResultadosDe los 34 pacientes identificados cumplían criterios de estudio 26 (76,5%) casos; de ellos, se confirmó alguna arbovirosis en 14 (53,8%): 13 fiebres dengues más 1chikungunya. No se registraron casos de fiebre de zika. Existían antecedentes de viaje a zonas endémicas (23; 88,4%), pero no en 3 casos (11,6%), en los que se consideró la posibilidad de una transmisión autóctona; de ellos, se confirmó un caso de dengue. La incidencia estimada de arbovirosis fue de 0,4 (IC95%: 0,33-0,51) casos ×10.000hab./año, que, comparada con la incidencia estimada en la misma área geográfica durante el periodo 2009-2013 (0,19 casos ×10.000hab./año; IC95%: 0,07-0,31), mostró un incremento significativo (p=0,044). Los pacientes en periodo de viremia al momento de la primera visita médica fueron 11 (42,3%).
ConclusionesUn programa de vigilancia epidemiológica intensificada definido a nivel de AP y hospitalario es capaz de detectar significativamente más casos de arbovirosis importadas y transmitidas autóctonamente. Posiblemente asistimos a un aumento en la incidencia de arbovirosis importadas, por lo que las medidas encaminadas a su identificación y confirmación deben reforzarse.
To evaluate the results obtained by a surveillance network on arbovirosis composed by doctors and nurses located at hospitals and Primary Care trained in their identification, diagnostic confirmation and clinical management.
LocationNorth Metropolitan Area of Barcelona (1,400,000 inhabitants; Catalonia; Spain) during a calendar year.
ParticipantsSeven Primary Care and 10 hospital physicians plus 4 Primary Care nurses.
Type of studyA prospective observational study.
Main measurementsDemographic, epidemiological (autochthonous/imported, suspect/probable/confirmed case) and healthcare variables (symptoms, serological profile, viral period) were defined.
ResultsOf the 34 patients identified, 26 (76.5%) met study criteria. Among them, any arbovirosis was confirmed in 14 (53.8%): 13 dengue plus 1chikungunya fever. There were no cases of Zika fever. There was a history of travel to endemic areas 23 (88.4%), but not in 3cases (11.6%) in which the possibility of an indigenous transmission was considered; of them, a case of dengue was confirmed. The estimated incidence of arbovirosis was 0.4 (95%CI: 0.33-0.51) cases ×10,000hab/year which, when compared to the estimated incidence in the same geographical area during the period 2009-2013 (0.19cases ×10,000hab/year; 95%CI: 0.07-0.31), a significant increase was found (P=.044). Patients within viremia period at the time of their first medical visit were 11 (42.3%).
ConclusionsAn intensified epidemiological surveillance program defined at Primary Care and hospital levels is able to detect significantly more cases of imported and autochthonous arbovirosis. Possibly we are witnessing an increase in the incidence of imported arbovirosis and, thus, measures aimed at their identification and confirmation should be reinforced.
A finales del sigloxx, en los albores de la globalización y de los efectos palpables del cambio climático, se especulaba ya con la posibilidad de que algunas endemias definidas aún como «tropicales» pudieran expandirse a zonas «subtropicales templadas» como la Cuenca Mediterránea, la Península de Florida o el Mar del Plata, entre otros. Se formularon hipótesis y modelos predictivos concernientes a Plasmodium vivax y Plasmodium falciparum, por ejemplo. No obstante, a la postre, solo los virus vehiculizados por mosquitos han protagonizado brotes epidémicos en la Europa del Sur; nadie previó la aparición de la fiebre chikungunya en el Valle del Po (2007)1,2.
Valorado en perspectiva histórica, los virus transmitidos por artrópodos —arbovirus— ya habían dado muestras de una capacidad expansiva excepcional y a prueba de predicciones; valgan como ejemplo las epidemias de West-Nile en Nueva York (1999)3, de virus chikungunya en el Sudeste Asiático (1958) e Indostán (2006)4, o de virus zika en Polinesia (2014) y Sudamérica (2015)5. La primera identificación entomológica europea de vectores compatibles —Aedes albopictus— databa de 1979 (Albania) y, por lo tanto, la aparición de casos era solo cuestión de tiempo6.
A partir de 2010 los países más amenazados —España, Francia, Italia y Croacia— empiezan a diseñar programas de control entomológico y epidemiológico7. Dichos programas, en general, se centran en recomendaciones y medidas, algunas puramente administrativas como la Declaración Obligatoria de Enfermedad, para implementar a nivel de Salud Pública, así como en la dotación diagnóstica de los laboratorios. No obstante, hacen poca referencia al papel de la atención primaria (AP).
El objetivo del presente estudio es describir los resultados de un programa piloto interniveles (AP y hospitales) de formación, capacitación y diagnóstico precoz de arbovirosis en una zona geográfica densamente colonizada por A.albopictus.
Material y métodosLa zona Metropolitana Norte de Barcelona (Cataluña, España), territorio mayormente urbanizado con 1.400.000 habitantes, reúne condiciones favorables a la aparición de arbovirosis transmitidas autóctonamente. Con el objetivo de su identificación precoz, se diseñó el proyecto de vigilancia epidemiológica PICAT8 (Plataforma Integral para el Control de las Arbovirosis en Cataluña, 2017-2020), financiado mediante el Plan Estratégico de Investigación e Innovación en Salud (PERIS, cod. exp. SLT002/16/00466, Departament de Salut, Generalitat de Catalunya).
Durante 2017, y por medio de la Sociedad Catalana de Medicina Familiar y Comunitaria y su Grupo de Trabajo en Salud Internacional, el programa PICAT impartió un total de 23 ediciones de un curso básico de abordaje de las arbovirosis a 742 médicos/as de AP del conjunto de Cataluña (41 de ellos en la zona Metropolitana Norte).
Posteriormente, con la coordinación del Programa de Salud Internacional (PROSICS) de la zona Metropolitana Norte, se constituyó una red de vigilancia intensificada en arbovirosis interniveles en la que participaban, voluntariamente, profesionales de AP, hospital comarcal y hospital de tercer nivel con formación básica equivalente. En total, la red se constituyó con un total de 17médicos/as (7médicos/as de familia, 2internistas en hospitales de segundo nivel, 3internistas en el hospital de tercer nivel, 1médica de urgencias, 1microbióloga y 3médicos en la Unidad de Salud Internacional) más 4enfermeros/as de AP. Los médicos/as de familia y enfermeros/as participantes se consideraron referentes en arbovirosis de sus respectivas áreas básicas de salud, con lo que se estimó el volumen de población bajo la vigilancia directa de los sanitarios participantes en unas 330.000 personas, lo que representaría aproximadamente un 23% de la población de la zona Metropolitana Norte de Barcelona.
Los sanitarios referentes realizaron un curso adicional de 4horas en arbovirosis. Además, se dotó al laboratorio del Hospital Germans Trias i Pujol (Badalona) de los medios diagnósticos para dengue, chikungunya y zika (Real-Time PCR [RT-PCR] y serologías), al que los médicos de AP tenían acceso. Finalmente se definió un circuito de consulta y/o derivación rápido con un responsable clínico de Salud Internacional localizable. La fase preliminar se dio por cerrada en mayo de 2018.
La fase de implementación se inició en junio de 2018. Durante un año natural (junio de 2018-junio de 2019) los participantes en la red de vigilancia intensificada registraron prospectivamente datos clínicos y epidemiológicos de los casos sospechosos de arbovirosis.
De acuerdo con el Protocolo de Vigilancia y Control de las Arbovirosis en Cataluña9, se definió como caso probable a todo aquel con: a)antecedentes de un desplazamiento a un país endémico o cercanía con un caso índice importado en los últimos 15días y, b)fiebre con al menos dos de los siguientes síntomas: anorexia/náuseas, exantema, artralgias, leucopenia, test del torniquete positivo (aparición de >30 petequias en el hueco antecubital después del mantenimiento de una presión definida entre la sistólica y la diastólica, mediante manguito hinchable, durante 5min) y presencia de síntomas de alarma (fiebre elevada, trombocitopenia, manifestaciones hemorrágicas, hepatomegalia de más de 2traveses, dolor abdominal, vómitos persistentes, acumulación de líquidos, letargia y aumento del hematocrito con disminución del recuento de plaquetas).
Se definió como caso confirmado aquel en el que se detectaba la presencia en sangre de: a)antígeno viral (ARN) por RT-PCR; b)IgM específica de especie (ELISA), o c)incremento (×4) del título-base de anticuerpos IgG específicos de especie con un lapso de 3semanas.
Se consideró a un caso confirmado como de transmisión autóctona si el paciente no refería desplazamientos a zonas endémicas en los últimos 15días.
Se consideró que el periodo de viremia detectable por RT-PCR para cualquier arbovirus era de 5días desde el inicio sintomático, y que entre los días 6 y 120 de la primoinfección las IgM específicas debían ser demostrables. Las muestras serológicas obtenidas a partir del sexto día eran enviadas al Centro Nacional de Microbiología, área virológica, Instituto de Salud CarlosIII (CNE-ISCIII; Majadahonda, Madrid) y testadas en paralelo para virus dengue, chikungunya y zika (dengue: ELISA PanBio®, Australia; chikungunya: IIFT Euroimmun®, Alemania; zika: ZIKV ELISA Euroimmun®, Alemania). En pacientes con las tres serologías negativas y negativos con clínica neurológica asociada, el suero era testado para virus West-Nile.
Los sanitarios/as de referencia en AP disponían además de kits inmunocromatográficos para dengue (BioLineSD®-Dengue IgG/IgM, Standard Diagnostics Inc, Corea del Sur) y chikungunya (BioLine SD®-Chikungunya IgM, Standard Diagnostics Inc, Corea del Sur), dejando claro que suponían un apoyo on site al diagnóstico pero que sus resultados no alteraban el circuito de valoración, declaración, diagnóstico, manejo clínico y estudio epidemiológico.
Todos los casos de arbovirosis son de declaración obligatoria en Cataluña según disposición del decreto DOCG 203/2015 de 15 de septiembre, por el que debía remitirse la información requerida en una ficha epidemiológica específica al Servicio de Vigilancia Epidemiológica Territorial, que a su vez lo notificaba al CNE-ISCIII. Dicha declaración activaba la inspección entomológica contemplada en el PICAT; se tendían trampas para mosquitos (Trampa de Co2 BG-Lure®) y de ovoposición en un perímetro del caso índice definido en Google Earth y se examinaban los mosquitos prendidos en ellas durante al menos 45días.
Se definieron las siguientes variables: sexo, edad, motivo del viaje, origen del caso (Asia, América, África, autóctono), época húmeda/seca en ambos hemisferios (sí/no), caso autóctono/importado, intervalo inicio clínico-regreso a Europa, ingreso hospitalario (sí/no), presentación clínica (fiebre, exantema, fiebre +exantema), arbovirosis confirmada (sí/no), perfil serológico, tipo de arbovirosis (dengue, chikungunya, zika, West-Nile) y periodo virémico (sí/no).
Los casos identificados se registraron en una base de datos que asignaba un número al caso según orden de entrada, asegurando la confidencialidad y tomando todas las medidas de protección vigentes. Los datos se analizaron mediante el programa Stata 10.0® (Stata Corporation, Texas, EE.UU.). Se aplicó la prueba de chi-cuadrado para comparar proporciones, considerando estadísticamente significativos los valores de p<0,05.
ResultadosSe identificaron 34 pacientes sospechosos, de los que 26 (76,5%) cumplían criterios de caso probable y fueron estudiados clínica y serológicamente según el protocolo.
De los casos probables, 19 (73,1%) eran hombres y su edad media fue de 33,1 (9,4) años. Por lo que respecta a los motivos del viaje, 21 (92,3%) tomaron parte en viajes turísticos, uno (3,8%) por motivos laborales y 4 (15,4%) eran inmigrantes en viajes de visita a familiares (VFR-immigrants).
Fueron considerados como casos importados 23 (88,5%) pacientes y autóctonos 3 (11,5%).
Entre los casos importados, procedían de Asia 13 (59%; Filipinas: 5 casos), de América 7 (31,8%; Colombia: 4 casos) y de África 3 (13,7%; Senegal: 2 casos). De los casos considerados autóctonos 2 procedían del área geográfica de estudio (uno en Badalona y uno en Mataró) y uno visitó Kosovo y Eslovaquia.
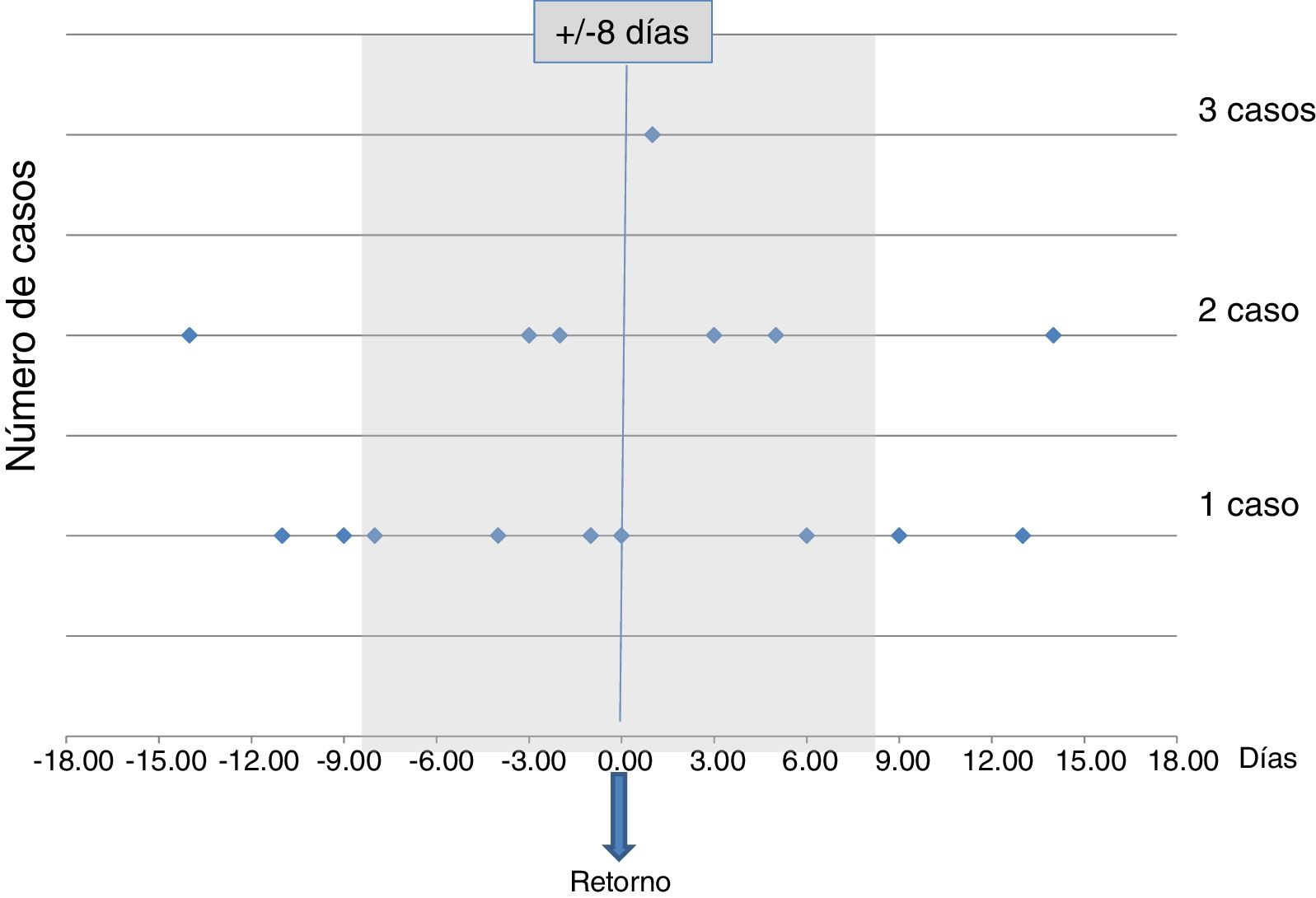
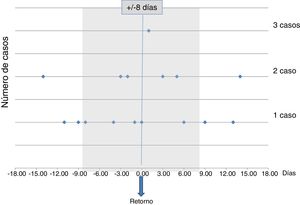
Un 50% de los casos debutaron clínicamente después de regresar a Europa, y hasta un 66% entre los ±8días de la fecha de retorno. La distribución temporal entre el inicio sintomático y el regreso a Europa se muestra en la figura 1.
Tres casos (11,5%) fueron identificados por médicos de AP, 4 (15,4%) de urgencias, 3 (11,5%) de hospitales de segundo nivel, 7 (26,9%) del hospital de tercer nivel y 9 (34,6%) de la Unidad de Salud Internacional-Servicio de Enfermedades Infecciosas.
Por lo que respecta a la presentación clínica inicial, se determinó la presencia de fiebre con exantema en 8 casos (30,8%). La sensibilidad, la especificidad y los valores predictivos comparativos de dicha combinación se presentan en la tabla 1.
Valor diagnóstico para las arbovirosis de la presencia de fiebre + exantema o fiebre y otros síntomas clínicos
| Arbovirosis confirmada | No arbovirosis | Total | |
|---|---|---|---|
| Fiebre + exantema | 7 | 1 | 8 |
| Fiebre o exantema u otros síntomas | 7 | 11 | 18 |
| Total | 14 | 12 | 26 |
Fiebre + exantema: sensibilidad 50% / especificidad 91% / VPP 87% / VPN 61%.
Fiebre + otros síntomas/signos (sin exantema): sensibilidad 50% / especificidad 12,5% / VPP 38,9% / VPN 12,5%
VPN: valor predictivo negativo.
VPP: valor predictivo positivo.
Fueron ingresados 7 (26,9%) pacientes. Dos (7,7%) de los casos presentaron clínica neurológica. Uno de ellos (procedente de Filipinas), con dengue confirmado, desarrolló un síndrome de Guillain-Barré post-dénguico; el segundo caso (procedente de Senegal) presentó una mielitis transversa con reactividad sérica inicial IgM-/IgG+ al virus West-Nile. No obstante, ambas inmunoglobulinas fueron posteriormente negativas en LCR, por lo que el caso quedó sin diagnóstico causal. No hubo casos de síndrome hemorrágico asociado a virus dengue ni el caso de chikungunya desarrolló artropatía inflamatoria postinfectiva.
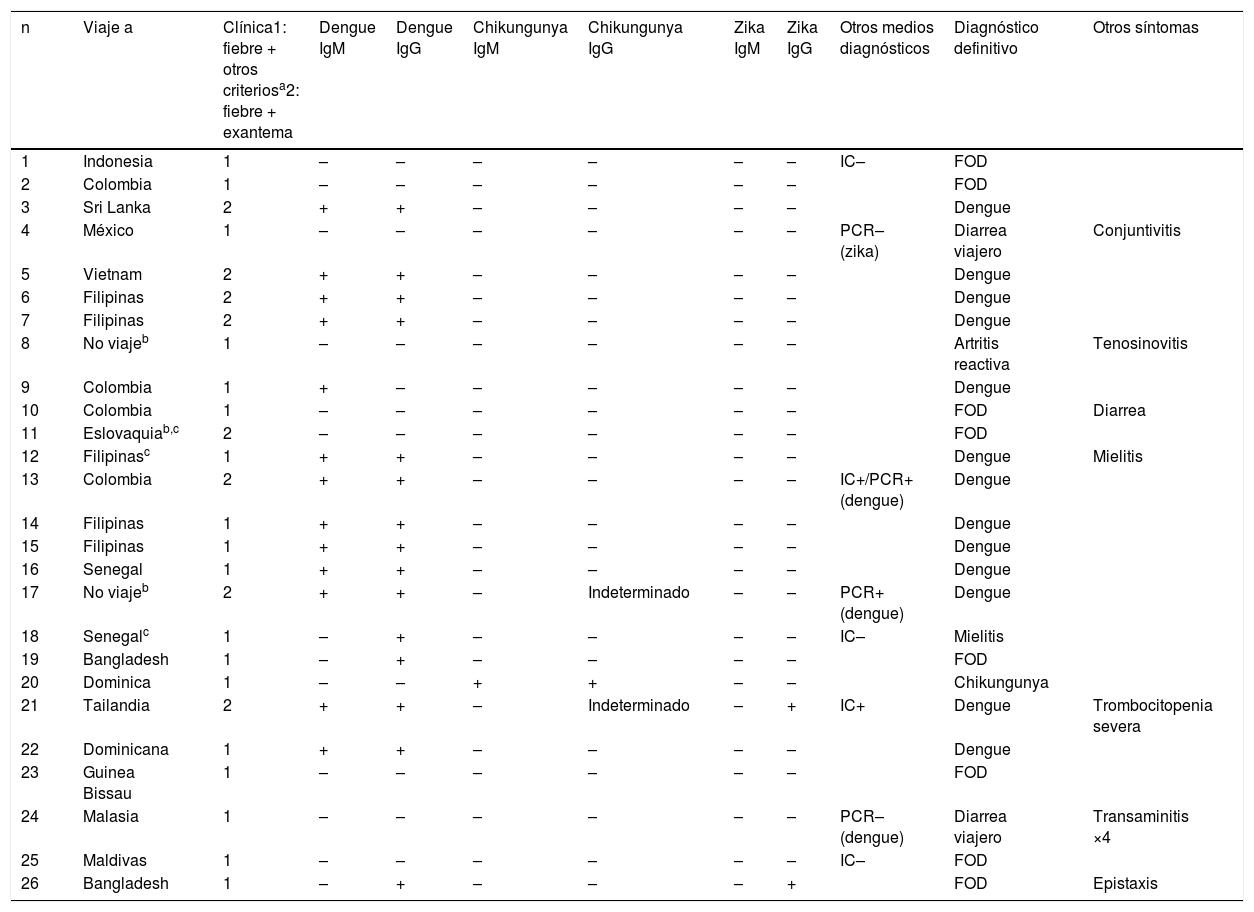
Los casos confirmados fueron 14 arbovirosis (13 dengues y un chikungunya), correspondiente a un 53,8% de los casos estudiados. El inicio sintomático se produjo durante la época húmeda del hemisferio norte (mayo-octubre) o sur (octubre-mayo) en 13 (92,8%) de los 14 casos. Su perfil serológico se muestra en la tabla 2. Cinco pacientes (19,6%, 2 positivos) fueron testados con kits inmunocromatográficos, y 4 (15,4%, 2 positivos), con RT-PCR.
Resumen epidemiológico, clínico y perfil serológico de los pacientes considerados casos probables (n=26)
| n | Viaje a | Clínica1: fiebre + otros criteriosa2: fiebre + exantema | Dengue IgM | Dengue IgG | Chikungunya IgM | Chikungunya IgG | Zika IgM | Zika IgG | Otros medios diagnósticos | Diagnóstico definitivo | Otros síntomas |
|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | Indonesia | 1 | – | – | – | – | – | – | IC– | FOD | |
| 2 | Colombia | 1 | – | – | – | – | – | – | FOD | ||
| 3 | Sri Lanka | 2 | + | + | – | – | – | – | Dengue | ||
| 4 | México | 1 | – | – | – | – | – | – | PCR– (zika) | Diarrea viajero | Conjuntivitis |
| 5 | Vietnam | 2 | + | + | – | – | – | – | Dengue | ||
| 6 | Filipinas | 2 | + | + | – | – | – | – | Dengue | ||
| 7 | Filipinas | 2 | + | + | – | – | – | – | Dengue | ||
| 8 | No viajeb | 1 | – | – | – | – | – | – | Artritis reactiva | Tenosinovitis | |
| 9 | Colombia | 1 | + | – | – | – | – | – | Dengue | ||
| 10 | Colombia | 1 | – | – | – | – | – | – | FOD | Diarrea | |
| 11 | Eslovaquiab,c | 2 | – | – | – | – | – | – | FOD | ||
| 12 | Filipinasc | 1 | + | + | – | – | – | – | Dengue | Mielitis | |
| 13 | Colombia | 2 | + | + | – | – | – | – | IC+/PCR+ (dengue) | Dengue | |
| 14 | Filipinas | 1 | + | + | – | – | – | – | Dengue | ||
| 15 | Filipinas | 1 | + | + | – | – | – | – | Dengue | ||
| 16 | Senegal | 1 | + | + | – | – | – | – | Dengue | ||
| 17 | No viajeb | 2 | + | + | – | Indeterminado | – | – | PCR+ (dengue) | Dengue | |
| 18 | Senegalc | 1 | – | + | – | – | – | – | IC– | Mielitis | |
| 19 | Bangladesh | 1 | – | + | – | – | – | – | FOD | ||
| 20 | Dominica | 1 | – | – | + | + | – | – | Chikungunya | ||
| 21 | Tailandia | 2 | + | + | – | Indeterminado | – | + | IC+ | Dengue | Trombocitopenia severa |
| 22 | Dominicana | 1 | + | + | – | – | – | – | Dengue | ||
| 23 | Guinea Bissau | 1 | – | – | – | – | – | – | FOD | ||
| 24 | Malasia | 1 | – | – | – | – | – | – | PCR– (dengue) | Diarrea viajero | Transaminitis ×4 |
| 25 | Maldivas | 1 | – | – | – | – | – | – | IC– | FOD | |
| 26 | Bangladesh | 1 | – | + | – | – | – | + | FOD | Epistaxis |
Otros criterios diagnósticos (dx requiere la presencia de 2): anorexia/náuseas, enantema, artralgias, leucopenia, test del torniquete positivo, fiebre >39°C, trombocitopenia, manifestaciones hemorrágicas, hepatomegalia >2 traveses, dolor abdominal, ascitis o derrame pleural, letargia, aumento del hematocrito.
La incidencia de arbovirosis en la población estudiada de la zona Metropolitana Norte de Barcelona fue de 0,4 (IC95%: 0,33-0,51) casos ×10.000hab./año, que, comparada con la incidencia estimada en la misma área geográfica durante el periodo 2009-2013 (0,19 casos ×10.000hab./año; IC95%: 0,07-0,31), mostró un incremento significativo (p=0,044).
Uno de los casos confirmados de dengue derivó de una transmisión autóctona en Badalona (clínica compatible y IgM+ e IgG+), aunque la investigación epidemiológica del entorno no identificó conniventes ni mosquitos infectados. Se trata del primer caso demostradamente derivado de una transmisión local europea en Cataluña.
Los pacientes en periodo de viremia al momento de la visita médica en la que sospechó una posible arbovirosis fueron 11 (42,3%). En ninguna de las trampas vectoriales tendidas en el entorno de los casos confirmados en periodo virémico se demostró presencia de A.albopictus infectados.
DiscusiónMuchos son los factores que parecen jugar a favor de los arbovirus en la endemización con mayor o menor intensidad de la Cuenca Mediterránea: población vulnerable, vector competente (A.albopictus), efectos del cambio climático y presencia de viajeros circulantes procedentes de áreas endémicas10-12. No obstante, en los últimos 5años los brotes epidémicos inesperados, explosivos y de rápida expansión han seguido aconteciendo en otras partes del mundo (caso de la epidemia de virus zika en América, 2015-2017). La Europa mediterránea parece asistir a una muy lenta —si bien inexorable— endemización caracterizada por un patrón de pequeños brotes con transmisión autóctona limitada a partir de un caso importado cuando existe una conjunción de circunstancias epidemiológicas, entomológicas y ecológicas favorables, que generalmente acontecen durante el semestre mayo-octubre13.
Algunos países o zonas transnacionales europeas14 han diseñado e implementado programas de vigilancia metodológicamente similares al desplegado en la zona Metropolitana Norte de Barcelona y que podrían ofrecer datos a comparar. En el estudio de Gobbi et al.15 (estudio Summer Fever, Véneto, Italia, 2010-2012, con participación de médicos/as de AP) el número de pacientes/año con arbovirosis importada confirmada fue comparable (también14). En cambio, las cifras aportadas por otros programas de vigilancia epidemiológica supranacional (TropNet)16 basados en unidades de Salud Internacional sin participación de la AP son netamente inferiores (25casos/año para el conjunto de España). Aunque no es posible concluir taxativamente que la inclusión de la AP en los programas formación, capacitación y vigilancia epidemiológica de arbovirosis se traduce en un aumento de diagnósticos, lo cierto es que en la zona Metropolitana Norte de Barcelona se registró un aumento significativo en el número de casos confirmados en comparación con las incidencias publicadas anteriormente (2015)17 en la misma área geográfica pero sin la participación de la AP. Evidentemente cabría argüir que esas diferencias pueden explicarse por un aumento real de la incidencia de arbovirosis, pero aunque dicha posibilidad existe, no es probable: de acuerdo con datos del Ministerio de Sanidad, la incidencia de arbovirosis en Cataluña y España en 2018-2019, mientras se realizó el estudio, fue netamente inferior a la registrada durante el bienio precedente (2016-2017)18. Es decir, se identificaron más casos durante un periodo «valle» general con un programa de vigilancia intensificado que durante el periodo «pico» precedente sin dicho programa. La presencia de médicos/as y enfermeros/as formados/as y con capacidad diagnóstica rompió la tendencia general a la baja en la zona de estudio.
En definitiva, y con la debida prudencia, podría defenderse que el artículo apoya que la mejora de los conocimientos sobre arbovirosis en todos los niveles sanitarios con inclusión de la AP y la disponibilidad de técnicas diagnósticas permiten controlar más fiablemente el patrón epidemiológico de unas enfermedades que posiblemente disponen de unas condiciones más favorables a su emergencia cada año que pasa19.
En la AP se identificaron 3 casos confirmados. Aunque el aporte neto es pequeño, no es despreciable (11,5%). Es muy posible que los pacientes con arbovirosis tuvieran problemas de acceso a sus médicos de AP (por las demoras en agendas) y prefirieran dirigirse a servicios especializados. Ello traduce un problema general que excede al de las enfermedades importadas y en el que la dotación de kits inmunocromatográficos a los centros colaboradores de AP aportó poco o nada. La solución probablemente apunta al refuerzo de las vías estructurales y organizativas, no a la dotación tecnológica2.
La colaboración de la AP, no obstante, fue relevante en otros aspectos clave no evaluados en el estudio pero contemplados en el programa PICAT por lo que se refiere a la investigación epidemiológica del entorno de los casos índice20.
El predominio de casos de virus dengue confirmados sobre los de chikungunya y zika fue avasallador. Otros países europeos han asistido a una disminución paralela en la incidencia de casos de virus de chikungunya importados (pero no por lo que respecta a brotes autóctonos de chikungunya, de los que se registraron 2 en Italia en 2017) debido a la contención de la gran epidemia americana de 201321. Otro tanto parece suceder con el virus zika: a la caída de casos a nivel mundial desde el brote de 2015 debe sumarse la probable incapacidad de A.albopictus para vectorizar el virus en la Península Ibérica22.
Por lo tanto, todo parecía favorecer a la aparición de casos autóctonos de dengue, y así fue. Se registró un caso de dengue por transmisión autóctona. El diagnóstico fue confirmado con el paciente ya fuera del periodo de viremia, lo que impidió una investigación epidemiológica humana y vectorial en el momento más propicio para identificar el virus por RT-PCR en personas y vectores de su entorno. En tanto que hasta el 80% de las infecciones dénguicas pueden ser asintomáticas, la posibilidad de que se dieran otras infecciones secundarias no puede ser descartada23,24.
Pocos pacientes requirieron ingreso hospitalario. Al igual que acontece en los países holoendémicos, las primoinfecciones (dengues clásicos) son enfermedades que pueden ser manejadas fácilmente en consultas externas por médicos formados en arbovirosis25. La presencia de la combinación fiebre y exantema mostró una sensibilidad baja (50%), aunque su especificidad fue alta (91%): dato a tener en cuenta. Es difícil definir mejores indicadores clínicos, ya que solo el 50% de los casos de dengue presentan exantema. En epidemias con mayor expresión dérmica (la fiebre de chikungunya presenta un 80% de exantema) dicha combinación semiológica sería de mayor utilidad26.
La experiencia del primer año de vigilancia apunta a algunas conclusiones:
La implementación de un programa de vigilancia epidemiológica entre niveles asistenciales con inclusión de la AP ha resultado ser factible y eficiente. No sobrecargó al sistema sanitario en general ni al Servicio de Microbiología en particular (26 casos probables/14 casos confirmados)27.
Hay una época de riesgo: más del 90% de los casos confirmados de arbovirosis se presentaron durante el periodo mayo-octubre28. La incidencia interanual aumentó a expensas de casos de dengue. Se registró un caso de transmisión autóctona dénguica a partir de un caso índice importado en un patrón epidemiológico muy similar al de otras regiones mediterráneas densamente colonizadas por A.albopictus29,30. Las incidencias de virus chikungunya y zika importados disminuyeron como reflejo de la contención de las epidemias en sus zonas endémicas18.
Los criterios definitorios de caso probable (antecedente de un desplazamiento internacional más fiebre en los últimos 15días con otro signo clínico, especialmente la presencia de exantema) mostraron una sensibilidad moderada (50%) pero una especificidad alta (91%). En conjunto, fueron adecuados para el programa (53,8% se confirmaron).
Por lo que respecta a la confirmación diagnóstica, hubo una infrautilización de los kits inmunocromatográficos, y su utilidad en la AP como prueba diagnóstica on site es dudosa. Una estrategia posiblemente más razonable consistiría en dotar de RT-PCR específicas a los Servicios de Microbiología del hospital de tercer nivel —y accesibles desde los petitorios de los médicos de AP—, ya que el 42,3% de los pacientes fueron atendidos dentro del periodo de viremia31.
El estudio adolece de algunas limitaciones: se trata en definitiva de la descripción prospectiva de una serie de casos en un territorio concreto durante un año. Es plausible que aporte datos sesgados a la baja en cuanto a incidencia de arbovirosis en tanto que una red de vigilancia de base voluntaria puede ser más consistente en unas zonas que en otras. Apunta a una dirección, pero será al término de los 3años de duración prevista del PICAT cuando se podrán barajar datos más extrapolables.
La naturaleza de las arbovirosis es multifactorial y difícilmente predecible. Parece claro, no obstante, que ninguno de los factores favorecedores a su transmisión va a desvanecerse; las condiciones propicias a la transmisión vírica aumentarán debido al mayor número de desplazamientos internacionales a países emergentes endémicos y a los efectos del cambio climático. Los resultados de un estudio que incluye formación, capacitación diagnóstica y acceso a una consulta especializada como el descrito apuntan a que se podría detectar un mayor número de casos importados y que incluso sería capaz de identificar casos autóctonos. Sin embargo, el escenario epidemiológico completo solo se podrá obtener si se destinan unos recursos que permitan pasar de la formación puntual a la normalizada y a una estandarización de los medios diagnósticos de laboratorio (incluyendo serologías y RT-PCR) en el marco de la participación en programas transnacionales de control epidemiológico y vectorial. Toda disposición a implementarlos debería incluir a la atención primaria.
- •
Las arbovirosis son enfermedades víricas vectorizadas por mosquitos. El área mediterránea se considera una zona de especial riesgo de emergencia debido a factores climáticos y sociales.
- •
Los programas de vigilancia y control de arbovirosis, así como los medios diagnósticos de confirmación, raramente son accesibles a los médicos de atención primaria.
- •
Diseño y puesta en marcha de una red de vigilancia epidemiológica intensificada interniveles atención primaria-hospital en una zona densamente colonizada por Aedes albopictus.
- •
Durante los 12 meses de estudio se diagnosticaron significativamente más casos de arbovirosis que en el año precedente y se identificó al primer paciente con dengue transmitido autóctonamente en Cataluña.
- •
Cualquier planificación en el control y diagnóstico precoz de las arbovirosis debe incluir la atención primaria.
La Plataforma Integral para control de las arbovirosis en Cataluña (PICAT) es un proyecto realizado con el apoyo del Departamento de Salud de la Generalitat de Catalunya y ha sido financiada mediante una beca del Pla Estratègic de Recerca i Innovació en Salut (PERIS) 2016-2020, cod. exp. SLT002/16/00466.
Conflicto de interesesNinguno.
AgradecimientosA los miembros del Grupo de Vigilancia en Arbovirosis MetroNord, con agradecimiento a su labor: Albert Alcántara, Pere Beato, Marta Fletas, Antonio Heras, Víctor M. López-Lifante, Israel López-Muñoz, Olga Pérez, Anna Ribatallada, Neus Robert, Lourdes Solà, Laura Soldevila y Xavier Villanova.