Introducción
La vacunología en los comienzos de este siglo se caracteriza por una serie de hechos relevantes. Algunos de ellos pueden generar cierta inquietud, entre los que destacan, entre otros, la aparición de enfermedades infecciosas emergentes, las desigualdades de los calendarios vacunales entre países industrializados y países en vías de desarrollo y el incremento de los fenómenos migratorios; en cambio, otros mueven al optimismo, como los progresos en las nuevas tecnologías y las importantes inversiones de las Administraciones Públicas y de las Organizaciones no Gubernamentales tanto en investigación y desarrollo como para colocar preparados vacunales en zonas geográficas remotas.
Por otra parte, hay datos que apuntan a que el campo de las enfermedades inmunoprevenibles va a experimentar un progreso no visto hasta ahora, de modo que la vacunación, en un futuro próximo, no solamente se consolidará como uno de los 10 grandes logros en la salud pública en las últimas décadas1, sino que es probable que se sitúe en primera posición.
La evolución de la vacunología se refleja en los trabajos científicos aparecidos en las revistas especializadas en los últimos años, de tal manera que, en el año 1990, se publicaron 2.300 artículos relacionados con vacunas, para pasar a 4.000 aproximadamente en 19992. Otros datos que apoyan este creciente interés son los siguientes: a) entre los años 1988 y 1998, las cantidades que se invirtieron en investigación y desarrollo de nuevas vacunas pasaron de 500 a 1.000 millones de dólares; b) en ese mismo período las ventas de preparados inmunizantes se multiplicaron por 3, hasta alcanzar los 6.000 millones de dólares; c) las compañías de biotecnología pasaron de 12 a 72 entre 1988 y 1998, y d) el número de páginas de la revista Vaccine se multiplicó por 7 entre 1984 y 19983. Aun así, queda mucho por hacer, pues de los 56.000 millones de dólares anuales que se han gastado en el mundo en los últimos años, en investigación sanitaria, sólo el 10% se destinó a enfermedades que afectan al 90% de la población (tuberculosis y malaria, entre otras)2.
En esta primera entrega se pasará revista a los grandes retos de la vacunología para los próximos años. Entre ellos destacan las necesidades y disponibilidad de vacunas en países ricos y pobres, la seguridad vacunal y las nuevas tecnologías de aplicación. En una segunda entrega se revisarán las nuevas vacunas profilácticas frente a enfermedades infecciosas prevalentes, las perspectivas de la inmunización terapéutica y las estrategias a diseñar para mejorar la adherencia a los programas de vacunación.
Vacunación en países ricos y pobres
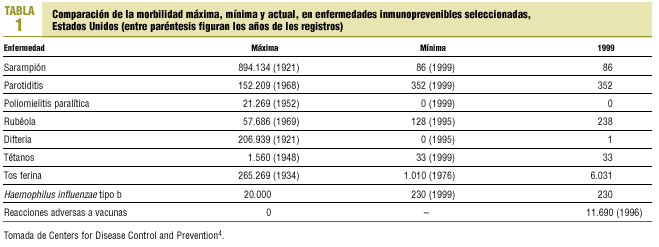
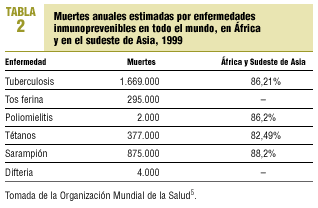
Resulta reconfortante comprobar cómo en los países industrializados el descenso de enfermedades prevenibles por vacunación ha sido espectacular, cuando se comparan las incidencias en la era prevacunal con las de los últimos años (tabla 1); pero esta imagen resulta engañosa cuando observamos que 6 enfermedades frente a las que se dispone de vacunas más o menos efectivas causaron, durante el año 1999, alrededor de 3.000.000 de muertes en los países en vías de desarrollo (tabla 2), lo que hace cierta la frase de que «las vacunas no salvan vidas; la vacunación, sí»6.
Este hecho no hace sino poner de manifiesto las bajas coberturas frente a enfermedades prevenibles por vacunación en países no industrializados. Concretamente, respecto de la rubéola, a mitad del año 2000 solamente el 2% de los países africanos y el 20% de los países del sudeste asiático incluían la vacunación en sus calendarios sistemáticos. La vacuna antiparotiditis se encontraba en el calendario de vacunación del 24% de los países en vías de desarrollo en el año 1998; la de la hepatitis B tenía una cobertura mundial del 20% en 1999, y no se vacuna frente a la enfermedad invasora por Haemophilus influenzae tipo b en África, Asia y el Este de Europa, a pesar de ser esta bacteria la responsable de unas 500.000 muertes anuales en todo el mundo.
Además, en los últimos tiempos se está observando en algunas naciones no industrializadas una caída en las coberturas de las vacunas incluidas en el Programa Ampliado de Vacunación de la Organización Mundial de la Salud (OMS). Entre los años 1990 y 1998, Nigeria, Congo y la República Centroafricana pasaron de notificar coberturas del 80, el 46 y el 93% al 27, el 25 y el 53%, respectivamente. Entre los motivos que se aducen para explicar este desfavorable cambio se incluyen las guerras, la irrupción de la infección por el virus de la inmunodeficiencia humana y cierta disminución del interés internacional por las políticas vacunales en los países no industrializados.
No obstante, existen motivos para la esperanza. En el mes de enero del año 2000, se constituyó la Global Alliance for Vaccines and Immunization, entidad formada por los sectores público y privado, en la que se integran, entre otros la OMS, la Unicef, el Banco Mundial, la Fundación Rockefeller y el Programa de Vacunas Infantiles de la Fundación Bill y Melinda Gates. Esta «alianza» tiene 4 cometidos fundacionales: a) erradicar la poliomielitis en el mundo; b) vacunar a más del 90% de la población; c) introducir en
países en vías de desarrollo preparados vacunales de uso habitual en los países occidentales, y d) promover la investigación en enfermedades huérfanas (malaria y tuberculosis)7.
En las naciones desarrolladas, en términos generales, el panorama es mucho más halagüeño, aunque la cobertura frente a algunas enfermedades en vías de erradicación no son precisamente las más idóneas para conseguir dicho objetivo. Como ejemplo, valga el caso del sarampión; en la República de Irlanda se declararon 1.560 casos durante los 10 primeros meses del año 20008, las coberturas en el Reino Unido no llegan al 88%9, en Italia se sitúan en el 56%10, en Francia son del 80%11 y en Suiza no alcanzan el 83%12. Algunos incidentes recientes que han intentado asociar la aparición de alguna patología con la administración de una vacunas, como la vacuna del sarampión y el autismo13, y la vacuna de la hepatitis B y la esclerosis múltiple14 se encuentran, entre otros hechos, tras estas bajas coberturas.
En síntesis, para disminuir la morbimortalidad por enfermedades inmunoprevenibles es necesario diseñar estrategias distintas según la región de que se trate: en los países industrializados, mejorar la comunicación de los riesgos asociados a la vacunación15, y en los no industrializados, no solamente proporcionar a muy bajo coste económico el preparado, sino también mejorar la accesibilidad a los puntos de vacunación, educar al personal sanitario nativo y desmitificar creencias populares y religiosas16.
La seguridad vacunal
Durante la última década ha aumentado la preocupación, real o imaginaria, acerca de la seguridad vacunal y los efectos adversos provocados por la vacunación, lo que ha engendrado en países próximos al nuestro la aparición de los «movimientos antivacunas», lo cual no es de ninguna manera algo novedoso, pues ya se observó la aparición de estos movimientos con la primera vacuna, la viruela, que se utilizó profusamente.
Cuando se habla de seguridad vacunal, siempre hay que tener presente que las vacunas originan un espectacular descenso de la enfermedad diana, aunque ocasionalmente pueden provocar algún daño17. En la tabla 1 se puede observar cómo el espectacular descenso de las enfermedades inmunoprevenibles lleva parejo un incremento de la declaración de presuntos efectos adversos atribuidos a la vacunación. Discernir con lógica y raciocinio la causa y el efecto frente a la especulación o la mera asociación temporal, en lo que concierne a los efectos adversos, permitirá al clínico, en su relación con el paciente, decidir si va a promover el uso de una vacuna determinada18.
La situación actual, en algunos países, del balance entre los beneficios de un programa de vacunaciones, por una parte, y la seguridad vacunal y la aceptación de los riesgos en una sociedad intolerante, por otra, se puede expresar en el modelo del «efecto pirámide». En éste, la amplia base estaría constituida por los efectos positivos de una política mayoritaria de salud pública uso de una vacuna para prevenir una enfermedad grave y prevalente, y el agudo pico representaría el pequeño riesgo asociado a la vacunación. Mientras que en este último se situarían muy pocos sujetos que han sufrido daños o que perciben el riesgo de daño de una manera sustancial y aguda, en la base estaría representada la mayoría de la población, que se beneficia ampliamente de la vacunación, pero que no percibe las ventajas o lo hace indirectamente, motivado probablemente por un «efecto dilución» (el uso generalizado de una vacuna segura y efectiva elimina o disminuye el riesgo de padecer la enfermedad, lo que hace que la percepción del público sobre el valor de la vacuna, paradójicamente, disminuya). En este «efecto pirámide», los beneficiarios del programa no abanderarán las políticas vacunales, serán meros participantes pasivos en un teórico debate, pero los pocos que perciben riesgos sustanciales pueden luchar contra el programa, apasionada y estridentemente, pudiendo llegar a ser los únicos individuos que manifiestan su opinión17. Por consiguiente, los responsables de los programas de vacunación ya consolidados en la población se encuentran o se van a encontrar en una situación muy incómoda, que se caracterizaría por una alta cobertura vacunal, por una baja incidencia de enfermedades inmunoprevenibles y por una alta tasa de reacciones adversas presuntamente atribuibles a la vacunación, en la que en cualquier momento se puede desatar el pánico en los medios de comunicación y la pérdida de la confianza de la población19. En definitiva, se volvería a cumplir la aseveración de Dittmann15: «El mayor enemigo de una buena vacuna es su propio éxito».
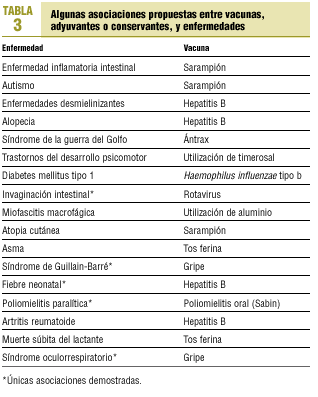
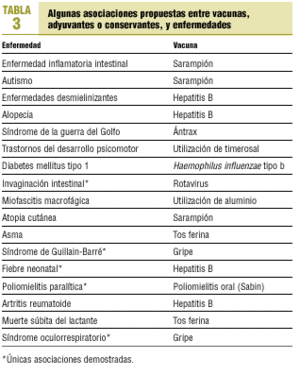
Por tanto, ya que el mantenimiento del éxito de los programas vacunales pasa obligatoriamente por la seguridad de los preparados incluidos en los calendarios sistemáticos, y a la vista del incremento de voces que intentan asociar las prácticas vacunales con algunas enfermedades (tabla 3) y de la amplia repercusión que pueden tener sus afirmaciones, merced, en parte, a las nuevas tecnologías de la comunicación, los grupos de expertos proponen que los médicos, enfermería y otro personal sanitario estén mejor formados e informados tanto sobre la vacunación en sí como sobre los aspectos riesgo/beneficio derivados de las prácticas vacunales20. La formación comenzaría durante su aprendizaje universitario y se extendería a lo largo de su ejercicio profesional, siendo responsabilidad de las Administraciones Públicas, a la vista de los conocimientos y
actitudes de la población21, tanto la formación como la información22, la emisión de recomendaciones, la monitorización de la seguridad vacunal poscomercialización23, la implantación de registros nominales informatizados24, el mantenimiento de la gratuidad de los programas e incluso la habilitación de incentivos para los actos vacunales, evitando, a juicio del autor, la obligatoriedad de la recepción de vacunas.
Nuevas vías de administración de vacunas
A la hora de escribir de nuevas vacunas, de novedosas técnicas de administración, de nuevos vehículos y de futuras combinaciones vacunales, hay que tener presente que las prioridades en necesidades de investigación sobre futuras vacunas no siempre coinciden entre los países industrializados y aquellos en vías de desarrollo, como se observa en la tabla 4. En ella se puede apreciar que, mientras que ambos están de acuerdo en la vacuna frente al virus de la inmunodeficiencia humana, los primeros demandan preparados contra enfermedades agudas, de alta prevalencia, pero no excesivamente graves, mientras que los segundos aspiran a disponer de vacunas frente a enfermedades «huérfanas», que, al margen de ser crónicas, provocan la muerte de varios millones de personas al año en el mundo.
Por desgracia, la mayoría de las vacunas disponibles actualmente y las que aparecerán en un futuro próximo son de administración parenteral, lo que de alguna manera puede condicionar la aceptabilidad de los programas de vacunación26, a pesar de que en ciertos ámbitos pudiera persistir la idea de que la administración parenteral de productos farmacéuticos sería más efectiva que cualquier otra vía27.
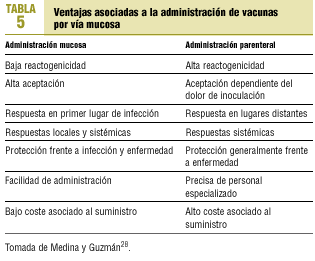
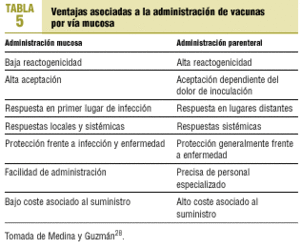
Desde hace años se trabaja en vías alternativas, más seguras, menos dolorosas y con efectividad similar o superior a los preparados convencionales. El paradigma de esta vía alternativa es la vía mucosa, que aporta ventajas indudables respecto de la parenteral tradicional (tabla 5). En breve se dispondrá de una vacuna antigripal viva atenuada, adaptada al frío, de reagrupación de genes (6:2) para administración intranasal29. Se está ensayando, en humanos, la inmunización transdérmica mediante la aplicación tópica de un antígeno con un adyuvante, aprovechando la riqueza del estrato córneo de la piel en células inmunes de Langerhans, que transportarán el antígeno a los ganglios linfáticos de drenaje para inducir respuestas inmunes sistémicas30. En esta misma línea, se ha ensayado en animales la inmunización epidérmica sin aguja de una vacuna antigripal en polvo vehiculizada con gas helio31.
Otra vía de administración, muy prometedora fundamentalmente para países con escasez de recursos, es la mediada por plantas comestibles. Básicamente, la tecnología consiste en la localización del gen que codifica un antígeno capaz de desencadenar una respuesta inmune protectora e insertarlo en el plásmido de una bacteria. Ésta se pone en contacto con una hoja de la planta comestible, para que libere los genes al genoma de la célula de la hoja, y se deja crecer en un medio antibiótico apropiado. Una vez que se formen tallos y raíces, se planta el cogollo en un área geográfica próxima adonde se va a utilizar la resultante, se deja desarrollar y, una vez transformado en planta, se recolecta y prepara para consumir. Los interrogantes que puede plantear esta novedosa técnica se pueden sintetizar, entre otros, en: a) ¿cuándo sabremos que la planta está lista para la recolección?; b) ¿cómo calculamos la dosis?; c) ¿cómo sabremos que la planta contiene la vacuna?, y d) ¿se mantendrá la potencia con el almacenamiento? En esta línea de investigación ya se dispone de ensayos del virus Norwalk32 y del antígeno de superficie de la hepatitis B33 vehiculizados ambos en patatas, y de toxinas de Escherichia coli enterotoxigénico en ese mismo tubérculo34 y en trigo35.
Nuevas tecnologías para el transporte de antígenos
Una de éstas la constituyen las vacunas de vectores vivos, en las que se inserta el gen responsable de la patogenicidad de un microorganismo en el genoma de otro previamente manipulado hasta hacerlo inocuo. El vector, administrado por vía mucosa y una vez en el huésped, no puede replicar sus proteínas estructurales, pero sí transfiere al núcleo celular el ARNm que codifica la proteína antigénica, la que estimulará la aparición de respuestas de linfocitos T citotóxicos36-38. Los vectores que actualmente se están ensayando son bacterianos (BCG, Listeria monocytogenes, Vibrio cholerae, Salmonella spp., Shigella spp., Yersinia enterocolitica, Bacillus anthracis, Lactobacillus spp. y Staphilococcus spp.) o víricos (poxvirus de aves y alfavirus).
Otra manera de transportar antígenos la constituyen las vacunas de ácidos nucleicos. Mediante esta técnica, por vía oral, intramuscular, subcutánea intradérmica o transdérmica, y utilizando una «pistola de genes»39, se administra un plásmido que incluye el gen que codifica una proteína patógena. Las células del huésped captan el ADN extraño, lo expresan y fabrican la proteína correspondiente, que permanece en el interior de la célula para unirse posteriormente al complejo mayor de histocompatibilidad clase I. Esta molécula transporta la proteína a la superficie de la célula, donde estimula los linfocitos CD8 citotóxicos. Las ventajas de este sistema son evidentes: a) induce expresión de antígenos que se parecen más a los epítopes víricos; b) induce inmunidad duradera; c) podría prescindir de la «cadena del frío»; d) puede permitir la creación de vacunas para agentes que no pueden crecer en cultivos, y e) pueden asociarse varios fragmentos de ADN de varios patógenos, con lo que dismunirían los actos vacunales. Sin embargo, también genera una serie de interrogantes: a) ¿puede insertarse en el genoma del huésped pudiendo dar lugar a una disrupción de genes normales?, ¿o a activación de oncogenes?, ¿o a transformación maligna de las células del huésped?, y b) si el ADN expresa durante largo tiempo el antígeno, ¿podrá dar lugar a tolerancia o a un ataque a los tejidos que expresan el antígeno39,40? Ya se dispone de experiencias en animales con una vacuna frente al herpes simplex tipo 141 y frente al sarampión42, y en humanos frente a la malaria43 y frente a la hepatitis B44.
Correspondencia: J.A. Navarro Alonso. Servicio de Prevención y Promoción de Salud. Programa Regional de Vacunaciones. Dirección General de Salud Pública. Consejería de Sanidad y Consumo. C/ Ronda de Levante, 11. 30008 Murcia. Correo electrónico: josea.navarro2@carm.es