Los fármacos anti-factor de crecimiento vascular endotelial son el tratamiento de elección para el edema macular secundario a oclusión venosa; aunque sus efectos secundarios han sido previamente descritos, estos suelen ser raros. A continuación, presentamos un caso de vasculitis retiniana asociada a bevacizumab en una paciente de 72 años que acudió a consulta por edema macular secundario a oclusión de vena central de la retina, por lo que fue tratada con bevacizumab intravítreo. Posteriormente presentó una respuesta inflamatoria mínima que fue resuelta con esteroides tópicos. Seis semanas después se detectó recurrencia del edema macular por lo que se aplicó una segunda dosis de bevacizumab, en esta ocasión con una respuesta inflamatoria severa que requirió tratamiento con esteroides paraoculares y antiinflamatorios no esteroideos tópicos. Se descartó la presencia de vasculitis sistémica y enfermedades infecciosas y se decidió cambiar el tratamiento intravítreo a aflibercept, con el que no se presentaron efectos adversos.
Anti-vascular endothelial growth factor drugs are the treatment of choice for macular edema due to venous occlusions. While rare, they have been associated with some uncommon adverse effects. We present a case of retinal vasculitis associated with bevacizumab in a72-year-old woman who presented to our clinic with sudden visual acuity loss in her left eye due to macular edema following central vein occlusion. She was treated with bevacizumab, with a minor inflammatory response that resolved with topical steroids. After 6 weeks, the macular edema recurred and a 2nd dose of bevacizumab was indicated, with a severe inflammatory reaction that resolved with periocular steroids and topical NSAIDs. Systemic vasculitis and infectious diseases were ruled out and treatment was switched to aflibercept with no adverse effects being reported.
La inyección intravítrea de agentes anti-factor de crecimiento endotelial vascular (VEGF) es la intervención intraocular más frecuente1. El espectro terapéutico de estos agentes continúa creciendo; sus indicaciones incluyen la degeneración macular exudativa, el edema macular diabético y el edema macular secundario a la oclusión venosa retiniana. Los anti-VEGF actualmente en uso incluyen bevacizumab, ranibizumab, aflibercept y brolucizumab. Desde su aparición, se ha investigado su perfil de seguridad y las posibles complicaciones asociadas2.
Las preocupaciones en torno a las complicaciones asociadas, sobre todo aquellas relacionadas con eventos inflamatorios no infecciosos, han recobrado interés recientemente debido a un aumento en las tasas de incidencia3. Cabe destacar que se sabe muy poco acerca del mecanismo de acción de los compuestos anti-VEGF recientemente desarrollados. Comprender mejor su efecto clínico y evolución ayudará a esclarecer los posibles factores de riesgo, la fisiopatología y la lógica terapéutica. También permitirá prevenir, diagnosticar y tratar efectos adversos, reduciendo su impacto en los resultados visuales de los pacientes.
Se describe, a continuación, el primer caso de inflamación intraocular no infecciosa con manifestación clínica de vasculitis retiniana asociada al uso de bevacizumab intravítreo para el tratamiento del edema macular secundario a oclusión de la vena central de la retina.
Reporte de casoUna paciente de 72 años presentó una disminución súbita de la agudeza visual en el ojo izquierdo de 15 días de evolución. Tenía antecedentes de hipertensión arterial y cirugía de cataratas en ambos ojos.
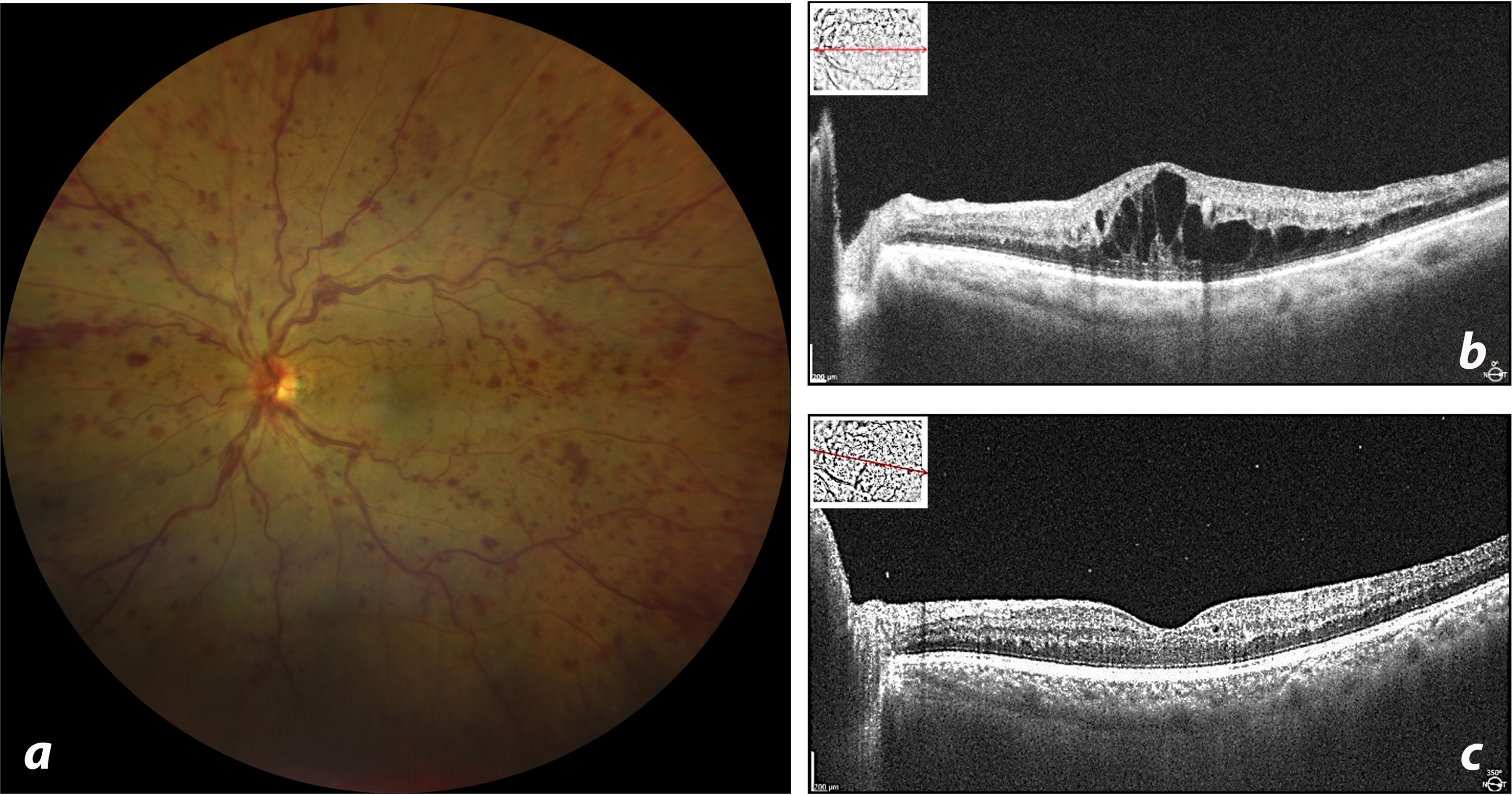
El examen oftalmológico reveló agudezas visuales corregidas de 20/25 en el ojo derecho y 20/80 en el izquierdo. La biomicroscopia mostró medios transparentes, pseudofaquia en los 2 ojos y pupilas isocóricas y fotorreactivas. El examen del fondo de ojo derecho no presentó particularidades, pero el del ojo izquierdo reveló múltiples hemorragias puntiformes y en mancha en los 4 cuadrantes, dilatación y tortuosidad vascular generalizada, principalmente de vasos venosos, y ausencia de reflejo foveal (fig. 1a). La tomografía de coherencia óptica (OCT) mostró un edema macular quístico severo en el ojo derecho (fig. 1b).
a. La retinografía revela la presencia de múltiples hemorragias puntiformes retinianas, tortuosidad vascular y ausencia de reflejo foveal. b. Tomografía de coherencia óptica macular (OCT) inicial que revela la presencia de edema macular cistoide. c. OCT 48h después de la inyección con presencia de puntos hiperreflectivos en la interfase vítrea y resolución del edema.
Se llegó al diagnóstico de oclusión de la vena central de la retina con edema macular secundario y derivada a medicina interna/cardiología para valorar y controlar los posibles factores de riesgo sistémicos. Se administró una inyección intravítrea de bevacizumab (1,25mg/0,05ml) en el ojo izquierdo, siguiendo el protocolo de la clínica tras obtener el consentimiento informado firmado de la paciente. No se administró profilaxis antibiótica tópica, ni antes ni después de la inyección. Aunque una consulta de seguimiento a las 24h confirmó que la paciente estaba asintomática, el examen clínico reveló hiperemia conjuntival leve y reacción en cámara anterior (flare de grado I), vítreo transparente y ausencia de alteraciones retinianas. Debido a la presencia de signos leves de inflamación intraocular anterior, se administró una combinación de antibióticos y esteroides tópicos (tobramicina y loteprednol), lográndose una resolución completa de los signos inflamatorios del segmento anterior. La agudeza visual corregida mejoró a 20/40. Una OCT realizada trascurridas 48h mostró reducción del edema quístico, aunque se observaron puntos hiperreflectivos en el interior de la cavidad vítrea (fig. 1c).
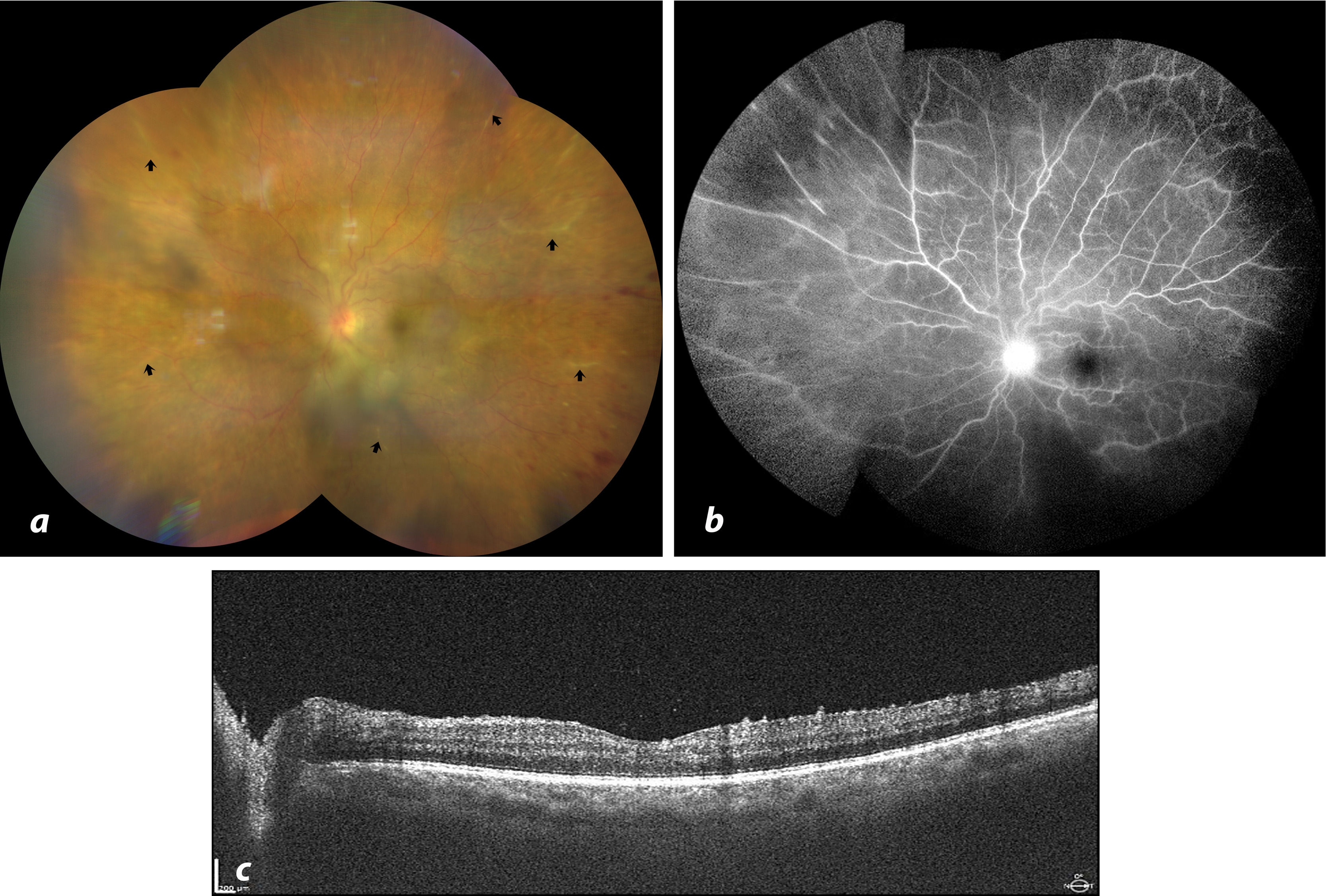
Seis semanas después, la paciente regresó con mejor apariencia clínica, remisión parcial de las hemorragias puntiformes y disminución de la agudeza visual (20/70) debido a la recurrencia del edema macular quístico. Se administró una segunda dosis de bevacizumab intravítreo. Tras 24h de seguimiento, no se observaron dolor ni cambios en la agudeza visual, fotopsias ni miodesopsias. Sí se observaron, no obstante, signos de inflamación: inyección ciliar (+1), flare (+1), células en cámara anterior (+1) y vitritis (+1). También se observaron condensaciones vítreas. Se inició tratamiento con fluorometolona tópica. Trascurridas 72h, la paciente seguía asintomática. Se observó una ligera mejora en la agudeza visual (20/40), acompañada de remisión de la hiperemia y el flare. No obstante, las células en cámara anterior (+1) y la vitritis (+1) persistieron, con envainamiento vascular observado en la periferia media de los 4 cuadrantes, predominantemente en los cuadrantes nasal y temporal superior y cerca del polo posterior en el cuadrante inferotemporal. La angiografía con fluoresceína mostró leve filtración perivascular en fases tardías acompañado de áreas de hipoperfusión en la retina periférica nasal. Aunque la OCT confirmó la remisión del edema macular, se observó un aumento de los puntos hiperreflectivos suspendidos en la cavidad vítrea y en la superficie retiniana (fig. 2).
a. Retinografía de campo amplio realizada tras la administración de la 2.a dosis de bevacizumab, mostrando envainamiento vascular generalizado (flechas negras). b. Fases tardías de la angiografía con fluoresceína (FA) mostrando ligera filtración perivascular en áreas de engrosamiento vascular, principalmente en la retina nasal. c. Tomografía de coherencia óptica mostrando remisión del edema macular.
Se realizaron pruebas de laboratorio complementarias para cribado de vasculitis, incluido ELISA para Toxoplasma gondii, VIH, herpesvirus y citomegalovirus; prueba VDRL; biometría; glucemia; electroforesis de proteínas; medición de la enzima convertidora de angiotensina (ECA); perfil inmunológico (PCR, VSG, FR, ANA, anti-ADN, anti-CCP, ANCA c y ANCA p); prueba QuantiFERON-TB Gold Plus; y radiografías de tórax, sin resultados significativos.
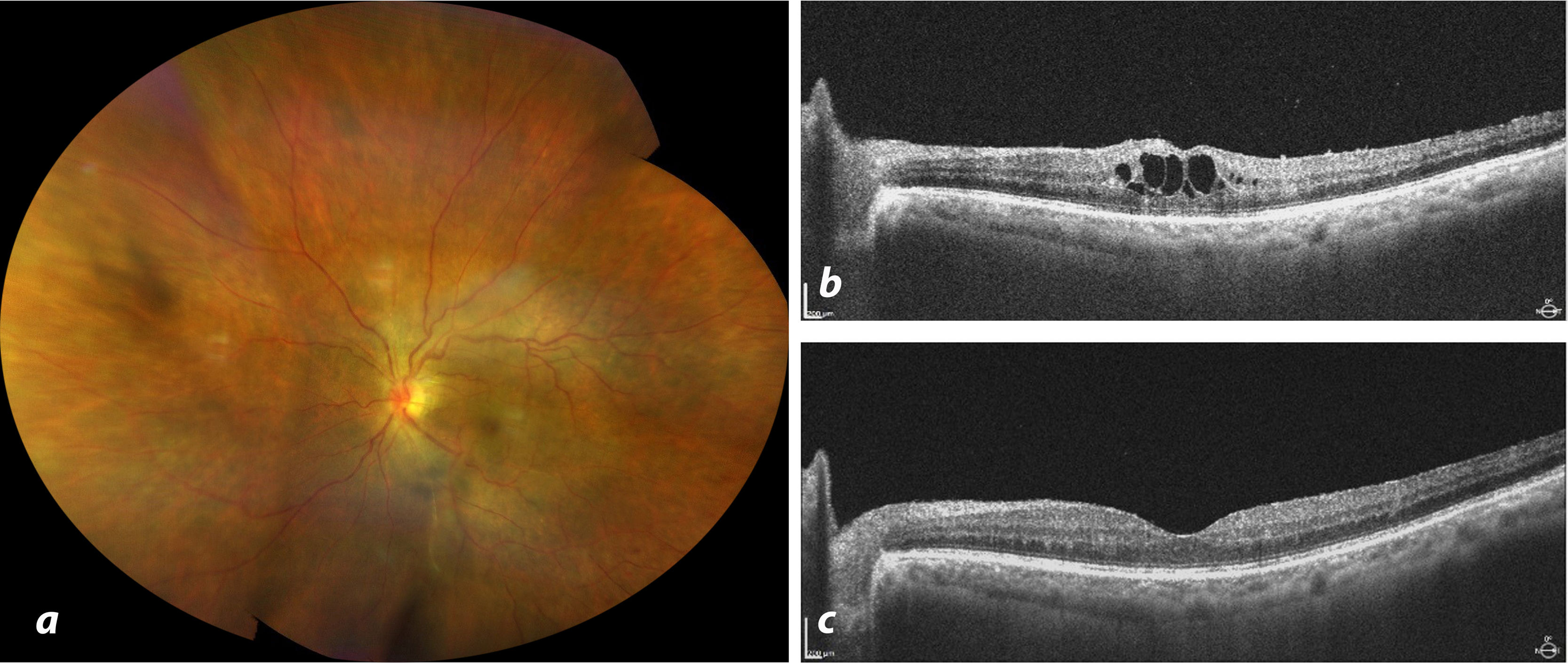
Como la paciente no presentaba ninguna otra afección, se administraron 2 dosis de 0,8ml de fosfato de betametasona paraocular, con una semana de intervalo. Se continuó con fluorometolona y se añadió nepafenaco tópico. Poco a poco, el estado de la paciente fue mejorando y la OCT confirmó la desaparición de celularidad vítrea. También se observó una disminución de la vitritis y envainamiento vascular (fig. 3a). Cinco semanas después de la resolución de la inflamación, la paciente presentó una recurrencia del edema macular (fig. 3b). En esta ocasión, se cambió el tratamiento a 2mg/0,05ml de aflibercept intravítreo. La paciente no mostró signos de inflamación ni reactivación clínica o tomográfica. En la séptima semana de seguimiento, el edema desapareció y la agudeza visual se recuperó a 20/40 (fig. 3c)
a. Retinografía de campo amplio mostrando resolución del engrosamiento vascular tras la administración de esteroides perioculares y fármacos antiinflamatorios tópicos no esteroides. b. Recurrencia del edema macular cistoide (EMC), observada por tomografía de coherencia óptica. c. Resolución del EMC tras la administración de una dosis de aflibercept tras 7 semanas de seguimiento.
Para nuestro conocimiento, este es el primer caso descrito de inflamación intraocular no infecciosa con manifestación clínica de vasculitis retinal asociada al uso de bevacizumab intravítreo para el tratamiento del edema macular secundario a la oclusión de la vena central de la retina.
El bevacizumab es bien conocido como tratamiento anti-VEGF efectivo para diversas patologías, incluido el edema macular por oclusiones de la vena retiniana. Aunque su uso intraocular se considera off-label, está permitido en nuestro país bajo regulaciones locales. Además, su favorable relación costo-beneficio lo posiciona como el tratamiento de primera línea para estos pacientes. La tasa de incidencia de eventos adversos asociados al uso de bevacizumab intravítreo no supera el 0,21%, según un extenso estudio internacional3. La ocurrencia de inflamación intraocular no infecciosa (uveítis) es aún más rara, con una tasa de incidencia del 0,09%4. No obstante, los pacientes que desarrollan uveítis secundaria presentan síntomas clínicos similares a los descritos en otras series de casos, incluido flare y celularidad en la cámara anterior (iritociclitis pseudogranulomatosa)5, hipopion6 y diversos grados de vitritis7. Comparativamente, la tasa de eventos inflamatorios intraoculares no infecciosos asociados a otras moléculas, sobre todo brolucizumab, ha sido notablemente mayor, incluida la vasculitis retiniana entre estos eventos8.
Según su presentación y características clínicas, clasificamos este caso como un evento no infeccioso. La paciente no reportó dolor ni disminución de la agudeza visual (síntomas típicos de la endoftalmitis infecciosa)9. La inflamación respondió bien a los esteroides tópicos y la resolución de los síntomas se correlacionó con la eliminación de bevacizumab del cuerpo vítreo. Se planteó la hipótesis de que la respuesta inmunológica estuviese inducida por factores individuales del paciente en respuesta directa al bevacizumab según los siguientes aspectos:
La paciente no tenía factores predisponentes, tales como antecedentes de uveítis o tratamiento con fármacos tópicos proinflamatorios. Se efectuaron estudios extensivos y no hubo evidencia de enfermedad inflamatoria sistémica durante la enfermedad ocular. Se consideraron improbables otros factores comúnmente asociados a respuestas inflamatorias estériles, tales como contaminación del fármaco por exotoxinas, proteínas no humanas, impurezas o partículas de silicona de la jeringa que pudieran potenciar el efecto inmunogénico del fármaco9. Los compuestos inyectados se obtuvieron directamente de la botella del fabricante sin reconstitución ni manipulación adicionales. Además, 12 pacientes recibieron inyecciones simultáneamente durante el primer tratamiento del paciente, y otros 14 fueron tratados en un segundo grupo usando suministros idénticos y una técnica similar. No se observaron otros efectos adversos en estos sujetos.
La presencia de anticuerpos anti-idiotípicos podría ser una explicación plausible del mecanismo inmunológico observado en este caso. Se ha documentado que estos anticuerpos pueden existir antes de la exposición a anticuerpos monoclonales7 y su producción y actividad pueden aumentar con la exposición repetida a un antígeno. Las características estructurales del bevacizumab, incluido un componente Fc, lo hacen susceptible a desencadenar una respuesta inmunogénica10. En tales circunstancias, podría sobrevenir una respuesta de hipersensibilidad tipo III con formación de complejos inmunológicos antígeno-anticuerpo. Estos complejos podrían precipitarse en los vasos retinianos, activando proteínas del complemento, reclutando células inflamatorias y liberando enzimas lisosomales y radicales libres. Efectos que podrían provocar daños estructurales y funcionales.
En el tratamiento sistémico con bevacizumab, una respuesta de hipersensibilidad retardada tipo III mediada por IgG podría expresarse como nefropatía y vasculitis con nefritis mediada por IgA11. Habitualmente, los complejos inmunológicos se forman en el sistema circulatorio antes de su deposición en los tejidos. Aunque el ojo es un sitio inmunológicamente privilegiado donde este proceso es menos probable, la alteración de la barrera hematorretiniana debido a eventos vasculares podría contribuir a la formación de anticuerpos anti-idiotípicos. Este mecanismo podría explicar los hallazgos clínicos observados en nuestro paciente. En el caso del brolucizumab, el desarrollo de vasculitis se ha atribuido a un mecanismo de hipersensibilidad retardada desencadenado por la formación de complejos inmunológicos resultantes de la presencia de anticuerpos locales8.
Otro posible mecanismo es una hipersensibilidad tipo IV, mediada por linfocitos T sensibilizados. Este tipo de hipersensibilidad se asocia comúnmente a la vasculitis retiniana oclusiva y hemorrágica observada en tratamientos con vancomicina y brolucizumab12. No obstante, el curso clínico más agresivo observado en esos casos difiere de la experiencia de nuestro paciente.
Es importante señalar que el tamaño más pequeño, el peso molecular y la mayor concentración molar de brolucizumab facilitan una mayor penetración tisular y una exposición prolongada al sistema inmunológico. En cambio, el bevacizumab, con su molécula más grande, tiene una penetración y efecto limitados. No obstante, la molécula más grande del bevacizumab también reduce la exposición al sistema inmunológico, aunque no descarta completamente este mecanismo.
Las preocupaciones en torno a las complicaciones asociadas, sobre todo aquellas que tienen que ver con eventos inflamatorios no infecciosos, han vuelto a generar interés debido al incremento de las tasas de incidencia. Es importante destacar que se entiende muy poco sobre el mecanismo de acción de los nuevos compuestos anti-VEGF. Obtener una mejor comprensión clínica y evolutiva de estos fármacos ayudará a aclarar los posibles factores de riesgo, la fisiopatología y la lógica terapéutica. También nos permitirá prevenir, diagnosticar y tratar los efectos secundarios, reduciendo su impacto en los resultados visuales de los pacientes.
ConclusionesAunque la inflamación intraocular por el uso de bevacizumab intravítreo es poco común, es una posibilidad. Su gravedad y presentación varían entre los individuos. Este paciente presentó vasculitis retiniana, que, aunque benigna y no isquémica, requirió tratamiento y seguimiento. Se debe hacer seguimiento incluso a los signos clínicos y paraclínicos leves de inflamación ya que podrían señalar sensibilización al compuesto, lo cual podría requerir tratamiento adicional.
El efecto terapéutico del fármaco puede mantenerse sin cambios a pesar de la respuesta inmunogénica. Cambiar a un nuevo compuesto anti-VEGF es una alternativa viable que, sin embargo, puede aumentar el riesgo a una mayor respuesta inmunológica o sensibilidad cruzada. Los esteroides pueden usarse simultáneamente como una opción terapéutica para el manejo tanto de la reacción inflamatoria como de la patología subyacente.
Declaración de consentimiento informadoSe obtuvo consentimiento informado por escrito del paciente.
Aprobación éticaLa aprobación ética para este estudio se obtuvo de nuestro comité de ética institucional (comité de ética CDO) con el n.o de aprobación: MLSA2021_3BS.
Conflicto de interesesNinguno.
Ninguno.