La cicatrización de las heridas y la integración de injertos tisulares libres dependen esencialmente del crecimiento de los vasos sanguíneos, es decir, de la invasión angiogénica de las células endoteliales, que se ve reducida drásticamente en fumadores, en pacientes que sufren microangiopatías (p. ej., en la diabetes), o en los que reciben tratamiento con inmunosupresores. A pesar de que se han estudiado diferentes factores angiogénicos para acelerar la cicatrización de las heridas en dichos pacientes críticos, aún no se han investigado de forma sistemática sus interrelaciones. Este estudio se llevó a cabo para revelar qué combinación de factores proangiogénicos con factores activadores de la maduración es la más eficaz en el proceso de corrección de lesiones endoteliales. Se aislaron células endoteliales de la vena umbilical humana, se cultivaron hasta su confluencia, y se ensayaron en un modelo de corrección de lesión endotelial con la adición de factor de crecimiento del endotelio vascular (VEGF)-A165, factor de crecimiento plaquetario (PDGF)-AB, angiopoyetina-1 (ANG1), o ANG2 y sus 16 combinaciones posibles. El VEGF-A165 más la ANG1 fue la combinación más eficaz para acelerar el proceso de corrección endotelial. Además, el VEGF-A165 estimuló el cierre de la lesión en todas las combinaciones estudiadas, mientras que se vio atenuado por el PDGF-AB. Así pues, con respecto a sus efectos en las células endoteliales, la combinación de VEGF-A con ANG1 es la más prometedora y es superior a las combinaciones con PDGF-AB.
IntroducciónEl proceso de cicatrización depende de forma crítica del brote de los capilares sanguíneos, que requiere la proliferación y la migración de las células endoteliales1,2. De forma similar, el crecimiento de los injertos se ve favorecido en gran medida por la angiogénesis concomitante3,4. Sin embargo, la respuesta angiogénica se reduce en pacientes que sufren diabetes mellitus y en fumadores, lo que provoca un aumento del tiempo de cicatrización o incluso defectos de cicatrización5-8. La angiogénesis se regula mediante factores angiogénicos, siendo el factor de crecimiento del endotelio vascular A (VEGF-A) el más destacado entre ellos9,10. La expresión del VEGF-A está inducida por una caída en la presión de oxígeno como consecuencia del aumento de la demanda tisular, la disminución de la densidad capilar, o una reacción inflamatoria9,10. Una vez secretado por células tisulares no endoteliales (es decir, fibroblastos o células epiteliales), el VEGF-A actúa en las células endoteliales a través de receptores específicos, principalmente el VEGF-R210, de forma paracrina. Posteriormente activa muchas funciones endoteliales, que a su vez provocan el brote de los capilares9,10. Además del VEGF-A, y como consecuencia de la hemorragia, siempre existen plaquetas, que segregan el factor de crecimiento derivado de las plaquetas11 (PDGF). Es bien sabido que el PDGF también es angiogénico12, pudiendo aumentar así la angiogénesis inducida por el VEGF. Además, el receptor de la tirosina cinasa endotelial TIE2 contribuye a la maduración de los capilares13. La actividad de TIE2 se ve aumentada por la angiopoyetina-1 (ANG1) y (en concentraciones fisiológicas) disminuida por la ANG214,15. No obstante, los vasos sanguíneos que han proliferado por la predominancia del VEGF-A presentan exudación16-20 y, por tanto, se estudió el VEGF-A combinado con el PDGF21,22 o la ANG123-26. Ambas combinaciones indujeron el crecimiento de más capilares funcionales con una permeabilidad prácticamente normal. Este estudio se realizó para analizar de forma más específica, mediante comparación directa en el mismo ensayo, cuál de las 16 combinaciones posibles de VEGF-A, PDGF, ANG1, y ANG2 es la más eficaz para inducir el crecimiento y la migración de las células endoteliales como prerrequisito para el brote capilar.
Materiales y MétodosAislamiento y cultivo de las célulasLas células endoteliales de la vena umbilical humana (HUVEC) se aislaron y cultivaron de la forma descrita previamente27. Brevemente, las HUVEC se extirparon de las venas de los cordones umbilicales con un 0,2% de colagenasa tipo II de Clostridium histolyticum (Biochrom, Berlín, Alemania) durante 15min a 37°C. Tras su incubación, la vena umbilical respectiva se lavó con una solución salina balanceada de Hanks (HBSS). La suspensión celular se centrifugó y se desechó el sobrenadante, y las células se resuspendieron y cultivaron hasta su confluencia en Endothelial Cell Basal Medium MV® con Cell-Growth-Supplement-Pack MV® (ambos de PromoCell, Heidelberg, Alemania) a 37°C en una atmósfera humidificada con un 5% de CO2.
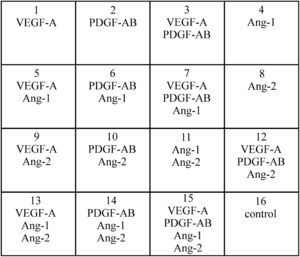
Tratamiento de las células con los factores estudiadosLas células se sembraron en una placa con 24 pocillos (TPP, Trasadingen, Suiza), y en cada uno de ellos (a excepción de los controles no tratados) se depositó un factor distinto o una combinación de los mismos (fig. 1). Los agentes utilizados fueron VEGF-A165 (2,4μg/ml de solución madre en solución salina tamponada con fosfato [PBS] con un 1% de albúmina sérica bovina [BSA], concentración final: 24 ng/ml), ANG1 (16μg/ml de solución madre en PBS con un 1% de BSA, concentración final: 16 ng/ml), ANG2 (16μg/ml de solución madre en PBS con un 1% de BSA, concentración final: 16 ng/ml), y PDGF (en su mayor parte heterodímeros de PDGFAB, 2μg/ml de solución madre en PBS con un 1% de BSA, concentración final: 20 ng/ml) (todos adquiridos a R&D Systems, Mineápolis, MN). Para lograr efectos significativos, todos los reactivos de prueba se utilizaron aproximadamente cuatro veces por encima de su concentración eficaz media (EC50) como indicó la ficha técnica del fabricante. Se estudiaron todas las combinaciones posibles de las cuatro sustancias y el medio de cultivo celular completo con un 1% de BSA como control negativo. Las 16 combinaciones se presentan en la fig. 1.
Modelo de lesión endotelialLas HUVEC se cultivaron en los pocillos de las placas de cultivo hasta el 100% de confluencia. La monocapa se arañó a lo largo de una escala utilizando una punta de pipeta de 200ml. El arañazo inicial se fotografió con un microscopio invertido Nikon (Melville, NY) Diaphot equipado con lentes Hoffman Modulation Contrast (Modulation Optics, Greenvale, NY) y su objetivo correspondiente (plan 4/0.13 DL, 160/-, Phl; Nikon, Tokio, Japón). Las fotos se tomaron con una cámara Canon (Lake Success, NY) EOS 10D. Posteriormente las células se incubaron a 37°C durante 5h en una atmósfera humidificada con un 5% de CO2. La migración celular se determinó comparando la fotografía inicial con una fotografía tras 5h de incubación. La anchura del arañazo se midió utilizando el programa ImageJ 1.34s para histometría (NIH, Bethesda, MD). Se comparó el ancho de la hendidura entre ambos extremos de la herida entre las muestras estudiadas y los controles no tratados.
Tinción de inmunofluorescenciaLas células se fijaron con metanol a –20°C durante 10min, se lavaron en PBS con un 1% de BSA, se incubaron con anticuerpo frente al factor de von Willebrand (vWF) (F-3520; Sigma, Deisenhofen, Alemania) 1:100 en PBS/BSA durante 30min a temperatura ambiente en una cámara húmeda, se lavaron dos veces en PBS/BSA, seguido de la incubación con anticuerpo monoclonal anti-conejo marcado con isotiocianato de fluoresceína (FITC) (F-4890, Sigma) 1:20 en PBS/BSA durante otros 30min, y se lavó de nuevo dos veces con PBS. Los controles negativos se incubaron solamente con el anticuerpo secundario marcado con FITC. Las muestras se analizaron directamente con un microscopio Ortholux® con un objetivo de inmersión en agua (25/0.60W Fluoreszenz) y un equipo de filtros I 2/3 para epifluorescencia (Leitz, Wetzlar, Alemania) o utilizando un haz translumínico. Las fotos se tomaron con una cámara Canon EOS 10D.
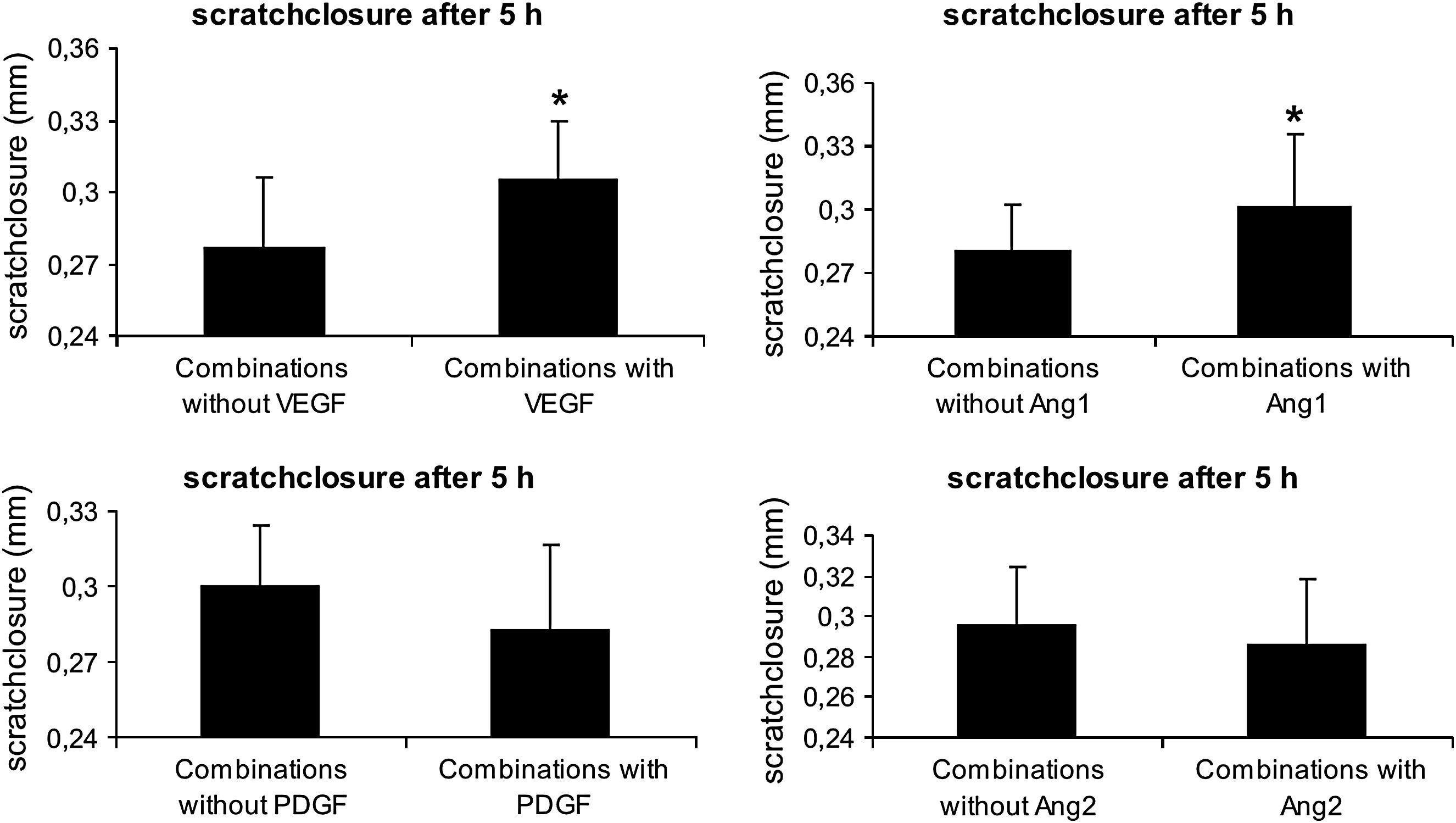
Análisis estadísticoLas células endoteliales se aislaron de forma independiente de 7 cordones umbilicales diferentes. Cada combinación de factores desde el grupo 1 hasta el 16 (fig. 1) se investigó con HUVEC de cada uno de estos cordones umbilicales. Así pues, se realizaron 7 mediciones independientes en cada grupo. (Tres de estos grupos se muestran comparados con el grupo control, véase la figura 2). Para revelar los efectos del VEGF-A, por ejemplo, se agruparon muestras de todos los grupos sin VEGF-A (grupos 16, 2, 4, 6, 8, 10, 11, 14) o con VEGF-A (grupos 1, 3, 5, 7, 9, 12, 13, 15). Las muestras se emparejaron en función de los cordones umbilicales y los factores presentes durante el tiempo de incubación. Por ejemplo, las HUVEC del cordón umbilical número 1 del grupo 16 se emparejaron con las procedentes del cordón umbilical número 1 del grupo 1, y así sucesivamente. Así pues, solamente una variable difirió entre muestras emparejadas, el factor de interés. Los datos se presentan como la media ± desviación estándar (DE) y se estableció la significancia estadística en p≤0,05, según la prueba t de Student para datos apareados.
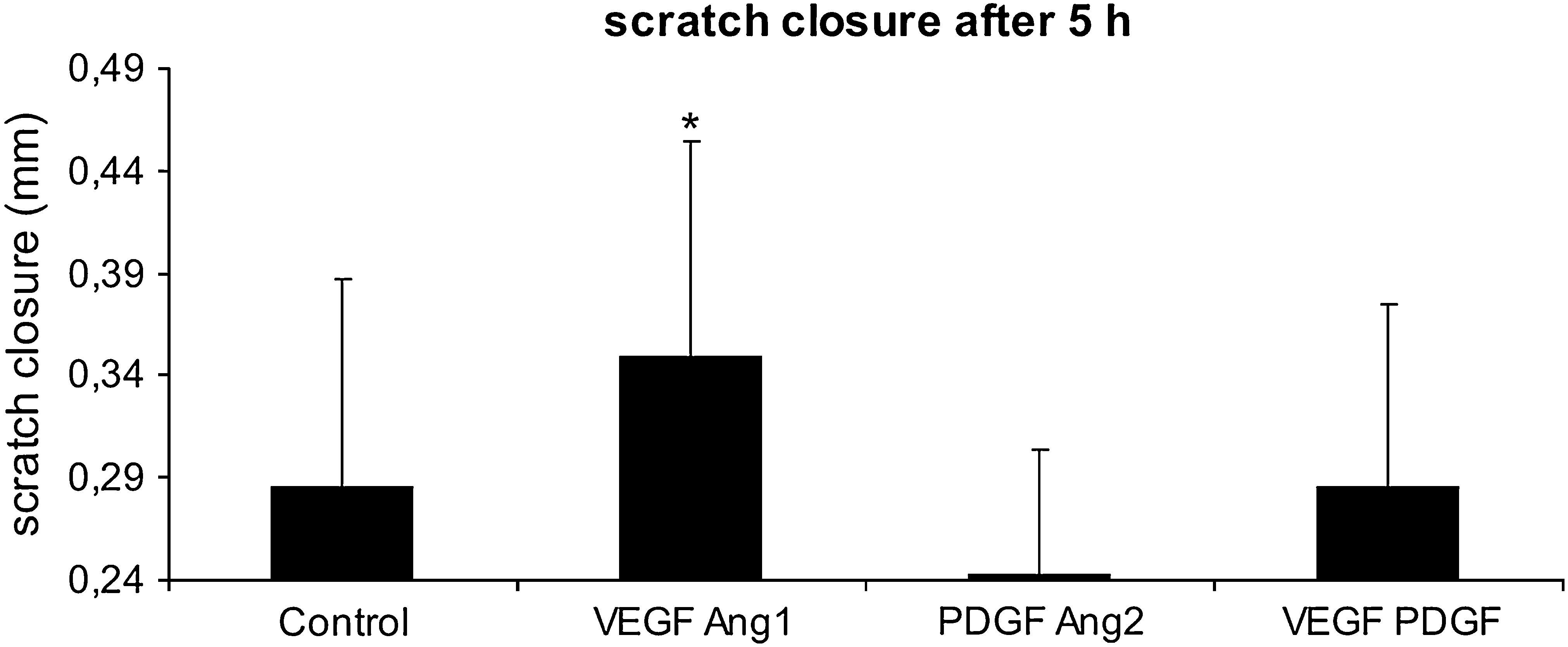
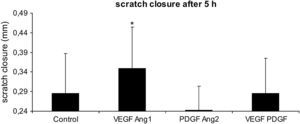
Influencia de las diferentes combinaciones de factores angiogénicos en el cierre de la lesión endotelial. Las monocapas HUVEC del primer pase se arañaron con la punta de una pipeta, y se midió el cierre del arañazo 5h después en un grupo control (medio de cultivo celular solamente) o en presencia de VEGF-A165 más ANG1, PDGF más ANG2, o VEGF-A165 más PDGF. Los resultados se presentan como la media±DE para n=7, ∗p≤0,05. Scratch closure alter 5h: cierre del arañazo tras 5h; Scratch closure (mm)=cierre del arañazo (mm).
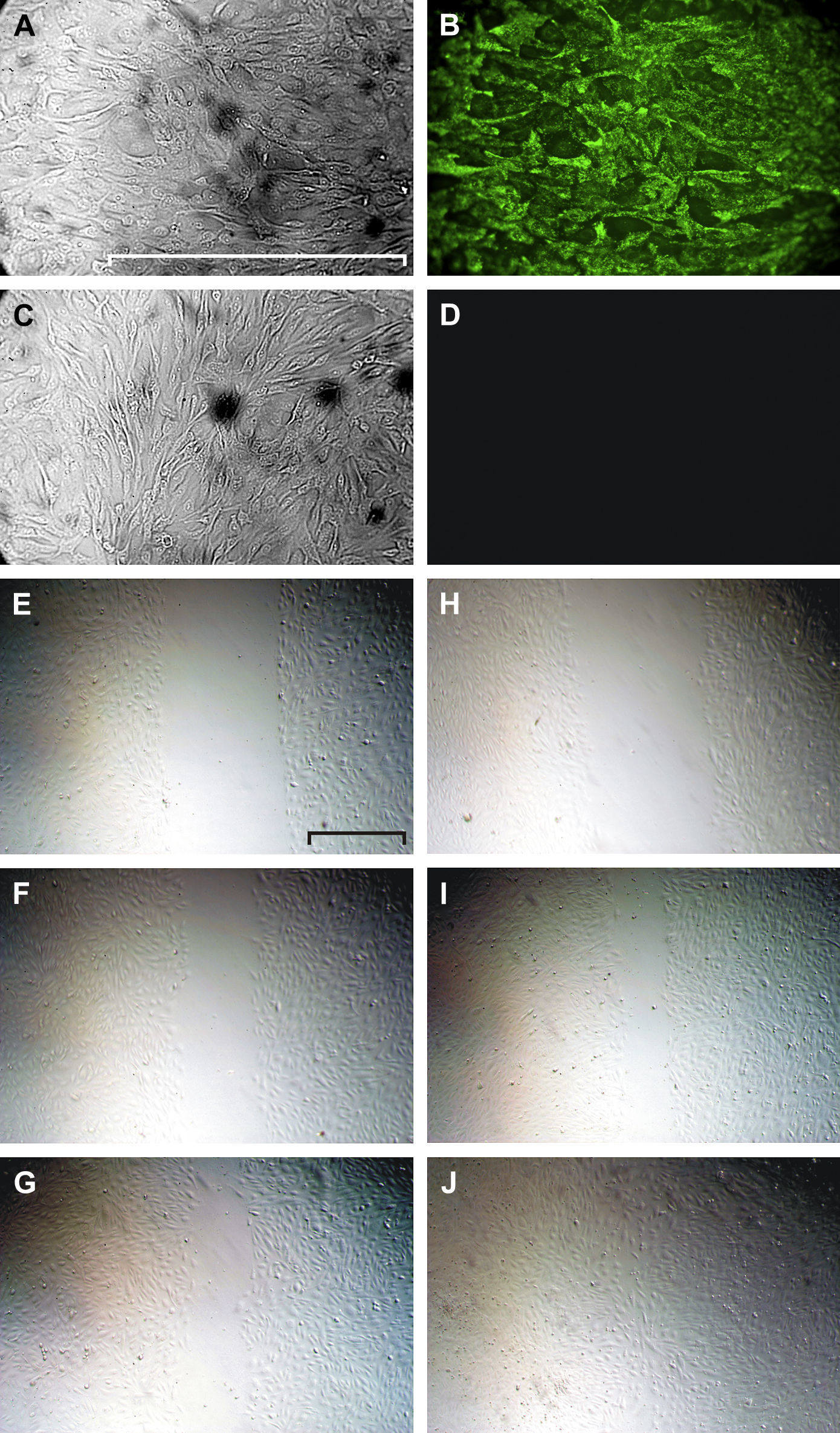
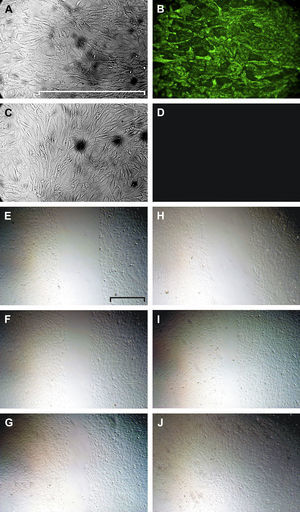
Se confirmó el origen endotelial de las células cultivadas hasta su confluencia mediante la tinción inmunológica positiva del vWF (figs. 3A y 3B). La disrupción de estas monocapas cerró espontáneamente en aproximadamente 24h (figs. 3C a 3H).
Tinción del vWF (A-D) y cierre del arañazo (E-J). Las HUVEC del primer pase se muestran mediante microscopía de transiluminación (A) y microscopía de fluorescencia tras la tinción inmunológica del vWF (B). En D y C se muestra un control negativo (anticuerpo secundario marcado con FITC solo) y su correspondiente imagen de transiluminación, respectivamente. La microscopía de transiluminación utilizando el contraste de modulación de Hoffmann muestra un defecto endotelial causado por arañazo reciente (E, H) y el seguimiento a las 5h (F, I) y a las 16h (G, J) en condiciones control (E-G) o en presencia de VEGF-A165(H-J). Escala=500mm.
Incluso con la adición de factores del crecimiento y el aumento resultante de la velocidad del cierre de la lesión, siguió existiendo una discontinuidad apreciable durante un mínimo de 5h. Así pues, las mediciones se realizaron a las 0 y 5h después del arañazo. Se estudiaron 4 factores del crecimiento y todas sus combinaciones, y se evaluaron sus efectos cuantificando la velocidad del cierre de la herida como medida compuesta de la migración y proliferación celular. Todos los grupos con un único factor se estudiaron en comparación con todos los grupos con el mismo factor. Este análisis reveló que se logró un aumento estadísticamente significativo de la velocidad del cierre de la herida (fig. 3) con VEGF-A165 y ANG1, mientras que PDGF-AB causó una disminución de ambos, aunque no fue estadísticamente significativa.
En comparación con los cultivos control con un medio de cultivo celular completo, el aumento de la velocidad del cierre de la lesión (fig. 4) fue mayor con la adición de VEGF-A165 más ANG1. Por el contrario, con la adición de PDGF-AB más ANG2, el cierre de la herida se ralentizó (fig. 4).
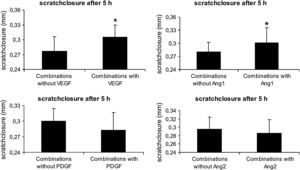
Influencia de diferentes combinaciones de 4 factores angiogénicos en el cierre de la lesión endotelial in vitro. Las monocapas HUVEC del primer pase se arañaron con la punta de una pipeta, y se midió el cierre del arañazo 5h después con la adición o no de VEGF-A165, ANG1, PDGF, y ANG2. Todas las combinaciones sin uno de estos factores se compararon con todas las combinaciones en las que se añadió este factor especial. Los resultados se presentan como la media±DE de n=56, ∗p≤0,05. Combinations with: combinaciones con; Combinations without: combinaciones sin; scratch closure after 5h: cierre del arañazo tras 5h; scratch closure (mm): cierre del arañazo (mm).
Este estudio mostró que, de las 16 combinaciones posibles de 4 factores angiogénicos, la combinación de VEGF-A165 más ANG1 fue la más eficaz en la aceleración de la migración y proliferación endotelial en un ensayo de lesión endotelial in vitro utilizando HUVEC. Además, el VEGF-A165 estimuló el cierre de la herida en todas las combinaciones estudiadas, mientras que se vio atenuado por el PDGF-AB.
El cierre de la lesión, determinado por la reducción de la amplitud de la disrupción en una monocapa endotelial, es resultado de la combinación de la proliferación y migración celular. Dado que ambas funciones celulares son esenciales en el brote capilar, este ensayo cubre dos aspectos principales de la angiogénesis.
Si bien las diferencias entre los factores estudiados hubiesen sido más pronunciadas en un medio de cultivo celular sin suero o sin factores del crecimiento, las pruebas presentadas aquí se realizaron en presencia de un medio de crecimiento celular normal, para simular de forma más estrecha las condiciones in vivo, en las que el tratamiento terapéutico con factores angiogénicos sencillamente añadiría estos factores a los ya presentes cerca de una herida. Además, los 4 factores se estudiaron en las 16 combinaciones posibles, y el VEGF-A165 estimuló el cierre de la herida en todas las combinaciones estudiadas.
El VEGF-A es el factor angiogénico estudiado de forma más amplia9,28. Es bien sabido que estimula la proliferación y migración endotelial29 así como otras funciones endoteliales que intervienen en el brote capilar o en el mantenimiento de los vasos sanguíneos maduros30. Así pues, los datos presentados aquí concuerdan con los referidos en la literatura. Sin embargo, el VEGF-A aplicado para inducir la angiogénesis in vivo no solamente aumenta la densidad capilar sino que desgraciadamente se correlaciona con un aumento de la permeabilidad capilar, lo que impide el correcto funcionamiento de la nueva red capilar formada31. Existe un interés creciente por combinar el VEGF-A con otros factores, para facilitar así el reclutamiento de células perivasculares y la maduración de los vasos sanguíneos, sellando los capilares, p. ej., PDGF y ANG1. El PDGF-AB se une a diferentes receptores endoteliales12. La ausencia de PDGF en ratones knockout provoca un defecto en la maduración de los vasos sanguíneos32. Por consiguiente, una combinación de VEGF con PDGF permitió inducir vasos sanguíneos más maduros33. De forma alternativa, el VEGF-A se ha estudiado combinado con la ANG123,24. La ANG1 activa el receptor endotelial de la tirosina cinasa TIE2 y la ruta metabólica de la fosfatidilinositol 3 cinasa34,35. De nuevo, esta combinación permitió inducir más vasos sanguíneos maduros23,24.
Los resultados presentados aquí permiten comparar directamente las combinaciones de VEGF-A y PDGF-AB con las de VEGF-A y ANG1. Esta comparación mostró que los efectos del VEGF-A165 en el cierre del arañazo se ven aumentados si se combina con la ANG1. Así pues, la combinación del VEGF con la ANG1 pudo tener dos efectos deseados, la prevención del aumento de la permeabilidad vascular36 y un aumento adicional de la proliferación y migración de las células endoteliales. Dado que la ANG1ha demostrado ser un quimiotáctico para las células endoteliales37, el aumento de la velocidad en el cierre de la lesión endotelial concuerda con los estudios de la literatura. Los efectos del VEGF-A y la ANG1 están restringidos básicamente a las células endoteliales porque sus receptores se expresan de forma selectiva en estas células. Esto puede ser útil para reducir los efectos secundarios en una situación in vivo y podría constituir una ventaja adicional en situaciones clínicas.
Sin embargo, se ha descrito la expresión del VEGF-A durante reacciones inflamatorias que, por ejemplo, conducirían al fracaso de los implantes dentales38. Este efecto probablemente fue una consecuencia de la reacción inflamatoria en general, no del VEGF solo. Además, al combinarlo con la ANG1, se evita el aumento de la permeabilidad vascular inducido por el VEGFA39. Así pues, ante una situación no inflamatoria y en combinación con la ANG1, el VEGF inducirá la angiogénesis aumentando la proliferación y migración de las células endoteliales y acelerando el cierre de la herida, lo que evitará así el fracaso de los implantes y favorerá el crecimiento de injertos tisulares libres.
Además, el VEGF-A estimula la expresión de la ANG240, lo que a su vez ha demostrado favorecer la inflamación inducida por el factor de necrosis tumoral α41. Por el contrario, la activación del TIE2 a través de la ANG1 estimula la ruta metabólica de la fosfatidilinositol 3 cinasa42, inactivando así el FoxO1, un conocido factor de transcripción de la ANG243. De este modo, la ANG1 probablemente evitará las reacciones inflamatorias mediadas por la ANG2 dependiente del VEGF-A.
Aunque conocido como factor angiogénico, el PDGFAB redujo el cierre de la lesión endotelial en nuestro estudio. Esto concuerda con los resultados que muestran una reducción de la densidad capilar con el PDGF combinado con el VEGF33 o un aumento de la densidad capilar mientras estuvieron bloqueados los efectos del PDGF44. Así pues se cree que el principal efecto del PDGF en el proceso de angiogénesis es la maduración de los vasos sanguíneos recién formados33.
Recientemente, se ha descrito que la ANG2, introducida inicialmente como un antagonista endógeno del TIE215, lo activa42. De forma inesperada, la combinación de PDGF-AB con ANG2 redujo de forma significativa el cierre del arañazo, hecho que es difícil de comprender. Sin embargo, no pudimos encontrar en la literatura ninguna otra prueba sobre los efectos combinados del PDGF-AB y la ANG2. Nuestros resultados, como mínimo, predicen la superioridad del VEGF más la ANG1 sobre el PDGF-AB más la ANG2.
Una aplicación clínica de los factores proangiogénicos para acelerar el cierre de las heridas es el tratamiento de los pacientes con defectos de cicatrización y un riesgo elevado de fracaso de los implantes. Un prerrequisito para este tratamiento consiste en revelar las combinaciones óptimas de factores angiogénicos para mejorar sus efectos. Este estudio sugiere que el VEGF más la ANG1 es la combinación más prometedora de los 4 factores y las 16 combinaciones estudiadas.
Agradecemos la ayuda técnica experta de G. Beyer.