La hiperplasia intimal es uno de los principales procesos patológicos involucrados en el fracaso del implante de injertos venosos en pacientes con diabetes mellitus. En el presente estudio, probamos la hipótesis de que en la diabetes inducida por estreptozotocina el efecto supresor de la aminoguanidina sobre la hiperplasia intimal está mediado por la expresión regulada a la baja de los productos finales de glicosilación avanzada (advanced glycation end products [AGE]) y su receptor (RAGE). Para inducir la hiperplasia intimal, se implantó un injerto autólogo de vena yugular externa en la aorta abdominal infrarrenal de 52 ratas macho Sprague-Dawley. En ratas diabéticas, se administró agua destilada con o sin aminoguanidina, mientras que en no diabéticas sólo se administró agua destilada. Los injertos venosos se recuperaron a las 1 y 4 semanas después de la cirugía para un análisis morfológico y un análisis semicuantitativo mediante reacción en cadena de la polimerasa retrotranscriptasa para RAGE y la subunidad p65 del factor nuclear kappaB (NF-kappaB). Mediante fluoroespectrofotometría se determinó la concentración sérica de AGE. Comparado con ratas no diabéticas, en animales diabéticos que recibieron agua destilada la concentración sérica de AGE aumentó significativamente. En el injerto venoso se identificó un aumento significativo de la expresión de RAGE y de p65 de NF-kappaB, cociente de área intimal:medial, y porcentaje de células positivas al antígeno de proliferación nuclear celular (PCNA). En ratas diabéticas tratadas con aminoguanidina, la concentración sérica de AGE, la expresión de p65 de NF-kappaB, cociente área intimal:medial y porcentaje de células PCNA positivas disminuyeron significativamente. Sin embargo, en estos animales no se identificó una diferencia en la expresión de RAGE comparado con el grupo diabético que recibió agua destilada. Los datos del presente estudio sugieren que los AGE y su receptor (RAGE) podrían desempeñar un papel clave en la hiperplasia intimal venosa en la diabetes mellitus y la hiperplasia intimal suprimida por aminoguanidina a través de la inhibición de esta vía.
El conducto más habitualmente usado en los procedimientos quirúrgicos para tratar la coronariopatía y la arteriopatía periférica sigue siendo la vena autóloga. Aunque los injertos venosos son satisfactorios para aliviar los síntomas en pacientes que experimentan arteriopatía isquémica grave, la permeabilidad a largo plazo sigue siendo un problema crítico. En conjunto, se ocluyen un 12-20% de los injertos venosos al año y un 30% a los 2 años1. Al cabo de 5 años, se ocluyen el 37-62% de los bypass venosos y que requieren una revisión2,3. En el fracaso del injerto venoso participan tres procesos diferentes: trombosis, hiperplasia intimal y aterosclerosis acelerada. El fracaso agudo de un injerto venoso se debe principalmente a la trombosis mientras que el tardío se asocia con aterosclerosis progresiva del injerto4. La progresión de la hiperplasia intimal, que se caracteriza por la proliferación y migración de las células musculares lisas vasculares (CMLV) desde la media a la íntima, es un proceso importante en el mecanismo del fracaso del injerto venoso5,6.
La diabetes mellitus se asocia con aterosclerosis y no sólo es un factor de riesgo, sino que también se asocia con una peor evolución cuando en la reconstrucción coronaria7 e infragenicular8 se utiliza un injerto protésico de vena safena. El hecho de que en un elevado número de ensayos clínicos no se haya podido demostrar una disminución significativa de la progresión de la enfermedad cardiovascular con un control estricto de la glucemia9 indica que las interacciones entre la diabetes y la vascularización son complejas y que, además de la glucemia, participan otros factores.
El receptor de los productos finales de glicosilación avanzada (advanced glycation end products [AGE]) (RAGE) es un receptor multiligando de la superficie celular que pertenece a la superfamilia de inmunoglobulinas de moléculas de la superficie celular10. Los productos finales de glicosilación avanzada (AGE) son unos de los ligandos más importantes de RAGE. La participación de RAGE por los AGE puede inducir estrés oxidativo celular, activar el factor nuclear de transcripción kappaB (NF-kappaB) y dar lugar a una lesión del vaso11. El objetivo del presente estudio fue examinar el papel del sistema AGE-RAGE en la hiperplasia intimal del injerto venoso entre ratas diabéticas.
Materiales y MétodosA partir del centro de animales de laboratorio de la China Medical University, se obtuvieron 60 ratas macho Sprague-Dawley (peso corporal 180-220g). Todos los animales se mantuvieron en un ciclo de luz/oscuridad (12/12h) con una temperatura de 24°C. Todos los procedimientos se efectuaron de acuerdo con los protocolos aprobados por los comités apropiados de investigación y cumplieron con las directrices chinas de experimentos en animales.
Animales diabéticosUn grupo de 40 ratas recibió una inyección intraperitoneal de 60mg/kg de estreptozotocina (STZ; Sigma Chemical Co., St. Louis, Estados Unidos) disuelta en 0,1mol/l de un tampón citrato, recién preparado (pH 4,5) inmediatamente antes de la administración. A las 48h de la inyección, se obtuvo una muestra de sangre a partir de las venas de la cola y se determinó la glucemia con un sistema de monitorización de la glucosa sanguínea THE Accu-Chek (Roche Diagnostics, Palo Alto, Estados Unidos) para garantizar la inducción de diabetes (concentración sanguínea de glucosa en ayunas≥16,7mmol/l). En 32 ratas se indujo satisfactoriamente diabetes. Las de control sólo recibieron una inyección del tampón citrato de 0,1mol/l (n=20). Las ratas diabéticas fueron asignadas aleatoriamente a agua de bebida que contenía un 1% de aminoguanidina (AG, Sigma) en agua destilada (n=16) o vehículo (n=16). Las ratas de control sólo bebieron agua destilada.
Modelo de hiperplasia intimal venosa en ratasDespués de 2 semanas, al igual que en las publicaciones previas12,13, se desarrolló un modelo de hiperplasia intimal del injerto venoso en el que utilizó un injerto autólogo de vena yugular externa interpuesto en la aorta abdominal infrarrenal mediante anastomosis terminoterminal. Brevemente, las ratas se anestesiaron con pentobarbital sódico en dosis de 30mg/kg por vía intraperitoneal en suero salino al 0,9%. Mediante una sutura 11/0 se injertó un segmento de vena yugular externa izquierda (∼0,8cm) en la aorta abdominal infrarrenal (Surgical Instrument Manufactory, Ningbo, China) con microscopio de disección (SXP-1B; Medical Optical Instrument Manufactory, Shanghái, China). En cada extremo se requirieron 10-12 suturas interrumpidas. La aorta se clampó durante una media de 60min. El campo operatorio se irrigó durante la intervención con suero salino y penicilina antes de cerrar el músculo y la piel.
Obtención de tejidoSe obtuvieron los injertos venosos de las ratas diabéticas que bebieron AG o agua destilada a las 1 (n=8) y 4 (n=8) semanas después de la cirugía. Los injertos venosos de las ratas de control se obtuvieron a las 1 (n=10) y 4 (n=10) semanas después de la cirugía. Cada muestra se dividió en dos partes desde el centro, la mitad proximal para las evaluaciones morfológicas y la mitad distal para el análisis con reacción en cadena de la polimerasa retrotranscriptasa (RCP-RT). Antes de sacrificar a los animales, se obtuvo una muestra de 1ml de sangre periférica a partir de la aurícula derecha para el análisis de los valores séricos de AGE.
Análisis de los valores séricos de AGETras centrifugación, se obtuvieron 0,2ml de suero que se diluyeron en 2ml de agua destilada. La concentración sérica de AGE se determinó mediante fluoroespectrofotometría. El nivel de proteína se determinó mediante el método de Coomassie del azul brillante. La longitud onda de la luz de excitación y de la luz de emisión fue de 370 y 440nm, respectivamente. El valor de AGE se expresó en unidades por mg de proteína.
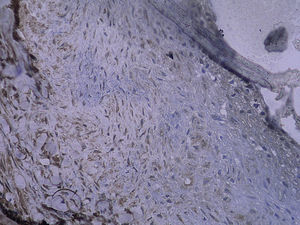
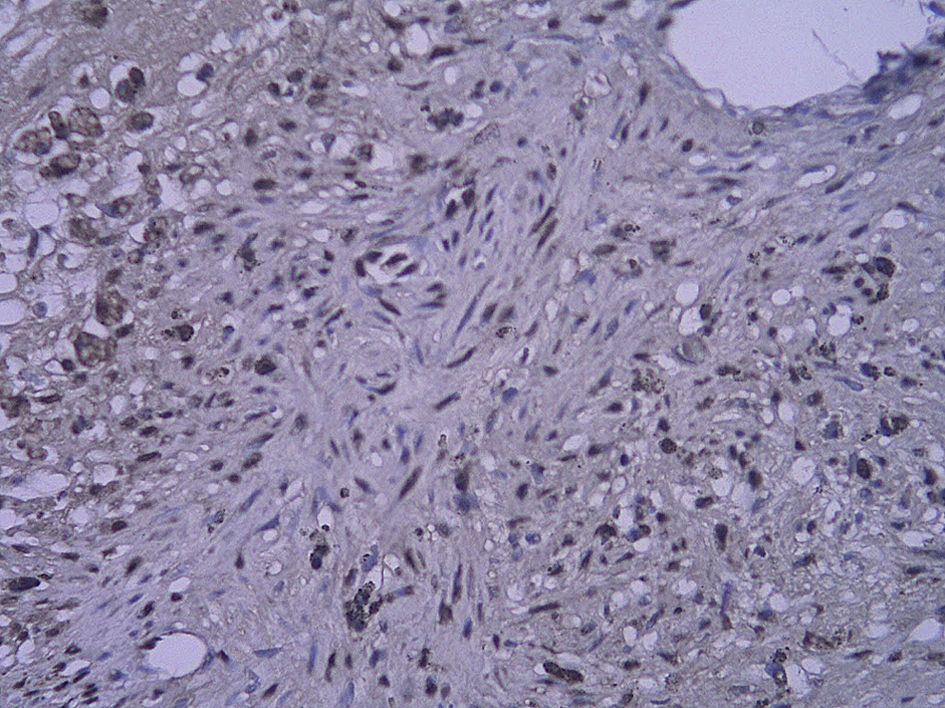
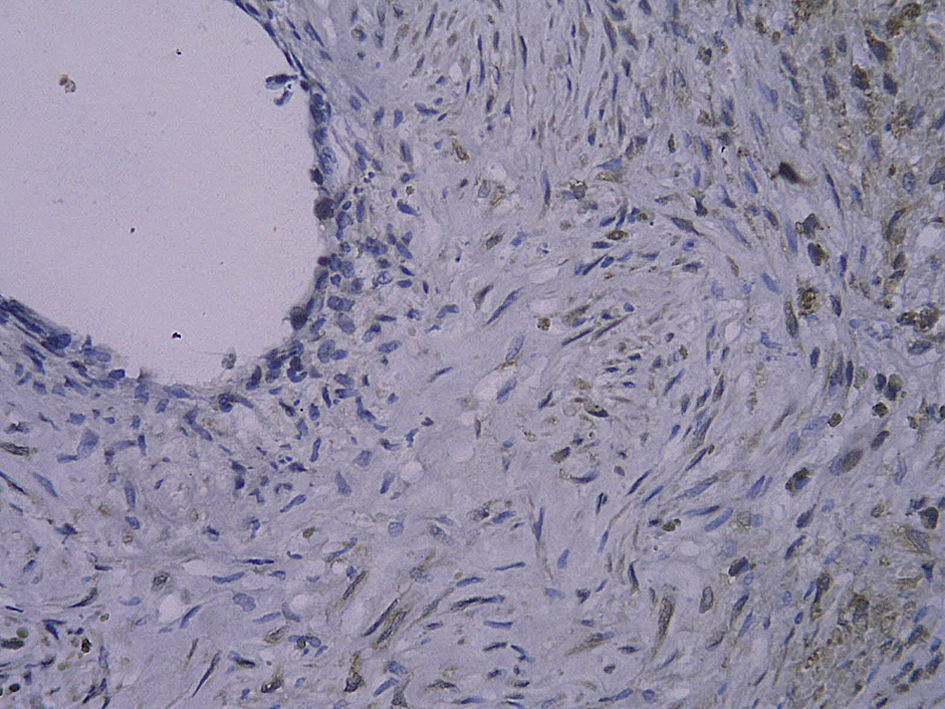
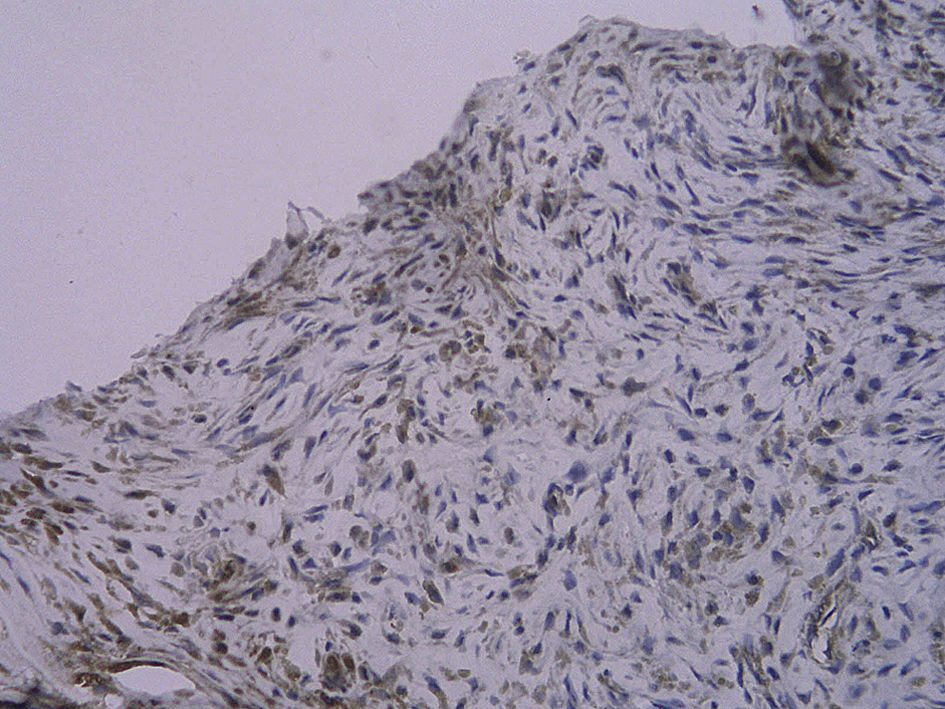
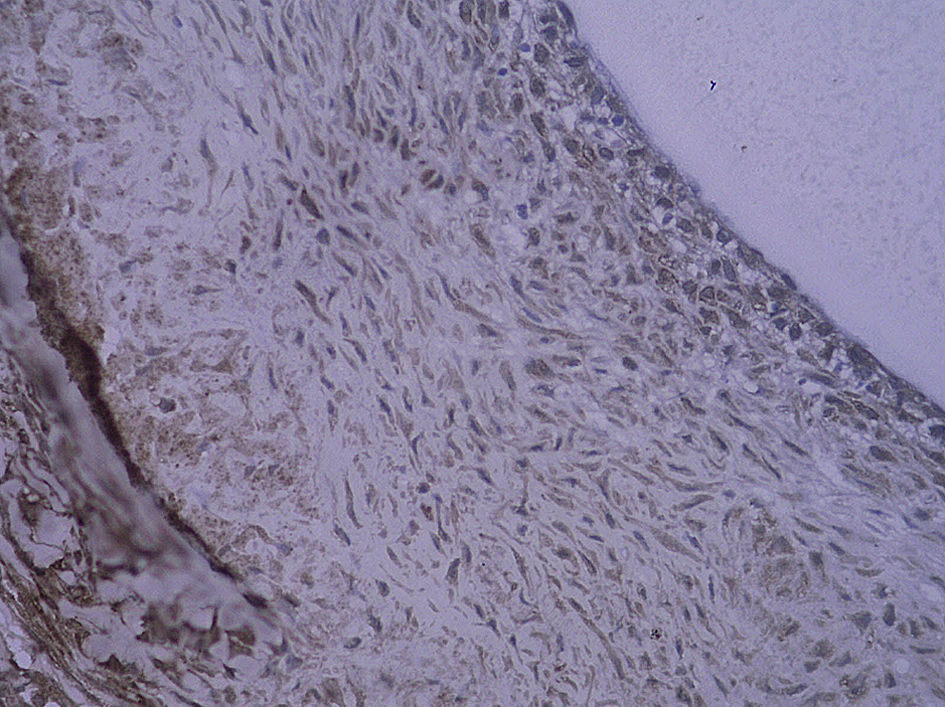
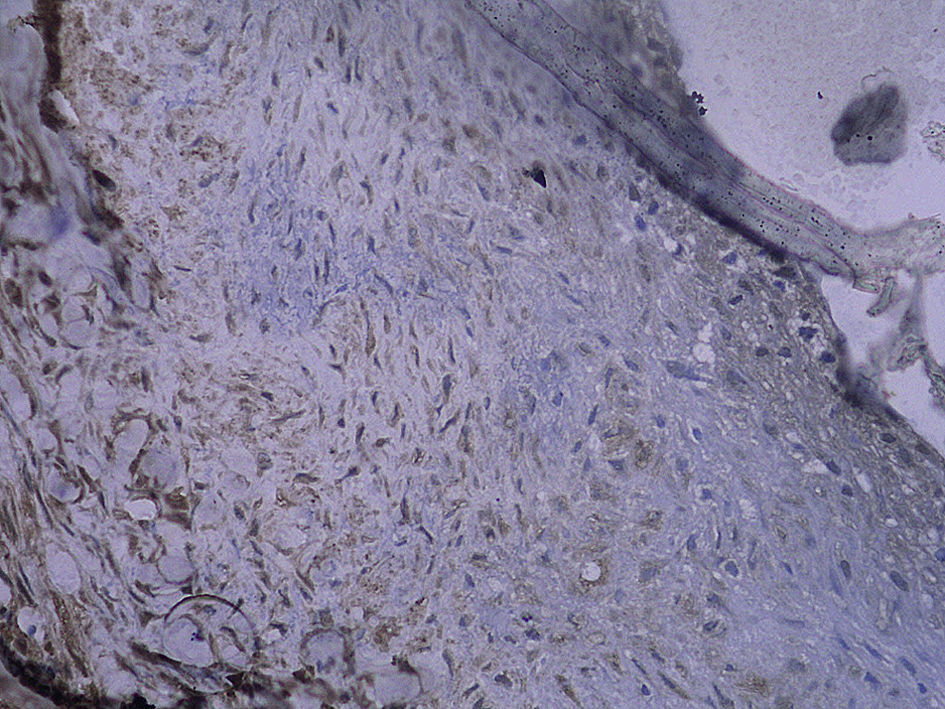
Tinción histológica e inmunohistoquímicaDe la mitad proximal se obtuvieron cortes consecutivos de 5 μm que se fijaron en parafina. Cada 100 μm, se obtuvieron ocho secciones adyacentes en tres puntos diferentes que se tiñeron con (1) hematoxilina y eosina (HE), (2) tinción de fibras elásticas de Verhoeff, (3) anticuerpo anti-RAGE, (4) anti-NK-kappaB p65, (5) anti-antígeno de la proliferación nuclear celular (PCNA) y (6-8) anticuerpo de control. La tinción HE y de fibras elásticas de Verhoeff se efectuó sistemáticamente. Se calcularon las áreas intimal y medial mediante un análisis mofrométrico cuantitativo con un programa informático de dibujo (Meta Morph BX41; Olympus, Tokio, Japón). Se calculó el cociente área intimal:medial.
Para el procedimiento de tinción inmunohistoquímica se rehidrataron los cortes, se trataron con un 3% de peróxido de hidrógeno, se bloquearon con un 5% de suero de burro y se incubaron con un anticuerpo policlonal generado en cabra anti-RAGE de rata (dilución 1:100; Santa Cruz Biotechnology, Santa Cruz, Estados Unidos) durante toda la noche a 4°C. Después de un lavado con suero salino neutralizado en fosfato, la sección se incubó con una dilución de 1:300 de anticuerpos generados en cabra/burro conjugada con peroxidasa (Zymed, San Francisco, Estados Unidos) durante 30min. Por último, las secciones se revelaron usando hidrocloruro de diaminobencidina y se contratiñeron con hematoxilina. Se incubaron portas de control negativo con inmunoglobulina G emparejada por isotipo como sustitución del anticuerpo primario. Para la tinción de p65 NK-kappaB y de PCNA, el procedimiento fue similar al mencionado previamente (ambos anticuerpos se adquirieron a partir de Santa Cruz Biotechnology). Algunas secciones se pretrataron a temperaturas altas como una técnica de antígeno desenmascarado antes de su tinción. La evaluación cuantitativa se efectuó con un aumento de x 400. Se efectuó un recuento de las células con tinción positiva en la neoíntima, y se calculó el porcentaje de dichas células en cada uno de los tres segmentos diferentes del injerto venoso.
RCP-RTEl ARN total se aisló a partir de los tejidos del injerto venoso utilizando el reactivo Trizol (Invitrogen, Carlsbad, Estados Unidos) después de homogeneizar los tejidos con ultrasonidos (JY92-II; Surgical Instrument Manufactory, Ningbo, China). Se efectuaron extracciones con cloroformo, lavados y precipitaciones. La pureza y el rendimiento se determinó mediante espectrofotometría (F-3000; Hitachi, Tokio, Japón). Acto seguido, se usó 1,0 μg de ARN total para la obtención de ADN complementario (ADNc) con oligo-dT y Superscript II RT (ambos de Invitrogen) a 42°C durante 50min. Las secuencias de los cebadores fueron designadas mediante el programa Primer Premier 5.0 (correspondiente a GenBank) y sintetizadas por Shanghai Sangon Biological Engineering Technology & Services (Shanghái, China): RAGE 5′-ATGAGCAGAGCGGCTATTCC-3′(sentido, 5′-CACGCTTCGGTCAGAGCTCA-3′(antisentido); NF-κB p65 5′-CAATGGACCAACTGAACCC-3′(sentido), 5′-TCCGCAATGGAGGAGAA-3′ (antisentido). Como referencia para la cuantificación de ARNm de RAGE y de p65 NF-kappaB se amplificó la gliceraldehído-3-fosfato deshidrogenasa (GAPDH) (5′-GAGCTGAACGGGAAACTCAC-3′ sentido, 5′-GGTCTGGGATGGAAACTGTG-3′antisentido). El material sometido a transcripción inversa (2μl) se amplificó con cebadores sentido y antisentido, trifosfatos desoxinucleótido, solución tampón y taq DNA polimerasa (Invitrogen). Las muestras se sometieron a 32 ciclos para RAGE y a 30 ciclos para p65 NF-kappaB y GAPDH de amplificación en un termociclador. Un ciclo se definió como 94°C durante 30 s, 55°C durante 30 s y 72°C durante un minuto, con 72°C durante 10min después de todos los ciclos. Los transcritos amplificados se visualizaron en geles de agarosa al 1,5% y tinción de bromuro de etidio. Se observaron los productos de amplificación específicos de los tamaños esperados (513bp para RAGE, 657bp para p65 NF-kappaB, y 476bp para GAPDH). Las intensidades relativas de las bandas de interés se analizaron con el programa TotalLab versión 1.11 (Nonlinear Dynamics, Newcastle upon Tyne, Reino Unido). Los resultados se expresaron como cocientes de ARNm de RAGE o de p65 NF-kappaB con respecto a ARNm de GAPDH.
Análisis estadísticoLos datos se expresaron como medias ± desviación estándar (DE). Las medias de los diferentes grupos se compararon con un análisis de la varianza seguido de una prueba de Newman-Keuls. Se consideró estadísticamente significativo un valor de p<0,05.
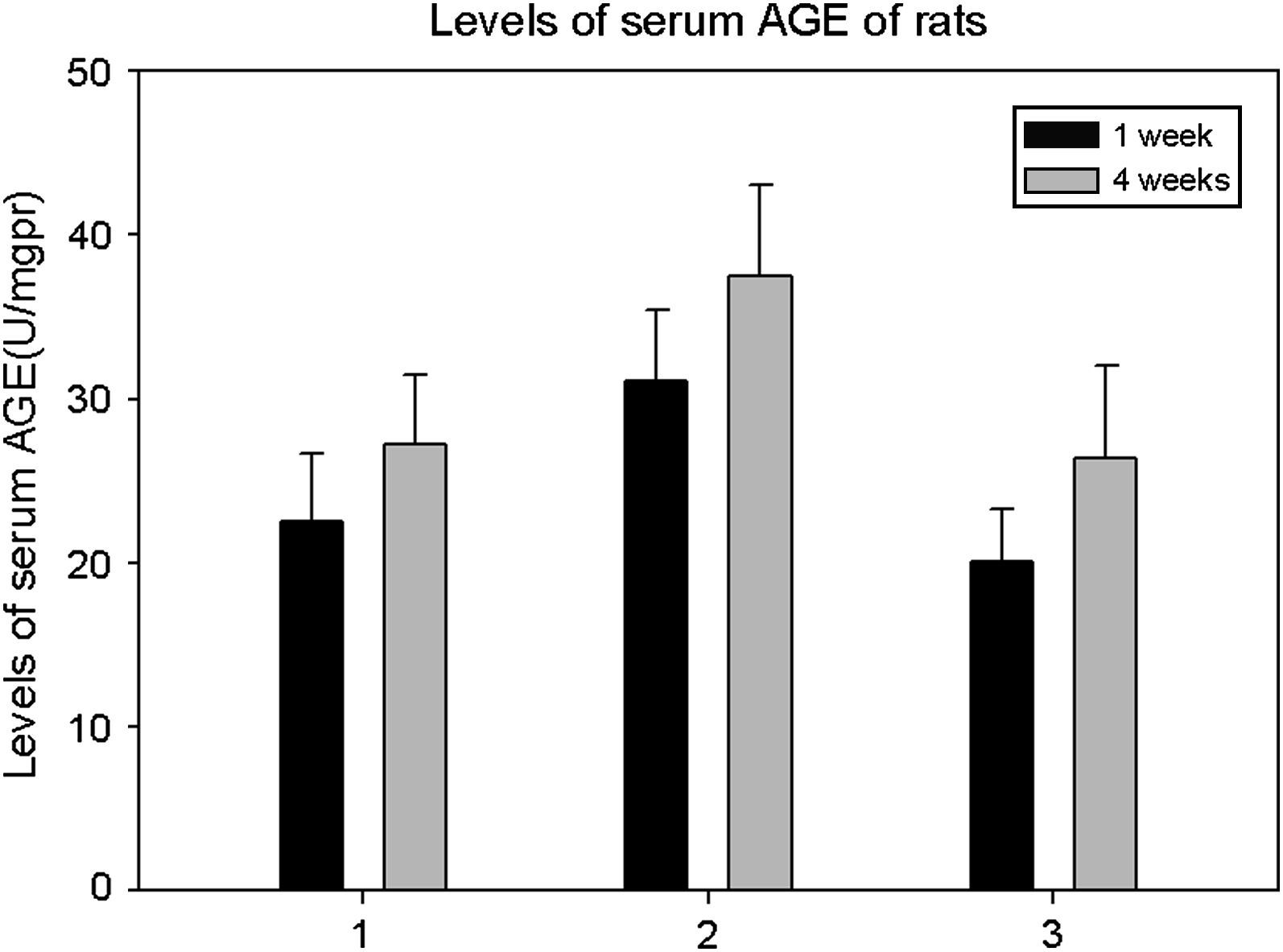
ResultadosConcentración sérica de AGETras un tiempo de implantación del injerto de 1 y 4 semanas, la concentración sérica de AGE de ratas diabéticas que bebieron agua destilada aumentó significativamente comparado con los animales que bebieron AG (p=0,000, una semana; p=0,000, 4 semanas). No obstante, no hubo diferencias significativas entre ratas diabéticas que bebieron AG y animales de control (p=0,183, una semana; p=0,727, 4 semanas) (fig. 1).
Concentración sérica de productos finales de glicosilación avanzada (advanced glycation end products [AGE]) en ratas de los tres grupos (media±DE). Comparado con ratas que bebieron aminoguanidina (AG) y animales de control, la concentración sérica de AGE en ratas diabéticas que bebieron agua destilada aumentó significativamente a 1 y 4 semanas (p<0,05). No hubo diferencias significativas entre ratas diabéticas que bebieron AG y animales de control (p>0,05). 1: ratas que bebieron AG; 2: ratas diabéticas que bebieron agua destilada; 3: animales de control. 1 week: una semana; 4 weeks: 4 semanas; Levels of serum AGE of rats: concetración sérica de AGE en ratas; Levels of serum AGE (U/mgpr): concentración sérica de AGE (U/mg).
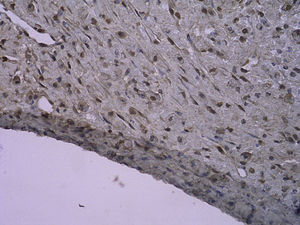
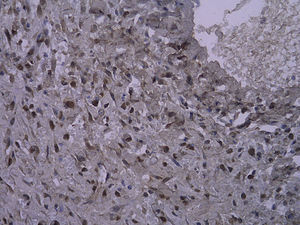
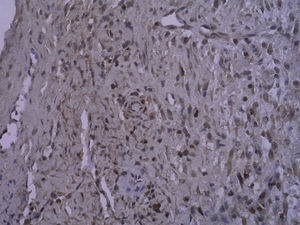
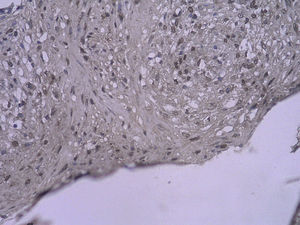
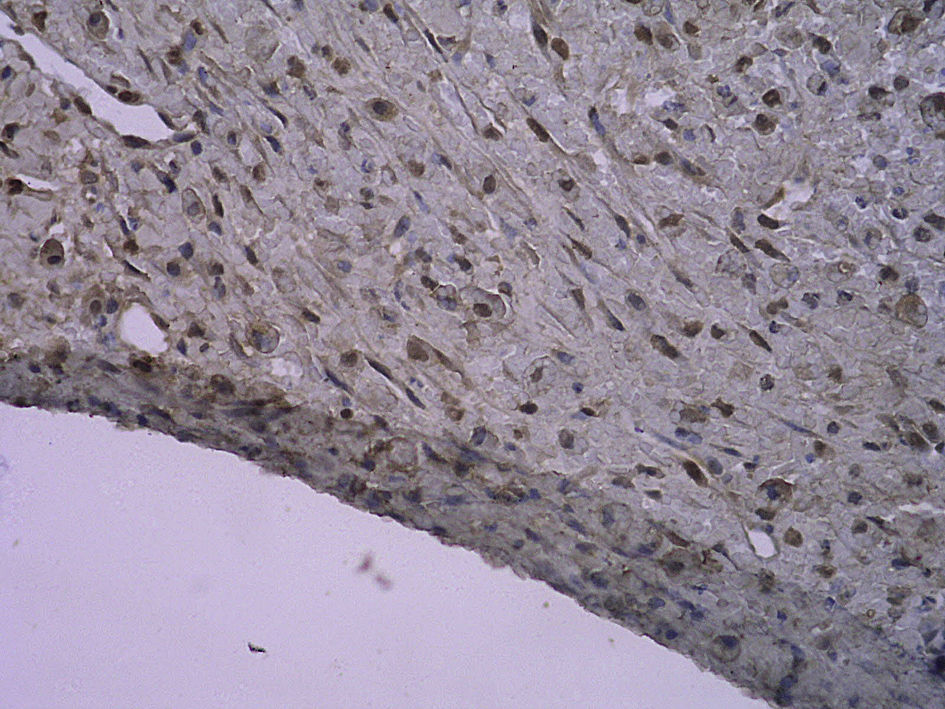
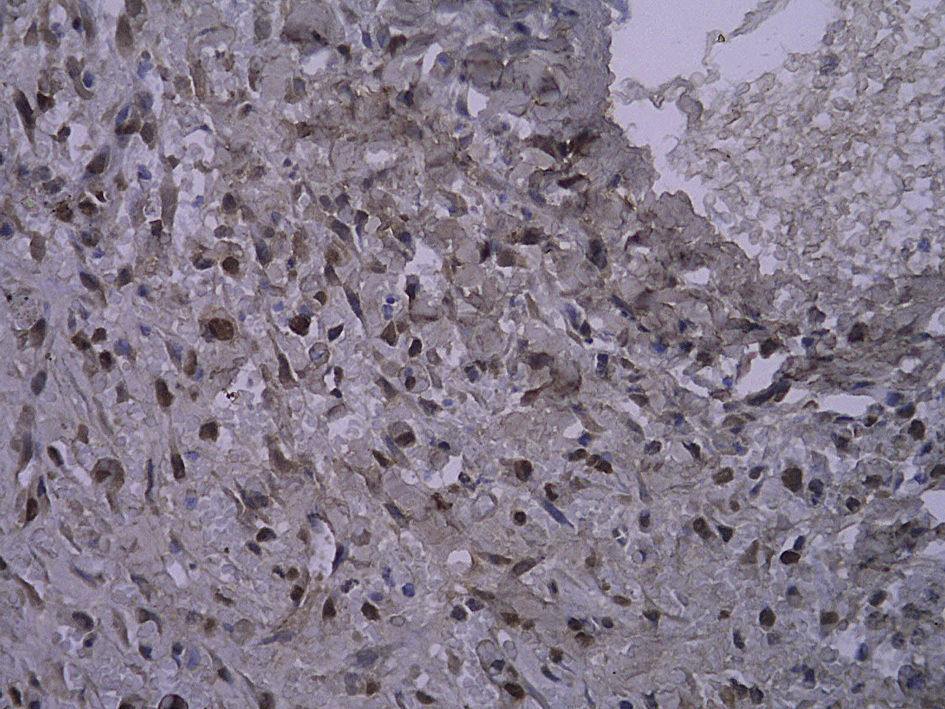
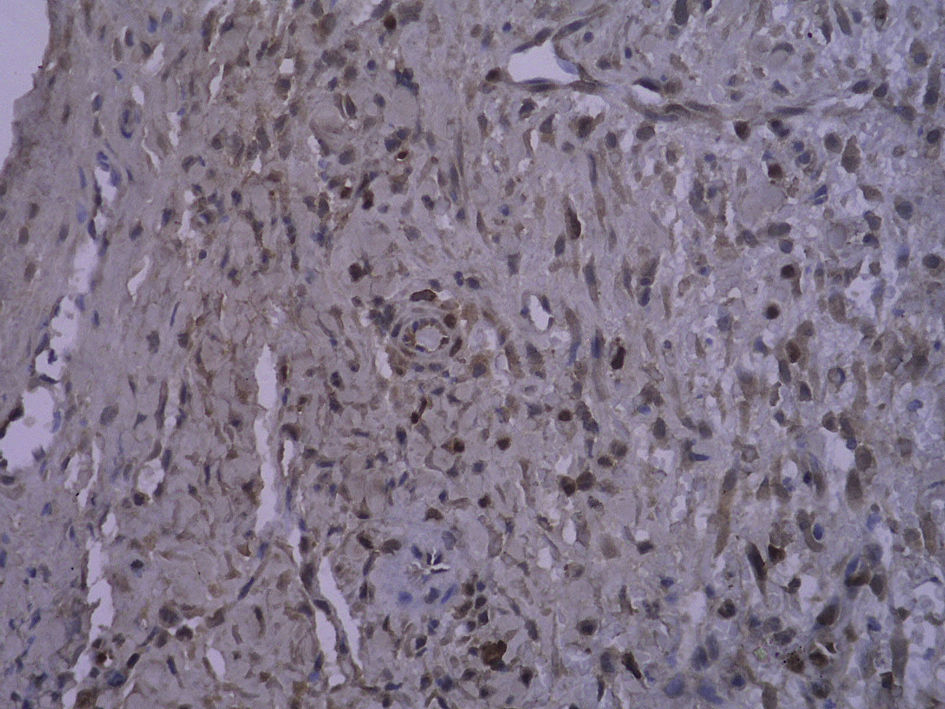
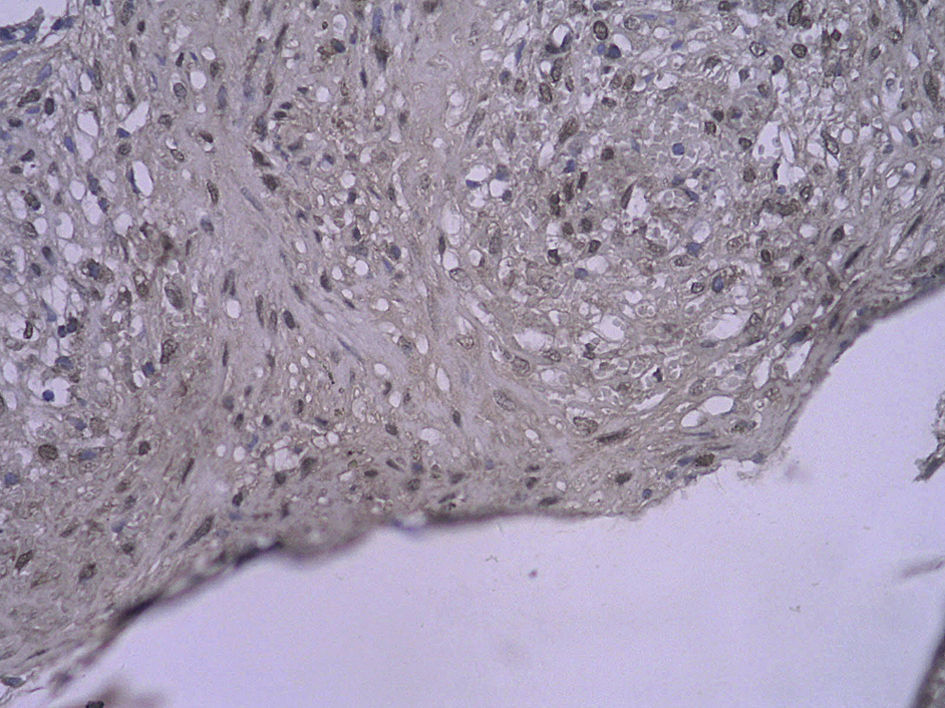
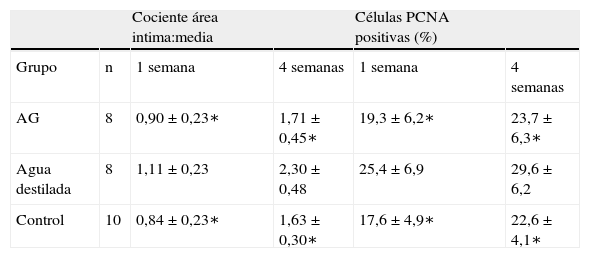
En todos los injertos venosos estaban presentes lesiones de hiperplasia intimal. A las 1 y 4 semanas de la cirugía, en ratas diabéticas que bebieron agua destilada el cociente área íntima:media fue significativamente mayor que en ratas no diabéticas (p=0,015, una semana; p=0,001, 4 semanas). Es interesante destacar que, en ratas diabéticas que bebieron AG, fue significativamente menor que en las diabéticas que bebieron agua destilada (p=0,047, una semana; p=0,004, 4 semanas). Se obtuvieron resultados similares para el porcentaje de células PCNA positivas entre ambos grupos (tabla I y figs. 2-4).
Resultados de la progresión de la lesión de hiperplasia intimal del injerto venoso en los tres grupos (media±DE)
| Cociente área intima:media | Células PCNA positivas (%) | ||||
| Grupo | n | 1 semana | 4 semanas | 1 semana | 4 semanas |
| AG | 8 | 0,90±0,23∗ | 1,71±0,45∗ | 19,3±6,2∗ | 23,7±6,3∗ |
| Agua destilada | 8 | 1,11±0,23 | 2,30±0,48 | 25,4±6,9 | 29,6±6,2 |
| Control | 10 | 0,84±0,23∗ | 1,63±0,30∗ | 17,6±4,9∗ | 22,6±4,1∗ |
Comparado con ratas diabéticas que bebieron agua destilada, el cociente del área íntima:media y el porcentaje de células PCNA-positivas de los animales diabéticos que bebieron AG y del grupo de control disminuyeron significativamente a 1 y 4 semanas (∗p<0,05). AG: aminoguanidina; PCNA: antígeno de la proliferación nuclear celular.
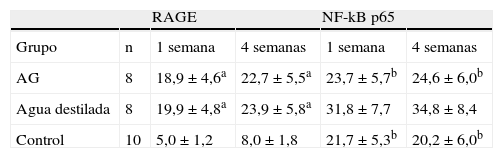
Con la tinción inmunohistoquímica se detectaron RAGE y p65 de NF-kappaB en todos los injertos venosos. Una semana después de la cirugía, en ratas diabéticas que bebieron AG o agua destilada el porcentaje de células RAGE positivas aumentó significativamente comparado con animales no diabéticos (p=0,000, AG frente a control; p=0,000, agua destilada frente al control). A las 4 semanas de la cirugía, se obtuvieron resultados similares (p=0,000, AG frente a control; p=0,000, agua destilada frente a control). No obstante, no hubo diferencias significativas entre ratas diabéticas que bebieron AG o agua destilada en el porcentaje de células RAGE positivas (p=0,570, una semana; p=0,575, 4 semanas). Después de la primera y a las 4 semanas de la cirugía, el porcentaje de células p65 NF-kappaB positivas en ratas diabéticas que bebieron AG disminuyó significativamente comparado con diabéticas que bebieron agua destilada (p=0,007, una semana; p=0,003, 4 semanas) y no se identificó una diferencia comparado con animales no diabéticos (p=0,494, una semana; p=0,163, 4 semanas) (tabla II, figs. 5-10). La expresión de RAGE y p65 NF-kappaB coincidió con la detección de ARNm mediante RCP-RT (figs. 11 y 12).
Resultados inmunohistoquímicos de la expresión de proteína de RAGE y de p65 NF-kappaB en los tres grupos (media±DE, %)
| RAGE | NF-kB p65 | ||||
| Grupo | n | 1 semana | 4 semanas | 1 semana | 4 semanas |
| AG | 8 | 18,9±4,6a | 22,7±5,5a | 23,7±5,7b | 24,6±6,0b |
| Agua destilada | 8 | 19,9±4,8a | 23,9±5,8a | 31,8±7,7 | 34,8±8,4 |
| Control | 10 | 5,0±1,2 | 8,0±1,8 | 21,7±5,3b | 20,2±6,0b |
Comparado con ratas no diabéticas del grupo de control, la expresión de RAGE de ratas diabéticas aumentó significativamente a la 1 y 4 semanas (ap<0,05). Comparado con ratas diabéticas que bebieron AG y animales de control, en ratas diabéticas que bebieron agua destilada la expresión de p65 NF-kappaB aumentó significativamente a 1 y 4 semanas (bp<0,05). AG: aminoguanidina; RAGE: receptor de AGE (productos finales de glicosilación avanzada [advanced glycation end products]).
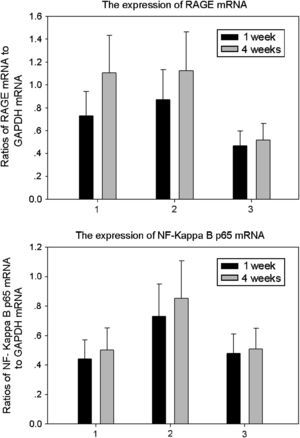
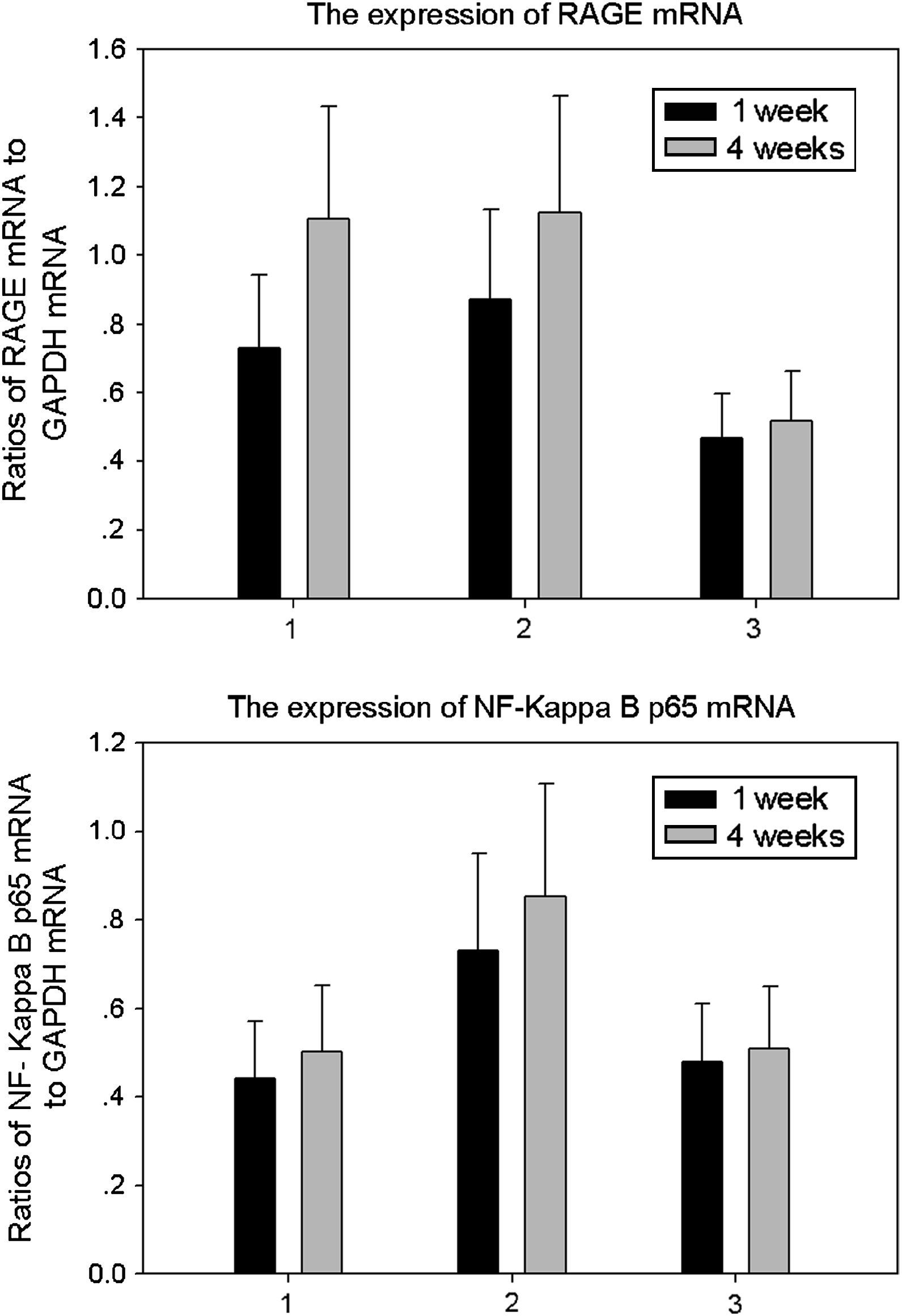
Resultados de la expresión de ARNm de RAGE y p65 de NF-kappaB de ratas de los tres grupos (media±DE). Comparado con ratas no diabéticas del grupo control, en animales diabéticos la expresión de ARNm de RAGE aumentó significativamente a 1 y 4 semanas (p<0,05). Comparado con ratas que bebieron aminoguanidina (AG) y animales de control, la expresión de ARNm de p65 de NF-kappaB de ratas diabéticas que bebieron agua destilada aumentó significativamente a 1 y 4 semanas (p<0,05). 1: ratas que bebieron AG; 2: ratas diabéticas que bebieron agua destilada; 3: animales control. 1 week: una semana; 4 weeks: 4 semanas; Ratios of NF-Kappa B p65 mRNA to GAPDH mRNA: cociente de ARNm p65 NF-kappaB con respecto a ARNm de GAPDH; Ratios of RAGE mRNA to GAPDH mRNA: cociente ARNm RAGE con respecto a ARNm GAPDH; The expression of NF-Kappa B p65 mRNA: expresión de ARNm p65 NF-kappaB; The expression of RAGE mRNA: expresión de ARNm de RAGE.
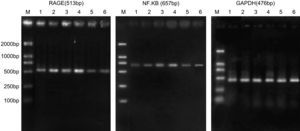
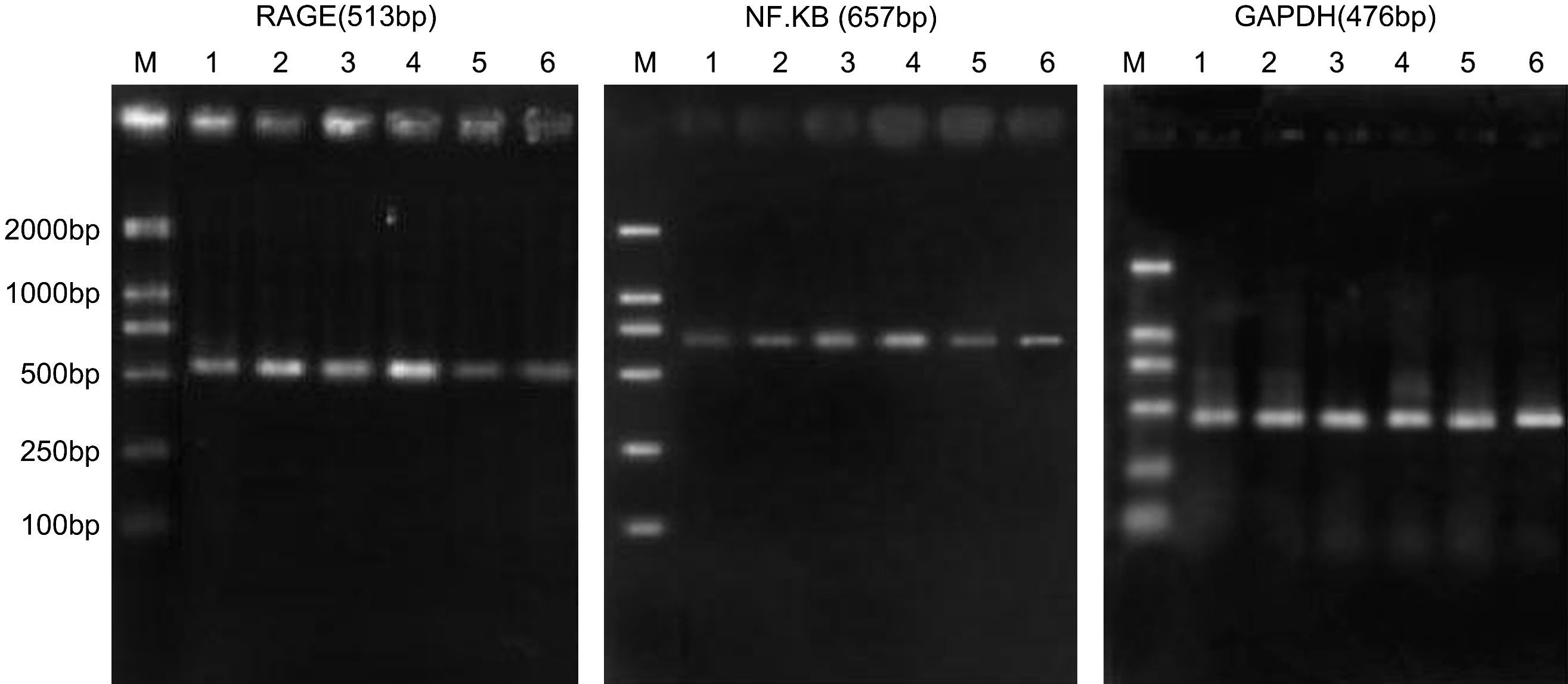
Resultados de la reacción en cadena de la polimerasa retrotranscriptasa (RCP-RT) de la expresión de ARNm de RAGE y p65 de NF-kappaB. RAGE (513bp), NF-kappaB (657bp), GAPDH (476bp). 1: ratas diabéticas que bebieron aminoguanidina (AG) una semana después de la cirugía; 2: ratas diabéticas que bebieron AG 4 semanas después de la cirugía; 3: ratas diabéticas que bebieron agua destilada una semana después de la cirugía; 5: ratas de control una semana después de la cirugía; 6: ratas de control 4 semanas después de la cirugía; M: marcador.
La cardiopatía coronaria aterosclerótica y la aterosclerosis de las extremidades inferiores son enfermedades críticas en la población de edad avanzada. Uno de los tratamientos más efectivos en estos pacientes es el uso de injertos venosos como conductos de bypass. No obstante, la hiperplasia intimal, una respuesta biológica habitual de la pared venosa tras su implantación en la circulación arterial, a menudo desencadena su fracaso. Por esta razón, la permeabilidad a largo plazo del injerto es limitada. En esta lesión patológica participan muchos componentes, incluida la proliferación y migración de las CMLV, el reclutamiento de las células inflamatorias, la apoptosis y los fenómenos de adhesión y agregación plaquetaria. Se han examinado diversas estrategias terapéuticas para reducir estos procesos, pero en ninguno de los ensayos efectuados hasta la fecha se ha demostrado su valor clínico.
Es bien conocido que la morbilidad y mortalidad de la diabetes se deben a la gravedad de las complicaciones tanto macro como microvasculares. La enfermedad acelera la aterogénesis, y predispone al infarto de miocardio y el ictus14-16. Es indispensable un control estricto de la glucosa. Es interesante destacar que el control exclusivo de la glucemia no mejora la enfermedad cardiovascular diabética9. Recientemente, se ha demostrado el papel contribuidor del sistema AGE-RAGE en el desarrollo de complicaciones vasculares. En los estados diabéticos, se sabe que los AGE se acumulan a un ritmo muy acelerado tanto en diversos tejidos como en la circulación y se han implicado en el desarrollo de dichas complicaciones.
Es probable que en la disfunción tisular inducida por AGE participen mecanismos dependientes del receptor. El RAGE pertenece a la superfamilia de inmunoglobulinas de las moléculas de superficie celular. Puede reconocer múltiples clases de ligandos, como los AGE, S100/calgranulinas, anfoterina, péptido beta-amiloide, y fibrillas betaplegadas, lo que sugiere que, en los tejidos, los efectos RAGE-dependientes pueden ser diversos. Sin embargo, se cree que el más importante es la transducción de señales desencadenada por el dominio para propagar respuestas inmunes/inflamatorias17-19. Una vez se forman los AGE, la interacción con RAGE desencadena la generación de citocinas proinflamatorias, moléculas de adhesión y quimiocinas. La atracción de las células inflamatorias, como leucocitos polimorfonucleares, fagocitos mononucleares y linfocitos T, en los tejidos proporciona un mecanismo para mantener la respuesta inflamatoria. En este proceso, la activación de NF-kappaB es la vía más importante de transmisión de señales20. Este factor desempeña un importante papel en la transcripción de una diversidad de genes, sobre todo los relacionados con la inflamación. Además, su activación también se asocia con la proliferación y migración de CMLV. De hecho, este factor activado está presente en lesiones ateroscleróticas humanas, incluidas las células musculares lisas vasculares, macrófagos y células endoteliales, mientras que no se detecta en arterias sanas21,22. En un estudio previo se demostró que la inhibición de este factor mediante transferencia de IkappaB (una subunidad inhibidora de NF-kappaB) no sólo bloqueó la proliferación de CMLV sino también la migración y adhesión de aquellas en cultivo23. El tratamiento con señuelo oligodesoxinucleótido que compitió con la región reguladora génica de NF-kappaB suprimió significativamente la hiperplasia intimal, seguido de la inhibición de la proliferación de CMLV en injertos venosos en un modelo de conejo24.
La diabetes desempeña un importante papel en el desarrollo y modulación de la hiperplasia intimal en injertos venosos25. La de tipo 2 se ha asociado con aumentos sustanciales del depósito de matriz extracelular, además de un aumento del depósito de CMLV en un modelo de ratón26. Se desconoce el mecanismo por el que el tipo de diabetes influye en las respuestas vasculares. Suponemos que el sistema AGE-RAGE podría desempeñar un importante papel en este procedimiento.
Desarrollamos un modelo de rata diabética mediante inyección intraperitoneal de STZ. En el modelo, la glucemia permaneció estable, mientras que la tasa de mortalidad fue ligeramente mayor que la documentada previamente27. En nuestros estudios previos, se recogieron injertos venosos a las 6 y 24h, y a los 3, 7, 14, 28 y 56 días después de la cirugía en el mismo modelo animal. Los resultados demostraron que la progresión de las lesiones de hiperplasia intimal aumentó con el tiempo. Al mismo tiempo, la expresión de RAGE en las lesiones y la concentración sérica de AGE aumentaron con el tiempo. La relación entre el grado de las lesiones y la expresión del receptor fue una regresión lineal (r=0,749). Se documentó que el aumento de la glucemia y la lesión vascular podrían aumentar su expresión28,29, lo que fue similar a este resultado. En otro estudio, se desarrolló un modelo animal de hiperplasia intimal de injerto venoso autólogo en ratas diabéticas y no diabéticas. En las lesiones se examinaron tanto su progresión como la concentración sérica de AGE y la expresión de RAGE, NF-kappaB y molécula 1 de adhesión celular vascular (VCAM-1). Los resultados demostraron que, comparado con ratas no diabéticas, obviamente en animales diabéticos, se identificó un aumento de todos los parámetros (datos no publicados). En el presente estudio, los resultados de la concentración sérica de AGE, expresión de RAGE y de p65 de NF-kappaB, y el cociente del área intimal:medial y las células PCNA positivas son similares a los del estudio previo.
Creemos que el sistema AGE-RAGE desempeñó un papel clave en la hiperplasia intimal de los injertos venosos en ratas diabéticas. Cuando se implantaron los injertos, fue inevitable una lesión de isquemia-reperfusión. Por esta razón, la expresión de RAGE en los injertos estuvo regulada al alza. Mediante su fijación a los AGE aumentados en suero, el receptor activaría la vía del postreceptor. La activación de NF-kappaB sería uno de los mecanismos más importantes que contribuiría a la propagación de la perturbación del injerto venoso a través de diversas vías, como la disfunción endotelial, y la proliferación de las CMLV. En el presente estudio el resultado fue un claro aumento de las lesiones hiperplásicas intimales.
La aminoguanidina es un tipo de hidracina con una función nucleofílica que puede bloquear la producción de la glicosilación. Parece actuar a través de la unión covalente con la cetoamina estable (productos de Amadori) y sus derivados, como la 3-deoxiglucosona, inhibiendo de este modo la formación de AGE30. Aunque la AG es un inhibidor selectivo de la óxido nítrico sintasa inducible (NOSi), no está claro el papel de la enzima en la lesión de hiperplasia intimal. Se ha descrito que, después de una lesión vascular, la expresión de iNOS puede estimular la formación de neoíntima31; no obstante, un mayor número de estudios demostraron in vivo o in vitro que la transferencia genética de NOS reducía la progresión de las lesiones32,33. El papel de la aminoguanidina como inhibidor de los AGE es definitivo. En el presente estudio, su administración a ratas diabéticas indujo una disminución significativa de la concentración sérica de AGE, lo que significa que disminuyeron los ligandos de RAGE, al igual que sus efectores retrógrados. Aunque la expresión de RAGE fue similar, la de p65 de NF-kappaB y el cociente del área intimal:medial y las células PCNA-positivas disminuyeron significativamente. Por lo tanto, consideramos que el mecanismo a través del que actúa la AG es la inhibición del sistema AGE-RAGE.
En la comparación de los resultados al cabo de 1 y 4 semanas, el aumento de la expresión de p65 NF-kappaB no alcanzó significación estadística, a diferencia del de la expresión de RAGE. La razón podría atribuirse a la activación de IkappaB después de la de NA-kappaB.
A medida que un mayor número de pacientes diabéticos requieren tratamiento quirúrgico con implante de injertos venosos autólogos, en la práctica clínica, su permeabilidad a largo plazo es cada vez más problemática. La inhibición del sistema AGE-RAGE podría ser un importante tratamiento para la prevención de la hiperplasia intimal.



![Concentración sérica de productos finales de glicosilación avanzada (advanced glycation end products [AGE]) en ratas de los tres grupos (media±DE). Comparado con ratas que bebieron aminoguanidina (AG) y animales de control, la concentración sérica de AGE en ratas diabéticas que bebieron agua destilada aumentó significativamente a 1 y 4 semanas (p<0,05). No hubo diferencias significativas entre ratas diabéticas que bebieron AG y animales de control (p>0,05). 1: ratas que bebieron AG; 2: ratas diabéticas que bebieron agua destilada; 3: animales de control. 1 week: una semana; 4 weeks: 4 semanas; Levels of serum AGE of rats: concetración sérica de AGE en ratas; Levels of serum AGE (U/mgpr): concentración sérica de AGE (U/mg). Concentración sérica de productos finales de glicosilación avanzada (advanced glycation end products [AGE]) en ratas de los tres grupos (media±DE). Comparado con ratas que bebieron aminoguanidina (AG) y animales de control, la concentración sérica de AGE en ratas diabéticas que bebieron agua destilada aumentó significativamente a 1 y 4 semanas (p<0,05). No hubo diferencias significativas entre ratas diabéticas que bebieron AG y animales de control (p>0,05). 1: ratas que bebieron AG; 2: ratas diabéticas que bebieron agua destilada; 3: animales de control. 1 week: una semana; 4 weeks: 4 semanas; Levels of serum AGE of rats: concetración sérica de AGE en ratas; Levels of serum AGE (U/mgpr): concentración sérica de AGE (U/mg).](https://static.elsevier.es/multimedia/11302542/0000002300000002/v1_201304291534/S1130254209000957/v1_201304291534/es/main.assets/thumbnail/gr1.jpeg?xkr=ue/ImdikoIMrsJoerZ+w96p5LBcBpyJTqfwgorxm+Ow=)