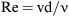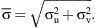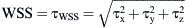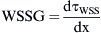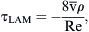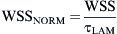La derivación femoropoplítea es un procedimiento reconstructivo vascular frecuente. Al cabo de un año, una proporción significativa de los injertos de derivación dejan de ser funcionales debido a la oclusión por progresión de la hiperplasia intimal (HI).
MétodosLa parte clínica del estudio ha consistido en el análisis de 43 pacientes tratados con una derivación femoropoplítea supragenicular ocluida al año del procedimiento, tratados satisfactoriamente mediante trombólisis. Se evaluaron angiográficamente los cambios morfológicos de la íntima en la anastomosis y el ángulo de la anastomosis terminolateral distal. En la segunda parte del estudio, se realizó un modelo experimental (mediante velocimetría por imagen de partículas) del flujo sanguíneo en la anastomosis terminolateral distal y numéricamente (mediante dinámica de fluidos computacional). Los resultados se correlacionaron con las localizaciones de HI identificadas previamente.
ResultadosDemostramos que la localización de los focos de HI se correlacionan con los de alteración del flujo sanguíneo, de aumento de la tensión de cizallamiento de la pared, y con los puntos de estancamiento, según lo documentado por los hallazgos de la visualización experimental y los angiográficos. También confirmamos que las anastomosis con ángulos más agudos son menos propensas a HI y a la oclusión de la luz.
ConclusiónSugerimos que una mejor comprensión de la hemodinámica y de su influencia en la HI debería dar lugar a un diseño optimizado de los injertos, mediante la adopción de un ángulo más agudo en las anastomosis.
La hiperplasia intimal (HI) constituye un reto clínico extraordinario al afectar a casi todos los procedimientos reconstructivos vasculares conocidos. Se documentó por primera vez en 1950, en un modelo canino de lesión arterial, descrita como el “engrosamiento fibroso de la íntima” de las muestras evaluadas con el microscopio, obtenidas 5-10 semanas después de una intervención quirúrgica de la arteria femoral1. El tipo de reconstrucción vascular más frecuente es la exclusión mediante una derivación de un segmento circulatorio patológco. Sin embargo, >25% de los bypass fracasan en el primer año de la cirugía y >50% en los 10 primeros años. La estenosis en el lugar de la anastomosis debida a HI es la principal causa de fracaso al cabo de un año del procedimiento de reconstrucción2,3.
Numerosos factores, entre lo que destacan principalmente los hemodinámicos, contribuyen al desarrollo de HI. Sin embargo, todavía se desconoce qué tipo de flujo sanguíneo muestra el efecto más lesivo, en relación con la proliferación de la íntima. La HI se asocia con numerosos parámetros de flujo, por ejemplo, con un flujo turbulento, tensiones de cizallamiento de la pared (TCP) altas, bajas o incluso oscilantes, y con un gradiente de TCP temporal o espacial alto o bajo4,5. Contrariamente, algunos autores han sugerido que el flujo sanguíneo en una arteria lesionada puede tener incluso un efecto protector, actuando puramente como factor mecánico que suprime la respuesta endotelial arrastrando a los factores trombogénicos y a las citocinas6.
El objetivo del presente estudio fue evaluar los parámetros geométricos óptimos de la anastomosis terminolateral infrainguinal de un injerto de derivación que minimizarían la influencia negativa de la hemodinámica en la pared vascular y, por lo tanto, aumentarían su permeabilidad a largo plazo. Además, tratamos de profundizar en los conocimientos actuales sobre las características del flujo en estas anastomosis.
MétodosEn la parte clínica del estudio, se evaluaron mediante una angiografía de control (AG) 43 bypass protésicos femoropoplíteos proximales infrainguinales ocluidos al cabo de 6 meses de la reconstrucción, un día después de la práctica de una trombólisis satisfactoria. En la anastomosis terminolateral distal se cuantificaron el ángulo de la anastomosis, los cambios morfológicos en la pared vascular sugestivos de HI (estenosis de la luz y pared irregular del vaso) y el porcentaje de flujo residual en la arteria receptora (segmento de salida proximal [SSP]).
De acuerdo con el análisis del ángulo de la anastomosis y la frecuencia de los cambios intimales evaluados en la AG, se detectaron dos grupos diferentes de pacientes (grupo A, ángulo ≤30°, n = 9; grupo B, ángulo >30°, n = 34). Se evaluaron los cambios sugestivos de HI en el extremo distal, en el talón y en el suelo de la anastomosis; y se compararon ambos grupos.
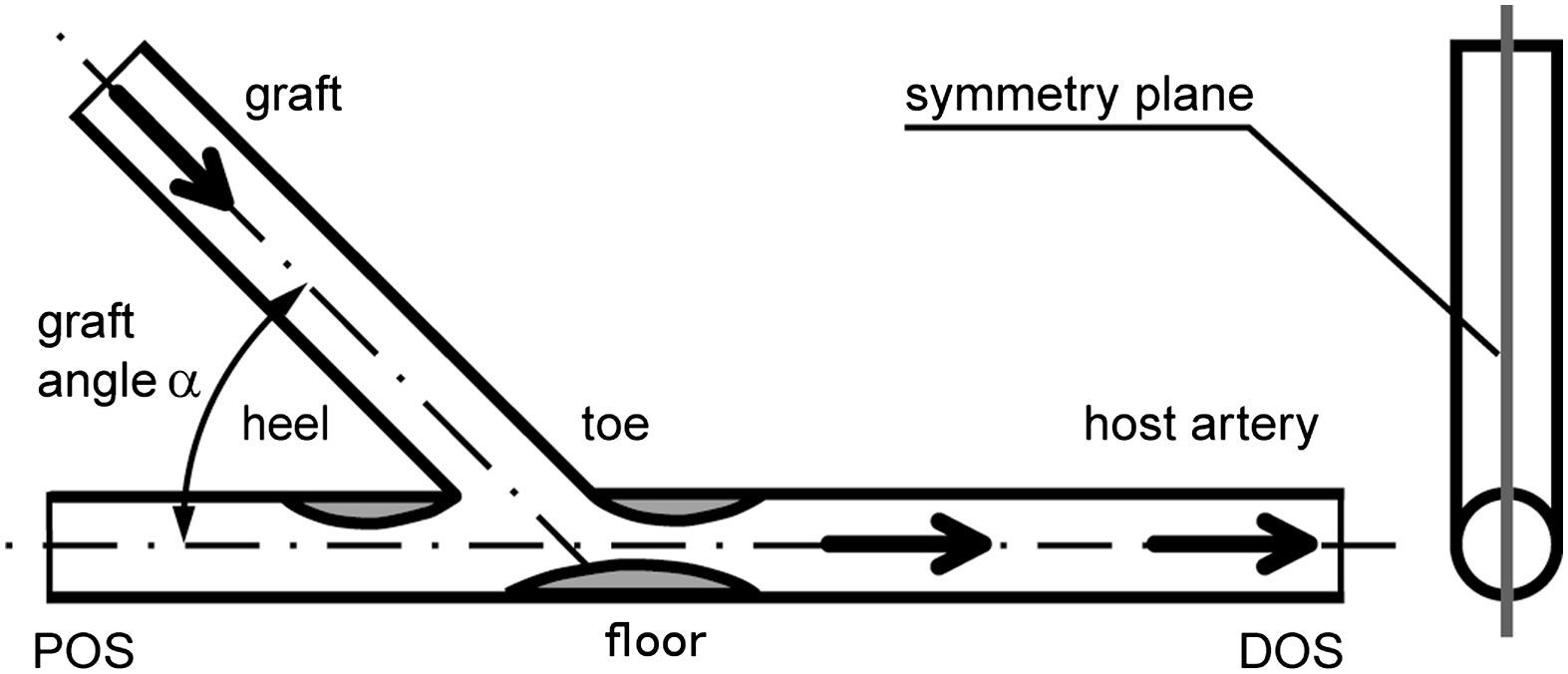
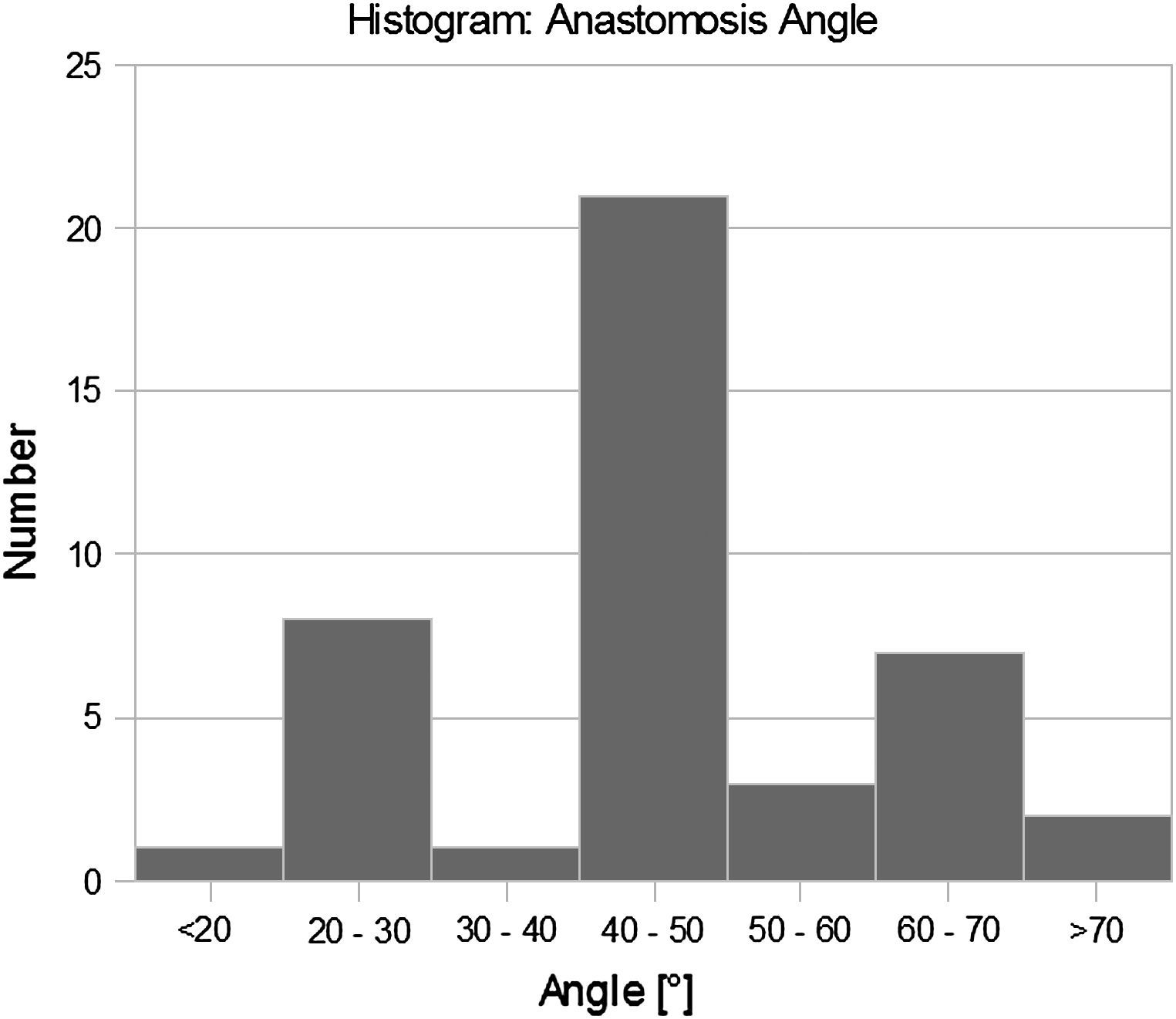
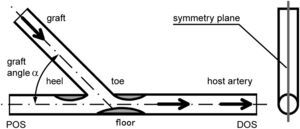
Más tarde, se crearon y examinaron modelos experimentales (visualización del flujo y velocimetría por imagen de partículas [VIP]) y numéricos (dinámica de fluidos computacional [DFC]) de la anastomosis terminolateral distal de injertos femoropoplíteos con obliteración completa del flujo residual de la arteria receptora. En cada modelo el ángulo de las anastomosis fue de 25°, 45° y 60° (Fig. 1). Estos valores se eligieron con respecto a la distribución de los ángulos identificados en las AG (Fig. 2).
Dibujo esquemático de la anastomosis y regiones de particular interés reconocidas en la angiografía.). DOS: segmento distal a la salida; floor: suelo; graft: injerto; graft angle α: ángulo alfa del injerto; heel: talón; host artery: arteria huésped; POS: segmento proximal a la salida; symmetry plane: plano de simetría; toe: extremo.
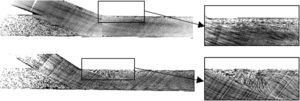
Campo de la velocidad del flujo en los modelos de anastomosis de 25° (parte superior) y 60° (parte inferior) obtenidos mediante velocimetría de imágenes de partículas. Detalle de la anastomosis cerca del extremo (derecha). Angle [°]: ángulo [°]; Histogram: Anastomosis Angle: histograma: ángulo de anastomosis; Number: número.
El principio fundamental de la VIP es una evaluación del campo de velocidad a partir del cambio de las partículas añadidas previamente al líquido de trabajo (una solución de un 64% de NaI en agua destilada, ρ = 1,730 kg/m3; η = 0,00254 Ns/m2; t = 24 °C). El líquido tiene el mismo índice de refracción que el plexiglás. El sistema VIP fue suministrado por Dantec Dynamics (Skovlunde, Dinamarca) e incluyó un par de cámaras (Dantec HiSense de tecnología CCD –charge-coupled device– de 1.024 x 1.280 píxeles con una frecuencia de muestreo de 4,5 Hz para el modo double-frame y de 9 Hz para el modo single-frame), dos láseres pulsados (Nd:YAG New Wave Gemini 15 Hz/120 mJ con sistema óptico), y un procesador de VIP (Dantec Flow-Map 1500 y un buffer de 2 x 1 gigabytes). El movimiento se visualizó mediante partículas fluorescentes (10 μm de diámetro) que emitían luz con la exposición a un láser de neodimio [ND]-YAG7 (λ = 532 nm).
Para la simulación numérica, se empleó la DFC para realizar un modelo de flujo pulsátil en el seno de la anastomosis8. Con respecto a las características del flujo estudiadas, la simulación se centró en el máximo de la onda del pulso. En el máximo, el campo del flujo es casi idéntico a un estado estacionario con los correspondientes valores de flujo instantáneos.
Se modeló un caso de anastomosis con un diámetro interno de 6 mm9 tanto del injerto como de la arteria huésped, de viscosidad sanguínea cinemática, ν = 3,5 • 10−6 • m2 • s−1, y densidad de la sangre, ρ = 1.056 kg • m−3.
En el injerto de derivación femoropoplítea, el intervalo del número de Reynolds,
donde v es la velocidad media de volumen en un instante del período, d es el diámetro de la arteria huésped, y v es la viscosidad cinemática de la sangre, fue de Remin = –300 (el signo negativo indica flujo en dirección inversa) y Remax = 1.000 en condiciones de reposo.De acuerdo con la teoría de la similitud, se crearon modelos transparentes con un diámetro interno de 20 mm tanto del injerto como de la arteria huésped. Los modelos tenían paredes rígidas. Como fluido de trabajo, se usó una solución acuosa de NaI con partículas de marcado añadidas (diámetro de 10 μm). La visualización y las determinaciones VIP se efectuaron en un plano de simetría del modelo. Para la simulación numérica (DFC), se generó una cuadrícula hexaédrica computacional tridimensional. La longitud del modelo distal de la anastomosis fue de 25 veces el diámetro del modelo. Para la simulación, se eligió un modelo matemático laminar. En la bibliografía pueden encontrarse descripciones detalladas del experimento y los métodos numéricos2,7,8,10.
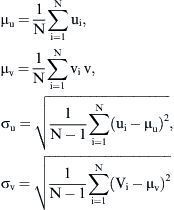
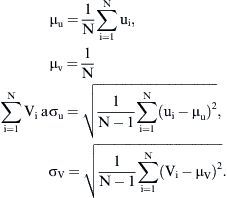
Tanto el experimento como la DFC se ejecutaron en cuatro modos de flujo estacionario (Re = 300, 500, 800 y 1.000) y se generó flujo laminar en la entrada de la anastomosis. El patrón de flujo se visualizó y evaluó (vórtices, puntos de estancamiento, etc.). En la VIP, se estimaron los componentes del eje x e y del vector de velocidad media y sus desviaciones estándar respectivas:
La amplitud de la fluctuación de velocidad en un punto se puede expresar como:Se calcularon a partir de la simulación numérica, el campo del flujo tridimensional, la amplitud de la TCP,y su gradiente espacial (TCPG) en la dirección del flujo principal (eje x).Para comparar la distribución de TCP entre los diversos modelos, ésta se normalizó por la tensión de cizallamiento (τLAM), que se derivó de un perfil laminar con un número de Reynolds idéntico.
Donde v¯ es la velocidad media del volumen y ρ es la densidad del fluido. El valor de TCP normalizado (TCPNORM) se calculó comoResultadosEn la primera parte del estudio, se evaluó la angiografía en los 43 pacientes. El ángulo de anastomosis fue inferior a 30° en nueve pacientes. Se identificó una obliteración completa de la arteria huésped en 37. Los cambios de la morfología intimal se localizaron en 34 pacientes en el extremo distal de la anastomosis, en 42 en el talón y en 40 en el suelo.
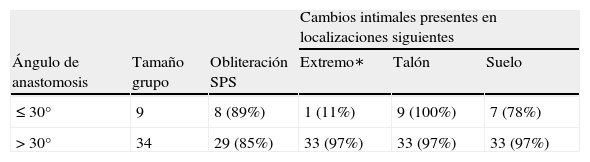
De acuerdo con el ángulo de la anastomosis (que varió entre 20° y 60°) y la frecuencia de los cambios intimales en la AG, se distinguieron dos grupos de pacientes (grupo A, ángulo ≤30°, n = 9; grupo B, ángulo >30°, n = 34). Se encontraron cambios localizados en el extremo distal de la anastomosis indicativos de proliferación neointimal en el 11% del grupo A y en hasta el 97% del grupo B (tabla I), hallazgo que representó la única observación significativa (prueba exacta de Fisher, p = 0,036).
Datos tabulares agrupados de acuerdo con el ángulo de la anastomosis distal visualizados en la angiografía
| Cambios intimales presentes en localizaciones siguientes | |||||
| Ángulo de anastomosis | Tamaño grupo | Obliteración SPS | Extremo∗ | Talón | Suelo |
| ≤ 30° | 9 | 8 (89%) | 1 (11%) | 9 (100%) | 7 (78%) |
| > 30° | 34 | 29 (85%) | 33 (97%) | 33 (97%) | 33 (97%) |
SPS: segmento orificio salida proximal.
El valor porcentual es en relación al tamaño del grupo respectivo (∗p < 0,05).
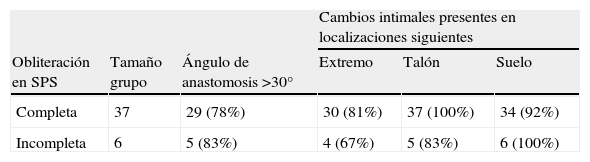
En la parte experimental del estudio, optamos por un modelo de obliteración completa de la arteria huésped (compatible con el hallazgo del 86% de las anastomosis obliteradas por completo en la AG). Además, no se puso de manifiesto ninguna relación entre la presencia de cambios morfológicos detectados en la AG y la obliteración (parcial comparado con completa) de la arteria receptora (χ2, p > 0,05) (tabla II).
Datos tabulares agrupados de acuerdo con el grado de obliteración del injerto (completa o incompleta) visualizado en la angiografía
| Cambios intimales presentes en localizaciones siguientes | |||||
| Obliteración en SPS | Tamaño grupo | Ángulo de anastomosis >30° | Extremo | Talón | Suelo |
| Completa | 37 | 29 (78%) | 30 (81%) | 37 (100%) | 34 (92%) |
| Incompleta | 6 | 5 (83%) | 4 (67%) | 5 (83%) | 6 (100%) |
SPS: segmento orificio salida proximal.
El valor porcentual es en relación al tamaño del grupo respectivo.
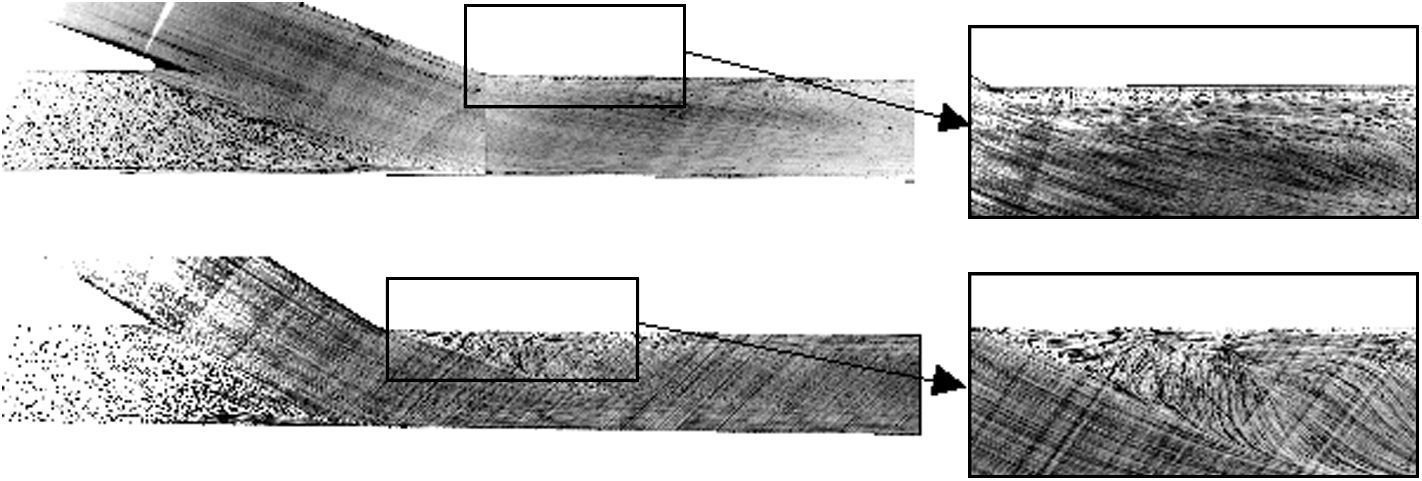
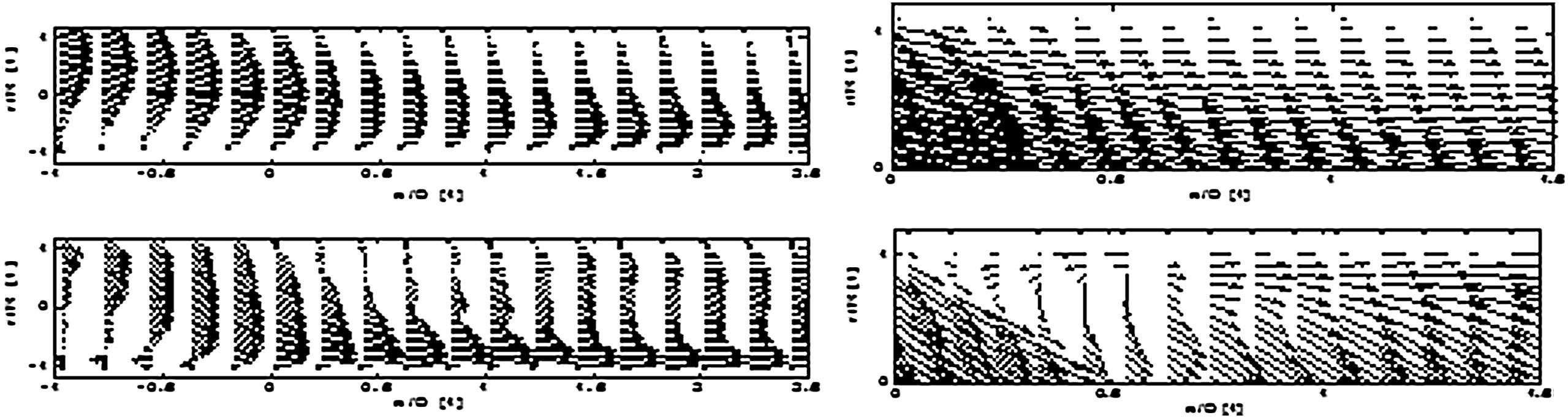
La visualización del campo de flujo delimitó claramente tres zonas de estancamiento del fluido (extremo distal, talón y suelo) en los modelos de 45° y 60° (Fig. 3, abajo), un hallazgo que se corresponde con precisión con los estudios AG. Por otro lado, en el modelo de 25° (Fig. 3, arriba) sólo se identificaron dos puntos de estancamiento (talón y suelo), hallazgo muy similar a los obtenidos en la AG.
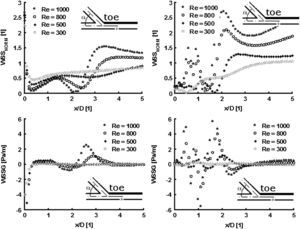
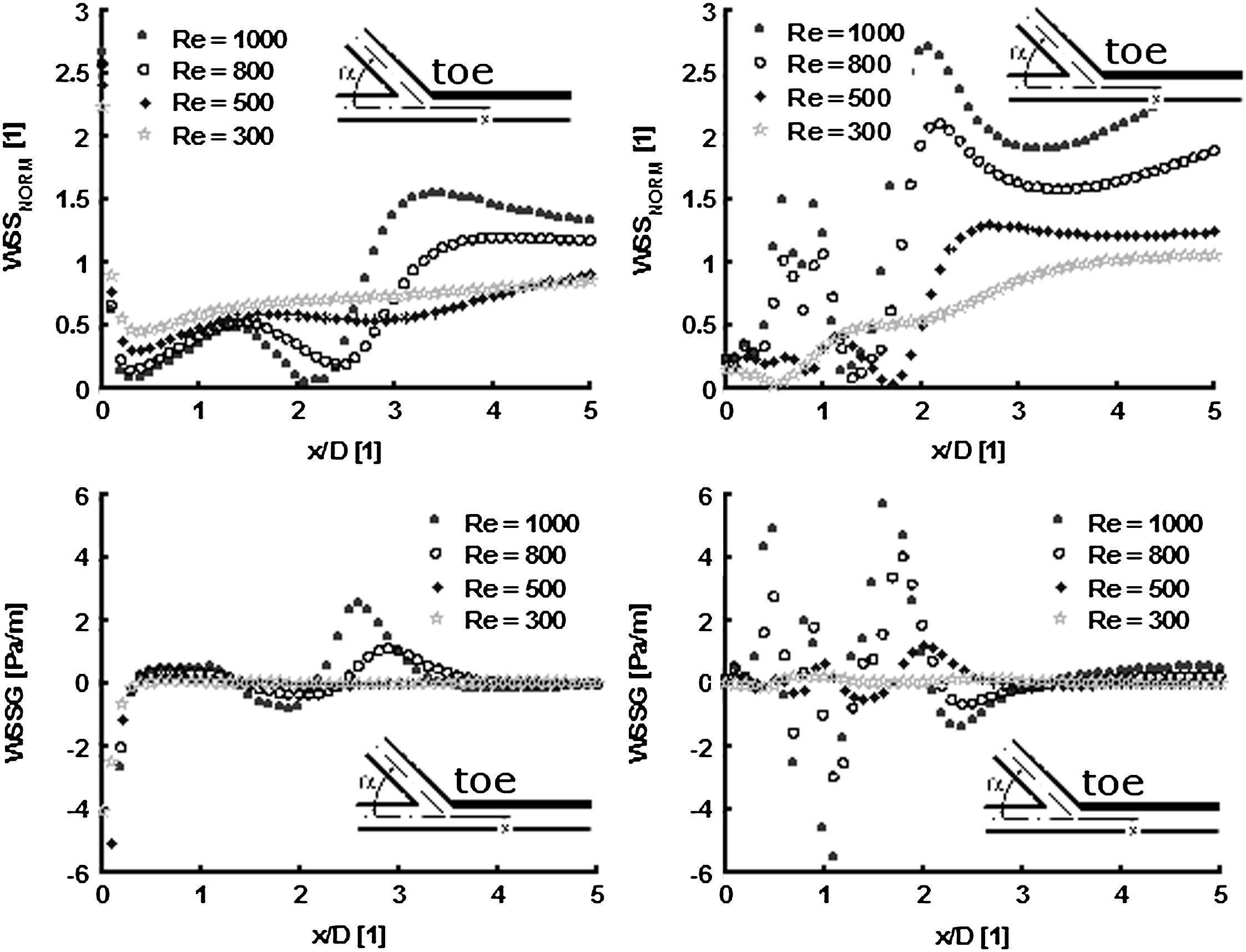
La evaluación del campo de velocidad mediante VIP reveló un aumento de la TCP en la proximidad de los puntos de estancamiento en los modelos de 45 y 60°, en comparación con el modelo de 25° donde no se observaron cambios. Además, los ángulos de anastomosis menos agudos depararon mayores valores de fluctuación de la velocidad del flujo en el extremo distal, donde se observó la mayor tasa de cambios en la AG (Fig. 4). En las anastomosis con ángulos menos agudos, sólo se observó un ligero aumento de la fluctuación de la velocidad cerca del suelo, y en el talón se observaron valores bajos, con independencia del ángulo de anastomosis.
Cuando se comparó la distribución de la TCP obtenida a partir de la simulación numérica de los modelos de anastomosis de 25° y 45° con la tasa de flujo del fluido de una densidad del volumen establecida de forma arbitraria (Re = 300, 500, 800 y 1.000), se hizo evidente que la TCP fue reducida en el caso de los ángulos más agudos, en particular para valores más altos de Re. De forma parecida, el TCPG disminuyó marcadamente para el modelo de ángulo de 25° comparado con el de 45°, en particular en un área que se extendía distalmente desde el extremo distal de la anastomosis hasta x = 2D (donde D es el diámetro del modelo) (Fig. 5).
DiscusiónLa HI se ha identificado como una causa frecuente de fracaso tardío de numerosos procedimientos de revascularización (cirugía de derivación, angioplastia con balón, aterectomía, etc.). Esto constituye un problema grave de una gran magnitud. Nuestros conocimientos actuales sobre el desarrollo de la HI siguen siendo incompletos y no se dispone de una guía unificada en relación a cómo prevenir su formación y retrasar su progresión en la práctica clínica.
El crecimiento acelerado de las células musculares lisas y de la matriz circundante es la causa principal de fracaso a largo plazo de las anastomosis terminolaterales de los injertos vasculares11. En los estudios previos, tanto los hallazgos clínicos como los experimentales han demostrado que los factores hemodinámicos, en particular el patrón de flujo y la tensión de cizallamiento de la pared, desempeñan un papel esencial en el desarrollo y localización de la HI12-16. Sin embargo, el proceso en sí es mucho más complicado. La magnitud y dirección de la tensión de cizallamiento de la pared modulan la disposición citoesquelética y la expresión de numerosos factores de crecimiento. Por ejemplo, la óxido nítrico sintasa, el factor beta de transformación del crecimiento, el factor 2 de crecimiento fibroblástico, la endotelina 1, el factor B de crecimiento derivado de las plaquetas, la enzima conversora de la angiotensina y el factor de crecimiento endotelial vascular manifiestan un cambio de expresión no uniforme de acuerdo con una TCP en los límites de los valores habituales17,18 (1-6 dyn/cm2 en el sistema venoso y 10-70 dyn/cm2 en el sistema arterial). En general, una TCP <5 dyn/cm2 estimula un perfil aterogénico/vasoconstrictor, mientras que valores de más de 15 dyn/cm2 inducen un reposo endotelial; la respuesta endotelial mantiene una magnitud de TCP arterial media en alrededor de 15-20 dyn/cm2. Valores elevados de la TCP (≥ 70 dyn/cm2) producen un efecto adverso sobre la función endotelial causando una lesión mecánica18. En diversos estudios in vitro se ha investigado la influencia de la hemodinámica en la progresión de la disfunción de la anastomosis. Se ha examinado la importancia de diversas características, como el ángulo de la anastomosis9,19-22, la simetría y forma de la anastomosis23-25, la forma del pulso y el perfil de velocidad de entrada26. Algunos autores correlacionan la función de la anastomosis con diferentes características del flujo, como la presión y la magnitud de la TCP27, la intensidad de la turbulencia o la desproporción entre el diámetro y la distensibilidad del injerto y de la arteria huésped28-30. Una TCP globalmente disminuida se asocia con una mayor incidencia de hiperplasia intimal. Esto fue demostrado claramente por Binns et al31, que midieron el engrosamiento neointimal en anastomosis terminolaterales de un injerto de politetrafluoroetileno (PTFE) (diámetro de 4,6 y 8 mm) en un modelo canino. Documentaron que los injertos que excedían el diámetro de la anastomosis indujeron menores TCP, dando lugar a un mayor grado de HI, mientras que los injertos de un diámetro menor que el de la anastomosis dieron lugar a una TCP anormalmente alta con trombosis precoz y fracaso del injerto debido a lesión endotelial mecánica con un aumento de la mojabilidad superficial. En otro estudio, Kohler et al32 demostraron que el aumento del flujo sanguíneo y de la TCP daba lugar a una disminución significativa del engrosamiento neointimal en injertos de PTFE en babuinos. De forma parecida, Imparato et al33 y Fry34 encontraron que el flujo de alta velocidad y el aumento del estrés de cizallamiento pueden dar lugar a una lesión endotelial y, por lo tanto, mantener una proliferación fibrocolágena subendotelial reactiva. El análisis de la tensión de cizallamiento en una anastomosis dio lugar a que Faulkner et al35 y Giordana et al36 consideraran que la HI en la anastomosis distal era una secuela de la dinámica anormal del flujo.
La cuestión del ángulo óptimo de la anastomosis terminolateral se ha estudiado mediante simulaciones numéricas24,25 (p. ej., DFC) y en modelos mecánicos7,22,37 (p. ej., VIP), al igual que en estudios in vivo38,39. Las observaciones fueron unánimes: los ángulos más agudos implican una disminución del vórtice y de las zonas de separación y una disminución de la hiperplasia intimal. En la práctica quirúrgica diaria, rara vez se construye una anastomosis terminolateral con un ángulo <20°, la longitud de una anastomosis aumenta en una proporción seno(alfa)−1 con respecto al diámetro del injerto, donde alfa es el ángulo de la anastomosis. Con un ángulo de 20°, la longitud de la anastomosis ya es del triple que el diámetro del injerto. Además, sería difícil construir anastomosis más largas (más agudas) e implantarlas en sus localizaciones anatómicas.
En el presente estudio, la evaluación con AG de 43 injertos de derivación femoropoplíteos poco después de la trombólisis reveló una tendencia predominante de las localizaciones de los cambios intimales en el extremo distal, el talón y el suelo de las anastomosis. La diferencia significativa en la frecuencia de los cambios en el extremo distal de la anastomosis es indicativa de la propensión de aquellas con ángulos menos agudos a desarrollar hiperplasia intimal. Es un resultado predecible. Sin embargo, esta parte concreta del estudio aporta la excepcional prueba clínica del efecto del ángulo de la anastomosis sobre el desarrollo de HI en la anastomosis terminolateral distal de un injerto de derivación femoropoplíteo supragenicular en seres humanos.
En la parte experimental del estudio, se usaron modelos de anastomosis de 25, 45 y 60° para visualizar los patrones de flujo mediante VIP (modelo experimental) y DFC (modelo numérico). En ambos modelos, se encontró que las tres localizaciones (extremo distal, talón y suelo) de la anastomosis, identificadas previamente en la AG, eran similares a las localizaciones que demostraron parámetros hemodinámicos patológicos asociados con la HI, la presencia de un punto de estancamiento y de un TCPG.
Ambos modelos visualizados según lo mostrado en las Figs 3 a 6 proporcionan una clara perspectiva del tipo de flujo. De inmediato, queda claro que las anastomosis más agudas muestran un flujo laminar en prácticamente toda la estructura, mientras que los ángulos menos agudos condicionan un flujo cada vez más turbulento, en especial en las localizaciones mencionadas, previamente identificadas en la AG, que con los mecanismos ya descritos dan lugar en último término a la HI.
Distribución de la tensión de cizallamiento de la pared (TCP) y el gradiente de tensión de cizallamiento de la pared (TCPG) en los modelos de anastomosis de 25° (izquierda) y 45° (derecha) obtenidos a partir de la dinámica de fluidos computacional para diversas tasas de flujo (Re = 300, 500, 800 y 1.000). Todos los gráficos representan los valores de TCP y TCPG determinados a lo largo de la mitad de una línea que empieza en el extremo de la anastomosis del modelo, según lo indicado en el esquema. Los valores no dimensionales del eje x (x/D) representan la distancia del extremo de la anastomosis (x) relativa al diámetro del tubo (D).
La influencia de la tensión de cizallamiento de la pared en la pared del vaso depende hasta un grado considerable del factor tiempo y del área afectada por la TCP y el TCPG. Con mayor importancia, la TCP se relaciona con el ángulo de la anastomosis, el cual puede optimizarse. En función de los resultados de este estudio y de los datos de estudios publicados adicionales, consideramos firmemente que la introducción del ángulo recomendado de menos de 45° (de preferencia, ≤30°) de la anastomosis terminolateral femoropoplítea distal en la práctica diaria prolongará su tiempo de vida40.
Experimentalmente, la TCP se puede evaluar de forma indirecta valorando el perfil de la velocidad del flujo directamente utilizando una sonda especial (anemometría de temperatura constante). En nuestro experimento, seleccionamos la VIP, un método no invasivo indirecto, porque no modifica el flujo por la inserción de la sonda, como producen los métodos directos. El modelo DFC omite deliberadamente el hecho de que la sangre es un flujo no newtoniano con propiedades reológicas y mecánicas complicadas cuya simulación es sumamente compleja y difícil. Además, tratamos de modelar un flujo no estacionario según un flujo estacionario, y tuvimos que elegir diversos valores del número de Reynolds aun cuando el flujo pulsátil no puede representarse por este número solo. Usamos valores de TCP normalizados para comparar los modelos entre sí, lo que constituía el objetivo. Debido a la simplificación del modelo, induciría a error recalcular a la inversa los valores para el ejemplo. El modelo tiene una geometría simplificada que pasa por alto la flexibilidad de la pared de un vaso y otros factores, como la desproporción entre el diámetro y la distensibilidad del injerto y de la arteria receptora.
ConclusiónLa primera parte de este estudio incluyó un análisis de los hallazgos de la AG de 43 injertos de derivación femoropoplíteos suprageniculares ocluidos al cabo de 6 meses de la intervención primaria, tratados con una trombólisis satisfactoria. Se identificaron dos grupos con incidencias marcadamente diferentes en los cambios patológicos en la pared del vaso a nivel del extremo distal de la anastomosis terminolateral distal del injerto. En el grupo con ángulos más agudos (≤30°, n = 9) los cambios en el extremo distal se detectaron en el 11% de las anastomosis comparado con el 97% (p = 0,036) del grupo con ángulos menos agudos (>30°, n = 34).
En la segunda parte del estudio, se crearon dos modelos (físico [VIP] y numérico [DFC]) de una anastomosis terminolateral distal de 25°, 45° y 60°. La evaluación de ambos modelos, de acuerdo con los patrones de flujo, puntos de estancamiento, TCP, TCPG y fluctuación de la velocidad cerca de la pared del vaso, reveló una menor incidencia de cambios patológicos en las anastomosis con ángulos más agudos. Estos hallazgos se corresponden con precisión a los cambios observados en la AG.
El presente estudio respalda la recomendación de la conveniencia de ángulos de menos de 45° (de preferencia, ≤30° para la anastomosis terminolateral) y aporta pruebas adicionales haciendo énfasis en las características del flujo, en una anastomosis obtenida a partir de un modelo experimental y computacional, pruebas que se correlacionan, además, con los datos clínicos en seres humanos.
Esta investigación se financió con la beca GA CR 101/05/0675 (“Theoretical and Experimental Optimization of Vascular Reconstructions with Regard to Hemodynamics'”).




![Campo de la velocidad del flujo en los modelos de anastomosis de 25° (parte superior) y 60° (parte inferior) obtenidos mediante velocimetría de imágenes de partículas. Detalle de la anastomosis cerca del extremo (derecha). Angle [°]: ángulo [°]; Histogram: Anastomosis Angle: histograma: ángulo de anastomosis; Number: número. Campo de la velocidad del flujo en los modelos de anastomosis de 25° (parte superior) y 60° (parte inferior) obtenidos mediante velocimetría de imágenes de partículas. Detalle de la anastomosis cerca del extremo (derecha). Angle [°]: ángulo [°]; Histogram: Anastomosis Angle: histograma: ángulo de anastomosis; Number: número.](https://static.elsevier.es/multimedia/11302542/0000002300000005/v2_201308271555/S1130254209002361/v2_201308271555/es/main.assets/thumbnail/gr2.jpeg?xkr=ue/ImdikoIMrsJoerZ+w96p5LBcBpyJTqfwgorxm+Ow=)