Evaluamos las complicaciones cardiológicas (CC) ocurridas después de la práctica de una revascularización arterial primaria (RAP) por isquemia crítica (IC) de los miembros inferiores, para determinar la influencia en los resultados clínicos de las complicaciones. Creamos un protocolo de tratamiento optimizado con respecto a la evaluación preoperatoria de pacientes IC así como al seguimiento intra y postoperatorio según las guías clínicas y los estudios importantes recientes publicados en la literatura médica.
MétodosRealizamos un análisis prospectivo de los resultados clínicos de la RAP a partir de los factores de riesgo, las comorbilidades, el tipo de tratamiento quirúrgico y la presentación de complicaciones. Esta cohorte se dividió en pacientes con y sin complicaciones. Los pacientes con complicaciones se clasificaron de acuerdo con estándares predefinidos: menores, quirúrgicas, fracaso de la revascularización y sistémicas. Las consecuencias de éstas fueron la reintervención, la necesidad de medicación adicional, la aparición de una lesión física irreversible y una mortalidad prematura.
ResultadosSe realizó la RAP de 106 pacientes (estadio III de Fontaine [n=49; 46%] y estadio IV [n=57; 56%]) mediante un procedimiento de derivación (n=67; 63%) o una angioplastia con balón (n=39; 37%). No se registraron diferencias entre ambos grupos en las comorbilidades. En 34 pacientes (32%) se registraron 84 complicaciones. Los pacientes que las manifestaron presentaban una tasa significativamente menor de tratamiento con fármacos antiagregantes plaquetarios (sin complicaciones [n=63; 88%] frente a complicaciones (n=18; 53%); p=0,000) y/o bloqueadores beta (sin complicaciones [n=66; 92%] frente a con complicaciones [n=16; 47%]; p=0,000), comparados con los pacientes sin complicaciones. Las dos consecuencias más lesivas de la aparición de episodios adversos fueron la formación de una lesión física irreversible (n=3) y el fallecimiento precoz (n=8). El 60% (n=9) de las complicaciones sistémicas fueron cardíacas. La tasa de mortalidad después del procedimiento fue del 7,5%, con un 75% (n=6) de los casos de origen cardíaco.
ConclusiónLas complicaciones afectan a>30% de los pacientes con IC después de RAP. Las más lesivas en los resultados clínicos de los pacientes con ICMI fueron las complicaciones cardíacas, dando lugar a una mayor morbilidad y mortalidad. Se observaron correlaciones significativas entre la prescripción de bloqueadores beta y antiagregantes plaquetarios y la prevención de complicaciones. Sigue siendo de extrema importancia prestar una atención sistemática a la prevención de las complicaciones sistémicas para mejorar los resultados de la RAP para el salvamento de la extremidad. Por esta razón, aconsejamos la implementación de un protocolo de tratamiento optimizado mediante una discusión estricta de los pacientes de acuerdo con un protocolo predeterminado para optimizar y estandarizar la valoración preoperatoria, así como al igual que la vigilancia intra y postoperatoria del paciente.
La enfermedad arterial periférica obstructiva (EAPO) de la extremidad inferior (APO) es un síndrome frecuente con una alta prevalencia en la mayoría de las poblaciones adultas del mundo occidental1-7, que se da en alrededor del 5% de la población de 55-74 años de edad8,9. Sus manifestaciones clínicas son una importante causa de enfermedades agudas y crónicas. Además, se asocia con una disminución de la capacidad funcional y de la calidad de vida, y de un aumento del riesgo de mortalidad.
Los pacientes tratados mediante revascularización arterial primaria (RAP) por isquemia crítica (IC) de los miembros inferiores representan un reto dinámico para el anestesista y el cirujano vascular que se extiende más allá de las dificultades de la intervención programada. Con frecuencia, estos pacientes experimentan una arteriopatía que afecta a varios lechos vasculares, al igual que otras comorbilidades significativas, como son la diabetes, las neumopatías y las nefropatías. Además, los pacientes con IC corren un riesgo incluso mayor de presentar episodios cardiovasculares isquémicos10-13. Al ser tratados mediante la RAP, corren mayor riesgo de presentar complicaciones cardíacas (CC) peri y postoperatorias con compromiso vital, como infartos de miocardio14-16. Un 50% de los pacientes intervenidos por ICMI fallecen al cabo de 5 años11,17,18, principalmente debido a episodios cardiovasculares19-21.
La optimización hemodinámica pre, intra y postoperatoria, el control cardíaco y la detección oportuna de complicaciones postoperatorios durante el tratamiento definitivo, endovascular o quirúrgico, de estos pacientes en alto riesgo pueden ser uno de los principales objetivos para mejorar los resultados postoperatorios de los pacientes tratados mediante RAP.
La evaluación prospectiva de las complicaciones es útil y necesaria para obtener una perspectiva apropiada de su incidencia después del tratamiento de la IC en cirugía vascular; puede usarse como indicador de la calidad quirúrgica y asistencial22-29. Es importante comprender las causas y las consecuencias de las complicaciones en pacientes tratados mediante RAP por IC. Por lo tanto, los objetivos del presente estudio fueron 1) valorar la incidencia de complicaciones después de la RAP por IC y 2) examinar su influencia en los resultados clínicos relacionados con parámetros de salud generales de los pacientes con IC.
Materiales y métodosPacientesSe realizó una encuesta de 2 años de duración en 106 pacientes consecutivos sin antecedentes de RAP o de amputaciones. Fueron ingresados por primera vez con IC y tratados mediante RAP primaria. El criterio de inclusión de la población del estudio fue la presentación de IC: dolor isquémico en reposo (estadio III de Fontaine) con una presión en reposo del tobillo<50 mmHg y la presentación de gangrena o de una úlcera isquémica tórpida (estadio IV de Fontaine) con una presión en reposo del tobillo<70 mmHg. Esto se corresponde con las categorías 4, 5 y 6 de los estándares de la Society of Vacular Surgery/North American Chapter of the International Society for Cardiovascular Surgery30,31 (SVS/ISCVS) y el documento de consenso TransAtlantic Inter-Society Consensus (TASC) Document on Management of Peripheral Arterial Disease1,2. Las lesiones femoropoplíteas incluidas se correspondieron a las de tipo B, C o D según la morfología de la placa, de la clasificación TASC1,2. La cohorte se dividió en pacientes con y sin complicaciones durante el ingreso.
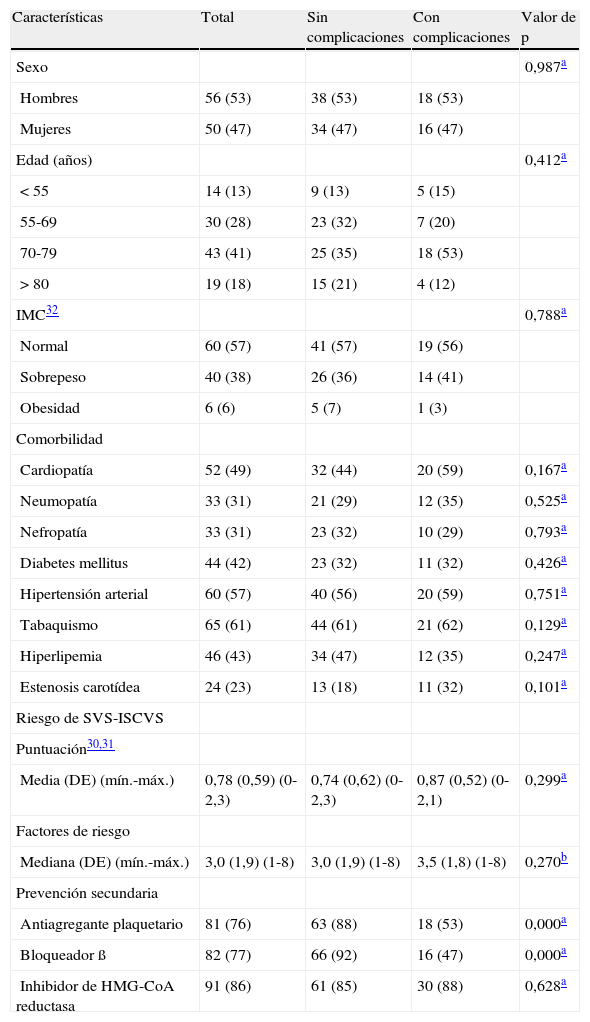
Factores de riesgo y comorbilidadesLos factores de riesgo y las comorbilidades se registraron de forma prospectiva para todos los pacientes durante la anamnesis del ingreso. El tabaquismo, la hipertensión arterial, las cardiopatías, la hiperlipemia, la diabetes mellitus, la nefropatía, la neumopatía, la estenosis carotídea y la edad se clasificaron de acuerdo con los estándares de documentación referidos por la SVS/ICSVS y en el documento de consenso TASC. Los factores de riesgo y las comorbilidades fueron registradas en el preoperatorio de acuerdo con los estándares de documentación TASC y de la American Heart Association/American College of Cardiology (AHA/ACC) por un especialista vascular o por un cardiólogo, en la clínica ambulatoria o durante el ingreso antes de la intervención cuando ésta estuvo indicada con carácter urgente. Así mismo, se determinó el índice de masa corporal32 (IMC) de los pacientes, y se clasificó como normal (18,5-24,9kg/m2), sobrepeso (25,0-29,9kg/m2) y obesidad (> 30kg/m2). En la tabla I se enumeran los datos sobre los factores de riesgo y comorbilidades.
Características iniciales de la muestra total (n=106) estratificada por pacientes con y sin complicaciones
| Características | Total | Sin complicaciones | Con complicaciones | Valor de p |
| Sexo | 0,987a | |||
| Hombres | 56 (53) | 38 (53) | 18 (53) | |
| Mujeres | 50 (47) | 34 (47) | 16 (47) | |
| Edad (años) | 0,412a | |||
| < 55 | 14 (13) | 9 (13) | 5 (15) | |
| 55-69 | 30 (28) | 23 (32) | 7 (20) | |
| 70-79 | 43 (41) | 25 (35) | 18 (53) | |
| > 80 | 19 (18) | 15 (21) | 4 (12) | |
| IMC32 | 0,788a | |||
| Normal | 60 (57) | 41 (57) | 19 (56) | |
| Sobrepeso | 40 (38) | 26 (36) | 14 (41) | |
| Obesidad | 6 (6) | 5 (7) | 1 (3) | |
| Comorbilidad | ||||
| Cardiopatía | 52 (49) | 32 (44) | 20 (59) | 0,167a |
| Neumopatía | 33 (31) | 21 (29) | 12 (35) | 0,525a |
| Nefropatía | 33 (31) | 23 (32) | 10 (29) | 0,793a |
| Diabetes mellitus | 44 (42) | 23 (32) | 11 (32) | 0,426a |
| Hipertensión arterial | 60 (57) | 40 (56) | 20 (59) | 0,751a |
| Tabaquismo | 65 (61) | 44 (61) | 21 (62) | 0,129a |
| Hiperlipemia | 46 (43) | 34 (47) | 12 (35) | 0,247a |
| Estenosis carotídea | 24 (23) | 13 (18) | 11 (32) | 0,101a |
| Riesgo de SVS-ISCVS | ||||
| Puntuación30,31 | ||||
| Media (DE) (mín.-máx.) | 0,78 (0,59) (0-2,3) | 0,74 (0,62) (0-2,3) | 0,87 (0,52) (0-2,1) | 0,299a |
| Factores de riesgo | ||||
| Mediana (DE) (mín.-máx.) | 3,0 (1,9) (1-8) | 3,0 (1,9) (1-8) | 3,5 (1,8) (1-8) | 0,270b |
| Prevención secundaria | ||||
| Antiagregante plaquetario | 81 (76) | 63 (88) | 18 (53) | 0,000a |
| Bloqueador ß | 82 (77) | 66 (92) | 16 (47) | 0,000a |
| Inhibidor de HMG-CoA reductasa | 91 (86) | 61 (85) | 30 (88) | 0,628a |
DE: desviación estándar; IMC: índice de masa corporal.
Los datos se presentan como número y porcentajes a menos que se especifique lo contrario.
Se recogió el tratamiento inicial referido por los pacientes de acuerdo con los estándares de documentación del documento de consenso TASC y de la AHA/ACC; los fármacos prescritos como prevención secundaria fueron recogidos en el momento del ingreso para un análisis posterior, y se clasificaron de acuerdo con las siguientes categorías: fármacos antiagregantes plaquetarios, bloqueadores beta e inhibidores de la HMG-CoA reductasa.
RevascularizaciónEl tratamiento vascular (RAP) consistió en angioplastias transluminales percutáneas (ATP) y en procedimientos de derivación. Las ATP se realizaron mediante la dilatación convencional con balón de la lesión, con o sin la implantación de un stent, bajo anestesia regional. Después del procedimiento, se prescribió a los pacientes una dosis diaria de ácido acetilsalicílico/aspirina. El procedimiento de derivación se practicó de acuerdo con las técnicas vasculares estándares, con preferencia por el empleo de vena invertida en las derivaciones femoropoplíteas (supra e infrageniculares) y las derivaciones crurales, bajo anestesia general. Después del procedimiento se prescribió una dosis diaria de un cumarínico. La permeabilidad de los injertos se determinó en todos los pacientes mediante el examen con eco-Doppler y la determinación del índice tobillo-brazo 4 semanas después del procedimiento. Los estándares de documentación de la SVS/ISCVS y del documento de consenso TASC determinaron la definición de permeabilidad primaria y secundaria, la decisión de intervenir y el tipo de intervención. El tratamiento no vascular consistió en el drenaje/desbridamiento, la amputación menor (definida como amputación de un dedo o del pie) y la amputación mayor (definida como amputación supra o infragenicular). Un cirujano vascular realizó o supervisó todas las intervenciones.
ComplicacionesEn Holanda, la Asociación Holandesa de Cirujanos (AHC) ha consensuado la definición de complicación33-37. Esta definición difiere de la utilizada en otros estudios porque se ha elegido con el objetivo explícito de excluir el criterio subjetivo sobre causa y efecto, al igual que correcto e incorrecto. La definición de complicación es un “acontecimiento o estado involuntario e indeseado que se produce durante o después del tratamiento médico, que es tan lesivo para la salud del paciente que se requiere (el ajuste del) tratamiento o que da lugar a una lesión permanente. La complicación puede identificarse durante la hospitalización, hasta 30 días después del alta o el traslado a otro servicio. El resultado deseado del tratamiento, la probabilidad de que se produzca un acontecimiento adverso, y la presencia o ausencia de un error médico como causa son inapropiados en la identificación de un acontecimiento adverso”37. Esta definición no cambió durante el período de estudio.
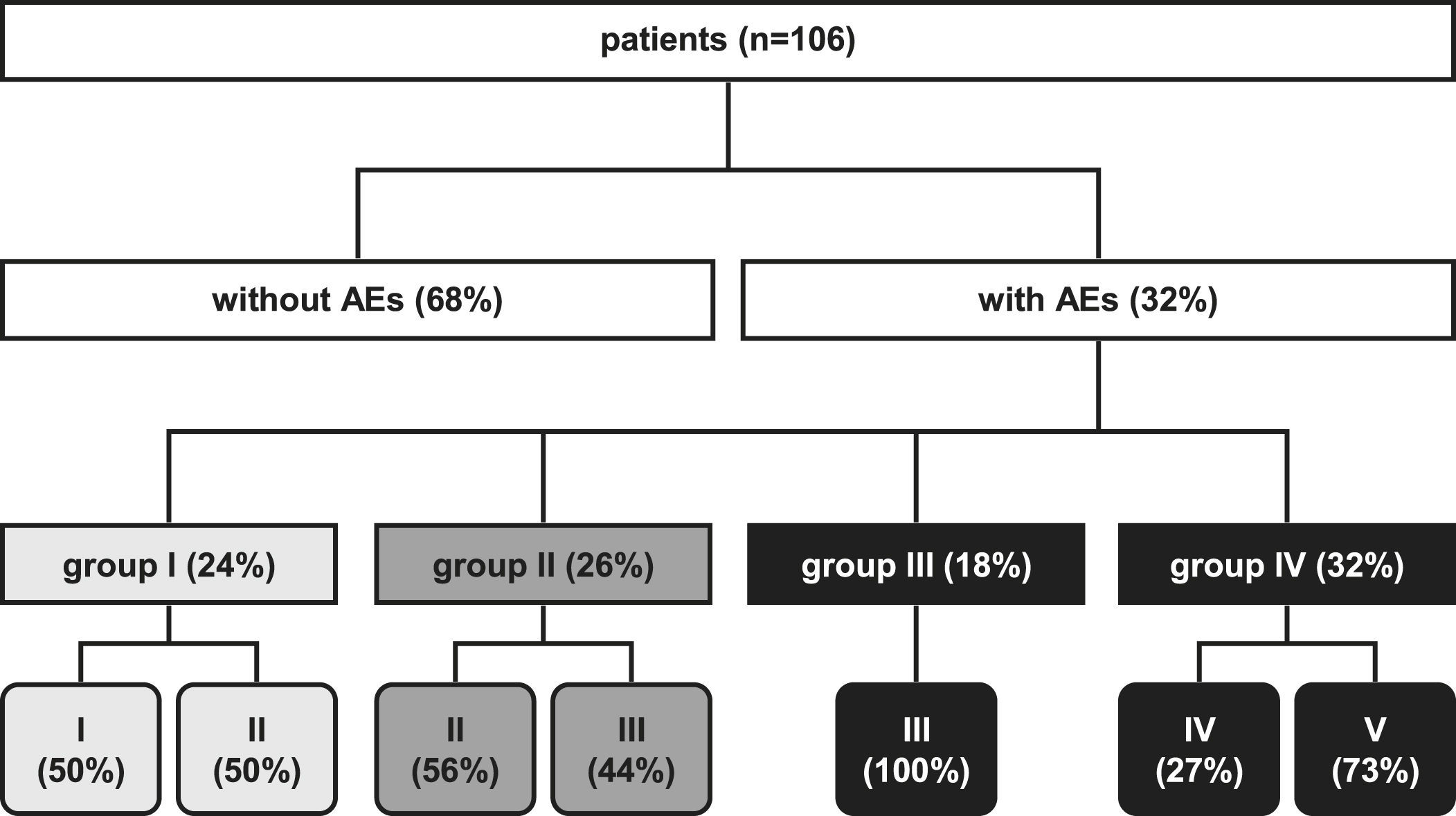
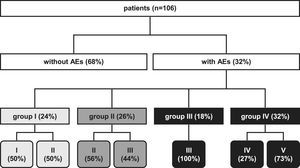
En 1993, en el servicio de cirugía del St. Elisabeth Hospital en Tilburg, Holanda, se implementó un sistema de registro completamente automatizado (aplicación autodesarrollada en Microsoft Access con el resultado de la base de datos Oracle). En 1995, se alcanzó una cobertura total de la aplicación y fue también posible el registro de las complicaciones en la unidad de cuidados intensivos, en el quirófano, en el servicio de urgencias y en la clínica ambulatoria. Desde 1995, el sistema se ha basado en una lista detallada de criterios desarrollados por la AHC (apéndices I y II). Las complicaciones son registradas por el facultativo al establecer su diagnóstico. Las complicaciones registradas se evalúan y se abordan durante la reunión semanal con todos los cirujanos de mayor experiencia, residentes de cirugía e internos. Como se muestra en la figura 1 y en el apéndice I, los pacientes se subdividieron en cuatro grupos, según el tipo de complicaciones: menores, quirúrgicas, fracaso de la revascularización y sistémicas.
Clasificación de los pacientes según la presentación de las complicaciones más importantes ocurridas durante el período postoperatorio y sus consecuencias clínicas. Grupo I: menores; grupo II: quirúrgicas; grupo III: fracaso de la revascularización; grupo IV: sistémicas; I: sin consecuencias; II: transfusión/medicación adicional; III: nueva intervención; IV: lesión física irreversible; V: muerte. patients (n=106): pacientes (n=106); without AEs (68%): sin complicaciones (68%); with AEs (32%): con complicaciones (32%); group I: grupo I (24%); group II: grupo II (26%); group III: grupo III (18%); group IV: grupo IV (32%).
La información de los pacientes se registró de forma prospectiva en un archivo electrónico de pacientes (base de datos Oracle) utilizado para todos los pacientes durante la obtención de los datos del ingreso. La revisión fue retrospectiva, y este material se introdujo en una base de datos de análisis informático diseñada específicamente para pacientes vasculares, desarrollada en Access (Office XP de Microsoft, Redmond, WA). Los análisis estadísticos se realizaron mediante un programa estadístico informático, utilizando Excel (Office XP de Microsoft) y el SPSS 16.0 para Windows (SPSS, Inc, Chicago, Estados Unidos). Después de completar la obtención de datos, se realizaron análisis univariantes con la práctica de las pruebas de la Chi2 y de la t de Student para datos independientes. Los procedimientos secundarios y las complicaciones se analizaron con la prueba de la U de Mann-Whitney. Se realizaron análisis univariantes y multivariantes utilizando las complicaciones (menores, quirúrgicas, sistémicas y el fracaso de la revascularización) como variables dependientes, con un ajuste para sexo, edad, IMC, cardiopatías, neumopatías, nefropatías, diabetes mellitus, hipertensión arterial, tabaquismo, hiperlipemia, estenosis carotídea, puntuación de riesgo de SVS-ISVCS, fármacos antiagregantes plaquetarios, bloqueadores beta e inhibidores de la HMG-CoA reductasa. En todos los análisis estadísticos, se consideró significativo un valor de p<0,05. Para investigar las diferencias en las tasas de permeabilidad primaria, permeabilidad secundaria, salvamento de la extremidad y supervivencia, se realizó un análisis de tablas de vida, construido según lo descrito por los estándares de la SVS-ISCVS.
ResultadosPacientes, factores de riesgo y comorbilidadesUn total de 56 hombres (53%) y 50 mujeres (47%) fueron tratados mediante RAP por IC. Las edades medias fueron de 72 y 70 años, respectivamente (límites 47-93). Las indicaciones de la RAP fueron la presentación de una isquemia en estadio III de la clasificación de Fontaine en 49 pacientes (44%) o en estadio IV de Fontaine en 57 pacientes (56%). La duración media de la hospitalización fue de 9 y 13 días, respectivamente (rango 2-82). Estos pacientes presentaban antecedentes de cardiopatía (n=52, 49%), neumopatía (n=33, 31%), nefropatía (n=33, 31%), diabetes mellitus (n=39, 38%) e hipertensión arterial (n=60, 57%), lo que dio lugar a una puntuación media de riesgo de 0,8. Globalmente, 46 (43%) pacientes tenían sobrepeso o eran obesos. En la tabla I se describe un resumen de los factores de riesgo y de las características de la enfermedad. No se encontraron diferencias significativas en los factores de riesgo entre pacientes con y sin complicaciones.
MedicaciónAnálisis univarianteEn relación con la prevención secundaria, se detectó una diferencia respecto a los fármacos de prescripción: antiagregantes plaquetarios (total n=81, 76%; sin complicaciones n=63, 88% frente a con complicaciones n=18, 53%; p<0,000) y bloqueadores beta (total n=82, 77%; sin complicaciones n=66, 92% frente a con complicaciones n=16, 47%; p<0,000). No se evidenció ninguna diferencia por lo que respecta a los inhibidores de la HMG-CoA reductasa (total n=91, 86%; sin complicaciones n=61, 85% frente a con complicaciones n=30, 88%; p=0,628). En relación con la prevención secundaria, el 75-86% de los pacientes con IC cumplían con los objetivos de las guías de documentación del documento de consenso TASC y de la AHA/ACC.
Análisis multivarianteLa no prescripción de bloqueadores beta y antiagregantes plaquetarios se asoció con una aparición de complicaciones (odds ratio [OR]=0,017; p=0,000 y OR=19,808; p=0,000, respectivamente). Posteriormente, la no prescripción de bloqueadores beta se asoció con la incidencia de la subcategoría de complicaciones sistémicas (OR=0,00; p=0,000).
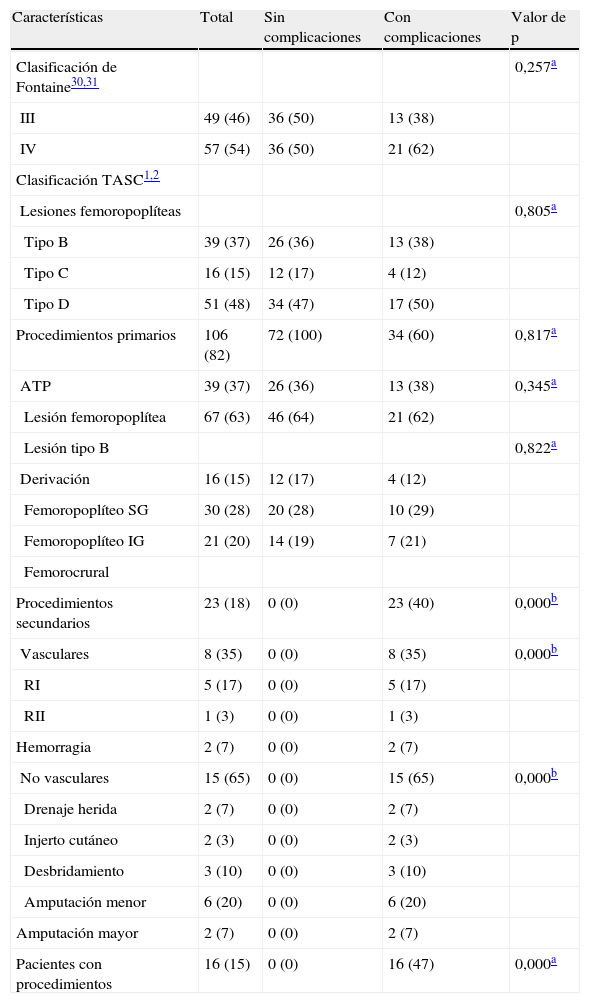
RevascularizaciónProcedimientos primariosPor lo que respecta al tipo TASC de lesión femoropoplítea estratificada en los pacientes con y sin complicaciones, no se identificó ninguna diferencia (TASC B, sin complicaciones n=26, 36% frente a con complicaciones n=13, 38%; TASC C, sin complicaciones n=12, 17% frente a con complicaciones n=4, 12%; TASC D, sin complicaciones n=34, 47% frente a con complicaciones n=17, 50%; p=0,805). Por lo que respecta a las ATP estratificadas por pacientes con o sin complicaciones no se detectaron diferencias (total n=39, 37%; sin complicaciones n=26, 36% frente a con complicaciones n=13, 38%; p=0,345). Hubo un total de 67 procedimientos primarios de derivación (63%): 57 (85%) con vena invertida y 10 (15%) con politetrafluoroetileno (PTFE). En relación al tipo de procedimiento de derivación estratificado por pacientes con o sin complicaciones, no se identificó una diferencia (femoropoplíteo supragenicular: total n=16, 15% y sin complicaciones n=12, 17% frente a con complicaciones n=4, 12%; femoropoplíteo infragenicular: total n=30, 28% y sin complicaciones n=20, 28% frente a con complicaciones n=10, 29%; femorocrural: total n=21, 20% y sin complicaciones n=14, 19%, frente a con complicaciones n=7, 21%; p=0,822).
Procedimientos secundariosLos procedimientos secundarios sólo afectaron a pacientes con complicaciones (total n=23, 40%, p=0,000; vasculares n=8, 35%, p=0,000; no vasculares n=15, 65%, p=0,000). Según lo citado en la tabla II, no se identificó ninguna diferencia en los pacientes estratificados por la incidencia de complicaciones (p=0,917) en la RAP (ATP p=0,345; derivación p=0,822). Las tasas de permeabilidad primaria y secundaria acumulativa total a los 30 días de las tablas de vida de todos los procedimientos de derivación, y la de salvamento de la extremidad fueron del 89%, 97% y 99%, respectivamente.
Resumen de las clasificaciones de Fontaine y TASC y procedimientos primarios y secundarios de todos los pacientes con ICE estratificados por pacientes con y sin complicaciones
| Características | Total | Sin complicaciones | Con complicaciones | Valor de p |
| Clasificación de Fontaine30,31 | 0,257a | |||
| III | 49 (46) | 36 (50) | 13 (38) | |
| IV | 57 (54) | 36 (50) | 21 (62) | |
| Clasificación TASC1,2 | ||||
| Lesiones femoropoplíteas | 0,805a | |||
| Tipo B | 39 (37) | 26 (36) | 13 (38) | |
| Tipo C | 16 (15) | 12 (17) | 4 (12) | |
| Tipo D | 51 (48) | 34 (47) | 17 (50) | |
| Procedimientos primarios | 106 (82) | 72 (100) | 34 (60) | 0,817a |
| ATP | 39 (37) | 26 (36) | 13 (38) | 0,345a |
| Lesión femoropoplítea | 67 (63) | 46 (64) | 21 (62) | |
| Lesión tipo B | 0,822a | |||
| Derivación | 16 (15) | 12 (17) | 4 (12) | |
| Femoropoplíteo SG | 30 (28) | 20 (28) | 10 (29) | |
| Femoropoplíteo IG | 21 (20) | 14 (19) | 7 (21) | |
| Femorocrural | ||||
| Procedimientos secundarios | 23 (18) | 0 (0) | 23 (40) | 0,000b |
| Vasculares | 8 (35) | 0 (0) | 8 (35) | 0,000b |
| RI | 5 (17) | 0 (0) | 5 (17) | |
| RII | 1 (3) | 0 (0) | 1 (3) | |
| Hemorragia | 2 (7) | 0 (0) | 2 (7) | |
| No vasculares | 15 (65) | 0 (0) | 15 (65) | 0,000b |
| Drenaje herida | 2 (7) | 0 (0) | 2 (7) | |
| Injerto cutáneo | 2 (3) | 0 (0) | 2 (3) | |
| Desbridamiento | 3 (10) | 0 (0) | 3 (10) | |
| Amputación menor | 6 (20) | 0 (0) | 6 (20) | |
| Amputación mayor | 2 (7) | 0 (0) | 2 (7) | |
| Pacientes con procedimientos | 16 (15) | 0 (0) | 16 (47) | 0,000a |
ATP: angioplastias transluminales percutáneas; IG: infragenicular; RI: revascularización del injerto; RII: retirada del injerto infectado; SG: supragenicular; TASC: TransAtlantic Inter-Society Consensus.
Los datos se presentan como número y porcentajes a menos que se especifique lo contrario.
Trenta y cuatro pacientes (hombres n=18, 53% y mujeres=16, 47%) presentaron complicaciones. El 65% de los pacientes tenían≥70 años de edad. La indicación de RAP fue una isquemia en estadio III de Fontaine en 13 (38%) y en estadio IV en 21 (62%).
Como se cita en las tablas III y IV, se registró un total de 48 complicaciones (durante el ingreso n=43, 90% y después del alta en la clínica ambulatoria n=5, 10%): el 50% se clasificaron como menores/quirúrgicas y el 50%, como fracaso de la revascularización/sistémicas, que dieron lugar a los procedimientos secundarios citados en la tabla IV. En la figura 1 las complicaciones se relacionan con sus resultados a corto plazo. En la mitad de los pacientes con complicaciones menores no se observó repercusión clínica y en la otra mitad se indicaron transfusiones/tratamiento farmacológico adicionales. Las complicaciones quirúrgicas dieron lugar prácticamente por igual a la indicación de transfusión/tratamiento farmacológico adicional (56%) o a la de una nueva intervención (44%) debido a hemorragia postoperatoria (n=2) o drenaje de la herida (n=2). Los pacientes con un fracaso de la revascularización fueron tratados nuevamente para restablecer la permeabilidad en el 100% de los casos. Los cinco fracasos del procedimiento de derivación se trataron mediante tres embolectomías y dos ATP de las derivaciones para obtener una permeabilidad primaria asistida en el período postoperatorio. En dos pacientes la nueva intervención no fue satisfactoria y fue necesaria la amputación de la extremidad afectada (una infragenicular y otra supragenicular).
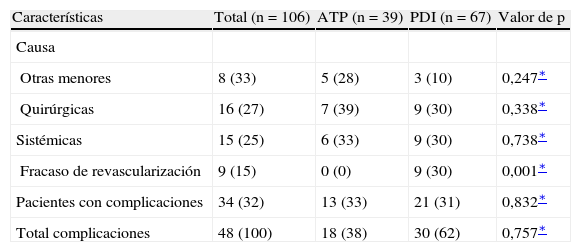
Resumen de las complicaciones de todos los pacientes con IC primaria: estratificados por revascularización primaria (ATP frente a derivación)
| Características | Total (n=106) | ATP (n=39) | PDI (n=67) | Valor de p |
| Causa | ||||
| Otras menores | 8 (33) | 5 (28) | 3 (10) | 0,247∗ |
| Quirúrgicas | 16 (27) | 7 (39) | 9 (30) | 0,338∗ |
| Sistémicas | 15 (25) | 6 (33) | 9 (30) | 0,738∗ |
| Fracaso de revascularización | 9 (15) | 0 (0) | 9 (30) | 0,001∗ |
| Pacientes con complicaciones | 34 (32) | 13 (33) | 21 (31) | 0,832∗ |
| Total complicaciones | 48 (100) | 18 (38) | 30 (62) | 0,757∗ |
ATP: angioplastia transluminal percutánea; IC: isquemia crítica de la extremidad; PDI: procedimiento de derivación mediante injerto.
Los datos se presentan como número y porcentajes a menos que se especifique lo contrario.
Complicaciones (n=48) después de la revascularización primaria por isquemia crítica de la extremidad en la muestra total (n=106)
| Características | |
| Menores | |
| Flebitis | 1 (2) |
| Infección del tracto urinario | 6 (13) |
| Trombosis venosa profunda | 1 (2) |
| Total | 8 (17) |
| Quirúrgicas | |
| Dehiscencia de la herida | 1 (2) |
| Infección de la herida | 7 (15) |
| Hemorragia | 7 (15) |
| Otros | 1 (2) |
| Total | 16 (33) |
| Fracaso de la revascularización | |
| Infección del injerto de bypass | 1 (2) |
| Fracaso del injerto de bypass | 8 (17) |
| Total | 9 (19) |
| Sistémicas | |
| Neumonía | 2 (4) |
| Insuficiencia respiratoria | 1 (2) |
| Arritmias | 1 (2) |
| Paro cardíaco | 2 (4) |
| Shock cardiogénico | 3 (2) |
| Insuficiencia cardíaca congestiva | 1 (2) |
| Infarto de miocardio | 2 (4) |
| Ictus | 3 (4) |
| Total | 15 (31) |
| Número total de CC | 48 (100) |
CC: complicaciones cardiológicas.
Los datos se presentan como número y porcentajes a menos que se especifique lo contrario.
Como se cita en la tabla III, los pacientes tratados mediante procedimientos de revascularización mínimamente invasivos (ATP), al igual que procedimientos quirúrgicos convencionales (derivaciones), tuvieron las mismas probabilidades de presentar complicaciones (total n=34, 37%; ATP n=13, 33%, frente a bypass n=21, 31%; p=0,832). No se detectaron diferencias en la incidencia de complicaciones totales en los pacientes estratificados por tipos de RAP (ATP n=18, 30% frente a bypass n=30, 62%; p=0,757).
Todas las complicaciones sistémicas dieron lugar a una lesión física irreversible (n=3, 27%) o, en el peor de los casos, a la muerte del paciente (n=8, 73%). Las causas de la muerte fueron arritmias (n=1), paro cardíaco (n=2), infarto de miocardio (n=1), shock cardiogénico (n=2), hemorragia (n=1) y accidente vascular cerebral (n=1) y se tradujeron en una tasa de mortalidad global a los 30 días del 7,5%.
DiscusiónEl objetivo primario del presente estudio fue evaluar la presentación de complicaciones después de la RAP por IC. El objetivo secundario fue evaluar la influencia en los resultados clínicos relacionados con parámetros de salud generales de los pacientes con IC.
Las complicaciones se asociaron con peores resultados de salud de los pacientes y con un aumento de los costes totales estimados medios en el tratamiento de la EAPO38. El registro de las complicaciones es un instrumento útil para tener una perspectiva sobre la incidencia y tipo de complicaciones que puede aparecer tras revascularización por IC. Optimiza nuestra vigilancia respecto a todas las evoluciones indeseadas en la enfermedad de los pacientes y en el tratamiento de las enfermedades secundarias ocurridas en el servicio de cirugía vascular y sus causas (posiblemente prevenibles). Además, nos brinda la oportunidad de valorar la calidad del trabajo realizado y compararlo con los resultados descritos en los estudios publicados. No obstante, es necesaria una uniformidad de los sistemas de registro de complicaciones para comparar los resultados entre los diferentes centros de asistencia sanitaria.
Nuestros resultados muestran que el 32% de los pacientes con IC tratados mediante revascularización primaria presentaron 48 complicaciones durante el período perioperatorio de 30 días. Como se describe en las tablas III y IV, el 31% fueron sistémicas, de las cuales el 47% fueron de causa cardíaca. Las complicaciones cardíacas son la causa principal de morbilidad y mortalidad de pacientes tratados con procedimientos de cirugía vascular39. En numerosos artículos se ha confirmado también que los pacientes tratados con una reconstrucción vascular corren un mayor riesgo de presentar complicaciones cardíacas perioperatorias40-42. Como se muestra en la figura 1, después de la presentación de complicaciones sistémicas se observó una repercusión importante en la mortalidad y morbilidad de los pacientes, las cuales deberían prevenirse durante los períodos pre, peri y postoperatorios. Es importante destacar que en el 75% de los pacientes la causa de mortalidad fue cardiológica, lo que se tradujo en una tasa de mortalidad global a 30 días del 7,5% comparado con una mortalidad de hasta el 3,9-8% en los estudios publicados previamente43-50.
No hubo diferencias significativas en los factores de riesgo, comorbilidades, IMC y estadio de isquemia de la clasificación de Fontaine entre los pacientes con o sin complicaciones. Esto se podría explicar por el hecho de que la IC se acompañó de comorbilidades extensas en casi todos los pacientes.
El análisis detallado de las variables correlacionadas con la incidencia de complicaciones reveló que los pacientes sin complicaciones estaban siendo tratados en mayor proporción con bloqueadores beta. Las guías clínicas de tratamiento perioperatorio recomiendan que los pacientes en riesgo cardíaco elevado deben ser tratados con bloqueadores beta3-5,51-55. Sin embargo, los datos disponibles también sugieren que estos fármacos están infrautilizados en los pacientes tratados mediante técnicas de revascularización periférica56-59, como también pudo ser el caso de los pacientes con IC que presentaron complicaciones cardíacas en el presente estudio. De acuerdo con los estudios publicados51,60-66, se recomienda la administración de bloqueadores beta de una a dos semanas antes de la cirugía y su continuación después de la intervención para obtener un control adecuado de la frecuencia cardíaca, lo que, en último término, da lugar a una disminución de la incidencia de complicaciones cardiovasculares perioperatorias, y a un beneficio en la supervivencia a largo plazo. Además, la supresión de los bloqueadores beta antes de cirugía mayor se asocia con un aumento de la incidencia de morbilidad y mortalidad cardiovascular. Por otra parte, un análisis más detallado reveló que los pacientes tratados con fármacos antiagregantes plaquetarios presentaron un menor número de complicaciones comparado con los no tratados. En pacientes con arteriopatía periférica obstructiva está indicada su administración como prevención cardiovascular secundaria60,67-69. En un paciente al que se ha suprimido el tratamiento antes de experimentar el acontecimiento se observa una peor evolución que en el que continúa con el tratamiento o que en el que nunca ha sido tratado.
En los pacientes con IC estratificados por la incidencia de complicaciones no se observaron diferencias por lo que respecta al procedimiento de revascularización primaria realizado (ATP frente a derivación). Esto indica que no es aceptable la hipótesis aceptada ampliamente de que los procedimientos de revascularización mínimamente cruentos (ATP) se acompañan de un menor número de complicaciones, comparados con las técnicas convencionales. Una posible explicación del porcentaje relativamente alto de complicaciones en el grupo ATP podría ser el significativo estado comórbido de los pacientes con IC con la vulnerabilidad consiguiente a un desequilibrio hemodinámico después de la utilización de agentes de contraste. Otra explicación podría residir en el hecho de que, en el presente estudio, en comparación con la mayoría de los estudios sobre complicaciones, también se incluyeron las complicaciones observadas después del alta en la clínica ambulatoria.
Para reducir el número de complicaciones y, por lo tanto, la morbilidad y mortalidad de los pacientes, sugerimos que el adecuado tratamiento cardiológico preoperatorio, intraoperatorio y postoperatorio sea uno de los principales objetivos durante los procedimientos endovasculares y quirúrgicos de estos pacientes de alto riesgo con IC.
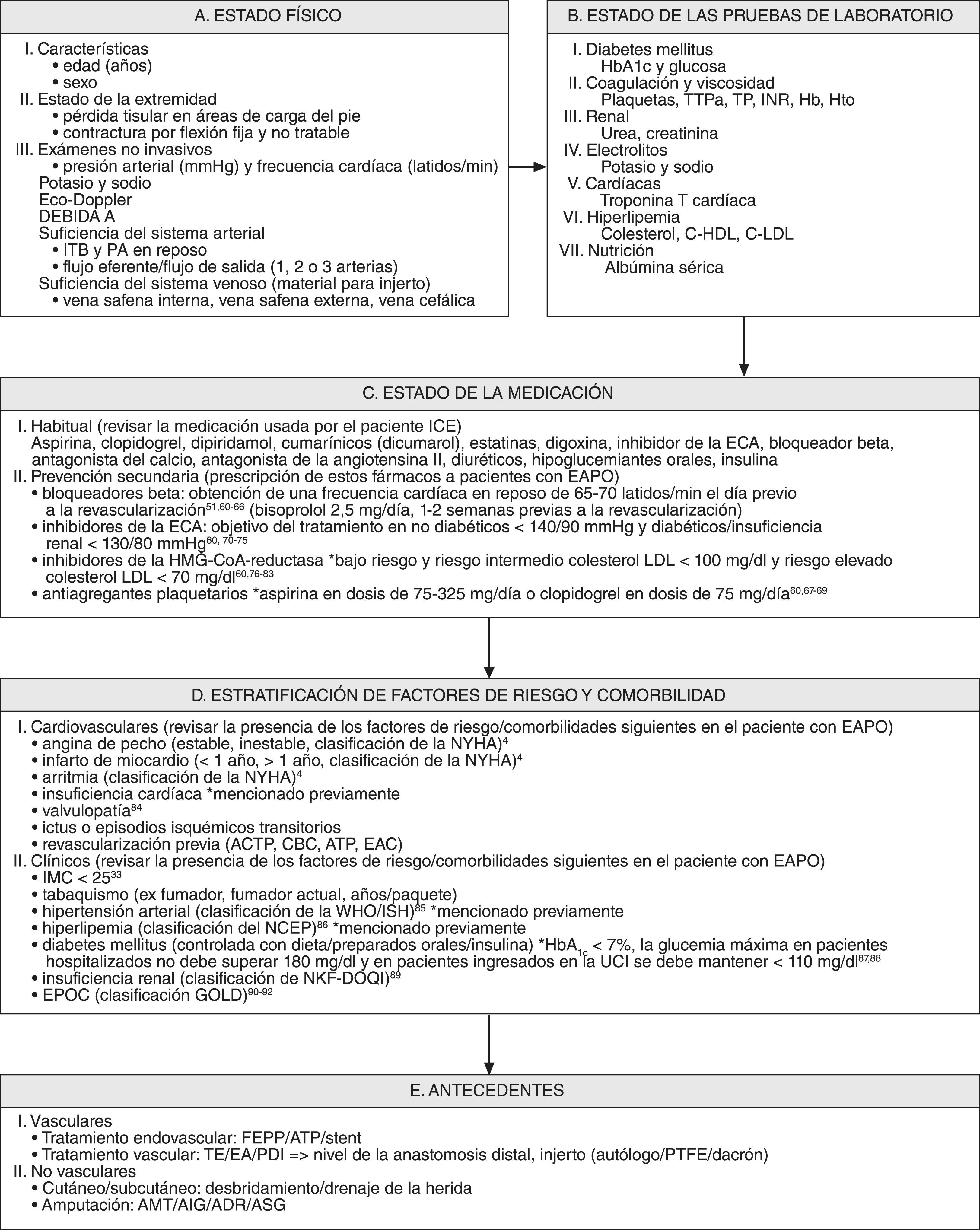
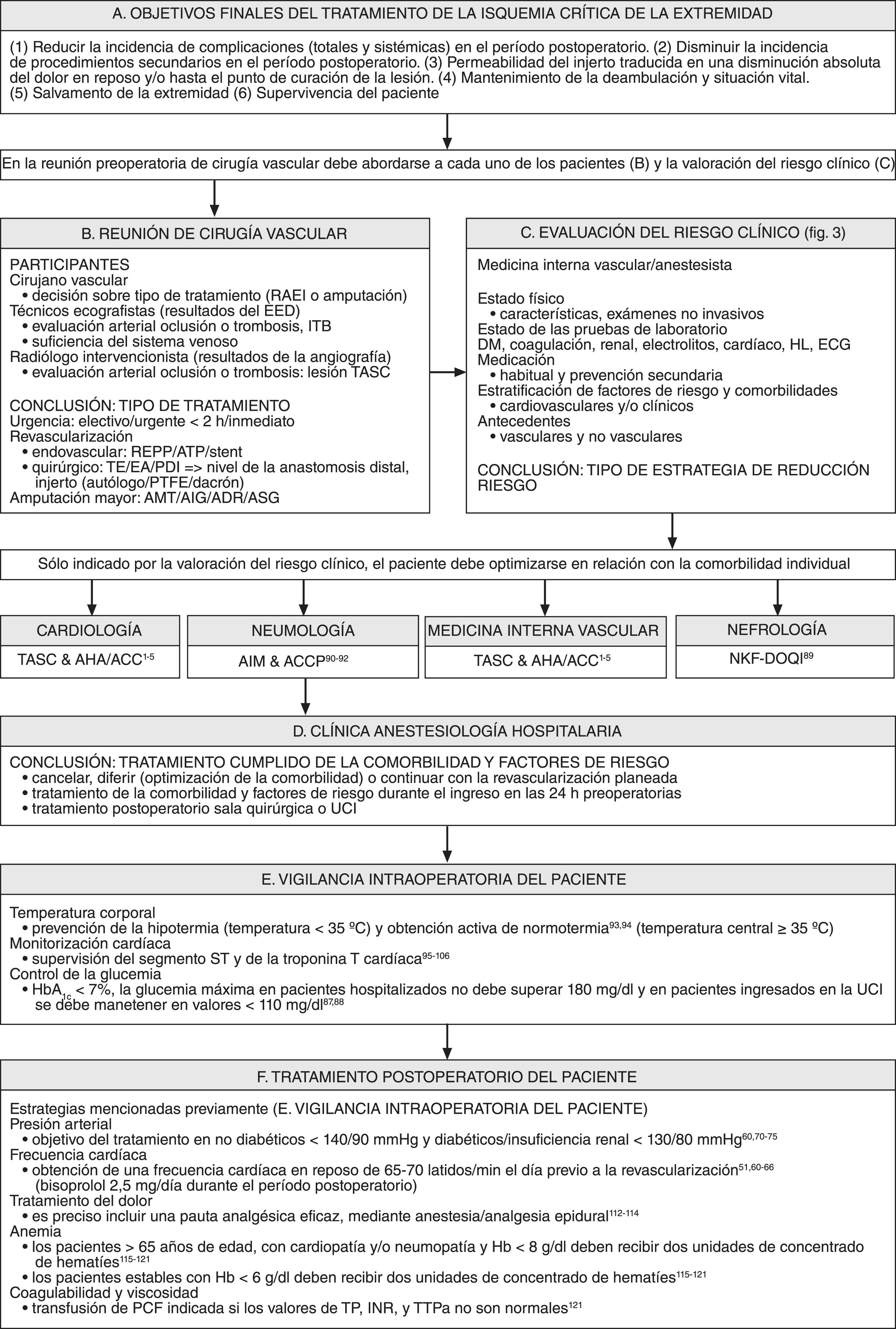
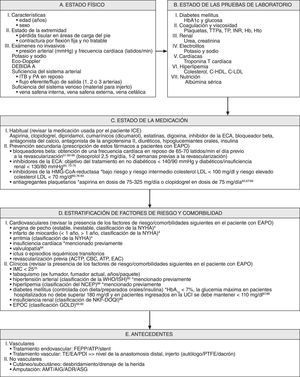
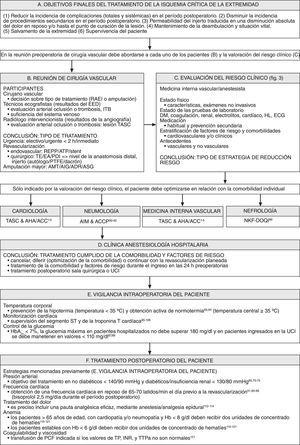
Reunión multidisciplinaria preoperatoriaCuando se considera a un paciente para un procedimiento de revascularización es esencial una evaluación preoperatoria cuidadosa del riesgo clínico (fig. 2). Una amplia evaluación y optimización preoperatoria cardíaca de acuerdo con las guías del documento de consenso TASC y de la ACC/AHA es de una importancia primordial para reducir la incidencia de las complicaciones cardíacas perioperatorias. En segundo lugar, como ya se ha mencionado previamente, las guías clínicas sobre tratamiento perioperatorio recomiendan que los pacientes con cardiopatía de alto riesgo reciban un bloqueador beta3-5,51-55. En tercer lugar, el tratamiento antihipertensivo da lugar a una reducción de episodios cardiovasculares en los pacientes con EAPO60,70-75. En cuarto lugar, el uso de inhibidores de la HMG-CoA reductasa puede reducir el riesgo de infarto de miocardio perioperatorio y de episodios vasculares mayores. La interrupción de este tratamiento se asocia con resultados significativamente peores, comparado con pacientes que continúan el tratamiento o con aquellos que nunca han sido tratados60,76-83. En quinto lugar, en pacientes que presentan EAPO está indicado el uso de fármacos antiagregantes plaquetarios como prevención cardiovascular secundaria.
Reunión multidisciplinaria preoperatoria; evaluación del riesgo clínico y estrategias posteriores para la reducción del riesgo. ACTP: angioplastia coronaria transluminal percutánea; ADR: amputación por desarticulación de la rodilla; AIG: amputación infragenicular; AMT: amputación transmetatarsiana; ASG: amputación supragenicular; ATP: angioplastia transluminal percutánea; C-HDL: colesterol unido a lipoproteínas de alta densidad; C-LDL: colesterol unido a lipoproteínas de baja densidad; EA: endarterectomía; EAC: endarterectomía carotídea; EAPO: enfermedad arterial periférica obstructiva; ECA: enzima conversora de la angiotensina; EPOC: enfermedad pulmonar obstructiva crónica; FEPP: revascularización extraluminal planificada percutánea; GOLD: Global Initiative on Obstructive Lung Diseases; Hb: hemoglobina; Hto: hematocrito; IMC: índice de masa corporal; INR: índice internacional normalizado; ITB: índice tobillo-brazo; NCEP: National Cholesterol Education Program; NFK-DOQI: National Kidney Foundation-Disease Outcomes Quality Initiative; NYHA: New York Heart Association; PA: presión arterial; PDI: procedimiento de derivación mediante injerto; PTFE: politetrafluoroetileno; TE: tromboembolectomía; TP: tiempo de protrombina; TTPa: tiempo de tromboplastina parcial activado; UCI: unidad de cuidados intensivos; WHO/ISH: World Health Organization/International Society of Hypertension.
En la figura 3 se muestra la vigilancia intraoperatoria de los pacientes. En primer lugar, es preciso prevenir la hipotermia intraoperatoria y la carga isquémica miocárdica, que son variables pronósticas independientes de complicaciones cardíacas mórbidas perioperatorias93-98. La monitorización intraoperatoria y postoperatoria del segmento ST y de la liberación de troponina T puede ser útil para supervisar a los pacientes con factores de riesgo aislados o múltiples de coronariopatía, con coronariopatía conocida, o tratados con técnicas de cirugía vascular97-106. En segundo lugar, la hiperglucemia es una variable pronóstica independiente de riesgo cardiovascular; su gravedad se relaciona directamente con la tasa de mortalidad durante la isquemia miocárdica107-111. Es necesario controlar la glucemia de los pacientes con diabetes mellitus o con hiperglucemia aguda durante el período perioperatorio, ya que corren un riesgo elevado de presentar isquemia miocárdica durante los procedimientos de revascularización mayores96,97.
Algoritmo de la reunión vascular multidisciplinaria preoperatoria y evaluación del riesgo clínico, vigilancia intraoperatoria del paciente y tratamiento postoperatorio. ACCP: American College of Chest Physicians; ADR: amputación por desarticulación de la rodilla; AHA/ACC: American College of Cardiology y American Heart Association; AIG: amputación infragenicular; AIM: directrices clínicas de Annals of Internal Medicine; AMT: amputación transmetatarsiana; ASG: amputación supragenicular; ATP: angioplastia transluminal percutánea; EA: endarterectomía; ECG: electrocardiograma; EED: examen eco-Doppler; Hb: hemoglobina; HL: hiperlipemia; HtINR: índice internacional normalizado; ITB: índice tobillo-brazo; NFK-DOQI: National Kidney Foundation-Disease Outcomes Quality Initiative; PCF: plasma congelado fresco; PDI: procedimiento de derivación mediante injerto; PTFE: politetrafluoroetileno; RAEI: revascularización arterial de la extremidad inferior; TASC: Trans Atlantic Inter-Society Consensus; TE: tromboembolectomía; TP: tiempo de protrombina; TTPa: tiempo de tromboplastina parcial activado; UCI: unidad de cuidados intensivos.
El tratamiento postoperatorio de los pacientes se muestra en la figura 3. Puesto que la mayoría de los episodios cardiológicos que se presentan en los pacientes quirúrgicos sin cardiopatía conocida se producen en el postoperatorio, este período puede ser el momento durante el que es más decisiva la supresión del estrés, de la hemodinámica adversa y las respuestas de hipercoagulabilidad. La anestesia/analgesia epidural se asocia a la administración de dosis más bajas de opiáceos, una mejor ablación de la respuesta de las catecolaminas y una disminución de la hipercoagulabilidad112-114. En segundo lugar, la anemia y unos valores del hematocrito<28-30% inducen estrés sobre el sistema cardiovascular, lo que puede exacerbar la isquemia miocárdica y agravar la insuficiencia cardíaca115-121. En tercer lugar, también se ha demostrado que la hiperviscosidad y la hipercoagulabilidad son marcadores de un mal pronóstico1-5,121.
LimitacionesDebido a su naturaleza retrospectiva, el presente estudio adolece de limitaciones que deben ser consideradas cuando se interpreten los resultados. El número de pacientes incluidos en el presente estudio no permite realizar análisis adicionales en profundidad. Los pacientes con tratamiento quirúrgico previo por IC fueron excluidos del estudio para reducir la influencia de las complicaciones previas en los resultados del tratamiento actual. La muestra estuvo formada exclusivamente por pacientes con IC y los resultados no se pueden generalizar a otras muestras de pacientes. Es preciso tener en cuenta que los resultados se obtuvieron en un hospital con un gran volumen de pacientes y que las tasas de complicaciones cardíacas podrían diferir en otros centros.
ConclusiónLas complicaciones afectan a>30% de los pacientes con IC después de la práctica de una RAP. Las más lesivas en los resultados clínicos de estos pacientes se relacionaron con la patología cardíaca, y dieron lugar a una mayor morbilidad y mortalidad. Se observaron correlaciones significativas entre la prescripción de bloqueadores beta y/o antiagregantes plaquetarios y la prevención de estos acontecimientos. Sigue siendo primordial una atención permanente en la prevención de las complicaciones sistémicas para mejorar los resultados de los procedimientos de salvamento de la extremidad.
Clasificación de las complicaciones y explicación de las causas
| Categoríaa | Causa del acontecimiento adversob (grupos 1-4) | Resultado (categorías I-V) |
| Cardíacas | 1 Menores | I Sin consecuencias |
| Pulmonares | 2 Quirúrgicas | II Transfusión/medicación adicional |
| Neurológicas | 3 Fracaso de la revascularización | III Nueva intervención |
| Renales | 4 Sistémicas | IV Lesión física irreversible |
| (subcutáneas, músculos/óseas, hematológicas,tratamiento vascular) | V Muerte |
Explicación y definición de las causas de las complicaciones perioperatorias: menores, una complicación tal como una infección del tracto urinario o trombosis venosa profunda; quirúrgicas, una complicación debida al tratamiento quirúrgico, como un absceso, infección de la herida, necrosis de la herida, dehiscencia de la herida, o hemorragia; fracaso de la revascularización, cuando se ocluyó un injerto de derivación primario o en riesgo de oclusión y se efectuó una nueva intervención quirúrgica o endovascular o cuando se ocluyó un segmento arterial anatómico después de la angioplastia transluminal percutánea efectuada el mismo segmento; sistémicas, complicación con amenaza potencial para la vida del paciente, como neumonía, insuficiencia respiratoria, arritmia, paro cardíaco, shock cardiogénico, insuficiencia cardíaca congestiva, infarto de miocardio, shock e ictus.
Subdivisión de las categorías especificas de las complicaciones
| Cardíacas |
| Insuficiencia cardíaca congestiva |
| Arritmia |
| Paro cardíaco |
| Infarto de miocardio |
| Endocarditis/pericarditis |
| Shock cardiogénico |
| Hipertensión/hipotensión arterial |
| Taquicardia/bradicardia |
| Pulmonares |
| Insuficiencia respiratoria |
| Aspiración/neumonía |
| Líquido pleural |
| Atelectasia |
| Embolia |
| Neurológicas |
| Accidente vascular cerebral |
| Episodio isquémico transitorio |
| Neuropraxia |
| Renales |
| Insuficiencia renal |
| Insuficiencia renal terminal |
| Infección del tracto urinario |
| Retención de orina |
| Pielonefritis/hidronefrosis |
| Subcutáneas |
| Ampolla/úlcera |
| Absceso |
| Epidermólisis |
| Seroma |
| Celulitis |
| Hematoma de la herida |
| Infección de la herida |
| Dehiscencia de la herida |
| Necrosis/pérdida inesperada de tejido |
| Músculos/óseas |
| Síndrome compartimental |
| Osteomielitis |
| Hematológicos |
| Hemorragia espontánea |
| Trombocitopenia inducida por heparina |
| Reacción a la transfusión |
| Disminución de la hemoglobina |
| Trombosis por déficit de antitrombina III, de proteína C o proteína S |
| Septicemia |
| Líquidos y electrolitos |
| Tratamiento vascular |
| Infección de la vía |
| Trombosis venosa profunda |
| Infección de PDI |
| Estenosis PDI/segmento anatómico después de ATP |
| Oclusión PDI/segmento anatómico después de ATP |
| Pseudoaneurisma anastomótico/segmento anatómico después de ATP |
| Hemorragia |
| Tratamiento general |
| Error de medicación, de diagnóstico, criterio o técnica |
| Retraso hasta la llegada al quirófano, de la respuesta del médico o del diagnóstico |
| Archivo hospitalario incompleto |
ATP: angioplastia transluminal percutánea; PDI: procedimento de derivación con injerto.