El ventrículo derecho (VD), históricamente subestimado en la fisiopatología cardiovascular, ha demostrado ser determinante en la evolución del paciente crítico. Su estructura anatómica y funcional, diseñada para la circulación pulmonar de baja resistencia, lo convierte en una cavidad eficiente en condiciones normales, pero altamente vulnerable ante incrementos en la poscarga. La disfunción del VD surge de mecanismos como hipertrofia, fibrosis, isquemia, inflamación y desacople ventrículo-arterial, lo que precipita complicaciones sistémicas secundarias a hipoperfusión y congestión que comprometen hígado, riñón, intestino, músculo-esquelético, sistema nervioso e inmunológico. En el síndrome de dificultad respiratoria aguda (SDRA), la interacción corazón-pulmón incrementa la carga del VD y se asocia a mayor mortalidad. La fluidoterapia, aunque puede mejorar el gasto cardiaco en hipovolemia, también puede inducir sobredistensión, regurgitación tricuspídea y reducción del gasto del ventrículo izquierdo (VI). La integración de ecocardiografía, ultrasonido a la cabecera, inotrópicos y moduladores de la resistencia vascular pulmonar conforman pilares terapéuticos. Este escenario exige una visión multidisciplinaria y traslacional para desarrollar estrategias individualizadas que optimicen el pronóstico.
The right ventricle (RV), historically underestimated in cardiovascular pathophysiology, has emerged as a key determinant in the evolution of critically ill patients. Its anatomical and functional design, adapted to the low-resistance pulmonary circulation, makes it highly efficient under physiological conditions but extremely vulnerable to increases in afterload. RV dysfunction results from mechanisms such as hypertrophy, fibrosis, ischemia, inflammation, and ventriculo-arterial uncoupling, leading to systemic complications driven by hypoperfusion and congestion that affect the liver, kidneys, intestines, musculoskeletal system, nervous system, and immune response. In acute respiratory distress syndrome (ARDS), heart–lung interactions markedly increase RV load and are associated with higher mortality. Fluid resuscitation, while potentially improving cardiac output in hypovolemia, may also trigger RV overdistension, tricuspid regurgitation, and impaired left ventricular output. The integration of echocardiography, point-of-care ultrasound, inotropes, and pulmonary vascular resistance modulators represents the cornerstone of management. This scenario highlights the need for a multidisciplinary and translational approach to develop individualized strategies aimed at improving patient outcomes.
El estudio del ventrículo derecho (VD) ha estado marcado por un recorrido histórico de descubrimientos y reinterpretaciones. Ya en 1288, Ibn Nafis describió las conexiones funcionales entre el corazón y el pulmón, anticipando el concepto moderno de circulación pulmonar. Más de dos siglos después, en 1509, Miguel Servet identificó que el VD cumplía un rol distinto al ventrículo izquierdo (VI), estableciendo el principio de dos circuitos hemodinámicos diferenciados. Sin embargo, no fue sino hasta 1943 cuando Isaac Starr propuso, erróneamente, que la pared libre del VD era prescindible para mantener la circulación sistémica, restándole relevancia fisiopatológica. Durante décadas, esta visión reduccionista condujo a un subdiagnóstico de la disfunción ventricular derecha en escenarios clínicos críticos. Hoy, por el contrario, se reconoce al VD como un actor central en la fisiopatología de la falla cardiaca, la hipertensión arterial pulmonar y, de manera destacada, en el síndrome de dificultad respiratoria aguda (SDRA), particularmente en el contexto de la infección por COVID-19, donde su sobrecarga y desacople con la vasculatura pulmonar determinan pronóstico1–4.
Desde el punto de vista anatómico y funcional, el VD se diferencia de su contraparte izquierda no solo por su morfología, sino también por la carga hemodinámica que enfrenta. Ambos ventrículos manejan el mismo volumen sistólico y trabajan en unísono, pero el VD perfunde la circulación pulmonar tanto en sístole como en diástole. Su cavidad es un 15% más grande, con una pared aproximadamente 5mm más delgada y un peso 30% menor que el VI. Estas características derivan de la baja resistencia vascular pulmonar, que impone un trabajo mecánico reducido y una curva presión-volumen de morfología completamente distinta. Mientras el VI genera presiones elevadas para vencer la resistencia periférica, el VD se adapta a un régimen de baja presión, pero altamente sensible a cambios en la poscarga, como ocurre en situaciones de hipertensión pulmonar aguda o SDRA1,2.
La comprensión contemporánea del VD ha transformado la visión clínica: lejos de ser una cavidad pasiva, constituye un determinante fundamental en la adaptación cardiorrespiratoria del paciente crítico. Esta perspectiva obliga a reconsiderar los paradigmas de reanimación hídrica y ventilación mecánica, integrando al VD como epicentro en la toma de decisiones hemodinámicas y terapéuticas.
Fisiología y fisiopatología del ventrículo derechoEl VD, derivado de la cavidad cardiaca secundaria anterior, se sitúa justo detrás del esternón y comparte integración estructural y funcional con el VI a través del septum interventricular. Su diseño anatómico está adaptado a la circulación pulmonar de baja resistencia, con una pared libre más delgada y flexible que, a pesar de su menor masa, logra mantener un volumen sistólico equivalente al del VI. La contracción del VD combina movimientos longitudinales, generados por miofibrillas helicoidales del septum, y movimientos transversos, aportados por fibras circunferenciales, en estrecha dependencia de la contractilidad septal y de la interdependencia ventricular1,2.
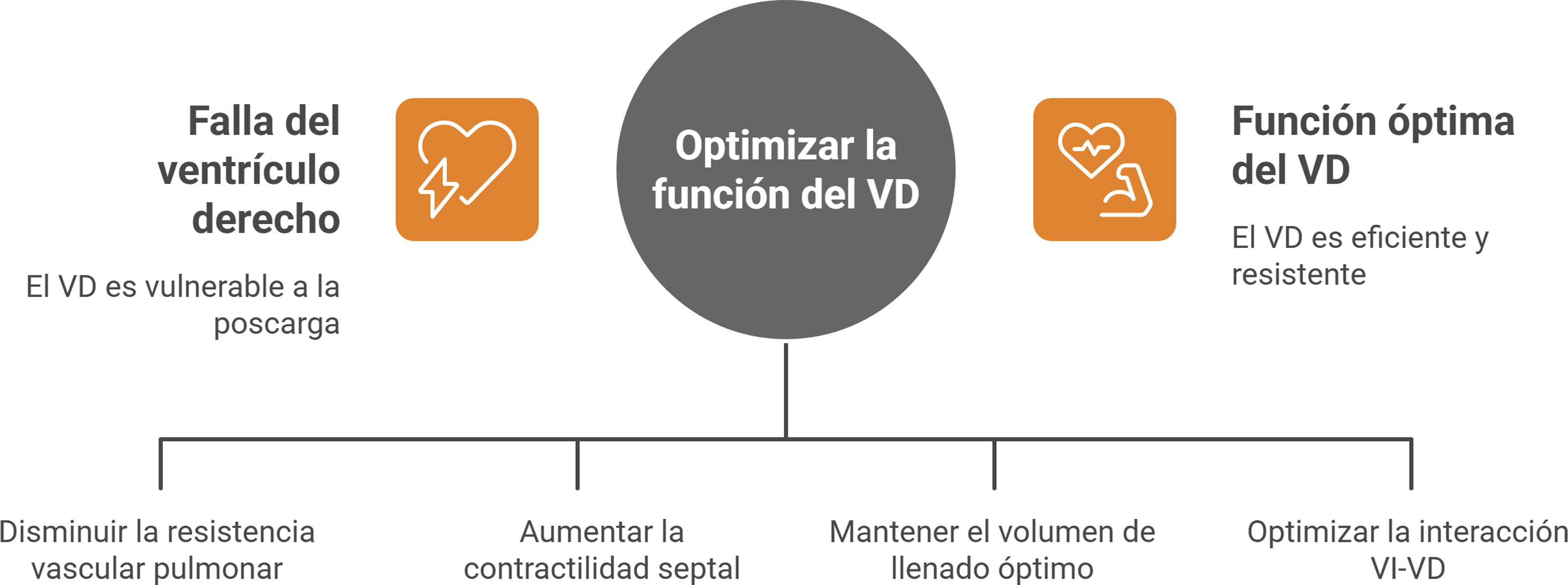
Desde la perspectiva fisiopatológica, el VD es particularmente sensible a variaciones en la poscarga: incrementos modestos en la resistencia vascular pulmonar, como los observados en el SDRA, la hipertensión pulmonar o el tromboembolismo pulmonar generan dilatación aguda, desplazamiento septal hacia el VI y reducción del gasto cardiaco (fig. 1). En escenarios crónicos, la hipertrofia adaptativa puede sostener la función transitoriamente, pero la sobrecarga mantenida conduce a falla ventricular derecha. De esta manera, el VD representa una cavidad eficiente en condiciones fisiológicas, pero vulnerable cuando se altera el delicado equilibrio entre precarga, poscarga, contractilidad e interdependencia con el VI1.
Mecanismos de lesión del ventrículo derechoLos procesos fisiopatológicos que ocasionan fallo del VD incluyen la hipertrofia, la fibrosis, la isquemia, la activación neurohumoral, inflamación y cambios en los sustratos metabólicos. Un aumento de la poscarga ocasiona hipertrofia del VD que en principio es adaptativa. Posteriormente se documenta depleción de los receptores adrenérgicos, fallo en la estimulación de la adenilato ciclasa del miocito ocasionando menos respuesta a los beta adrenérgicos. Esto conlleva a menor contractilidad, mayor resistencia vascular y una mala respuesta adaptativa dada por la dilatación anormal del VD1,2.
Por otro lado, existe desbalance entre el aporte y la demanda de oxígeno del VD con hipoperfusión de la pared, hipertrofia y lesión microvascular capilar; reportándose reducción en el flujo de la arteria coronaria derecha el cual es proporcional con el estrés de la pared del VD. Esta reducción en el sustrato energético conlleva a comprometer la contractilidad con posterior desacople ventrículo arterial y falla ventricular secundaria2.
Los principales determinantes de la función del VD don la precarga, post carga y la contractilidad condiciones que pueden ser alteradas dependiendo de diversas patologías (tabla 1).
Mecanismos de lesión y patologías asociadas a lesión del ventrículo derecho
| Mecanismos de lesión del VD | Ejemplos |
|---|---|
| Precarga | Insuficiencia tricúspideEdema pulmonar cardiogénicoShunt de izquierda a derechaShunt arteriovenoso extracardiaco |
| Postcarga | Obstrucción mecánica (TEP, estenosis pulmonar)Hipertensión pulmonar precapilarEnfermedad pulmonar e hipoxiaHipertensión pulmonar postcapilar. (enfermedad del VI) |
| Contractilidad | Infarto agudo de miocardioMiocarditisPOP cirugía cardiacaEsclerosis sistémica |
| Relajación | Fibrosis miocárdicaRigidez sarcoméricaMiocardiopatía infiltrativaPericarditis constrictiva |
Fuente: Elaboración propia.
La hipertensión pulmonar y la falla cardiaca del VD ocasionan lesiones sistémicas que muchas veces han sido subestimadas. Evidenciándose falla de múltiples órganos debido a hipoperfusión, inflamación sistémica, mecanismos de cross-talking entre los diferentes tejidos y signos de congestión venosa (tabla 2).
Complicaciones relacionadas con la falla del ventrículo derecho
| Sistema / Órgano | Complicaciones asociadas |
|---|---|
| Cardiovascular | - Disfunción del VI por interdependencia ventricular- Reducción del volumen sistólico izquierdo- Discordancia entre hipertrofia del VD y atrofia del VI- Síndrome de compresión de la arteria coronaria izquierda |
| Hígado | - Hepatitis isquémica- Hepatopatía congestiva |
| Riñón | - Lesión renal por hipoperfusión- Nefropatía congestiva crónica |
| Intestino | - Traslocación bacteriana- Ruptura de la barrera intestinal- Caquexia- Endotoxemia e inflamación |
| Homeostasis del hierro | - Deficiencia de hierro- Alteraciones en los niveles de hepcidina |
| Músculo-esquelético | - Debilidad- Descondicionamiento |
| Endocrino-metabólico | - Síndrome metabólico- Hipo o hipertiroidismo |
| Inmunológico | - Infiltrado linfocitario perivascular- Incremento de mediadores inflamatorios y cross-talk multiorgánico |
| Coagulación | - Estado hipercoagulable (↑ Factor von Willebrand, PAI-1, fibrinógeno)- Trombocitopenia |
| Sistema nervioso central | - Depresión- Ansiedad- Deterioro cognitivo |
| Oftalmológico | - Glaucoma de ángulo abierto- Desprendimiento de retina- Oclusión de arteria retiniana |
| Piel | - Prúrigo |
| Sistema nervioso autónomo | - Disfunción simpática- Menor variabilidad de frecuencia cardiaca- Mayor riesgo de fibrilación auricular- Disfunción endotelial |
| Sueño | - Apnea obstructiva del sueño- Trastornos de la regulación del sueño- Hipoxia nocturna |
Tomado y adaptado de: Rosenkranz S, et al.3.
Las complicaciones sistémicas son variadas que en resumen pueden reducirse a complicaciones relacionadas con hipoperfusión o congestión; cualquiera de los dos escenarios podría encasillar la lesión de VD en diferentes fenotipos con un manejo más individualizado.
Manifestaciones relacionadas con congestión venosa:
- •
Compromiso hepático: ictericia, ascitis, elevación de fosfatasa alcalina, bilirrubinas y glutamil transferasa y fibrosis hepática
- •
Compromiso renal: activación de endotelio venoso, edema renal, activación de mediadores inflamatorios3.
Manifestaciones relacionadas con hipoperfusión:
- •
Compromiso hepático: elevación de LDH y transaminasas
- •
Compromiso renal: activación neurohumoral, estrés oxidativo, hipoperfusión renal, señalización alterada, modulación inmune3.
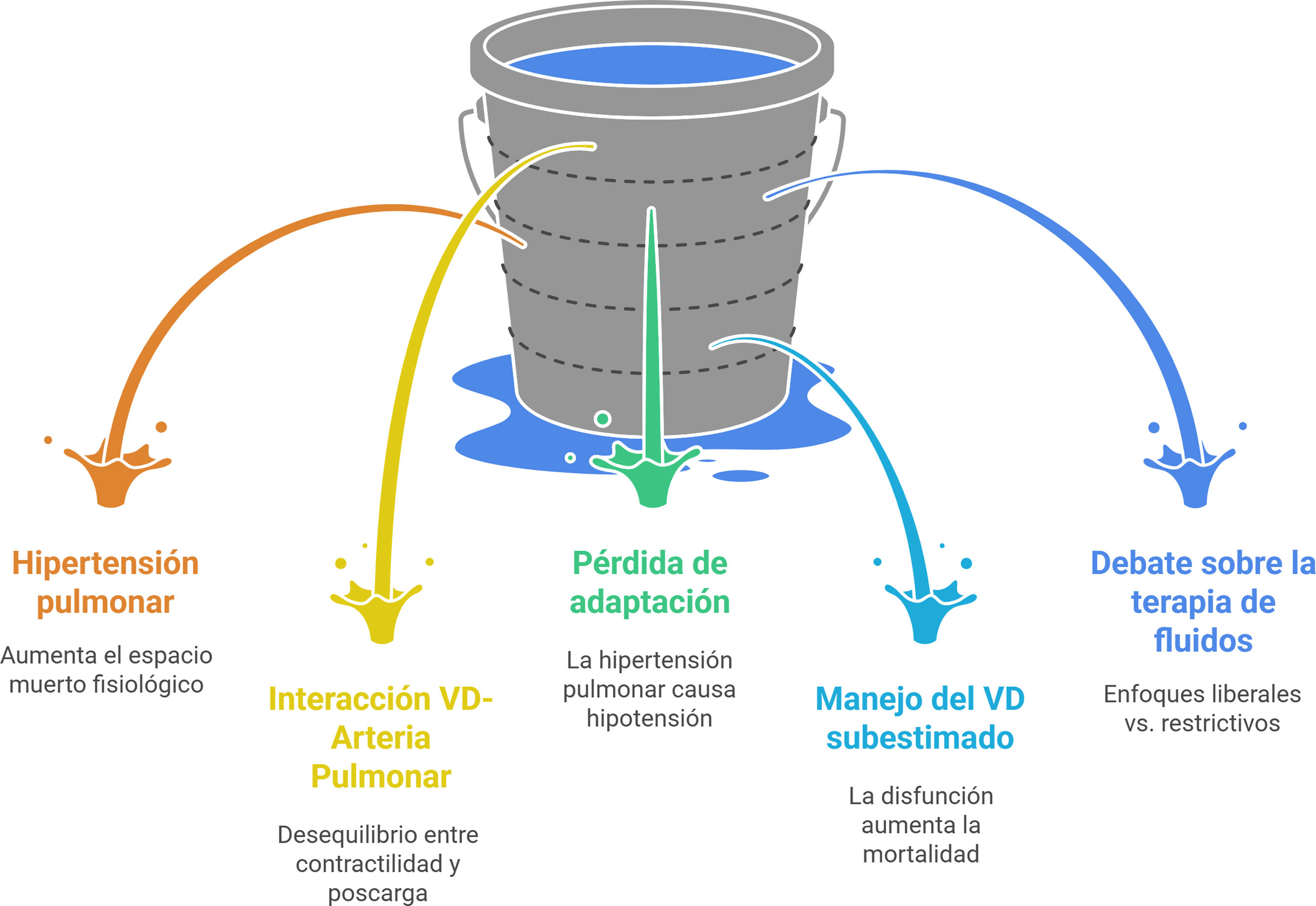
El SDRA es una condición heterogénea, multifactorial, de alta mortalidad. Donde el 21% de los pacientes afectados cursan con hipertensión pulmonar; la interacción corazón pulmón compromete principalmente al VD debido a un incremento en el espacio muerto fisiológico ya sea por hipoxemia que genera vasoconstricción pulmonar o por aumento en la presión positiva de la vía aérea en pacientes ventilados que generan no solo deformidad del parénquima pulmonar sino obstrucción de los capilares intraalveolares4-6. La interacción entre el VD y arteria pulmonar está determinada por la proporcionalidad entre la contractilidad del VD y el aumento de la poscarga del mismo como mecanismo de adaptación; Este mecanismo dinámico (denominado adaptación homeometrica o mecanismo Anrep) permite el acople de la contractilidad del VD según se comporte la resistencia vascular pulmonar. Sin embargo, en los pacientes graves este acople se pierde donde la hipertensión pulmonar ocasiona más hipotensión debido a la respuesta proinflamatoria pertinente y al escaso tiempo para realizar una adecuada adaptación6,7. Esta relación entre lesión pulmonar y fallo ventricular conlleva a una alta mortalidad, afirmación demostrada por un metaanálisis realizado por Sato et al. (n=1.861) OR 1,45, (IC 95% 1,13–1,86, p=0,003, I2=0%)8. A pesar de estos hallazgos Ganeriwal et al. evaluaron de forma retrospectiva 51 estudios (n=1.526) de pacientes con SDRA donde solo el 27% de ellos tuvieron en cuenta el manejo del VD; siendo esta estructura poco valorada a pesar de la relación que existe entre disfunción y mortalidad9.
El manejo del SDRA debe ser multidisciplinario teniendo en cuenta el manejo con ventilación mecánica invasiva evitando la lesión inducida por el ventilador, el uso de corticoides, la posición prono o el bloqueo neuromuscular según sea el caso10. Sin embargo, La fluido terapia en los pacientes con SDRA debería ser restrictiva, procurando mantener balances negativos; esto fue demostrado en el estudio FACTT (n=1.000 con SDRA) donde comparó manejo hídrico conservador vs. liberal demostrando menos días de ventilación mecánica invasiva (12 vs. 14,5 días, p <0,01), menos días de estancia en la Unidad de Cuidados Intensivos (UCI) (11 vs. 13 días p <0,01); sin embargo la mortalidad fue similar (28,4 vs. 25,5% p=0,3) y no hubo diferencias en la presencia de shock o necesidad de terapia de remplazo renal (14% vs. 10% p=0,06)11.
Estas afirmaciones llevan a un gran debate relacionado con el beneficio del uso de fluidoterapia liberal o restrictiva en pacientes con fallo del VD (fig. 2).
La dinámica de fluidos del ventrículo derechoHistóricamente se ha relegado el estudio del impacto de la fluidoterapia sobre el VD debido a su aparente poca relevancia clínica y su compleja geometría; asumiendo que en la mayoría de los casos el VD permanece siempre en el área dependiente de la curva de Frank Starling7.
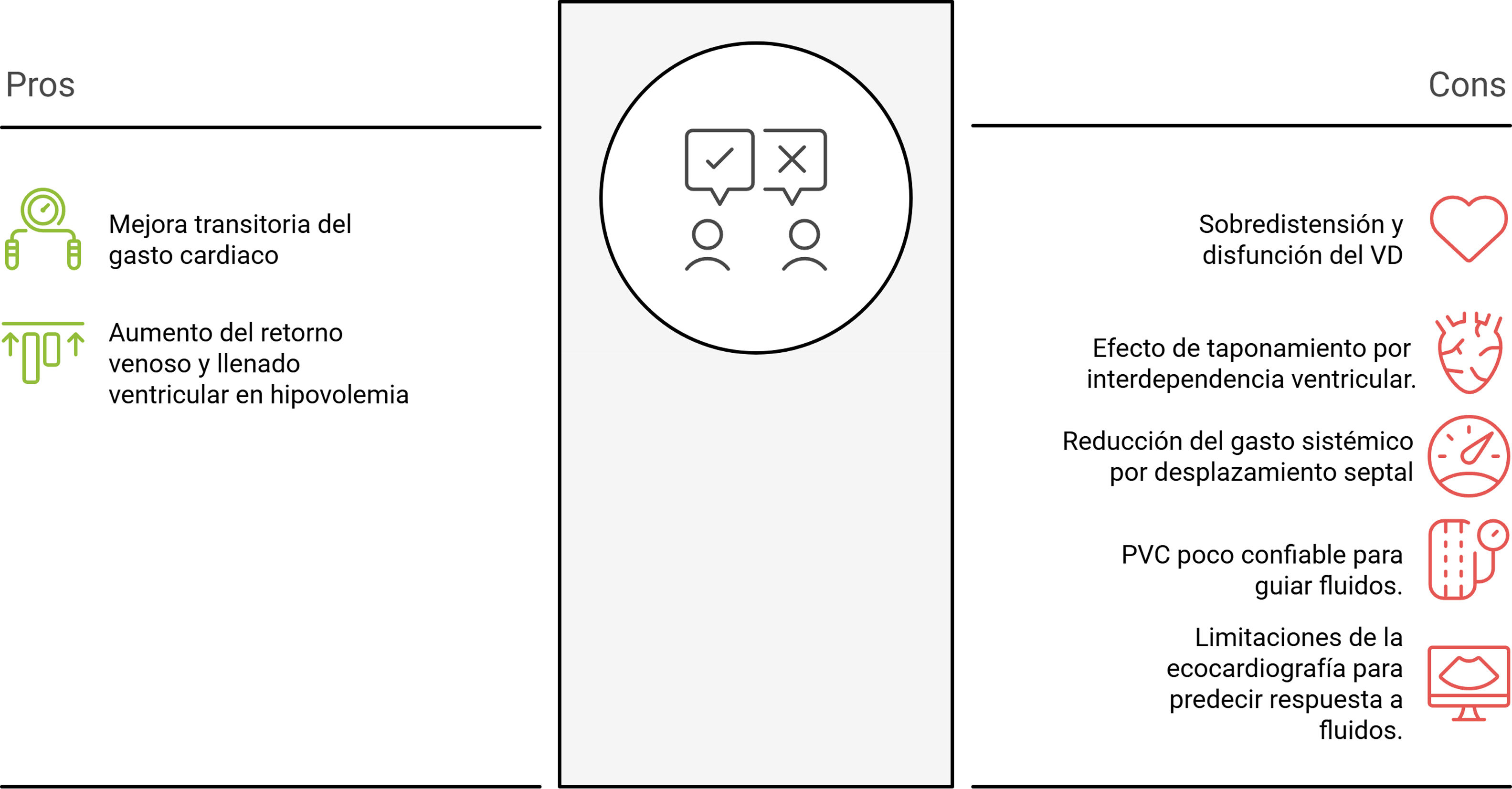
En la década de los 80, un estudio de Dell’Italia et al., que incluyó pacientes con infarto de miocardio del VD manejados con un incremento progresivo de aporte hídrico, demostró incremento de la presión de la aurícula derecha (de 11,2 a 15 ± 2mmHg, p <0,001) y un incremento de la presión en cuña de la arteria pulmonar (de 10,4 a 15,2mmHg, p <0,001), sin incrementarse de forma significativa el gasto cardiaco (1,9 ± 0,5 [SD] a 2,1 ± 0,4 L/min/m2)12. Posteriormente hacia los albores de los 2000 el grupo académico de Tyberg et al. demostraron que la fluidoterapia conlleva a aumento de tamaño del VD, restricción pericárdica y menores presiones de llenado del VI dada la interdependencia ventricular13. Y ya hacia los finales de la década de los 2000 donde se pone entredicho el uso de la presión venosa central (PVC) como un parámetro de respuesta a volumen, donde Marik et al. realizaron una revisión sistemática (24 estudios n=803) encontrando que 56 ± 16% de los pacientes respondían a volumen, no hubo diferencias significativas entre la PVC entre respondedores (8,7mmHg) y no respondedores (9,7mmHg)14. Posteriormente también se cuestiona el uso de parámetros ultrasonográficos de respuesta a volumen de forma aislada; Vignon et al. realizaron un estudio con 540 paciente y encontraron que la sensibilidad y la especificidad del índice de vena cava superior mayor respecto al índice de vena cava inferior (p=0,02) demostrando que la ecografía transtorácica tiene un rendimiento aun inferior respecto a su contraparte transesofágica15.
Todas estas afirmaciones cuestionan el rendimiento de las pruebas dinámicas y estáticas de respuesta a volumen de forma aislada. Debido a que la mecánica de fluidos del VD es completamente diferente a la del VI. Esta discrepancia fue demostrada recientemente en el año 2021 por Collia et al. quienes encontraron que los flujos diastólicos tempranos VD y VI fueron similares, sin embargo, el VI forma un flujo turbulento que genera un vórtice que se ubica en el centro de la cavidad ventricular mientras que el VD forma este mismo fenómeno físico únicamente ligado al área peri valvular con una morfología en espiral a través del tracto de salida, por otro lado el VD se comporta como un reservorio durante la fase de diástole almacenando una mayor cantidad de volumen. Estos fenómenos contribuyen a que el VI mantenga una mayor energía cinética durante la diástole mientras que el VD la disipa. En sístole la forma circular del VI permite una mayor eficiencia para vencer resistencias vasculares periféricas, mientras que la forma elongada y espiralada del VD permite el manejo de mayores volúmenes en contra de presiones vasculares pulmonares más bajas. Si bien ambos ventrículos presentan el mismo volumen latido, es notable que el VD tiene una mayor potencia propulsiva que el VI (4,8W vs. 3,5W)16. Todas las consideraciones a favor y en contra de la fluidoterapia en el VD deben ser consideradas en los diferentes escenarios de salud para ofrecer mejores desenlaces en el paciente críticamente enfermo (fig. 3).
Principios del manejo relacionados con el ventrículo derechoLos objetivos de la terapia surgen en la reducción de la precarga, post - carga y mejoría de la contractilidad, identificando adecuadamente los factores desencadenantes del fallo. La resistencia vascular pulmonar puede reducirse con prostaciclina IV. La contractilidad puede mejorarse empleando inotrópicos como levosimendán, Milrinone o empleando soporte ventricular17,18. El tratamiento temprano de arritmias evitaría el circulo vicioso que existe entre hipotensión, isquemia y arritmias7.
Los estados óptimos de precarga del VD dependerán de la causa fisiológica y el tiempo de la enfermedad. Teóricamente los pacientes con shock debido a aumento de la poscarga ventricular derecha (tromboembolia pulmonar) o reducción en la contractilidad (infarto agudo de miocardio de pared del VD) se beneficiarían de mayor carga volumétrica lo que conllevaría a un mayor volumen latido. Sin embargo, como mencionamos previamente esta afirmación es materia de debate ya que el uso deliberado de volumen puede ser pernicioso debido a que la falla cardiaca derecha en su mayoría es exacerbada por mayor congestión venosa y sobrecarga de volumen, el cual es a su vez responsable de incrementar el estrés de la pared del VD, la severidad de la regurgitación tricúspidea y el empeoramiento de la interdependencia ventricular19. Si bien aquellos pacientes con depleción relativa se pueden beneficiar de un mayor aporte hídrico, aquellos pacientes con volumen intravascular normal pueden tener una mayor constricción pericárdica con reducción en la presión de llenado ventricular. Incluso existen pacientes con falla ventricular derecha que se benefician de la descongestión volumétrica y de la reducción de la precarga ya que al normalizarse la precarga puede reducir la dilatación anular tricúspidea, la regurgitación tricúspidea, el estrés de la pared del VD y la deformación septal1.
Por otro lado, la falla cardiaca del VD ocasiona congestión venosa y a su vez está relacionada con la generación del síndrome cardiorrenal20,21. De forma objetiva los signos clínicos de congestión (edema periférico, estertores, roncus) pueden documentarse mediante la presencia de líneas B, o signos de derrame pleural evidentes en el ultrasonido a la cabecera del paciente22 o implementando el protocolo VEXUS. El protocolo VEXUS evalúa la presencia de congestión venosa donde básicamente observa un patrón pulsátil de las venas hepáticas, renales, femorales; estos hallazgos pueden determinar disfunción del VD23,24.
El uso de diurético y la restricción hídrica son la piedra angular del manejo de la formación del edema pulmonar y periférico25. Sin embargo, ante condiciones de acidosis refractaria, balances positivos, oliguria persistente, e hipercalemia se debería considerar la necesidad de terapia de remplazo renal.
ConclusionesEl VD, históricamente relegado en la fisiopatología cardiovascular, emerge hoy como un eje central en el manejo del paciente crítico. La evidencia revisada demuestra que su papel trasciende la mera adaptación hemodinámica, pues condiciona la falla multiorgánica a través de fenómenos de congestión, hipoperfusión e inflamación sistémica. En este sentido, la medicina traslacional ofrece un puente entre el conocimiento fisiopatológico y la práctica clínica: desde el desarrollo de biomarcadores de disfunción ventricular y nuevas herramientas de imagen multimodal, hasta el diseño de estrategias terapéuticas personalizadas que integren hemodinámica, ventilación mecánica y monitoreo por ultrasonido.
El futuro de la investigación sobre el VD exige un abordaje multidisciplinario, donde confluyan la cardiología, la neumología, la nefrología, la hepatología y la medicina crítica. Explorar terapias dirigidas al desacople VD-arteria pulmonar, la modulación inflamatoria y el uso de dispositivos de soporte específico permitirá avanzar hacia intervenciones más precisas y efectivas. Asimismo, la validación de algoritmos de fluidoterapia que incorporen inteligencia artificial y parámetros dinámicos puede redefinir los paradigmas de resucitación en escenarios de alta complejidad. De esta manera, la integración de distintas especialidades y la investigación traslacional constituyen la ruta para transformar el conocimiento en soluciones clínicas con impacto real en la supervivencia y calidad de vida de los pacientes.
FinanciaciónAutofinanciado.
Contribución de autoríaTodos los autores participaron en la concepción del estudio, la redacción del borrador, la elaboración del manuscrito final, así como en la revisión crítica y aprobación de la versión definitiva de este.
Conflicto de interesesLos autores no declaran conflicto de intereses.