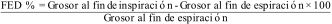La sarcopenia es un síndrome clínico que se caracteriza por pérdida progresiva y generalizada de la masa musculoesquelética, aumentando el riesgo de resultados adversos, incluida la discapacidad física, el riesgo de caídas y una mayor probabilidad de muerte. La sarcopenia en el paciente crítico es un síndrome clínico heterogéneo y multifactorial. Esta entidad se considera un factor de riesgo independiente relacionado con peores desenlaces en la unidad de cuidados intensivos, y se incluyen complicaciones asociadas a la ventilación, como la atrofia de los músculos respiratorios debido al cese de la actividad contráctil, facilitada por la administración de sedantes y relajantes musculares para la asistencia ventilatoria. La inactividad del diafragma conlleva al acortamiento pasivo de las fibras musculares y al menor consumo energético de los músculos respiratorios, favoreciendo la disfunción diafragmática, que se asocia con mayor tiempo de ventilación mecánica, falla en el destete ventilatorio, mayor riesgo de infección y mayor riesgo de muerte. Resulta necesario utilizar herramientas diagnósticas, como la ecografía muscular y diafragmática, que constituye una herramienta de gran utilidad. La medición de la excursión diafragmática y el engrosamiento diafragmático pueden contribuir en el proceso de destete ventilatorio y asegurar una extubación exitosa.
Sarcopenia is a clinical syndrome characterized by progressive and generalized loss of skeletal muscle mass, increasing the risk of adverse outcomes, including physical disability, risk of falls, and increased likelihood of death. Sarcopenia in the critically ill patient is a heterogeneous and multifactorial clinical syndrome. This entity is considered an independent risk factor related to worse outcomes in the intensive care unit, including complications associated with ventilation such as respiratory muscle atrophy due to cessation of contractile activity, facilitated by the administration of sedatives and muscle relaxants for ventilatory support. Diaphragm inactivity leads to passive shortening of muscle fibers and lower energy consumption of the respiratory muscles. This favors diaphragmatic dysfunction, which is associated with longer mechanical ventilation time, ventilatory weaning failure, increased risk of infection and increased risk of death. It is necessary to use diagnostic tools such as muscle and diaphragmatic ultrasound which is a very useful tool. The measurement of diaphragmatic excursion and diaphragmatic thickening can contribute to the ventilatory weaning process and ensure a successful extubation.
La sarcopenia es un síndrome clínico que se caracteriza por pérdida progresiva y generalizada de la masa y la función del sistema musculoesquelético, conllevando a un aumento en el riesgo de resultados adversos, incluida la discapacidad física, el riesgo de caídas y una mayor probabilidad de muerte. Se describió inicialmente en el adulto mayor como una disminución de la masa corporal magra relacionada con la edad que afectaba la movilidad, el estado nutricional y la independencia. Actualmente se reconoce que esta entidad está ampliamente relacionada con la edad, pero no es exclusiva del adulto mayor. Su etiología es multifactorial, y su patogénesis no está claramente dilucidada. El European Working Group on Sarcopenia in Older People (EWGSOP) define la sarcopenia como la combinación de baja masa muscular esquelética y bajo rendimiento muscular. El Nutritional Screening & Assessment in Adults de la European Society for Clinical Nutrition and Metabolism (ESPEN) identifica la sarcopenia mediante la presencia de baja masa muscular esquelética y baja fuerza muscular. El International Working Group on Sarcopenia (IWGS) describe la sarcopenia como la presencia de baja masa muscular esquelética y baja función muscular, que puede presentarse con la pérdida de masa muscular sola o junto con un aumento de masa grasa1-4.
La sarcopenia en el paciente crítico es un síndrome clínico heterogéneo y multifactorial que se asocia a peores resultados en salud y altos costos en los sistemas sanitarios5. La prevalencia oscila entre el 5% y el 13% en personas de 60 a 70años y entre el 11 y el 50% en personas mayores de 80años1. En el escenario del cuidado crítico existen menos estudios sobre prevalencia, con variaciones entre el 30% y el 70%: se describen valores entre el 15% y el 50% en pacientes con cáncer, del 30% al 45% en pacientes con insuficiencia hepática y del 60% al 70% en pacientes críticamente enfermos. Adicionalmente existen otras entidades que frecuentemente se interrelacionan con la sarcopenia, como la fragilidad, la desnutrición y la caquexia6.
Esta entidad se puede clasificar como sarcopenia primaria, relacionada con la edad, o secundaria, cuando es relacionada con inactividad, desnutrición y sarcopenia relacionada al cuidado intensivo5. Los pacientes críticamente enfermos hospitalizados en la unidad de cuidados intensivos (UCI) están generalmente sedados, en algunos casos con relajación neuromuscular y con soporte ventilatorio, lo que predispone el desarrollo del síndrome de desacondicionamiento físico, que compromete la fuerza del músculo esquelético, incluyendo los músculos del sistema respiratorio como el diafragma, que se constituye como el principal músculo inspiratorio, el cual se atrofia y pierde fuerza en pacientes ventilados, incluso en periodos cortos de tiempo, factor que puede extender el tiempo de ventilación invasiva e interferir en el destete ventilatorio y la extubación7-9.
La ventilación mecánica es una estrategia terapéutica sumamente importante en el manejo de los pacientes críticos, y constituye una herramienta de soporte vital durante el periodo agudo de la enfermedad. El principal objetivo de la ventilación mecánica es generar reposo de la musculatura respiratoria, pero el cese de la actividad contráctil genera acortamiento pasivo y menor consumo energético, favoreciendo la disfunción diafragmática asociada al soporte ventilatorio8,10.
La disfunción diafragmática se define como la atrofia muscular del diafragma, la pérdida de fuerza muscular y la pérdida de su función contráctil, lo que se asocia con mayor tiempo de ventilación mecánica, falla en el destete ventilatorio, mayor riesgo de infección y mayor riesgo de muerte11-13.
Se conoce que aproximadamente el 40% de los pacientes que ingresan al servicio de cuidados críticos requieren soporte ventilatorio, y hasta el 15% de los paciente reciben soporte ventilatorio de manera prolongada, lo que se relaciona directamente con complicaciones que dificultan el procesos de destete ventilatorio, favoreciendo procesos infecciosos y desacondicionamiento físico asociados a la ventilación mecánica, con lo que aumentan los tiempos de hospitalización en la UCI y aumentan el riesgo de muerte8,14-16.
Las complicaciones de la ventilación mecánica generalmente están circunscritas a procesos infecciosos y complicaciones de vías aéreas superiores e inferiores, como estenosis traqueal, barotrauma y neumotórax. Algunas otras complicaciones son más difíciles de reconocer, como la atrofia muscular y la debilidad de los músculos respiratorios; el músculo diafragma se ve afectado rápidamente, con la necesidad de ventilación mecánica, lo que afecta el proceso de retiro de ventilación mecánica17,18.
El síndrome de debilidad adquirida en la UCI ha sido identificado clínicamente y está asociado con la prolongación del destete ventilatorio, con la reducción en la eficacia de la rehabilitación y con estancias hospitalarias más prolongadas. Por ello, es esencial llevar a cabo una estratificación de riesgos en pacientes que experimentan pérdida muscular con el fin de optimizar la gestión clínica, incluyendo aspectos como la rehabilitación motora, el destete ventilatorio y la planificación nutricional, entre otros7,19.
La ecografía constituye una herramienta de medición válida, accesible y no invasiva para la evaluación de la masa muscular, permitiendo su incorporación como parte de la rutina diaria en la UCI, sin exposición a radiación ionizante y con un costo relativamente bajo. Su utilidad radica no solo en la estimación cuantitativa de la masa muscular, sino también en el seguimiento evolutivo de su pérdida en pacientes críticamente enfermos. Diversos estudios han demostrado que aquellos pacientes con mayores pérdidas de masa muscular presentan estancias más prolongadas en la UCI, siendo esta pérdida especialmente acentuada durante las primeras semanas de inmovilización15,20. En particular, la ecografía diafragmática permite evaluar variables funcionales y estructurales como el grosor del diafragma, la fracción de engrosamiento y la excursión diafragmática, lo que aporta información clínica relevante para identificar disfunción muscular respiratoria. Estas mediciones se han correlacionado con el éxito o el fracaso del destete ventilatorio, posicionando a la ecografía como una herramienta clave para el abordaje integral de la sarcopenia en el paciente crítico, ya que permite una evaluación dinámica del principal músculo respiratorio y contribuye a la estratificación del riesgo de falla en la extubación.
MetodologíaSe realizó una búsqueda no sistemática de la literatura utilizando términos como «Sarcopenia»; «Critical Care»; «Ventilator Weaning» y «Diaphragm» (DeCS/MeSH/BIREME), así como sinónimos, tanto en inglés como en español, que se combinaron con los operadores booleanos «AND», «OR» y «NOT» en los motores de búsqueda y bases de datos PubMed, ScienceDirect, Embase, EBSCO y MEDLINE. Como criterio de inclusión, se definió cualquier artículo relacionado con aspectos relacionados con el proceso de retiro de la ventilación mecánica en el paciente con sarcopenia al interior de la UCI o el paciente críticamente enfermo, como los avances en medicina basada en la evidencia en la aplicación de esta. Posteriormente se dio prioridad a los estudios de índole originales y a las revisiones sistemáticas con análisis estadístico tipo metaanálisis y revisiones no sistemáticas. Además, estos debían estar disponibles en texto completo. También se incluyeron artículos con información relevante sobre conceptos generales acerca de los aspectos fundamentales sobre ultrasonografía en el proceso de weaning ventilatorio. Como criterios de no inclusión, se estableció que no se considerarían los artículos publicados en un idioma distinto al español y al inglés. Teniendo en cuenta la amplitud del tema y la gran variedad de publicaciones, se incluyeron los artículos más relevantes del tema sin excluir su temporalidad. También se consideraron otras referencias de utilidad para la discusión de conceptos generales. Las estimaciones estadísticas y los cálculos asociados encontrados se expresaron en sus medidas de asociación causal y medidas de tendencia central, ya sean frecuencias, porcentajes, intervalos de confianza (IC), diferencia de medias (DM), riesgo relativo (RR), Odds ratio (OR) o Hazard ratio (HR).
ResultadosCambios de la contractilidad muscular en la sarcopeniaLa contracción muscular se origina a partir de la integridad del sistema nervioso, que es el encargado de generar el estímulo aferente al músculo; posteriormente se genera el acortamiento del sarcómero, que constituye la unidad contráctil, mediante el entrecruzamiento de los puentes de actina y de miosina, lo que genera la contracción muscular. Los músculos respiratorios, tanto inspiratorio como espiratorio, actúan perfectamente sincronizados para facilitar los procesos de ventilación espontánea, modificando las presiones intratorácicas21,22.
La capacidad contráctil del aparato musculoesquelético depende de sustratos energéticos, principalmente del glucógeno muscular y, en situaciones particulares, de ácido grasos, pero en condiciones carentes nutricionales el músculo puede utilizar sus propias proteínas musculares para la adquisición de energía. Esto genera la disminución de la capacidad funcional de la célula muscular y la activación de mecanismos metabólicos como la gluconeogénesis, y, como consecuencia, hay depleción de reservas energéticas musculares y la atrofia muscular secundaria22,23. En el caso de los músculos de la función respiratoria, el principal músculo afectado es el diafragma, seguido de los músculos accesorios de la respiración; ello afecta principalmente el proceso activo de la respiración, que es la inspiración, generando cambios espirométricos como la disminución del volumen inspirado, la caída del volumen residual, la disminución de la capacidad vital y cambios en el intercambio de gases, favoreciendo la hipoxemia y la hipercapnia24.
Sarcopenia y cambios musculares diafragmáticos en el paciente crítico usuario de ventilación mecánicaEl músculo diafragma es una estructura musculotendinosa que tiene como punto de inserción anterior la apófisis xifoides y, lateralmente, los bordes costales hasta los extremos de la 10 y 11 costillas, y posteriormente se inserta en las vértebras lumbares. La inervación está dada por el nervio frénico, conformado por raíces cervicales C3, C4 y C5. Es el principal músculo inspiratorio, contribuyendo al 75% del volumen corriente en la respiración: cuando este músculo se contrae en el ciclo respiratorio se genera la presión transdiafragmática25.
El soporte ventilatorio en el paciente crítico permite disminuir la carga de los músculos respiratorios, principalmente del diafragma, mientras se resuelve la patología aguda que generó la falla respiratoria. Cuando clínicamente esté resuelta la causa, se inicia el proceso de destete ventilatorio, asumiendo que hay una recuperación total de la musculatura, lo que facilitará el temprano retiro del ventilador mecánico. Sin embargo, en algunos pacientes no se logra la recuperación total de la bomba muscular respiratoria, lo que altera el equilibrio que debe existir entre la carga ventilatoria de cada ciclo de la respiración y el rendimiento de los músculos respiratorios, retrasando el proceso de destete ventilatorio26,27.
La debilidad muscular en el paciente crítico internado en la UCI es de rápida instauración, incluso en periodos cortos de tiempo, favorecida por la utilización de medicamentos (sedantes-relajantes) y la inmovilización prolongada. Estos factores contribuyen a la atrofia diafragmática y la desventaja mecánica generada en el ciclo respiratorio, donde el diafragma y los músculos respiratorios no logran mantener la carga impuesta en cada ciclo respiratorio para mantener la adecuada ventilación. Se tienen datos estadísticos que estiman que entre en 1% y el 5% de los pacientes críticos con requerimiento de ventilación mecánica invasiva tienen dificultades con el destete y terminan fracasando en el proceso, extendiendo los tiempos de ventilación mecánica. Algunos de los factores asociados al fallo en el destete son la presencia de neumopatía crónica, desnutrición, lesiones neurológicas y fallas en la programación de parámetros ventilatorios durante la estancia en la UCI12,26,28,29.
La sarcopenia en el paciente crítico soportado con ventilación mecánica adicionalmente genera cambios bioquímicos y moleculares de las fibras musculares del diafragma, generando proteólisis descontrolada y aumento del catabolismo proteico más el estrés oxidativo generado por la condición patológica del paciente crítico. La ventilación mecánica invasiva, a pesar de soportar al paciente, genera estrés oxidativo, con alta producción de radicales libres, que activan las caspasas, las calpaínas y la vía de la ubiquitina proteasoma, que en conjunto aceleran la proteólisis muscular y la formación rápida de vacuolas autofagocíticas, generando la disfunción diafragmática medida por la ventilación mecánica30. Todas estas condiciones generan una disfunción diafragmática que entorpece el destete o el retiro de la ventilación mecánica, y en estos casos es indispensable inducir una correcta programación de parámetros ventilatorios. El soporte nutricional y el seguimiento por el grupo de rehabilitación pueden minimizar la atrofia muscular y disminuir los tiempos de ventilación mecánica31.
Otro aspecto relacionado a disfunción diafragmática es la polineuropatía del paciente crítico, en el cual se presenta la desmielinización nerviosa mediada por los procesos catabólico y el estrés oxidativo, que compromete la fuerza del músculo estriado con posterior compromiso del diafragma, que refleja la disminución de la presión inspiratoria máxima y de la presión espiratoria máxima32.
La atrofia diafragmática generada por la ventilación mecánica invasiva tiene una gran asociación al modo ventilatorio. En aquellos casos donde el ventilador suple completamente la frecuencia y el volumen corriente, sin posibilidad de que el paciente genere respiraciones espontáneas, como sucede en el modo controlado, genera atrofia diafragmática de rápida aparición33.
Retiro, destete o weaning ventilatorioEl término «destete ventilatorio» hace referencia al retiro progresivo del soporte aportado con el ventilador mecánico al paciente. En este caso se logra disminuir los parámetros ventilatorios a niveles basales, lo que, junto con la resolución de la patología de base, la resolución radiológica, la estabilidad hemodinámica y la adecuada evolución neurológica que permita la permeabilidad de la vía aérea, facilita avanzar al siguiente paso, que es la prueba de respiración espontánea. Esta tiene como objetivo identificar la capacidad respiratoria del paciente mientras tiene un soporte ventilatorio mínimo o nulo34,35.
El proceso de destete ventilatorio puede facilitar al personal médico tomar decisiones y predecir si la extubación tendrá éxito, aunque el consenso internacional del 2005 no recomienda su utilización rutinaria para la toma de decisiones36. Se han propuesto predictores de destete ventilatorio que incluyen la variabilidad del ritmo cardíaco, la calidad del sueño, la fuerza de agarre de la mano, la disfunción diafragmática y los marcadores de estrés oxidativo. Sin embargo, todos estos resultados aún necesitan validación en grupos más grandes de pacientes37-40.
Papel de la ecografía en la evaluación diafragmáticaLa ecografía diafragmática resulta ser una herramienta diagnóstica ampliamente utilizada, mínimamente invasiva y con bajos costos que permite la evaluación de las condiciones diafragmáticas en el paciente soportado con ventilación mecánica invasiva. Esta técnica requiere entrenamiento para la obtención de las ventanas ecográficas, y los estudios de ultrasonografía mostraron tener una buena correlación intra e interobservador. En la actualidad se cuenta con dos técnicas que permiten evaluar el diafragma: el engrosamiento y la excursión del diafragma41,42.
La utilidad de la ecografía para la evaluación de la cinética diafragmática fue reportada en 1975, cuando evidenció el movimiento de los órganos abdominales. Se han descrito diversas técnicas para el abordaje del diafragma, de manera tanto directa como indirecta, con las sondas ecográficas disponibles en los equipos. Los transductores de 6 a 13MHZ de frecuencia alta ofrecen mejor resolución para el estudio del engrosamiento diafragmático, mientras que los transductores de 2 a 6MHZ son más utilizados en el estudio de la excursión diafragmática43,44.
Excursión diafragmáticaPara la evaluación de la excursión diafragmática se puede utilizar el transductor convex 2-6MHz o el sectorial 2-5MHz. Existen tres abordajes diferentes:
- 1.
Abordaje subcostal anterior. Paciente posicionado en decúbito supino. Se ubica el transductor a nivel subcostal en la línea axilar anterior o medio-clavicular, orientando la sonda en dirección cefálica y posterior. De esta forma el rayo del ultrasonido alcanza la parte perpendicular del tercio posterior del hemidiafragma45.
- 2.
Abordaje subcostal posterior. Evalúa el diafragma con el paciente en posición sedente en posición supina. Se encuentra una limitante consistente en la dificultad de observar todo el diafragma en las bases cuando el pulmón se encuentra en la fase inspiratoria debido al «signo de la cortina»45.
- 3.
Abordaje subxifoideo. Se posiciona el paciente en decúbito supino y se ubica el transductor convex transversalmente por debajo de la apófisis xifoidea. Este abordaje es bastante útil y muy utilizado en pacientes longilíneos y en pacientes pediátricos, debido a que permite evaluar la excursión de ambos hemidiafragmas de manera simultánea (fig. 1).
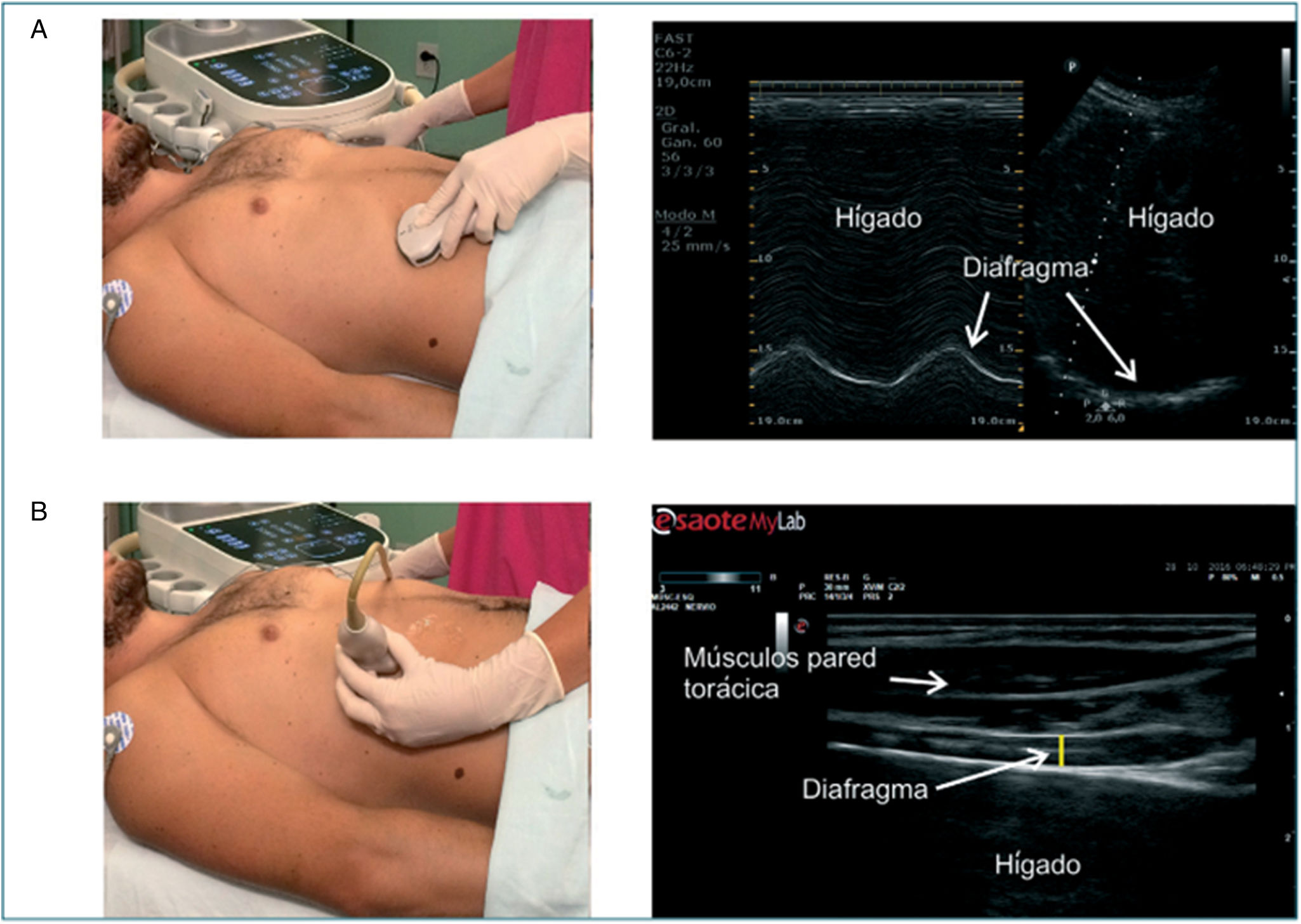
Figura 1.Abordaje ecográfico del diafragma. A)Se observa la posición del transductor convexo 2-6MHz en el abordaje subcostal anterior a la altura de la línea medio-clavicular; a la derecha, imagen ecográfica del diafragma en modoM yB examinando la excursión diafragmática. B)Escaneo del diafragma en línea axilar anterior a nivel del 8.°-9.° espacio intercostal con transductor lineal 6-13MHz; a la derecha, imagen ecográfica en modoB para evaluar el engrosamiento diafragmático.
Fuente: tomado de Acosta et al.45.
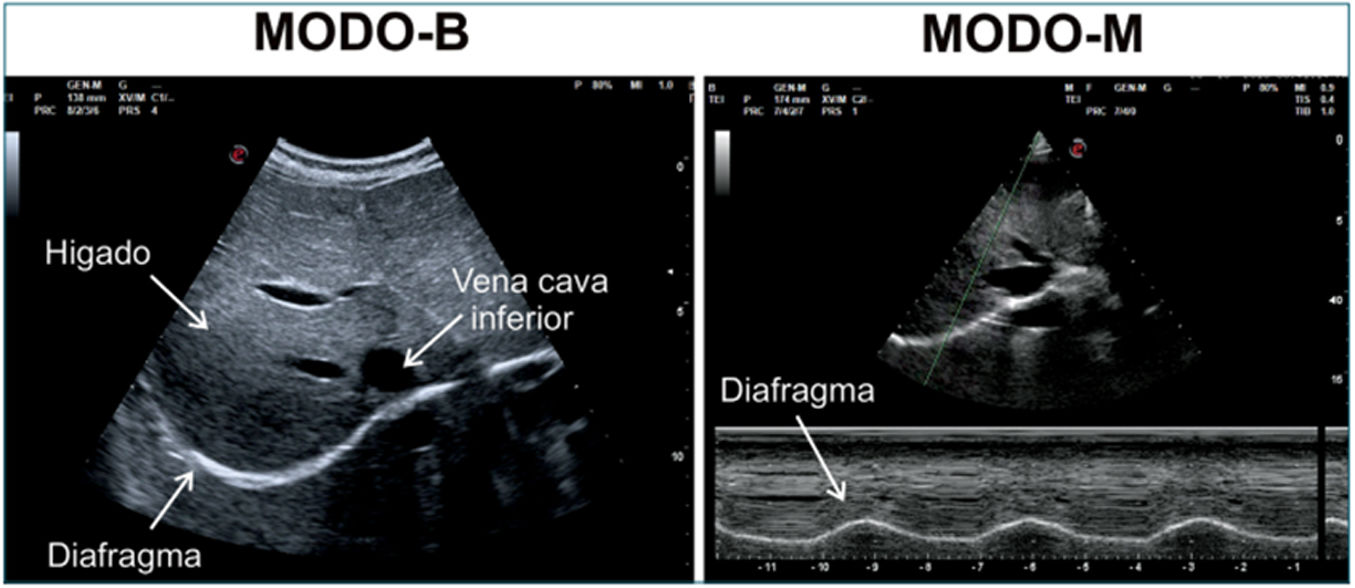
Cuando se emplea el ecógrafo en modoB, el diafragma se visualiza como una línea hipoecoica que se desplaza hacia y desde el transductor durante los movimientos respiratorios de inspiración y espiración. En modoM, este desplazamiento genera un patrón sinusoidal característico que refleja la cinética diafragmática durante el ciclo respiratorio (fig. 2).
Modos ecográficos para evaluar la cinética diafragmática. A la derecha, imagen obtenida usando la ventana acústica hepática, con transductor convex utilizando modoB; a la izquierda se observa el diafragma como una línea hiperecoica con movimiento sinusoidal, en modo M, con ascenso durante la inspiración y descenso en espiración.
Fuente: tomado de Acosta et al.45.
Generalmente es más fácil la visualización del diafragma derecho, debido a la excelente ventana acústica generada por el hígado. Por el contrario, la visualización ecográfica de la hemidiafragma izquierdo resulta más compleja, debido a la pobre ventana acústica que brinda el bazo y al aire contenido en la cámara gástrica.
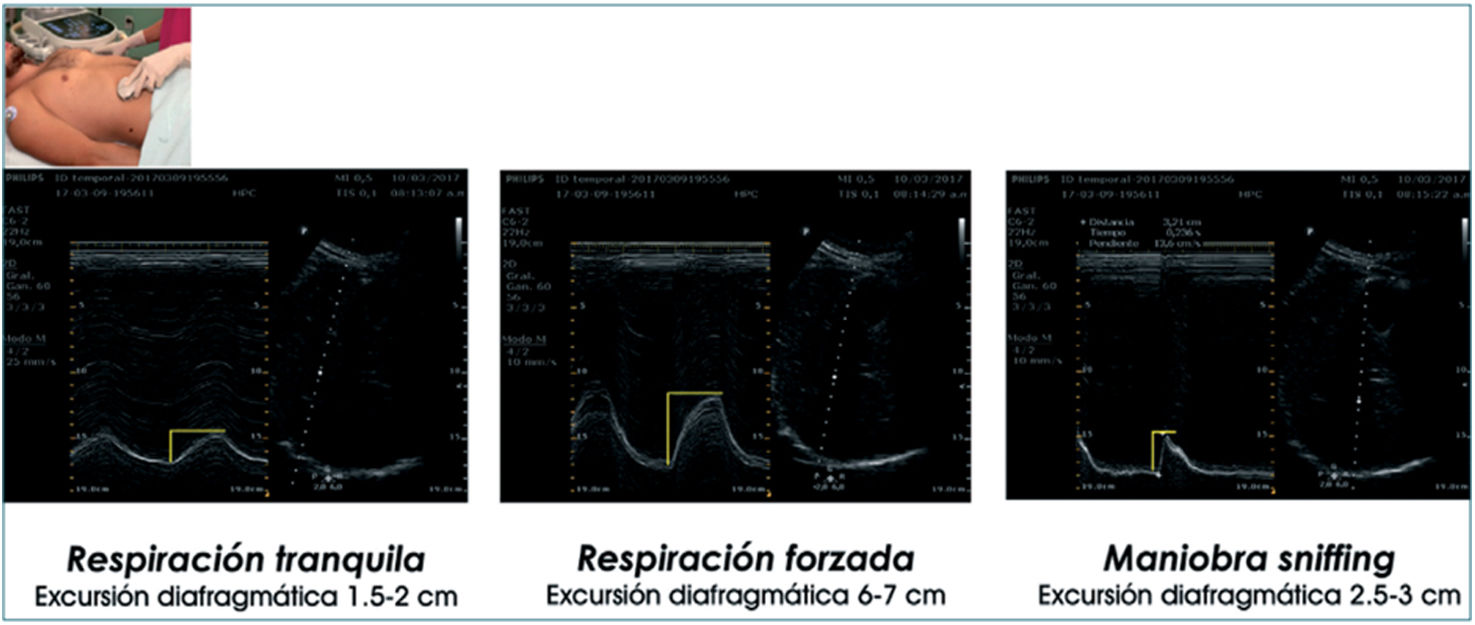
Para la evaluación de la excursión diafragmática es necesario obtener las ventanas ecográficas en tres momentos diferentes: durante la respiración tranquila o normal, durante una inspiración y espiración profunda, y durante la espiración rápida mediante la maniobra de sniff45. Esta última consiste en una inspiración rápida a través de la nariz con la boca cerrada, lo que permite valorar la fuerza contráctil del diafragma e identificar alteraciones como la parálisis diafragmática (fig. 3).
Evaluación de la excursión diafragmática. Excursión diafragmática utilizando la sonda convex 2-6MHz a nivel subcostal en línea medio-clavicular, en modoM yB, durante respiración tranquila, forzada y maniobra de sniffing.
Fuente: tomado de Acosta et al.45.
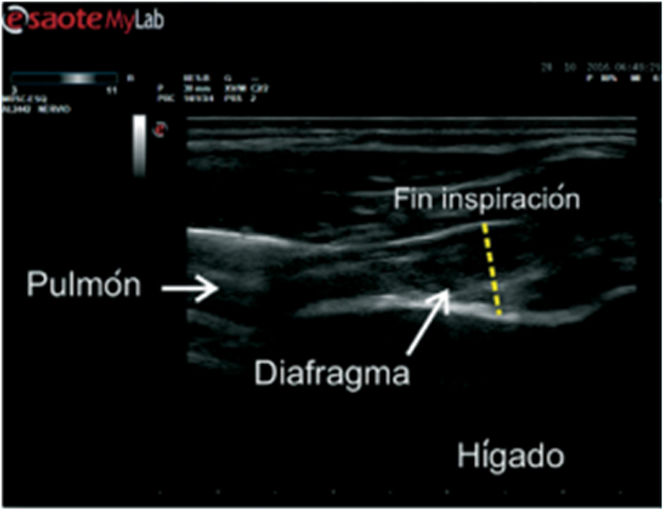
Para el correcto estudio del engrosamiento diafragmático se utiliza el transductor de alta frecuencia 6-12MHz, mediante el abordaje intercostal (fig. 4)46,47.
Abordaje intercostal del engrosamiento diafragmático.
Paciente en decúbito supino. El transductor lineal de alta frecuencia se posiciona en el 8.°-9.° espacio intercostal a nivel de la línea media axilar. En esta vista se identifican dos líneas hiperecogénicas: la más superficial corresponde a la pleura diafragmática, y la más profunda, al peritoneo. Entre ambas se encuentra una estructura hipoecoica que representa el músculo diafragmático. Durante la inspiración se observa un engrosamiento progresivo del diafragma, mientras que en la espiración se evidencia su adelgazamiento. Estos cambios pueden ser evaluados tanto en modoB como en modoM.
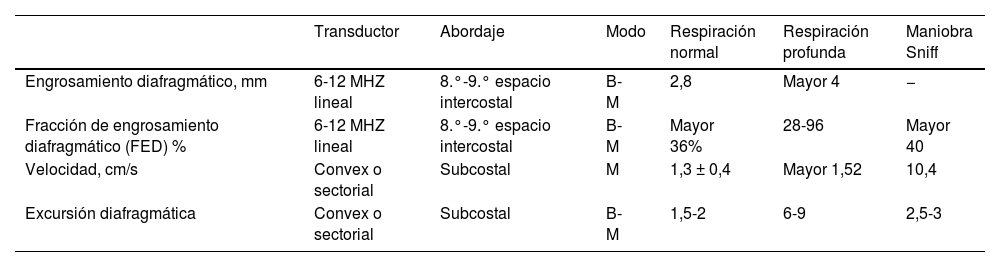
Los valores de referencia normales para la interpretación del grosor diafragmático al final de una espiración normal son de 2,2-2,8mm; durante una inspiración máxima pueden alcanzar 4mm o más, en tanto que valores <2mm indican atrofia diafragmática48 (tabla 1).
Valores de referencia en la evaluación diafragmática ecográfica en los diferentes abordajes
| Transductor | Abordaje | Modo | Respiración normal | Respiración profunda | Maniobra Sniff | |
|---|---|---|---|---|---|---|
| Engrosamiento diafragmático, mm | 6-12 MHZ lineal | 8.°-9.° espacio intercostal | B-M | 2,8 | Mayor 4 | − |
| Fracción de engrosamiento diafragmático (FED) % | 6-12 MHZ lineal | 8.°-9.° espacio intercostal | B-M | Mayor 36% | 28-96 | Mayor 40 |
| Velocidad, cm/s | Convex o sectorial | Subcostal | M | 1,3 ± 0,4 | Mayor 1,52 | 10,4 |
| Excursión diafragmática | Convex o sectorial | Subcostal | B-M | 1,5-2 | 6-9 | 2,5-3 |
Fuente: tomada y adaptada de Acosta et al.45.
El engrosamiento diafragmático se evalúa empleando fracción de engrosamiento diafragmático (FDE):
En la ventana subcostal, utilizando del modoM, es posible determinar la velocidad de contracción diafragmática, que se calcula mediante el cociente entre la excusión diafragmática durante la inspiración y el tiempo inspiratorio, y se expresa en cm/segundo. Durante una ventilación normal la velocidad de contracción diafragmática es de 1,5cm/s, mientras que valores <1cm/s son indicadores de disfunción diafragmática (tabla 1).
Recomendaciones de expertosLa evaluación del diafragma por ultrasonido se ha convertido en una herramienta necesaria para la evaluación del paciente con soporte ventilatorio invasivo. Algunos autores están a favor y otros en contra de la utilización de esta técnica para facilitar el proceso de destete ventilatorio y la extubación, y algunos estudios aseguran que la ecografía pleural facilita evaluar la variación del engrosamiento del diafragma en pacientes con soporte ventilatorio invasivo, estimar la función contráctil y la atrofia muscular diafragmática49.
Kaur et al.50, en la India, refieren que las técnicas ecográficas diafragmáticas son seguras, precisas y son confiables en pacientes que permanecen en la UCI. Grosu et al.51, en Estados Unidos, aseguran que la fracción de acortamiento diafragmático puede utilizarse para evaluar con precisión la variación del engrosamiento del diafragma en pacientes críticamente enfermos sometidos a ventilación mecánica invasiva, por lo que podría detectar fiablemente atrofia diafragmática y evaluar la función contráctil.
Por otra parte, Barbosa et al., en Brasil, expresan reservas respecto al uso de la fracción de engrosamiento diafragmático (TFdi) en pacientes con ventilación mecánica invasiva, y no recomiendan su aplicación rutinaria en este contexto. Argumentan que un aumento del grosor diafragmático no siempre refleja una mayor capacidad contráctil del músculo, ya que también puede observarse en ciertas patologías pleurales. La TFdi se calcula utilizando el ecógrafo en modoM mediante la siguiente fórmula:
TFdi (%)=[(Grosor al final de la inspiración−Grosor al final de la espiración)/Grosor al final de la espiración]×100.
En sujetos sanos, se considera un valor normal de TFdi por encima del 20%20,52-55.
Dubé et al.12, en Francia, mostraron una correlación fuerte entre la medición del cambio en la presión a nivel del tubo orotraqueal generada por la estimulación bilateral de los nervios frénicos y la fracción de engrosamiento pleural, y que es posible diagnosticar la disfunción diafragmática en pacientes hospitalizados en la UCI con soporte ventilatorio. Con respecto a la fracción de engrosamiento diafragmático, Grosu et al.51 plantean utilizarla solo para la valoración cualitativa de la actividad muscular inspiratoria.
Dubé et al.12 demostraron que hay una correlación positiva muy fuerte entre la fracción de acortamiento diafragmático y la medición del cambio en la presión a nivel del tubo orotraqueal generada por la estimulación bilateral de los nervios frénicos, y la ecografía diafragmática puede detectar disfunción diafragmática en el momento que el paciente tolera el cambio de modos controlados a modos espontáneos. Zhang et al.56, en China, asociaron la fracción de engrosamiento pleural con resultados clínicos, sugiriendo que una fracción de engrosamiento diafragmático <25,8% es buen predictor de falla en el destete.
Con respecto a la excursión diafragmática, debe limitarse exclusivamente a los pacientes que realicen respiraciones espontáneas. El valor normal en pacientes sanos es de 18±3mm en hombres y de 16±3mm en mujeres, y para el diagnóstico de disfunción diafragmática los valores van de 10 a 14mm en ventilación espontánea38,52. Farghaly y Hasan53, en Corea del Sur, evaluaron la excursión diafragmática y el engrosamiento diagramático en pacientes ventilados en modos espontáneos. Los valores de corte relacionados con extubación exitosa fueron >10,5mm para la excursión diafragmática, >21mm para el engrosamiento al final inspiración y >34,2% para la fracción de engrosamiento diafragmático, con una sensibilidad del 87,5%, del 77,5% y del 90%, respectivamente54.
En el contexto colombiano, Guzmán-David et al.57 realizaron un estudio observacional prospectivo en una UCI de cuarto nivel en Bogotá, en el cual evaluaron la pérdida de masa muscular mediante ecografía del recto femoral durante los primeros tres días de hospitalización crítica. Encontraron que el 58% de los pacientes presentaron una atrofia muscular significativa (≥10%) en solo 72horas, con una tasa de pérdida diaria entre el 1,78% y el 5%. Aunque no se hallaron asociaciones estadísticamente significativas con desenlaces como debilidad muscular respiratoria, días de ventilación mecánica ni mortalidad a 28días, los autores documentaron un riesgo clínicamente relevante de debilidad adquirida en la UCI (ICUAW) y debilidad de prensión en los pacientes con mayor atrofia muscular. Este hallazgo refuerza la utilidad de la ecografía como herramienta precoz de estratificación de riesgo, aplicable no solo a la evaluación de extremidades, sino también potencialmente a la monitorización del músculo diafragma, el cual desempeña un rol fundamental en el proceso de destete ventilatorio. La integración de la ecografía muscular en la práctica clínica diaria permite anticipar desenlaces adversos, planificar estrategias de rehabilitación, intervención nutricional, y tomar decisiones informadas en torno al retiro de la ventilación mecánica en pacientes con sarcopenia asociada al cuidado crítico.
ConclusiónLa disfunción diafragmática en el paciente críticamente enfermo, inducida por factores como la ventilación mecánica prolongada, la sepsis, el shock, la insuficiencia multiorgánica y la propia sarcopenia, constituye un determinante clave en la evolución clínica, con impacto directo sobre el tiempo de hospitalización en la UCI y el riesgo de mortalidad. La inactividad del diafragma durante el soporte ventilatorio promueve la atrofia de fibras musculares tipoI yII, disminuyendo su fuerza contráctil y comprometiendo de forma significativa la función respiratoria, particularmente en pacientes con sarcopenia establecida.
El manejo integral de estos pacientes debe ser liderado por un equipo multidisciplinario, compuesto por el médico intensivista, el personal de enfermería, los servicios de rehabilitación y nutrición, con el objetivo de reducir complicaciones y optimizar los tiempos de intervención. Estrategias fundamentales incluyen: evitar el uso innecesario o prolongado de sedantes y bloqueadores neuromusculares, controlar agresivamente la sepsis, y reducir el tiempo de ventilación mecánica mediante intervenciones individualizadas.
En este contexto, la ecografía diafragmática se posiciona como una herramienta clave para la toma de decisiones clínicas. La medición del grosor diafragmático y su fracción de engrosamiento, así como la evaluación de su excursión, permiten estimar de forma objetiva la probabilidad de éxito del destete ventilatorio y la extubación. Su naturaleza no invasiva y su aplicabilidad a la cabecera del paciente la convierten en una técnica ideal para ser incorporada de forma rutinaria en los protocolos de destete en la UCI en Colombia. Esta estrategia, además de orientar el retiro de la ventilación, permite monitorizar dinámicamente la función diafragmática, detectar de forma precoz la sarcopenia respiratoria y ajustar planes de rehabilitación y soporte nutricional en tiempo real.
FinanciamientoAutofinanciado.
Contribución de los autoresTodos los autores han contribuido en la concepción, la redacción de borrador, la redacción del manuscrito final, la revisión y la aprobación del manuscrito.
Conflicto de interesesLos autores no declaran conflicto de intereses.