Special Issue: Lecciones aprendidas del COVID-19
Más datosEl síndrome de dificultad respiratoria del adulto (SDRA) por el virus SARS-CoV-2 tiene una alta morbi-mortalidad secundaria al severo compromiso pulmonar sumado a una respuesta inmune disregulada, causal de una tormenta de citoquinas y disfunción orgánica. La membrana de oxigenación extracorpórea veno-venosa (ECMO V-V) es un soporte de rescate que ha demostrado efectividad en casos severos y refractarios de SDRA; no obstante, también puede generar una respuesta inflamatoria sistémica por el contacto de la sangre con la superficie extraña. Por estas razones las estrategias de purificación sanguínea, como la hemo-adsorción con CytoSorb, son una alternativa terapéutica frente una liberación exagerada de citoquinas. Se describe el caso de un paciente joven con SDRA severo y refractario por SARS-CoV-2 con necesidad de soporte ECMO, y posterior clínica de tormenta de citoquinas dada por hipotensión y disfunción multiorgánica, con necesidad de remoción extracorpórea de citoquinas con CytoSorb, con los cuales logró una estabilización clínica que permitió retiro del soporte extracorpóreo.
Adult respiratory distress syndrome (ARDS) due to the SARS-CoV-2 virus has high morbidity and mortality secondary to severe pulmonary involvement added to a dysregulated immune response that causes a cytokine storm and organ dysfunction. Veno-venous extracorporeal membrane oxygenation (VV ECMO) is a rescue support that has been demonstrating effectiveness in severe and refractory cases of ARDS; however, it can also generate a systemic inflammatory response due to the contact of blood with a foreign surface. For these reasons, blood purification strategies such as haeme adsorption with CytoSorb are a therapeutic alternative to an exaggerated release of cytokines. We describe the case of a young patient with severe and refractory ARDS due to SARS CoV-2 with the need for ECMO support, and subsequent symptoms of cytokine storm due to hypotension and multi-organ dysfunction, who required extracorporeal removal of cytokines with CytoSorb, with which he achieved clinical stabilization that allowed withdrawal of extracorporeal support.
Desde hace mucho tiempo se conoce que las citoquinas juegan un rol importante en la inmunopatología durante la infección viral. Una respuesta inmune innata rápida y bien coordinada es la primera línea de defensa frente a la infección viral. Sin embargo, si esta respuesta es excesiva y disregulada puede causar una lesión al organismo. Evidencia relevante de pacientes severamente enfermos por coronavirus humano sugiere que la respuesta proinflamatoria juega un papel protagónico en la patogénesis de la enfermedad1.
Los pacientes que desarrollan síndrome respiratorio agudo severo por COVID-19 (SARS-CoV-2) han incrementado las admisiones hospitalarias y a las UCI de manera global y, en este último escenario, la evidencia actual recomienda el inicio del soporte con membrana de oxigenación extracorpórea (ECMO) en pacientes que desarrollen síndrome de distrés respiratorio del adulto (SDRA) severo y refractario en centros con experiencia y experticia en dicho soporte extracorpóreo. Así lo soporta un reciente registro multicéntrico internacional de pacientes con SDRA relacionado con la COVID-19 en donde el uso del ECMO veno-venoso (V-V) en pacientes seleccionados obtuvo una sobrevida mayor a valores predichos2.
A pesar de sus beneficios, el inicio de soporte ECMO está asociado con una reacción inflamatoria inmediata y compleja, similar al síndrome de respuesta inflamatoria sistémica (SIRS). El complemento y los sistemas de contacto son activados como resultado de la interacción entre la sangre y los biomateriales3.
Los métodos de purificación sanguínea fueron usados para reducir los niveles de citoquinas durante la respuesta inflamatoria exuberante en pacientes sépticos, y parecen ser técnicas promisorias para la estabilización hemodinámica y de oxigenación. El dispositivo extracorpóreo de hemoadsorción de citoquinas CytoSorb (CytoSorbents Corporation, NJ, EE. UU.) ha sido diseñado para capturar y reducir directamente los mediadores inflamatorios de peso molecular medio (10-60 kDa), esto incluye citoquinas pro y antiinflamatorias, quemoquinas y exotoxinas bacterianas4.
A continuación, presentamos un caso clínico de la experiencia del uso del CytoSorb en un paciente en ECMO diagnosticado con SDRA secundario a SARS-CoV-2 con clínica de tormenta de citoquinas.
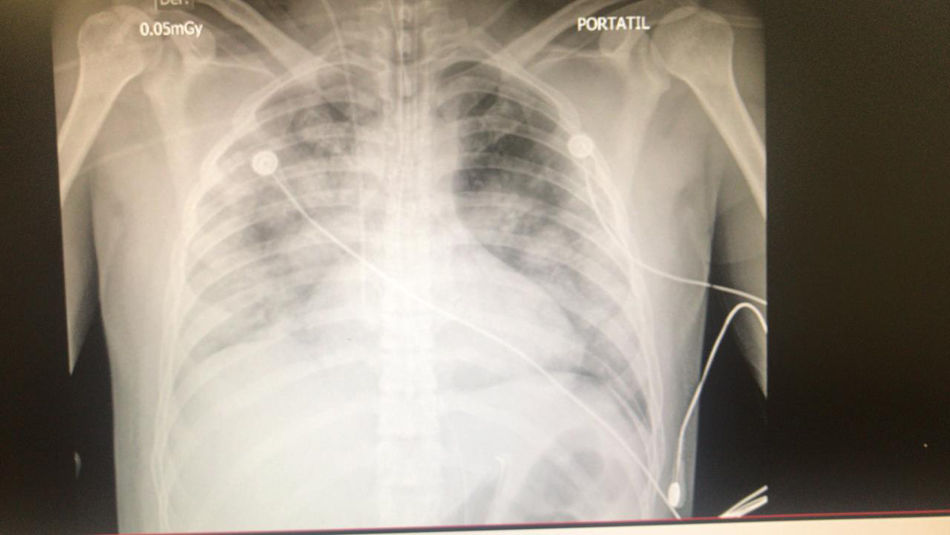
Reporte de casoPaciente masculino de 33 años, 70kg de peso y 1,67 m de estatura, con IMC de 25 y sin antecedentes de importancia, consultó por cuadro clínico de cinco días de fiebre de 39°C, más astenia, adinamia, y prueba por PCR SARS-CoV-2 positivo. Síntomas respiratorios con disnea que progresa a falla respiratoria con saturación de O2 de 53% al medio ambiente, 80% con máscara de no reinhalación y frecuencia respiratoria de 30, requiriendo intubación orotraqueal. La radiografía evidencia compromiso difuso con radiopacidades en los cuatro cuadrantes (fig. 1). A pesar del soporte mecánico ventilatorio invasivo, adecuada sedación y relajación neuromuscular, más posición prona, el paciente progresa a hipoxemia severa con índices de PaO2/FiO2 <de 80, sumado a un choque séptico con necesidad de doble soporte vasopresor. Debido al SDRA severo y refractario con puntaje de RESP (Respiratory ECMO Survival Prediction) de 6 y SOFA (Sequential Organ Failure Assessment) de 8, se consideró candidato a soporte ECMO. Se realizó canulación venosa femoro-yugular derecha en el sitio de remisión y una vez estabilizado en ECMO V-V se trasladó a un centro de referencia con unidad de soporte vital extracorpóreo (USVEC).
Durante los primeros cuatro días se logró estabilización clínica con metas adecuadas de oxigenación, ventilación y perfusión. Sin embargo, al quinto día el paciente presenta un nuevo deterioro hemodinámico con reinicio del soporte vasopresor respiratorio con necesidad de posición prona, elevación de reactantes de fase aguda y reagudización de la lesión renal (tabla 1) con necesidad de inicio de terapia de reemplazo renal continuo.
Variables clínicas y paraclínicas en función del tiempo donde se ve la mejoría inicial con el soporte ECMO y un segundo deterioro al quinto día que es resuelto con el inicio del CytoSorb
| Fecha | Día 0 | Día 1 | Día 4 | Día 5 | Día 6 | Día 7 | Día 8 | Día 10 | Día 11 | Día 15 | |
|---|---|---|---|---|---|---|---|---|---|---|---|
| 23-06-2020 | 23-06-2020 | 26-06-2020 | 27-06-2020 | 28-06-2020 | 29-06-2020 | 30-06-2020 | 02-07-2020 | 03-07-2020 | 07-07-2020 | ||
| Evento | Previo a ECMO | Canulado en ECMO | Canulado en ECMO | Deterioro hemodinámico y respiratorio | Inicio CytoSorb | CytoSorb no. 2 | CytoSorb no. 3 | Seguimiento | Decanulación de ecmo | Seguimiento | Unidades |
| Parámetros hemodinámicos | |||||||||||
| T° | 36 | 36 | 37,8 | 37,9 | 35 | 35 | 35,5 | 36,2 | 37,2 | 38 | °C |
| FC | 77 | 85 | 116 | 116 | 144 | 107 | 88 | 87 | 99 | 139 | lpm |
| PAM | 48 | 73 | 64 | 54 | 59 | 59 | 62 | 73 | 73 | 54 | mmHg |
| SO2 | 80 | 89 | 88 | 82 | 66 | 83 | 90 | 97 | 98 | 91 | % |
| GU | 0,3 | 3,7 | 2,3 | 1,7 | 0,6 | 0,4 | 0,5 | 1,3 | 1,4 | 1,2 | cc/kg/h |
| Soporte vasoactivo | |||||||||||
| Vasopresina | 4 | 0,5 | ––– | ––– | ––– | ––– | ––– | ––– | ––– | ––– | u/h |
| Noradrenalina | 0,6 | 0,15 | ––– | 0,07 | 0,4 | ––– | ––– | ––– | 0,1 | 0,2 | mcg/kg/min |
| Dobutamina | ––– | ––– | ––– | ––– | ––– | 2,5 | 2,5 | ––– | ––– | ––– | mcg/kg/min |
| Paraclínicos | |||||||||||
| Leucocitos | 14,5 | 16,1 | 12,3 | 13,7 | 14,1 | 17,5 | 14,5 | 10,1 | 18,7 | 16,9 | x 1.000/uL |
| Neutrófilos | 85,8 | 87,9 | 86,6 | 85,2 | 82 | 87,8 | 85,1 | 87,3 | 85,5 | 91,1 | % |
| Hb | 15,7 | 12,3 | 10,5 | 10,9 | 11,3 | 13,2 | 12,3 | 10,7 | 10 | 11,3 | g/dL |
| Plaquetas | 231 | 175 | 113 | 86 | 93 | 69 | 100 | 110 | 149 | 359 | x 1.000/uL |
| Creatinina | 1,1 | 1,7 | 1,9 | 2,3 | 2,2 | 1,9 | 1,5 | 1 | 1 | 1,5 | mg/dL |
| BUN | 8,7 | 19 | 30 | 44 | 55 | 46 | 31 | 24 | 30 | 53 | mg/dL |
| PCR | 267 | 290,3 | ––– | 353,9 | 378,6 | 421,7 | 233,4 | 54,5 | 32 | 170,6 | mg/L |
| Dímero D | 650 | ––– | ––– | 2.370 | 4.880 | 5.830 | 4.740 | 2.370 | 2.420 | 3.330 | ng/mL |
| LDH | 816 | ––– | ––– | 895 | 704 | 807 | 931 | 599 | 574 | 549 | u/L |
| Ferritina | 1.334 | ––– | ––– | 863 | 1.030 | 4.080 | 8.780 | 5.570 | 3.340 | 2.120 | ng/mL |
| TGO - AST | 137 | 74 | ––– | 83 | ––– | 54 | 63 | 126 | 143 | 153 | u/L |
| TGP - ALT | 101 | 55 | ––– | ––– | ––– | 48 | 39 | ––– | 89 | ––– | u/L |
| INR | 0,88 | 0,95 | 0,93 | ––– | 1,1 | ––– | 1,23 | 1,27 | 1,14 | ––– | |
| PTT | 30,2 | 100,6 | 35,6 | 36,8 | 38,9 | 71,7 | 104,2 | 43,2 | 36,6 | ––– | seg |
| Gases arteriales | |||||||||||
| pH | 7,24 | 7,42 | 7,47 | 7,45 | 7,42 | 7,44 | 7,49 | 7,51 | 7,46 | 7,41 | |
| PaO2 | 66,3 | 53,9 | 53,5 | 50,2 | 62,5 | 48,7 | 60,4 | 75,3 | 77,9 | 86,8 | mmHg |
| PaCO2 | 55,3 | 33,8 | 36,5 | 42,1 | 42,6 | 35 | 32,9 | 30,9 | 32 | 37,4 | mmHg |
| HCO3 | 23,2 | 21,9 | 26 | 28,9 | 26,5 | 23,7 | 24,9 | 24,4 | 22,6 | 23,2 | mEq/L |
| SaO2 | 80 | 87,8 | 87,2 | 82,8 | 90,7 | 84 | 90,9 | 80,5 | 94,5 | 96 | % |
| PaO2/FiO2 | 73 | 154 | 133,7 | 125,5 | 156 | 69 | 151 | 251 | 194,7 | 178,6 | |
| B,E, | –5,4 | –1,9 | 2,5 | 4,5 | 1,6 | 0,3 | 2,1 | 2,1 | –0,5 | –1,0 | |
| Lactato | 1,84 | 1,91 | 1,06 | 1,27 | 1,18 | 1,9 | 1,45 | 1,59 | 2,5 | 2,0 | mmol/L |
PAM: presión arterial media; GU: gasto urinario; Hb: hemoglobina; BUN: nitrógeno ureico sanguíneo; PCR: proteína C reactiva; LDH: deshidrogenasa láctica; TGO: transaminasa glutámico oxaloacética; AST: aspartato aminotrasferasa; TGP: transaminasa glutámico pirúvica; ALT: alanino aminotrasferana; INR: international normalized ratio; BE: base exceso.
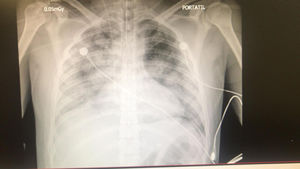
En ausencia de infección documentada microbiológicamente, se consideró a la tormenta de citoquinas como la causal del deterioro, por lo que se inició filtro de remoción de citoquinas CytoSorb. Aprovechando el inicio del soporte renal extracorpóreo por medio de Prismaflex (Baxter Healthcare Corporation, Deerfield, IL, EE. UU.), se realizó una conexión secuencial del circuito del ECMO al filtro de CytoSorb y al filtro de la hemodiafiltración (fig. 2). La línea de entrada del flujo sanguíneo del ECMO al CytoSorb se realizó a través del circuito post membrana (presión positiva); del filtro del CytoSorb el flujo sanguíneo pasó al filtro renal y de este la línea de retorno al ECMO por el circuito pre centrífuga (presión negativa). Después de tres sesiones por tres días consecutivos, la respuesta favorable resolvió el choque, moduló el SIRS y estabilizó los índices de oxigenación, lo que permitió el retiro y decanulación del ECMO después de 11 días de soporte de manera exitosa (tabla 2). A pesar de una evolución favorable, el paciente desarrolló un choque séptico ocho días más tarde y falleció.
Variables mecánicas y de los circuitos extracorpóreos. Parámetros ventilatorios y programación de los circuitos de ECMO y CytoSorb
| Fecha | Día 0 | Día 1 | Día 4 | Día 5 | Día 6 | Día 7 | Día 8 | Día 10 | Día 11 | Día 15 | |
|---|---|---|---|---|---|---|---|---|---|---|---|
| 23-06-2020 | 23-06-2020 | 26-06-2020 | 27-06-2020 | 28-06-2020 | 29-06-2020 | 30-06-2020 | 02-07-2020 | 03-07-2020 | 07-07-2020 | ||
| Evento | Previo a ECMO | Canulado en ECMO | Canulado en ECMO | Deterioro hemodinámico y respiratorio | Inicio CytoSorb | CytoSorb no, 2 | CytoSorb no, 3 | Seguimiento | Decanulación de ECMO | Seguimiento | Unidades |
| Parámetros ventilatorios | |||||||||||
| MODO | V/C | P/C | P/C | P/C | P/C | P/C | P/C | P/C | P/C | P/C | |
| PIP | ––– | 18 | 20 | 20 | 22 | 24 | 24 | 20 | 20 | 20 | cmH2O |
| V Cte | 440 | 300 | 240 | 170 | 40 | 120 | 230 | 420 | 390 | 400 | ml |
| PEEP | 12 | 12 | 12 | 12 | 12 | 10 | 10 | 10 | 10 | 8 | cmH2O |
| FR | 20 | 12 | 12 | 12 | 12 | 12 | 12 | 12 | 12 | 12 | rpm |
| FiO2 | 90 | 35 | 40 | 40 | 40 | 70 | 40 | 30 | 40 | 50 | % |
| Mecánica ventilatoria | |||||||||||
| °P Pico | 36 | 31 | 33 | 31 | 36 | 32 | 36 | 32 | 33 | 30 | cmH2O |
| °P Plateau | 30 | ––– | ––– | ––– | ––– | ––– | ––– | ––– | ––– | ––– | cmH2O |
| Driving Pressure | 18 | 19 | 21 | 19 | 24 | 22 | 26 | 22 | 14 | 22 | cmH2O |
| Distensibilidad | 24 | 16 | 15 | 15 | 16 | 17 | 16 | 15 | 14 | 17 | |
| Parámetros ECMO | |||||||||||
| Flujo de Bomba | ––– | 4,1 | 4,9 | 5,5 | 5,3 | 5,4 | 4,9 | 4,1 | 3,9 | ––– | L/min |
| RPM | ––– | 5.000 | 5.000 | 5.000 | 5.500 | 5.400 | 4.900 | 4.300 | 4.000 | ––– | rpm |
| Sweep Gas | ––– | 2 | 4 | 5 | 6 | 8 | 5 | 4 | 0 | ––– | L/min |
| FdO2 | ––– | 100 | 100 | 100 | 100 | 100 | 100 | 100 | 21 | ––– | % |
| Dosis Heparina | ––– | ––– | 800 | 1.000 | 1300 | 1.600 | 1.300 | 200 | 200 | ––– | u/h |
| Parámetros trrc | |||||||||||
| Dispositivo | ––– | ––– | ––– | ––– | Prismaflex | Prismaflex | Prismaflex | ––– | ––– | ––– | |
| Sitio | ––– | ––– | ––– | ––– | ECMO | ECMO | ECMO | ––– | ––– | ––– | |
| Modo | ––– | ––– | ––– | ––– | HDFVVC | HDFVVC | HDFVVC | ––– | ––– | ––– | |
| Flujo de Bomba | ––– | ––– | ––– | ––– | 300 | 300 | 300 | ––– | ––– | ––– | ml/min |
| Dosis de Diálisis | ––– | ––– | ––– | ––– | 25 | 25 | 25 | ––– | ––– | ––– | ml/kg/h |
PIP: presión inspiratoria positiva; V Cte: volumen corriente; PEEP: positive end expiratory pressure; °P: presión; RPM: revoluciones por minuto; Sweep gas: gases frescos; FdO2: fracción entregada de oxígeno; ECMO: extracorporeal membrane oxigenation; HDFVVC: hemodiafiltración veno venosa continua.
La respuesta del huésped no es sólo un proceso instantáneo local, donde células endoteliales y leucocitos están involucrados. En general, las infecciones pueden provocar daño no sólo como consecuencia de la virulencia del patógeno. Los patrones moleculares asociados a patógeno (PAMP) o asociados a daño (DAMP) del sistema inmune innato son activados al unirse a los receptores de reconocimiento de estos patrones (PRR), resultando en una liberación de citoquinas inflamatorias. La liberación de citoquinas induce la liberación y producción de más citoquinas, lo que agrava la lesión celular y orgánica, y puede generar un círculo vicioso también conocido como la «tormenta de citoquinas»1.
El SDRA es la principal causa de muerte en pacientes infectados con SARS-CoV-2. Actualmente se sabe que varias citoquinas proinflamatorias (IL-6, IL-8, IL-1β, factor estimulante de colonias de granulocitos-macrófagos y especies reactivas de oxígeno) y quimiocinas (como CCL2, CCL-5, proteína 10 inducida por IFNγ [IP-10] y CCL3) contribuyen a la aparición de SDRA. Estos resultados soportan que después de la infección por SARS-CoV-2, los altos títulos de virus y la disregulación de la respuesta de citoquinas/quimiocinas causan una tormenta de citoquinas inflamatorias, la cual a su vez se acompaña de cambios inmunopatológicos en los pulmones1.
El soporte ECMO veno-venoso, al proveer una óptima oxigenación sanguínea, una eliminación del CO2 unido a una ventilación protectora, se ha beneficiado de avances tecnológicos importantes en los últimos 15 años, con lo que ha demostrado una mejoría de la sobrevida en pacientes seleccionados con SDRA antes y después de la COVID-192,5.
A pesar de la adopción generalizada de las técnicas de soporte vital extracorpóreo, el uso del ECMO continúa asociado a una morbi-mortalidad significativa, en gran parte debido a la reacción inflamatoria compleja causada por la activación de cascadas inflamatorias y de coagulación al momento que la sangre entra en contacto con una superficie extraña. Niveles de citoquinas proinflamatorias se incrementan rápidamente, las cuales, en asociación con la activación de los sistemas de complemento y de contacto, resulta en activación leucocitaria. Si esta respuesta inmune innata es severa, persistente o no controlada por una respuesta anti-inflamatoria compensadora (CARS), puede llevar a lesión endotelial, disrupción de la microcirculación y a disfunción orgánica4.
La vía alterna del complemento es la responsable primaria de producir anafilotoxinas C3a y C5a y el complejo de ataque de membrana (MAC). Esto ocurre como resultado del incremento de la hidrólisis de C3 en la superficie del biomaterial. El sistema de contacto es el responsable de la producción de factor XII activado (FXIIa), el cual induce la vía intrínseca de la coagulación, llevando a la formación de trombos. Los productos de cada uno de estos sistemas promueven más producción de citoquinas proinflamatorias y tienen diferentes efectos en los leucocitos, plaquetas y el endotelio vascular. En particular, los neutrófilos son activados, llevan a infiltración neutrofílica del tejido y eventual lesión orgánica4.
El modelo detrás de las técnicas de purificación sanguínea consiste en el «modelo citoquinético»: esto significa incrementar el gradiente de concentración de citoquinas desde el plasma al tejido infectado removiendo mediadores inflamatorios de la sangre. Esta reconstitución de gradiente de citoquinas es seguida por el tráfico de leucocitos al foco infeccioso, resultando en un incremento de la depuración bacteriana local4.
El CytoSorb fue aprobado en Europa en el 2011 y actualmente puede ser usado como terapia sola o en combinación de circuitos extracorpóreos, como la terapia de reemplazo renal continuo, circulación extracorpórea y ECMO. La tecnología se basa en cadenas de polímero biocompatible y poroso capaces de capturar mediadores inflamatorios a través de exclusión por tamaño y adsorción no específica. Esta tecnología ha mostrado una rápida eliminación de citoquinas in vitro e in vivo en modelos animales sépticos donde se ha demostrado la habilidad del CytoSorb en depurar citoquinas en sangre y mejorar sobrevida4. Dentro de los estudios observacionales, una cohorte internacional de 198 pacientes, en su mayoría sépticos, la hemoadsorción con CytoSorb se asoció con un descenso de los niveles de IL-6 y a una mortalidad más baja a la predicha6. Sin embargo, sólo un ensayo clínico aleatorizado que evaluó la eficacia en sepsis con 97 pacientes con choque séptico y lesión pulmonar aguda o SDRA aleatorizados al manejo estándar o a hemoadsorción con CytoSorb seis horas al día durante un máximo de siete días consecutivos, no evidenció diferencias en niveles de IL-6 (desenlace primario) ni mejoría en los puntajes de disfunción orgánica múltiple7.
La evidencia de CytoSorb en pacientes bajo soporte extracorpóreo es escasa y de predominio en series de casos, la mayor de estas con 23 pacientes con ECMO veno arterial, donde el CytoSorb se asoció a una disminución de los niveles de citoquinas y una reducción de la vasoplegia al reducir el soporte vasopresor, de manera segura y sin eventos adversos8. En pacientes con SDRA tratados con ECMO veno venoso, nueve pacientes con CytoSorb fueron comparados con nueve pacientes controles mediante puntaje de propensión. Aunque el puntaje RESP (Respiratory ECMO Survival Prediction) predijo una mortalidad más alta en el grupo de adsorción de citoquinas, la mortalidad fue menor en este grupo comparado con el grupo de solo ECMO V-V. La necesidad de reanimación hídrica y soporte vasopresor, así como los niveles de lactato, disminuyeron significativamente a las 72 horas en el grupo de adsorción de citoquinas. Estos datos sugieren que la remoción de citoquinas mediante CytoSorb puede ser benéfica en pacientes con SDRA severo que requieren soporte ECMO V-V9.
Nuestro paciente progresó a un SDRA severo y refractario, por lo que requirió soporte ECMO V-V, y posteriormente desarrolló un curso clínico compatible con tormenta de citoquinas, para lo cual requirió hemoadsorción con CytoSorb, con lo que se logró una adecuada respuesta clínica inicial.
La principal limitante y aprendizaje para el futuro fue el desenlace fatal del paciente, dado que genera interrogantes sobre la oportunidad, así como la intensidad y duración del soporte con CytoSorb.
Teniendo en cuenta al CytoSorb como un soporte extracorpóreo complejo e innovador con beneficio teórico, in vitro y en desenlaces menores, pero sin evidencia científica fuerte, son necesario estudios con evidencia científica más robusta que permita una adecuada selección del paciente según severidad y temporalidad.
ConclusiónFrente a la elevada morbi-mortalidad del SDRA por SARS-CoV-2 es cada vez más frecuente el soporte ECMO, así como la respuesta inflamatoria inmune exagerada por la tormenta de citoquinas, por lo que técnicas hemoadsortivas como el CytoSorb son alternativas terapéuticas razonables en la resolución de la disfunción orgánica secundaria. En quién y el cuándo son aún interrogantes que requieren futuras investigaciones clínicas.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Pacientes de la Fundación Clínica Shaio.