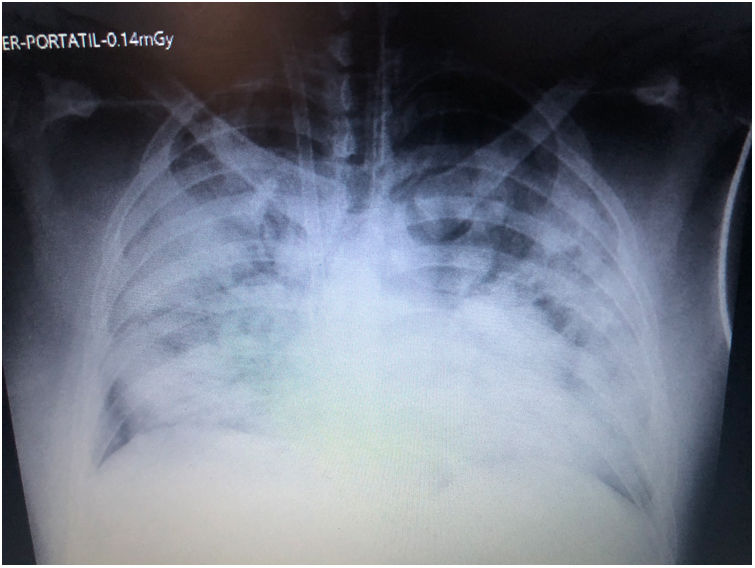
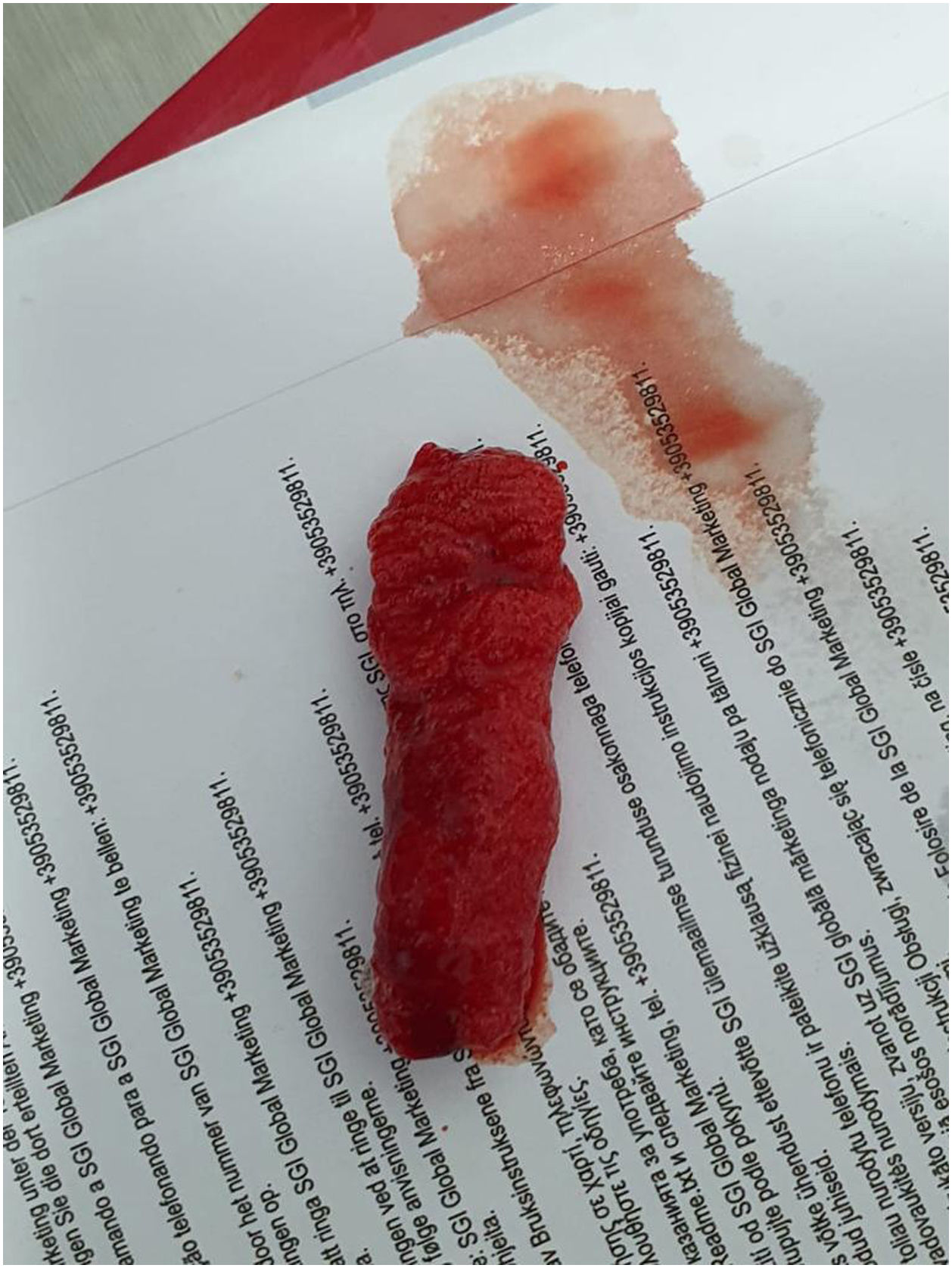
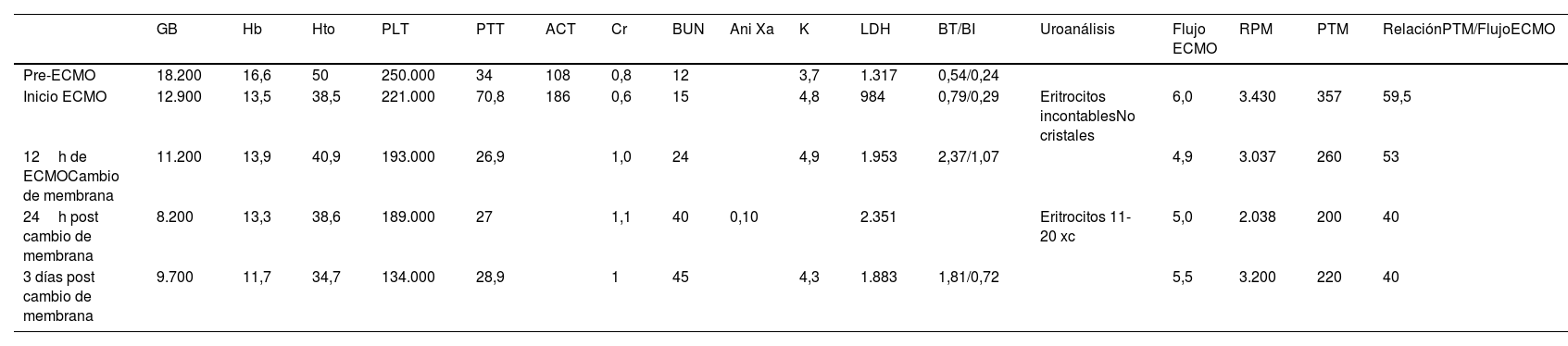
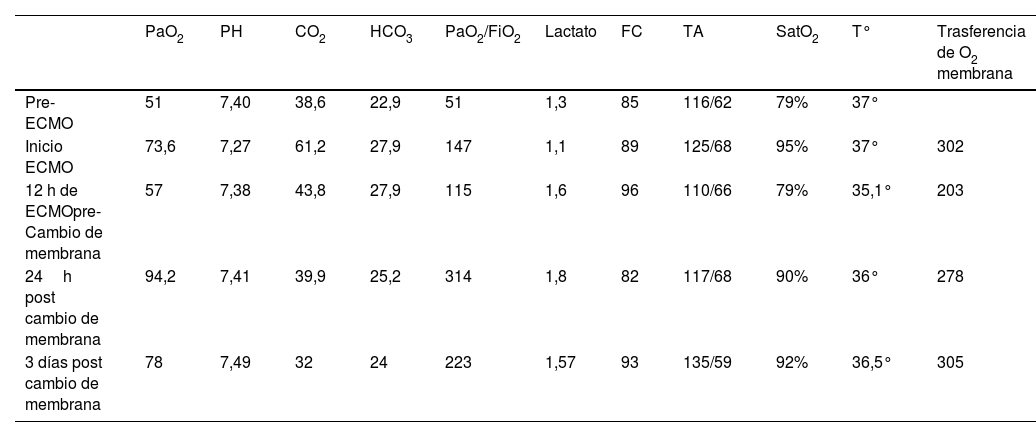
El uso de la oxigenación con membrana extracorpórea (ECMO) en pacientes con falla respiratoria ha demostrado mejoría en desenlaces clínicos. A pesar de los avances tecnológicos, se presentan complicaciones relacionadas con los dispositivos, entre ellas la hemólisis secundaria a exageradas fuerzas de cizallamiento generadas por los flujos sanguíneos a través del circuito. Las causas principales se asocian a trombosis del cono de la centrífuga o RPM (revoluciones por minuto) inadecuadamente elevadas. Sin embargo, la membrana de oxigenación también debe ser considerada como agente etiológico. Se describe un caso de un paciente joven con SDRA severo y refractario por SARS-CoV-2 con necesidad de soporte ECMO, el cual desarrolló un cuadro clínico temprano de hemólisis aguda severa por disfunción de la membrana. La hemólisis resolvió con el cambio de la misma, con posterior evolución favorable del paciente.
The use of extracorporeal membrane oxygenation (ECMO) in patients with respiratory failure has demonstrated improvement in clinical outcomes. Despite technological advances, complications related to the devices occur, including hemolysis secondary to exaggerated shear forces generated by blood flows through the circuit. The main causes are associated with thrombosis of the centrifuge cone or inappropriately high RPM (revolutions per minute). However, the oxygenation membrane must also be considered as an etiological agent. We describe a case of a young patient with severe and refractory ARDS due to SARS-CoV-2 in need of ECMO support, who developed an early clinical picture of severe acute hemolysis due to membrane dysfunction. The hemolysis resolved with its change with subsequent favorable evolution of the patient.
Artículo
Socios de la Asociación de Medicina Crítica y Cuidado Intensivo
Para acceder a la revista
Es necesario que lo haga desde la zona privada de la web de la AMCI, clique aquí