La talla baja es el principal motivo de consulta en endocrinología pediátrica, precisando en ocasiones tratamiento con hormona de crecimiento.
ObjetivoEvaluar la relación de los factores de buena respuesta al tratamiento con hormona de crecimiento durante el primer año con la respuesta final y valorar si existen diferencias según el tipo de déficit.
Pacientes y métodosEstudio longitudinal, retrospectivo y observacional en 139 pacientes tratados por déficit de hormona de crecimiento idiopático (severo o parcial) hasta talla adulta. Criterios de buena respuesta en el primer año de tratamiento: a) incremento velocidad de crecimiento≥3cm/año, b) velocidad de crecimiento≥1 desviación estándar (DE), c) incremento talla≥0,5 DE, d) incremento talla≥0,3 DE. Estudio del índice de repuesta al tratamiento al primer y segundo año. Variables de respuesta final: talla adulta, talla adulta respecto a talla genética, talla adulta respecto al pronóstico de crecimiento inicial y talla adulta respecto a talla al inicio del tratamiento.
ResultadosEl tratamiento produce una ganancia de talla adulta con respecto a la talla genética de 0,06±0,7 DE. Los pacientes buenos respondedores el primer año de tratamiento presentaron una mejor respuesta final (velocidad de crecimiento≥3cm, p=0,000; velocidad de crecimiento≥1 DE, p=0,008; ganancia talla≥0,5 DE, p=0,007; ganancia talla≥0,3 DE, p=0,006), así como los pacientes con déficit severo (p=0,04). El índice de respuesta al tratamiento al primer año asocia una mejor respuesta final (r=0,249; p=0,003), manteniéndose el segundo año (r=0,294; p=0,01).
ConclusionesEl tratamiento con hormona de crecimiento alcanza la talla genética. El porcentaje de buenos respondedores varía según el criterio. La respuesta al primer año de tratamiento y un déficit severo son factores determinantes para conseguir una buena respuesta final.
Short stature is the most frequent reason for Pediatric Endocrinology consultations and sometimes requires treatment with growth hormone.
ObjectiveThe possible correlation of a good response to any early response factor with a better final response was studied, and also whether there was a difference in response to treatment according to the type of deficit.
Patients and methodsThis was a longitudinal, retrospective and observational study of 139 patients treated for idiopathic growth hormone deficiency up to adult height. There were good response criteria in the first year of treatment: a) an increase in growth rate≥3cm / year, b) a growth rate≥1 standard deviation (SD), c) an increase in height≥0.5 SD, d) an increase in height≥0.3 SD. Study of the Index of Responsiveness to treatment in the first and second year. Final response variables: adult height with respect to target height, adult height with respect to initial growth prediction and adult height with respect to initial height at the start of treatment. The possible correlation of a good response to any of the early response factors with a better final response to treatment was studied, and also whether there was a difference in the response to treatment according to the type of deficit.
ResultsThe treatment produced a gain in adult height with respect to genetic height of 0.06±0.7 SD. Patients considered good responders in the first year of treatment presented a better final response (growth rate≥3cm: p=0.000, growth rate≥1 SD: p=0.008, height gain≥0.5 SD: P=0.007, height gain≥0.3 SD: P=0.006), as well as patients with a severe deficit (P=0.04). The index of responsiveness to treatment during the first year was associated with a better final response (r=0.249, P=0.003), with this correlation being maintained in the second year (r=0.294, P=0.01).
ConclusionsGrowth hormone treatment increased height in the genetic target. The percentage of good responders varied depending on the criteria used. The response in the first year of treatment and a severe deficit were determining factors for achieving a good long-term response.
La talla baja es el motivo de consulta más frecuente en las consultas de endocrinología pediátrica1. Se considera talla baja aquella menor de −2 desviaciones estándar (DE) de la media de la población de referencia para igual edad y sexo2. Según esta definición, la talla baja afecta a un 2,3% de la población, y a menudo es causa de un estrés importante en el niño en crecimiento y en su familia3. La probabilidad de que una talla baja sea patológica va a depender, entre otras cosas, de la severidad de la misma. Se calcula que solo 1 de cada 10 pacientes con talla entre −2 y −3 DE presentan causas orgánicas, mientras que en aproximadamente el 58% de los pacientes con talla menor a −3 DE se encuentra una causa orgánica1.
El déficit de hormona del crecimiento (GH) supone una causa importante de talla baja en la infancia. Su diagnóstico se basa en la sintomatología, criterios auxológicos y estudios endocrinológicos. Está ampliamente demostrada la importancia de un diagnóstico y tratamiento precoz del déficit de GH (DGH) debido a su influencia en el adecuado desarrollo neurológico, metabólico y auxológico4.
La hormona de crecimiento humana recombinante (rhGH) está disponible como terapia sustitutiva desde 1985, reemplazando al uso de la GH derivada de la hipófisis humana debido al riesgo de contaminación con el prión Jakob Creutzfeld. El objetivo principal del tratamiento con rhGH en estos pacientes es normalizar la talla durante la infancia y la adolescencia y alcanzar una talla adulta (TA) dentro del rango normal y acorde con su talla genética (TG), minimizando los riesgos del tratamiento y empleando el menor coste posible5. La rhGH, al igual que otros tratamientos, supone un gasto importante para el sistema sanitario que ha disminuido en los últimos años; aún así sería beneficioso definir factores predictores de respuesta para optimizar la eficacia del tratamiento. Este hecho justifica la necesidad de estudios a largo plazo con rhGH, para proveer a los clínicos la información necesaria para elegir qué pacientes podrían beneficiarse más del tratamiento sin riesgos a largo plazo6.
Diferentes ensayos clínicos demuestran la eficacia del tratamiento con rhGH para que estos niños consigan un crecimiento recuperador2. Se cree que una adecuada respuesta al tratamiento en el primer año es primordial, ya que es determinante para conseguir una adecuada ganancia de talla en los años posteriores, y se correlaciona con el resultado de la talla final7. No obstante, existe una importante variabilidad en la respuesta a dicho tratamiento, de manera que no todos los pacientes obtienen el mismo grado de beneficio.
Por tanto, tomando como hipótesis que la variabilidad de respuesta puede ser debida a la causa idiopática del DGH, que probablemente engloba otras entidades, nos planteamos como objetivo del estudio valorar la eficacia del tratamiento en la TA en el DGH, analizar la relación con la respuesta al mismo en el primer año, y con el índice de respuesta al primer y segundo año. Además, estudiar si existe diferencia en la respuesta al tratamiento en función del tipo de DGH (severo o parcial).
Pacientes y métodosPoblación a estudioSe trata de un estudio longitudinal, retrospectivo y observacional con pacientes controlados en consultas de Endocrinología Infantil de un hospital terciario, nacidos entre 1989 y 2004, y que habían sido tratados por DGH idiopático.
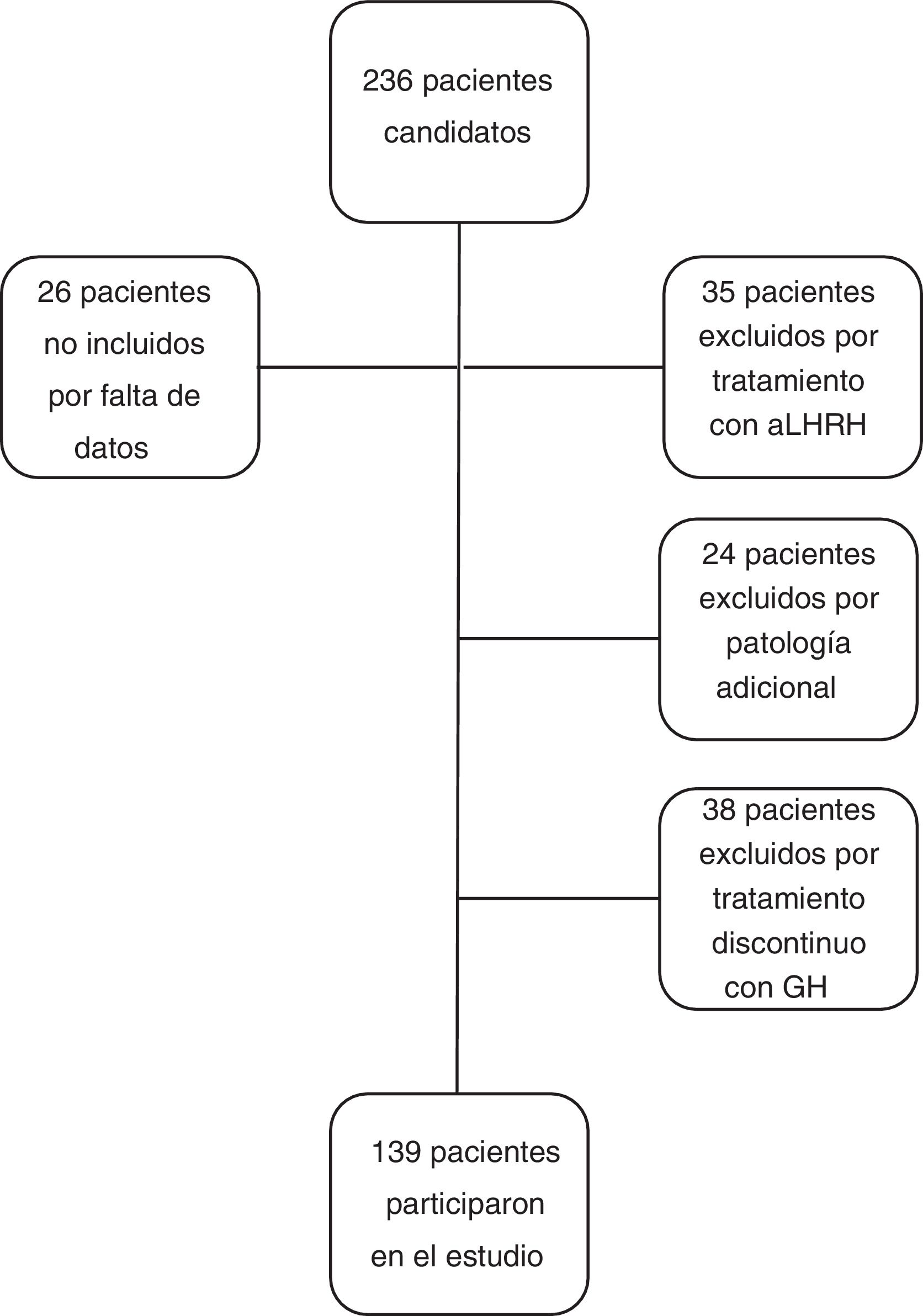
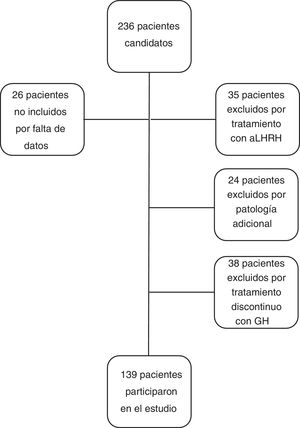
Los criterios de inclusión en el estudio fueron: pacientes con talla menor de −2 DE para la edad y sexo al diagnóstico de DGH, con cifra de GH<10ng/ml en 2 test de estímulo de GH, que recibieron tratamiento con GH a dosis sustitutivas durante al menos un año y que alcanzaron la casi-TA. Se considera casi-TA cuando el ritmo de crecimiento es<0,5cm/año y la edad ósea es de 15 años en mujeres o de 17 años en varones. Se ha utilizado este concepto en el estudio cuando se hace referencia a la TA ya que los pacientes fueron dados de alta antes de alcanzar la TA final. Los criterios de exclusión del estudio fueron: pacientes con DGH de etiología orgánica, con patología adicional que pudiera condicionar el crecimiento y pronóstico de talla (cáncer, cardiopatías congénitas, parálisis cerebral infantil, síndromes o cromosomopatías), pacientes que habían recibido tratamiento concomitante con análogos de hormona liberadora de la hormona luteinizante, pacientes diagnosticados de DGH con un único test de estímulo, o pacientes que recibieron tratamiento con rhGH de manera discontinua, excluyéndose del estudio un total de 97 pacientes (n=97), siendo el grupo final de estudio de 139 pacientes (n=139). No se excluyó a ningún paciente por mala respuesta o efectos adversos al tratamiento (fig. 1).
Recolección de datos a estudioLas variables estudiadas fueron las siguientes: 1) antecedentes genéticos: talla materna, talla paterna y TG; 2) antecedentes perinatales: tipo de gestación, edad gestacional al nacimiento, tipo de parto, patología perinatal asociada y antropometría neonatal; 3) antropometría durante el seguimiento: peso, talla, índice de masa corporal; 4) variables durante el seguimiento: velocidad de crecimiento (VC), edad ósea, pronóstico de crecimiento (PC) y TA; 5) resultados analíticos: estudio del eje GH-IGF (pico máximo de GH tras test de estímulo), factor de crecimiento insulínico tipo 1, proteína transportadora 3 del factor de crecimiento similar a la insulina, 6) tratamiento: dosis de rhGH en mcg/kg/día.
Las variables talla, peso e índice de masa corporal fueron calculadas y expresadas en valor absoluto y en DE según los Estudios Españoles de Crecimiento 20108. La variable VC fue expresada en valor absoluto y en DE según los Estudios Españoles de Crecimiento 20089. Para el cálculo de la edad ósea se utilizó el atlas radiográfico de maduración ósea de Greulich y Pyle10 y se calculó el pronóstico de TA basado en la talla y la edad ósea, por el método de Bayley-Pinneau11. Todas las variables estudiadas fueron evaluadas un año antes, al inicio del tratamiento con rhGH y anualmente hasta alcanzar la casi-TA.
Se analizaron los siguientes criterios, propuestos por Bang et al.12 y considerados de buena respuesta el primer año de tratamiento:
- a)
Incremento (Δ) de la VC≥3cm/año al primer año.
- b)
VC≥1 DE al primer año.
- c)
Δ de talla≥0,5 DE al primer año.
- d)
Δ de talla≥0,3 DE al primer año.
Se analizó el índice de repuesta al tratamiento (IoR)13 al primer y segundo año de tratamiento. Este índice de respuesta es un modelo de predicción desarrollado y validado inicialmente por Ranke et al.13, en el que se utilizan parámetros relevantes del paciente con el objetivo de definir un modelo que tuviera utilidad práctica para predecir el crecimiento prepuberal durante cada uno de los primeros 4 años de tratamiento con rhGH. Se ha calculado el IoR para el primer (IoR1) y segundo año (IoR2) según las siguientes fórmulas:
- -
IoR1=(VC primer año-[12,41-0,36*edad inicio GH+0,47*Peso nacimiento DE+1,54*(log[3*Dosis GH inicial (mg/kg/semana)])−0,6*[Talla DE 1.er año-TG DE]+0,28*peso DE 1.er año)/1,72.
- -
IoR2=VC 2.o-[5,69−0,09*edad inicio GH+0,63*(log[3*Dosis GH inicial (mg/kg/semana)])+0,24*peso DE 2.o año+0,31*VC 1.er año)/1,19.
Como criterios de respuesta final al tratamiento se consideraron:
- a)
TA (DE)
- b)
TA con respecto a la TG (DE)
- c)
TA con respecto al PC inicial (DE)
- d)
TA con respecto a la talla al inicio del tratamiento (TI) (DE)
Se estudió la posible correlación de una buena respuesta a cualquiera de los factores de repuesta precoz el primer año de tratamiento, o del IoR1 e IoR2 con una mejor respuesta final al mismo. Además, se analizó si existe diferencia en la respuesta al tratamiento en función del tipo de DGH (severo o parcial). Se define DGH idiopático severo si el pico de GH máxima en los test de estímulo es menor a 3ng/ml, y DGH parcial si se encuentra entre 3 y 10ng/ml.
Análisis estadísticoSe realizó estudio de normalidad previo al estudio estadístico y posteriormente estudio de comparación de medias y correlaciones. Las variables cuantitativas se describieron mediante la media, desviación típica y mediana. Las variables categóricas se describieron como frecuencia y porcentajes. Para estudiar la relación entre variables categóricas se utilizó la prueba de Chi-Cuadrado y el Estadístico Exacto de Fisher. Para estudiar la relación entre variables cuantitativas se aplicó el Coeficiente de Correlación de Pearson. Para estudiar la relación entre variables cuantitativas y categóricas se utilizó la t de Student (T-Test). Para el estudio estadístico se usó el programa SPSS v.15, y se consideró significación estadística p<0,05.
Este proyecto de investigación ha sido aprobado por el Comité de Ética de la Investigación de la Comunidad de Aragón (CEICA).
ResultadosLa muestra se compone de 139 pacientes (96 mujeres y 43 varones). El 71,2% correspondían a DGH severo y el 28,2% a DGH parcial. La cifra media de GH constatado en los test de estímulo al diagnóstico fue 4,04±2,57ng/ml (0ng/ml-9,86ng/ml). La edad media al inicio de tratamiento fue de 11,1±2,5 años, con una duración del mismo de 4,2±2 años, una dosis media de inicio de 26,14±2mcg/kg/día, y una edad media al final del tratamiento de 15,3±1,2 años. La TG fue de −1,3±0,7 DE, la TI fue de −2,5±0,4 DE y el PC inicial fue de −2,19±0,6 DE; es decir, 150,35±3,40cm en mujeres y 164,9±2,87cm en varones.
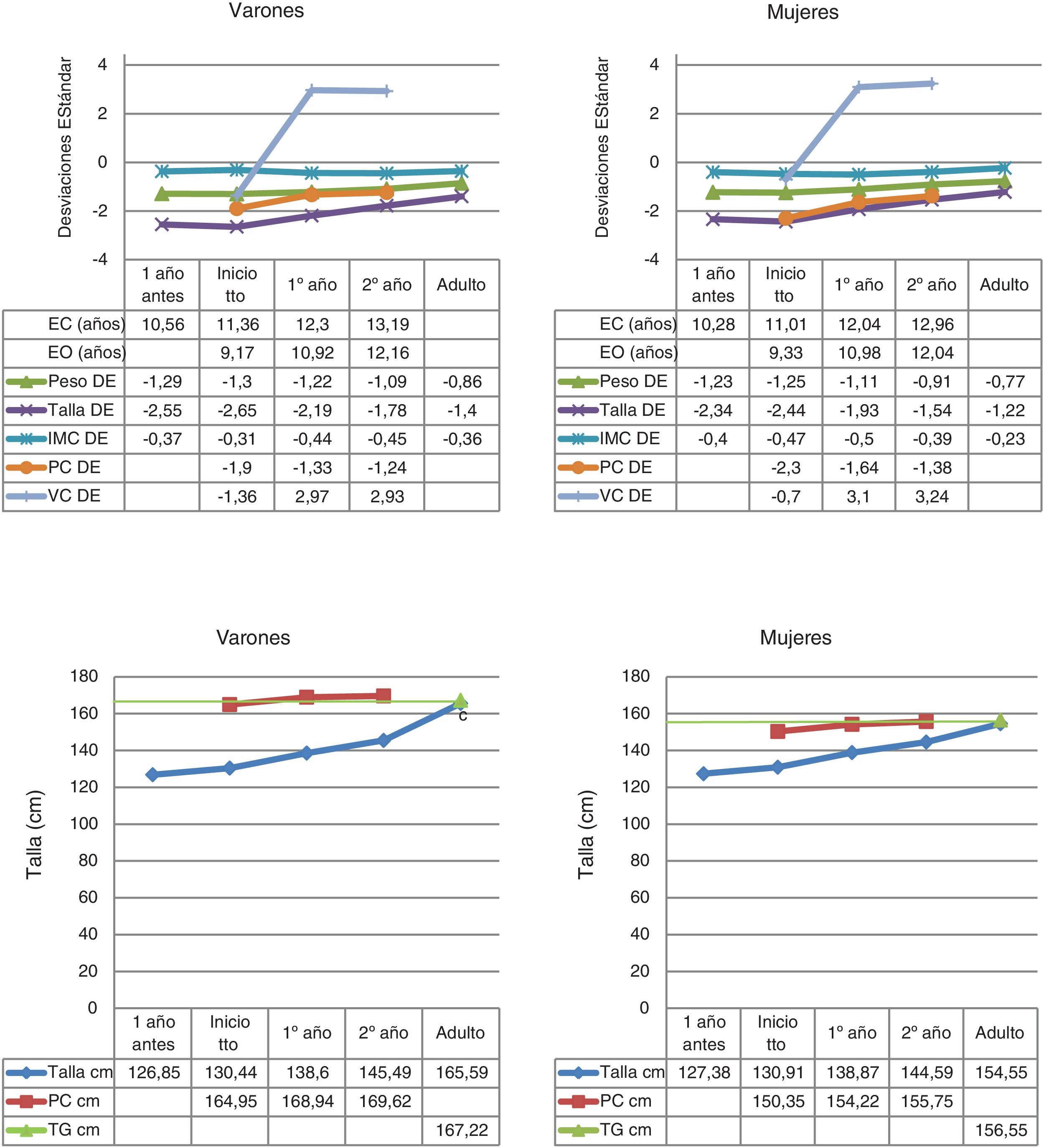
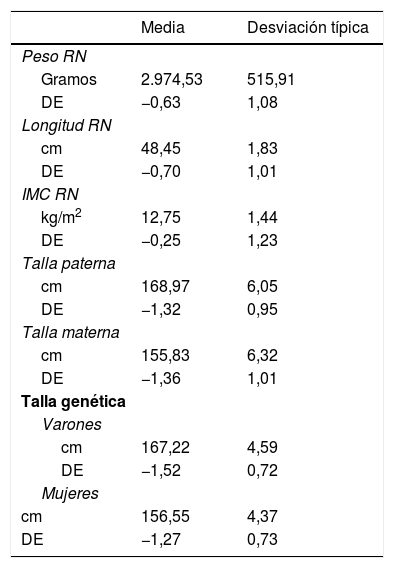
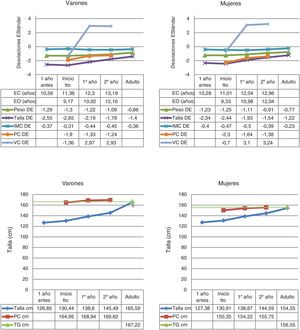
Los datos del nacimiento, tallas de los padres y talla genética se muestran en la tabla 1. Las principales características descriptivas y su evolución durante el seguimiento se muestran en la figura 2.
Datos del nacimiento, tallas de los padres y talla genética, expresadas en valor absoluto y en desviaciones estándar
| Media | Desviación típica | |
|---|---|---|
| Peso RN | ||
| Gramos | 2.974,53 | 515,91 |
| DE | −0,63 | 1,08 |
| Longitud RN | ||
| cm | 48,45 | 1,83 |
| DE | −0,70 | 1,01 |
| IMC RN | ||
| kg/m2 | 12,75 | 1,44 |
| DE | −0,25 | 1,23 |
| Talla paterna | ||
| cm | 168,97 | 6,05 |
| DE | −1,32 | 0,95 |
| Talla materna | ||
| cm | 155,83 | 6,32 |
| DE | −1,36 | 1,01 |
| Talla genética | ||
| Varones | ||
| cm | 167,22 | 4,59 |
| DE | −1,52 | 0,72 |
| Mujeres | ||
| cm | 156,55 | 4,37 |
| DE | −1,27 | 0,73 |
cm: centímetros; DE: desviación estándar; IMC: Índice de masa corporal; RN: recién nacido.
Estadística descriptiva de las variables cuantitativas recogidas durante el seguimiento a casi-talla adulta de niños con DGH.
cm: centímetros; DE: desviación estándar; EC: edad cronológica; EO: edad ósea; IMC: índice de masa corporal; PC: pronóstico de crecimiento; TG: talla genética; VC: velocidad de crecimiento.
La edad media al inicio puberal fue de 12,14±1,1 años en el grupo total, siendo de 11,86±0,9 años en mujeres y 12,79±1,2 años en varones. Un 61,9% de los pacientes iniciaron el tratamiento con rhGH en la etapa prepuberal.
Un 48,2% de los pacientes fueron buenos respondedores en el primer año de tratamiento según el criterio incremento de la VC≥3cm/año al primer año, un 77% según el criterio VC≥1 DE al primer año, un 45,3% según el incremento de talla≥0,5 DE al primer año, y un 71,9% según el incremento de talla≥0,3 DE al primer año.
La VC media pretratamiento fue de 4,73±1,1cm/año (−0,91±1,8 DE), mientras que la VC media el primer año de tratamiento fue de 7,91±1,5cm/año (3,06±3 DE), consiguiendo alcanzar una TA que supera en DE a la TI con respecto a su población de referencia (TA=−1,28±0,6 DE y TI=−2,5±0,4 DE), siendo de 154,5±3,7cm en mujeres, y 165,6±4,1cm en varones. La TA con respecto a la TG fue de 0,06±0,7 DE, y la TA con respecto al PC inicial fue de 0,9±0,6 DE. Se constató un incremento de la TA con respecto a la TI de 1,2±0,6 DE, sin objetivar diferencias significativas entre sexos.
Las mujeres presentan una mejor TA con respecto al PC inicial (p=0,00), sin encontrar diferencias entre sexos en el resto de variables de respuesta final. Aquellos pacientes con DGH severo presentan una mejor TA con respecto a su TG (p=0,04), sin encontrar diferencias en el resto de variables de respuesta final (tabla 2).
Principales relaciones entre tipo de déficit (severo o parcial) y las variables de respuesta final al tratamiento
| Talla adulta-Talla genética (DE) | Talla adulta-Pronóstico de crecimiento (DE) | Talla adulta-Talla al inicio del tratamiento (DE) | ||
|---|---|---|---|---|
| N | p | p | p | |
| Tipo de déficit | ||||
| Severo | 99 | 0,040 | 0,772 | 0,817 |
| Parcial | 40 | |||
DE: desviación estándar; p: nivel de significación. Los resultados en negrita indican significación estadística.
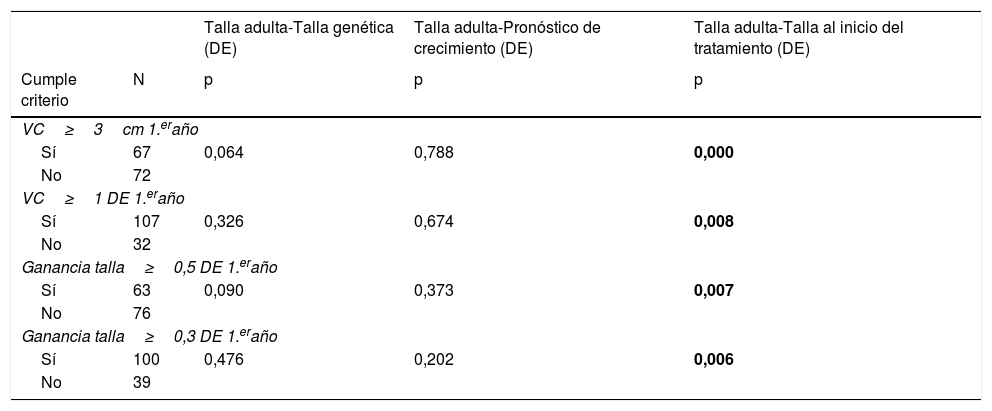
La respuesta en el primer año de tratamiento es un factor determinante para alcanzar una buena respuesta a largo plazo, ya que los pacientes considerados buenos respondedores el primer año de tratamiento según los 4 criterios presentaron una mejor respuesta final según el criterio TA con respecto a la TI. Sin embargo, no hubo correlación con el resto de variables de respuesta final estudiadas (tabla 3).
Principales relaciones entre criterios de buena repuesta precoz y las variables de respuesta final al tratamiento
| Talla adulta-Talla genética (DE) | Talla adulta-Pronóstico de crecimiento (DE) | Talla adulta-Talla al inicio del tratamiento (DE) | ||
|---|---|---|---|---|
| Cumple criterio | N | p | p | p |
| VC≥3cm 1.eraño | ||||
| Sí | 67 | 0,064 | 0,788 | 0,000 |
| No | 72 | |||
| VC≥1 DE 1.eraño | ||||
| Sí | 107 | 0,326 | 0,674 | 0,008 |
| No | 32 | |||
| Ganancia talla≥0,5 DE 1.eraño | ||||
| Sí | 63 | 0,090 | 0,373 | 0,007 |
| No | 76 | |||
| Ganancia talla≥0,3 DE 1.eraño | ||||
| Sí | 100 | 0,476 | 0,202 | 0,006 |
| No | 39 | |||
DE: desviación estándar; p: nivel de significación; VC: velocidad de crecimiento. Los resultados en negrita indican significación estadística.
El IoR el primer año se asocia con una mejor respuesta final (TA con respecto a la TG, r=0,249; p=0,003), y se mantiene al segundo año (TA con respecto a la TI, r=0,294; p=0,001). No se objetiva correlación del IoR con el resto de variables de respuesta final.
DiscusiónEl estudio incluye 139 pacientes tratados con rhGH durante al menos un año por DGH y que ya han alcanzado la casi-TA. Más de la mitad de los pacientes del presente estudio eran mujeres, porcentaje similar al observado en estudios previos como los realizados por Ranke et al.14,15, Ramchiel et al.16 o Straetemans et al.7, pero supone un porcentaje mayor al que se observa en otros estudios de la literatura donde hay predominio del sexo masculino, como los realizados por Carrascosa et al.17,18. La mayor parte de los pacientes del estudio correspondían a DGH severo, lo que supone un mayor porcentaje de pacientes con DGH severo con respecto a estudios anteriores7,17,18.
Múltiples estudios apoyan que el inicio del tratamiento con rhGH a una edad temprana favorece que los pacientes alcancen una TA acorde a su TG. Ranke et al. compararon 265 niños con GHD tratados antes de los 3 años de edad con 509 niños tratados después de los 7 años de edad, mostrando que después del primer año de tratamiento con GH el incremento de la talla fue significativamente mayor por unidad de dosis de rhGH en los niños menores que en los mayores14. Así, el tratamiento debe iniciarse lo antes posible para lograr la máxima respuesta en el crecimiento5,19. La edad media al inicio de tratamiento en este estudio fue acorde a estudios previos como el de Rachmiel et al.16,20, menor a lo que se objetiva en estudios más antiguos21, pero superior a lo que se refleja en otros estudios, donde sitúan la edad media de inicio del tratamiento en torno a los 7 años6,7,17,18. Esta diferencia de edad es debida a que los primeros pacientes incluidos en el estudio son pacientes antiguos, ya que en la actualidad se inicia antes el tratamiento con rhGH.
La TG en varones en nuestro estudio fue ligeramente inferior a la registrada en estudios previos, como los estudios de ganancia de talla en función de la secreción de GH previa al tratamiento realizados por Carrascosa et al.17,18, el trabajo sobre TA alcanzada en función de las dosis de rhGH llevado a cabo por Rachmiel et al.16 o el estudio de Straetemans et al.7 que comparaba diferentes criterios de respuesta pobre al tratamiento con GH. La TI en el presente estudio fue similar a lo encontrado en la literatura con pacientes no prepuberales16. Sin embargo, estudios previos realizados con pacientes de menor edad muestran una talla inferior al inicio del tratamiento6,7,12,15,17,18,22.
El efecto más importante del tratamiento con rhGH es normalizar la VC, pero además la GH también tiene una importante influencia en el desarrollo de riesgos posteriores para la salud4. Existe una amplia variabilidad en la respuesta al tratamiento con rhGH, probablemente debido a problemas de cumplimiento, gravedad del DGH y sensibilidad del paciente a la rhGH. La rhGH debe administrarse diariamente por vía subcutánea, y la dosis aprobada por la FDA es de 25-100mcg/kg/día, siendo de 25-35mcg/kg/día en niños prepúberes, lo que está en consonancia con el presente estudio23. Los beneficios del tratamiento con rhGH en el incremento de la VC están ampliamente demostrados en la literatura, y respaldan los resultados de este estudio. Por tanto, el tratamiento con rhGH consigue alcanzar una TA en el rango genético.
Diversos autores han ido analizando la respuesta al tratamiento con rhGH durante el crecimiento, y la publicación de series retrospectivas ha demostrado que dicha respuesta presenta amplios márgenes de variabilidad, cualquiera que sea la categoría diagnóstica atribuida al paciente. También, y a la vista de la respuesta obtenida al finalizar un determinado período de tratamiento (por ejemplo, primer o segundo año de tratamiento), diversos autores han calculado cómo los datos basales clínicos y bioquímicos junto con los obtenidos durante el período anterior permiten refinar los análisis con la finalidad de detectar los factores predictivos y su peso relativo en la predicción24. La definición de criterios de moderada o buena respuesta al tratamiento con rhGH resulta útil a la hora de establecer la decisión de continuar o interrumpir el tratamiento. Los estudios actuales van dirigidos a adaptar el tratamiento con rhGH al potencial de crecimiento y respuesta de cada paciente, con el fin de lograr un uso racional, individualizado y óptimo en términos de eficacia, seguridad y coste.
Diferentes autores han propuesto distintos puntos de corte para definir una respuesta adecuada al tratamiento con rhGH en estos pacientes24–27. En este estudio, se analizan los criterios de buena respuesta a corto plazo propuestos por Bang et al.12. Según este trabajo, los 2 criterios que menor proporción de buenos respondedores encuentra son el incremento de talla≥0,5 DE y el incremento de la VC≥3cm/año al primer año de tratamiento. En el presente estudio, se constata que, al igual que para Bang et al., el porcentaje de buenos respondedores varía en función del criterio utilizado. Así, al igual que lo hallado por Bang et al., los 2 criterios más estrictos corresponden al incremento de talla≥0,5 DE al primer año y al incremento de la VC≥3cm/año al primer año, seguidos de el incremento de talla≥0,3 DE y del criterio VC≥1 DE al primer año.
Van Dommelen en su estudio investigó el efecto de la adherencia al tratamiento con rhGH en la respuesta al mismo a los 2 años de tratamiento en niños prepúberes con DGH, y encontró una fuerte correlación entre una alta adherencia al tratamiento en el segundo año y una adecuada respuesta al mismo según el IoR23. En el presente estudio se constata que el IoR al primer y al segundo año se asocia fuertemente con una mejor respuesta final al tratamiento.
Además, existe evidencia de que los niños con DGH orgánico responden menos al tratamiento con rhGH en comparación con aquellos que tienen deficiencia de hormona de crecimiento idiopática28, o de que los pacientes con DGH permanente obtienen un mayor beneficio del tratamiento con rhGH tanto a corto como a largo plazo con respecto a los pacientes con DGH transitorio29. Sin embargo, salvo en el trabajo realizado por Bang et al.12y apoyado posteriormente por Wit et al.30, la respuesta en función del tipo de déficit no ha sido ampliamente estudiada por otros autores hasta el momento, siendo corroborado en nuestro estudio. Así, este estudio muestra que en aquellos pacientes con DGH idiopático, los que tienen un déficit severo presentan una mejor respuesta final al tratamiento.
En conclusión, los hallazgos de este estudio muestran que los pacientes alcanzan su TG, que aquellos pacientes buenos respondedores al primer año de tratamiento según los 4 criterios analizados presentaron una mejor respuesta final, y que el IoR1 e IoR2 se asocian con una mejor respuesta final. Además aquellos pacientes con DGH severo presentan una mejor respuesta final.
Por tanto, vemos que una buena respuesta precoz al tratamiento es un factor determinante para alcanzar una buena respuesta a largo plazo, y que aquellos pacientes con DGH severo se beneficiarán más del tratamiento. Estos resultados permiten ayudar al clínico a tomar decisiones sobre la conveniencia de proseguir, modificar o incluso suspender un tratamiento con rhGH.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.