Existen situaciones de talla baja con test de estímulo para hormona del crecimiento (GH) normal, pero secreción nocturna disminuida, en las que podría existir un beneficio con el tratamiento con GH.
ObjetivoEvaluar la talla adulta y la ganancia de talla en pacientes con diagnóstico de disfunción neurosecretora tratados con GH.
Material y métodosEstudio longitudinal, retrospectivo y observacional con 61 pacientes tratados con GH tras diagnóstico de disfunción neurosecretora que han alcanzado la talla adulta. Se evaluaron variables como la ganancia de talla adulta, la velocidad de crecimiento, la variación del pronóstico de crecimiento y la evolución de IGF-1 e IGFBP-3. También han sido calculadas variables de buena respuesta en el primer año, mediante el uso del index of responsiveness.
ResultadosHubo una mejoría en la talla y en la velocidad de crecimiento. Se observó un incremento de talla adulta respecto a talla inicial de 1,15±0,60 DE, de talla respecto a talla genética de −0,015±0,62 DE y de talla adulta respecto al pronóstico de crecimiento inicial de 0,74±1,13 DE. El index of responsiveness en el primer año se asocia con un mayor incremento de talla en el primer año (p=0,001), una mayor talla adulta (p<0,001) y una mayor ganancia de talla adulta respecto a su talla inicial (p<0,039).
ConclusionesLos pacientes diagnosticados de disfunción neurosecretora muestran una buena respuesta al tratamiento con GH: se observa una ganancia de talla similar a su talla genética y una mejora de su pronóstico de crecimiento inicial.
There are situations of short stature, with a normal stimulus test for GH, but decreased nocturnal secretion in which there could be a benefit with GH treatment.
ObjetivesTo assess adult height and height gain in patients with neurosecretory dysfunction diagnosis treated with growth hormone.
Material y methodsLongitudinal, retrospective and observational study including 61 patients treated with growth hormone after diagnosis of neurosecretory dysfunction who have already reached adult height. Variables such as adult height gain, growth rate, growth prognosis variation and IGF-1 and IGFBP-3 were evaluated. Variables related to a good response in the first year have also been calculated, using the index of responsiveness.
ResultsGH treatment produces an improvement in growth rate and height, observing an increase in adult height with respect to initial height of 1.15±0.60 SD, height with respect to genetic height of −0.015±0.62 SD and adult height with respect to the initial growth prognosis 0,74±1,13 DE. The index of responsiveness in the first year is associated with a greater increase in height in the first year (P<0.001), with a greater adult height (P<0.001) and with a greater gain in adult height compared to its initial height (P=0.039).
ConclusionsPatients with growth delay due to neurosecretory dysfunction of GH show a good response to treatment with rhGH, observing a significant height gain in their genetic size and improving their initial growth prognosis.
La talla baja es un motivo muy frecuente de consulta y preocupación en pediatría. Una de las causas puede ser la disfunción neurosecretora, caracterizada por obtener un resultado normal en los test de estímulo de hormona de crecimiento (GH), niveles de IGF-1 normales o altos, pero con test de secreción nocturna (media de 21 determinaciones) alterado; es un criterio diagnóstico una media ≤ 3 ng/ml1.
El crecimiento es un proceso complejo en el que intervienen factores genéticos, endocrinos, autocrinos-paracrinos y también factores permisivos como son la nutrición, la situación psicosocial y otros factores ambientales2. Por lo tanto, es un proceso sensible a las condiciones desfavorables, por lo que es un buen indicador de salud3. La secreción de GH presenta un patrón pulsátil y de predominio nocturno, pero aún se trata de un proceso en gran medida desconocido a nivel fisiológico y fisiopatológico en lo que respecta al patrón de secreción y de las vías a través de las cuales los distintos factores lo modifican y modulan. En el caso de la disfunción neurosecretora existe un patrón de secreción nocturna alterado, a expensas de una disminución en el número y amplitud de los pulsos de secreción.
No todos los autores encuentran correlación entre talla o velocidad de crecimiento y secreción espontánea de GH. Se trata de un tema muy estudiado en la bibliografía1,4,5. Ya en 1984, Blatt et al. observaron, en pacientes con leucemia linfoblástica aguda que habían recibido tratamiento con radioterapia craneal profiláctica, una alteración en la secreción espontánea de GH y una respuesta normal a los test de estímulo, con disminución en la velocidad de crecimiento. Esto era similar a lo que sucedía en pacientes no irradiados con alteración del crecimiento: así se postuló la idea de la existencia de anomalías en la neurorregulación de la secreción de GH6.
La talla baja toma una especial importancia en la población: es la primera causa de consulta en los servicios de endocrinología por las consecuencias psicológicas que esto conlleva. Se define como talla baja aquella: 1) talla situada por debajo del percentil 3 o de −2 DE respecto a la curva normal para la misma edad y sexo de la población a la que pertenece; 2) con una velocidad de crecimiento menor al P25 (−1 DE) para la edad y sexo, mantenida, al menos, durante 2años, independientemente de la talla actual; 3) talla que, estando dentro del ± 2 DE de la curva correspondiente a su población, se encuentra por debajo de −2 DE respecto a su talla diana y 4) una predicción de talla adulta por debajo de −2 DE respecto a su talla diana7.
La talla baja se clasifica en 2grupos fundamentales, la talla baja idiopática y la talla baja patológica (trastornos primarios del crecimiento o secundarios a enfermedades, como pueden ser enfermedades digestivas, oncológicas, renales crónicas, etc.)8,9. La talla baja idiopática (80% de los casos) engloba a todas aquellas condiciones de talla baja en la que desconocemos su causa y en las que, además, se cumplen los siguientes criterios: 1) longitud y peso al nacimiento normal para la edad gestacional; 2) proporciones corporales normales; 3) ausencia de enfermedad endocrina, cromosomopatía, trastornos psicoafectivos graves, enfermedad crónica orgánica; 4) nutrición adecuada y 5) tiempo de maduración que puede ser normal o lento. Con todo esto, podemos decir que la talla baja idiopática es un diagnóstico de exclusión10.
Desde las consultas médicas, se debe hacer una adecuada aproximación diagnóstica, elaborar en primer lugar una adecuada anamnesis y después una exploración física exhaustiva. Según estos datos, se harán las pruebas complementarias que se consideren oportunas para descartar así las causas de talla baja patológica y, solo si se descartan estas, hablar de talla baja idiopática.
Dentro de las pruebas complementarias encontramos los test de estímulo de GH, los cuales presentan limitaciones en la reproducibilidad, lo que cuestiona su validez real como instrumento para el estudio de la secreción de GH hipofisaria. Peso a ello, continúan empleándose en la mayoría de los países para el diagnóstico de la deficiencia y resistencia de GH. No obstante, su valor debe ser considerado en el contexto clínico, auxológico, de estudios de imagen y moleculares, cuando proceda11.
Como ya se ha explicado, el uso de los test de estímulo de GH sigue siendo un tema controvertido, al no establecerse unos límites definidos de normalidad y, además, al tratarse de estudios poco reproducibles. Muchas veces se encuentran valores considerados como normales en pacientes con tallas bajas graves y bajas velocidades de crecimiento.
Nuestro objetivo con este estudio es evaluar la respuesta al tratamiento con GH en pacientes con GH normal en test de estímulo, diagnosticados de disfunción neurosecretora, tratados hasta alcanzar la talla adulta.
Material y métodosSe trata de un estudio longitudinal, retrospectivo y observacional en el que se incluye a 61 pacientes controlados en las consultas de endocrinología pediátrica de un hospital terciario tratados con GH tras diagnóstico de disfunción neurosecretora, que han alcanzado la talla adulta en el momento del estudio. El uso de GH fue financiado por el sistema de salud de la comunidad autónoma. Este proyecto de investigación ha sido aprobado por el Comité de Ética de Investigación de la Comunidad.
Los criterios de inclusión fueron:
- a)
Talla menor de −2 DE al diagnóstico.
- b)
Test de estímulo de GH >10 ng/ml.
- c)
Test de secreción nocturna: media de 21 determinaciones menor de 3 ng/ml.
- d)
Haber recibido tratamiento sustitutivo con rhGH.
- e)
Haber nacido con peso y longitud adecuados para la edad gestacional.
- f)
Haber alcanzado la talla adulta (aquella alcanzada en la última consulta, un estadio de Tanner V y edad ósea >14 años en mujeres y >16 años en varones).
Los criterios de exclusión fueron:
- a)
Existencia de enfermedades intercurrentes que afecten al crecimiento (nacer pequeño para la edad gestacional, síndromes, displasias óseas…).
- b)
Falta de continuidad del tratamiento durante el seguimiento.
- c)
No haber finalizado el crecimiento en el momento del estudio.
- d)
Haber recibido tratamiento concomitante con análogos de gonadotropinas (GnRH).
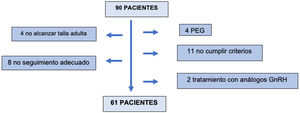
Se seleccionó a 90 pacientes, de los cuales 61 formaron finalmente parte del estudio. Fueron excluidos 29 pacientes: 4 por no haber alcanzado la talla adulta en la última visita, 8 por seguimiento inadecuado, 4 pacientes por ser pequeños para la edad gestacional, 11 por no cumplir los criterios de inclusión en el test de estímulo o secreción nocturna y 2 por recibir tratamiento concomitante con análogos de GnRH (fig. 1).
Durante el estudio se han evaluado variables antropométricas y analíticas en distintos momentos del estudio (previo al tratamiento, al inicio del tratamiento, a los 4 meses de tratamiento, al inicio de la pubertad, al año de tratamiento, a los 2años de tratamiento y en la última consulta). Uno de los parámetros estudiados fue el index of responsiveness (IoR), índice utilizado en pacientes con déficit de GH para estimar si será un buen respondedor al tratamiento con GH. Dicho índice es calculado mediante la siguiente fórmula:
IoR primer año=(velocidad de crecimiento en el primer año 12,41 – 0,36×edad al comienzo de GH+0,47×peso al nacimiento DE+1,54×(log(3×dosis al inicio de GH (mg/kg/semana))) – 0,6×(talla en el primer año DE – talla genética DE)+0,28×peso primer año DE))/1,72.
IoR segundo año=(velocidad de crecimiento en el segundo año – (5,69–0,09×edad al inicio de GH+0,63×(log(3×dosis de GH al inicio (mg/kg/semana)))+0,24×peso en el segundo año DE+0,31×velocidad de crecimiento en el primer año))/1,19.
Se han analizado también parámetros de buena respuesta en el primer año de tratamiento, evaluándose el incremento de talla ≥ 0,5 DE respecto a la previa, incremento de talla ≥ 0,3 DE respecto a la previa, incremento de la velocidad crecimiento ˃ 3cm/año respecto a la previa y velocidad de crecimiento ˃ 1 DE respecto a la previa.
Por otro lado, se evaluaron variables de respuesta final, como son la diferencia entre la talla adulta y la talla al inicio del tratamiento con GH. También se calculó la diferencia entre la talla adulta y la talla genética y la diferencia entre la talla adulta y el pronóstico de crecimiento al inicio del tratamiento.
Posteriormente, se realizó un estudio estadístico descriptivo en los distintos puntos del estudio. Para cada variable se calcularon las medidas centrales y de dispersión (media aritmética, desviación estándar, máximo y mínimo) para las distribuciones que cumplían la distribución normal. Para comprobar la normalidad de cada variable cuantitativa se aplicó el test de Kolmogorov-Smirnov. Para comparar medias de variables cuantitativas se aplicó el test t de Student para muestras apareadas. También se determinó el grado de correlación existente entre 2variables cuantitativas, calculándose para ello el coeficiente de correlación de Pearson. Por último, el análisis de los datos fue realizado mediante el paquete estadístico IBM SPSS Statistics versión 25; se consideraron como resultados estadísticamente significativos los valores de p < 0,05.
ResultadosEl estudio incluye a 61 pacientes diagnosticados de disfunción neurosecretora (78,7% mujeres, 21,3% varones) tratados con GH, que habían alcanzado la talla adulta. A todos ellos se les hizo test de estímulo de GH y se obtuvo una media de 12,55±8,16 ng/ml. Una vez descartado el déficit de GH, se realizó el test de secreción nocturna, con una media de 1,98±0,62 ng/ml. En el estudio de los antecedentes personales nos encontramos con una muestra en la que el peso, la longitud y el perímetro cefálico eran normales para su edad gestacional. Respecto a los antecedentes familiares no existía talla baja y la talla genética era de −1,14±0,71 DE (tabla 1).
Antecedentes familiares, personales y talla diana
| N | Media±DE | |
|---|---|---|
| Antecedentes familiares | ||
| Talla del padre | ||
| Centímetros | 59 | 170,09±5,64 |
| DE | 59 | −1,11±0,91 |
| Talla de la madre | ||
| Centímetros | 59 | 156,96±5,45 |
| DE | 59 | −1,18±0,91 |
| Talla genética | ||
| Centímetros | ||
| Varones | 13 | 169,27±4,91 |
| Mujeres | 46 | 157,23±4,62 |
| DE | 59 | −1,14±0,71 |
| Antecedentes personales | ||
| Edad gestacional (semanas) | 58 | 38,02±1,96 |
| Peso | ||
| kg | ||
| Varones | 13 | 3,17±0,44 |
| Mujeres | 45 | 2,77±0,48 |
| DE | 58 | −0,30±0,93 |
| Longitud | ||
| Centímetros | ||
| Varones | 11 | 48,97±1,64 |
| Mujeres | 44 | 48,04±2,01 |
| DE | 55 | −0,28±0,72 |
| Perímetro cefálico | ||
| Centímetros | ||
| Varones | 4 | 33,62±1,79 |
| Mujeres | 18 | 32,86±1,29 |
| DE | 22 | −0,59±0,76 |
DE: desviaciones estándar; kg: kilogramos; N: número de pacientes.
Al inicio del tratamiento la edad cronológica media de los pacientes fue de 10,17±2,13 años (varones 10±2,61 años y mujeres 10,09±2,01 años) con una talla de −2,53±0,39 DE, con un pronóstico de crecimiento de −2,15±0,71 DE. Al analizar el estadio puberal al inicio, encontramos que el 65,6% presentaban un estadio prepuberal (Tanner I), mientras que el 34,4% había iniciado la pubertad (24,6% Tanner II y 9,8% Tanner III).
La edad media en el primer año de tratamiento fue de 11,20±2,16 años, con una talla de −2,07±0,48 DE y una velocidad de crecimiento de 2,60±2,74 DE. Se analizaron datos de buena respuesta en el primer año y se obtuvo que el 78,7% incrementó su talla en DE ≥ 0,5, el 80,3% mostró un incremento en la talla en DE ≥ 0,3, el 37,7% presentó un incremento en su velocidad de crecimiento ˃3cm/año y el 72,1% incrementó su velocidad de crecimiento ˃1 DE.
A los 2 años de tratamiento la edad media fue de 12,18±2,14 años, con una talla de −1,80±0,57 DE, una velocidad de crecimiento de 2,01±2,46 DE y un pronóstico de crecimiento −1,25±0,71 DE.
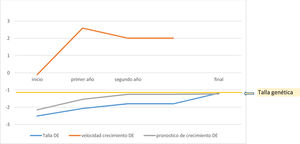
Por último, al alcanzar la talla adulta, la edad media fue de 15,71±1,32 años con una talla de −1,18±0,63 DE (tabla 2), situándose en su talla genética (−1,14±0,71 DE; 169,27±4,91 cm para varones 157,23±4,62 cm en mujeres) (tabla 2).
Evolución de datos antropométricos durante el estudio
| Talla genética | Pretratamiento | 1.er año de tratamiento | 2.° año de tratamiento | Inicio de pubertad | Última consulta | |
|---|---|---|---|---|---|---|
| N | 59 | 61 | 61 | 61 | 61 | 61 |
| Media±DE | −1,14±0,71 DE | |||||
| Edad (años±DE) | 9,22±2,15 | 11,20±2,16 | 12,18±2,14 | 11,68±1,33 | 15,71±1,32 | |
| Talla (media±DE) | −2,51±0,39(p < 0,001)* | −2,07±0,48 | −1,80±0,57 | −1,94±0,48 | −1,18±0,63 | |
| Velocidad de crecimiento (media±DE) | −0,11±1,90 | 2,60±2,74 | 2,01±2,46 | |||
| Edad ósea (años±DE) | 8,10±2,58 | 10,15±2,38 | 11,31±2,26 | 10,86±1,19 | 14,60±1,04 | |
| Pronóstico de crecimiento (media±DE) | −2,15±0,71 | −1,54±0,62 | −1,25±0,71 | −1,71±0,87 | −1,23±0,72(p < 0,001)* | |
| IGF-1 ng/ml | 175,28±101,20 | 409,26±171,29 | 444,39±193,89 | 400,61±112,75 | ||
| IGFBP-3 mcg/ml | 3,79±1,03 | 5,2±1,42 | 5,87±1,41 | 8,8±4,10 | ||
| Dosis de GH mcg/kg al día (media±DE) | 26,93±3,87 | 26,6±4,07 | 27,15±3,84 | Sin tratamiento |
DE: desviación estándar; N: tamaño muestral.
Los pacientes recibieron tratamiento con GH una media de 4,71±2,15 años, con una dosis media de GH estable a lo largo de los años de tratamiento (inicio 26,93±3,87 mcg/kg al día; primer año 26,6±4,07 mcg/kg al día; segundo año 27,15±3,84 mcg/kg al día).
El IoR en el primer año se correlaciona de forma positiva con la talla adulta en DE (r=0,454; p<0,001) y con el incremento de talla en DE en el primer año (r=0,482; p<0,001). También se correlaciona de forma positiva con la diferencia de talla adulta en DE respecto a la talla al inicio de tratamiento (r=0,27; p=0,039). Sin embargo, no se asocia con la diferencia de la talla adulta DE respecto a la talla genética en DE ni con la diferencia de la talla adulta respecto al pronóstico de crecimiento al inicio en DE; tampoco con el incremento de velocidad de crecimiento en el primer año (tabla 3).
Cálculo del index of responsiveness en el primer año
| IoR | |||
|---|---|---|---|
| N | r | p | |
| Talla adulta DE | 61 | 0,454 | <0,001 |
| Diferencia de la talla adulta DE respecto a la talla al inicio de tratamiento DE | 61 | 0,277 | 0,039 |
| Diferencia de la talla adulta DE respecto a la talla genética DE | 61 | 0,099 | 0,466 |
| Diferencia de la talla adulta DE respecto al pronóstico de crecimiento al inicio en DE | 49 | −0,253 | 0,08 |
| Incremento de talla en DE en el primer año | 58 | 0,482 | <0,001 |
| Incremento en la velocidad de crecimiento en cm/año en el primer año | 59 | 0,171 | 0,196 |
| Incremento en la velocidad de crecimiento en DE en el primer año | 59 | 0,487 | <0,001 |
DE: desviación estándar; IoR: index of responsiveness; N: tamaño muestral; r: coeficiente de correlación de Pearson.
Los pacientes de media quedaron a −0,015±0,62 DE de su talla diana, mejoraron 1,15±0,60 DE de talla respecto a la talla al inicio del tratamiento, 0,74±1,13 DE respecto al pronóstico de crecimiento previo al inicio del tratamiento y 0,78±0,63 DE respecto al pronóstico de crecimiento al inicio de la pubertad (fig. 2).
En el ámbito bioquímico, tanto los niveles de IGF-1 como de IGFBP-3 aumentaron durante los 2primeros años (siempre dentro de intervalos de normalidad) para después disminuir tras la finalización del tratamiento.
No se han registrado efectos adversos importantes en el estudio. Únicamente en uno de los 61 pacientes analizados se constató cefalea con fondo de ojo normal que precisó suspensión temporal de GH, que se reinició posteriormente sin incidencias.
DiscusiónEl estudio incluye a 61 pacientes (78,7% mujeres) controlados en las consultas de endocrinología pediátrica de un hospital terciario tratados con GH tras diagnóstico de disfunción neurosecretora, que han alcanzado la talla adulta en el momento del estudio; el 65,6% presentaba un estadio prepuberal al inicio del tratamiento. Los pacientes consiguieron alcanzar su talla genética y mejoraron su pronóstico de crecimiento inicial.
Al inicio del tratamiento, la edad cronológica media de los pacientes fue de 10,17±2,13 años con una talla de −2,53±0,39 DE. Quizá parezca tardío el inicio del tratamiento, pero esto puede deberse a que la disfunción neurosecretora suele aparecer en momentos peripuberales. Esto puede explicar que en nuestra muestra encontremos un mayor porcentaje de pacientes puberales respecto a estudios previos, como es el de Villafuerte et al.12, estudio retrospectivo de pacientes con déficit de GH, en el que solo el 6,3% habían iniciado la pubertad al iniciar el tratamiento. Esto puede explicar que las predicciones de talla adulta sean ligeramente más favorables en dicho estudio, ya que en el momento de iniciar el tratamiento presentaban un mayor potencial de crecimiento. Comparando los datos, vemos como el pronóstico de crecimiento previo al inicio de tratamiento con GH en nuestra muestra fue de −2,15±0,71 DE, es decir, 164,19±5,37cm en varones y 150,90±4cm en mujeres, mientras que en dicho estudio se obtuvo un pronóstico de crecimiento de −1,74±0,99 DE. La velocidad de crecimiento previa al inicio del tratamiento fue de −0,11±1,9 DE. Estudios previos muestran datos similares respecto a la edad de inicio de tratamiento, talla en DE al inicio del estudio y pronóstico de talla adulta en DE13-17.
Tras el primer año de tratamiento, los pacientes presentaban una talla de −2,07±0,48 DE con un pronóstico de crecimiento de −1,54±0,62 DE y una velocidad de crecimiento de 2,60±2,74 DE. Datos similares en el primer año de tratamiento fueron observados por Avilés et al.15,18 sobre la talla alcanzada en el primer año en pacientes con talla baja idiopática y sobre la velocidad de crecimiento. Spiliotis et al.19 ya realizaron una comparación entre pacientes con déficit de GH y con disfunción neurosecretora, en la que observaron un aumento en la velocidad de crecimiento, duplicando su velocidad en el primer año, similar a lo que ocurre en nuestra muestra.
Respecto a la valoración de la buena respuesta en el primer año de tratamiento con GH, se obtuvo un incremento de talla en DE ≥ 0,5 en el 78,7%; en el 80,3% se observó un incremento de talla en DE ≥ 0,3; el 37,7% incrementó la velocidad de crecimiento ˃3cm/año y el 72,1% incrementó la velocidad de crecimiento ˃1 DE. Los datos obtenidos en diversos estudios18-23, realizados en pacientes con diagnóstico de déficit de GH, muestran un porcentaje similar de buenos respondedores a los obtenidos en nuestra muestra. En dicho estudio el 74% presentaba un incremento de talla en DE > 0,5, el 88% presentó un incremento de talla >0,3 DE, el 81% presentó un incremento en la velocidad de crecimiento >1 DE, lo que podría reflejar que la respuesta en esta entidad es similar a la respuesta en pacientes con déficit de GH.
Respecto a la talla final alcanzada, diversos estudios muestran datos similares12,14, mientras que otros muestran una talla final mejor que la obtenida en nuestra muestra. En estos últimos, la población estudiada presentaba menor edad al inicio del estudio, con un mayor porcentaje de prepuberales y, además, con una talla genética más alta15. Por otro lado, el tiempo medio de tratamiento con GH fue algo mayor, con una media de 5,4 años12,15,24, lo que podría relacionarse con el inicio más precoz del tratamiento (tabla 4).
Tabla comparativa. Estudios analizados
| Autor | N | DGH/TBI | Talla genética(media y DE) | Edad inicio de tratamiento | Talla inicio tratamiento (media y DE) | Estadio puberal al inicio del tratamiento en % | Pronóstico de crecimiento al inicio de tratamiento (media y DE) | Talla primer año de tratamiento | Velocidad de crecimiento en primer añoDE | Talla final DE | Ganancia de talla respecto a talla inicial DE | Ganancia de talla respecto a pronóstico de crecimiento inicial DE | Duración de tratamiento con GH (años) |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Úbeda et al. | 61 | TBI | −1,14±0,71 | 10,17±2,13 | −2,53±0,39 | 65,6 prepuberal34,4 puberal | −2,15±0,71 | −2,07±0,48 | 2,60±2,74 | −1,18±0,63 | 1,15±0,60 | 0,25±0,82 | 4,71±2,15 |
| Villafuerte et al.12 | 89 | DGH | −0,61±0,66 | 10,5±3,41 | −2,46±0,86 | 88 prepuberal12 puberal | −1,68±1,04 | −1,91±0,91 | 4,33±3,53 | −0,81±0,87 | 1,65±1,43 | 6,14±2,87 | |
| Avilés et al.14 | 47 | TBI | −1,43±0,88 | 11,6±1,2 | −2,1±0,85 | −1,94±0,8 | −1,64±0,69 | −1,28±0,62 | 1,56±0,65 | ||||
| Straetemans, et al.16 | 120 | DGH | −0,82±0,92 | 6,7±2,9 | −3,17±0,83 | Prepuberal | −2,35±0,75 | 2,7±2,03 | 0,83±0,59 | ||||
| Carrascosa et al.17 | 318 | TBI | −0,97±0,78 | 6,9±2,1 | −3,40±0,86 | Prepuberal | −2,44±0,88 | 3,90±1,64 | 0,96±0,8 | ||||
| Ranke et al.13 | 509 | DGH | −0,8±1,2 | 7,5±0,3 | −2,5±0,8 | Prepuberal | −1,9±0,8 | 3,8±2,1 | 0,6±0,4 | ||||
| De Ridder et al. | 342 | DGH | −0,97±0,96 | 9,0±3,3 | −3,40±1,01 | Prepuberal 60 | −2,69±0,95 | −1,71±0,91 | 1,72±1,10 | 7,9±3,3 | |||
| −0,90±0,87 | 14,0±2,0 | −2,92±1,14 | Puberal 40 | −2,34±1,13 | −1,68±0,94 | 1,18±1,16 | 3,3±1,2 |
DE: desviación estándar; DGH: déficit de hormona de crecimiento; N: tamaño muestral; TBI: talla baja idiopática.
Durante el tratamiento con GH, los pacientes mejoraron 1,15±0,60 DE su talla respecto a la del inicio del tratamiento y 0,74±1,13 DE respecto al pronóstico de crecimiento previo al tratamiento. La ganancia de talla respecto a la talla inicial y respecto al pronóstico de crecimiento inicial fue similar a la encontrada en estudios previos12,13,15.
Respecto a la dosis de rhGH, en estudios previos la dosis utilizada de GH era mayor, con una media de 31 mcg/kg al día15, mientras que en nuestra muestra se utilizó una dosis media de GH estable a lo largo de los años de tratamiento (inicio 26,93±3,87 mcg/kg al día; primer año 26,6±4,07 mcg/kg al día; segundo año 27,15±3,84 mcg/kg al día).
Finalmente, respecto a efectos adversos, estos son infrecuentes y escasos22. En nuestro estudio una paciente precisó suspensión temporal de GH por cefalea con fondo de ojo normal, si bien pudo reiniciar posteriormente el tratamiento.
Por todo lo comentado, los pacientes tratados con rhGH por el diagnóstico de disfunción neurosecretora presentan una buena respuesta, hasta lograr una talla final similar a la de los pacientes tratados por déficit de GH, y esta buena respuesta ya es objetivable desde el primer año22,23.
Como conclusiones del estudio cabe reseñar que los pacientes con retraso de crecimiento y test de estímulo de GH normales diagnosticados de disfunción neurosecretora muestran una buena respuesta al tratamiento con rhGH, similar a la de los pacientes afectos de déficit de GH, ya que consiguen alcanzar su talla genética y mejoran su pronóstico de crecimiento inicial. Al igual que sucede en el déficit de GH, el IoR durante el primer año permite valorar a los pacientes que serán buenos respondedores al tratamiento. Los niveles de IGF-1 e IGFBP-3 presentan unos valores normales antes del tratamiento con rhGH y se elevan tras su inicio, con niveles mantenidos dentro de la normalidad en todo momento. Por todo ello, nos planteamos la duda de la obligatoriedad de 2 test de estímulo para el diagnóstico de déficit de GH, así como la exclusión de recibir tratamiento en los pacientes con talla baja y test normales, ya que puede resultar beneficioso, como se demuestra con este estudio.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Este trabajo se presentó como póster en octubre de 2020 en el Congreso de la Sociedad Española de Endocrinológica Pediátrica (SEEP) en Zaragoza y como trabajo fin de máster en Condicionantes Genéticos, Nutricionales y Ambientales del Crecimiento y el Desarrollo en la Universidad de Zaragoza, en el curso académico 2019-2020.