Hace poco más de 30 años, se sugirió que el virus del papiloma humano (VPH) era el agente causal del cáncer cervicouterino (CaCu), pero no fue sino 15 años después cuando el virólogo alemán Harald zur Hausen fue galardonado con el premio Nobel de Medicina por identificar dicha relación1, la cual constituye uno de los grandes avances para comprender el virus, la historia natural de la enfermedad de la infección por VPH y su importancia oncogénica2. La infección por VPH es la enfermedad por transmisión sexual más frecuente en Estados Unidos de Norteamérica, pues se estima que 14 millones de personas se infectan cada año por este virus3. En la actualidad, se ha establecido que la infección persistente con tipos virales de VPH de alto riesgo oncógeno, es el factor etiológico principal para desarrollar CaCu, entidad que en México ocupa el segundo lugar como causa de muerte por cáncer en mujeres1.
Hasta la fecha, se identificaron más de 200 genotipos de VPH, de los cuales cerca de una tercera parte infectan las mucosas del hospedero y más de 40 tipos se transmiten normalmente por vía sexual e infectan la región anogenital4-6. Se estima que hasta una cuarta parte de las personas sexualmente activas se infectan por VPH genital alrededor de los 21 años de edad, además que más de la mitad se infectará al menos una vez a lo largo de su vida4 y que cerca de 7% de los adultos contraen infecciones orales por VPH7,8. Sin embargo, estudios de diagnóstico molecular han detectado la presencia de VPH en 8 de cada 10 mujeres sexualmente activas, las cuales no presentan síntomas4.
De la infección por VPH al desarrollo de CaCu
Se ha determinado que la relación entre el cáncer cervical y la infección por VPH es más alta, que la relación entre el cáncer de pulmón y el tabaquismo, o que la relación entre el cáncer de hígado y el virus de la hepatitis B6. El VPH tiene la capacidad de estimular continuamente el crecimiento tumoral, de manera que en un periodo habitualmente largo se favorece la generación de mutaciones al azar en el genoma celular y esto conlleva a que algunas de ellas le confieran mayor capacidad oncógena a la célula neoplásica9.
La infección por tipos oncógenos del VPH es la causa principal de la neoplasia intraepitelial cervical. Así, el riesgo de progresión de lesiones de bajo grado a lesiones de alto grado parece ser mayor en pacientes con infección persistente por tipos oncógenos de VPH, así como por valores altos de carga viral10,11. Muchos tipos de VPH inducen solamente lesiones productivas de partículas virales y no se asocian con lesiones malignas. En dichas lesiones, la expresión de los productos de los genes virales se encuentra cuidadosamente regulada, de modo que las proteínas virales se expresan en momentos definidos y en cantidades controladas a medida que la célula infectada migra hacia la superficie epitelial. Los eventos que dan lugar a la producción de partículas virales en las capas superiores del epitelio parecen ser comunes, tanto en virus de alto como de bajo riesgo oncógeno. Aunque el cáncer es una consecuencia poco frecuente de la infección por VPH y los eventos iniciales que conducen a la transformación maligna por virus oncógenos no están del todo esclarecidos, existe la posibilidad de que en la zona de transformación epitelial del cuello uterino (un sitio donde los VPH de alto riesgo no logran regular apropiadamente su ciclo productivo), ocurra una variación tanto en el nivel de expresión de las proteínas virales como del momento en que esta expresión suceda, lo que favorece el desarrollo de cáncer en estos sitios1. Debido a que el VPH infecta el epitelio cervical sin entrar en la circulación, las partículas no se exponen directamente al sistema inmunitario. Como resultado, la vigilancia inmunitaria típica, que involucra el tránsito de células especializadas desde el sitio de la infección hasta órganos linfoides secundarios se encuentra limitada o abatida. Aunado a esto, una vez dentro de la célula, la partícula del VPH puede utilizar múltiples mecanismos para abatir la respuesta inmune que es necesaria para la eliminación de la infección1.
El CaCu ocurre en 2 formas predominantes: carcinoma escamoso y adenocarcinoma. El tipo histológico encontrado con mayor frecuencia en las mujeres es el carcinoma escamoso (80% de los casos) y se relaciona con el VPH 16 en la mayoría de los casos. El adenocarcinoma es el segundo tipo histológico más común y aunque el VPH tipo 16 también es el más frecuente en estos casos, la proporción de los genotipos 18 y 45 aumenta significativamente en este tipo de tumores1.
Experiencia con el uso de vacunas contra el VPH
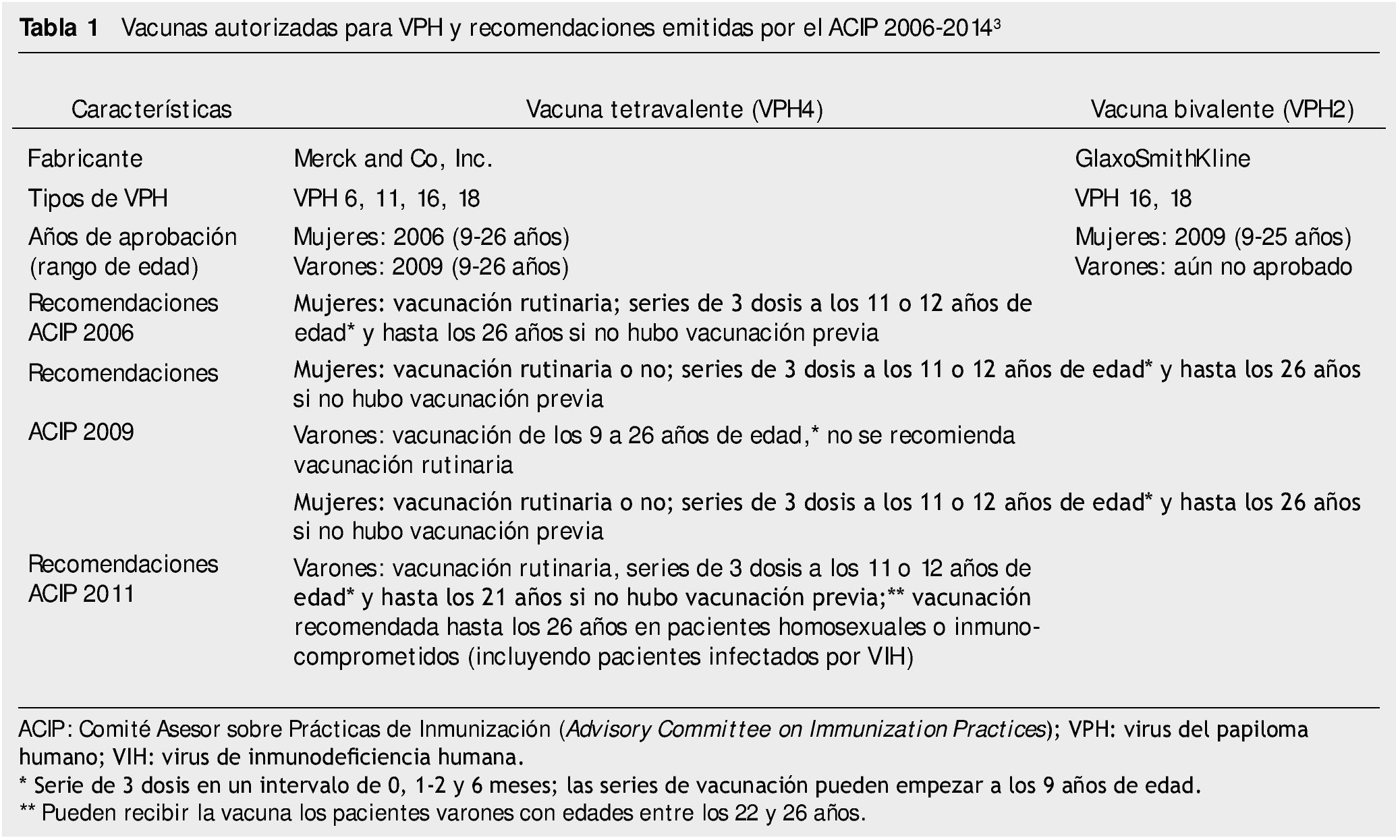
Una parte fundamental en el manejo de las infecciones por VPH es el aspecto preventivo, y en ese sentido, las vacunas representan un medio extraordinario para lograr tal propósito. Las vacunas contra el VPH aprobadas hasta la fecha son 26:
1. Vacuna bivalente (VPH 16 y 18). Sintetizada mediante un sistema de expresión celular de un baculovirus, combinado con un compuesto de aluminio (AS04), que permite la protección e inducción de altos y prolongados títulos de anticuerpos, además de un aumento de la inmunidad mediada por células. Su protocolo de administración es una dosis a los 0, 1 y 6 meses.
2. Vacuna tetravalente (VPH 6, 11, 16 y 18). Se prepara mediante una proteína recombinante sintetizada en levaduras y se administra también con un compuesto alumínico como adyuvante. El esquema de vacunación es a los 0, 2 y 6 meses.
Tal como se muestra en la tabla 1, la vacuna tetravalente contra el VPH fue la primera en aprobarse (2006) y, de acuerdo con la literatura médica, posee un excelente el grado de protección contra CaCu y verrugas genitales12.
Además, la vacuna tetravalente ha demostrado una relación riesgo-beneficio aceptable; en los ensayos clínicos fase III a gran escala, la vacuna evitó hasta 100% de las lesiones cervicales premalignas moderadas y graves asociadas con los tipos 16 y 18, en mujeres no infectadas previamente por estos tipos de VPH13.
Ambas vacunas contienen partículas no infecciosas (carentes de ADN) similares a los virus, producidas mediante técnicas de recombinación6,13. Tras la administración de 3 dosis, tanto la vacuna bivalente como la tetravalente, producen concentraciones elevadas de anticuerpos séricos en prácticamente todas las personas vacunadas. En las mujeres sin infección (ni previa ni actual por los genotipos 6, 11, 16 y 18), ambas vacunas alcanzan una protección mayor a 90% frente a la infección persistente por VPH durante periodos de hasta 5 años tras la vacunación (el máximo tiempo de seguimiento en los estudios realizados)13. Por otra parte, un mes posterior a la aplicación de la tercera dosis de la vacuna contra VPH, cerca de 100% de las mujeres (con edades entre 15 a 26 años) presentan anticuerpos detectables para cada genotipo del VPH, en concentraciones de 10 a 104 veces más altas que aquellas que se registran en las infecciones naturales, cabe destacar que las concentraciones de anticuerpos que se obtienen después de la vacunación están inversamente relacionadas con la edad14.
Cuando se habla de marcadores para evaluar la eficacia de las vacunas contra el VPH, hay que considerar que el CaCu invasor se desarrolla tras un largo periodo. Por tanto, el mejor indicador hasta la fecha sigue siendo el desarrollo mismo de alteraciones a nivel citológico15.
Futuro prometedor
A pesar de que aún no existe una medida capaz de eliminar el riesgo de CaCu13, el desarrollo de vacunas específicas contra el VPH ha venido a dar una luz de esperanza para la prevención de un problema de salud, que sigue siendo una de las principales causas de muerte en todo el mundo.
La aplicación sistemática de la vacuna contra VPH representa fehacientemente, una de las mejores opciones preventivas. Hoy en día, se cuenta con los avances de la ingeniería genética y las técnicas de DNA recombinante, que ofrecen herramientas consideradas como seguras y eficaces, de manera que no hay razón para no hacer uso de ellas.
Debido a la vigencia y pertinencia del tema, que ofrece una alternativa prometedora para abatir la presencia de los VPH oncogénicos, que impactan a la salud de los mexicanos y de los habitantes del mundo, la Sociedad Mexicana de Oncología (SMeO), iniciará a través de la Gaceta Mexicana de Oncología (GAMO), a partir de este número, la publicación de una serie de artículos abordando desde diferentes aspectos este tema apasionante, que representa un importante problema de Salud Pública.
* Autor para correspondencia:
Av. San Fernando N° 22, Colonia Sección XVI, Delegación Tlalpan,
C.P. 14080, México D.F., México.
Correo electrónico: ochoacarrillo@prodigy.net.mx (Francisco Javier Ochoa-Carrillo).