Estudiar el impacto de la carga vírica inicial de citomegalovirus (CMV) sobre la respuesta virológica al tratamiento anticipado con ganciclovir en receptores de trasplante de progenitores hematopoyéticos (TPH) después de 4 semanas de tratamiento.
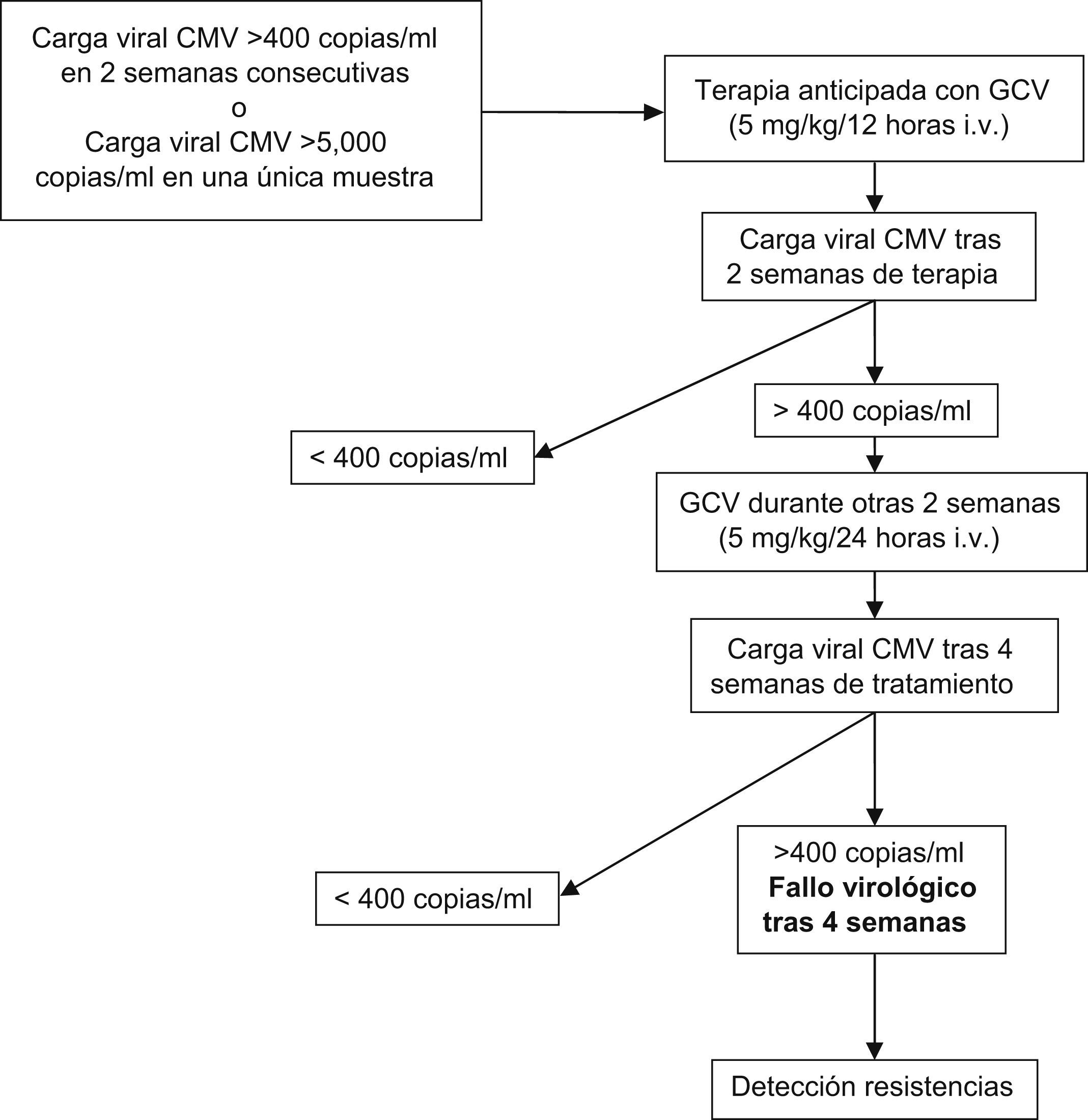
MétodosSe incluyó a 81 receptores de TPH realizados consecutivamente. El tratamiento anticipado se inició ante la presencia de carga vírica de CMV en 2 semanas consecutivas o cuando la carga vírica fue superior a 5.000copias/ml en una única determinación. Si la carga vírica persistía superior a 400copias/ml después de 2 semanas de tratamiento, el tratamiento con ganciclovir se mantenía durante 2 semanas más. Se definió el fallo virológico (FV) como la presencia de carga vírica de CMV superior a 400copias/ml después de 4 semanas de tratamiento.
ResultadosTreinta y dos pacientes (39,5%) que presentaron un total de 39 episodios de replicación de CMV recibieron tratamiento anticipado. Se observó FV en 16 pacientes (50%) después de 18 (50%) episodios de replicación de CMV. Además, 2 episodios de replicación (5%) presentaron adicionalmente fallo clínico. La carga vírica inicial superior a 20.000copias/ml al inicio del tratamiento fue el único factor de riesgo para el FV (odds ratio [OR] de 5,88, intervalo de confianza [IC] del 95%, rango de 1,49 a 25; p = 0,03). La enfermedad del injerto contra el húesped grado ii–iv fue el principal factor de riesgo para la presencia de replicación de CMV superior a 20.000copias/ml al inicio del tratamiento (OR de 16, IC del 95%, rango de 8,5 a 45).
ConclusionesLa presencia de una carga vírica inicial de CMV superior a 20.000copias/ml es el principal factor de riesgo de FV después de 4 semanas de tratamiento anticipado con ganciclovir tras el TPH.
To study the impact of initial cytomegalovirus (CMV) viral load on virological response to ganciclovir preemptive therapy in allogeneic stem cell transplant (SCT) recipients after 4 weeks of treatment.
MethodsEighty-one consecutive allogeneic SCT recipients were included. Preemptive therapy was initiated when CMV load was positive for 2 consecutive weeks or when a viral load >5000copies/mL was detected in 1 sample. If viral load was >400copies/mL after 2 weeks of treatment, maintenance treatment with ganciclovir was continued for 2 additional weeks. Virological failure was defined as a CMV load >400copies/mL after 4 weeks of treatment.
ResultsGanciclovir preemptive therapy was initiated in 32 patients (39.5%) who had 39 episodes of CMV replication. Virological failure occurred in 16 patients (50%) after 18 episodes of replication (46%). Clinical failure additionally occurred in 2 episodes (5%). The only risk factor for virological failure was a peak viral load >20 000copies/mL at the beginning of treatment (OR 5.88; 95% CI: 1.49–25, P=.03). The main risk factor for CMV replication >20 000copies/mL at the start of treatment was the presence of grade II–IV acute graft-versus-host-disease (OR 16; 95% CI: 8.5–45).
ConclusionCMV viral load >20 000copies/mL is the main risk factor for virological failure after 4 weeks of ganciclovir preemptive therapy following SCT.
A pesar de los avances obtenidos en su actitud diagnóstico-terapéutica, la infección por citomegalovirus (CMV) es una de las complicaciones infecciosas más importantes después del trasplante de progenitores hematopoyéticos (TPH).
El tratamiento anticipado es una estrategia de profilaxis en la que los pacientes reciben tratamiento antivírico ante las pruebas de infección por CMV activa y asintomática. Actualmente, esta estrategia se considera la mejor alternativa a la profilaxis universal para el tratamiento de la infección por CMV en algunos grupos de pacientes1,2. El tratamiento anticipado con ganciclovir intravenoso basado en la detección de la carga vírica de CMV en plasma se ha utilizado ampliadamente durante los últimos años y se ha mostrado eficaz en la reducción del riesgo de enfermedad por CMV1,3. Sin embargo, en la actualidad no se dispone de pruebas suficientes para establecer de forma precisa la carga vírica de CMV a partir de la que debería iniciarse este tratamiento anticipado.
La monitorización de la carga vírica de CMV mediante el empleo de técnicas cuantitativas de PCR (polymerase chain reaction ‘reacción en cadena de la polimerasa’) proporciona información adicional sobre el riesgo de desarrollo de enfermedad por CMV, de forma que este riesgo se incrementa con cada aumento de logaritmo10 en la carga vírica4. De la misma forma, la velocidad de replicación vírica, que se refleja en la tasa de incremento vírico obtenida en muestras sucesivas de PCR cuantitativa, se ha mostrado como un factor pronóstico de desarrollo de la enfermedad4. Sin embargo, debido a que no se desarrolla enfermedad en todos los pacientes con replicación de CMV, en algunos casos se administra tratamiento anticipado con ganciclovir solamente a aquellos pacientes que sobrepasan un determinado grado de carga vírica, lo que permite reducir el número de pacientes que reciben tratamiento. No obstante, se desconoce si los pacientes en los que se desarrolla una intensa replicación vírica inicial pueden presentar un mayor riesgo de fallo virológico (FV) y, por tanto, de enfermedad por CMV.
Por tanto, el objetivo de este trabajo es estudiar el impacto de la carga vírica inicial y la cinética de replicación de CMV sobre la respuesta virológica al tratamiento anticipado con ganciclovir durante 4 semanas en pacientes receptores de un TPH. Además, se investigan los factores relacionados con mayor riesgo de desarrollo de FV con el objetivo de identificar a los pacientes de alto riesgo en los que el tratamiento anticipado puede ser una estrategia ineficaz.
MétodosSe incluyó a 81 receptores consecutivos de TPH realizados en el Hospital Universitario Reina Sofía durante un período de 32 meses (desde mayo de 2001 hasta diciembre de 2003). Se siguió a los pacientes durante un período de 12 meses o hasta su fallecimiento. Se realizó el régimen de acondicionamiento y la profilaxis frente a la enfermedad del injerto contra el huésped (EICH) según un protocolo estandarizado institucional, que está basado en el tipo de TPH y de la enfermedad de base. Además, se emplearon injertos con reducción parcial de linfocitos T en pacientes de alto riesgo de desarrollo de EICH, que se define con uno de los siguientes criterios: a) edad del receptor o del donante superior a 35 años y b) injerto procedente de donante multípara o con HLA (human leukocyte antigen ‘antígenos de histocompatibilidad’) no idéntico. Los injertos fueron completamente reducidos de linfocitos T CD4+ y parcialmente reducidos de linfocitos T CD8+ (1×106 CD8+/kg) mediante el empleo de un método inmunomagnético descrito previamente5. Para el tratamiento de la EICH aguda y crónica se emplearon metilprednisolona (2mg/kg/24h) y ciclosporina, respectivamente, combinada con esteroides.
Para la inclusión de los pacientes en el estudio se requirió la autorización de los pacientes o de sus representantes mediante consentimiento informado. El Comité Ético del centro aprobó el protocolo y el estudio se realizó de acuerdo con los principios de la Declaración de Helsinki.
DefinicionesSe consideró seropositividad frente a CMV cuando se detectó inmunoglobulina G anti-CMV mediante análisis de inmunoabsorción ligado a enzimas (DiaSorin P002033). Se definió la replicación de CMV como la presencia de cualquier carga vírica de CMV en plasma. Los episodios de replicación sintomática se consideraron como enfermedad por CMV de acuerdo con los criterios previamente definidos6. La neumonitis por CMV se definió como la presencia de infiltrados intersticiales en la radiografía de tórax junto con la demostración histológica de CMV en la biopsia pulmonar o el aislamiento de CMV en cultivo procedente de lavado broncoalveolar. Para la definición y la graduación de la EICH aguda se emplearon los criterios que describieron Przepiorka et al7. El fallo clínico se definió como el desarrollo de enfermedad por CMV durante el tratamiento. Se consideró como FV la presencia de carga vírica de CMV superior a 400copias/ml después de 4 semanas de tratamiento.
La carga vírica inicial se definió como la carga vírica obtenida en la primera muestra en la que se detectó ácido desoxirribonucleico de CMV. La carga vírica máxima se definió como la máxima carga vírica detectada en cualquier punto del seguimiento. El incremento inicial diario de la carga vírica de CMV se calculó dividiendo la primera carga vírica obtenida, entre el número de días transcurridos entre esta determinación y la carga vírica negativa precedente. El descenso inicial diario de la carga vírica de CMV se calculó dividiendo la diferencia entre la máxima carga vírica de CMV y la siguiente carga vírica obtenida después del inicio del tratamiento anticipado entre el número de días transcurridos entre las 2 pruebas4.
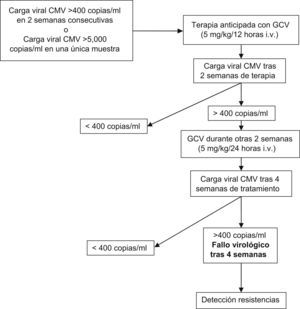
Protocolo de tratamiento anticipado frente a citomegalovirusEl tratamiento anticipado frente a CMV se realizó según los resultados de la PCR cuantitativa frente a CMV obtenidos de forma semanal; para esto se empleó un equipo comercial de PCR de acuerdo con las condiciones del fabricante (Cobas Amplicor, Roche Diagnostic, Basel, Suiza). El límite inferior de esta técnica fue de 400copias/ml. La monitorización de CMV comenzó el día −7 (días antes del trasplante) y se mantuvo hasta el día +100 (días después del trasplante) o hasta el día +180 en pacientes con historia previa de replicación de CMV o EICH.
Las indicaciones de tratamiento anticipado con ganciclovir fueron la presencia de carga vírica de CMV en 2 semanas consecutivas o cuando la carga vírica de CMV en cualquier muestra fue superior a 5.000copias/ml. Los pacientes con recuento de neutrófilos inferior a 1.000×106/l o aclaramiento de creatinina inferior a 60ml/min no se incluyeron en el estudio.
Para el tratamiento anticipado se empleó ganciclovir intravenoso (5mg/kg/12h) durante 2 semanas. El tratamiento anticipado finalizó cuando la PCR de CMV resultaba negativa después de 2 semanas de tratamiento. Por el contrario, si la carga vírica era superior a 400copias/ml al final de este período, se continuaba el tratamiento con ganciclovir intravenoso (5mg/kg/24h) durante 2 semanas más (fig. 1). En caso de persistencia de carga vírica de CMV superior a 400copias/ml después de 4 semanas de tratamiento, se comprobaba la existencia de resistencia a ganciclovir mediante la detección de las mutaciones de los genes UL97 y UL54 de acuerdo con el método descrito previamente8.
El tratamiento de la neutropenia relacionada con ganciclovir se realizó de la siguiente forma: a) se empleó factor estimulante de las colonias de granulocitos cuando el recuento de neutrófilos osciló entre 1.000×106/l y 500×106/l y b) cuando el recuento de neutrófilos fue inferior a 500×106/l en pacientes tratados con factor estimulante de las colonias de granulocitos se interrumpió el tratamiento con ganciclovir durante un mínimo de 2 días y posteriormente se reintrodujo el tratamiento a mitad de dosis (5mg/kg/24h).
Profilaxis frente a otras infeccionesLos pacientes se hospitalizaron en habitaciones equipadas con filtros HEPA. Todos los pacientes recibieron profilaxis con ofloxacina (200mg/12h) y fluconazol (400mg/24h). En pacientes seropositivos frente a virus herpes simple, se realizó profilaxis con aciclovir (250mg/m2 intravenoso o 400mg/8h por vía oral). Estas profilaxis se emplearon desde el día −7 hasta el prendimiento. Para la profilaxis frente a Pneumocystis jiroveci se empleó trimetoprim con sulfametoxazol (160/800mg/24h) administrado ininterrupidamente desde el prendimiento. Los receptores de TPH procedente de donante no relacionado recibieron gammaglobulina inmune (500mg/kg por semana) desde el día −7 hasta el día +100. Los productos hemoderivados empleados en todos los pacientes se deplecionaron de leucocitos y se irradiaron (25Gy).
Tratamiento de la enfermedad por citomegalovirusLa enfermedad por CMV se trató con ganciclovir intravenoso (5mg/kg/12h) durante un mínimo de 3 semanas. Además, en los pacientes con neumonitis por CMV se administró tratamiento con inmunoglobulinas inespecíficas.
Factores de riesgo asociados a fallo virológico después de 4 semanas de tratamiento anticipadoComo potenciales factores de riesgo de FV del tratamiento anticipado se analizaron las siguientes variables que estaban presentes antes del FV: a) variables relacionadas con la inmunosupresión (empleo de injertos con reducción de linfocitos T, esteroides [dosis >1mg/kg/24h] y duración del tratamiento con ciclosporina); b) tipo de donante (género, tipo de concordancia de HLA [idéntico a donante relacionado, idéntico relativo, idéntico a donante no relacionado o donante no idéntico); c) desarrollo de EICH moderada a grave (tipo ii-iv); d) edad del receptor, y e) factores asociados a la carga vírica de CMV y a su cinética (carga vírica inicial, carga vírica máxima, tasa diaria de incremento en la carga vírica de CMV y tasa diaria de descenso en la carga vírica de CMV). Los episodios de EICH grave que ocurrieron simultáneamente o durante las 2 semanas previas a la reactivación de CMV se incluyeron en el análisis.
Factores de riesgo para desarrollo de alta carga vírica de citomegalovirus (superior a 20.000copias/ml)Para identificar a los pacientes con mayor riesgo de desarrollo de altas cargas vírica de CMV al comienzo del tratamiento anticipado se analizaron las variables relacionadas con la inmunosupresión, el tipo de donante, el desarrollo de EICH moderada a grave y la edad del receptor anteriormente descritas, que estaban presentes al comienzo del tratamiento anticipado.
Análisis estadísticoEl estudio finalizó después de 12 meses de seguimiento o con el fallecimiento del paciente. El objetivo primario fue el FV después de 4 semanas de tratamiento o hasta el fallecimiento. El objetivo secundario fue la presencia de carga vírica de CMV superior a 20.000copias/ml. Las variables cuantitativas se analizaron mediante el test de la t de Student. La asociación entre los potenciales factores de riesgo y el fallo clínico o FV se realizó mediante regresión logística múltiple y se expresaron los resultados mediante odds ratio (OR) con intervalos de confianza (IC) del 95%.
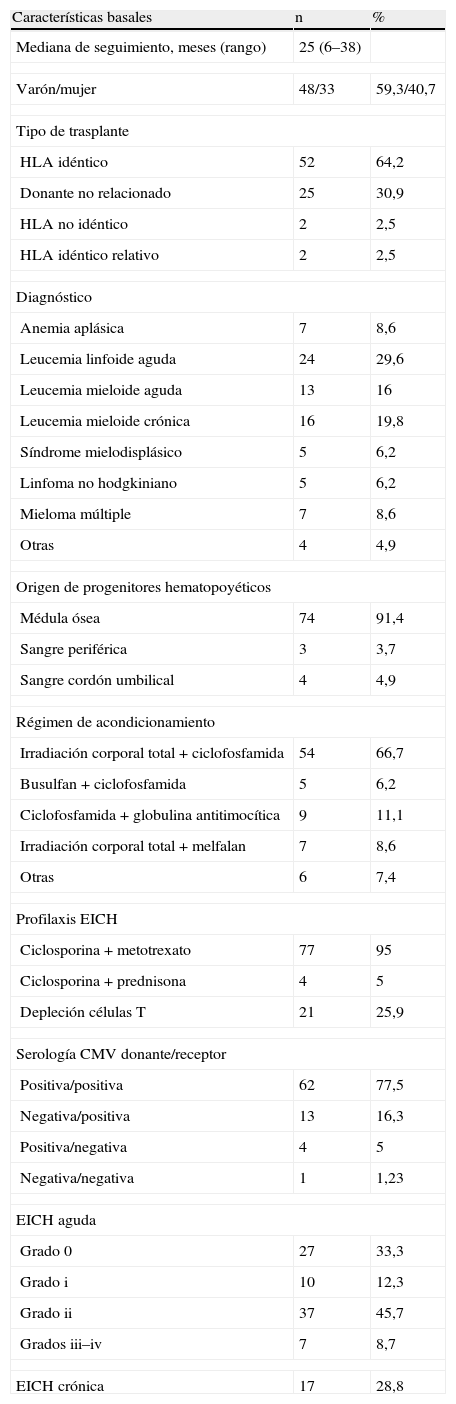
ResultadosAnálisis descriptivoLas caracteristicas basales de los pacientes incluidos en el estudio se muestran en la tabla 1. La mediana de edad fue de 41 años (rango de 4 a 56). Cuarenta y ocho de los 81 pacientes (59%) eran mujeres. La enfermedad de base más frecuente fue la leucemia linfoide aguda (29,6%) seguida por la leucemia mieloide crónica (19,8%) y la leucemia mieloide aguda (16%). El tipo más común de trasplante fue el procedente de donante HLA idéntico relacionado (64,2%) seguido por el procedente de donante no relacionado (30,9%). La médula ósea fue la principal fuente para la obtención de progenitores hematopoyéticos (91,4%).
Características basales de los pacientes incluidos en el estudio (n=81)
| Características basales | n | % |
| Mediana de seguimiento, meses (rango) | 25 (6–38) | |
| Varón/mujer | 48/33 | 59,3/40,7 |
| Tipo de trasplante | ||
| HLA idéntico | 52 | 64,2 |
| Donante no relacionado | 25 | 30,9 |
| HLA no idéntico | 2 | 2,5 |
| HLA idéntico relativo | 2 | 2,5 |
| Diagnóstico | ||
| Anemia aplásica | 7 | 8,6 |
| Leucemia linfoide aguda | 24 | 29,6 |
| Leucemia mieloide aguda | 13 | 16 |
| Leucemia mieloide crónica | 16 | 19,8 |
| Síndrome mielodisplásico | 5 | 6,2 |
| Linfoma no hodgkiniano | 5 | 6,2 |
| Mieloma múltiple | 7 | 8,6 |
| Otras | 4 | 4,9 |
| Origen de progenitores hematopoyéticos | ||
| Médula ósea | 74 | 91,4 |
| Sangre periférica | 3 | 3,7 |
| Sangre cordón umbilical | 4 | 4,9 |
| Régimen de acondicionamiento | ||
| Irradiación corporal total + ciclofosfamida | 54 | 66,7 |
| Busulfan + ciclofosfamida | 5 | 6,2 |
| Ciclofosfamida + globulina antitimocítica | 9 | 11,1 |
| Irradiación corporal total + melfalan | 7 | 8,6 |
| Otras | 6 | 7,4 |
| Profilaxis EICH | ||
| Ciclosporina + metotrexato | 77 | 95 |
| Ciclosporina + prednisona | 4 | 5 |
| Depleción células T | 21 | 25,9 |
| Serología CMV donante/receptor | ||
| Positiva/positiva | 62 | 77,5 |
| Negativa/positiva | 13 | 16,3 |
| Positiva/negativa | 4 | 5 |
| Negativa/negativa | 1 | 1,23 |
| EICH aguda | ||
| Grado 0 | 27 | 33,3 |
| Grado i | 10 | 12,3 |
| Grado ii | 37 | 45,7 |
| Grados iii–iv | 7 | 8,7 |
| EICH crónica | 17 | 28,8 |
CMV: citomegalovirus; EICH: enfermedad del injerto contra el huésped; HLA: human leukocyte antigen ‘antígenos de histocompatibilidad’.
En 54 pacientes (66,7%) el régimen de acondicionamiento consistió en ciclofosfamida (60mg/kg/24h, durante 2 días) e irradiación corporal total. La dosis de irradiación corporal total se fraccionó en 45 pacientes (13,2Gy en 8 fracciones, dosis pulmonar 9Gy). Nueve pacientes recibieron una dosis única de 9Gy (dosis pulmonar 7Gy). Cinco pacientes recibieron busulfan (4mg/kg/24h, durante 4 días) y ciclofosfamida (60mg/kg/24h, durante 2 días). Siete pacientes con mieloma multiple recibieron melfalan (140mg/m2) e irradiación corporal total (13,2Gy) en un régimen fraccionado. Siete pacientes con anemia aplásica recibieron ciclofosfamida (50mg/kg/24h, durante 4 días) con globulina equina antitimocítica (30mg/kg/24h, durante 3 días). En 4 pacientes con injerto procedente de cordón umbilical el régimen de acondicionamiento consistió en tiotepa (5mg/kg/24h, durante 2 días), busulfan (4mg/kg/24h, durante 3 días), ciclofosfamida (60mg/kg/24h, durante 2 días) y globulina antitimocítica procedente de conejo (2mg/kg/24h, durante 4 días).
La profilaxis de EICH se realizó con ciclosporina (1,5mg/kg/12h) y metotrexato (15mg/m2 el día +1 y 10mg/m2 los días +3, +6 y +11) en 77 pacientes. El tratamiento con metotrexato se sustituyó por prednisona en 4 pacientes que recibieron un injerto procedente de sangre de cordón umbilical. Veintiún pacientes recibieron un injerto con reducción de linfocitos T CD4+.
Sesenta y dos pacientes (77,5%) presentaron estado serológico donante/receptor positivo/positivo, 13 pacientes (16,3%) presentaron estado serológico negativo/positivo, 4 pacientes (5%) presentaron estado positivo/negativo y un paciente (1%) presentó estado negativo/negativo.
La EICH grado ii y iii-iv se desarrolló en 37 (45,7%) y 7 pacientes (8,7%), respectivamente. Asimismo, en un total de 17 pacientes (28,8%) se desarrolló EICH crónica.
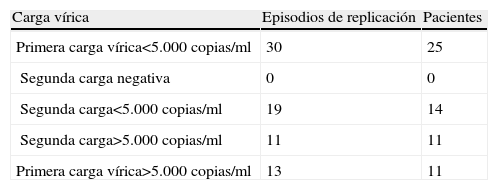
Cinética de la replicación de citomegalovirusDurante el período de seguimiento se presentaron 43 episodios de replicación vírica detectados en 36 pacientes (tabla 2). Siete pacientes presentaron 2 episodios de replicación de CMV. La cuantificación de la primera carga vírica de CMV fue inferior a 5.000copias/ml en 30 episodios (70%) ocurridos en 25 pacientes. En todos estos episodios, la primera carga vírica se siguió de una segunda carga vírica positiva que fue inferior a 5.000copias/ml en 19 episodios (63%) correspondientes a 14 pacientes y superior a 5.000copias/ml en 11 episodios (37%) correspondientes a 11 pacientes.
Carga vírica de citomegalovirus en 43 episodios de replicación observados en 36 pacientes
| Carga vírica | Episodios de replicación | Pacientes |
| Primera carga vírica<5.000 copias/ml | 30 | 25 |
| Segunda carga negativa | 0 | 0 |
| Segunda carga<5.000copias/ml | 19 | 14 |
| Segunda carga>5.000copias/ml | 11 | 11 |
| Primera carga vírica>5.000copias/ml | 13 | 11 |
En 13 episodios (30%) correspondientes a 11 pacientes la primera carga vírica que se detectó fue superior a 5.000copias/ml y se asoció a neumonitis por CMV en 4 pacientes (36%). Todos estos pacientes habían recibido tratamiento prolongado con ciclosporina y esteroides.
La mediana de tiempo hasta el primer episodio de replicación vírica fue de 43 días y la mediana de tiempo hasta el segundo episodio de replicación vírica fue de 114 días.
Globalmente, la mediana de la carga vírica inicial fue de 2.480copias/ml (rango de 585 a 92.800copias/ml). La mediana de la carga vírica máxima fue de 31.100copias/ml (rango de 526 a 135.000copias/ml). En 9 pacientes la carga vírica inicial se correspondió con la carga vírica máxima.
Cinética de la replicación de citomegalovirus durante el tratamiento anticipado con ganciclovirEl tratamiento anticipado con ganciclovir se administró, según los criterios del estudio, en 32 pacientes durante 39 episodios de replicación de CMV. Siete de los 32 pacientes (22%) requirieron 2 cursos de tratamiento anticipado. La mediana de días hasta el primer y el segundo curso de tratamiento fue de 43 días (rango de −7 a 70) y de 115 días (rango de 67 a 171), respectivamente. La mediana de duración del tratamiento fue de 26 días (rango de 4 a 77). Se observó FV después de 4 semanas de tratamiento en 16 pacientes (50%) durante 18 episodios de replicación de CMV (18%). En 2 episodios (5%) se observó fallo clínico junto con FV (coriorretinitis y polirradiculopatía). No se detectaron mutaciones de los genes UL97 y UL54 en ningún episodio de replicación vírica después de las 4 semanas de tratamiento.
En 6 de los 81 pacientes (7,4%) se desarrolló enfermedad por CMV (4 neumonitis, una coriorretinitis y una polirradiculoneuropatía); sólo 2 de estos habían recibido tratamiento anticipado con ganciclovir.
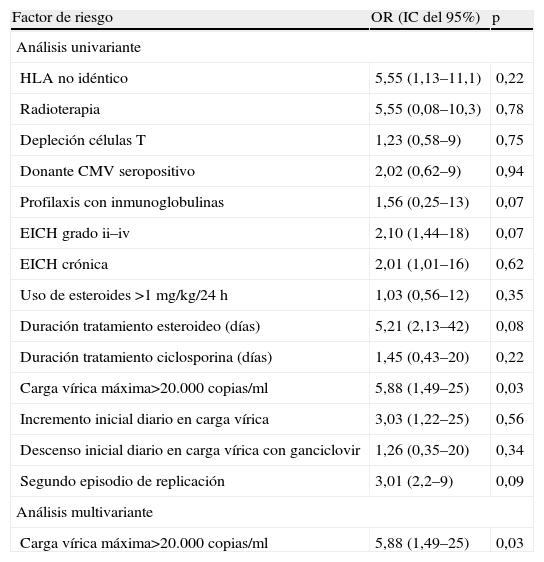
Factores de riesgo de fallo virológico después de 4 semanas de tratamiento anticipadoEl análisis de la relación entre el desarrollo de FV después de 4 semanas con la cinética vírica y el resto de las variables se muestra en la tabla 3. La presencia de una carga vírica maxima de CMV superior a 20.000copias/ml fue el único factor asociado a FV en el análisis univariante (OR de 5,88, IC del 95%, rango de 1,49 a 25; p=0,03). No se encontró relación entre FV y la tasa de crecimiento o el descenso diario de la carga vírica de CMV. No se encontraron diferencias estadísticamente significativas en ninguna de las variables incluidas (inmunosupresión, tipo de donante, EICH y edad del receptor) entre los pacientes con carga vírica máxima inferior y superior a 20.000copias/ml.
Factores de riesgo de fallo virológico después de 4 semanas de tratamiento anticipado con ganciclovir
| Factor de riesgo | OR (IC del 95%) | p |
| Análisis univariante | ||
| HLA no idéntico | 5,55 (1,13–11,1) | 0,22 |
| Radioterapia | 5,55 (0,08–10,3) | 0,78 |
| Depleción células T | 1,23 (0,58–9) | 0,75 |
| Donante CMV seropositivo | 2,02 (0,62–9) | 0,94 |
| Profilaxis con inmunoglobulinas | 1,56 (0,25–13) | 0,07 |
| EICH grado ii–iv | 2,10 (1,44–18) | 0,07 |
| EICH crónica | 2,01 (1,01–16) | 0,62 |
| Uso de esteroides >1mg/kg/24h | 1,03 (0,56–12) | 0,35 |
| Duración tratamiento esteroideo (días) | 5,21 (2,13–42) | 0,08 |
| Duración tratamiento ciclosporina (días) | 1,45 (0,43–20) | 0,22 |
| Carga vírica máxima>20.000copias/ml | 5,88 (1,49–25) | 0,03 |
| Incremento inicial diario en carga vírica | 3,03 (1,22–25) | 0,56 |
| Descenso inicial diario en carga vírica con ganciclovir | 1,26 (0,35–20) | 0,34 |
| Segundo episodio de replicación | 3,01 (2,2–9) | 0,09 |
| Análisis multivariante | ||
| Carga vírica máxima>20.000copias/ml | 5,88 (1,49–25) | 0,03 |
CMV: citomegalovirus; EICH: enfermedad del injerto contra el huésped; HLA: human leukocyte antigen 'antígenos de histocompatibilidad'; IC: intervalo de confianza; OR: odds ratio.
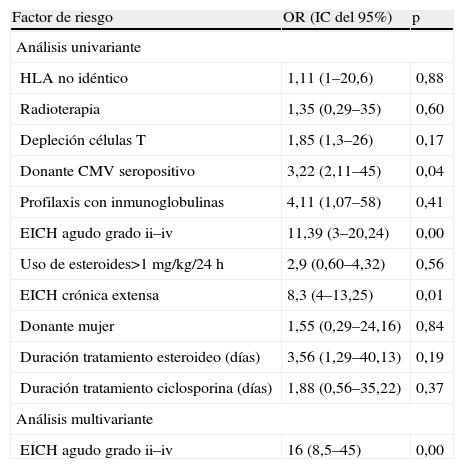
La tabla 4 muestra la relación entre el desarrollo de replicación vírica superior a 20.000copias/ml y sus potenciales factores de riesgo. El modelo de regresión logística multivariable, en el que se incluyeron únicamente las variables estadísticamente significativas en el análisis univariante, identificó como único factor de riesgo la EICH grado ii–iv (OR de 16, IC del 95%, rango de 8,5 a 45; p=0,003).
Factores de riesgo de carga vírica inicial superior a 20.000copias/ml
| Factor de riesgo | OR (IC del 95%) | p |
| Análisis univariante | ||
| HLA no idéntico | 1,11 (1–20,6) | 0,88 |
| Radioterapia | 1,35 (0,29–35) | 0,60 |
| Depleción células T | 1,85 (1,3–26) | 0,17 |
| Donante CMV seropositivo | 3,22 (2,11–45) | 0,04 |
| Profilaxis con inmunoglobulinas | 4,11 (1,07–58) | 0,41 |
| EICH agudo grado ii–iv | 11,39 (3–20,24) | 0,00 |
| Uso de esteroides>1mg/kg/24h | 2,9 (0,60–4,32) | 0,56 |
| EICH crónica extensa | 8,3 (4–13,25) | 0,01 |
| Donante mujer | 1,55 (0,29–24,16) | 0,84 |
| Duración tratamiento esteroideo (días) | 3,56 (1,29–40,13) | 0,19 |
| Duración tratamiento ciclosporina (días) | 1,88 (0,56–35,22) | 0,37 |
| Análisis multivariante | ||
| EICH agudo grado ii–iv | 16 (8,5–45) | 0,00 |
CMV: citomegalovirus; EICH: enfermedad del injerto contra el huésped; HLA: human leukocyte antigen 'antígenos de histocompatibilidad'; IC: intervalo de confianza; OR: odds ratio.
Durante el tratamiento anticipado con ganciclovir se observó anemia (hemoglobina<8gr/dl), trombocitopenia (<20.000×106/l) y neutropenia (<500×106/l) en 6 (14%), 16 (37%) y 7 (16%) pacientes, respectivamente. El tratamiento se interrumpió en todos los pacientes en los que se desarrolló neutropenia. La mediana de tiempo hasta la retirada del tratamiento anticipado con ganciclovir fue de 5 días (rango de 3 a 9). Todos los pacientes toleraron la administración de ganciclovir a mitad de dosis (5mg/kg/24h).
MortalidadQuince de los 81 pacientes (18,5%) incluidos en el estudio fallecieron. Nueve pacientes murieron como consecuencia de procesos infecciosos de origen bacteriano (3 episodios de neumonía, una endocarditis por Staphylococcus aureus y un absceso intraabdominal por Escherichia coli), de origen vírico (2 neumonitis por CMV y una leucoencefalopatía multifocal progresiva) y de origen fúngico (aspergilosis invasiva). En los 2 pacientes que fallecieron de neumonitis por CMV el comienzo de los síntomas coincidió con la detección de replicación vírica de CMV superior a 5.000copias/ml. Los 4 pacientes restantes con enfermedad por CMV respondieron al tratamiento.
DiscusiónLa alta sensibilidad de las técnicas basadas en la PCR permite la detección de pequeñas cantidades de ácido desoxirribonucleico vírico. Sin embargo, la aplicación de estas técnicas en la práctica clínica no se encuentra bien establecida9. Algunos autores han indicado que el tratamiento anticipado debe iniciarse únicamente en aquellos pacientes que presentan una carga vírica de CMV por encima de un valor umbral preestablecido, lo que permitiría reducir el número de pacientes que reciben tratamiento antivírico10–12. Sin embargo, el retraso en el inicio del tratamiento anticipado hasta alcanzar ese valor umbral de carga vírica puede ser una estrategia escasamente segura, especialmente en aquellos pacientes con alto riesgo de replicación acelerada de CMV.
Los resultados muestran una alta tasa de FV después de 4 semanas de tratamiento anticipado con ganciclovir (18 de los 39 episodios de replicación). Esto puede indicar que el protocolo de tratamiento anticipado no era eficaz en un cierto número de pacientes en los que otras estrategias de profilaxis pueden ser más eficaces. Aunque la carga vírica de CMV descendió en la mayoría de los pacientes tras el inicio del tratamiento anticipado, otro grupo de pacientes presentó replicación vírica de bajo grado, incluso cuando el tratamiento con ganciclovir se prolongó hasta la semana 4, lo que pudo presentar además un fracaso clínico en esta situación.
Este estudio indica que una carga vírica inicial de CMV muy alta (>20.000copias/ml) es el principal factor de riesgo para FV después de 4 semanas de tratamiento anticipado con ganciclovir. Resulta lógico pensar que esta situación pueda ocurrir en los pacientes de alto riesgo, los que pueden presentar una dinámica de replicación muy activa. Por todo esto, se investiga qué grupo de pacientes presenta mayor riesgo de desarrollo de una carga vírica máxima de CMV superior a 20.000copias/ml en el protocolo de tratamiento anticipado. En este sentido, la EICH grado ii-iv representó el principal factor de riesgo (OR de 16, IC del 95%, rango de 8,5 a 45), lo que confirma los datos procedentes de estudios anteriores13. Además, en los pacientes con EICH moderada a grave, otros estudios han identificado otras poblaciones de riesgo entre las que se incluyen los receptores de injertos HLA no idénticos, injertos de donantes no relacionados o injertos de donantes con reducción de linfocitos T y pacientes tratados con regímenes de acondicionamiento no mieloablativos o alemtuzumab1,14–17. Por tanto, en todas estas poblaciones de alto riesgo parece razonable establecer que la profilaxis universal puede ser una estrategia profiláctica más adecuada que el tratamiento anticipado.
En este estudio, ninguno de los pacientes en los que se detectó inicialmente una carga vírica de CMV inferior a 5.000copias/ml presentó posteriormente negativización de la carga vírica en las siguientes determinaciones de seguimiento. Sin embargo, se han observado situaciones en las que una primera replicación vírica de bajo grado se ha seguido de una segunda replicación vírica superior a 5.000copias/ml. Debido al diseño del estudio no es posible analizar la progresión de estos pacientes y, en particular, el riesgo de desarrollo de enfermedad por CMV, ya que todos los pacientes recibieron tratamiento anticipado. Sin embargo, el hecho de que el 36% de los episodios de replicación con una carga vírica de CMV inferior a 5.000copias/ml se continuaran con una segunda determinación superior a 5.000copias/ml demuestra que cuando se emplea tratamiento anticipado en pacientes de alto riesgo ésta debería comenzarse ante cualquier grado de replicación vírica.
La relación entre el grado de replicación y el riesgo de desarrollo de enfermedad por CMV se ha demostrado anteriormente4,18. En esta serie, 4 de los 81 pacientes (5%) presentaron síntomas de neumonitis por CMV que coincidió con la detección de la primera carga vírica superior a 5.000copias/ml, lo que indicó la presencia de una rápida cinética de replicación vírica.
Resulta destacable que la reducción parcial de linfocitos T, manteniendo un número suficiente de linfocitos T CD8+, no se identificó como un factor de riesgo de replicación de CMV. Este fenómeno se ha descrito previamente en relación con la infección por virus de Epstein-Barr y puede ser debido al hecho de que el mantenimiento de 1×106 linfocitos T CD8+/kg en el injerto es suficiente para mantener la respuesta inmune y, por tanto, evitar la replicación vírica19.
Los resultados de este estudio contrastan con los resultados que publicaron recientemente Verkruyse et al12, en los que se concluye que en pacientes clínicamente estables el retraso del tratamiento anticipado hasta un valor umbral de carga vírica igual o superior a 10.000copias/ml (determinada por PCR en sangre total) resulta una estrategia profiláctica segura y eficaz. En este estudio, el 93% de los pacientes en tratamiento anticipado mostró aclaramiento de la viremia después de 5 semanas de tratamiento. Sin embargo, en un análisis por intención de tratar, esta estrategia fue ineficaz en 2 de 23 pacientes (8,6%) en los que la carga vírica inicial de CMV fue igual o superior a 10.000copias/ml. Además, y al igual que en este estudio, este alto grado de replicación coincidió con el desarrollo de neumonitis grave por CMV.
En conclusión, los resultados indican que un alto grado de replicación vírica de CMV (>20.000copias/ml) es el principal factor de riesgo de FV después de 4 semanas de tratamiento anticipado con ganciclovir. Debido a que este factor se presenta en pacientes con EICH moderada a grave, otras estrategias profilácticas (como la profilaxis universal o el inicio de tratamiento anticipado ante las primeras pruebas de replicación vírica) deberían emplearse en esta población.
FinanciaciónLa Red Española para la Investigación en Patologías Infecciosas (REIPI RD06/0008), el Ministerio de Sanidad y Consumo y el Instituto de Salud Carlos III han financiado parcialmente este trabajo.