A pesar de los avances en el tratamiento del cáncer de recto y la expansión del abordaje terapéutico multimodal, todavía es necesaria la realización de una amputación abdominoperineal (AAP) como tratamiento radical en el 20-30% de los casos.
La AAP del recto está gravada con una importante morbilidad, destacando la obstrucción intestinal y las complicaciones de la herida, pudiendo desarrollarse una enteritis rádica en el 15% de los casos sometidos a radioterapia postoperatoria. Además, con el fin de mejorar los resultados oncológicos a nivel local, se recomienda la realización de una AAP ampliada, técnica que precisa de un procedimiento de reconstrucción perineal que permita un cierre sin tensión en un tejido previamente radiado y prevenga el desarrollo de hernias perineales.
El objetivo de este trabajo es revisar los métodos de reparación pélvica y perineal tras la AAP por cáncer, con especial atención a las nuevas técnicas de reparación protésica.
Despite the advances in the treatment of cancer of the rectum and the expansion of the multimodal therapeutic technique, abdominoperineal resection (APR) still needs to be performed as radical treatment in 20-30% of cases.
APR of the rectum involves a significant morbidity, including intestinal obstruction and wound complications, with radiotherapy-induced enteritis being able to develop in 15% of cases subjected to post-operative radiotherapy. Furthermore, with the aim of improving local oncology results, an extended APR is recommended; a technique that requires a perineal reconstruction technique that allows a tension free closure in a previously radiated tissue and may prevent perineal hernias developing.
The objective of this article is to review pelvic and perineal repair methods after APR due to cancer, with special attention to the new prosthetic repair techniques.
El cáncer colorrectal es la neoplasia más frecuente en España en ambos sexos, con 25.600 casos diagnosticados cada año, de los cuales un tercio aproximadamente se localiza en el recto1. A pesar de los avances en el tratamiento del cáncer de recto y la expansión del abordaje terapéutico multimodal, todavía es necesaria la realización de una amputación abdominoperineal (AAP) como tratamiento radical en el 20-30% de los casos2,3.
La AAP del recto está gravada con una importante morbilidad, destacando la obstrucción intestinal4,5 y las complicaciones de la herida perineal (retraso de la cicatrización, dehiscencia, sinus y hernia perineal)6.
La ocupación de la pelvis por el intestino delgado tras la cirugía se asocia con una incidencia de obstrucción intestinal de 8-19%4,5, pudiendo desarrollarse una enteritis rádica en el 15% de los casos sometidos a radioterapia postoperatoria7,8. El 50% de estos pacientes requerirá tratamiento quirúrgico por alguna complicación, cirugía que se encuentra gravada con una morbilidad del 50% y una mortalidad del 15%7,8.
Por otro lado, con el fin de mejorar los resultados oncológicos a nivel local, se recomienda la realización de una AAP cilíndrica o ampliada9,10, técnica que con frecuencia precisa de reconstrucción perineal que permita un cierre sin tensión en un tejido previamente radiado11 y prevenga el desarrollo de hernias perineales12.
El objetivo de este trabajo es analizar con sentido crítico las distintas técnicas de reparación pélvica y perineal tras la AAP por cáncer, con especial atención a las nuevas técnicas de reparación protésica.
Técnicas de partición pélvicaLa fijación postoperatoria de las asas del intestino delgado en una pelvis operada es un factor de riesgo para desarrollar una obstrucción intestinal adherencial. Además, la falta de movilidad del intestino derivada de esta fijación incrementa su exposición a la radioterapia postoperatoria y, en consecuencia, el riesgo de desarrollar una enteritis por radiación7.
Se han diseñado numerosas estrategias de tratamiento médico y prevención de los efectos de la radioterapia, con resultados poco alentadores. El reposo digestivo, la utilización de radioprotectores, antidiarreicos y probióticos, el oxígeno hiperbárico, la terapia endoscópica y la radioterapia de intensidad modulada ofrecen resultados poco consistentes y son, en muchos casos, terapias sintomáticas que no ofrecen una solución definitiva al problema13. Por todo ello, las técnicas quirúrgicas que evitan la ocupación y fijación del intestino en la pelvis (partición pélvica) constituyen una de las principales herramientas disponibles para la prevención de estas complicaciones.
La partición pélvica puede realizarse mediante tejido autólogo o protésico. La sutura primaria del peritoneo pélvico o reperitonización es una técnica común de partición pélvica14. Para evitar un cierre peritoneal bajo tensión se han utilizado el útero, la vejiga o la aponeurosis posterior del músculo recto abdominal15,16. A pesar de su sencillez, al tratarse de un cierre bajo tensión tisular el riesgo de disrupción de la reperitonización es alto, no evitando de forma definitiva la fijación del intestino a la pelvis y sus consecuencias. Así, Chen et al16 registraron una incidencia de enteritis postradioterapia del 12% con esta técnica, cifra cercana al 15% de incidencia global aceptada para esta complicación7.
La utilización del epiplón mayor es la técnica de partición pélvica más empleada, utilizándose como un colgajo pediculado a través de los vasos gastroepiploicos izquierdos cuyo extremo final se sutura al peritoneo parietal pélvico, a la grasa perineal o se abandona libre en la pelvis17–27. Curiosamente, en la mayoría de estos estudios sólo se analizan las complicaciones de la herida perineal, no incluyéndose resultados sobre la incidencia de obstrucción intestinal y de enteritis postradioterapia. Únicamente Russ et al19, en una serie retrospectiva de 24 casos, mencionan de forma subjetiva que la tolerancia a la radioterapia tras oclusión pélvica con epiplón mayor se encuentra mejorada.
Por último, también es posible realizar una omentopexia utilizando el epiplón como una “hamaca”, suturando sus bordes libres al promontorio sacro, pared abdominal anterior y serosa del colon28,29. Si bien ambas series presentan resultados positivos, son especialmente significativos los presentados por Choi y Lee29, quienes en un estudio prospectivo no aleatorizado encontraron una diferencia muy significativa al comparar la toxicidad intestinal crónica tras radioterapia en pacientes con omentopexia (12%) y un grupo control (40%).
A pesar de la amplia utilización de la partición pélvica con tejidos autólogos y especialmente del epiplón mayor, no existe una sólida evidencia científica que avale la utilización de un método u otro. Por ello, aunque a la luz de los estudios disponibles sea difícil proponer una recomendación, la ausencia o el tamaño del omento, las posibilidades de suturar el peritoneo pélvico sin tensión, la utilización de la vía laparoscópica y las preferencias del equipo son los factores que determinarán la elección de la técnica.
En el caso de no poder utilizar tejido nativo para realizar la partición pélvica, se han propuesto técnicas alternativas como la oclusión pélvica mediante prótesis de mama30, moldes sintéticos31 y expansores tisulares32–34. La oclusión pélvica por un material protésico evita que el intestino se adhiera a otros tejidos y se exponga al área de radiación, disminuyendo las complicaciones relacionadas con la radioterapia. Sin embargo, estas técnicas requieren una reintervención para retirar el implante y se han relacionado con una importante morbilidad (infecciones, fístulas, erosión vascular), no habiéndose extendido su uso34,35.
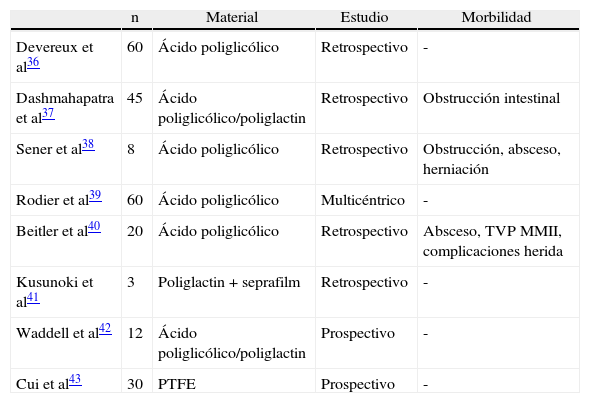
Por último, otra opción protésica de partición pélvica es la utilización de mallas (tabla 1). La primera descripción de esta técnica corresponde a Deveraux et al36, autores que utilizaron una malla reticular de ácido poliglicólico instalada en “hamaca”, evitando la caída del paquete intestinal hacia la pelvis. Posteriormente, han sido publicados varios trabajos que describen la utilización de la misma técnica37–40, otros materiales absorbibles41,42 e incluso prótesis irreabsorbibles43, quedando demostrada su eficacia para prevenir la obstrucción intestinal por adherencias pélvicas y la enteritis por radiación36,37,39. Sin embargo, la instalación de mallas se asocia con una prolongación del tiempo de cirugía, desarrollo de íleo postoperatorio7 y complicaciones derivadas de la malla, tales como obstrucción36,37, fístula intestinal36, absceso pélvico36,40, herniación de asas entre la pelvis y la malla37 y trombosis venosa profunda de los miembros inferiores40. A pesar de las complicaciones descritas, se ha sugerido que no se debería evitar el uso de estas técnicas ya que su aparición es anecdótica y muchas de ellas pueden evitarse con una cuidadosa técnica quirúrgica7. Recientemente, Cui et al43 han presentado los resultados de un estudio prospectivo aleatorizado instalando como técnica de partición una prótesis de e-PTFE, utilizando como grupo control pacientes con reperitonización convencional. Los pacientes en los que se utilizó e-PTFE no presentaron episodios de oclusión intestinal tras un seguimiento medio de 18 meses, con una excelente tolerancia en términos de morbilidad postoperatoria, resolución del íleo postoperatorio y alta hospitalaria. Aunque la experiencia con esta técnica es escasa, a la vista de estos resultados y de la aparición de nuevos materiales protésicos con excelente manejabilidad tanto por vía laparotómica como laparoscópica, buen comportamiento en contacto con vísceras huecas y excelente tolerancia a la infección, se hace muy atractivo el uso de mallas como técnica de partición pélvica tras AAP.
Partición pélvica con mallas
| n | Material | Estudio | Morbilidad | |
| Devereux et al36 | 60 | Ácido poliglicólico | Retrospectivo | - |
| Dashmahapatra et al37 | 45 | Ácido poliglicólico/poliglactin | Retrospectivo | Obstrucción intestinal |
| Sener et al38 | 8 | Ácido poliglicólico | Retrospectivo | Obstrucción, absceso, herniación |
| Rodier et al39 | 60 | Ácido poliglicólico | Multicéntrico | - |
| Beitler et al40 | 20 | Ácido poliglicólico | Retrospectivo | Absceso, TVP MMII, complicaciones herida |
| Kusunoki et al41 | 3 | Poliglactin+seprafilm | Retrospectivo | - |
| Waddell et al42 | 12 | Ácido poliglicólico/poliglactin | Prospectivo | - |
| Cui et al43 | 30 | PTFE | Prospectivo | - |
TVP MMII: trombosis venosa profunda de los miembros inferiores.
Otro problema distinto tras la realización de una AAP es la necesidad de reconstrucción del suelo pélvico, maniobra especialmente importante tras la realización de una AAP cilíndrica o ampliada. La alta tasa de infección y dehiscencia de la herida perineal tras un cierre primario es un problema importante (25-60%), cuya incidencia se incrementa tras la administración de radioterapia6,11. Además, según la literatura, existe un 3,5% de riesgo de desarrollar una hernia perineal6,12.
Tradicionalmente, los grandes defectos perineales se han tratado mediante colgajos miocutáneos de músculo recto abdominal, glúteo o gracilis9,44–51.
El colgajo de músculo recto anterior del abdomen ha sido muy utilizado ya que aporta una importante superficie de piel, tejidos para ocluir la pelvis y alcanza bien la superficie del periné, obteniéndose excelentes resultados46–48,50. Recientemente, Lefevre et al48 han publicado los resultados obtenidos con este tipo de colgajo en un estudio retrospectivo que compara los resultados obtenidos mediante el colgajo de músculo recto abdominal y la omentoplastia. Los pacientes reconstruidos por medio de colgajo presentaron una disminución muy significativa del tiempo de cicatrización del periné, de las complicaciones de la herida perineal y una ausencia de hernias en esta localización. Finalmente, aunque uno de los aspectos más criticados de este colgajo es la incidencia de complicaciones de la herida abdominal51, la incidencia de eventración en pacientes tratados mediante colgajo no excedió la del grupo control (7 vs 9,6%)48. Esta complicación, junto a la dificultad en el posicionamiento de los estomas, han sido los aspectos más criticados a la utilización del colgajo del músculo recto anterior del abdomen51.
Con respecto al colgajo de músculo gracilis, existe menos experiencia. Parece que, además de proporcionar un injerto de menor tamaño, el colgajo de músculo gracilis se acompaña de una tasa de complicaciones locales (absceso, necrosis) no despreciable45.
Finalmente, aunque existen referencias previas44, la publicación de la experiencia de Holm et al9 ha reeditado el interés por la utilización de colgajos dependientes del músculo glúteo como técnica de reparación51. Estas técnicas obtienen una importante cantidad de tejido, con una amplia superficie cutánea y una fácil movilización, con escasas complicaciones9,51.
A pesar de que los resultados obtenidos con los colgajos demuestran una menor incidencia de complicaciones de la herida perineal, todos se asocian a una complejidad técnica que puede precisar de otros especialistas, tiempos quirúrgicos prolongados, largos períodos de reposo en cama y riesgo de necrosis del colgajo9,44. No obstante, la utilización de colgajos miocutáneos continúa siendo la opción técnica más frecuentemente utilizada para la reconstrucción perineal tras la realización de una AAP ampliada.
Recientemente, con el desarrollo de nuevos materiales protésicos, se ha propuesto la utilización de distintos tipos de prótesis absorbibles de origen biológico52–54.
Las propiedades de estas prótesis en términos de regeneración tisular, resistencia a la infección, tolerancia y manejabilidad, las hacen atractivas para este tipo de reconstrucción55,56. La experiencia acumulada con este tipo de reparación es escasa52–54, habiéndose comunicado buenos resultados pero con una morbilidad frecuente (seroma en 6-26%52–54 y dolor perineal en 33%53,54), aunque clínicamente poco significativa.
ConclusionesA pesar de los avances en el tratamiento del cáncer de recto y la expansión del abordaje terapéutico multimodal, la AAP continúa siendo una opción técnica necesaria en un 30% de los casos.
Las técnicas de partición pélvica son necesarias para evitar la morbilidad derivada de la ocupación y fijación del intestino en la pelvis tras la realización de una APP, fundamentalmente en aquellos casos que recibirán radioterapia postoperatoria.
Aunque existen descritas numerosas técnicas de partición pélvica, la utilización del epiplón mayor para ocluir la pelvis continúa siendo la opción más frecuentemente utilizada. Sin embargo, en los pacientes con ausencia o escasez de epiplón mayor, la utilización de mallas puede ser una alternativa válida, aunque no existe suficiente experiencia para poder recomendar su utilización de forma rutinaria.
En aquellos pacientes sometidos a una AAP ampliada se hace necesaria la realización de una técnica de reconstrucción perineal mediante la elaboración de colgajos miocutáneos, fundamentalmente dependientes del músculo recto anterior del abdomen o del glúteo mayor. Sin embargo, debido a su complejidad técnica y morbilidad asociada, la utilización de mallas también podría jugar un papel importante en este tipo de reparación.
Finalmente, aunque la utilización de mallas para la partición pélvica y reconstrucción perineal tras AAP del recto es simple y eficaz, la experiencia acumulada es escasa, siendo necesarios estudios que aclaren sus indicaciones, la elección de los materiales más adecuados y los aspectos técnicos en relación a su colocación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.