La quimioterapia neoadyuvante (QTN) es el tratamiento de elección en las pacientes con cáncer de mama localmente avanzado e inflamatorio. Los objetivos de este tratamiento son mejorar las opciones quirúrgicas (convertir tumores inoperables en operables, así como obtener mejores resultados estéticos), determinar la respuesta a la quimioterapia (respuesta patológica completa [pCR, en sus siglas en inglés]) y aumentar la supervivencia libre de enfermedad.
La QTN es una situación clínica ideal para investigar predictores moleculares de respuesta, predecir los pacientes que conseguirán una pCR y los pacientes con un pronóstico favorable, aunque no alcancen una pCR.
Los estudios actuales definirán mejor el esquema óptimo de quimioterapia (nuevos fármacos) y los pacientes que más se beneficiarán de este tratamiento.
Neoadjuvant systemic therapy (NST) has become widely accepted as the treatment of choice for patients with locally advanced and inflammatory breast cancer. In general, NST is used to improve the surgical options (induction of tumour shrinkage that may render inoperable tumours amenable to surgery and may allow smaller resection and better cosmetic outcome for patients with operable tumours), to determine the response to NST (pCR: pathologic complete response), and to obtain long-term disease-free survival. NST is an ideal clinical setting to discover molecular predictors of response to therapy, to predict patients who will achieve a pCR, and patients who will have a favourable prognosis despite not achieving a pCR.
Current trials will better define the optimal NST (new drugs) and those patients who might best benefit from this therapy.
La quimioterapia neoadyuvante (QTN) es el tratamiento estándar en el cáncer de mama localmente avanzado e inflamatorio1. Los principales objetivos de la QTN son conseguir una cirugía conservadora, controlar de forma temprana la enfermedad micrometastásica, disminuir el tamaño tumoral (downstaging) y testar la quimiosensibilidad del tumor in vivo. La respuesta a la QTN es un predictor de respuesta a largo plazo y da información pronóstica después de un breve tiempo de seguimiento, a diferencia de los estudios en adyuvancia que proporcionan resultados a 5–10 años de seguimiento.
Se empezó a utilizar en la década de 1980 en las pacientes con cáncer de mama localmente avanzado, y su objetivo era convertir los tumores inoperables en operables1. Dados los buenos resultados que se obtuvieron, se empezó a realizar estudios en pacientes con enfermedad en estadios iniciales. Los primeros estudios clínicos tenían como objetivo determinar si el tratamiento sistémico de inicio resultaba superior en términos de supervivencia libre de enfermedad y supervivencia global2. Recientemente, gracias a los perfiles de expresión génica, se ha observado que el cáncer de mama es una enfermedad heterogénea, dividida en diferentes subtipos moleculares (luminal A, luminal B, receptor del factor de crecimiento epidérmico humano 2 [HER-2] y triple negativo) con diferencias en términos de pronóstico y respuesta a la quimioterapia3.
El subtipo HER-2 (sobreexpresado o amplificado en el cáncer de mama localmente avanzado y metastático en un 35%, y en el cáncer de mama inflamatorio en un 40%)4 presenta un beneficio en supervivencia al añadir trastuzumab de forma concomitante a la quimioterapia en estadio inicial y metastásico, lo que ha llevado a su estudio en neoadyuvancia5.
El objetivo de esta revisión es analizar los diferentes estudios que se han realizado sobre QTN en diferentes áreas y los resultados obtenidos.
Material y métodosLa información de esta revisión se ha obtenido a partir de una búsqueda bibliográfica en PubMed y se han escogido los artículos publicados desde el inicio de la QTN hasta la actualidad. Se han excluido los estudios de tratamiento hormonal neoadyuvante.
Quimioterapia neoadyuvante frente a adyuvanteSe han diseñado diferentes ensayos fase III aleatorizados con el objetivo de contestar si la QTN es mejor que la QT adyuvante, por lo que se han administrado los mismos esquemas de quimioterapia antes y después de la cirugía. Los objetivos primarios en la mayoría de estos estudios han sido la supervivencia global (SG) y la supervivencia libre de enfermedad (SLE).
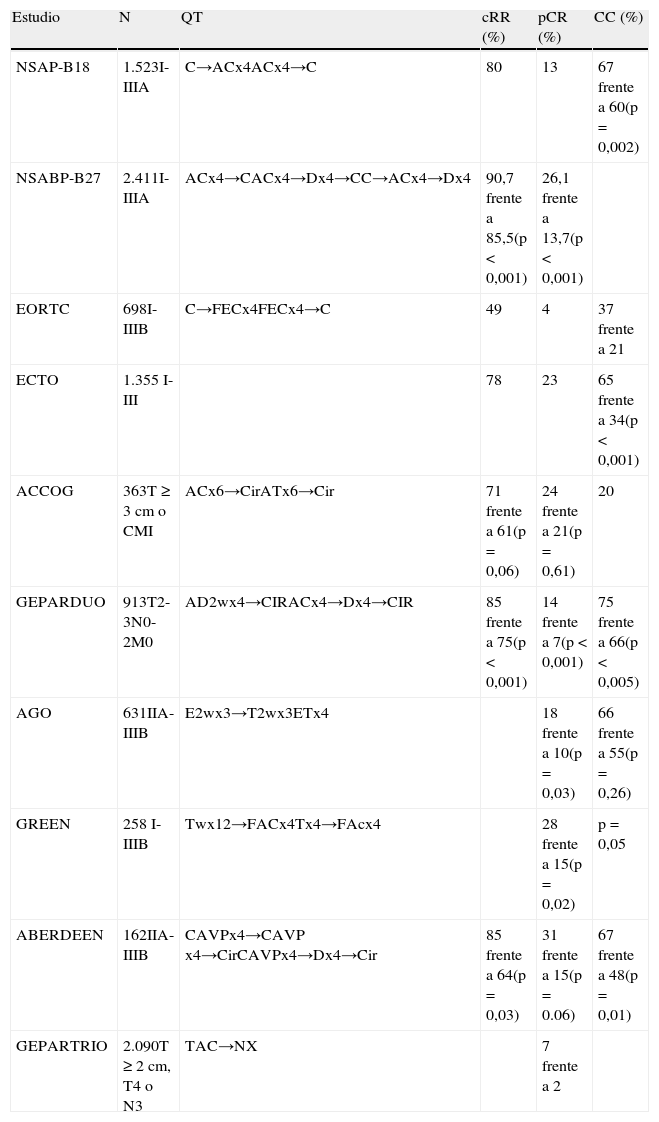
El primer estudio bien diseñado y con un buen tamaño muestral fue el NSABP-B186, en el que se comparaban cuatro ciclos de antraciclinas de forma neoadyuvante y el mismo esquema de forma adyuvante. Se observó un aumento del porcentaje de respuesta (RR), de respuesta clínica completa (cCR) y de respuesta patológica completa (pCR) en el grupo con QTN (el 80, el 36 y el 13%, respectivamente). Del 13% que consiguió una pCR, un 4% presentó carcinoma ductal in situ residual. La realización de cirugía conservadora fue mayor en el grupo en que se administró quimioterapia de forma neoadyuvante (el 67 frente al 60%; p=0,002). En un análisis por subgrupos, este fue el primer ensayo que demostró que la obtención de pCR se asociaba a una SLE mayor y una SG mayor, en comparación con las que obtenían menores grados de respuesta. A los 9 años de seguimiento7, siguen sin observarse diferencias en términos de SLE (el 55 frente al 53%) o SG (el 69 frente al 70%). Pacientes con mayor pCR, presentan mejor SLE a los 5 años (p=0,00005), SG (p=0,0008) y supervivencia libre de recaída (p<0,0001).
En el estudio de la EORTC8, las pacientes se aleatorizaban a 4 ciclos de FEC antes y después de la cirugía. La RR, cCR y pCR fueron del 49, el 7 y el 4%, respectivamente. La SG, la SLE y la recaída locorregional fueron similares en los 2 grupos, sin presentar diferencias estadísticamente significativas. En este estudio, de nuevo se demostró que conseguir una pCR se asociaba a una mejor supervivencia. Estos dos estudios comentados previamente muestran que 3 meses con antraciclinas en esquema neoadyuvante o adyuvante no presentan diferencias en ILE ni SG, aumentando la cirugía conservadora con aceptable control local.
En el estudio ECTO9, se aleatorizó a las pacientes a 4 ciclos de doxorubicina/paclitaxel seguidos de 4 ciclos de CMF en esquema neoadyuvante, frente a 2 esquemas en adyuvancia: el mismo esquema y un tercer brazo de 4 ciclos de doxorubicina seguido de 4 ciclos de CMF. La pCR en la rama de QTN fue de un 23% en mama y un 20% en mama y axila. El porcentaje de cirugía conservadora fue mayor en la neoadyuvancia (el 65 frente al 34%; p<0,001). A los 5 años de seguimiento10, la SLE (p=0,24) y la SG (p=0,81) fueron similares en las 2 ramas.
En 2005 se publicó el metaanálisis de Mauri et al11, cuyo objetivo era contestar a la pregunta de si la QTN era mejor que la quimioterapia adyuvante. Se incluyeron 9 estudios aleatorizados, en los que la pCR era altamente variable. No se observaron diferencias en cuanto a SG, SLE, ni recidivas a distancia, y la probabilidad de progresión durante el tratamiento neoadyuvante era extremadamente baja. No obstante, se observó un porcentaje mayor de cirugía conservadora, aunque con un aumento del riesgo de recurrencia locorregional (RR=1,22; p=0,15) en el grupo con neoadyuvancia, sobre todo cuando sólo se realizaba radioterapia sin cirugía (RR=1,53; p=0,009) en las pacientes que conseguían una cCR. Esto último enfatizaba la importancia de incorporar la cirugía en el tratamiento locorregional después de la QTN.
En 2007 se presentó un metaanálisis en el que se incluían 14 estudios con 5.500 pacientes, en el que se observó que no había diferencias en SG en cuanto a QTN o QT adyuvante. En el grupo neoadyuvante, se detectó un porcentaje menor de mastectomías (RR=0,71; intervalo de confianza [IC] del 95%, 0,67–0–75) sin empeorar el control local (hazard ratio [HR] = 1,12; IC del 95%, 0,92–1,37). Esta revisión demostraba que el incremento del porcentaje de recidiva local asociado a QTN se reduce de forma importante después de excluir los estudios en los que los pacientes reciben exclusivamente radioterapia después de la regresión tumoral completa12.
Esquema y número de ciclos óptimoLa respuesta clínica tumoral se observa en un 70–90% de las pacientes con QTN, que varía en función del tipo de QT y el número de ciclos13. Se han diseñado varios estudios para responder a esta cuestión.
El NSABP-B2714 es el mayor estudio que compara QTN con antraciclinas y taxanos. En este estudio, añadir docetaxel a antraciclinas no varió de forma estadísticamente significativa ni la SLE, ni la SG. No obstante, en el subgrupo de pacientes que obtuvieron una respuesta parcial a antraciclinas, la administración de docetaxel demostró un aumento en SLE (HR=0,71; p=0,007), mientras que en las no respondedoras no se mejoraron estos resultados. La consecución de una pCR se asociaba con una mayor SG (HR=0,33; p<0,0001) y SLE (HR=0,45; p<0,0001).
En el estudio ACCOG15 se aleatorizó a 363 pacientes con cáncer de mama inflamatorio o localmente avanzado a 6 ciclos de AC (doxorubicina más ciclofosfamida) o AD (doxorubicina más docetaxel). A los 32 meses de seguimiento, no había diferencias significativas entre las 2 ramas en términos de RR (el 61 frente al 70%), cCR (el 17 frente al 20%), cirugía conservadora (el 20 frente al 20%), pCR (el 24 frente al 21%) o porcentaje de recaída (el 31 frente al 25%).
Hasta el momento, el esquema óptimo de QTN no está establecido, aunque una combinación de 4 ciclos de antraciclinas seguidas de cuatro 4 de taxanos (paclitaxel semanal o docetaxel trisemanal) es la combinación que consigue el porcentaje mayor de pCR (22–31%)16. No obstante, hay un grupo de bajo riesgo en los que la adición de taxanos tiene un beneficio mínimo. Un objetivo que debe conseguirse es poder identificar factores pronósticos que nos ayuden a individualizar el régimen de QTN apropiado para estos pacientes con la mínima toxicidad. Otras preguntas que se deben responder serían si la administración de antraciclinas y taxanos ha de ser secuencial o concurrente, y si estos últimos se han de administrar de forma semanal o trisemanal. Para ello, se diseñaron los estudios siguientes:
- –
En el estudio GeparDuo17, se aleatorizó a 913 pacientes a 4 ciclos de AD cada 2 semanas o 4 ciclos de AC cada 3 semanas, seguido de 4 ciclos de D. La rama secuencial estaba asociada a mayor cRR (el 85 frente al 75%; p<0,001), pCR (el 22 frente al 11%; p<0,001) y cirugía conservadora (el 75 frente al 66%; p<0,005). Posiblemente, la adición de ciclofosfamida ayudó a estos resultados.
- –
En el estudio AGO18, se aleatorizó a 631 pacientes a 3 ciclos de dosis densas de epirubicina, seguido de 3 ciclos de dosis densas de paclitaxel, o 4 ciclos de epirubicina más paclitaxel cada 3 semanas seguidos de cirugía. El esquema de dosis densas estaba asociado con una mayor pCR (el 18 frente al 10%; p=0,03) y cirugía conservadora (el 66 frente al 55%; p=0,26).
- –
En el estudio de Green19, se aleatorizó a 258 pacientes a 12 ciclos de paclitaxel semanal o cada 3 semanas por 4 ciclos seguido de 4 ciclos de FAC (fluorouracilo, doxorubicina y ciclofosfamida). El esquema semanal se asoció a una mayor pCR (el 28 frente al 16%; p=0,02) y cirugía conservadora (p=0,05).
Estos estudios indican que el esquema secuencial de antraciclinas y taxanos se asocia a mejores resultados que el esquema concurrente. Sin embargo, es imposible determinar si el beneficio observado es resultado del uso secuencial o por las diferencias en las dosis administradas de quimioterapia (mayores en la rama secuencial) o la duración del tratamiento (mayores en la rama secuencial)20. Similar a los resultados en los estudios de cáncer de mama metastásico, el esquema de paclitaxel semanal, es más activo21.
En algunos estudios se ha evaluado la respuesta durante el tratamiento con la intención de optimizar el siguiente esquema de quimioterapia que se debe administrar:
- –
En el estudio de Aberdeen22, en las pacientes que consiguieron una cCR a CVAP (ciclofosfamida, doxorubicina, vincristina y prednisolona) por 4 ciclos, el cambio a docetaxel aumentó el número de respuestas (el 85 frente al 64%; p=0,03), pCR (el 31 frente al 15%; p=0,06), SLE a 5 años (el 90 frente al 72%; p=0,04), SG a los 5 años (el 97 frente al 78%; p=0,04) y cirugía conservadora (el 67 frente al 48%; p=0,01). Incluso las pacientes que no respondieron tenían buena respuesta a docetaxel con un porcentaje de respuesta global del 47% (CR [respuesta completa] = 11%; PR [respuesta parcial] = 36%).
- –
En el estudio GeparTrio23 con un diseño similar, si después de 2 ciclos de QTN esquema TAC había una reducción del tumor superior al 50%, las pacientes se aleatorizaban a 4 o 6 ciclos más de TAC. Se aleatorizó a las no respondedoras a 4 ciclos más de TAC o 4 ciclos de vinorelbina y capecitabina. De las 627 pacientes no respondedoras, se observó que no había diferencias entre las 2 ramas en términos de cCR, pCR y cirugía conservadora. La pCR fue muy baja en las 2 ramas (el 7 frente al 2%), similar a los resultados del estudio Aberdeen.
Los resultados de estos estudios se resumen en la tabla 1.
Sumario de los resultados de los estudios con neoadyuvancia
| Estudio | N | QT | cRR (%) | pCR (%) | CC (%) |
| NSAP-B18 | 1.523I-IIIA | C→ACx4ACx4→C | 80 | 13 | 67 frente a 60(p=0,002) |
| NSABP-B27 | 2.411I-IIIA | ACx4→CACx4→Dx4→CC→ACx4→Dx4 | 90,7 frente a 85,5(p<0,001) | 26,1 frente a 13,7(p<0,001) | |
| EORTC | 698I-IIIB | C→FECx4FECx4→C | 49 | 4 | 37 frente a 21 |
| ECTO | 1.355 I-III | 78 | 23 | 65 frente a 34(p<0,001) | |
| ACCOG | 363T≥3cm o CMI | ACx6→CirATx6→Cir | 71 frente a 61(p=0,06) | 24 frente a 21(p=0,61) | 20 |
| GEPARDUO | 913T2-3N0-2M0 | AD2wx4→CIRACx4→Dx4→CIR | 85 frente a 75(p<0,001) | 14 frente a 7(p<0,001) | 75 frente a 66(p<0,005) |
| AGO | 631IIA-IIIB | E2wx3→T2wx3ETx4 | 18 frente a 10(p=0,03) | 66 frente a 55(p=0,26) | |
| GREEN | 258 I-IIIB | Twx12→FACx4Tx4→FAcx4 | 28 frente a 15(p=0,02) | p=0,05 | |
| ABERDEEN | 162IIA-IIIB | CAVPx4→CAVP x4→CirCAVPx4→Dx4→Cir | 85 frente a 64(p=0,03) | 31 frente a 15(p=0.06) | 67 frente a 48(p=0,01) |
| GEPARTRIO | 2.090T≥2cm, T4 o N3 | TAC→NX | 7 frente a 2 |
AC: doxorubicina más ciclofosfamida; AD: doxorubicina y docetaxel; AT: doxorubicina y paclitaxel; C: ciclofosfamida; CAVP: ciclofosfamida, doxorubicina, vincristina y prednisolona; CC: cirugía conservadora; CMF: ciclofosfamida, metotrexato y fluorouracilo; D: docetaxel; ET: epicubicina y paclitaxel; FAC: fluorouracilo, doxorubicina y ciclofosfamida; FEC: fluorouracilo, epirubicina y ciclofosfamida; NX: vinorelbina y capecitabina; pCR: respuesta patológica completa; RR: porcentaje de respuestas; QT: quimioterapia; TAC: docetaxel, doxorubicina y ciclofosfamida.
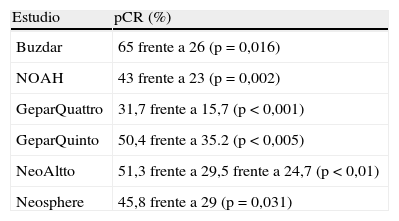
Los resultados de 3 estudios fase III en pacientes con cáncer de mama localmente avanzado HER-2 positivo (MDAnderson Cancer Center neoadjuvant trastuzumab trial24, Neoadjuvant Herceptin trial NOAH25 y el estudio GeparQuattro26) han demostrado que el tratamiento con QTN más trastuzumab aumenta de forma significativa la pCR hasta un 65%.
En el primer estudio que presentó Buzdar en 200524, las pacientes con enfermedad de estadio II y IIIA (operables) comparaba 6 meses de QTN (4 ciclos de paclitaxel trisemanal seguidos de 4 ciclos de FEC con o sin trastuzumab semanal seguido de cirugía). El estudio se cerró prematuramente por la superioridad de trastuzumab más QT (pCR del 65 frente al 26%; p=0,016). No hubo diferencias en cirugía conservadora (el 57 frente al 53%). La población seleccionada de buen pronóstico, la mayor duración de trastuzumab (24 semanas) y la concurrencia de antraciclinas y trastuzumab contribuyeron a estos resultados excelentes.
El estudio fase III NOAH25 analizó la eficacia y la seguridad de doxorubicina y paclitaxel, seguido de paclitaxel y después CMF con o sin trastuzumab en pacientes HER-2 positivo. El estudio también incluyó una tercera rama con pacientes HER-2 negativo que recibían el mismo esquema sin trastuzumab.
Las pacientes HER-2 positivo que recibieron trastuzumab de forma concurrente obtuvieron un aumento del porcentaje de respuesta global (el 89 frente al 77%; p=0,02) y de pCR del (el 43 frente al 23%; p=0,002) comparado con los que sólo recibieron quimioterapia26. Después de un seguimiento de 3 años, la supervivencia libre de evento mejoró en las pacientes HER-2 positivo con trastuzumab comparado con QT sola (el 70,1 frente al 53,3%; HR=0,56; p=0,007).
El estudio GeparQuattro27 se diseñó para evaluar la pCR obtenida después de administrar epirubicina más ciclofosfamida, seguido de 1–3 esquemas diferentes de docetaxel. Hubo un aumento del porcentaje de pCR para las pacientes HER-2 positivo en las que se administró trastuzumab (el 31,7 frente al 15,7%; p<0,001).
Estos 3 estudios fase III demostraron un aumento significativo de pCR al añadir trastuzumab a la QTN. Las variaciones de los valores de pCR (el 31,722 frente al 65,2%24) se explicarían por la estadificación tumoral, los diferentes esquemas de tratamiento y su duración.
En el SABCS de 2010 se han presentado los resultados de 3 estudios de neoadyuvancia fase III en pacientes HER-2 positivo:
- –
En el estudio GeparQuinto28, se aleatorizaba a las pacientes a QTN con epirubicina y ciclofosfamida en una rama con trastuzumab y la otra con lapatinib. La pCR definida como respuesta patológica completa en la mama (ypT0/is ypN—/+) fue del 50,4% en la rama de trastuzumab, frente al 35,2% en la rama de lapatinib (p<0,005). En este estudio, las dosis de lapatinib (1.000–1.250 mg/día) fueron menores respecto a otros estudios (p. ej., 1.500 mg/día en el estudio NeoAltto). La cirugía conservadora fue de un 65,6% en la rama de trastuzumab frente al 56% en la rama de lapatinib.
- –
El estudio NeoAltto29 se comparó la eficacia de lapatinib más paclitaxel, frente a trastuzumab más paclitaxel y frente a lapatinib concomitante con trastuzumab más paclitaxel de forma neoadyuvante en pacientes HER-2 positivo. La pCR fue mayor en la combinación de lapatinib más trastuzumab comparado con trastuzumab y lapatinib (el 51,3 frente al 29,5 y frente al 24,7%, respectivamente; p<0,01). Esto nos demuestra que el bloqueo doble de la vía HER-2 es un concepto válido.
- –
En el estudio Neosphere30, se aleatorizó a las pacientes HER-2 positivo a cuatro ramas con trastuzumab más docetaxel (TH), docetaxel, trastuzumab y pertuzumab (THP), trastuzumab y pertuzumab (HP) y docetaxel con pertuzumab (TP). La pCR fue mayor en la rama THP del 45,8% frente al TH del 29% (p=0,031). Estos resultados demuestran la superioridad de la actividad antitumoral de THP, lo que justifica seguir estudiando los dos anticuerpos monoclonales con o sin docetaxel en mujeres HER-2 positivo en enfermedad en estadios iniciales o enfermedad metastásica.
Los resultados de estos estudios se resumen en la tabla 2.
Sumario de los resultados de los estudios con HER-2 positivo
| Estudio | pCR (%) |
| Buzdar | 65 frente a 26 (p=0,016) |
| NOAH | 43 frente a 23 (p=0,002) |
| GeparQuattro | 31,7 frente a 15,7 (p<0,001) |
| GeparQuinto | 50,4 frente a 35.2 (p<0,005) |
| NeoAltto | 51,3 frente a 29,5 frente a 24,7 (p<0,01) |
| Neosphere | 45,8 frente a 29 (p=0,031) |
pCR: respuesta patológica completa.
En diferentes estudios se ha demostrado que, en función de la histología o del subtipo molecular, se obtienen diferentes resultados en neoadyuvancia.
En cuanto a la histología, el carcinoma lobulillar infiltrante (CLI) presenta bajos porcentajes de pCR a QTN, comparado con el carcinoma ductal infiltrante (CDI), pero a largo plazo se obtienen mejores resultados31.
En lo que se refiere a los diferentes subtipos moleculares, se ha observado que las pacientes con fenotipo similar a basal y HER-2 positivo/ER negativo presentan una mayor pCR con la QTN comparados con el subtipo luminal A32,33. El subtipo luminal B se asocia a una respuesta intermedia.
El pobre pronóstico de los subtipos similar a basal y HER-2 positivo/ER negativo se explicaría por la alta probabilidad de recaída en estas pacientes cuando no consiguen la pCR32,34.
En el estudio GeparDuo17, un pequeño subgrupo de pacientes HR positivo/HER-2 negativo que tenían una baja probabilidad de conseguir una pCR, presentaba un pronóstico excelente, mientras que las pacientes con HR negativo/HER-2 positivo sólo tenían un buen pronóstico cuando conseguían una pCR.
Valor de la pCRLa pCR es el marcador más importante de QTN, ya que ha demostrado un aumento en la SLP y la SG. Tradicionalmente, la actividad antitumoral de la QTN se ha medido por el porcentaje de pacientes que consiguen una pCR, que generalmente se define como la ausencia de enfermedad residual invasiva en la mama durante la cirugía (ypT0/is ypN—/+). No obstante, la presencia de CIS residual, ganglios afectados o enfermedad mínima residual no está bien definida.
En cuanto a la presencia de enfermedad residual in situ, se sabe que no tiene impacto en la supervivencia libre de enfermedad35. En cambio, el estado ganglionar axilar después de la QTN sí tiene significado pronóstico. En un análisis retrospectivo, los pacientes que pasaban de ganglios positivos a ganglios negativos después de la QTN tenían un mejor pronóstico incluso con la presencia de enfermedad residual en la mama36.
Todavía no está establecido el manejo óptimo de las pacientes con enfermedad residual después de los ciclos máximos de QTN. No se ha visto beneficio en añadir quimioterapia después de la cirugía a estas pacientes, si se ha administrado un esquema de quimioterapia estándar que incluya taxanos y antraciclinas durante 6 meses de forma completa de forma preoperatoria22,23. Por tanto, el tratamiento se ha de elaborar desde el principio y no cambiarlo a menos que haya progresión de la enfermedad.
Symmans et al37 desarrollaron un modelo para cuantificar el volumen de la enfermedad residual. Se analizó el impacto de los resultados patológicos después de la QTN y el riesgo de recidiva creando una fórmula que estimaba la probabilidad de DFS. Esta fórmula se basaba en el tamaño y la extensión de la enfermedad residual invasiva en la mama, el número de ganglios afectados y el mayor tamaño de tumor a nivel ganglionar. Al resultado de esta fórmula se le ha llamado residual cancer burden, siendo un nuevo factor de riesgo independiente que mejora la predicción de la enfermedad a distancia después de QTN38. Este parámetro ha sido incorporado en diferentes estudios de QTN para ver cómo puede predecir el riesgo de recidiva en diferentes esquemas de QTN en pacientes que no consiguen una pCR en mama y axila.
En el año 2005 se publicó un nomograma para predecir la pCR basado en características clínicas y patológicas del tumor primario39.
Predictores de progresión tumoralLos predictores de progresión de enfermedad pretratamiento incluyen la raza y características de agresividad, como el tamaño tumoral, receptores hormonales negativos, Ki-67 altos y alto grado nuclear40. Es interesante remarcar que estos predictores de progresión están asociados con una mayor probabilidad de respuesta a la QTN. Ello indica que, aunque morfológicamente son similares, los cánceres altamente proliferativos contienen dos subpoblaciones diferentes: una altamente quimiosensible (alta pCR) y otra pequeña, pero altamente quimiorresistente.
Biopsia del ganglio centinela en neoadyuvanciaActualmente, realizar la técnica de la biopsia del ganglio centinela (BGC) en neoadyuvancia es un tema de gran controversia que genera preguntas como, por ejemplo, si esta técnica es igual de efectiva en neoadyuvancia que en adyuvancia, o cuál es el mejor momento para realizarla, antes o después de la QTN.
En cuanto a la primera pregunta, parece ser menos eficaz en neoadyuvancia, ya que existe un mayor número de falsos negativos41.
En relación con el momento idóneo de su realización, se valoran las ventajas y los inconvenientes de cada situación. Así, las ventajas de realizar la BGC previamente al tratamiento con QTN son el conocimiento real del estado ganglionar (ya que no se ha modificado por este tratamiento) y poder seleccionar a un subgrupo de mejor pronóstico en las pacientes en que el resultado de la BGS sea negativo. El inconveniente más importante a destacar es la realización de 2 intervenciones quirúrgicas. Por el contrario, la ventaja de realizar la BGC post-QTN es llevar a cabo una única intervención. En cuanto a los inconvenientes, cabe destacar la fibrosis secundaria a la quimioterapia y la alteración del drenaje vásculo-linfático a cargo de émbolos metastásicos42. Además, la respuesta de los ganglios a la quimioterapia puede no ser uniforme, sin que en estos casos el ganglio centinela sea reflejo del estado axilar43. Por todo esto, en la actualidad se están realizando estudios para poder validar la técnica en este escenario.
ConclusionesAsí pues, como conclusiones podemos destacar que:
- –
La QTN está indicada en el cáncer de mama localmente avanzado (estadios II y III), afectación supraclavicular o infraclavicular (N3) y cáncer de mama inflamatorio.
- –
Los diferentes estudios realizados no han mostrado diferencias en supervivencia (SLE y SG) entre QTN y QTA, ni se ha definido el esquema óptimo, aunque en las pacientes HER-2 negativo la combinación de antraciclinas y taxanos consigue las mejores pCR (el 22 frente al 31%) (IA), y en cuanto a las pacientes HER-2 positivo, está indicado añadir trastuzumab al esquema de quimioterapia (IIB).
- –
Ningún estudio ha demostrado que la administración de QTA a pacientes con enfermedad residual mejore los resultados y, por tanto, no hay lugar para QTA si se ha administrado la QTN estándar (antraciclinas y taxanos).
- –
La QTN incrementa el porcentaje de cirugía conservadora sin un aumento importante de las recaídas locales.
- –
Las pacientes que mejor responden a QTN (pCR) presentan una supervivencia mayor que las que no responden, por lo que pCR es un excelente factor pronóstico.
- –
Actualmente se están llevando a cabo estudios para validar el ganglio centinela en neoadyuvancia.
- –
Las nuevas clasificaciones moleculares, junto con los nuevos fármacos dirigidos contra células diana, nos están ayudando poco a poco a ir diseñando esquemas de tratamiento cada vez más dirigidos y personalizados (tailored) hacia nuestras pacientes, a la vez que nos permitirán conocer cuál de ellas se beneficiarán de la QTN, para así evitar toxicidad a las que no.
Los autores declaran no tener ningún conflicto de intereses.