La reconstrucción mamaria inmediata mediante expansor-prótesis constituye una alternativa en la cirugía del cáncer de mama que precisa mastectomía. El objetivo de este estudio es analizar el impacto asistencial de este procedimiento y su eficacia para la reconstrucción mamaria.
Pacientes y métodoEl grupo a estudio fueron pacientes intervenidas quirúrgicamente de cáncer de mama, por un mismo cirujano, entre enero de 2009 y diciembre de 2012, y a quienes se realizó mastectomía y reconstrucción inmediata con expansor-prótesis. Se excluyeron todas aquellas pacientes con reconstrucción diferida o autóloga, así como a las que se realizó mastectomía profiláctica. Las variables analizadas fueron: edad, tiempo quirúrgico, estancia hospitalaria, retraso en el inicio de quimioterapia, complicaciones, reintervenciones, características histopatológicas del tumor y afectación ganglionar, comparándose, mediante un estudio prospectivo no aleatorizado, con un grupo control, constituido por pacientes intervenidas mediante una cirugía conservadora o mastectomía sin reconstrucción.
ResultadosSe incluyeron 69 pacientes en el grupo a estudio y 312 pacientes en el grupo control. El análisis comparativo entre el grupo a estudio y control no mostró diferencias significativas en las demoras asistenciales, el inicio del tratamiento adyuvante y las complicaciones postoperatorias, aunque sí en el tiempo quirúrgico y la estancia hospitalaria. Un total de 61 pacientes (88,4%) finalizaron la expansión y 53 (76,8%) acabaron con éxito su reconstrucción mamaria. El análisis por grupos de tratamiento demostró que el mayor éxito del procedimiento se consiguió en las pacientes sin tratamientos adyuvantes (100%), mientras que las pacientes con tratamiento quimioterápico y radioterápico presentaron la menor tasa de éxito (80%).
ConclusiónLa reconstrucción mamaria inmediata mediante expansor-prótesis es un procedimiento que precisa mayor tiempo quirúrgico y estancia hospitalaria respecto a otras técnicas oncológicas de la mama. La mayoría de las pacientes culminarán con éxito el proceso reconstructivo, aunque existirá una mayor tasa de fracaso en las pacientes irradiadas.
Immediate breast reconstruction with an expander-implant is an alternative in breast cancer surgery in patients requiring mastectomy. The objective of this study was to analyze the welfare impact of this procedure and its effectiveness in breast reconstruction.
Patients and methodThe study group consisted of patients treated for breast cancer who underwent mastectomy and immediate reconstruction with an expander-implant. All patients were treated by a single surgeon between January 2009 and December 2012. We excluded all patients with delayed or autologous reconstruction and prophylactic mastectomy. The variables analyzed were age, operating time, length of hospital stay, delayed initiation of chemotherapy, complications, reoperations, histopathologic features of the tumor, and lymph node involvement. These variables were compared in a prospective non-randomized study with those in a control group consisting of patients who underwent conservative surgery or mastectomy without reconstruction.
ResultsThere were 69 patients in the study group and 312 patients in the control group. Comparison between the study and the control group showed no significant differences in healthcare delays, the start of adjuvant therapy, or postoperative complications, but differences were found in operating time and length of hospital stay. Expansion was completed in 61 patients (88.4%) and breast reconstruction in 53 (76.8%). Analysis by treatment groups showed that greater procedural success was achieved in patients without adjuvant treatments (100%), while patients with chemotherapy and radiotherapy had the lowest success rate (80%).
ConclusionImmediate breast reconstruction with an expander-implant requires longer operating time and hospital stay than other techniques in breast oncology. Most patients will successfully complete the reconstructive process, but the failure rate will be higher in irradiated patients.
La cirugía oncológica de la mama permite el control locorregional del proceso y obtiene información para la planificación de los tratamientos adyuvantes. Actualmente, la cirugía conservadora constituye el tratamiento quirúrgico de elección en la mayoría de las pacientes con cáncer de mama, ya que garantiza unos periodos de supervivencia similares a la mastectomía1,2 y evita el impacto negativo de la amputación mamaria sobre la imagen corporal y la autoestima. No obstante, existe un grupo de pacientes que precisarán una mastectomía para el control adecuado de su enfermedad, ya sea por las características oncológicas de su proceso (multicentricidad, tumores localmente avanzados) o por las condiciones anatómicas de su mama (mala proporción mama-tumor), y precisarán una valoración para la indicación de una reconstrucción inmediata de la mama (RIM). Este procedimiento se ha propuesto como una estrategia encaminada a atenuar el impacto negativo de la amputación mamaria mediante la realización de diferentes técnicas cuya elección dependerá de las características oncológicas del proceso y de la experiencia del grupo3.
El método de expansión-prótesis constituye una opción para la RIM que es compatible con los tratamientos adyuvantes (quimioterapia, radioterapia) y presenta una morbilidad menor respecto a los procedimientos autólogos4,5. Sin embargo, este procedimiento posee una repercusión asistencial sobre el consumo de los recursos sanitarios si se compara con las técnicas conservadoras de la mama o las mastectomías sin reconstrucción, que hace necesaria su evaluación para conocer su impacto en los programas de cáncer de mama y, al mismo tiempo, identificar los mejores escenarios para su indicación.
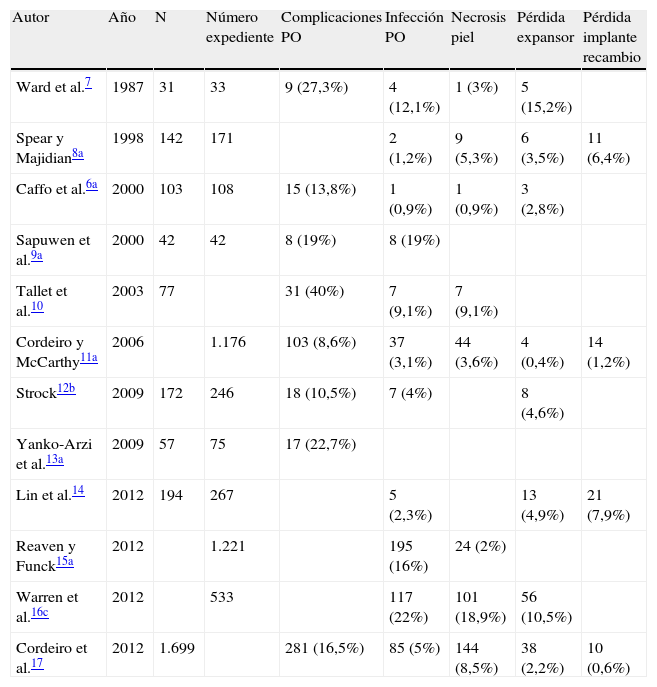
La tabla 1 expone la experiencia de diferentes autores6–17 en la RIM con expansión-prótesis. Se trata de experiencias dispares, con distintos criterios de inclusión, y en la mayoría no se evalúa el impacto de los tratamientos adyuvantes en el procedimiento reconstructivo, a excepción de las publicaciones de Cordeiro y McCarthy11 y Cordeiro et al.17. La tasa de fracaso de la expansión ha oscilado entre el 0,4% de Cordeiro y McCarthy11 y Wright et al.18 y el 19% de Spauwen et al.19.
Cuadro comparativo de bibliografía expansión-prótesis
| Autor | Año | N | Número expediente | Complicaciones PO | Infección PO | Necrosis piel | Pérdida expansor | Pérdida implante recambio |
| Ward et al.7 | 1987 | 31 | 33 | 9 (27,3%) | 4 (12,1%) | 1 (3%) | 5 (15,2%) | |
| Spear y Majidian8a | 1998 | 142 | 171 | 2 (1,2%) | 9 (5,3%) | 6 (3,5%) | 11 (6,4%) | |
| Caffo et al.6a | 2000 | 103 | 108 | 15 (13,8%) | 1 (0,9%) | 1 (0,9%) | 3 (2,8%) | |
| Sapuwen et al.9a | 2000 | 42 | 42 | 8 (19%) | 8 (19%) | |||
| Tallet et al.10 | 2003 | 77 | 31 (40%) | 7 (9,1%) | 7 (9,1%) | |||
| Cordeiro y McCarthy11a | 2006 | 1.176 | 103 (8,6%) | 37 (3,1%) | 44 (3,6%) | 4 (0,4%) | 14 (1,2%) | |
| Strock12b | 2009 | 172 | 246 | 18 (10,5%) | 7 (4%) | 8 (4,6%) | ||
| Yanko-Arzi et al.13a | 2009 | 57 | 75 | 17 (22,7%) | ||||
| Lin et al.14 | 2012 | 194 | 267 | 5 (2,3%) | 13 (4,9%) | 21 (7,9%) | ||
| Reaven y Funck15a | 2012 | 1.221 | 195 (16%) | 24 (2%) | ||||
| Warren et al.16c | 2012 | 533 | 117 (22%) | 101 (18,9%) | 56 (10,5%) | |||
| Cordeiro et al.17 | 2012 | 1.699 | 281 (16,5%) | 85 (5%) | 144 (8,5%) | 38 (2,2%) | 10 (0,6%) |
PO: postoperatorio.
El objetivo de este estudio es presentar la experiencia de los autores en un programa de RIM mediante expansión-prótesis, con el fin de evaluar su impacto asistencial respecto a la cirugía conservadora (tumorectomía y oncoplastia) y la mastectomía sin reconstrucción, y conocer la eficacia de este procedimiento reconstructivo en mujeres mastectomizadas por un cáncer de mama.
Pacientes y métodoPacientesEstudio prospectivo no aleatorizado en mujeres diagnosticadas de un carcinoma de mama y que han sido intervenidas quirúrgicamente entre el 1 de enero de 2009 y el 31 de diciembre de 2012. El grupo a estudio lo componen las pacientes en quienes se indicó la realización de una mastectomía y RIM mediante la colocación de un expansor. En este grupo se han excluido las pacientes reconstruidas mediante un procedimiento autólogo (puro o mixto), aquellas con irradiación previa de la mama (tumores metacrónicos en cirugía conservadora) y las mujeres con RIM por una mastectomía reductora de riesgo.
El grupo control lo forman las pacientes intervenidas simultáneamente durante el periodo a estudio, y en el mismo se han diferenciado las que realizaron una resección sin remodelación (tumorectomía/cuadrantectomía), una conservación mamaria con remodelación (procedimiento oncoplástico) y las que precisaron una mastectomía y no fueron reconstruidas.
Todas las pacientes, tanto las del grupo a estudio como las del grupo control, fueron informadas del procedimiento quirúrgico al cual serían sometidas, y firmaron el consentimiento para la cirugía.
Las variables analizadas se corresponden con las características epidemiológicas (edad, estado menstrual), asistenciales (demoras, estancia, reingreso), quirúrgicas (tipo de técnica quirúrgica, tiempo operatorio, complicaciones, reintervención) y patológicas (tamaño tumoral, afectación ganglionar, estadificación, subtipo tumoral) de las pacientes y a partir de ellas se realiza su análisis y comparación entre ambos grupos.
Método quirúrgicoEn el grupo a estudio se emplearon 3 tipos de mastectomías. El patrón de Steward se utilizó en aquellos casos en donde las condiciones de la mama y/o tumor no permitieron la preservación de piel o de piel-pezón, habitualmente tumores T3-T4. En mujeres con mama voluminosa y ptósica este patrón de Steward se orientó al polo inferior con el fin de preservar todo el colgajo cutáneo y hacer coincidir la cicatriz con el nuevo surco inframamario. La mastectomía preservadora de piel se utilizó en pacientes con volumen mamario medio o bajo y en donde el proceso neoplásico afectaba al complejo aréola-pezón o al tejido retroareolar. En un tercer grupo de enfermas se realizó una mastectomía preservadora de piel y pezón, especialmente en mujeres con mama de escaso volumen, y en todas ellas se realizó biopsia intraoperatoria del tejido retroareolar para descartar la afectación de la base del pezón. La indicación de una mastectomía bilateral se discutió en el Comité Clínico de la Unidad y dicha recomendación se basó en el riesgo para un metacrónico contralateral (portadoras BRCA, antecedentes familiares) o en la oportunidad anatómica (mamas de pequeño volumen).
La reconstrucción de la paciente se realizó mediante la colocación de un expansor mamario de silicona (Mentor Contour Profile® 6100, 6200, 6300) en posición retropectoral. En la totalidad de los casos se desinsertó el músculo serrato mayor para la cobertura lateral del dispositivo de expansión. El relleno del dispositivo se inició a la cuarta semana de la intervención y la pauta de llenado se estableció en 50-100cc cada 2 semanas. Todas las enfermas fueron intervenidas por el mismo cirujano.
En las mujeres sin tratamiento adyuvante (carcinomas in situ), el recambio del expansor se realizó 2-3 meses después de finalizar la expansión. En las mujeres tratadas con quimioterapia y sin irradiación de la pared, la sustitución se realizó a los 2 meses de recibir el último ciclo de citostático. En las mujeres que precisaron tratamiento radioterápico de la pared torácica, se inició la irradiación entre la cuarta y quinta semana de finalizar la quimioterapia. En estos casos se irradió la pared torácica con el expansor lleno y se procedió a su sustitución a los 3 meses de finalizar el tratamiento radioterápico. Durante el recambio se efectuó la retirada del expansor y su sustitución por un implante definitivo. En esta segunda intervención se optimizó la posición definitiva del implante mediante capsulotomía y/o remarcación del surco inframamario. En aquellos casos que precisaron una simetrización de la mama contralateral se realizó una mastopexia o mamoplastia de reducción a partir de un patrón vertical.
Análisis estadísticoTodas las variables cuantitativas se expresan con su media y desviación estándar, mientras que las cualitativas se expresan en proporciones. Las diferencias entre variables cuantitativas (edad, tamaño tumoral, tiempo quirúrgico, estancia, número de intervenciones/paciente, número de intervenciones/programación) se analizaron mediante la prueba t-Student para grupos independientes. Si las condiciones del t-test no se verificaban se utilizó la prueba U de Mann-Whitney. Los resultados se consideraron estadísticamente significativos cuando el valor de p fue menor del 5% (p<0,05). Los datos fueron analizados con el paquete estadístico IBM® SPSS® Statistics 19.0 para Windows (IBM® 2011). El estudio comparativo de proporciones entre las diversas variables cualitativas se llevó a cabo mediante el test exacto de Fisher o test de Ji-cuadrado.
Se definió como expansión exitosa aquella realizada en mujeres que completaron el proceso de expansión y fueron programadas para recambiar el expansor por prótesis definitiva. El recambio por implante definitivo exitoso fue considerado aquel que durante el periodo a estudio no presentó complicaciones inmediatas (infección, extrusión). Los efectos adversos a largo plazo, principalmente estéticos, no fueron objetivo de este estudio.
ResultadosUn total de 381 mujeres con cáncer de mama fueron intervenidas quirúrgicamente durante el periodo a estudio; en ellas se practicaron 142 tumorectomías, 112 procedimientos oncoplásticos, 58 mastectomías sin reconstrucción y 69 mastectomías con RIM mediante expansión-prótesis. La edad media de las pacientes fue 56 años, aunque las del grupo a estudio fueron significativamente más jóvenes (43,1 años).
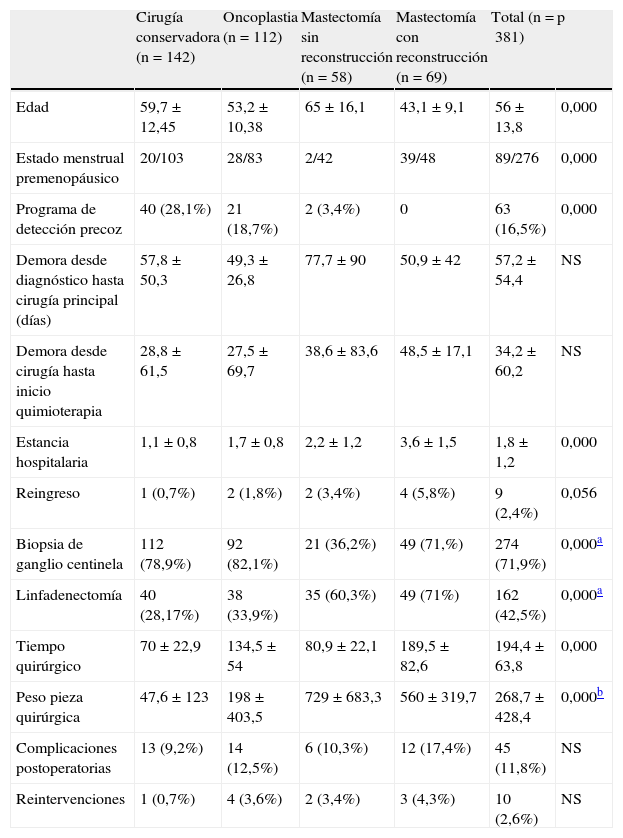
Análisis comparativo del grupo estudio y controlEl análisis comparativo entre los grupos estudio y control no mostró diferencias significativas en las demoras asistenciales, tanto a la cirugía (57,2 días), como al inicio del tratamiento adyuvante (34,2 días) (tabla 2). Por el contrario, el tiempo operatorio fue significativamente mayor en el grupo a estudio (189min), especialmente respecto a las tumorectomías (70min) y mastectomías sin reconstrucción (80min). Asimismo, la estancia media del grupo a estudio (3,6 días) fue significativamente mayor que la de los procedimientos conservadores (1,1 días para la tumorectomía y 1,7 para la cirugía oncoplástica) y a las mastectomías sin reconstrucción (2,2 días). Aunque la tasa de reingresos fue mayor en el grupo a estudio (5,8%), no mostró significación estadística respecto al grupo control. La biopsia de ganglio centinela fue el principal procedimiento para la estadificación ganglionar en las pacientes del grupo a estudio y aquellas intervenidas mediante procedimientos conservadores, a diferencia de las enfermas mastectomizadas sin reconstrucción, en quienes prevaleció la linfadenectomía (71%). Las complicaciones postoperatorias y las reintervenciones fueron más elevadas en el grupo a estudio (17,4 y 4,3%, respectivamente) respecto al grupo control, diferencias que no fueron estadísticamente significativas.
Características de las pacientes, tumor y complicaciones postoperatorias según el tipo de cirugía
| Cirugía conservadora (n=142) | Oncoplastia (n=112) | Mastectomía sin reconstrucción (n=58) | Mastectomía con reconstrucción (n=69) | Total (n=381) | p | |
| Edad | 59,7±12,45 | 53,2±10,38 | 65±16,1 | 43,1±9,1 | 56±13,8 | 0,000 |
| Estado menstrual premenopáusico | 20/103 | 28/83 | 2/42 | 39/48 | 89/276 | 0,000 |
| Programa de detección precoz | 40 (28,1%) | 21 (18,7%) | 2 (3,4%) | 0 | 63 (16,5%) | 0,000 |
| Demora desde diagnóstico hasta cirugía principal (días) | 57,8±50,3 | 49,3±26,8 | 77,7±90 | 50,9±42 | 57,2±54,4 | NS |
| Demora desde cirugía hasta inicio quimioterapia | 28,8±61,5 | 27,5±69,7 | 38,6±83,6 | 48,5±17,1 | 34,2±60,2 | NS |
| Estancia hospitalaria | 1,1±0,8 | 1,7±0,8 | 2,2±1,2 | 3,6±1,5 | 1,8±1,2 | 0,000 |
| Reingreso | 1 (0,7%) | 2 (1,8%) | 2 (3,4%) | 4 (5,8%) | 9 (2,4%) | 0,056 |
| Biopsia de ganglio centinela | 112 (78,9%) | 92 (82,1%) | 21 (36,2%) | 49 (71,%) | 274 (71,9%) | 0,000a |
| Linfadenectomía | 40 (28,17%) | 38 (33,9%) | 35 (60,3%) | 49 (71%) | 162 (42,5%) | 0,000a |
| Tiempo quirúrgico | 70±22,9 | 134,5±54 | 80,9±22,1 | 189,5±82,6 | 194,4±63,8 | 0,000 |
| Peso pieza quirúrgica | 47,6±123 | 198±403,5 | 729±683,3 | 560±319,7 | 268,7±428,4 | 0,000b |
| Complicaciones postoperatorias | 13 (9,2%) | 14 (12,5%) | 6 (10,3%) | 12 (17,4%) | 45 (11,8%) | NS |
| Reintervenciones | 1 (0,7%) | 4 (3,6%) | 2 (3,4%) | 3 (4,3%) | 10 (2,6%) | NS |
NS: no significativo.
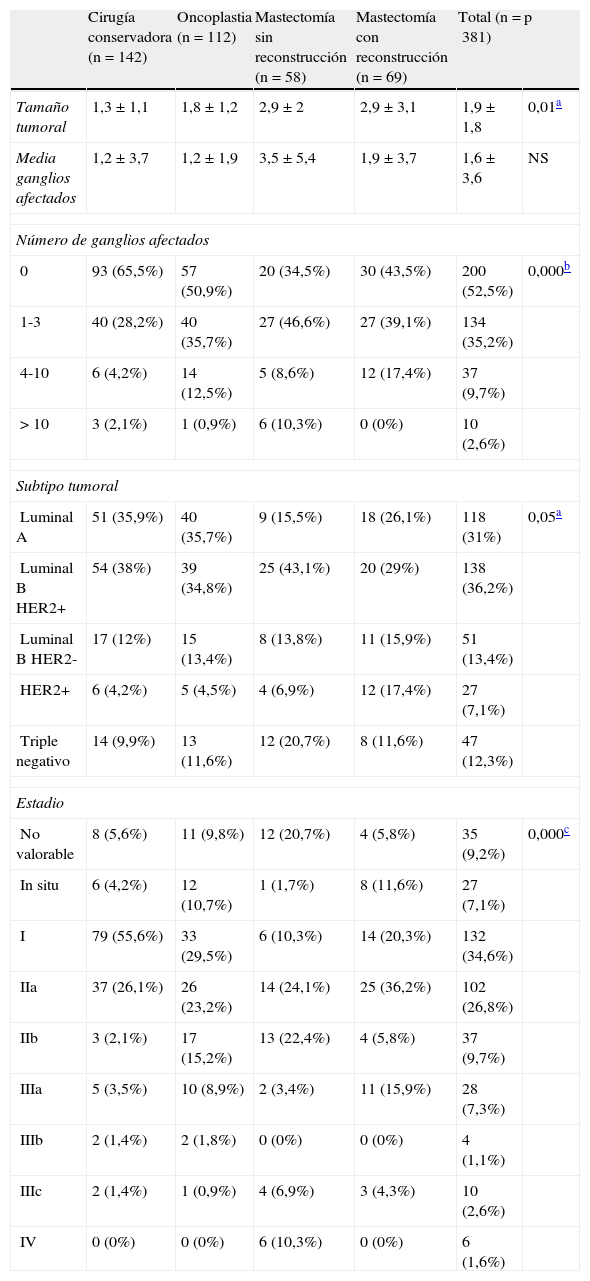
El estudio histopatológico de las piezas quirúrgicas (tabla 3) demostró un tamaño medio mayor en el grupo a estudio (2,9cm) respecto a los procedimientos conservadores, así como un mayor número de ganglios axilares afectados (1,9 ganglios afectados), diferencias que solo fueron significativas para el tamaño tumoral. El estudio del subtipo mostró una mayor proporción de tumores HER2 en el grupo a estudio, en el límite de la significación estadística.
Características tumorales en los grupos a estudio
| Cirugía conservadora (n=142) | Oncoplastia (n=112) | Mastectomía sin reconstrucción (n=58) | Mastectomía con reconstrucción (n=69) | Total (n=381) | p | |
| Tamaño tumoral | 1,3±1,1 | 1,8±1,2 | 2,9±2 | 2,9±3,1 | 1,9±1,8 | 0,01a |
| Media ganglios afectados | 1,2±3,7 | 1,2±1,9 | 3,5±5,4 | 1,9±3,7 | 1,6±3,6 | NS |
| Número de ganglios afectados | ||||||
| 0 | 93 (65,5%) | 57 (50,9%) | 20 (34,5%) | 30 (43,5%) | 200 (52,5%) | 0,000b |
| 1-3 | 40 (28,2%) | 40 (35,7%) | 27 (46,6%) | 27 (39,1%) | 134 (35,2%) | |
| 4-10 | 6 (4,2%) | 14 (12,5%) | 5 (8,6%) | 12 (17,4%) | 37 (9,7%) | |
| >10 | 3 (2,1%) | 1 (0,9%) | 6 (10,3%) | 0 (0%) | 10 (2,6%) | |
| Subtipo tumoral | ||||||
| Luminal A | 51 (35,9%) | 40 (35,7%) | 9 (15,5%) | 18 (26,1%) | 118 (31%) | 0,05a |
| Luminal B HER2+ | 54 (38%) | 39 (34,8%) | 25 (43,1%) | 20 (29%) | 138 (36,2%) | |
| Luminal B HER2- | 17 (12%) | 15 (13,4%) | 8 (13,8%) | 11 (15,9%) | 51 (13,4%) | |
| HER2+ | 6 (4,2%) | 5 (4,5%) | 4 (6,9%) | 12 (17,4%) | 27 (7,1%) | |
| Triple negativo | 14 (9,9%) | 13 (11,6%) | 12 (20,7%) | 8 (11,6%) | 47 (12,3%) | |
| Estadio | ||||||
| No valorable | 8 (5,6%) | 11 (9,8%) | 12 (20,7%) | 4 (5,8%) | 35 (9,2%) | 0,000c |
| In situ | 6 (4,2%) | 12 (10,7%) | 1 (1,7%) | 8 (11,6%) | 27 (7,1%) | |
| I | 79 (55,6%) | 33 (29,5%) | 6 (10,3%) | 14 (20,3%) | 132 (34,6%) | |
| IIa | 37 (26,1%) | 26 (23,2%) | 14 (24,1%) | 25 (36,2%) | 102 (26,8%) | |
| IIb | 3 (2,1%) | 17 (15,2%) | 13 (22,4%) | 4 (5,8%) | 37 (9,7%) | |
| IIIa | 5 (3,5%) | 10 (8,9%) | 2 (3,4%) | 11 (15,9%) | 28 (7,3%) | |
| IIIb | 2 (1,4%) | 2 (1,8%) | 0 (0%) | 0 (0%) | 4 (1,1%) | |
| IIIc | 2 (1,4%) | 1 (0,9%) | 4 (6,9%) | 3 (4,3%) | 10 (2,6%) | |
| IV | 0 (0%) | 0 (0%) | 6 (10,3%) | 0 (0%) | 6 (1,6%) | |
NS: no significativo.
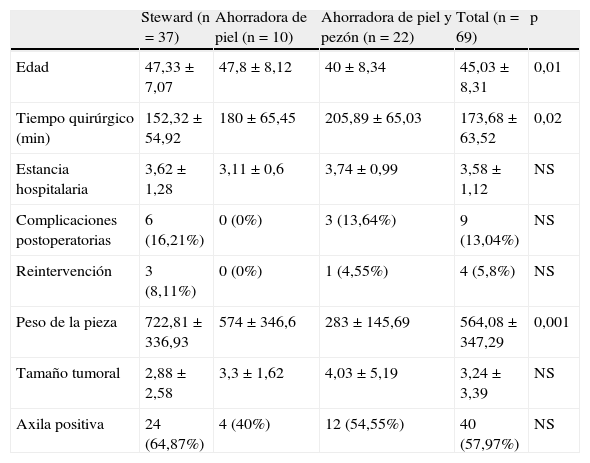
La tabla 4 expone las características clínicas y asistenciales del grupo a estudio según el tipo de mastectomía realizada. Esta comparativa demostró que las pacientes intervenidas mediante una mastectomía preservadora de piel y pezón presentaron una menor edad al diagnóstico, un mayor tiempo quirúrgico para la realización del procedimiento y un menor peso de la pieza quirúrgica.
Tipos de mastectomía y características clinicopatológicas
| Steward (n=37) | Ahorradora de piel (n=10) | Ahorradora de piel y pezón (n=22) | Total (n=69) | p | |
| Edad | 47,33±7,07 | 47,8±8,12 | 40±8,34 | 45,03±8,31 | 0,01 |
| Tiempo quirúrgico (min) | 152,32±54,92 | 180±65,45 | 205,89±65,03 | 173,68±63,52 | 0,02 |
| Estancia hospitalaria | 3,62±1,28 | 3,11±0,6 | 3,74±0,99 | 3,58±1,12 | NS |
| Complicaciones postoperatorias | 6 (16,21%) | 0 (0%) | 3 (13,64%) | 9 (13,04%) | NS |
| Reintervención | 3 (8,11%) | 0 (0%) | 1 (4,55%) | 4 (5,8%) | NS |
| Peso de la pieza | 722,81±336,93 | 574±346,6 | 283±145,69 | 564,08±347,29 | 0,001 |
| Tamaño tumoral | 2,88±2,58 | 3,3±1,62 | 4,03±5,19 | 3,24±3,39 | NS |
| Axila positiva | 24 (64,87%) | 4 (40%) | 12 (54,55%) | 40 (57,97%) | NS |
NS: no significativo.
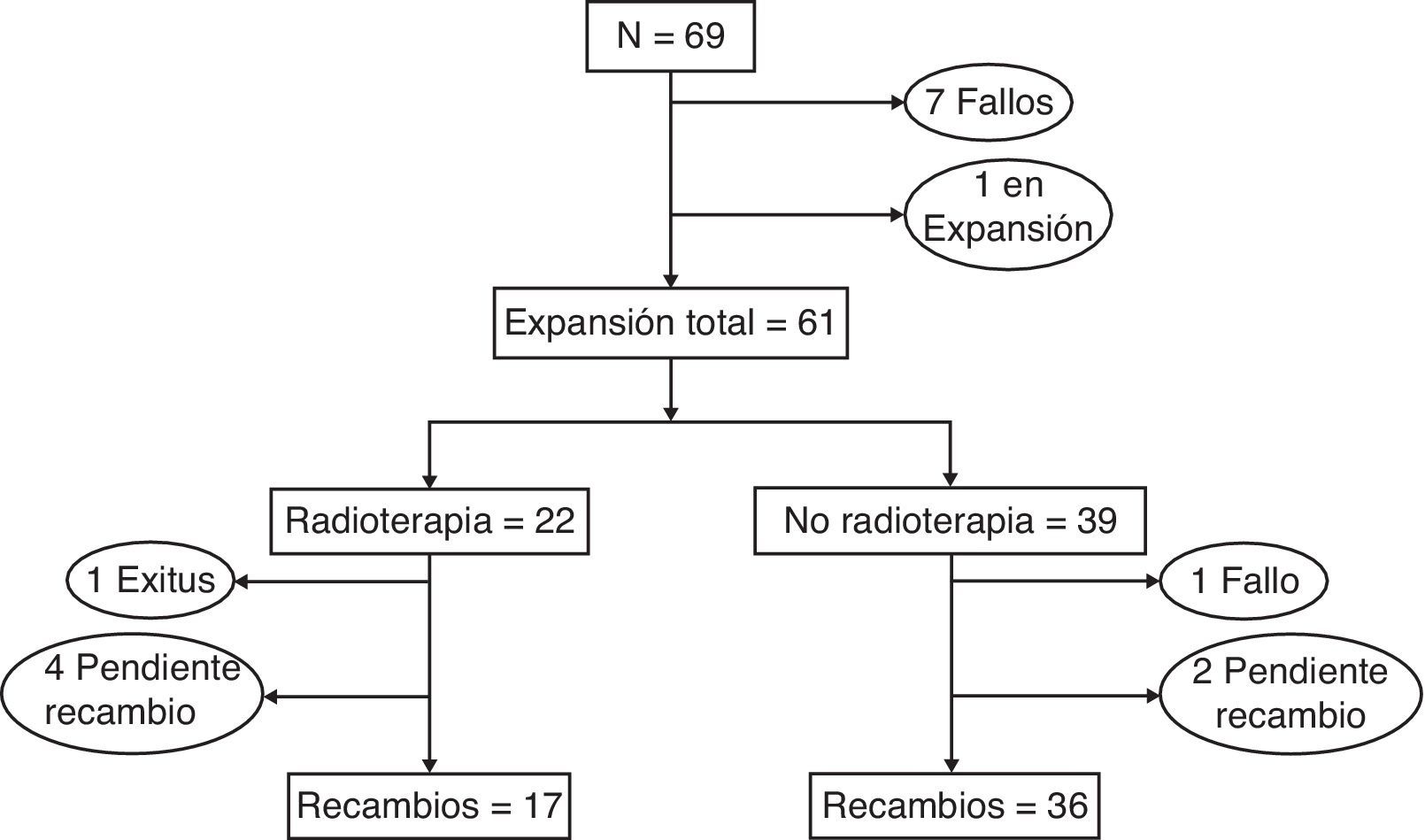
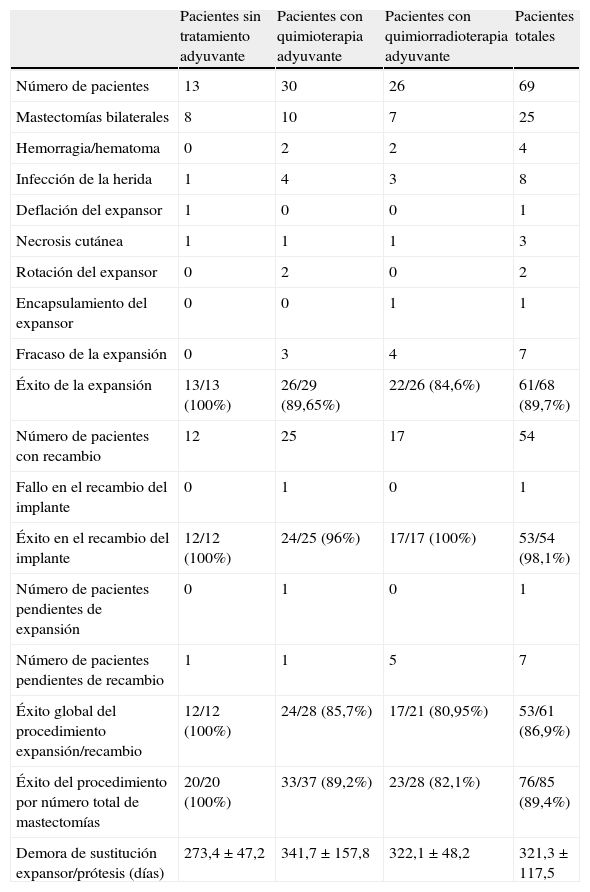
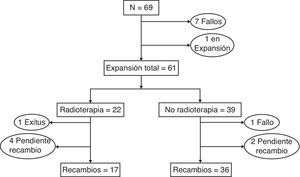
La figura 1 y la tabla 5 muestran la evolución de las pacientes del grupo a estudio durante el proceso de expansión. Un total de 61 pacientes (88,4%) finalizaron la expansión, mientras que en 7 enfermas se produjo una interrupción del procedimiento debido a la infección del expansor (6 pacientes), que obligó a su retirada o al encapsulamiento del dispositivo, lo que impidió el proceso de expansión (una enferma). Todas las pacientes que no recibieron tratamiento adyuvante culminaron la expansión, mientras que aquellas que realizaron tratamiento quimioterápico o quimiorradioterápico presentaron un éxito de expansión del 89 y 84%, respectivamente.
Descripción de la evolución clínica en el grupo a estudio según el tipo de tratamiento adyuvante
| Pacientes sin tratamiento adyuvante | Pacientes con quimioterapia adyuvante | Pacientes con quimiorradioterapia adyuvante | Pacientes totales | |
| Número de pacientes | 13 | 30 | 26 | 69 |
| Mastectomías bilaterales | 8 | 10 | 7 | 25 |
| Hemorragia/hematoma | 0 | 2 | 2 | 4 |
| Infección de la herida | 1 | 4 | 3 | 8 |
| Deflación del expansor | 1 | 0 | 0 | 1 |
| Necrosis cutánea | 1 | 1 | 1 | 3 |
| Rotación del expansor | 0 | 2 | 0 | 2 |
| Encapsulamiento del expansor | 0 | 0 | 1 | 1 |
| Fracaso de la expansión | 0 | 3 | 4 | 7 |
| Éxito de la expansión | 13/13 (100%) | 26/29 (89,65%) | 22/26 (84,6%) | 61/68 (89,7%) |
| Número de pacientes con recambio | 12 | 25 | 17 | 54 |
| Fallo en el recambio del implante | 0 | 1 | 0 | 1 |
| Éxito en el recambio del implante | 12/12 (100%) | 24/25 (96%) | 17/17 (100%) | 53/54 (98,1%) |
| Número de pacientes pendientes de expansión | 0 | 1 | 0 | 1 |
| Número de pacientes pendientes de recambio | 1 | 1 | 5 | 7 |
| Éxito global del procedimiento expansión/recambio | 12/12 (100%) | 24/28 (85,7%) | 17/21 (80,95%) | 53/61 (86,9%) |
| Éxito del procedimiento por número total de mastectomías | 20/20 (100%) | 33/37 (89,2%) | 23/28 (82,1%) | 76/85 (89,4%) |
| Demora de sustitución expansor/prótesis (días) | 273,4±47,2 | 341,7±157,8 | 322,1±48,2 | 321,3±117,5 |
Durante el periodo a estudio se realizaron un total de 54 recambios del expansor por el implante definitivo, con una demora media entre la primera y la segunda intervención quirúrgica de 321 días. Una paciente presentó infección del implante definitivo, que obligó a su retirada, lo que sitúa el éxito del recambio en el 98%.
El análisis global del grupo a estudio mostró que 61 pacientes culminaron el procedimiento de expansión y 53 (76,8%) finalizaron con éxito su reconstrucción mamaria. El análisis por mastectomía reconstruida (incluyendo aquellas mastectomías bilaterales) demostró que de las 85 mastectomías realizadas en estas 61 pacientes, un total de 76 (89%) alcanzaron la reconstrucción definitiva. El análisis por grupos de tratamiento demostró que el mayor éxito del procedimiento se consiguió en el grupo de pacientes sin tratamientos adyuvantes (100%), mientras que aquellas con tratamiento quimioterápico y radioterápico presentaron la menor tasa de éxito (80%).
DiscusiónLa cirugía oncológica de la mama se fundamenta en un conflicto de intereses: por un lado, debe garantizar una resección amplia para la extirpación completa de la lesión, y por otro, debe minimizar el deterioro local para alcanzar un resultado cosméticamente adecuado. Actualmente, con el diagnóstico precoz, en la mayoría de los casos este conflicto puede resolverse favorablemente mediante un procedimiento conservador, ya sea a través de una resección local (tumorectomía) o mediante una extirpación y remodelación oncoplástica. Sin embargo, algunas pacientes requerirán una mastectomía, y especialmente en mujeres jóvenes, premenopáusicas con tumores avanzados y con mayor afectación ganglionar (como es el caso de nuestro grupo a estudio), se planteará la necesidad de una RIM.
El procedimiento de reconstrucción conlleva un incremento en el consumo de los recursos sanitarios en comparación a otros procedimientos quirúrgicos utilizados en la cirugía oncológica de la mama. Nuestro estudio muestra un mayor tiempo quirúrgico y estancia hospitalaria de la RIM con expansión-prótesis respecto a la cirugía conservadora y la mastectomía sin reconstrucción.
Otro aspecto importante desde el punto de vista asistencial es el cumplimiento oportuno de todos los tratamientos. Las guías clínicas proponen el inicio de quimioterapia entre las 6-8 semanas posquirúrgicas20 para una mejoría en la mortalidad y supervivencia. La mayor complejidad en la técnica quirúrgica en la RIM puede suponer un incremento en la demora del inicio de tratamientos adyuvantes, pero en nuestro estudio no se evidenció diferencia estadísticamente significativa en el inicio del tratamiento posquirúrgico entre los diferentes grupos, y esto probablemente se deba a la elevada dispersión en la demora de las pacientes tratadas mediante técnicas conservadoras. No obstante, la demora registrada en nuestro estudio (34,2 días) ha sido menor que la reportada por Caffo et al.6 y por Wrigth et al.18, quienes registran una media de 44 y 35 días, respectivamente, para el inicio de tratamiento citostático. Otros autores admiten un retraso en el inicio de la quimioterapia, sin que este se encuentre fuera del rango de tiempo propuesto por las guías21,22.
La reconstrucción mamaria juega un papel importante en la reducción del impacto de la mastectomía en la imagen corporal y la autoestima de la mujer con cáncer de mama23. En la bibliografía consultada, la incidencia de complicaciones postoperatorias se situó entre el 13,8% de Caffo et al.6 y el 40% de Tallet et al.10, mientras que la tasa de fracaso de la expansión ha oscilado entre el 0,4% de Cordeiro y McCarthy11 y Wright et al.18, y el 19% de Spauwen et al.19. Nuestro estudio muestra una incidencia de complicaciones postoperatorias y fracaso de la expansión (17,4 y 9%, respectivamente) en los rangos de las series publicadas, si bien su incidencia ha variado dependiendo del tratamiento adyuvante realizado, al demostrar una disminución en el éxito de la expansión en las enfermas irradiadas (15,4% de fracaso). La influencia del tratamiento adyuvante en el éxito de la reconstrucción ha sido evaluada por diferentes autores11,24–26 y los mismos avalan su utilización en pacientes en estadios ii y iii, al no demostrarse que disminuya la eficacia de los tratamientos adyuvantes. Si bien el tratamiento quimioterápico (primario o adyuvante) no ha demostrado efectos adversos significativos en los resultados estéticos de la reconstrucción27,28, la irradiación de la pared torácica predispone a un empeoramiento de las secuelas cosméticas, especialmente cuando se han utilizado implantes25,29. Sin embargo, en un artículo publicado por Shah et al. en 201330, que recopila la bibliografía sobre reconstrucción mamaria en pacientes con radioterapia posquirúrgica, se evidencia que la reconstrucción con expansor-prótesis es la más frecuente en los últimos años, con un buen resultado a largo plazo y sin diferencia significativa en las complicaciones posradioterapia de las últimas series; esto probablemente está relacionado con las nuevas técnicas de radiación. Por ello, las pacientes mastectomizadas que requieren tratamiento quimioterápico y radioterápico constituyen el grupo más problemático para la realización de una RIM y la obtención de resultados cosméticos satisfactorios. No obstante, la alternativa de una reconstrucción diferida en estas mujeres conlleva, en la mayoría de los casos, el uso de colgajos miocutáneos sobre una pared torácica irradiada, cuyo resultado se basará en cicatrices visibles y el parcheado cutáneo, así como una morbilidad inherente en las zonas donantes del colgajo. La RIM mediante expansión-prótesis supone una alternativa en este grupo de pacientes cuyo principal valor es la posibilidad de una mastectomía preservadora de piel o de piel-pezón que optimiza los resultados estéticos, si bien debe asumirse un incremento en las complicaciones locales y en el posible fracaso de la expansión. El estudio de Cordeiro11,31 realizado en 1.639 enfermas reconstruidas con expansor e irradiadas tras el recambio demuestra que la infección es la principal causa de fracaso de este procedimiento durante el primer año, mientras que la contractura capsular y la insatisfacción de la paciente justifican una tasa de fracaso del 29% a los 7 años de seguimiento. La tasa de control locorregional durante los 7 primeros años fue del 100%, y la consolidación del procedimiento alcanzó al 71% de las pacientes reconstruidas, lo que sitúa la reconstrucción mediante expansión-prótesis como una alternativa adecuada en las pacientes con irradiación posmastectomía. Esta serie de pacientes apunta a la posibilidad de la reconstrucción inmediata con expansión-prótesis en mujeres que requieren irradiación posmastectomía, con una consolidación del procedimiento a medio plazo en un número significativo de pacientes (71%) y con un control locorregional adecuado de su proceso. En el presente estudio, este grupo de pacientes presentó un fracaso de la expansión de un 15,4%, superior al registrado por las pacientes sin radioterapia (10,4%) o sin tratamientos adyuvantes (0%), lo que exige al cirujano un proceso informativo adecuado en este grupo de enfermas para crear unas expectativas reales.
La preservación de piel y de piel-pezón constituye un elemento decisivo en la consecución de un buen resultado cosmético tras una reconstrucción inmediata, al proporcionar un aspecto natural con cicatrices de baja visibilidad. El estudio muestra que la mastectomía preservadora de piel y pezón ha mostrado diferencias significativas en el tiempo quirúrgico (205min) y el peso de la pieza (283g) respecto a la mastectomía preservadora de piel e incisión de Steward. Esto se ha debido a que este procedimiento fue utilizado en mujeres muy jóvenes con mamas pequeñas en donde la oportunidad anatómica aconsejó la resección bilateral, lo que supone un incremento en el tiempo operatorio. La principal limitación en la conservación del envoltorio cutáneo y del pezón es la presencia de tejido mamario y/o tumoral residual que pueda incrementar el riesgo de recaída locorregional. Durante los últimos años diversos autores han analizado la incidencia de las recurrencias locorregionales en pacientes con mastectomías preservadoras de piel y piel-pezón, con una incidencia que varía entre el 032–34 y el 20,8%35, aunque la mayoría de los estudios las sitúan por debajo del 6%36. Casi todos los autores coinciden en que el riesgo de recaída tras una mastectomía con preservación cutánea es similar al de una mastectomía radical estándar, y en su origen destacan los factores biológicos del tumor como principal factor de riesgo. En este sentido, el reciente estudio del Instituto Europeo de Oncología37 aporta información sobre el papel del subtipo tumoral en la recaída locorregional tras una mastectomía preservadora de piel. Así, en las 1.742 pacientes analizadas y las 121 recaídas estudiadas, la mayor incidencia de recurrencia se produjo en tumores con subtipo triple negativo (10,9%) y luminal B HER2 positivo (9,8%), mientras que el luminal A y luminal B HER2 negativo presentaron una incidencia significativamente menor (2,5 y 3,8%, respectivamente). Estos datos coinciden con los de otros estudios previos36,38, que han demostrado un mayor riesgo de recaída locorregional para los subtipos triple negativo y HER2 respecto a los luminales A. En el presente estudio no se ha analizado el fracaso locorregional debido al escaso tiempo de seguimiento, si bien la incidencia de subtipos tumorales no mostró diferencias entre los grupos analizados. El subtipo tumoral no debe considerarse una contraindicación para una mastectomía preservadora de piel y reconstrucción inmediata, aunque deberá valorarse conjuntamente con otras variables clínicas (tipo de presentación) y patológicas (tamaño tumoral, afectación ganglionar) para discutir la idoneidad de una reconstrucción diferida en aquellos casos en donde el riesgo de progresión locorregional y/o sistémica sea elevado.
En conclusión, la RIM mediante expansión-prótesis constituye un procedimiento que incrementa el tiempo quirúrgico operatorio y la estancia media respecto a la cirugía conservadora y la mastectomía sin reconstrucción en mujeres con cáncer de mama. Existe además un aumento de las complicaciones postoperatorias, reintervención y demora para el inicio del tratamiento adyuvante que, si bien no ha sido significativo estadísticamente en nuestro estudio, supone un incremento de la morbilidad y un retraso en el inicio de la terapia con citostáticos. La mayoría de las pacientes (9 de cada 10) culminarán este procedimiento reconstructivo, pero su éxito está directamente relacionado con el tratamiento adyuvante, ya que el fracaso de la técnica se incrementa en las mujeres con irradiación posmastectomía (15,4%). A pesar de estas restricciones, este procedimiento debe ser una alternativa disponible en las unidades de mama para garantizar la RIM en la mujer mastectomizada.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes y que todos los pacientes incluidos en el estudio han recibido información suficiente y han dado su consentimiento informado por escrito para participar en dicho estudio.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.