Valorar las complicaciones postoperatorias en pacientes intervenidas mediante mastectomía ahorradora de piel o piel y aréola-pezón, con reconstrucción inmediata e implantación de prótesis o prótesis más malla biológica.
Pacientes y métodosEstudio prospectivo. Periodo de estudio: octubre de 2011-octubre de 2014. Criterios de inclusión: cáncer de mama multicéntrico, carcinoma ductal in situ con indicación de mastectomía y tumores cT2 que no tuvieron respuesta a tratamiento sistémico primario. Criterios de exclusión: edad>75 años. Grupo control: pacientes reconstruidas mediante prótesis. Grupo estudio: pacientes reconstruidas mediante prótesis y malla biológica de dermis porcina acelular, no entrecruzada, de 1,6mm e hidratada.
ResultadosSe incluyeron en el grupo de estudio 34 pacientes, y en el grupo control, 38 pacientes. Extrusión de prótesis: grupo estudio uno (2,9%); grupo control 9 (23,7%) (p=0,015). Infecciones: grupo estudio 3 (8,8%); grupo control 3 (7,9%) (p=1). Necrosis cutánea: grupo estudio 5 (14,7%); grupo control 5 (13,2%) (p=1). Seroma: grupo estudio 5 (14,7%); grupo control 5 (13,2%) (p=1).
ConclusiónSe ha observado una disminución significativa de la extrusión de la prótesis en las mujeres en las que se implantaron mallas biológicas. En seromas, infección y necrosis cutánea no observamos diferencias significativas.
To evaluate postoperative complications after skin- or nipple-sparing mastectomy with immediate implant-based breast reconstruction with or without biological dermal mesh.
Patients and methodsProspective study. Study period: October 2011-October 2014. Inclusion criteria: multicentre breast cancer, ductal carcinoma in situ with indication for mastectomy, and cT2 tumours with no response to primary systemic treatment. Exclusion criteria: patients older than 75 years. Control group: breast reconstructions with mammary prosthesis exclusively. Study group: breast reconstructions with implant and non-crosslinked biological 1.6mm hydrated acellular porcine dermal mesh.
ResultsThirty-four patients were included in the treatment group and 38 patients in the control group. Number of prosthesis extrusions: study group one (2.9%); control group 9 (23.7%) (P=.015). Infections: study group 3 (8.8%); control group 3 (7.9%) (P=1). Skin necrosis: study group 5 (14.7%); control group 5 (13.2%) (P=1). Seroma: study group 5 (14.7%); control group 5 (13.2%) (P=1).
ConclusionThe number of extrusions was significantly lower in breast reconstructions with prosthesis and biological mesh. No significant differences were observed in seroma, infection, or skin necrosis.
Actualmente se considera que la reconstrucción mamaria forma parte del tratamiento integral del cáncer de mama. Son muchos los avances que se han hecho en este campo a lo largo de los años con la introducción de técnicas quirúrgicas sencillas, que consiguen excelentes resultados sin alterar los tejidos. Entre estas novedades se encuentra el uso de mallas o matrices dérmicas acelulares (ADM), que se han utilizado en las reconstrucciones inmediatas tras cirugía radical para cubrir el implante y estabilizar la posición del mismo.
En la actualidad existen numerosas mallas biológicas de fuentes tanto alogénicas como xenogénicas a partir de productos obtenidos de dermis porcina, pericardio bovino y submucosa del intestino delgado. Las ADM de origen humano (AlloDerm®, LifeCell, Branchburg, Nueva Jersey, EE. UU.) cuentan con una larga experiencia de uso y múltiples publicaciones al respecto, comunicándose buenos resultados clínicos con su uso1. Más recientemente se ha generalizado también el uso de matrices acelulares de origen porcino desarrolladas usando los mismos principios que las mallas de origen humano, y que además se procesan para retirar la galactosa-alfa 1,3 (epítopo terminal de galactosa), que se cree desempeña un papel importante en el rechazo xenogénico2. Ambas matrices se revascularizan, se recelularizan, se remodelan y se integran en el tejido del huésped sin evidencia de encapsulación ni contractura3.
La técnica quirúrgica de la reconstrucción mamaria asistida con malla fue concebida por primera vez por Andrew Salzberg en 20014, e implica, en primer lugar, la liberación del músculo pectoral mayor en su porción inferior y la disección del bolsillo subpectoral. Posteriormente, una lámina de ADM se inserta entre el pliegue inframamario y el borde inferior del pectoral mayor. El implante se aloja bajo el músculo pectoral, en su porción superior, y bajo la lámina de ADM, en su porción más inferior. En esta posición, la malla aporta una capa adicional de cobertura y soporte al polo inferior de la mama reconstruida, sin necesidad de elevar ningún músculo adicional5,6 y permitiendo al cirujano colocar el surco submamario y el pliegue lateral mamario en la posición deseada.
Son muchos los estudios que se han realizado por diversos autores para analizar las ventajas del uso de las mallas en las reconstrucciones mamarias, y si bien la mayoría defiende las ventajas de las mismas en cuanto a los resultados estéticos que proporcionan7–11, su uso no está exento de complicaciones, habiéndose generado resultados contradictorios a este respecto. Hay autores que señalan en sus análisis un aumento de las complicaciones, como la infección12,13 y el seroma12,14, al utilizar ADM. Para otros autores estas diferencias no existen o no son estadísticamente significativas1,4,10,15.
La finalidad de este estudio ha sido analizar nuestros resultados respecto a las complicaciones que se han presentado en las reconstrucciones inmediatas en las que se ha utilizado material protésico y ADM de origen porcino, comparándolas con las complicaciones surgidas cuando en la reconstrucción tras mastectomía solo se usó el implante mamario.
Material y métodoEn este estudio se han incluido todas las pacientes a las que se les ha realizado una mastectomía ahorradora de piel, o mastectomía ahorradora de piel y complejo aréola-pezón (CAP) con reconstrucción inmediata, a partir de octubre de 2011. En las pacientes intervenidas desde octubre de 2011 a octubre de 2013 la reconstrucción se realizó utilizando únicamente un implante mamario anatómico de gel de silicona cohesivo, mientras que en las pacientes intervenidas a partir de octubre de 2013 hasta octubre de 2014 se utilizó, además del implante, la ADM para la reconstrucción de la mama, estando estas últimas incluidas en un proyecto de investigación financiado que está desarrollándose en nuestra unidad, aprobado por el Comité de Ética del hospital. Los criterios de inclusión fueron cáncer de mama infiltrante multicéntrico, tumores cT2 que no tuvieron respuesta a tratamiento sistémico primario y carcinomas ductales in situ con indicación de mastectomía (tumores extensos [>4cm], multicéntricos, con microcalcificaciones difusas, masas palpables o incapacidad para obtener márgenes negativos). Como criterios de exclusión: edad>75 años.
La indicación quirúrgica fue como tratamiento oncológico por diagnóstico de cáncer de mama. El material utilizado para nuestro estudio ha sido la matriz biológica acelular derivada de dermis de origen porcino (Strattice®, LifeCell Branchburg, Nueva Jersey, EE. UU.).
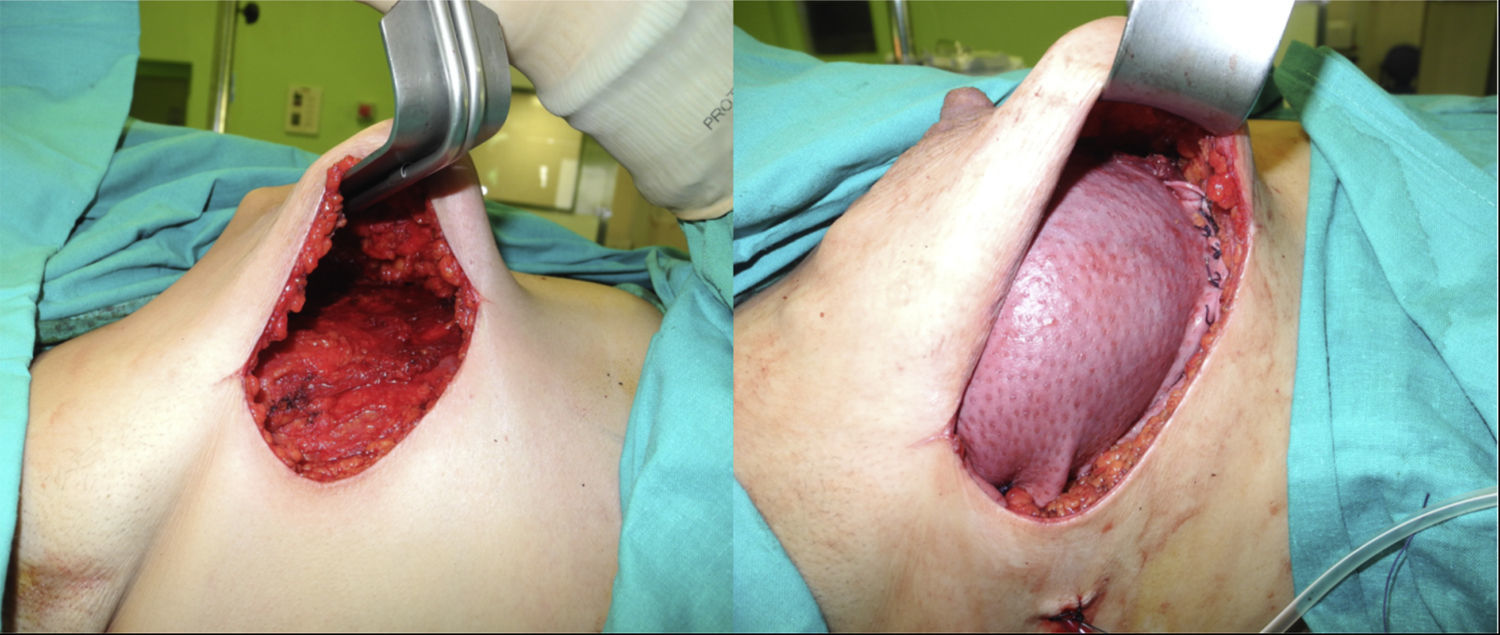
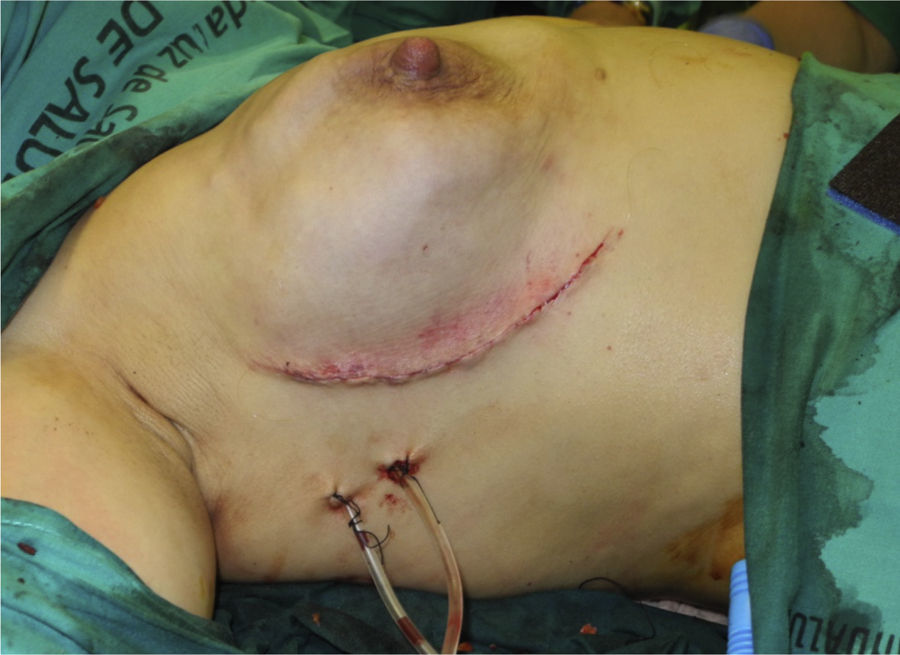
En cuanto a la técnica quirúrgica, todos los implantes se colocaron en posición retromuscular. En los casos en que se utilizó la ADM el implante fue cubierto por el músculo pectoral mayor en la parte superior, y por la ADM en su porción inferior. La ADM fue tratada según las indicaciones de la casa comercial. En cuanto a las reconstrucciones sin matriz, se realizó una cobertura muscular parcial del implante desinsertando el borde inferior del pectoral mayor. Las incisiones de abordaje más utilizadas han sido la línea axilar anterior y la hemiareolar inferior; en algunos casos, asociadas, en el mismo tiempo quirúrgico, a patrones cutáneos de mastopexia/reducción (patrón vertical o de T invertida). El abordaje de la cirugía axilar, la biopsia selectiva de ganglio centinela o la linfadenectomía se realizó a través de la incisión mamaria. La simetrización contralateral se realizó en el mismo acto quirúrgico en aquellos casos en que fue necesaria.
A todas las pacientes se les dejó un drenaje aspirativo situado entre el implante mamario y el músculo pectoral mayor/malla en su extremo distal, y entre la malla y el tejido subcutáneo en la porción proximal del drenaje; y un segundo drenaje en la axila si se realizaba linfadenectomía axilar.
La profilaxis antibiótica se inicia previamente a la cirugía, manteniéndose por vía intravenosa hasta su alta hospitalaria, para completarse por vía oral durante 7 días si no surge ninguna complicación.
Desde el postoperatorio inmediato recomendamos el uso de un sujetador de compresión especial posquirúrgico para garantizar una presión ligera con distribución homogénea de la mama, minimizando los espacios muertos pero sin comprometer la vascularización de la zona.
En ambos grupos de pacientes, sometidas a reconstrucción inmediata con o sin ADM, se valoró el índice de complicaciones (necrosis de piel, pérdida del CAP, infección, seroma, hematoma y extrusión de la prótesis), así como el haber recibido quimioterapia o radioterapia previas, como factores que podrían influir en el índice de complicaciones. Los resultados observados en ambos grupos se compararon estadísticamente usando el test de Chi-cuadrado o el test de Fisher al tratarse todas ellas de variables cualitativas. Las diferencias se consideraron estadísticamente significativas para un valor de p<0,05.
ResultadosSe realizaron un total de 72 reconstrucciones inmediatas tras mastectomía en 62 pacientes incluidas en el estudio, con un rango de edad de 31 a 75 años y una media de 48,9 años.
En 38 casos la reconstrucción se realizó utilizando solo el implante, y en 34 reconstrucciones se usó la malla Strattice® además del implante mamario.
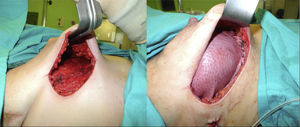
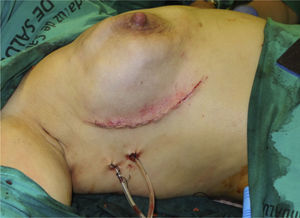
En 19 reconstrucciones (26,39%) se realizó mastectomía ahorradora de piel, y en 53 (73,61%), mastectomía ahorradora de piel y CAP (figs. 1 y 2).
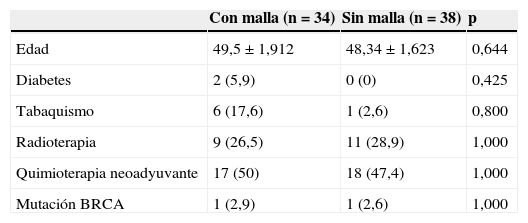
Cuando se analizan por separado los 2 grupos de pacientes encontramos que ambos son homogéneos en cuanto a la edad, la diabetes, el tabaquismo y el tratamiento previo con quimioterapia y/o radioterapia (ver tabla 1).
Tabla comparativa para los grupos de casos y controles
| Con malla (n=34) | Sin malla (n=38) | p | |
|---|---|---|---|
| Edad | 49,5±1,912 | 48,34±1,623 | 0,644 |
| Diabetes | 2 (5,9) | 0 (0) | 0,425 |
| Tabaquismo | 6 (17,6) | 1 (2,6) | 0,800 |
| Radioterapia | 9 (26,5) | 11 (28,9) | 1,000 |
| Quimioterapia neoadyuvante | 17 (50) | 18 (47,4) | 1,000 |
| Mutación BRCA | 1 (2,9) | 1 (2,6) | 1,000 |
En el caso de la edad se presenta la media±DE, y para las variables cualitativas, la frecuencia (porcentaje).
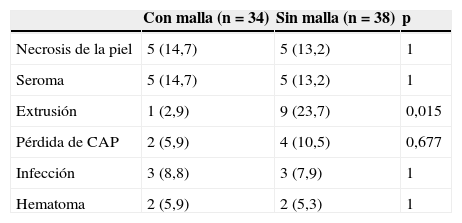
Al comparar las complicaciones en ambos grupos no encontramos diferencias estadísticamente significativas para el seroma, la infección, el hematoma, la necrosis de piel y la pérdida de CAP (ver tabla 2). Sin embargo, la extrusión del implante fue más frecuente en las reconstrucciones en las que no se empleó Strattice® (23,7 vs. 2,9%) (p=0,015).
Frecuencia de las principales complicaciones en ambos grupos
| Con malla (n=34) | Sin malla (n=38) | p | |
|---|---|---|---|
| Necrosis de la piel | 5 (14,7) | 5 (13,2) | 1 |
| Seroma | 5 (14,7) | 5 (13,2) | 1 |
| Extrusión | 1 (2,9) | 9 (23,7) | 0,015 |
| Pérdida de CAP | 2 (5,9) | 4 (10,5) | 0,677 |
| Infección | 3 (8,8) | 3 (7,9) | 1 |
| Hematoma | 2 (5,9) | 2 (5,3) | 1 |
Datos expresados como n (%).
Tras una revisión de la bibliografía se eligió la malla Strattice® de origen porcino por ofrecer una mayor facilidad de manejo, al no requerir rehidratación, estar lista en 2min de lavado con suero fisiológico, estar disponible en tamaños grandes, poderse almacenar a temperatura ambiente y no tener polaridad16.
En las reconstrucciones tras mastectomía, el tratamiento neoadyuvante y adyuvante, sobre todo después de la radioterapia, aumenta el número de complicaciones y la pérdida de implantes. Así, Krueger et al.17 observan un 68% de complicaciones en las paciente irradiadas frente al 31% de las pacientes no irradiadas, con un porcentaje mayor de pérdidas de implante. Cordeiro y McCarthy18 también presentan un número mayor de complicaciones absolutas en las pacientes irradiadas frente a las no irradiadas (11,7 vs. a 5,6%), con un porcentaje mayor de infecciones, pérdida de implante, necrosis y seroma. Por eso consideramos importante que ambos grupos de pacientes fueran homogéneos respecto al antecedente de haber recibido radioterapia y/o quimioterapia para estudiar el índice de complicaciones atribuibles al uso o no de ADM, ya que estos factores podrían sesgar la interpretación de los resultados.
Analizando nuestros resultados, no hemos encontrado un aumento significativo en la incidencia de seromas, hematomas, infecciones o necrosis de la piel, incluida la pérdida del CAP, al realizar las reconstrucciones con ADM frente a los casos sin ellas. Estos resultados son comparables a los de otras series publicadas en las que tampoco se ha encontrado un aumento significativo en la incidencia de complicaciones al incluir la ADM en las reconstrucciones mamarias4,9,10,15,19. Existe controversia al respecto, ya que en la literatura se encuentran trabajos en los que sí se muestra un aumento significativo en la incidencia de complicaciones postoperatorias con el uso de ADM. Algunos hacen referencia al aumento en el índice de seromas, infecciones, necrosis e incluso en la pérdida del implante20, mientras que otros solo reportan un aumento significativo en el índice de seromas12,14,21 y de infecciones12,13,22. La causa de estas diferencias en los resultados no está clara. Algunos autores23–25 apuntan a que la mayoría de los estudios desarrollados sobre el efecto de las ADM en los resultados postoperatorios están hechos con AlloDerm®, ya que ha sido el producto comercializado durante más tiempo, y ha sido posteriormente cuando se han publicado series con el uso de otras ADM tanto de origen humano como de origen porcino, y aunque la preparación es similar en cuanto a la eliminación de la celularidad del tejido y de organismos infecciosos, pueden existir diferencias sutiles en el procesamiento y almacenamiento de estos productos, no publicadas, que provoquen una respuesta inflamatoria mayor influyendo en la formación de seroma y que podría estar relacionada con el aumento de otras complicaciones como la infección o extrusión del implante23. También se hace referencia a que las importantes diferencias inmunológicas entre las matrices de origen humano y no humano puedan influir en el índice de complicaciones, no siendo extrapolables los resultados de diferentes estudios25. En otros trabajos se considera que el hecho de que no exista unanimidad de criterios a la hora de definir el concepto de seroma o de infección puede influir en los diferentes resultados obtenidos, ya que los signos clínicos pueden ser interpretados de diferente forma. Brzezienski et al.26 concluyen que es necesario definir el concepto de seroma en las reconstrucciones inmediatas utilizando ADM, así como una clasificación del mismo para poder discutir su impacto o proponer soluciones para reducir su incidencia. Así mismo, es necesario unificar la definición de infección, ya que puede confundirse con el síndrome del pecho rojo (eritema autolimitado atribuible a la recelularidad de la ADM) y puede erróneamente elevar su incidencia estadística. El síndrome del pecho rojo se nos presentó en un caso de nuestra serie, y pudo ser diferenciado de un proceso infeccioso.
En nuestra serie, la extrusión del implante, cuando se ha utilizado Strattice® en la reconstrucción inmediata, se ha producido en un 2,9% de los casos, resultado similar al publicado en otras series con el uso de ADM14,20,22,27. Además, hemos obtenido una disminución estadísticamente significativa en la incidencia de extrusión al compararla con las reconstrucciones sin el uso de ADM. Se han realizado metaanálisis con resultados contradictorios al respecto. Kim et al.20 y Ho et al.28 refieren una mayor pérdida del implante con ADM; sin embargo, Sbitany y Serletti12,27 no encuentran diferencias cuando la reconstrucción se realiza con ADM o sin ella. En este estudio, el alto porcentaje de extrusiones en el grupo de pacientes reconstruidas solo con material protésico puede ser debido a que en todos los casos la cirugía radical fue mastectomía ahorradora de piel o piel y CAP y reconstrucción inmediata con prótesis en todos los casos, incluyendo, además, patrones cutáneos verticales o en T invertida en el mismo acto quirúrgico, aumentando así el riesgo de necrosis cutánea y la exposición del material protésico, entendiéndose así la drástica reducción del número de implantes perdidos al utilizar Strattice® para completar la cobertura del implante.
Entre las limitaciones que deben ser consideradas en nuestro estudio, hay que señalar que se trata de una serie pequeña de pacientes, existiendo dificultades a la hora de establecer pequeñas diferencias entre los grupos, si bien el propósito inicial del estudio era demostrar la seguridad del uso de Strattice® comparándolo con la técnica sin el uso de la misma antes de realizar evaluaciones más complejas.
Podemos concluir el beneficio de utilizar Strattice® en la reconstrucción inmediata tras mastectomía porque, aunque no disminuye la incidencia de algunas complicaciones postoperatorias inmediatas que precisen de una actuación quirúrgica, la matriz, por su mejor tolerancia a la exposición, disminuye el riesgo de extrusión del implante y, por tanto, del fracaso de la reconstrucción.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
FinanciaciónProyecto financiado por la Asociación Española Contra el Cáncer (AECC).
AutoríaTodos los autores han contribuido intelectualmente al trabajo, reúnen las condiciones de autoría y han aprobado la versión final del mismo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.