Evaluar en pacientes con ganglios axilares clínicamente negativos de inicio, la efectividad de la biopsia selectiva del ganglio centinela (BSGC) intraoperatoria mediante el método one step nucleic acid amplification (OSNA) para detectar metástasis microscópicas o celulares tras quimioterapia neoadyuvante, y evitar la duplicidad de procedimientos quirúrgicos.
Pacientes y métodosSe evaluó la efectividad de la BSGC mediante OSNA en pacientes con cáncer de mama que previamente tenían una axila clínica y ecográficamente negativa tras quimioterapia neoadyuvante (44 pacientes) o antes de la quimioterapia neoadyuvante (33 pacientes).
ResultadosLa tasa de identificación del ganglio centinela (GC) fue del 100% en ambos grupos. En las pacientes con BSGC previa a la quimioterapia se detectaron 13 mujeres con ganglios positivos (11 macrometástasis y 2 micrometástasis). En las pacientes tratadas primero con quimioterapia, se detectaron 10 mujeres con GC positivos, que fueron todos macrometástasis. El valor predictivo negativo de la prueba de ultrasonidos fue del 60,6% en pacientes con BSGC previa a quimioterapia y del 77,3% en pacientes con quimioterapia y posterior BSGC.
ConclusionesLa BSGC mediante el método OSNA en mujeres que presentan clínicamente ganglios linfáticos negativos tras haber recibido quimioterapia neoadyuvante predice el estado axilar con gran precisión. Permite de forma inmediata tomar decisiones sobre la indicación o no de realizar una linfadenectomía axilar, evitando así el retraso en la administración de la quimioterapia y beneficiándose las pacientes de un solo procedimiento quirúrgico.
To evaluate in patients with clinically negative axillary nodes at initial presentation, the effectiveness of sentinel lymph node biopsy (SLNB) using intraoperative the one step nucleic acid amplification (OSNA) method to detect microscopic metastases or isolated tumor cells after neoadjuvant chemotherapy. Thus, axillary dissection and duplication of surgical procedures will be avoided.
Patients and methodsWe evaluated in patients with breast cancer and clinically negative axilla, the effectiveness of SLNB by OSNA after neoadjuvant chemotherapy (44 patients) or prior to neoadjuvant chemotherapy (33 patients).
ResultsThe rate of SLN identification was 100% in both groups. In patients with SLNB prior to systemic treatment, 13 women showed positive nodes (11 macrometastases and 2 micrometastases), and those with SLNB after neoadjuvant chemotherapy, positive SLNB were detected in 10 women, which were all of them macrometastases. The negative predictive value of ultrasonography was 60.6% in patients with SLNB prior to neoadjuvant therapy and 77.3% in patients with chemotherapy followed by SLNB.
ConclusionsIntraoperative SLNB using OSNA in women with clinically negative axillary lymph nodes at initial presentation who received neoadjuvant chemotherapy, predicts axillary status with high accuracy. Also it allows immediately make decisions about the indication or not to perform an axillary dissection, thus avoiding delay in the administration of chemotherapy and benefit the patients for a single surgical procedure.
El estado de los ganglios linfáticos axilares es el factor pronóstico más importante para las pacientes con cáncer de mama (CM)1,2, y su disección está asociada con una elevada morbilidad. Se incluye así el riesgo de desarrollar linfedema del miembro superior, dolor, parestesia, y la restricción del movimiento de la cintura escapular3,4. Por el contrario, la biopsia selectiva del ganglio centinela (BSGC) es una cirugía mínimamente invasiva y permite la evaluación de los ganglios axilares con menor morbilidad5. De hecho, ha sido validado en el CM temprano para reflejar con precisión el estado de los ganglios linfáticos restantes en el conjunto del drenaje linfático6. De este modo, las pacientes con ganglios centinela (GC) negativos evitan la disección del resto de ganglios linfáticos axilares5,7. Sin embargo, no hay pruebas suficientes para apoyar la recomendación de la BSGC en ciertos casos, como las pacientes que han recibido quimioterapia neoadyuvante para reducir el tamaño de los tumores y permitir así la cirugía conservadora de la mama8–10. La quimioterapia induce alteraciones anatómicas del drenaje linfático, bien por la interrupción de los vasos linfáticos, bien por inflamación, fibrosis, bloqueo por células necróticas y/o células apoptóticas11, y podrían impedir una difusión adecuada del trazador durante el mapeo linfático y contribuir a una reducción en la tasa de éxito en la identificación del ganglio linfático centinela y al aumento de la tasa de falsos negativos12–15.
Se ha comprobado que ocurre una estadificación a la baja de los ganglios linfáticos axilares con la neoadyuvancia, a pesar de que las metástasis en los ganglios linfáticos son más resistentes a la terapia que el propio tumor primario. Por tanto, es necesario establecer la viabilidad de la biopsia del GC después de la quimioterapia neoadyuvante, teniendo en cuenta que la BSGC es un método preciso para la estadificación de la axila en pacientes con CM antes del tratamiento sistémico. Además, el examen anatomopatológico intraoperatorio del ganglio linfático centinela es útil para evitar un segundo procedimiento quirúrgico, pues un resultado positivo conlleva la disección ganglionar axilar. Los resultados previos de múltiples estudios apoyan la viabilidad de la biopsia intraoperatoria del GC, aunque las tasas de identificación y los falsos negativos son variables16–20. No obstante, el análisis de la BSGC mediante el método one step nucleic acid amplification (OSNA) se ha convertido en el más adecuado para aumentar la sensibilidad de la estadificación quirúrgica a través del descubrimiento de metástasis microscópicas o celulares, incluso no detectadas en el examen anatomopatológico de rutina21.
Por lo tanto, la demostración de la viabilidad y la precisión de la BSGC después de la quimioterapia neoadyuvante es de gran interés, no solo para evitar la duplicidad de procedimientos quirúrgicos, con el coste económico y temporal que ello conlleva, sino también para evitar la linfadenectomía axilar en el futuro a aquellas pacientes que respondan a la quimioterapia neoadyuvante disminuyendo el estadio de los ganglios hasta N022,23. En el presente estudio se evalúa en pacientes con ganglios axilares clínicamente negativos de inicio, la efectividad de la BSGC después de la quimioterapia neoadyuvante y su capacidad mediante el método OSNA para detectar metástasis tras el tratamiento sistémico, así como la eficacia de la ecografía axilar para detectar verdaderos negativos.
Material y métodosEn la Unidad de Patología Mamaria del Hospital Universitario de Jaén se practicó la BSGC a 44 pacientes diagnosticadas de CM invasivo tras recibir quimioterapia neoadyuvante (casos), y a 33 pacientes a las que se les realizó la BSGC previa al tratamiento sistémico (controles).
Los criterios de inclusión fueron: pacientes con CM T2-3 N0 entre enero de 2009 y agosto de 2011, con axila clínica y ecográficamente negativa. La axila fue examinada con una sonda lineal multifrecuencia (7-12MHz). Si el ganglio era sospechoso, se realizaba una biopsia con aguja gruesa (BAG). Todos los procedimientos fueron aprobados por el Comité Ético del Hospital Universitario de Jaén y se contó con el consentimiento informado de las pacientes. En todas ellas, la detección del GC se realizó utilizando radioisótopos solamente.
El día antes de la cirugía, el mapeo linfático se realizó con 4,0 mCi de nanocoloide de Tecnecio-99m (Nanocoll®, Amersham, UK) inyectado a nivel subareolar. La linfogammagrafía preoperatoria se realizó a todas las pacientes después de 1h de la inyección y se registró el patrón de drenaje linfático. Para ello, se usó una sonda de mano de detección gamma (Gamma Finder® II, WOM, AG, Ludwigsstadt, Alemania), con la que se pudieron identificar las áreas de mayor actividad en la axila y las estructuras ganglionares entre 20-24h después de la inyección. Se consideró GC a aquel que era radiactivo y/o palpable. Todos los ganglios se detectaron a nivel axilar. Cada GC fue extraído y enviado al Departamento de Anatomía Patológica para la biopsia intraoperatoria mediante el método OSNA24,25. El protocolo consistió en la homogeneización del tejido en una solución estabilizante del ARNm (Lynorhag®, pH 3,5; Sysmex, Barcelona, España) y la posterior amplificación isotérmica (65°C) de la citoqueratina 19 (CK19), utilizando el kit de amplificación Lynoamp® (Sysmex) mediante el ensayo de amplificación isotérmica mediada por la transcriptasa reversa, utilizando el detector de amplificación génica RD-100i® (Sysmex). Todos los casos fueron clasificados de acuerdo con el sistema de clasificación TNM.
En el análisis con la técnica OSNA, fueron considerados positivos y clasificados como micrometástasis los casos que mostraban niveles de ARNm de CK19>250copias/μl (número de copias>250 copias/μL<5.000copias/μl), o macrometástasis (número de copias>5.000copias/μl) siguiendo las especificaciones del sistema, basadas en cálculos previos. Los casos identificados como negativos por el sistema (<250copias/μl) fueron clasificadas posteriormente como células tumorales aisladas (número de copias/μl>100 pero<250) o negativo verdadero si el número de copias/μl fue<100. La disección axilar completa se llevó a cabo en aquellas pacientes con micro y macrometástasis. Los ganglios linfáticos obtenidos a partir de la disección axilar se evaluaron mediante tinción H&E estándar. Los esquemas de tratamiento quimioterápico fueron: adriamicina (60mg/m2 cada 21 días, 4 sesiones) más docetaxel (100mg/m2 cada 21 días, 4 sesiones). Si fueron HER-2 positivo, se administró trastuzumab dosis de carga 8mg/kg y 6mg/kg cada 21 días durante un año. El tratamiento quirúrgico se realizó según lo planeado, bien con cirugía conservadora (tumorectomía con o sin radioguided occult lesion localisation), bien mastectomía con reconstrucción inmediata (simple, ahorradora de piel o ahorradora del complejo aréola-pezón).
El seguimiento axilar de las pacientes contempló cada 6 meses un control ecográfico y exploración clínica. El seguimiento para excluir enfermedad sistémica se llevó a cabo según protocolo de nuestra Unidad, basado en las recomendaciones de la Sociedad Española de Senología y Patología Mamaria (SESPM) y de la American Society of Clinical Oncology. Finalmente, se utilizó la estadística descriptiva para estudiar los resultados obtenidos.
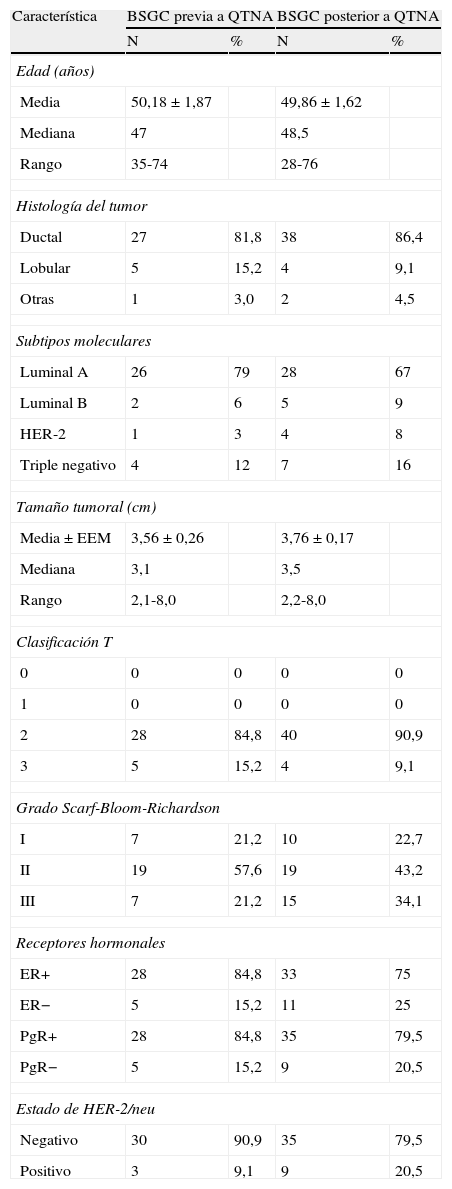
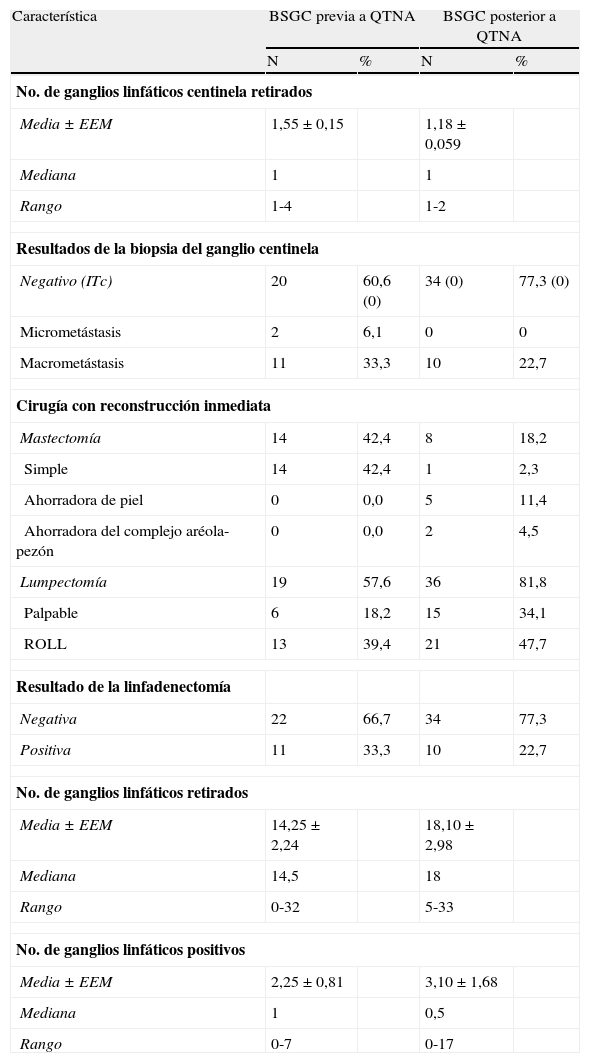
ResultadosLas características clínicas y patológicas de las 33 pacientes con CM a las que se le había practicado BSGC previa a la quimioterapia (controles) y de las 44 pacientes (casos) tratadas previamente con quimioterapia neoadyuvante y posterior BSGC se muestran en la tabla 1. Las características de los procedimientos realizados se muestran en la tabla 2. La tasa de identificación del GC fue del 100%.
Características clinicopatológicas de los pacientes
| Característica | BSGC previa a QTNA | BSGC posterior a QTNA | ||
| N | % | N | % | |
| Edad (años) | ||||
| Media | 50,18±1,87 | 49,86±1,62 | ||
| Mediana | 47 | 48,5 | ||
| Rango | 35-74 | 28-76 | ||
| Histología del tumor | ||||
| Ductal | 27 | 81,8 | 38 | 86,4 |
| Lobular | 5 | 15,2 | 4 | 9,1 |
| Otras | 1 | 3,0 | 2 | 4,5 |
| Subtipos moleculares | ||||
| Luminal A | 26 | 79 | 28 | 67 |
| Luminal B | 2 | 6 | 5 | 9 |
| HER-2 | 1 | 3 | 4 | 8 |
| Triple negativo | 4 | 12 | 7 | 16 |
| Tamaño tumoral (cm) | ||||
| Media±EEM | 3,56±0,26 | 3,76±0,17 | ||
| Mediana | 3,1 | 3,5 | ||
| Rango | 2,1-8,0 | 2,2-8,0 | ||
| Clasificación T | ||||
| 0 | 0 | 0 | 0 | 0 |
| 1 | 0 | 0 | 0 | 0 |
| 2 | 28 | 84,8 | 40 | 90,9 |
| 3 | 5 | 15,2 | 4 | 9,1 |
| Grado Scarf-Bloom-Richardson | ||||
| I | 7 | 21,2 | 10 | 22,7 |
| II | 19 | 57,6 | 19 | 43,2 |
| III | 7 | 21,2 | 15 | 34,1 |
| Receptores hormonales | ||||
| ER+ | 28 | 84,8 | 33 | 75 |
| ER− | 5 | 15,2 | 11 | 25 |
| PgR+ | 28 | 84,8 | 35 | 79,5 |
| PgR− | 5 | 15,2 | 9 | 20,5 |
| Estado de HER-2/neu | ||||
| Negativo | 30 | 90,9 | 35 | 79,5 |
| Positivo | 3 | 9,1 | 9 | 20,5 |
BSGC: biopsia selectiva del ganglio centinela; EEM: error estándar de la media; QTNA: quimioterapia neoadyuvante.
Procedimientos
| Característica | BSGC previa a QTNA | BSGC posterior a QTNA | ||
| N | % | N | % | |
| No. de ganglios linfáticos centinela retirados | ||||
| Media±EEM | 1,55±0,15 | 1,18±0,059 | ||
| Mediana | 1 | 1 | ||
| Rango | 1-4 | 1-2 | ||
| Resultados de la biopsia del ganglio centinela | ||||
| Negativo (ITc) | 20 | 60,6 (0) | 34 (0) | 77,3 (0) |
| Micrometástasis | 2 | 6,1 | 0 | 0 |
| Macrometástasis | 11 | 33,3 | 10 | 22,7 |
| Cirugía con reconstrucción inmediata | ||||
| Mastectomía | 14 | 42,4 | 8 | 18,2 |
| Simple | 14 | 42,4 | 1 | 2,3 |
| Ahorradora de piel | 0 | 0,0 | 5 | 11,4 |
| Ahorradora del complejo aréola-pezón | 0 | 0,0 | 2 | 4,5 |
| Lumpectomía | 19 | 57,6 | 36 | 81,8 |
| Palpable | 6 | 18,2 | 15 | 34,1 |
| ROLL | 13 | 39,4 | 21 | 47,7 |
| Resultado de la linfadenectomía | ||||
| Negativa | 22 | 66,7 | 34 | 77,3 |
| Positiva | 11 | 33,3 | 10 | 22,7 |
| No. de ganglios linfáticos retirados | ||||
| Media±EEM | 14,25±2,24 | 18,10±2,98 | ||
| Mediana | 14,5 | 18 | ||
| Rango | 0-32 | 5-33 | ||
| No. de ganglios linfáticos positivos | ||||
| Media±EEM | 2,25±0,81 | 3,10±1,68 | ||
| Mediana | 1 | 0,5 | ||
| Rango | 0-7 | 0-17 | ||
Hasta la fecha, no se han detectado recidivas por ecografía. Todas las pacientes se encuentran libres de enfermedad sistémica.
BSGC: biopsia selectiva del ganglio centinela; EEM: error estándar de la media; QTNA: quimioterapia neoadyuvante; ROLL: radioguided occult lesion localization.
En el grupo control, la edad media fue de 50 años (50,18±1,87 años, media±SEM), con un rango de 35 a 74 años. En el grupo de casos, la edad media fue de 49 años (49,86±1,62 años, media±SEM), con un rango desde 28 a 76 años. De las pacientes controles, en 27 (81,8%) el tumor fue carcinoma ductal infiltrante, en 5 (15,2%) fue carcinoma lobulillar infiltrante y en una (3%) fue de otro tipo histológico. De las pacientes casos, en 38 (86,4%) el tumor fue carcinoma ductal infiltrante, en 4 (9,1%) fue carcinoma lobulillar infiltrante, y en 2 (4,5%), otro tipo histológico.
En las pacientes controles se obtuvieron 1,55±0,15 ganglios linfáticos, y 13 pacientes (39,4%) presentaron GC positivos. De estos, 11 fueron macrometástasis y 2 micrometástasis. En 7 pacientes el GC fue el único ganglio positivo. En una paciente, uno de los ganglios axilares fue positivo, además del GC. En 5 pacientes, el GC y más de uno de los ganglios axilares fueron positivos.
En las pacientes casos se obtuvieron 1,18±0,059 ganglios, y 10 de ellos (22,7%) fueron positivos, todos macrometástasis. En 5 de las 10 pacientes, el GC fue el único ganglio positivo. En una paciente, uno de los ganglios axilares fue positivo, además del GC. En 4 pacientes, el GC y más de uno de los ganglios axilares fueron positivos.
El valor predictivo negativo (VPN), esto es, la probabilidad de que si los ganglios axilares son ecográficamente negativos, el GC sea realmente negativo y, por ende, el resto de la axila, fue del 60.6% en pacientes con BSGC previa al tratamiento sistémico, y del 77.3% en pacientes con neoadyuvancia y posterior BSGC.
Hasta la fecha, no se han detectado recidivas, y todas las pacientes están libres de enfermedad sistémica, con una mediana de seguimiento de 21,5 meses en los casos (rango: 12-40 meses) y 40 meses en los controles (25-42 meses).
DiscusiónEn nuestro estudio se ha evaluado la viabilidad y la exactitud de la biopsia intraoperatoria del GC mediante el método OSNA antes y después de la quimioterapia neoadyuvante en una serie de pacientes homogéneos. La tasa de identificación ha sido del 100%, con un VPN del estudio ecográfico previo del 60,60% en mujeres con BSGC previa a la quimioterapia neoadyuvante, y del 77,27% en mujeres con BSGC posterior al tratamiento sistémico primario. Estos resultados son consistentes con los de un metaanálisis que analiza la eficacia de la biopsia del GC después de la quimioterapia en un total de 1.273 pacientes con CM a partir de 21 estudios diferentes20. La estimación combinada de la tasa de identificación fue del 90%. En comparación, 3 metaanálisis sobre eficacia de la BGC sin quimioterapia neoadyuvante publican tasas de identificación entre el 83,66,26 y el 90%27. Por lo tanto, las tasas de identificación de los GC en los estudios con y sin quimioterapia neoadyuvante son similares. En otro metaanálisis utilizando quimioterapia28, la tasa de identificación del GC fue del 90,9%. En general, estas tasas no difieren sustancialmente de las obtenidas mediante la evaluación de las tasas de éxito en la identificación del GC en pacientes sin quimioterapia neoadyuvante, donde se han descrito tasas del 88-97%.
En la actualidad, se quiere demostrar que en las pacientes que tienen la axila clínicamente negativa de inicio, la BSGC es un procedimiento adecuado incluso después de la neoadyuvancia. Diversos estudios han puesto de manifiesto los resultados de este procedimiento29–43: el tamaño de la muestra osciló entre 14 y 428 pacientes, que presentaban un estadio clínico de los tumores entre T0 y T4. El fracaso en la identificación del GC osciló entre el 0-28% de los casos. Un inconveniente de la mayoría de estos estudios es que las pacientes podían haber presentado ganglios linfáticos palpables antes de la neoadyuvancia. Si se considera estrictamente que los ganglios linfáticos axilares sean clínicamente negativos de inicio, solo se han llevado a cabo 3 estudios previos44–46, con una tasa media de identificación del GC del 90% (usando tinción y/o radiomarcaje). En cualquier caso, la mayoría de estos ensayos fueron incluidos en el metaanálisis inicialmente referido20. Además, en estos estudios, todas las pacientes sufrieron linfadenectomía axilar junto con la BSGC tras la neoadyuvancia, independientemente del estado del ganglio, algo que no se ha hecho en el presente estudio para no realizar disecciones axilares innecesarias. Por este motivo, no se puede determinar la tasa de falsos negativos, si bien se puede inferir una tasa clínica de falsos negativos basándose en el seguimiento clínico de recurrencias axilares, que ha sido en nuestro caso del 0% hasta el momento.
Por otro lado, en un estudio de Hunt et al.47 con un importante número de pacientes (n=575), se obtuvo una tasa de identificación del GC mucho más alta, del orden del 97,4%. Como en nuestro caso, estos pacientes presentaban axila clínicamente negativa en el momento de la presentación y antes de la neoadyuvancia.
En este estudio se demuestra que la tasa de identificación del GC mejora significativamente con la experiencia, lo que explica nuestra tasa de identificación del 100%. Esto sugiere también que una elevada tasa de fracaso en el mapeo del GC puede deberse a la inexperiencia propia de los estudios iniciales y que, por lo tanto, se requiere un periodo de aprendizaje adecuado para realizar la BSGC en pacientes sometidas previamente a quimioterapia neoadyuvante, para tener unas tasas de identificación equivalente a las obtenidas en los procedimientos llevados a cabo antes de la quimioterapia.
Sin embargo, algunos autores realizan biopsia del GC en pacientes con axila clínicamente positiva después de la quimioterapia neoadyuvante48 y han encontrado que la tasa de identificación era del 80,6%. Nuestros resultados coinciden más con otros estudios clínicos que incluyen pacientes libres de ganglios en la presentación, y que mostraron tasas de identificación del 9849, el 97,450 y el 99%51. Estas pacientes se caracterizan por tumores de mama de gran tamaño, que es una de las indicaciones más frecuentes para aconsejar quimioterapia neoadyuvante. Como se ha indicado por Gimbergues et al.52, en estas pacientes la BSGC puede considerarse equivalente a la biopsia antes de la quimioterapia neoadyuvante. Por lo tanto, la BSGC después de la quimioterapia neoadyuvante parece ser tan exacta como la BSGC antes de la quimioterapia en pacientes con ganglios axilares clínicamente negativos en la presentación. Debido a que la biopsia del GC previa a tratamiento sistémico requiere 2 procedimientos quirúrgicos, uno para la extracción del GC y otro para la cirugía mamaria, podría inducir además un retraso en la administración de tratamiento sistémico en caso de complicaciones, y conduce, por último, a la pérdida de información sobre la erradicación potencial de las células cancerosas en el GC por la quimioterapia neoadyuvante.
Es evidente que sigue siendo controvertido determinar el momento óptimo para realizar la BSGC en el tratamiento neoadyuvante. De hecho, la SESPM, en su Conferencia de Consenso de 201053, sigue sin recomendar la biopsia del GC después del tratamiento con quimioterapia neoadyuvante, salvo en el contexto de ensayos clínicos.
Algunos autores argumentan que la quimioterapia altera los patrones de drenaje linfático, lo que resulta en un elevado número de falsos negativos14,54. Los defensores de la BSGC previa a la quimioterapia creen que la determinación del estado axilar antes de la quimioterapia ofrece una estadificación más precisa, puede determinar con mayor precisión las áreas de radiación, y permite mejorar la evaluación de la respuesta a la quimioterapia. Además, se atribuye a este enfoque una mejor tasa de identificación del GC y una menor tasa de falsos negativos. Por el contrario, los defensores de la BSGC tras la neoadyuvancia (en pacientes con axila clínica y ecográficamente negativa) creemos que así no se retrasa el inicio de la quimioterapia, se determina mejor el estado axilar posterior a la neoadyuvancia, lo que puede ser de mejor valor pronóstico, y se evita la pérdida de información sobre la respuesta ganglionar a la quimioterapia de aquellos ganglios clasificados como centinela. Finalmente, también se evita que muchas mujeres sufran una linfadenectomía axilar innecesaria y que las mujeres sufran 2 procedimientos quirúrgicos.
Aunque al principio se consideraban como desventajas las menores tasas de identificación del GC, los resultados actuales han mejorado notablemente. No obstante, los resultados acerca de la exactitud y la viabilidad de la biopsia del GC después de la quimioterapia neoadyuvante han sido contradictorios55–61. En los distintos estudios, la tasa de identificación fluctúa entre el 70-100% y el VPN de la prueba ecográfica entre el 50-88%61. Estas diferencias pueden estar relacionadas con los problemas de aprendizaje, la dificultad en la punción de los ganglios linfáticos pequeños, y el error de muestreo, por lo que este procedimiento es más valioso en pacientes con estadios localmente avanzados62.
En conclusión, nuestros resultados apoyan la idea de que la biopsia intraoperatoria del GC mediante el método OSNA después de la quimioterapia neoadyuvante en pacientes con CM mediante marcaje con radioisótopos es factible y puede predecir el estado axilar con una gran precisión en las pacientes que presentaban ganglios clínicamente negativos al inicio. Este análisis intraoperatorio permite, además, tomar decisiones de forma inmediata sobre la necesidad de llevar a cabo la linfadenectomía axilar, y evitar además el retraso en la administración de la quimioterapia. Es relevante también que las pacientes solo requieren un procedimiento quirúrgico en lugar de dos, beneficiándose tanto ellas como las Instituciones Sanitarias.
FinanciaciónConsejería de Salud de la Junta de Andalucía. Proyecto PI-0770-2010. Consejería de Innovación, Ciencia y Empresa. Grupo PAIDI BIO-296.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.