El suelo es el reservorio natural de hongos queratinofílicos que constituyen un pequeño pero importante grupo de hongos filamentosos; algunos de ellos se desarrollan típicamente sobre tejidos queratinizados de animales vivos. Hay numerosas especies de geohongos saprobios con habilidades queratolíticas reconocidas y son varios los trabajos realizados con el fin de vincular su presencia a la posible enfermedad humana.
ObjetivosConocer la biota de geohongos en general y la de aquellos queratolíticos en particular en suelos de dos parques públicos.
MétodosLas muestras se tomaron de suelos de dos parques públicos de la ciudad de Corrientes, Argentina, durante dos estaciones del año. Para el aislamiento de los hongos se usaron las técnicas del anzuelo queratínico y la de las diluciones.
ResultadosMediante la técnica del anzuelo se aislaron 170 cepas que se clasificaron en 17 géneros y 21 especies, entre las que merece destacar la presencia de Microsporum canis. El índice de Shannon de hongos queratolíticos fue medio, siendo en otoño (2,27) más alto que en primavera (1,92). Con la técnica de diluciones seriadas se obtuvieron 278 cepas que se clasificaron en 33 géneros y 71 especies; el índice de Shannon fue más alto en otoño (3,9) que en primavera (3,5).
ConclusionesLos suelos estudiados presentan condiciones particularmente favorables para la supervivencia de geohongos patógenos y oportunistas para el hombre y los animales.
The soil is a natural reservoir of keratinophilic fungi, which are a small but important group of filamentous fungi, some of which typically develop on keratinized tissues of living animals. There are numerous species of saprophytic fungi with recognized keratinophilic abilities, and several studies have been undertaken in order to link their presence to possible human disease.
AimsTo know the biota of geophilic fungi in general and of keratinophilic fungi particularly in soils from two public parks.
MethodsSoil samples from two public parks of Corrientes city, Argentina, were studied during two seasons, using the hook technique and serial dilutions for fungal isolation.
ResultsUsing the hook technique, 170 isolates were classified into 17 genera and 21 species, among which it is worth mentioning the presence of Microsporum canis. Shannon index for keratinophilic fungi in autumn was 2.27, and 1.92 in spring. By means of the serial dilutions technique, 278 fungi isolated were identified into 33 genera and 71 species. Shannon index in autumn was 3.9, and 3.5 in spring.
ConclusionsThe soils studied have particularly favorable conditions for the survival of pathogens and opportunistic geophilic fungi for humans and animals.
El suelo es el hábitat primordial de los hongos; para algunas especies es el sitio donde cumplen su ciclo biológico, para otras es solo un hábitat temporal donde permanecen hasta que, a través de algún mecanismo, logran alcanzar su nicho definitivo26. También es el reservorio natural de hongos queratinofílico/líticos. Estos constituyen un pequeño pero importante grupo de hongos filamentosos; algunos de ellos se desarrollan típicamente sobre tejidos queratinizados de animales vivos25. La presencia de geohongos con la capacidad de degradar la queratina fue descubierta en 1952; desde entonces se han reconocido más de 40 especies con esta habilidad. La distinción entre queratinolíticos y queratinofílicos es sutil y está basada en la diferente capacidad de usar la queratina. Sin embargo, entre los hongos fuertemente queratinolíticos, los débilmente queratinolíticos y los que solo digieren los compuestos queratínicos no hay una separación clara29,33,45. Los hongos queratinofílico/líticos son descomponedores de primera línea, indispensables para el ciclo biológico de la queratina y sus derivados, de ahí su importancia ecológica. Ellos están presentes en el ambiente con un patrón de distribución variable que depende de diferentes factores, tales como el pH del suelo y la presencia de seres humanos y otros animales, que es de fundamental importancia42,47. La habilidad de degradar la queratina es una característica poco común dentro de los hongos. La mayoría de los hongos queratinofílico/líticos conocidos pertenece al orden Onygenales, que agrupa a los dermatofitos y mohos afines, si bien hay algunas pocas especies de otros órdenes con esta característica. Todos son saprobios, comunes en el suelo y en restos de vegetales25. Los dermatofitos y hongos afines son queratinolíticos, y pueden infectar al hombre y los animales dando lugar a un ciclo entre el hombre, los animales y el suelo. Todos los dermatofitos tienen la habilidad de digerir la queratina in vivo e in vitro, provocando infecciones bien definidas en sus hospederos21,42. La mayoría de los dermatofitos, aun los más especializados, son capaces de vivir saprofíticamente; por ejemplo, Microsporum canis y Trichophyton mentagrophytes var. granulosum43,46. Los suelos ricos en materia orgánica pueden, por lo tanto, constituirse en un reservorio ocasional o permanente de ellos. El suelo probablemente es, en la compleja cadena epidemiológica, el eslabón que relaciona tanto en lo evolutivo como en el desarrollo a los dermatofitos geófilos, zoófilos y antropófilos21.
Actualmente hay muchas especies de geohongos saprobios con habilidades queratinofílico/líticas reconocidas, y son numerosos los trabajos realizados en distintos lugares con el fin de vincular su presencia a la posible enfermedad humana1,13,21,24,33. En nuestro país se ha informado del aislamiento de estos agentes en zonas rurales y áreas urbanas con características biogeográficas variadas23,30–32.
El objetivo de este trabajo fue conocer la biota de geohongos en general y la de queratinofílico/líticos en particular, en suelos de dos parques públicos.
Materiales y métodosÁrea de estudioEl muestreo se realizó en parques de la ciudad de Corrientes, Argentina (27°28′S-58°49′O). Esta ciudad es la capital de la provincia homónima y está situada a 52m sobre el nivel del mar, a orillas del río Paraná. Su clima es subtropical, sin estación seca. La humedad relativa media anual es del 72%. La temperatura media anual es de 21,5°C, con temperaturas extremas de 45°C en verano y −4°C en invierno. Su régimen de lluvias es regular, con precipitaciones que van de 950 a 1.400mm anuales10.
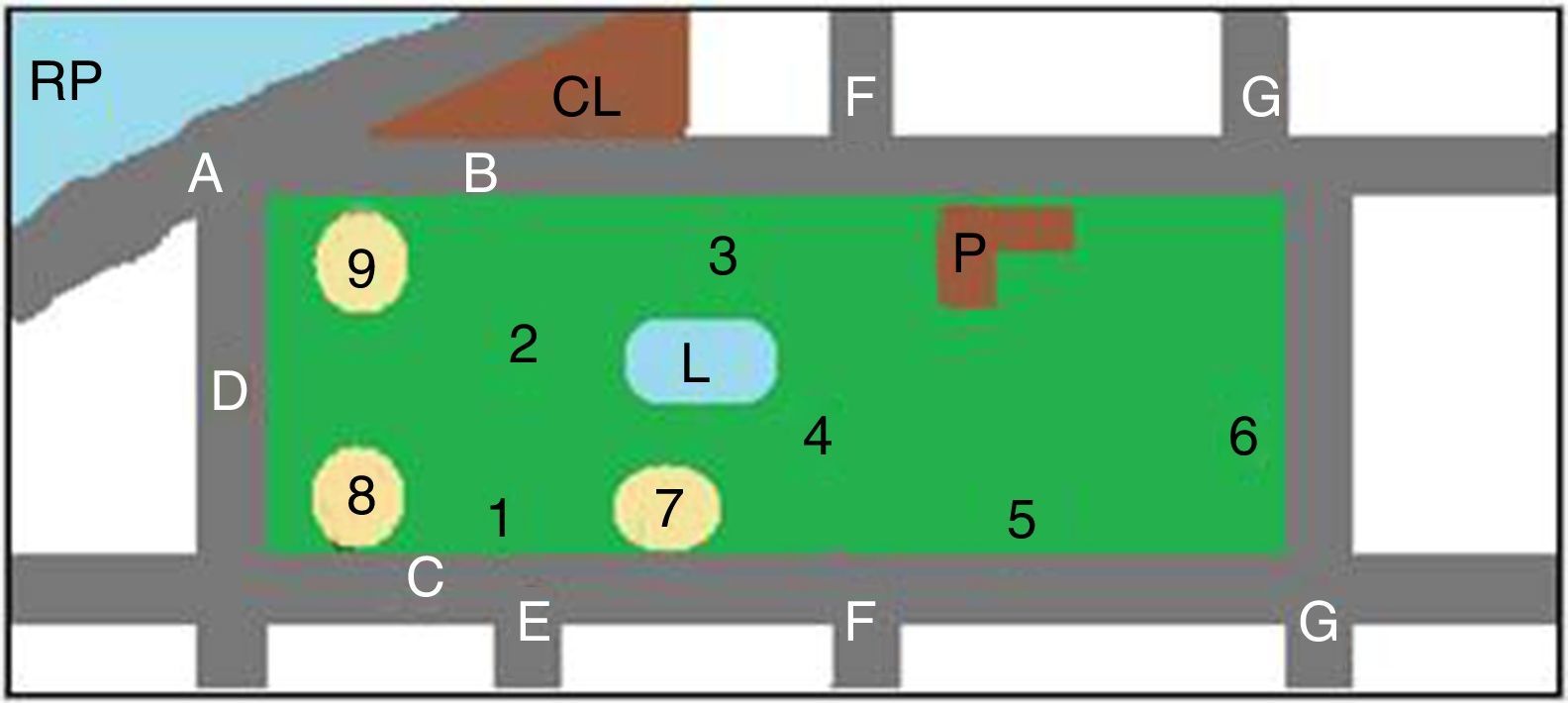
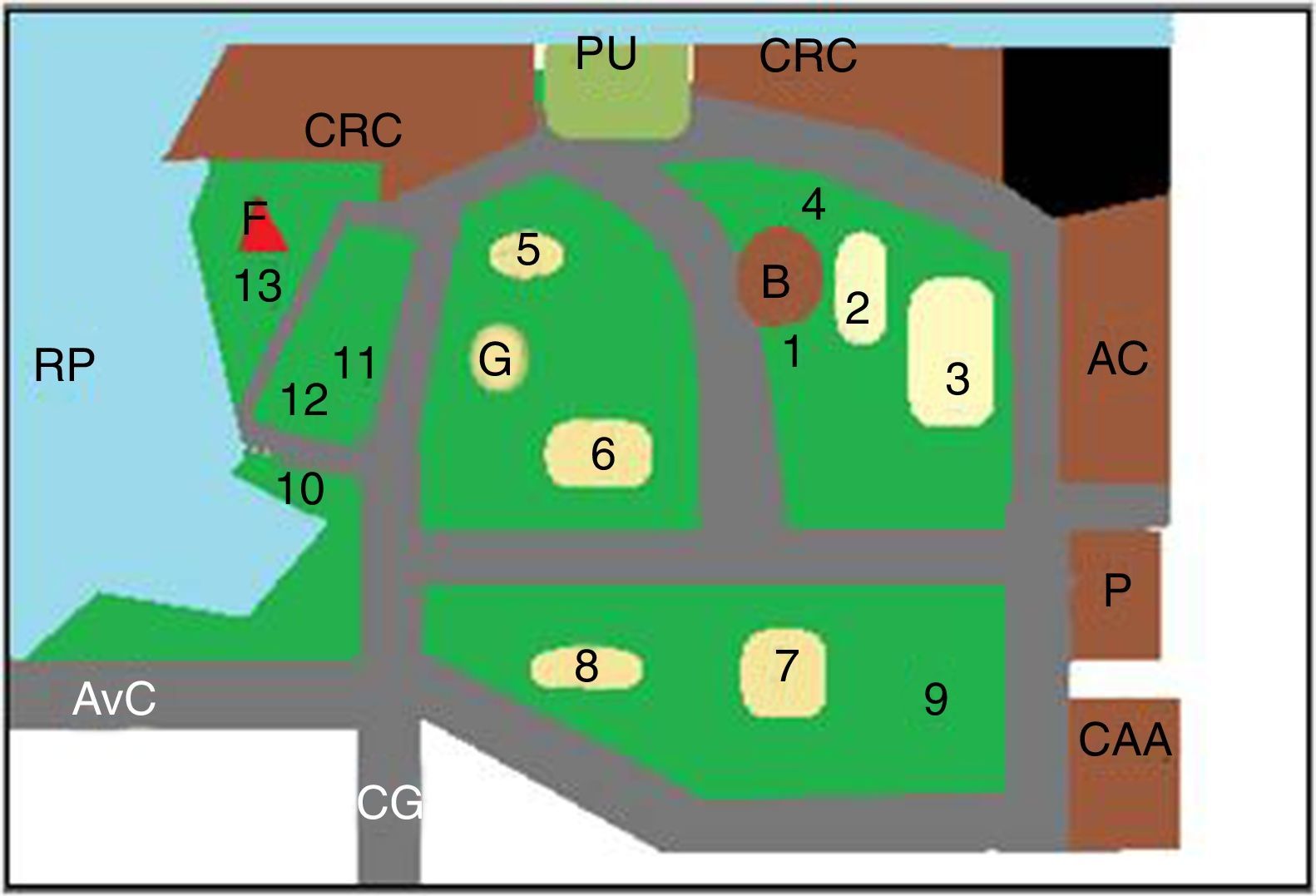
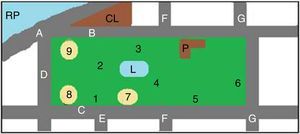
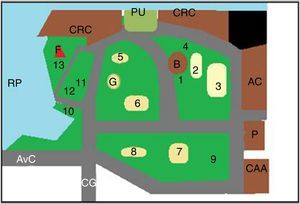
Los predios estudiados, parque Camba Cuá (fig. 1) y parque Mitre (fig. 2), están ubicados dentro de la zona urbana de la ciudad, frente al río Paraná, con amplios espacios sombreados.
Esquema del parque Mitre. AC: planta de potabilización de «Aguas de Corrientes»; AvC: Avenida Costanera; B: Biblioteca infantil; CAA: Club Atlético Alvear; CRC: Club de Regatas Corrientes; F: faro; P: cuartel de policía; RP: río Paraná; 1 a 13: sitios de muestreo; 2, 3, 5, 6, 7 y 8: areneros.
Para la toma de muestras se eligieron los lugares más concurridos por los visitantes (figs. 1 y 2). Las muestras fueron tomadas utilizando una geometría triangular equilátera, con un triángulo imaginario de 2m de lado en cada punto elegido. Cada muestra se conformó con 3 porciones de tierra, una por cada vértice del triángulo. Se realizaron 2 muestreos, uno en la primavera de 2011 y otro en el otoño de 2012, en los mismos lugares. El material se obtuvo con cuchara estéril, tomándolo justo por debajo de la superficie de la tierra (0,5-1cm), después de eliminar el material vegetal, los detritos y otros restos de la superficie del suelo. Cada muestra consistió en 200-250g de suelo, que se colocaron en sobres de papel estériles. Las muestras recogidas se conservaron en nevera hasta el momento de su procesamiento.
Aislamiento fúngicoPara el potencial aislamiento de hongos queratinofílicos se utilizaron la técnica del anzuelo queratínico36 y la técnica de las diluciones seriadas31.
En ambos casos, los hongos que no pudieron ser clasificados por observación macro y microscópica desde la placa original fueron transferidos a medios específicos para su identificación. En ambas técnicas, cada especie se contabilizó una sola vez en cada muestra, no importando si se repetía en la misma placa o en el duplicado36. La frecuencia de cada género se calculó a partir de la presencia de este en el total de las muestras. La diversidad se calculó con el índice de Shannon, cuyo rango de valores va de 1 a 541.
Identificación de los hongosPara la identificación de los hongos se utilizaron diversas obras7,12,14,16–18,22,39,44,48.
ResultadosEn total fueron recogidas 44 muestras de tierra, de las cuales 26 (13 de primavera y 13 de otoño) eran del parque Mitre y 18 (9 de primavera y 9 de otoño) del parque Camba Cuá.
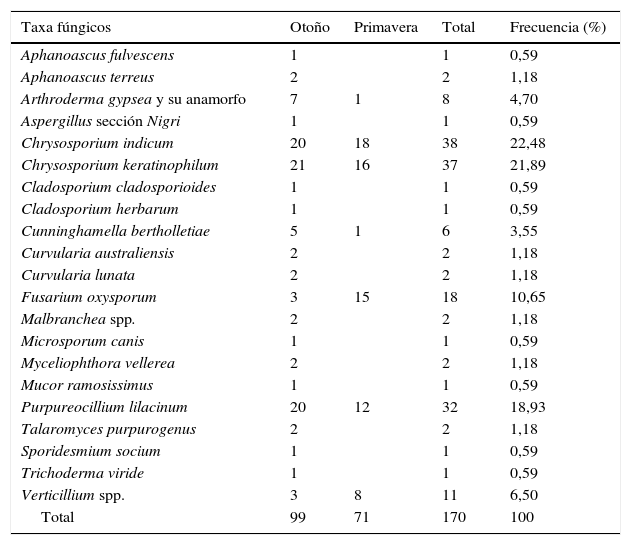
Técnica del anzuelo queratínicoEn el 100% de las muestras se obtuvo crecimiento fúngico sobre los pelos. Se aislaron 170 cepas que se clasificaron en 17 géneros y 21 especies (tabla 1). En otoño se aislaron 20 especies y en primavera 10. Las especies que aparecieron únicamente en otoño fueron 12, y 2 especies lo hicieron solo en primavera (tabla 1).
Géneros y especies de hongos aislados mediante la técnica del anzuelo queratínico
| Taxa fúngicos | Otoño | Primavera | Total | Frecuencia (%) |
|---|---|---|---|---|
| Aphanoascus fulvescens | 1 | 1 | 0,59 | |
| Aphanoascus terreus | 2 | 2 | 1,18 | |
| Arthroderma gypsea y su anamorfo | 7 | 1 | 8 | 4,70 |
| Aspergillus sección Nigri | 1 | 1 | 0,59 | |
| Chrysosporium indicum | 20 | 18 | 38 | 22,48 |
| Chrysosporium keratinophilum | 21 | 16 | 37 | 21,89 |
| Cladosporium cladosporioides | 1 | 1 | 0,59 | |
| Cladosporium herbarum | 1 | 1 | 0,59 | |
| Cunninghamella bertholletiae | 5 | 1 | 6 | 3,55 |
| Curvularia australiensis | 2 | 2 | 1,18 | |
| Curvularia lunata | 2 | 2 | 1,18 | |
| Fusarium oxysporum | 3 | 15 | 18 | 10,65 |
| Malbranchea spp. | 2 | 2 | 1,18 | |
| Microsporum canis | 1 | 1 | 0,59 | |
| Myceliophthora vellerea | 2 | 2 | 1,18 | |
| Mucor ramosissimus | 1 | 1 | 0,59 | |
| Purpureocillium lilacinum | 20 | 12 | 32 | 18,93 |
| Talaromyces purpurogenus | 2 | 2 | 1,18 | |
| Sporidesmium socium | 1 | 1 | 0,59 | |
| Trichoderma viride | 1 | 1 | 0,59 | |
| Verticillium spp. | 3 | 8 | 11 | 6,50 |
| Total | 99 | 71 | 170 | 100 |
Dentro del orden Onygenales, en ambos períodos, las especies más frecuentes fueron Chrysosporium indicum (22,48%) y Chrysosporium keratinophilum (21,89%). Entre los no Onygenales destacaron Purpureocillium lilacinum (18,93%), Fusarium oxysporum complex (10,65%) y el género Verticillium (6,5%).
La diversidad general, según el índice de Shannon, fue media (2,18), siendo en otoño (2,22) más alta que en primavera (1,64).
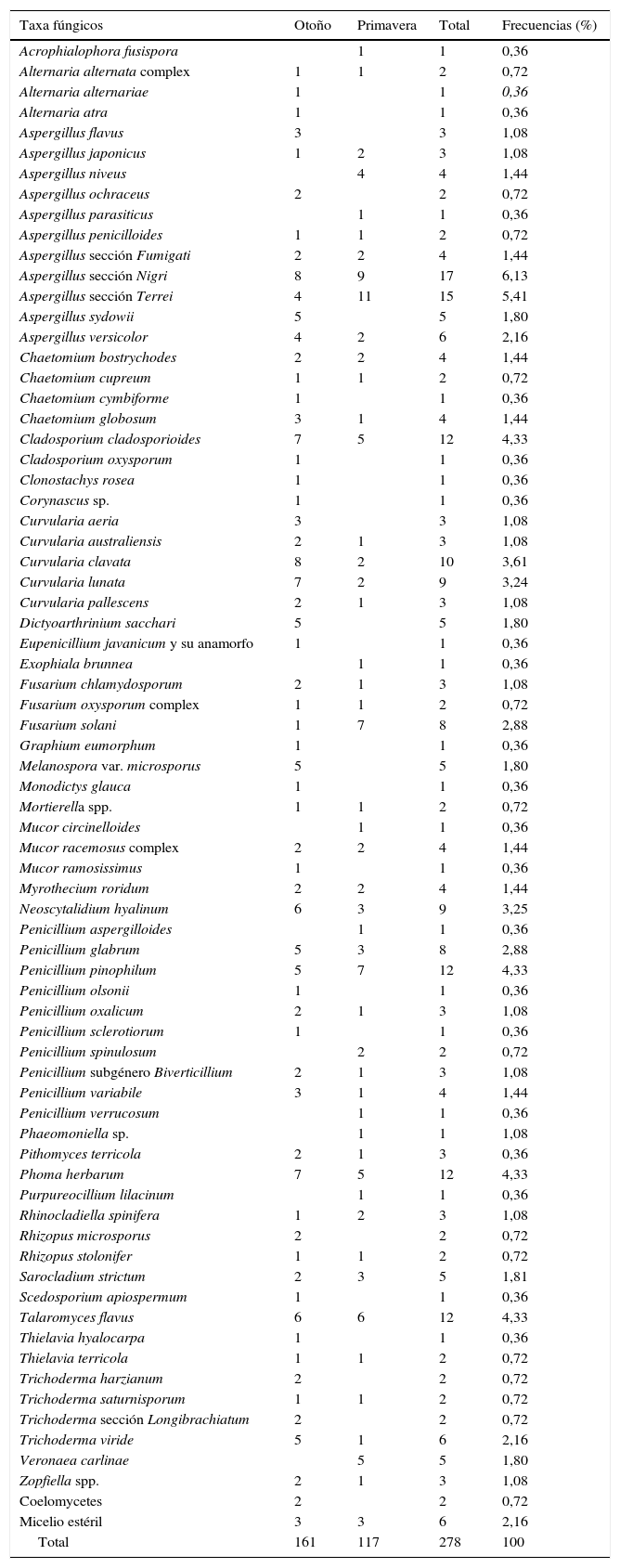
Técnica de las diluciones seriadasDe las 44 muestras recogidas se aislaron 278 cepas de hongos filamentosos; de ellas, 270 se clasificaron en 33 géneros y 71 especies; 2 eran cepas de Coelomycetes y 6 se clasificaron como micelios estériles (tabla 2). También se aislaron 21 cepas de levaduras que no se incluyeron en este artículo. La mayor parte de los géneros, 29 de 36 (80,55%), fueron mitospóricos, y solo 7 (19,45%) produjeron meiosporas. El 55,55% de los géneros (20/36) correspondían a hongos dematiáceos. En otoño se aislaron 60 especies; en primavera, 47. Las especies que solo aparecieron en otoño fueron 24, y 11 lo hicieron solo en primavera (tabla 2).
Géneros y especies de hongos aislados mediante la técnica de las diluciones
| Taxa fúngicos | Otoño | Primavera | Total | Frecuencias (%) |
|---|---|---|---|---|
| Acrophialophora fusispora | 1 | 1 | 0,36 | |
| Alternaria alternata complex | 1 | 1 | 2 | 0,72 |
| Alternaria alternariae | 1 | 1 | 0,36 | |
| Alternaria atra | 1 | 1 | 0,36 | |
| Aspergillus flavus | 3 | 3 | 1,08 | |
| Aspergillus japonicus | 1 | 2 | 3 | 1,08 |
| Aspergillus niveus | 4 | 4 | 1,44 | |
| Aspergillus ochraceus | 2 | 2 | 0,72 | |
| Aspergillus parasiticus | 1 | 1 | 0,36 | |
| Aspergillus penicilloides | 1 | 1 | 2 | 0,72 |
| Aspergillus sección Fumigati | 2 | 2 | 4 | 1,44 |
| Aspergillus sección Nigri | 8 | 9 | 17 | 6,13 |
| Aspergillus sección Terrei | 4 | 11 | 15 | 5,41 |
| Aspergillus sydowii | 5 | 5 | 1,80 | |
| Aspergillus versicolor | 4 | 2 | 6 | 2,16 |
| Chaetomium bostrychodes | 2 | 2 | 4 | 1,44 |
| Chaetomium cupreum | 1 | 1 | 2 | 0,72 |
| Chaetomium cymbiforme | 1 | 1 | 0,36 | |
| Chaetomium globosum | 3 | 1 | 4 | 1,44 |
| Cladosporium cladosporioides | 7 | 5 | 12 | 4,33 |
| Cladosporium oxysporum | 1 | 1 | 0,36 | |
| Clonostachys rosea | 1 | 1 | 0,36 | |
| Corynascus sp. | 1 | 1 | 0,36 | |
| Curvularia aeria | 3 | 3 | 1,08 | |
| Curvularia australiensis | 2 | 1 | 3 | 1,08 |
| Curvularia clavata | 8 | 2 | 10 | 3,61 |
| Curvularia lunata | 7 | 2 | 9 | 3,24 |
| Curvularia pallescens | 2 | 1 | 3 | 1,08 |
| Dictyoarthrinium sacchari | 5 | 5 | 1,80 | |
| Eupenicillium javanicum y su anamorfo | 1 | 1 | 0,36 | |
| Exophiala brunnea | 1 | 1 | 0,36 | |
| Fusarium chlamydosporum | 2 | 1 | 3 | 1,08 |
| Fusarium oxysporum complex | 1 | 1 | 2 | 0,72 |
| Fusarium solani | 1 | 7 | 8 | 2,88 |
| Graphium eumorphum | 1 | 1 | 0,36 | |
| Melanospora var. microsporus | 5 | 5 | 1,80 | |
| Monodictys glauca | 1 | 1 | 0,36 | |
| Mortierella spp. | 1 | 1 | 2 | 0,72 |
| Mucor circinelloides | 1 | 1 | 0,36 | |
| Mucor racemosus complex | 2 | 2 | 4 | 1,44 |
| Mucor ramosissimus | 1 | 1 | 0,36 | |
| Myrothecium roridum | 2 | 2 | 4 | 1,44 |
| Neoscytalidium hyalinum | 6 | 3 | 9 | 3,25 |
| Penicillium aspergilloides | 1 | 1 | 0,36 | |
| Penicillium glabrum | 5 | 3 | 8 | 2,88 |
| Penicillium pinophilum | 5 | 7 | 12 | 4,33 |
| Penicillium olsonii | 1 | 1 | 0,36 | |
| Penicillium oxalicum | 2 | 1 | 3 | 1,08 |
| Penicillium sclerotiorum | 1 | 1 | 0,36 | |
| Penicillium spinulosum | 2 | 2 | 0,72 | |
| Penicillium subgénero Biverticillium | 2 | 1 | 3 | 1,08 |
| Penicillium variabile | 3 | 1 | 4 | 1,44 |
| Penicillium verrucosum | 1 | 1 | 0,36 | |
| Phaeomoniella sp. | 1 | 1 | 1,08 | |
| Pithomyces terricola | 2 | 1 | 3 | 0,36 |
| Phoma herbarum | 7 | 5 | 12 | 4,33 |
| Purpureocillium lilacinum | 1 | 1 | 0,36 | |
| Rhinocladiella spinifera | 1 | 2 | 3 | 1,08 |
| Rhizopus microsporus | 2 | 2 | 0,72 | |
| Rhizopus stolonifer | 1 | 1 | 2 | 0,72 |
| Sarocladium strictum | 2 | 3 | 5 | 1,81 |
| Scedosporium apiospermum | 1 | 1 | 0,36 | |
| Talaromyces flavus | 6 | 6 | 12 | 4,33 |
| Thielavia hyalocarpa | 1 | 1 | 0,36 | |
| Thielavia terricola | 1 | 1 | 2 | 0,72 |
| Trichoderma harzianum | 2 | 2 | 0,72 | |
| Trichoderma saturnisporum | 1 | 1 | 2 | 0,72 |
| Trichoderma sección Longibrachiatum | 2 | 2 | 0,72 | |
| Trichoderma viride | 5 | 1 | 6 | 2,16 |
| Veronaea carlinae | 5 | 5 | 1,80 | |
| Zopfiella spp. | 2 | 1 | 3 | 1,08 |
| Coelomycetes | 2 | 2 | 0,72 | |
| Micelio estéril | 3 | 3 | 6 | 2,16 |
| Total | 161 | 117 | 278 | 100 |
El índice de Shannon se estimó sobre el total de las cepas aisladas (278). La diversidad general según este índice fue de 3,9. En otoño (3,9) fue un poco más alta que en primavera (3,5) (tabla 2).
El género más frecuente fue Aspergillus, con la misma frecuencia en las dos estaciones, y las especies más representadas Aspergillus sección Nigri y Aspergillus sección Terrei.
DiscusiónEn este trabajo se eligió realizar el muestreo en las estaciones de otoño y primavera porque corresponden a los períodos más y menos lluviosos de la región, respectivamente. En otoño se obtuvo mayor diversidad que en primavera con las dos técnicas usadas. Este hecho concuerda con lo registrado en estudios de aire exterior de las ciudades de Corrientes y de Resistencia (Argentina)20, lo que recuerda que las grandes diferencias metodológicas dificultan la comparación de resultados.
En el área estudiada se realizó previamente un trabajo similar al presente que arrojó datos muy diferentes a los que presentamos30. Dicho trabajo fue anterior al funcionamiento de la represa hidroeléctrica Yaciretá, cuyo dique de contención está a 234km de la ciudad de Corrientes. Esta represa produjo importantes consecuencias ecológicas, entre ellas el anegamiento de un bioma prácticamente único, que condujo a la extinción de numerosas especies endémicas, y la alteración de los pulsos naturales del río Paraná. Asimismo, como todas las grandes represas, contribuye a aumentar el calentamiento global, ya que la descomposición de la materia vegetal que genera en los territorios inundados produce gases que incrementan el efecto invernadero6.
Técnica del anzueloLos hongos queratinofílico/líticos se asocian con las actividades humanas o la presencia de animales, es decir, se hallan en áreas en las cuales hay un aporte constante de queratina45. Esta condición se cumple ampliamente en los parques estudiados y podría ser la razón por la que la frecuencia de hongos queratinofílico/líticos encontrada es más alta que la hallada en estudios previos en otras ciudades argentinas y en varias localidades de la provincia del Chaco23,30–32.
De las especies halladas, 13 se definen como queratinolíticas: C. indicum, C. keratinophilum, M. canis, Microsporum gypseum complex, Arthroderma gypsea, Myceliophthora vellerea, Aphanoascus fulvescens, Aspergillus sección Terrei, Curvularia lunata, F. oxysporum, P. lilacinum, Cladosporium cladosporioides y Talaromyces purpurogenus1,2,18,19,45.
La preponderancia de las especies de Chrysosporium es similar a la hallada en otros estudios de este tipo, ya que estas especies son cosmopolitas y se adaptan muy bien al clima caluroso3,15. En el presente se acepta su posible potencial patógeno3,44. Chrysosporium fue el género más frecuente en este estudio, y las dos especies fueron aisladas de los areneros.
M. canis es un dermatofito zoófilo que excepcionalmente ha sido aislado en suelos. Parece que su aislamiento solo está documentado en el suelo de un parque de Milán y en el jardín de un hospital en Roma44. Las tiñas producidas por esta especie son de carácter zoonótico y tienen distribución mundial. En nuestro caso, posiblemente las condiciones ambientales y la riqueza en queratina del suelo de los parques hayan favorecido la permanencia de los propágulos de este hongo.
M. gypseum complex tiene su hábitat natural en el suelo y es reconocido como patógeno humano y animal8. Su porcentaje en este estudio es bajo respecto al conocido para otras ciudades argentinas30,32, pero se aisló de los areneros, que constituirían una fuente de infección para los niños susceptibles.
P. lilacinum fue una de las especies más aisladas en este estudio. Esta especie es fuertemente proteolítica y es responsable de micosis superficiales y sistémicas en pacientes inmunocomprometidos8,11.
C. lunata es un conocido patógeno de plantas. Actualmente también es destacado como agente de infecciones cutáneas, de córnea, del aparato respiratorio y del sistema nervioso central en personas inmunocompetentes8,9,34.
Técnica de las dilucionesAl igual que en otros estudios realizados en la zona, la cantidad de hongos filamentosos encontrada en nuestro trabajo fue mayor en otoño que en primavera30–32.
Más de la mitad de los géneros aislados fueron hongos dematiáceos. La presencia de melanina, que caracteriza a estos hongos, les confiere mayor resistencia a las radiaciones ultravioletas, lo que les permite subsistir donde la radiación solar es alta, como en el área estudiada40.
El orden Eurotiales y sus anamorfos se encuentran entre los hongos de mayor dispersión, siendo la familia Trichocomaceae la más frecuente en muchos ambientes28. En este trabajo esta se presentó con mayor diversidad, principalmente con los géneros Aspergillus y Penicillium. Los integrantes del género Aspergillus son de gran interés por su capacidad fermentadora y por su impacto negativo sobre la contaminación de productos agrícolas, así como por su patogenicidad y toxicidad en mamíferos5,27. Las especies del género Penicillium son habitualmente aisladas como contaminantes en todo tipo de sustratos. Su papel es más relevante como agentes productores de micotoxinas que como patógenos humanos8.
El orden Sordariales estuvo fundamentalmente representado en nuestro estudio por la familia Chaetomiaceae y el género Chaetomium, usualmente asociado a sustratos que contienen celulosa, como papel, tejidos, semillas, plumas y madera38. Sin embargo, hay referencias de su oportunismo tanto en pacientes inmunocomprometidos, en los que provocan trastornos sistémicos, como en personas sanas, en los que aparecen lesiones de piel y uñas4,14.
Del orden Hypocreales, el género Fusarium es conocido por su capacidad oportunista de producir afecciones en el ser humano y los animales (principalmente F. solani y F. oxysporum). Actualmente es considerado un patógeno emergente debido a los bajos y muy variables perfiles de sensibilidad a los antifúngicos que caracterizan a sus diferentes especies35. Por otro lado, se lo reconoce como un importante productor de micotoxinas sobre productos alimenticios de diverso origen37.
ConclusiónEstos resultados mostraron que los suelos de la ciudad de Corrientes presentan condiciones edáficas y climáticas favorables para la supervivencia de geohongos patógenos para el hombre y los animales. El hallazgo de M. canis en suelo demostró, una vez más, el movimiento de los Onygenales en sus hábitats originales y que siguen conservando intactas las capacidades de sobrevivir y degradar la queratina.
Conflicto de interesesLos autores declaran no tener conflicto de intereses.
Los autores agradecen a la Secretaría General de Ciencia y Técnica de la Universidad Nacional del Nordeste el apoyo económico, y a la Sra. Liliana Alegre, la asistencia en la preparación de materiales.