El tratamiento de las micosis invasoras ha evolucionado en los últimos años con la aparición de nuevos antifúngicos. Recientemente se ha aprobado un nuevo azol, isavuconazol, con un amplio espectro de acción. Esta revisión analiza el papel que puede desarrollar el isavuconazol en cada una de las micosis invasoras más importantes: candidiasis, aspergilosis, mucormicosis, infección por otros hongos filamentosos e infección por hongos dimorfos.
The treatment of invasive fungal infections has deeply evolved in recent years with the inclusion of new antifungals to the therapeutic treatment arsenal. A new azole, isavuconazole, has been recently approved. This review focuses on the role of isavuconazole for treating the most important invasive fungal infections: invasive candidiasis, aspergillosis, mucormicosis, infections caused by other filamentous fungi and those caused by dimorphic fungi.
Las micosis invasoras son una causa importante de morbimortalidad en pacientes inmunodeprimidos13,21,46. En los últimos años ha aumentado la población susceptible de padecer estas infecciones debido a una mayor supervivencia de los pacientes con neoplasias hematológicas, trasplante de progenitores o trasplante de órgano sólido, y a la aparición de nuevos fármacos inmunosupresores, entre otros factores8,16,44. La mejora en las técnicas diagnósticas y en el conocimiento de la fisiopatogenia de las micosis invasoras también ha permitido reconocer nuevas formas clínicas de infección fúngica10,36. Las características del huésped, su comorbilidad, los diferentes fármacos inmunosupresores, las profilaxis recibidas o las intervenciones quirúrgicas condicionan la epidemiología y las características de las micosis invasoras. Debemos tener en cuenta todos esos factores cuando planteamos una estrategia de diagnóstico y de tratamiento.
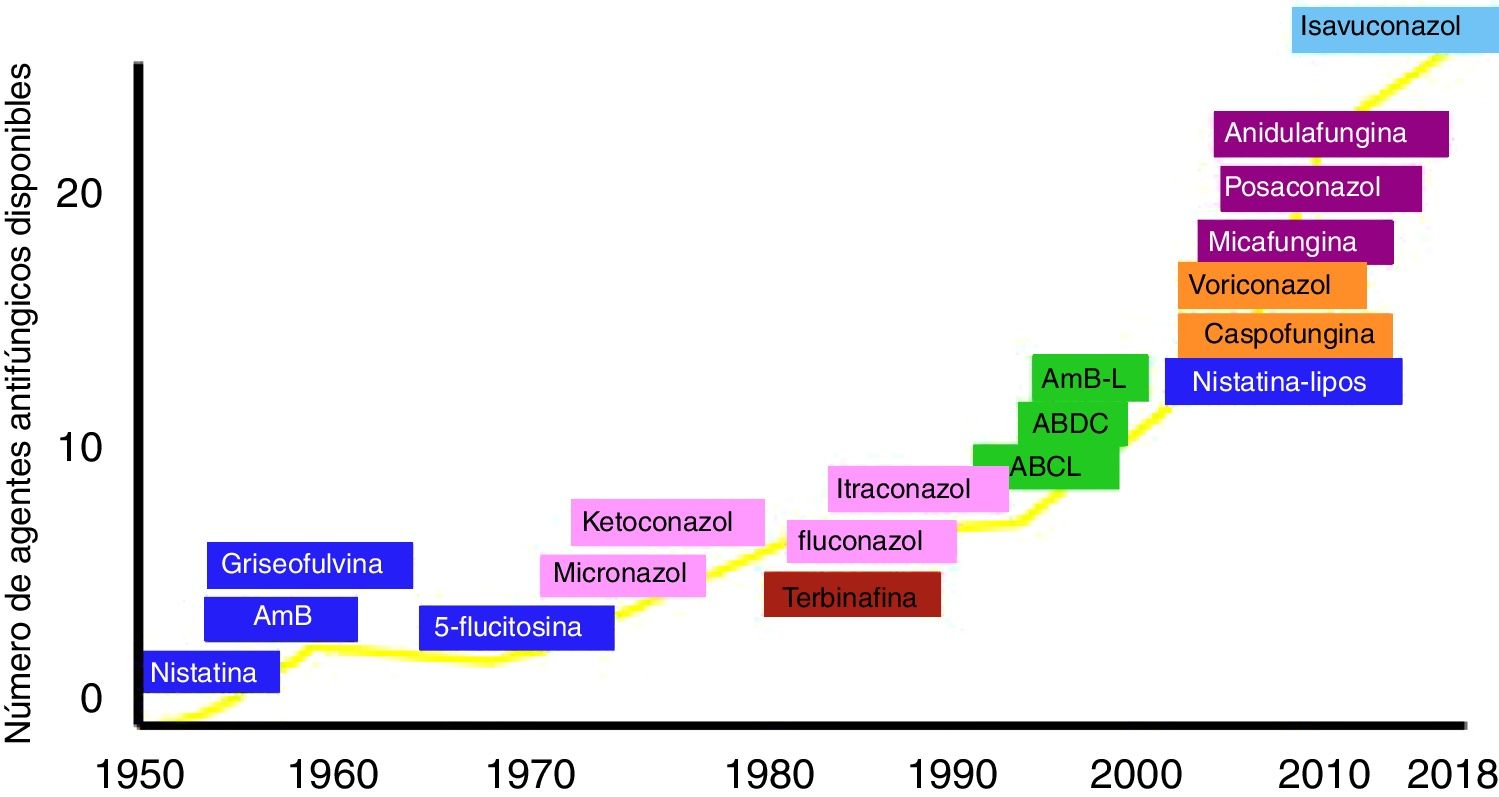
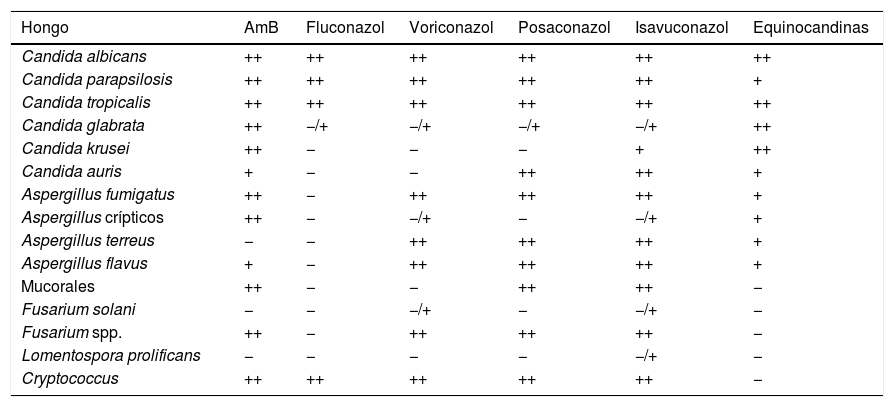
En los últimos años las opciones terapéuticas para el tratamiento de las micosis invasoras han aumentado de manera importante (fig. 1). En los años ochenta solo se disponía de la anfotericinaB, la 5-fluorocitosina o el fluconazol para tratar las micosis sistémicas más relevantes. Con la llegada del sigloxxi el arsenal terapéutico incorporó no solo nuevos fármacos con mejores perfiles de seguridad o mayor espectro (voriconazol, posaconazol), sino también nuevas familias que actuaban en otras dianas de acción, como las equinocandinas. La tabla 1 resume el espectro de acción de las tres grandes familias de antifúngicos utilizadas en la actualidad para el tratamiento de las micosis invasoras más frecuentes.
Sensibilidad in vitro de las especies de hongos a los principales antifúngicos
| Hongo | AmB | Fluconazol | Voriconazol | Posaconazol | Isavuconazol | Equinocandinas |
|---|---|---|---|---|---|---|
| Candida albicans | ++ | ++ | ++ | ++ | ++ | ++ |
| Candida parapsilosis | ++ | ++ | ++ | ++ | ++ | + |
| Candida tropicalis | ++ | ++ | ++ | ++ | ++ | ++ |
| Candida glabrata | ++ | −/+ | −/+ | −/+ | −/+ | ++ |
| Candida krusei | ++ | − | − | − | + | ++ |
| Candida auris | + | − | − | ++ | ++ | + |
| Aspergillus fumigatus | ++ | − | ++ | ++ | ++ | + |
| Aspergillus crípticos | ++ | − | −/+ | − | −/+ | + |
| Aspergillus terreus | − | − | ++ | ++ | ++ | + |
| Aspergillus flavus | + | − | ++ | ++ | ++ | + |
| Mucorales | ++ | − | − | ++ | ++ | − |
| Fusarium solani | − | − | −/+ | − | −/+ | − |
| Fusarium spp. | ++ | − | ++ | ++ | ++ | − |
| Lomentospora prolificans | − | − | − | − | −/+ | − |
| Cryptococcus | ++ | ++ | ++ | ++ | ++ | − |
Recientemente se ha aprobado un nuevo antifúngico de la familia de los azoles, el isavuconazol, en el que se centra la revisión actual. En esta revisión vamos a discutir las opciones terapéuticas actuales de las micosis invasoras más comunes: la candidiasis, la aspergilosis invasora, la infección por otros hongos filamentosos y la infección por hongos dimorfos, y expondremos el papel que puede desarrollar el isavuconazol en cada una de ellas.
CandidiasisLa candidiasis invasora es la micosis invasora más frecuente. Su incidencia ha disminuido en algunas poblaciones de manera destacada como consecuencia de las profilaxis antifúngicas adoptadas25, mientras que en otras poblaciones se ha descrito un aumento en los últimos años3,32. Por razones que no están bien establecidas, la epidemiología de la candidiasis ha cambiado en los últimos años. Aunque Candida albicans sigue siendo la especie aislada con mayor frecuencia en la gran mayoría de las series, en el norte de Europa y en nuestro país se ha documentado un aumento de especies de Candida resistentes a los azoles, en especial Candida glabrata, en los últimos años7,37. Recientemente se ha descrito la emergencia de una nueva especie dentro del género, Candida auris, que puede ser resistente a múltiples familias de antifúngicos y que presenta unas características clínicas especiales, con alta virulencia, recidiva de las infecciones y elevada mortalidad22,40.
Estos cambios epidemiológicos impactan de manera importante en el tratamiento empírico recomendado ante la sospecha de una candidiasis. El uso de equinocandinas en este tratamiento empírico ha sido defendido por varios autores por motivos tan diversos como su eficacia, el poder fungicida, las escasas resistencias, el perfil de seguridad y las pocas interacciones farmacológicas31,33. Sin embargo, otros estudios que han comparado la eficacia de las equinocandinas y los azoles en el tratamiento empírico de las candidemias no han arrojado diferencias en el pronóstico de los pacientes tratados con unos u otros antifúngicos23. En pacientes con shock séptico las equinocandinas podrían tener un efecto beneficioso19.
Recientemente, Cuervo et al.9 realizaron un estudio que tenía como finalidad crear un algoritmo con puntuación que permitiera, en la cama del paciente, predecir qué pacientes con aislamiento de levadura tendrían una infección causada por una cepa resistente a los azoles. Los pacientes que no cumplían las siguientes características tenían un riesgo bajo de sufrir una infección causada por una cepa resistente: 1)un mínimo de 3días de antifúngico previo; 2)ser receptores de un trasplante, y 3)estar hospitalizados en una área con más de un 20% de aislamientos de Candida resistentes a fluconazol en las candidemias del año previo. En estos pacientes, en especial si no presentan shock séptico, se podría plantear el uso del fluconazol como tratamiento empírico.
Otros puntos clave en el manejo de los pacientes con candidemia son la retirada del catéter venoso, la realización de hemocultivos de control, la observación de fondo de ojo (al séptimo día del aislamiento de Candida en el hemocultivo) o la realización de un ecocardiograma en pacientes con cardiopatía previa o candidemia persistente (para descartar infecciones complicadas), y la adecuación de la duración del tratamiento antifúngico según la complejidad de la infección.
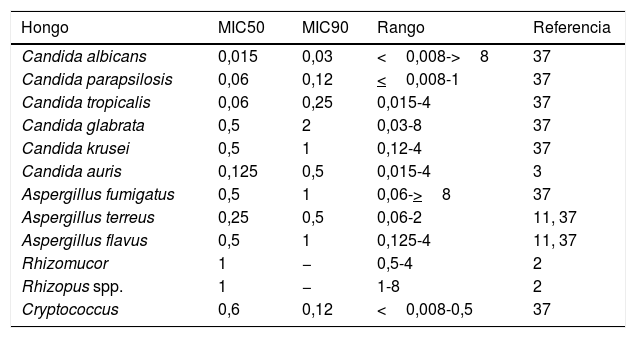
Papel del isavuconazol en la candidiasisLa experiencia clínica y los datos publicados en la literatura sobre el uso del isavuconazol en la candidiasis invasora son escasos. La tabla 2 detalla la actividad in vitro del isavuconazol frente a los hongos más frecuentes2,11,38. La sensibilidad in vitro y los mecanismos de resistencia de la mayoría de especies de Candida al isavuconazol son similares a aquellos frente al resto de los azoles, con ligeras variaciones dependiendo de la especie42. Por ejemplo, la expresión de MDR1 y FLU1, dos mecanismos de resistencia al fluconazol y al voriconazol en Candida, ligados al transportador MFS, no altera la sensibilidad al isavuconazol. Su actividad también se ve menos afectada por las mutaciones en ERG11 en comparación con el fluconazol o el voriconazol.
Actividad in vitro del isavuconazol frente a los hongos más frecuentes
| Hongo | MIC50 | MIC90 | Rango | Referencia |
|---|---|---|---|---|
| Candida albicans | 0,015 | 0,03 | <0,008->8 | 37 |
| Candida parapsilosis | 0,06 | 0,12 | <0,008-1 | 37 |
| Candida tropicalis | 0,06 | 0,25 | 0,015-4 | 37 |
| Candida glabrata | 0,5 | 2 | 0,03-8 | 37 |
| Candida krusei | 0,5 | 1 | 0,12-4 | 37 |
| Candida auris | 0,125 | 0,5 | 0,015-4 | 3 |
| Aspergillus fumigatus | 0,5 | 1 | 0,06->8 | 37 |
| Aspergillus terreus | 0,25 | 0,5 | 0,06-2 | 11, 37 |
| Aspergillus flavus | 0,5 | 1 | 0,125-4 | 11, 37 |
| Rhizomucor | 1 | − | 0,5-4 | 2 |
| Rhizopus spp. | 1 | − | 1-8 | 2 |
| Cryptococcus | 0,6 | 0,12 | <0,008-0,5 | 37 |
De los pocos datos clínicos descritos hasta el momento para el tratamiento de la candidiasis invasora con el isavuconazol destacan dos estudios. En el primero, un estudio aleatorizado y doble ciego, se evaluó el uso del isavuconazol en diferentes dosis frente al fluconazol oral para el tratamiento de la candidiasis esofágica en ocho hospitales de Sudáfrica47. La respuesta, según lo observado en una endoscopia, fue similar en todos los grupos de tratamiento. El segundo estudio4, aleatorizado y doble ciego, no demostró que el isavuconazol (200mg/8h, 6dosis, seguido de 200mg/24h) fuera equivalente a la caspofungina (70mg/24h) en el tratamiento de la candidemia y la candidiasis invasora (el isavuconazol no tiene indicación en su ficha técnica para el tratamiento de la candidiasis)20.
AspergilosisLa incidencia de la aspergilosis invasora ha aumentado en algunas poblaciones en los últimos años8,36. Las formas clínicas de aspergilosis pueden diferir mucho según el huésped y están muy condicionadas por la respuesta inmunitaria que el paciente muestra frente a la infección14. Así, en los pacientes neutropénicos las formas angioinvasoras son frecuentes y la inflamación producida en el pulmón es habitualmente escasa. Como consecuencia, la histología de estas lesiones suele mostrar una gran diseminación de hifas que invaden el territorio vascular, microtrombosis, infartos y zonas avasculares de difícil acceso para los antifúngicos. Estas formas se visualizan como el característico signo del halo invertido en la tomografía computarizada de pulmón. Por el contrario, en los pacientes sin neutropenia la aspergilosis se localiza con mayor frecuencia en los alvéolos pulmonares; en ellos, unas pocas esporas inhaladas son capaces de transformarse en hifas, lo que conlleva una gran inflamación con los neutrófilos como protagonistas. En esta situación clínica las imágenes habituales de la tomografía computarizada pulmonar son condensaciones, infiltrados alveolares o cavitaciones múltiples.
La mayoría de las infecciones por Aspergillus son causadas por la especie Aspergillus fumigatus. Esto es debido al tamaño de sus esporas y a sus características bioquímicas de crecimiento, que se adecuan a las condiciones habituales15. En un estudio realizado recientemente en nuestro país por Alastruey-Izquierdo et al.1, el 100% de las cepas de A.fumigatus aisladas en muestras clínicas de tejidos, sangre o aparato respiratorio, conservan la sensibilidad a los azoles. En Alemania y Holanda se ha descrito un aumento de la resistencia de A.fumigatus a los azoles que afecta hasta al 10% de los pacientes. Este hecho se ha relacionado con la inhalación de esporas que ya son resistentes a los azoles al haber adquirido esta resistencia con la mutación TR/L98H, causada probablemente por el uso de pesticidas con acción antifúngica en la agricultura27. En Manchester se han reportado más de un 20% de cepas de A.fumigatus resistentes a los azoles en pacientes con enfermedades pulmonares crónicas que han adquirido dicha resistencia como consecuencia de diferentes mutaciones después de ser tratados con azoles durante largos períodos de tiempo6. Las especies crípticas de Aspergillus, aquellas especies clásicamente clasificadas dentro de las especies Aspergillus fumigatus complex pero diferenciadas actualmente gracias a las nuevas técnicas moleculares, representan el 12% de los aislamientos en el estudio español1. Estas especies son frecuentemente resistentes a los azoles (80%), pero su patogenicidad está aún por determinarse. Otras especies de Aspergillus que pueden causar infección con cierta frecuencia son Aspergillus terreus, con frecuencia resistente a la anfotericinaB, y Aspergillus niger.
El tratamiento antifúngico debe administrarse precozmente cuando se sospeche de una infección causada por Aspergillus. Las guías más recientes de tratamiento de la aspergilosis invasora, las publicadas por el grupo de estudio de micología médica (GEMICOMED) de la Sociedad Española de Enfermedades Infecciosas (SEIMC)12 y las publicadas por la European Society of Clinical Microbiology and Infectious Diseases (ESCMID)45 describen como tratamiento de primera línea el isavuconazol (dosis de carga de 200mg/8h, vía oral, las primeras 48h, seguido de 200mg/24h vía oral) o el voriconazol (dosis de carga de 6mg/kg, vía intravenosa, cada 12h, o 400mg vía oral cada 12h las primeras 48h; posteriormente 4mg/kg vía intravenosa cada 12h o 300mg vía oral cada 12h). Cuando el uso de estos antifúngicos pueda ser problemático, se puede considerar la anfotericinaB liposomal.
Papel del isavuconazol en la aspergilosisLa tabla 2 detalla la actividad in vitro del isavuconazol frente a los hongos filamentosos más frecuentes. El isavuconazol demostró ser igual de eficaz que el voriconazol en el tratamiento de las micosis invasoras causadas por hongos filamentosos, según el estudio SECURE24, aleatorizado y doble ciego, que incluyó a 527 pacientes. El 80% de los pacientes presentaban como antecedente una enfermedad hematológica. La aspergilosis invasora fue la micosis más frecuentemente diagnosticada en el estudio, y destaca que el 35% de los pacientes fueron diagnosticados mediante la detección de galactomanano. Los pacientes que presentaban hepatopatía o trastorno hepatobiliar, y los que habían recibido profilaxis con azoles, fueron excluidos del estudio. La mortalidad global de los pacientes a los 42días del diagnóstico fue del 18,6% para los pacientes tratados con isavuconazol y del 20,2% para los tratados con voriconazol. La respuesta clínica, micológica y radiológica también fue similar entre los grupos. Sin embargo, los pacientes tratados con isavuconazol presentaron con menor frecuencia trastornos hepatobiliares, alteraciones visuales y efectos adversos cutáneos. Los efectos adversos atribuidos al tratamiento antifúngico también fueron menores (42% vs. 60%; p<0,001), así como la necesidad de retirar el tratamiento (8% vs. 14%). Un estudio farmacoeconómico con pacientes del estudio SECURE publicado posteriormente describió que los tratados con isavuconazol tuvieron una estancia hospitalaria media inferior, en especial aquellos con insuficiencia renal, con lo que el coste en recursos sanitarios fue menor18.
Un reciente estudio30 sobre el uso del isavuconazol en pacientes con micosis invasoras por hongos filamentosos que habían presentado intolerancia al voriconazol o al posaconazol (elevación de transaminasas, neurotoxicidad, cardiotoxicidad o efectos adversos cutáneos) concluye que el cambio a isavuconazol revirtió esos efectos adversos en el 91% de los pacientes en una media de 13días. Ningún paciente presentó efectos adversos que obligaran a retirar el isavuconazol. La mortalidad de los pacientes al final del tratamiento fue del 18%.
El manejo de los pacientes con micosis invasoras que tienen alteración renal y precisan tratamiento antifúngico intravenoso ha sido de extrema dificultad hasta el momento. La anfotericinaB es un fármaco que con frecuencia presenta nefrotoxicidad y algunos autores habían cuestionado el uso del voriconazol intravenoso debido a la potencial acumulación de ciclodextrina28. La formulación intravenosa del isavuconazol no contiene ciclodextrina, por lo que este fármaco se convierte probablemente en el antifúngico de elección en la población con insuficiencia renal que precisa tratamiento antifúngico intravenoso.
Las concentraciones del voriconazol en el plasma presentan una gran variabilidad interpersonal, ya que pueden verse afectadas por diversos factores como el polimorfismo del citocromo P450 o el uso de diferentes fármacos. Tener unas concentraciones plasmáticas adecuadas puede mejorar el pronóstico y evitar la toxicidad34,35. Por ello está recomendado realizar una monitorización plasmática de los valores cuando se utilice este fármaco12. Sin embargo, en la vida real esta monitorización es difícil de llevar a cabo, ya que la mayoría de centros no disponen de las técnicas necesarias y el envío de las muestras a centros de referencia suele conllevar retrasos en la información que hacen poco útil su uso en la práctica clínica. La frecuencia óptima de monitorización de las concentraciones de voriconazol no está bien establecida, pero se recomienda realizar determinaciones cada semana hasta llegar a una estabilidad de la dosis y cada vez que se cambie la vía de administración, se varíe la dosis de antifúngico, se introduzca alguna alteración en tratamientos concomitantes que puedan interaccionar o si hay cambios clínicos en el paciente. El coste de una determinación de voriconazol en España suele oscilar entre los 45 y los 80euros. La farmacocinética lineal, estable y predecible del isavuconazol hace que hoy en día no se considere necesario realizar una monitorización de los valores plasmáticos del fármaco para su seguimiento clínico.
Los azoles en general, y el itraconazol y el voriconazol en particular, presentan importantes interacciones con otros fármacos. El isavuconazol, en cambio, tiene un perfil de interacción bajo con otros fármacos17. A diferencia del voriconazol, su uso no está contraindicado en los pacientes con sirolimus y la alteración en la concentración de tacrolimus es mucho menor, aunque se recomienda una reducción inicial de la dosis del inmunosupresor. El uso concomitante del isavuconazol y el ketoconazol está contraindicado, mientras que la asociación del isavuconazol con la rifampicina o la carbamazepina debe valorarse cautelosamente. El isavuconazol no se ve afectado por inhibidores del pH gástrico. La mayoría de los azoles alargan el intervalo QT, con lo que su uso concomitante con otros fármacos que alargan el intervalo QT es controvertido (quinolonas, macrólidos, antidepresivos, dasatinib, diuréticos, entre otros). El isavuconazol es el único azol que disminuye el intervalo QT.
El voriconazol y el isavuconazol presentan algunas diferencias farmacocinéticas y farmacodinámicas que pueden ser relevantes en su acción frente a las micosis invasoras. La unión a proteínas (50 y 98%, respectivamente) y su volumen de distribución en los tejidos (75 y 450l, respectivamente) es muy dispar41. Teniendo en cuenta que el parámetro de eficacia de los azoles depende del AUC/CMI que se consiga, la baja unión a proteínas del voriconazol podría conceptualmente hacernos pensar que la concentración de fármaco libre en sangre consigue una mejor AUC/CMI en comparación con el isavuconazol. Sin embargo, en el tejido pulmonar, donde suele localizarse la infección causada por los hongos filamentosos, o en otros tejidos, el isavuconazol conseguiría mejores valores de AUC/CMI en comparación con el voriconazol. Este hecho podría ser de especial relevancia en pacientes con infecciones diseminadas, o en aquellos sin neutropenia, donde las formas de aspergilosis invasora se localizan con frecuencia en el pulmón. El isavuconazol también puede ser especialmente relevante en el tratamiento de las formas clínicas que se diagnostican en pacientes de UCI, en los pacientes con enfermedad pulmonar crónica y con formas más crónicas de aspergilosis. Aunque aún no se han publicado datos de eficacia en esta población, sí se ha descrito que los pacientes con aspergilosis pulmonar crónica son capaces de mantener concentraciones estables de isavuconazol y no presentar toxicidad a lo largo de meses de tratamiento39.
La tabla 3 resume las ventajas del uso del isavuconazol en comparación con el voriconazol en el tratamiento de las micosis invasoras.
Ventajas potenciales del uso del isavuconazol en los pacientes con micosis invasoras en comparación con el voriconazol
| Amplio espectro |
| No inferioridad en la eficacia del tratamiento de las micosis invasoras por hongos filamentosos |
| Farmacocinética lineal y predecible |
| No influenciable por la dieta, polimorfismos genéticos, antiácidos |
| Poca variabilidad interpersonal |
| Muy alta distribución al pulmón |
| Biodisponibilidad muy elevada |
| No necesita monitorización de la concentración plasmática |
| Poca interacción con otros fármacos |
| Menos efectos secundarios |
| Se puede utilizar en insuficiencia renal, diálisis y hemodiálisis |
Algunos estudios demuestran el aumento de las infecciones fúngicas causadas por hongos filamentosos no pertenecientes al género Aspergillus5,29. La más frecuente de estas infecciones es la mucormicosis. La tabla 2 muestra la actividad in vitro del isavuconazol frente a dos de las especies más frecuentes en las infecciones por mucorales.
Papel del isavuconazol en la mucormicosisEl estudio SECURE24 incluye 11 pacientes (6 y 5 por grupo de estudio, respectivamente) con micosis invasoras por hongos filamentosos diferentes de Aspergillus. Probablemente debido al bajo número de pacientes no se detalla información específica de este subgrupo de pacientes. Más recientemente se ha publicado el estudio VITAL26, que describe la eficacia y la seguridad del isavuconazol en pacientes con mucormicosis en un estudio abierto de una sola rama. Treinta y siete pacientes con mucormicosis recibieron 200mg/8h como dosis de carga las primeras 48h, seguido de 200mg/24h de isavuconazol. El 11% presentaron una respuesta parcial, el 43% permanecieron estables, el 3% sufrieron la progresión de la mucormicosis y el 35% fallecieron. En un 8% de pacientes la respuesta no pudo ser evaluada.
En un análisis posterior se comparó la eficacia de este tratamiento en un estudio de casos-control. El emparejamiento estaba basado en tres covariables dicotómicas: enfermedad grave (definida como SNC o afectación diseminada), malignidad hematológica y tratamiento quirúrgico dentro de los 7días de inicio del tratamiento antifúngico. La información de los pacientes controles se recoge del registro FungiScope, Registro Global de Infecciones Fúngicas Emergentes, que mantiene en una web a disposición de todo el mundo una base de datos anónima de infecciones fúngicas poco frecuentes. Treinta y tres controles son comparados con 21 pacientes del estudio VITAL. La mayor parte de los controles fueron tratados inicialmente con anfotericinaB (una media de 18días) y posteriormente con posaconazol. La mortalidad global a los 42días fue del 33% en el grupo del isavuconazol y del 39% en los controles. En este estudio no hay comparación de los efectos adversos atribuibles al uso de los diferentes antifúngicos. Con la información disponible hasta el momento puede afirmarse que el isavuconazol es un antifúngico eficaz como para ser considerado una alternativa en el tratamiento de la mucormicosis.
Otras infecciones fúngicasEl isavuconazol tiene actividad frente a Cryptococcus y otros hongos dimórficos. El estudio VITAL43, estudio fase III, abierto, no aleatorizado de una sola rama, describió la eficacia y la seguridad del tratamiento y el pronóstico de 38 pacientes con Cryptococcus (n=9), Paracoccidioides (n=10), Coccidioides (n=9), Histoplasma (n=7) y Blastomyces (n=7). La media de días de tratamiento fue de 180. El 63% de los pacientes presentaron una respuesta favorable, lo que demuestra que el isavuconazol puede incorporarse a las opciones terapéuticas de estas micosis invasoras. Futuros estudios contribuirán a posicionar de manera correcta este fármaco en cada indicación.
ConclusionesEl isavuconazol es un nuevo azol cuyo principal papel es el tratamiento de la aspergilosis invasora y la mucormicosis, con una eficacia demostrada similar a los tratamientos de elección pero con menos efectos adversos e interacciones con otros fármacos. En el futuro es posible que el isavuconazol sea capaz de posicionarse en primera línea de tratamiento en pacientes con enfermedades crónicas pulmonares e infección fúngica. Por último, su acción frente a Cryptococcus y diferentes hongos dimórficos lo convierte en una alternativa terapéutica en estas infecciones.
FinanciaciónLa Dra. Carolina Garcia-Vidal ha recibido la beca INTENSIFICACIÓ del «Strategic plan for research and innovation in health-PERIS 2016-2020» y la beca del Ministerio de Sanidad y Consumo, Instituto de Salud CarlosIII [FIS PI15/00744].
Conflicto de interesesLa autora ha recibido honorarios por ponencias de Gilead Science, Merck Sharp and Dohme, Pfizer, Novartis Jannsen, y tiene una beca de Gilead Science.