Las recaídas son comunes en pacientes con vasculitis asociadas a ANCA (VAA), lo cual conlleva una carga significativa en morbimortalidad, impacto en calidad de vida, discapacidad y costo. No obstante, se cuenta con poca evidencia en población colombiana.
ObjetivoEstimar la supervivencia libre de recaída durante el primer año en pacientes con VAA en un centro especializado en enfermedades reumatológicas en Colombia y describir las características clínicas y serológicas en esta población.
Materiales y métodosEstudio de seguimiento retrospectivo a una cohorte basado en los registros médicos de pacientes mayores de 18años con diagnóstico confirmado de VAA por el reumatólogo tratante y que habían alcanzado la remisión. Se extrajo información sobre recaída de VAA y sobre las características clínicas, inmunoserológicas y relacionadas con el tratamiento farmacológico. Se estimó la función de supervivencia libre de recaída durante el primer año.
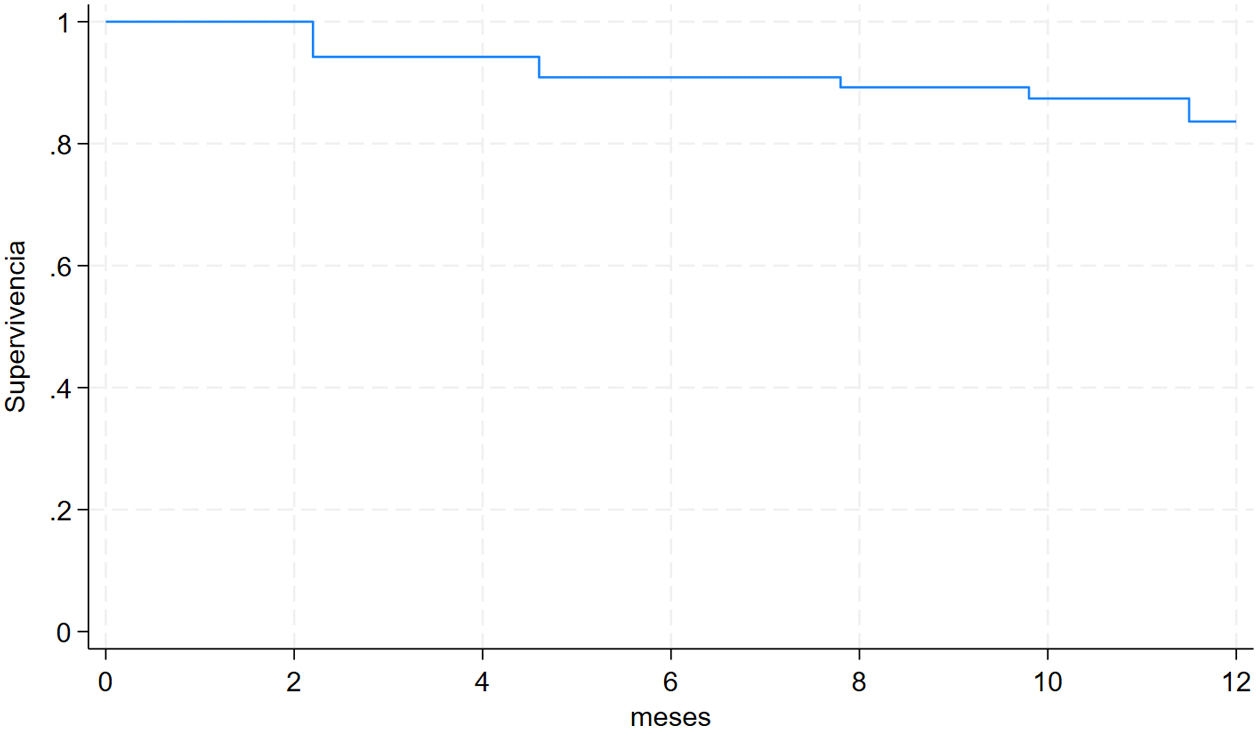
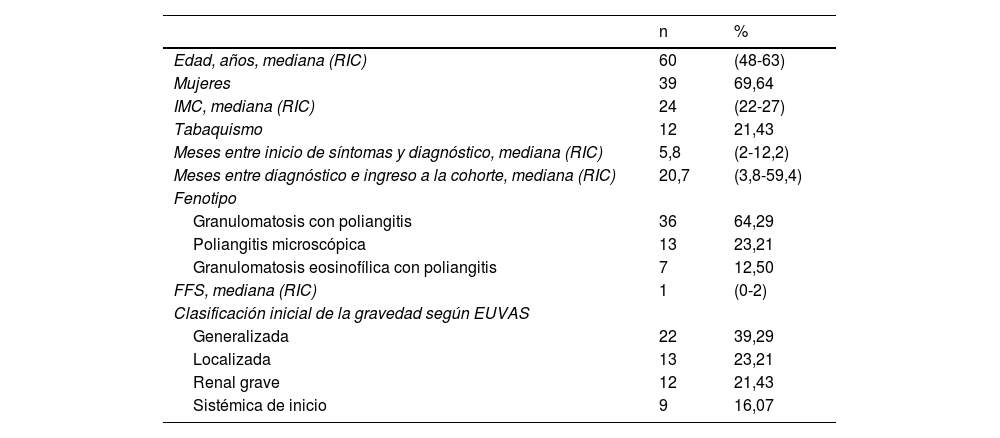
ResultadosSe incluyeron 56 pacientes, el 69,9% mujeres, con edad mediana de 60años (RIC=48-63). Según el fenotipo clínico, se clasificó el 64,3% como granulomatosis con poliangitis (GPA), el 23,2% como poliangitis microscópica (PAM) y el 12,5% como granulomatosis eosinofílica con poliangitis (GEPA). Según la clasificación del Grupo de Estudio de Vasculitis Europeo (EUVAS), el 39,3% debutaron con VAA generalizada, el 23,2% con VAA localizada, el 21,4% con VAA renal grave y el 16,1% con VAA sistémica. La mediana del Five Factor Score (FFS) fue de1 (RIC=0-2). La supervivencia acumulada libre de recaída al año fue del 82,2%.
ConclusionesLa supervivencia libre de recaída observada en esta cohorte fue similar a la reportada en estudios clínicos y registros de VAA.
Relapses are common in patients with ANCA-associated vasculitis (AAV), which results in a significant burden of morbidity, mortality, impact on quality of life, disability, and cost. However, evidence in the Colombian population is scarce.
ObjectiveThe objective of this study was to estimate the relapse-free survival during the first year and describe clinical and serological variables of patients with AAV in a specialized centre for rheumatic diseases in Colombia.
Materials and methodsA retrospective follow-up study was conducted on a cohort based on medical records of patients over 18years old with confirmed diagnosis of AAV by the treating rheumatologist and who had achieved remission. Information on AAV relapse and clinical, immunoserological, and treatment-related characteristics was extracted. The relapse-free survival function during the first year was estimated.
ResultsA total of 56 patients were included, 69.9% of whom were women, with a median age of 60 (IQR=48-63). According to the clinical phenotype, 64.3% were classified as granulomatosis with polyangiitis (GPA), 23.2% as microscopic polyangiitis (MPA), and 12.5% as eosinophilic granulomatosis with polyangiitis (EGPA). According to the European Vasculitis Study Group (EUVAS) classification, 39.3% had generalized AAV at debut, 23.2% had localized AAV, 21.4% had severe renal AAV, and 16.1% had systemic AAV. The median Five Factor Score (FFS) was1 (IQR=0-2). The cumulative relapse-free survival at one year was 82.2%.
ConclusionsThe relapse-free survival observed in this cohort was similar to other reports in clinical studies and AAV registries.
Las vasculitis asociadas a anticuerpos anticitoplasma de neutrófilos (ANCA) son enfermedades autoinmunes sistémicas caracterizadas por la inflamación de los vasos sanguíneos, lesión endotelial y daño tisular. Comprenden la granulomatosis con poliangitis (GPA), la poliangitis microscópica (PAM) y la granulomatosis eosinofílica con poliangitis (GEPA)1. Estas enfermedades afectan principalmente a los vasos de pequeño calibre del tracto respiratorio superior, los pulmones y los riñones, y se asocian con la presencia de anticuerpos específicos contra la mieloperoxidasa (MPO) y la proteinasa3 (PR3) presentes en los neutrófilos2.
La epidemiología de las vasculitis asociadas a ANCA (VAA) es heterogénea3. En Estados Unidos se estimó una incidencia anual de 3,3 casos por cada 100.000 habitantes entre 1995 y 2015, con una mayor incidencia en hombres y personas de mayor edad. En esta población, la prevalencia fue de 42,1 por cada 100.000 personas en el año 20154; en otros países se han reportado cifras más bajas. En un estudio realizado en Argentina se observaron incidencias de 0,9 y 1,4 por cada 100.000 personas-año para la GPA y la PAM, respectivamente. Asimismo, se encontró una prevalencia de 7,4 por cada 100.000 personas para la GPA y 5,2 por cada 100.000 personas para la PAM5. En pacientes con VAA la mortalidad es más alta durante el primer año y generalmente se asocia con infecciones o vasculitis activa6.
Las recaídas son comunes durante la evolución de las VAA, lo cual conlleva una carga significativa de morbilidad, impacto negativo en la calidad de vida y mayor riesgo de discapacidad y muerte7. Además, las recaídas en los pacientes generan costos adicionales para los sistemas de salud8. El tratamiento utilizado para prevenir estas recaídas no está exento de toxicidad, lo que a su vez puede ocasionar morbilidad en los pacientes. Por lo tanto, resulta fundamental identificar qué pacientes tienen un alto riesgo de recaída y focalizar los esfuerzos en su prevención9.
En Colombia, las VAA constituyen un grupo de enfermedades poco frecuentes de las cuales no se cuenta con suficiente información. Una revisión de literatura publicada en el 2009 logró recopilar datos sobre 857 vasculitis primarias, de las cuales el 20% eran VAA10. Por otra parte, un reporte de los pacientes atendidos en un periodo de 12años en un hospital universitario describió características clínicas, resultados y mortalidad hospitalaria en una serie de 106 VAA11. Sin embargo, no se han reportado estudios que caractericen las recaídas en nuestra población. El objetivo del presente estudio fue estimar la supervivencia libre de recaída durante el primer año y describir las variables clínicas y serológicas durante el seguimiento de una cohorte de pacientes con VAA en un centro especializado en enfermedades reumatológicas en Colombia.
MétodosEste reporte sigue las directrices para la notificación de estudios observacionales que recomienda la declaración Strobe12.
Diseño del estudio y contextoSe llevó a cabo un estudio de seguimiento retrospectivo a una cohorte, basado en los registros médicos de pacientes atendidos en el periodo 2014-2021 en Artmedica IPS, una institución ambulatoria especializada en reumatología con presencia en siete ciudades de Colombia. En el caso de los pacientes que al momento del ingreso a nuestra cohorte traían diagnósticos y conductas que se habían establecido en otra institución, esto fue documentado en la historia clínica institucional durante el primer encuentro clínico. El seguimiento se realizó hasta la ocurrencia de la recaída o censura administrativa al año de seguimiento.
ParticipantesSe incluyeron de manera consecutiva todos los pacientes mayores de 18años con diagnóstico confirmado de VAA por el reumatólogo tratante y que habían alcanzado remisión. Se excluyeron los pacientes cuyos registros en historia no eran compatibles con VAA según el criterio de un reumatólogo del grupo de investigación; aquellos con registros incompletos relacionados con la VAA; aquellos con VAA refractaria a la terapia de inducción, y aquellos que ya habían experimentado una recaída antes de su ingreso a la institución. Se consideró la primera recaída luego de la primera línea de terapia de inducción como el evento de interés por analizar, por lo que se excluyeron pacientes con recaídas previas y refractarios, teniendo en cuenta que estos subgrupos podrían tener un mayor riesgo de nuevos eventos y otros factores asociados con recaída, en comparación con un primer evento.
VariablesComo variable de desenlace se definió el tiempo hasta la recaída de VAA durante el primer año de seguimiento. Se incluyeron variables como el fenotipo clínico, la clasificación inicial de gravedad de la VAA según los criterios del Grupo de Estudio de Vasculitis Europeo (EUVAS)13 y el Five Factor Score (FFS)14, que se presentan en la tabla 1. Adicionalmente, se tomaron características clínicas, inmunoserológicas y relacionadas con el tratamiento farmacológico.
Características clínicas y demográficas de los pacientes con vasculitis asociadas a ANCA
| n | % | |
|---|---|---|
| Edad, años, mediana (RIC) | 60 | (48-63) |
| Mujeres | 39 | 69,64 |
| IMC, mediana (RIC) | 24 | (22-27) |
| Tabaquismo | 12 | 21,43 |
| Meses entre inicio de síntomas y diagnóstico, mediana (RIC) | 5,8 | (2-12,2) |
| Meses entre diagnóstico e ingreso a la cohorte, mediana (RIC) | 20,7 | (3,8-59,4) |
| Fenotipo | ||
| Granulomatosis con poliangitis | 36 | 64,29 |
| Poliangitis microscópica | 13 | 23,21 |
| Granulomatosis eosinofílica con poliangitis | 7 | 12,50 |
| FFS, mediana (RIC) | 1 | (0-2) |
| Clasificación inicial de la gravedad según EUVAS | ||
| Generalizada | 22 | 39,29 |
| Localizada | 13 | 23,21 |
| Renal grave | 12 | 21,43 |
| Sistémica de inicio | 9 | 16,07 |
EUVAS: European Vasculitis Study Group; FFS: Five Factor Score; IMC: índice de masa corporal.
Los puntos de corte para las variables cuantitativas de laboratorio fueron determinados por cada laboratorio en el cual se hicieron los estudios.
Control de sesgosPara controlar los sesgos de información, los datos fueron extraídos de registros de historias clínicas por investigadores previamente capacitados por un investigador experto del grupo de información clínica y supervisados por un reumatólogo. Los datos se extrajeron a un Google Forms, en el cual se realizó su validación interna y su estandarización. Se creó un diccionario de variables ligado al instrumento de recolección. Los datos no disponibles se registraron como datos perdidos.
Con el objetivo de reducir los sesgos de selección, la identificación de los pacientes se llevó a cabo en dos etapas: la búsqueda en los registros administrativos y la confirmación de la elegibilidad mediante la revisión de las historias clínicas. El reumatólogo confirmó el cumplimiento de los criterios de elegibilidad.
Tamaño de la muestraSe tomó el censo poblacional de los pacientes atendidos con diagnóstico de VAA.
Análisis estadísticoSe realizaron análisis descriptivos de la muestra total de los pacientes con VAA y del subgrupo de pacientes con recaída. Las variables categóricas se describen mediante frecuencias y porcentajes y las cuantitativas mediante mediana y rango intercuartil (RIC).
La supervivencia libre de recaída a un año se estimó con el modelo de supervivencia de Cox para datos censurados en el intervalo. El límite inferior del intervalo se tomó como la última fecha en la cual el paciente fue observado sin recaída, y el límite superior como la primera fecha en la cual el paciente fue evaluado con recaída. Se presenta la función de supervivencia a un año. Los análisis se obtuvieron con Stata versión 18 (College Station, TX, EE.UU.).
Consideraciones éticasEl protocolo de este estudio fue aprobado por el Comité Institucional de Ética de la Investigación en Seres Humanos de la Universidad CES (Ae-709) como investigación sin riesgo, de acuerdo con la Resolución 8430 de 1993. Al ingreso al programa se obtuvo consentimiento informado de los pacientes para el uso en condiciones de confidencialidad y anonimato de sus datos de historia clínica con fines de investigación.
ResultadosParticipantesSe incluyeron 56 pacientes provenientes de siete ciudades de Colombia (en orden de frecuencia: Medellín, Rionegro, Manizales, Pereira, Armenia, Cali y Tunja), los cuales aportaron 554,3 meses de seguimiento; en promedio, 9,9meses por paciente.
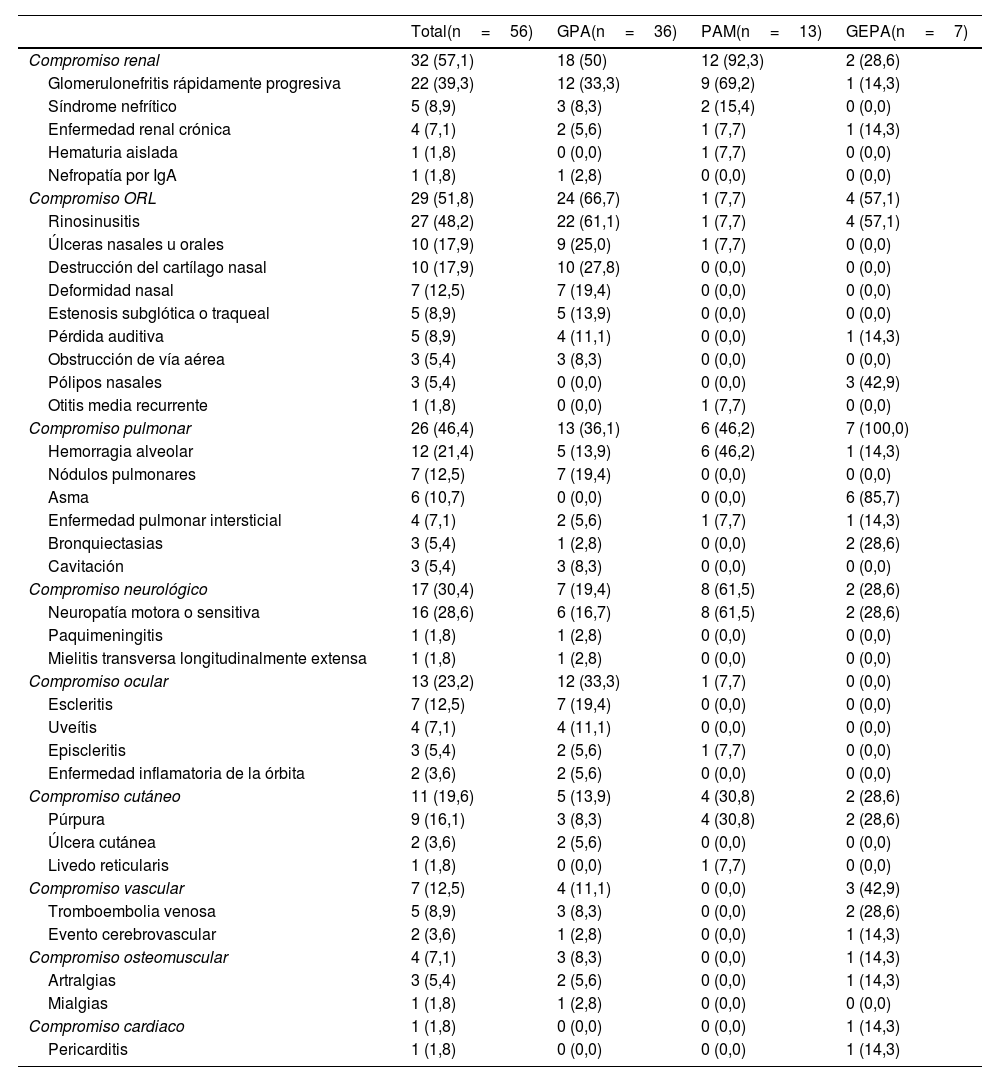
Características clínicas basalesLas características clínicas y sociodemográficas de los pacientes se detallan en la tabla 1. De los 56 pacientes incluidos en el estudio, 39 (69,6%) eran mujeres, con mediana de edad al ingreso de 60 años (RIC=48-63). En términos de fenotipo clínico, 36 pacientes (64,3%) fueron clasificados como GPA, 13 (23,2%) como PAM y 7 (12,5%) como GEPA. El compromiso por sistemas y las manifestaciones específicas se presentan en la tabla 2, siendo el renal el más frecuente, seguido del otorrinolaringológico, el pulmonar, el neurológico, el ocular, el cutáneo, el vascular, el osteomuscular y finalmente el cardiaco. Según la clasificación EUVAS, 22 pacientes (39,3%) debutaron con VAA generalizada, 13 (23,2%) con VAA localizada, 12 (21,4%) con VAA renal grave y 9 (16,1%) con VAA sistémica de inicio. El puntaje del FFS tuvo una mediana de1 (RIC=0-2).
Compromiso por sistemas de los pacientes con vasculitis asociadas a ANCA
| Total(n=56) | GPA(n=36) | PAM(n=13) | GEPA(n=7) | |
|---|---|---|---|---|
| Compromiso renal | 32 (57,1) | 18 (50) | 12 (92,3) | 2 (28,6) |
| Glomerulonefritis rápidamente progresiva | 22 (39,3) | 12 (33,3) | 9 (69,2) | 1 (14,3) |
| Síndrome nefrítico | 5 (8,9) | 3 (8,3) | 2 (15,4) | 0 (0,0) |
| Enfermedad renal crónica | 4 (7,1) | 2 (5,6) | 1 (7,7) | 1 (14,3) |
| Hematuria aislada | 1 (1,8) | 0 (0,0) | 1 (7,7) | 0 (0,0) |
| Nefropatía por IgA | 1 (1,8) | 1 (2,8) | 0 (0,0) | 0 (0,0) |
| Compromiso ORL | 29 (51,8) | 24 (66,7) | 1 (7,7) | 4 (57,1) |
| Rinosinusitis | 27 (48,2) | 22 (61,1) | 1 (7,7) | 4 (57,1) |
| Úlceras nasales u orales | 10 (17,9) | 9 (25,0) | 1 (7,7) | 0 (0,0) |
| Destrucción del cartílago nasal | 10 (17,9) | 10 (27,8) | 0 (0,0) | 0 (0,0) |
| Deformidad nasal | 7 (12,5) | 7 (19,4) | 0 (0,0) | 0 (0,0) |
| Estenosis subglótica o traqueal | 5 (8,9) | 5 (13,9) | 0 (0,0) | 0 (0,0) |
| Pérdida auditiva | 5 (8,9) | 4 (11,1) | 0 (0,0) | 1 (14,3) |
| Obstrucción de vía aérea | 3 (5,4) | 3 (8,3) | 0 (0,0) | 0 (0,0) |
| Pólipos nasales | 3 (5,4) | 0 (0,0) | 0 (0,0) | 3 (42,9) |
| Otitis media recurrente | 1 (1,8) | 0 (0,0) | 1 (7,7) | 0 (0,0) |
| Compromiso pulmonar | 26 (46,4) | 13 (36,1) | 6 (46,2) | 7 (100,0) |
| Hemorragia alveolar | 12 (21,4) | 5 (13,9) | 6 (46,2) | 1 (14,3) |
| Nódulos pulmonares | 7 (12,5) | 7 (19,4) | 0 (0,0) | 0 (0,0) |
| Asma | 6 (10,7) | 0 (0,0) | 0 (0,0) | 6 (85,7) |
| Enfermedad pulmonar intersticial | 4 (7,1) | 2 (5,6) | 1 (7,7) | 1 (14,3) |
| Bronquiectasias | 3 (5,4) | 1 (2,8) | 0 (0,0) | 2 (28,6) |
| Cavitación | 3 (5,4) | 3 (8,3) | 0 (0,0) | 0 (0,0) |
| Compromiso neurológico | 17 (30,4) | 7 (19,4) | 8 (61,5) | 2 (28,6) |
| Neuropatía motora o sensitiva | 16 (28,6) | 6 (16,7) | 8 (61,5) | 2 (28,6) |
| Paquimeningitis | 1 (1,8) | 1 (2,8) | 0 (0,0) | 0 (0,0) |
| Mielitis transversa longitudinalmente extensa | 1 (1,8) | 1 (2,8) | 0 (0,0) | 0 (0,0) |
| Compromiso ocular | 13 (23,2) | 12 (33,3) | 1 (7,7) | 0 (0,0) |
| Escleritis | 7 (12,5) | 7 (19,4) | 0 (0,0) | 0 (0,0) |
| Uveítis | 4 (7,1) | 4 (11,1) | 0 (0,0) | 0 (0,0) |
| Episcleritis | 3 (5,4) | 2 (5,6) | 1 (7,7) | 0 (0,0) |
| Enfermedad inflamatoria de la órbita | 2 (3,6) | 2 (5,6) | 0 (0,0) | 0 (0,0) |
| Compromiso cutáneo | 11 (19,6) | 5 (13,9) | 4 (30,8) | 2 (28,6) |
| Púrpura | 9 (16,1) | 3 (8,3) | 4 (30,8) | 2 (28,6) |
| Úlcera cutánea | 2 (3,6) | 2 (5,6) | 0 (0,0) | 0 (0,0) |
| Livedo reticularis | 1 (1,8) | 0 (0,0) | 1 (7,7) | 0 (0,0) |
| Compromiso vascular | 7 (12,5) | 4 (11,1) | 0 (0,0) | 3 (42,9) |
| Tromboembolia venosa | 5 (8,9) | 3 (8,3) | 0 (0,0) | 2 (28,6) |
| Evento cerebrovascular | 2 (3,6) | 1 (2,8) | 0 (0,0) | 1 (14,3) |
| Compromiso osteomuscular | 4 (7,1) | 3 (8,3) | 0 (0,0) | 1 (14,3) |
| Artralgias | 3 (5,4) | 2 (5,6) | 0 (0,0) | 1 (14,3) |
| Mialgias | 1 (1,8) | 1 (2,8) | 0 (0,0) | 0 (0,0) |
| Compromiso cardiaco | 1 (1,8) | 0 (0,0) | 0 (0,0) | 1 (14,3) |
| Pericarditis | 1 (1,8) | 0 (0,0) | 0 (0,0) | 1 (14,3) |
GEPA: granulomatosis eosinofílica con poliangitis; GPA: granulomatosis con poliangitis; ORL: otorrinolaringológico; PAM: poliangitis microscópica.
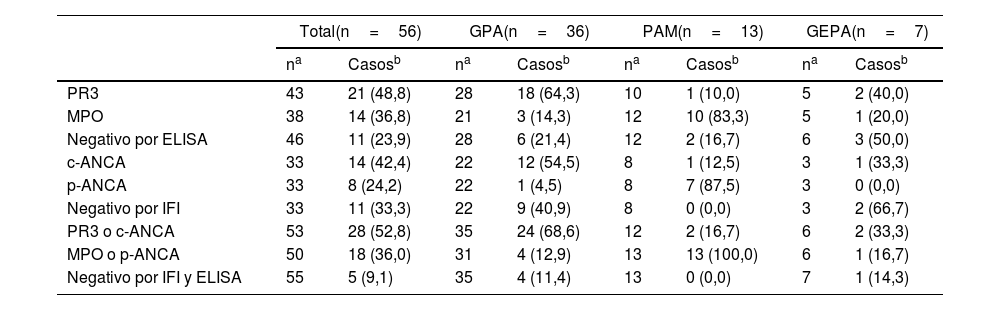
Los resultados disponibles del estado de anticuerpos se resumen en la tabla 3. Se identificaron 21 pacientes (48,8%) con positividad para PR3 y 14 (36,8%) para MPO, siendo solo un paciente positivo para ambos anticuerpos por inmunoensayo enzimático (ELISA). En cuanto a los resultados de inmunofluorescencia indirecta (IFI), 14 pacientes (42,4%) mostraron un patrón c-ANCA (citoplasmático), mientras que 8 (36,8%) presentaron un patrón p-ANCA (perinuclear). Cinco pacientes (9,0%) resultaron negativos para ANCA en ambos métodos de laboratorio. El diagnóstico de VAA en los pacientes ANCA negativos se basaba en una combinación de hallazgos clínicos con el resultado de biopsias que eran compatibles con esta entidad.
Resultados de ANCA según fenotipo clínico
| Total(n=56) | GPA(n=36) | PAM(n=13) | GEPA(n=7) | |||||
|---|---|---|---|---|---|---|---|---|
| na | Casosb | na | Casosb | na | Casosb | na | Casosb | |
| PR3 | 43 | 21 (48,8) | 28 | 18 (64,3) | 10 | 1 (10,0) | 5 | 2 (40,0) |
| MPO | 38 | 14 (36,8) | 21 | 3 (14,3) | 12 | 10 (83,3) | 5 | 1 (20,0) |
| Negativo por ELISA | 46 | 11 (23,9) | 28 | 6 (21,4) | 12 | 2 (16,7) | 6 | 3 (50,0) |
| c-ANCA | 33 | 14 (42,4) | 22 | 12 (54,5) | 8 | 1 (12,5) | 3 | 1 (33,3) |
| p-ANCA | 33 | 8 (24,2) | 22 | 1 (4,5) | 8 | 7 (87,5) | 3 | 0 (0,0) |
| Negativo por IFI | 33 | 11 (33,3) | 22 | 9 (40,9) | 8 | 0 (0,0) | 3 | 2 (66,7) |
| PR3 o c-ANCA | 53 | 28 (52,8) | 35 | 24 (68,6) | 12 | 2 (16,7) | 6 | 2 (33,3) |
| MPO o p-ANCA | 50 | 18 (36,0) | 31 | 4 (12,9) | 13 | 13 (100,0) | 6 | 1 (16,7) |
| Negativo por IFI y ELISA | 55 | 5 (9,1) | 35 | 4 (11,4) | 13 | 0 (0,0) | 7 | 1 (14,3) |
c-ANCA: anticuerpos anticitoplasma de neutrófilos patrón citoplasmático; ELISA: inmunoanálisis enzimático; GEPA: granulomatosis eosinofílica con poliangitis; GPA: granulomatosis con poliangitis; IFI: inmunofluorescencia indirecta; MPO: mieloperoxidasa; PAM: poliangitis microscópica; p-ANCA: anticuerpos anticitoplasma de neutrófilos patrón perinuclear; PR3: proteinasa 3.
Se obtuvieron registros de uno o más resultados histológicos en 37 pacientes (66,1%). De los 22 pacientes con datos de biopsia renal, 18 (81,8%) presentaron hallazgos de glomerulonefritis, 15 (68,2%) mostraron proliferación extracapilar con semilunas, 12 (54,5%) evidenciaron necrosis, 4 (18,2%) presentaron cambios crónicos por esclerosis glomerular y fibrosis intersticial, y uno (4,5%) mostró nefropatía por IgA. Se registraron resultados de biopsias nasales o de senos paranasales en 6pacientes, de los cuales 4 (66,7%) mostraron inflamación necrosante, 3 (50,0%) presentaron granulomas y uno (16,7%) mostró cambios de vasculitis. En cuanto a las biopsias pulmonares realizadas en 4pacientes, 2 (50,0%) mostraron granulomas, 2 (50%) presentaron infiltrado eosinofílico, uno (25,0%) evidenció vasculitis y el otro (25,0%) mostró neumonía intersticial no específica. Se llevaron a cabo cinco biopsias de piel, todas mostraron hallazgos de necrosis, 4 (80,0%) mostraron vasculitis, 2 (40,0%) reportaron granulomas y una (20,0%) evidenció infiltrado eosinofílico.
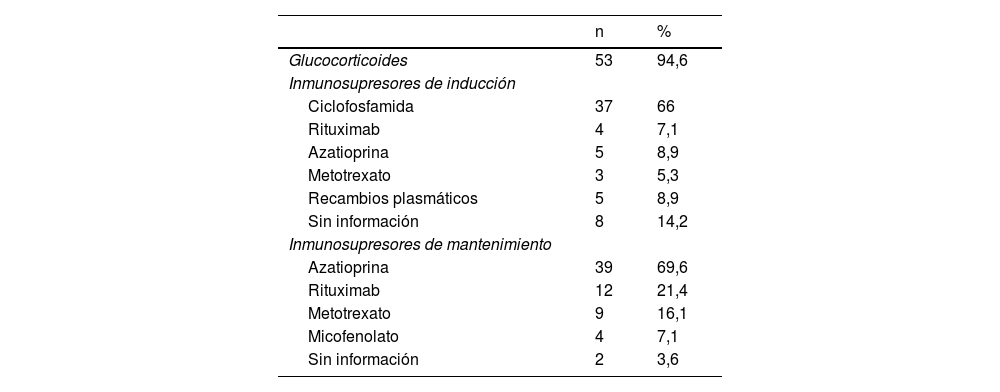
TratamientoEl tratamiento farmacológico se presenta en la tabla 4. La mayoría de los pacientes (94,6%) recibieron glucocorticoides con esquemas variables. Con respecto al uso de inmunosupresores de inducción, 37 pacientes (66%) recibieron ciclofosfamida y 4 (7,1%) recibieron rituximab. En cuanto al mantenimiento, el más usado fue azatioprina en 39 pacientes (69,6%), seguido de rituximab en 12 pacientes (21,4%). Además, 5 pacientes (8,9%) fueron sometidos a recambios plasmáticos y 11 (19,6%) recibieron profilaxis antibiótica con trimetoprim sulfametoxazol.
Tratamiento de pacientes con vasculitis asociadas a ANCA
| n | % | |
|---|---|---|
| Glucocorticoides | 53 | 94,6 |
| Inmunosupresores de inducción | ||
| Ciclofosfamida | 37 | 66 |
| Rituximab | 4 | 7,1 |
| Azatioprina | 5 | 8,9 |
| Metotrexato | 3 | 5,3 |
| Recambios plasmáticos | 5 | 8,9 |
| Sin información | 8 | 14,2 |
| Inmunosupresores de mantenimiento | ||
| Azatioprina | 39 | 69,6 |
| Rituximab | 12 | 21,4 |
| Metotrexato | 9 | 16,1 |
| Micofenolato | 4 | 7,1 |
| Sin información | 2 | 3,6 |
La figura 1 presenta la función de supervivencia libre de recaída, la cual se estimó al año de seguimiento en el 82,2%.
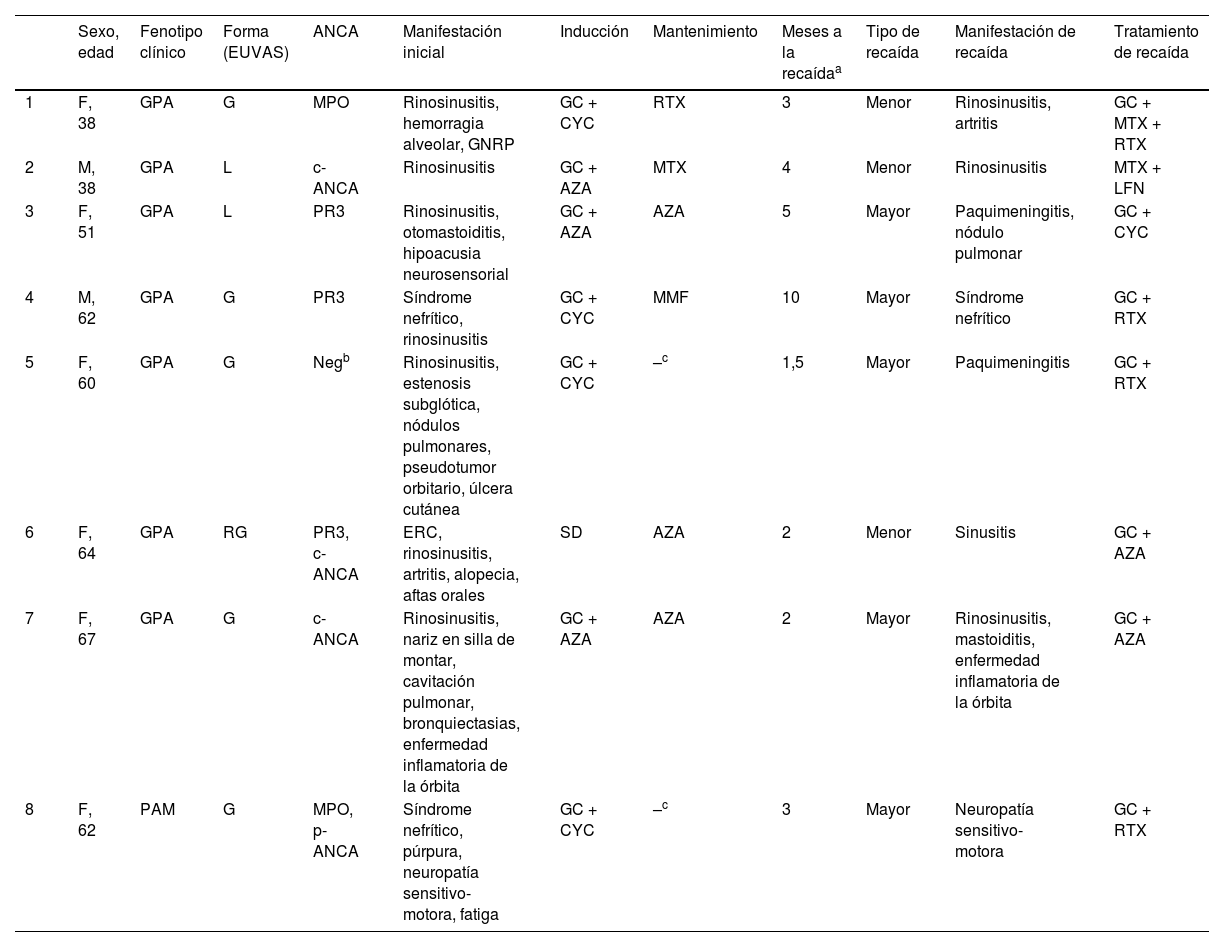
Características de los pacientes que presentaron recaída de VAAEn la tabla 5 se presentan las características de los 8 pacientes que experimentaron recaída. Se documentó una mediana de 3meses (RIC=2,0-4,3) entre el diagnóstico de remisión y la recaída. El 75% fueron mujeres, con una mediana de edad de 61años (RIC=47,7-62,5). Siete de estos pacientes (87,5%) tenían diagnóstico de GPA. Al momento del diagnóstico, 5pacientes (62,5%) tenían una enfermedad generalizada según clasificación EUVAS, con afectación otorrinolaringológica en 7 de ellos (87,5%), afectación renal en 4 (50,0%) y afectación pulmonar en 3 (37,5%). Se identificaron anticuerpos c-ANCA/PR3 en 5pacientes (62,5%) y p-ANCA/MPO en 2 (25,0%). Un paciente fue negativo para ANCA; sin embargo, la medición de los ANCA por ELISA se realizó después del inicio de la terapia de inducción, y el diagnóstico se estableció según las manifestaciones clínicas y los resultados histológicos compatibles.
Características de los pacientes con vasculitis asociadas a ANCA que presentaron recaída en el primer año de seguimiento
| Sexo, edad | Fenotipo clínico | Forma (EUVAS) | ANCA | Manifestación inicial | Inducción | Mantenimiento | Meses a la recaídaa | Tipo de recaída | Manifestación de recaída | Tratamiento de recaída | |
|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | F, 38 | GPA | G | MPO | Rinosinusitis, hemorragia alveolar, GNRP | GC + CYC | RTX | 3 | Menor | Rinosinusitis, artritis | GC + MTX + RTX |
| 2 | M, 38 | GPA | L | c-ANCA | Rinosinusitis | GC + AZA | MTX | 4 | Menor | Rinosinusitis | MTX + LFN |
| 3 | F, 51 | GPA | L | PR3 | Rinosinusitis, otomastoiditis, hipoacusia neurosensorial | GC + AZA | AZA | 5 | Mayor | Paquimeningitis, nódulo pulmonar | GC + CYC |
| 4 | M, 62 | GPA | G | PR3 | Síndrome nefrítico, rinosinusitis | GC + CYC | MMF | 10 | Mayor | Síndrome nefrítico | GC + RTX |
| 5 | F, 60 | GPA | G | Negb | Rinosinusitis, estenosis subglótica, nódulos pulmonares, pseudotumor orbitario, úlcera cutánea | GC + CYC | –c | 1,5 | Mayor | Paquimeningitis | GC + RTX |
| 6 | F, 64 | GPA | RG | PR3, c-ANCA | ERC, rinosinusitis, artritis, alopecia, aftas orales | SD | AZA | 2 | Menor | Sinusitis | GC + AZA |
| 7 | F, 67 | GPA | G | c-ANCA | Rinosinusitis, nariz en silla de montar, cavitación pulmonar, bronquiectasias, enfermedad inflamatoria de la órbita | GC + AZA | AZA | 2 | Mayor | Rinosinusitis, mastoiditis, enfermedad inflamatoria de la órbita | GC + AZA |
| 8 | F, 62 | PAM | G | MPO, p-ANCA | Síndrome nefrítico, púrpura, neuropatía sensitivo-motora, fatiga | GC + CYC | –c | 3 | Mayor | Neuropatía sensitivo-motora | GC + RTX |
ANCA: anticuerpos anticitoplasma de neutrófilos; AZA: azatioprina; c-ANCA: anticuerpos anticitoplasma de neutrófilos patrón citoplasmático; CYC: ciclofosfamida; ERC: enfermedad renal crónica; EUVAS: European Vasculitis Study Group; F: femenino; G: generalizada; GC: glucocorticoides; GNRP: glomerulonefritis rápidamente progresiva; GPA: granulomatosis con poliangitis; L: localizada; LFN: leflunomida; M: masculino; MMF: micofenolato mofetilo; MPO: mieloperoxidasa; MTX: metotrexato; Neg: negativo; PAM: poliangitis microscópica; PR3: proteinasa3; RG: renal grave; RTX: rituximab; SD: sin datos.
Durante las recaídas, los sistemas principalmente afectados fueron el otorrinolaringológico en 4pacientes (50,0%) y el sistema nervioso en 3 de ellos (37,5%). Se observó que 5pacientes (62,5%) experimentaron recaídas que involucraban un solo órgano, mientras que el resto presentaron recaídas que afectaban múltiples órganos. De los pacientes con recaídas, 5 (62,5%) experimentaron recaídas mayores que amenazaban la vida o un órgano, mientras que 3 (37,5%) tuvieron recaídas menores. En cuanto al tratamiento de mantenimiento al momento de la recaída, la terapia más comúnmente utilizada fue la azatioprina, en 3 pacientes (37,5%), mientras que solo un paciente (12,5%) estaba recibiendo rituximab, metotrexato o micofenolato. Dos pacientes (25,0%) experimentaron recaídas durante la terapia de inducción con ciclofosfamida. En cuanto al tratamiento de reinducción, se utilizó una combinación de glucocorticoides en 7 pacientes (87,5%), rituximab en 4 (50,0%), metotrexato en dos (25,0%), azatioprina en dos (25,0%) y ciclofosfamida o leflunomida en uno (12,5%).
DiscusiónEste estudio tuvo como objetivo estimar la supervivencia libre de recaída durante el primer año en pacientes con VAA, la cual se encontró en un 82,2%. Además, proporcionamos una caracterización clínica, histológica, de laboratorio y de tratamiento, tanto para el total de pacientes con VAA como para los pacientes que presentaron recaída.
Es importante destacar que los estudios sobre VAA en población latinoamericana son escasos, a pesar de su relevancia clínica, socioeconómica y para los sistemas de salud. En Colombia en particular, existen pocos estudios disponibles, como el de Fernández-Ávila et al.11, que describe a 106 pacientes con VAA, y el de Ochoa et al.10, con 455 pacientes con VAA. Por lo tanto, nuestro trabajo se suma a estas publicaciones sobre el tema, aportando información adicional sobre el seguimiento y las recaídas en estos pacientes.
Con referencia a las manifestaciones clínicas, el principal sistema comprometido fue el renal, en un 57,1% (tabla 2), similar a lo reportado en las series argentina15, española16 y sueca17, pero inferior al reporte de 84% en el estudio de Fernández-Ávila et al.11. No obstante, en nuestro estudio se incluyó un menor porcentaje de pacientes con PAM, los cuales cursan con afectación renal de forma más frecuente, además de incluir pacientes con GPA limitada y GEPA en un contexto ambulatorio; esto sumado al uso de una definición diferente de compromiso renal, pues en el nuestro no se consideró la hipertensión arterial como manifestación renal.
Los porcentajes de compromiso pulmonar, otorrinolaringológico, neurológico, cutáneo y ocular son similares a los reportados por otros autores, aunque cabe mencionar que al tener mayor proporción de pacientes con GPA, se identificó un mayor porcentaje de sinusitis que en otros estudios de población hispana11,15,16.
Por otro lado, nuestro estudio se suma a lo reportado en la literatura de las asociaciones entre ciertas manifestaciones clínicas y el fenotipo. El compromiso renal es casi constante en PAM e infrecuente en GEPA, mientras que el compromiso otorrinolaringológico es más frecuente en GPA y GEPA, y el compromiso ocular en GPA11,16,18-20.
En cuanto a la medición de los ANCA, nuestro estudio tuvo un porcentaje de positividad para PR3 y MPO del 48,8% y del 36,8%, respectivamente. Estos resultados son similares al registro sueco, el cual reporta el 51% para PR3 y el 43% para MPO21. Sin embargo, dada la naturaleza retrospectiva de nuestro estudio, no todos los pacientes tenían reporte de ANCA disponible y en algunos solo había reporte de ANCA medidos por IFI, que antes de 2017 se consideraba el estudio inicial en caso de sospecha de VAA22. Si se incluyen los resultados de ANCA por IFI, el porcentaje de positividad aumenta, alcanzando el 52,8% para PR3 o c-ANCA, que es mayor a la cohorte española (36%) y la argentina (42,5%), lo que probablemente se deba a que nuestro estudio tuvo mayor proporción de pacientes con GPA en relación con PAM, en comparación con las otras dos cohortes, en las cuales la proporción de estas enfermedades fue similar. A su vez, la positividad de MPO o p-ANCA fue menor en nuestro estudio que en las cohortes española y argentina, por el mismo motivo15,16.
En nuestro estudio, la mayoría de los pacientes con GPA tenían PR3 o c-ANCA y la mayoría de los pacientes con PAM tenían MPO o p-ANCA, similar a lo reportado en los registros españoles y franceses16,18,19. En las cohortes sueca, española y argentina la prevalencia de ANCA negativos en el grupo total de pacientes con VAA fue baja y similar a la nuestra, siendo del 6,0%, del 13,6% y del 8,6%, respectivamente15,16,21.
Con respecto al tratamiento, la mayoría de los pacientes recibieron glucocorticoides y ciclofosfamida como tratamiento de inducción, al igual que en otras cohortes por su indicación bien establecida en VAA11,15,16. El escaso uso de rituximab como terapia de inducción se explica por la exclusión de pacientes con enfermedad refractaria o recaídas previas al ingreso. En nuestro estudio, el medicamento más usado como mantenimiento fue azatioprina, pese a que en la actualidad la terapia preferida en este escenario es el rituximab, posiblemente porque en muchos casos se había iniciado previamente a la divulgación del estudio MAINRITSAN23 y por la mayor disponibilidad de la azatioprina en nuestro medio debido a su menor costo. Por otro lado, en el estudio de Fernández-Ávila et al.11 se utilizaron recambios plasmáticos con mayor frecuencia que en el nuestro (17,9% vs. 8,2%, respectivamente), lo cual podría deberse al cambio de la tendencia en su uso desde el estudio PEXIVAS y al mayor porcentaje de hemorragia alveolar difusa24.
La supervivencia libre de recaída a un año encontrada en nuestro estudio (82,2%) tiene una tendencia a comportarse similar a la de los estudios CYCAZAREM25, WEGENT26 y al brazo de azatioprina de los estudios MAINRITSAN23 y RITAZAREM27; sin embargo, es menor a la del brazo de rituximab en estos dos estudios, lo cual puede explicarse porque en nuestro trabajo la mayoría de los pacientes recibieron azatioprina en el mantenimiento y solo el 21,4% rituximab. Asimismo, la supervivencia libre de recaída reportada por los estudios del Registro del Grupo de Estudio de Vasculitis Francés de GPA, PAM y GEPA tiene un comportamiento similar al nuestro18-20.
Si bien en nuestro estudio se estableció un bajo poder estadístico para análisis de asociación, la mayoría de los pacientes que recayeron tenían diagnóstico de GPA, positividad para c-ANCA/PR3 y compromiso de vía aérea superior, hallazgos que son consistentes con lo reportado en la literatura9,28,29.
Este estudio presenta diversas fortalezas. Es el primero en estimar la supervivencia libre de recaída en pacientes con VAA y uno de los pocos que caracterizan esta enfermedad en Colombia. Además, se llevó a cabo una descripción detallada de los casos que experimentaron recaídas, lo que proporciona una mejor comprensión de cómo se manifiestan estas recaídas en nuestra población. Cabe destacar que todos los pacientes de la cohorte fueron evaluados por reumatólogos, lo cual representa el método estándar para el diagnóstico de estas enfermedades. Esto reduce la posibilidad de incorporación en la cohorte de otras enfermedades que pueden tener manifestaciones clínicas similares.
La principal limitación de este estudio es su carácter retrospectivo con base en fuentes secundarias. Incluso, algunos pacientes habían sido diagnosticados de manera hospitalaria o en otros centros ambulatorios años previos a su ingreso a la institución. La mediana entre el diagnóstico y el ingreso a la cohorte fue de 20,7meses, por lo que la presentación clínica al diagnóstico, los paraclínicos iniciales y el esquema de inducción podrían estar incompletos. Por otro lado, al excluir pacientes refractarios y con recaídas previas, se reduce el número de eventos y, por lo tanto, este puede ser más bajo al observado en poblaciones no selectas.
ConclusiónEste artículo proporciona información relevante sobre las características de los pacientes con VAA en Colombia, y de aquellos que recayeron. La supervivencia libre de recaída observada en esta cohorte fue similar a la reportada en estudios clínicos y registros de VAA.
FinanciaciónNo se recibió financiación específica para este estudio.
Conflictos de interesesLos autores declaramos no tener conflictos de intereses.