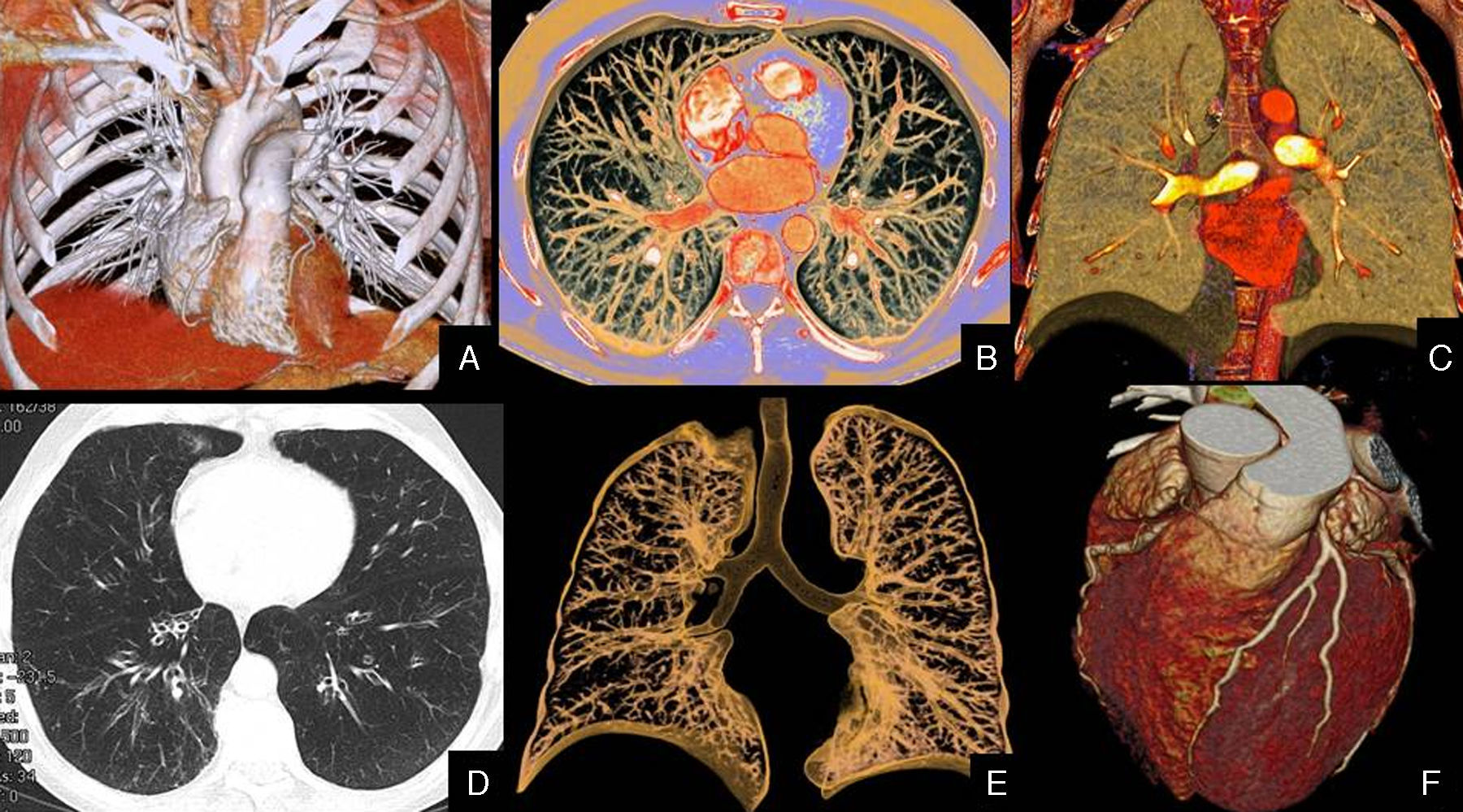
La comorbilidad cardíaca es uno de los factores pronósticos más importantes en las enfermedades pulmonares, particularmente en la enfermedad pulmonar obstructiva crónica (EPOC). Entre las distintas técnicas de imagen disponibles para estudiar dicha manifestación sistémica concomitante a la EPOC se incluyen el cateterismo cardíaco, la ecocardiografía transtorácica y la resonancia magnética. La tomografía computarizada multidetector (TCMD) ha supuesto un progreso significativo en este campo, al permitir obtener estudios simultáneos de la anatomía cardiopulmonar que van más allá del análisis anatómico-morfológico e incluyen una aproximación funcional a dicha afectación. En este trabajo se repasan aspectos prácticos necesarios para valorar la comorbilidad cardíaca en pacientes con EPOC, tanto desde el punto de vista de la hipertensión pulmonar, como del análisis de la disfunción ventricular y de la enfermedad coronaria.
Cardiac comorbidity is one of the most important prognostic factors in lung disease, especially in chronic obstructive pulmonary disease (COPD). The imaging techniques available for the study of this systemic manifestation concomitant with COPD include heart catheterization, transthoracic echocardiography, and magnetic resonance imaging. Multidetector computed tomography (MDCT) represents a significant advance in this field because it enables the acquisition of simultaneous studies of the cardiopulmonary anatomy that go beyond anatomic and morphologic analysis to include a functional approach to this condition. In this article, we review the practical aspects necessary to evaluate cardiac comorbidity in patients with COPD, both from the point of view of pulmonary hypertension and of the analysis of ventricular dysfunction and coronary heart disease.
La enfermedad pulmonar obstructiva crónica (EPOC) se caracteriza por una obstrucción crónica y poco reversible al flujo aéreo, asociada a una reacción inflamatoria anómala, principalmente frente al humo del tabaco1. La EPOC tiene una prevalencia del 10,2% entre los adultos españoles y representa la cuarta causa de muerte en esta población2. Entre los distintos factores que pueden afectar al pronóstico y supervivencia de estos pacientes se encuentran las neoplasias, la hipertensión arterial, la diabetes mellitus y las cardiopatías3. Se desconoce el común denominador de estas interrelaciones, aunque se postula que la inflamación sistémica crónica presente en la EPOC tiene un papel primordial en su desarrollo4.
Entre las manifestaciones sistémicas descritas, la comorbilidad cardiovascular constituye uno de los determinantes más importantes del pronóstico de los pacientes con EPOC, que se ha estimado como causa de mortalidad hasta en el 42% de los casos5. Estos pacientes tienen más riesgo de trombosis venosa profunda, tromboembolismo pulmonar, ictus, arritmias cardíacas, arteriosclerosis, infarto de miocardio e insuficiencia cardíaca6. La comorbilidad cardíaca en el contexto de la EPOC se puede manifestar como hipertensión pulmonar (HTP), disfunción ventricular derecha, disfunción ventricular izquierda, enfermedad coronaria y arritmias. Las arritmias más frecuentes en este grupo de pacientes son las taquiarritmias supraventriculares, como la fibrilación auricular y la taquicardia auricular multifocal7. La cardiopatía isquémica es una causa infraestimada de fallecimiento en los pacientes con EPOC.
La comorbilidad cardíaca en pacientes con EPOC se puede estudiar mediante diversas técnicas de imagen. El cateterismo de cavidades derechas y la medición de la presión pulmonar constituyen el patrón de referencia para diagnosticar la HTP. Entre las técnicas no invasivas destacan la ecocardiografía, por su rapidez y disponibilidad, y la resonancia magnética (RM), por su exactitud y reproducibilidad. Sin embargo, una de las técnicas que más interés ha suscitado para estudiar la afección cardiotorácica y, por tanto, la comorbilidad cardíaca en pacientes con EPOC, es la tomografía computarizada multidetector (TCMD). Este interés se debe particularmente a 2 propiedades inherentes a la técnica. Por una parte, es la tecnología que permite valorar la afección de la vía aérea y parénquima pulmonar con mayor detalle anatómico, constituyendo la técnica rutinaria y estándar de referencia para estudiar las enfermedades pulmonares. Por otra, los avances en esta tecnología han posibilitado sincronizar la adquisición de los estudios con el ritmo electrocardiográfico (ECG) de los sujetos, lo que implica un menor número de artefactos debidos al latido cardíaco pero, sobre todo, la posibilidad de valorar adicionalmente el corazón y su vascularización. Por tanto, además de estudiar la arquitectura pulmonar, la TCMD con sincronización ECG aporta información sobre la función cardíaca y la enfermedad coronaria en una misma exploración, lo que implica un gran avance para el manejo de los pacientes con EPOC (fig. 1). Así, la TCMD ofrece posibilidades diagnósticas que sobrepasan el mero estudio anatómico o morfológico del tórax, para entrar en la valoración funcional de la interacción cardiopulmonar y la repercusión que posee la EPOC sobre la función pulmonar y cardíaca.
En este trabajo se revisa la utilidad actual de la TCMD para establecer la comorbilidad cardíaca en pacientes con EPOC y se subraya su versatilidad, que permite obtener una valoración integral, anatómica y funcional de la afección cardiotorácica.
Protocolo de estudio de tomografía computarizada multidetectorEl protocolo de estudio de TC en pacientes con EPOC se debe ajustar a cada sujeto y sospecha clínica. El perfeccionamiento de la tecnología de TC se ha traducido en el desarrollo de los equipos multidetector (TCMD), con el consecuente incremento de la cobertura anatómica, velocidad de adquisición, y resolución espacial y temporal. Hoy en día, el estándar mínimo para la TCMD cardiotorácica son los equipos TCMD-64 cortes8, que con una resolución espacial de 0,4mm (64×0,6mm) y una resolución temporal de 165ms (tiempo de rotación de gantry de 0,33s) permiten adquirir estudios cardiotorácicos en apenas 15-18s9. Su mayor limitación es una resolución temporal todavía insuficiente, que puede hacer necesario administrar fármacos que reduzcan la frecuencia cardíaca de los pacientes antes de realizar la exploración. La tecnología de TCMD ha evolucionado hacia una mayor cobertura anatómica en los equipos volumétricos de última generación y hacia una mayor rapidez de adquisición en los equipos TCMD duales de segunda generación, que son capaces de obtener estudios cardiotorácicos con mayor precisión y exactitud diagnóstica, incluso en un único latido cardíaco y en menos de un segundo mediante la técnica de «pitch alto»10. La evolución parece progresar más allá del estudio morfológico hacia la valoración funcional, empleando para ello una adquisición simultánea de espectros de alta y baja energía con los que obtener mapas de atenuación de contraste que permiten caracterizar los tejidos11,12.
En los pacientes con EPOC en que se sospeche de comorbilidad cardíaca, la TCMD-64 es una tecnología de gran utilidad clínica. El protocolo de estudio de TCMD en ellos puede ser variable, desde exploraciones torácicas rutinarias, hasta adquisiciones más sofisticadas, sincronizadas con el ECG, que, a su vez, pueden comprender un estudio cardíaco dirigido, o un estudio cardiotorácico íntegro, de mayor interés en este grupo de pacientes. En este sentido, como norma general, si lo que se desea es valorar exclusivamente el corazón, es más recomendable realizar un estudio cardíaco dirigido, dado que es más rápido e implica menos artefactos, dosis de radiación y cantidad de contraste yodado. Por el contrario, si lo que más interesa es estudiar íntegramente el tórax, incluyendo el árbol traqueo-bronquial, parénquima pulmonar, grandes vasos, corazón y vasos coronarios, es recomendable realizar un protocolo cardiotorácico con sincronización ECG. En la tabla 1 se propone un protocolo TCMD-64 cardiotorácico con sincronización ECG.
Protocolo de estudio cardiotorácico TCMD-64 con sincronización ECG retrospectiva
| Exploración | Rango | Ápices pulmonares-diafragma |
| Dirección | Cráneo-caudal | |
| Tiempo | ∼18-22 s | |
| Radiación | Voltaje | 120kV |
| Corriente | 300mAs | |
| Modulación de la dosis | Modulación de la corriente del tubo (ECG-tube current modulation) | |
| Adquisición | Colimación | 64×0,6mm |
| Tiempo de rotación | 330ms | |
| Pitch | 0,3 | |
| Medicación | Bloqueadores beta | Si FC>65lpm y se desea valorar las arterias coronarias |
| Nitroglicerina | 0,4mg sublingual (comprimido/spray) si se desea valorar las arterias coronarias | |
| Contraste | Vía | Vena antecubital derecha |
| Tamaño de la aguja | 18-20G | |
| Concentración de contraste | 350-400mgI/ml | |
| Cantidad | 80ml | |
| Bolo | 50ml mezcla (30% contraste/70% suero salino)+50ml de suero salino | |
| Flujo | 4ml/s | |
| Técnica | Bolus tracking | |
| Región de interés | Arteria pulmonar | |
| Umbral | 100UH | |
| Retardo | 10s | |
| Reconstrucción | Mediastino (GC/IR) | 1mm/0,7mm. Filtro partes blandas (B26f) |
| Parénquima pulmonar (GC/IR) | 3mm/3mm. Filtro parénquima pulmonar (B60f) | |
| Arterias coronarias (GC/IR) | 0,75mm/0,4mm. Filtro partes blandas (B26f) | |
| Ventana de reconstrucción | Si FC<80lpm, 60-70% del ciclo cardíaco | |
| Si FC>80lpm, 40% del ciclo cardíaco |
Fuente: modificado de Bastarrika72
FC: frecuencia cardíaca; G: gauge; GC/IR: grosor de corte/incremento de reconstrucción; kV: kilovolt; lpm: latidos por minuto; mAs: miliamperio por segundo; mg; miligramo; mgI: miligramos de yodo; ml: mililitro; mm: milímetro; ms: milisegundo; s: segundos; TCMD: tomografía computarizada multidetector; UH: Unidades Hounsfield.
Si se opta por protocolos con sincronización ECG, como norma general es recomendable emplear fármacos betabloqueantes antes de la exploración, dado que la frecuencia cardíaca elevada suele ser la mayor limitación de la calidad diagnóstica de este tipo de estudio. En nuestro centro administramos metoprolol oral una hora antes de la exploración (50mg si el paciente pesa menos de 80kg; 100mg si el paciente pesa más de 80kg). Si la frecuencia cardíaca persiste superior a 65lpm, administramos la misma medicación de manera intravenosa (5-20mg) hasta alcanzar la frecuencia cardíaca deseada. No obstante, si únicamente se desea establecer la función cardíaca y no se considera imprescindible estudiar las arterias coronarias, el protocolo cardiotorácico se puede realizar sin premedicar al paciente. De esta manera, consideramos que los protocolos cardiotorácicos con sincronización ECG pueden aportar información clínicamente relevante que sobrepasa el mero estudio morfológico cardiopulmonar. Dichos protocolos se deberían llevar a cabo, por ejemplo, si se considera de interés clínico conocer la función ventricular o si se desea realizar una valoración cardiotorácica integral en la misma exploración, por ejemplo, en pacientes con hipertensión pulmonar.
Estrategias para reducir la dosis de radiaciónLos protocolos cardiotorácicos con sincronización ECG requieren usar todas las estrategias disponibles que permitan reducir la dosis de radiación administrada13. Se debe ajustar el kilovoltaje (kV) y miliamperaje (mAs) según el hábito corporal de los sujetos14,15, bien de manera manual (considerar el empleo de 100kV en pacientes con índice de masa corporal menor de 25kg/m2) o bien mediante programas informáticos, que regulen automáticamente estos parámetros. También se deben utilizar técnicas que modulen la corriente del tubo a lo largo del ciclo cardíaco. Esta tecnología permite reducir de forma significativa la dosis de radiación al administrar la dosis máxima en las fases del ciclo en que se considere que se van a poder valorar mejor las arterias coronarias (habitualmente durante la diástole). Si el equipo lo permite, es recomendable utilizar técnicas que minimicen la dosis de radiación administrada, como la sincronización ECG prospectiva16. Esta opción es útil si únicamente se desea realizar una valoración morfológica de las estructuras cardiovasculares, dado que solo se adquieren datos de la fase del ciclo cardíaco seleccionada y, por tanto, no permiten obtener parámetros de función ventricular, o adquirir los estudios en un latido único10. A modo comparativo, se estima que la dosis de radiación administrada es de 5-7mSv para estudios torácicos TCMD-64 convencionales (sin sincronización ECG)17, de unos 9mSv para los estudios cardíacos específicos18 y alrededor de 16-18mSv, para los estudios cardiotorácicos con sincronización ECG19.
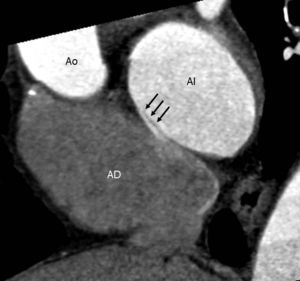
Estudio de la hipertensión pulmonarLa prevalencia estimada de HTP en pacientes ingresados por EPOC al menos una vez es del 10-30%20, alcanzando esta cifra el 90% en pacientes remitidos para cirugía de reducción de volumen pulmonar21. En su etiopatogenia multifactorial se postulan factores como la hipoxia crónica22, el remodelado vascular de las arterias pulmonares de pequeño calibre23 y la disfunción endotelial24. En pacientes con EPOC, la HTP progresa lentamente, suele ser leve o moderada (20-32,5mmHg) en reposo e implica mal pronóstico porque afecta negativamente a la supervivencia de estos pacientes25. Su gravedad depende del grado de obstrucción al flujo aéreo y de la dificultad para el intercambio gaseoso. En los casos de HTP grave, o cuando exista desproporción entre la gravedad de la HTP y el grado de EPOC, se deben considerar enfermedades concomitantes26, como la permeabilidad del foramen oval (fig. 2).
Estudio cardiotorácico con sincronización ECG de un paciente varón de 69 años, con EPOC, e hipertensión pulmonar desproporcionada. El estudio realizado con sincronización ECG puso de manifiesto la permeabilidad del foramen oval (flechas).
AD: aurícula derecha; AI: aurícula izquierda; Ao: aorta.
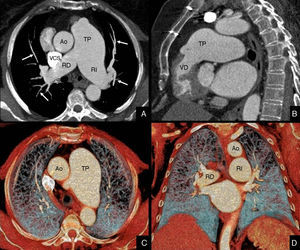
Si bien es necesario realizar un cateterismo de cavidades derechas para establecer el diagnóstico de HTP27, un número cada vez mayor de técnicas no invasivas permiten realizar un diagnóstico de sospecha, y evitan la morbimortalidad asociada al procedimiento28. Entre ellas destaca la ecocardiografía, que a pesar de sus conocidas limitaciones, particularmente en pacientes con EPOC, se utiliza actualmente como técnica de diagnóstico inicial. La ecocardiografía permite, por una parte, valorar morfológicamente el ventrículo derecho y establecer signos de sobrecarga de presión crónica o disfunción ventricular. Por otra, el estudio Doppler aporta parámetros que permiten estimar indirectamente la presión pulmonar calculando la velocidad del jet de insuficiencia tricuspídea, el tiempo de aceleración en el tracto de salida del ventrículo derecho y la velocidad pico proto- y telediastólica del flujo pulmonar29. Entre las técnicas seccionales, las 2 que han mostrado resultados más prometedores son la TC y la RM. Esta última permite, además, estimar la presión pulmonar de manera no invasiva y se considera estándar de referencia para cuantificar los parámetros cardíacos30. Como se ha dicho, en pacientes con EPOC, la TCMD permite conocer la repercusión anatómica o morfológica de la enfermedad y, según describen los estudios más recientes, obtener información funcional analizando la ventilación31 y vascularización/perfusión del parénquima32 (fig. 3). Desde el punto de vista de la valoración de la HTP y la comorbilidad cardíaca, la versatilidad de la TCMD viene dada por su capacidad para añadir al estudio morfológico un análisis exhaustivo de la vascularización cardiopulmonar y, cuantificar los parámetros de función ventricular, de gran interés para el seguimiento de estos pacientes.
Estudio cardiotorácico con sincronización ECG de un paciente varón de 48 años, con hipertensión pulmonar. El estudio vascular (A y B) mostró una dilatación del tronco principal (TP) y de las ramas izquierda (RI) y derecha (RD) de la arteria pulmonar, con disminución significativa del calibre y afilamiento de ramas segmentarias (flechas). Las reconstrucciones volumétricas con mapa de colores (C y D) mostraron la disminución de la vascularización pulmonar secundaria a la hipertensión del paciente.Ao: aorta; VCS: vena cava superior; VD: ventrículo derecho.
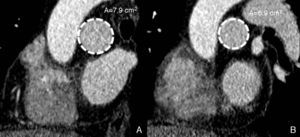
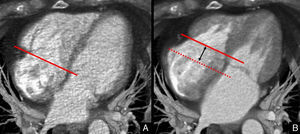
La aproximación a la HTP en estudios de TCMD se puede realizar desde distintas perspectivas. La más sencilla es medir el diámetro del tronco principal de la arteria pulmonar o el diámetro de las ramas izquierda y derecha de la arteria pulmonar33 en los estudios de TCMD rutinarios. Como norma general, se asume que si el diámetro de la arteria pulmonar en una angiografía por TCMD es superior al diámetro de la aorta, se debe sospechar una HTP34. De hecho, se ha observado correlación entre la presión pulmonar media elevada y la relación entre el diámetro de la arteria pulmonar/diámetro de la aorta >1, particularmente en pacientes menores de 50 años35. Así, un diámetro de la arteria pulmonar principal mayor o igual a 29mm predice la HTP con una sensibilidad del 86% y una especificidad del 89%36. Diámetros superiores a 16,7mm para la arteria pulmonar derecha y 16,9mm para la arteria pulmonar izquierda en una radiografía de tórax se consideran aumentados37. No obstante, estudios recientes indican que la exactitud y utilidad real de medir los diámetros es cuestionable, dado que el diámetro de los vasos puede variar de manera significativa según el momento del ciclo cardíaco en que haya sido adquirido el estudio. Para evitar esta limitación, se propone adquirir los estudios con sincronización ECG. De esta manera, es posible calcular la distensibilidad de la arteria pulmonar, un parámetro que depende de las propiedades elásticas de la pared arterial y refleja el cambio del volumen de la arteria pulmonar entre sístole y diástole38. El cálculo de este parámetro se realiza en reconstrucciones multiplanares seccionales de la rama derecha de la arteria pulmonar, sobre las que se dibujan los contornos vasculares en sístole y diástole (fig. 4). Su diferencia refleja la distensibilidad de la arteria pulmonar. Se considera normal una reducción del 20-25% del área seccional en diástole frente a la sístole39. En un estudio reciente realizado para establecer la utilidad de la TCMD-64 frente al cateterismo cardíaco derecho para diagnosticar la HTP, la distensibilidad ha demostrado ser el parámetro de mayor valor diagnóstico40. Por otro lado, a pesar de que no es posible cuantificar las resistencias vasculares pulmonares de una manera directa con TCMD, a partir de datos del gasto cardíaco calculados mediante esta técnica se han desarrollado fórmulas complejas para su estimación41.
Estudio cardiotorácico sincronizado con ECG del mismo paciente varón de 48 años, con hipertensión pulmonar de la figura 3. Estudio de distensibilidad de la arteria pulmonar. Imágenes seccionales de la rama derecha de la arteria pulmonar. A) Imagen sistólica. B) Imagen diastólica. Nótese que el área de la rama pulmonar derecha en sístole (7,9 cm2) es muy similar al área medida en diástole (6,96 cm2), signo sugestivo de hipertensión pulmonar.
Los 2 ventrículos (izquierdo y derecho) se encuentran englobados dentro del pericardio y, comparten el tabique interventricular. Así, los cambios de presión o volumen que puedan darse en cualquiera de los 2 ventrículos influyen en la función del otro ventrículo, lo que se conoce como interdependencia ventricular. Por tanto, en casos de sobrecarga de presión del ventrículo derecho, el abombamiento o desplazamiento hacia la izquierda del tabique interventricular afectará al llenado del ventrículo izquierdo y, del mismo modo, la disfunción ventricular izquierda repercutirá sobre la función del ventrículo derecho. La TCMD con sincronización ECG es una técnica útil para estudiar dicha interdependencia ventricular, sin las limitaciones de otras técnicas diagnósticas no invasivas.
Disfunción ventricular derechaLa HTP es la causa más frecuente de disfunción del ventrículo derecho en pacientes con EPOC. Habitualmente se debe a una sobrecarga de presión crónica que hipertrofia y dilata este ventrículo. Se estima que la prevalencia global de la disfunción sistólica del ventrículo derecho (fracción de eyección menor del 45%) en pacientes con EPOC está en torno al 20%. En un estudio que analizó de manera retrospectiva la disfunción ventricular en pacientes con enfermedad pulmonar grave, EPOC, enfermedades pulmonares intersticiales y HTP, se observó una prevalencia de disfunción ventricular derecha del 66%42.
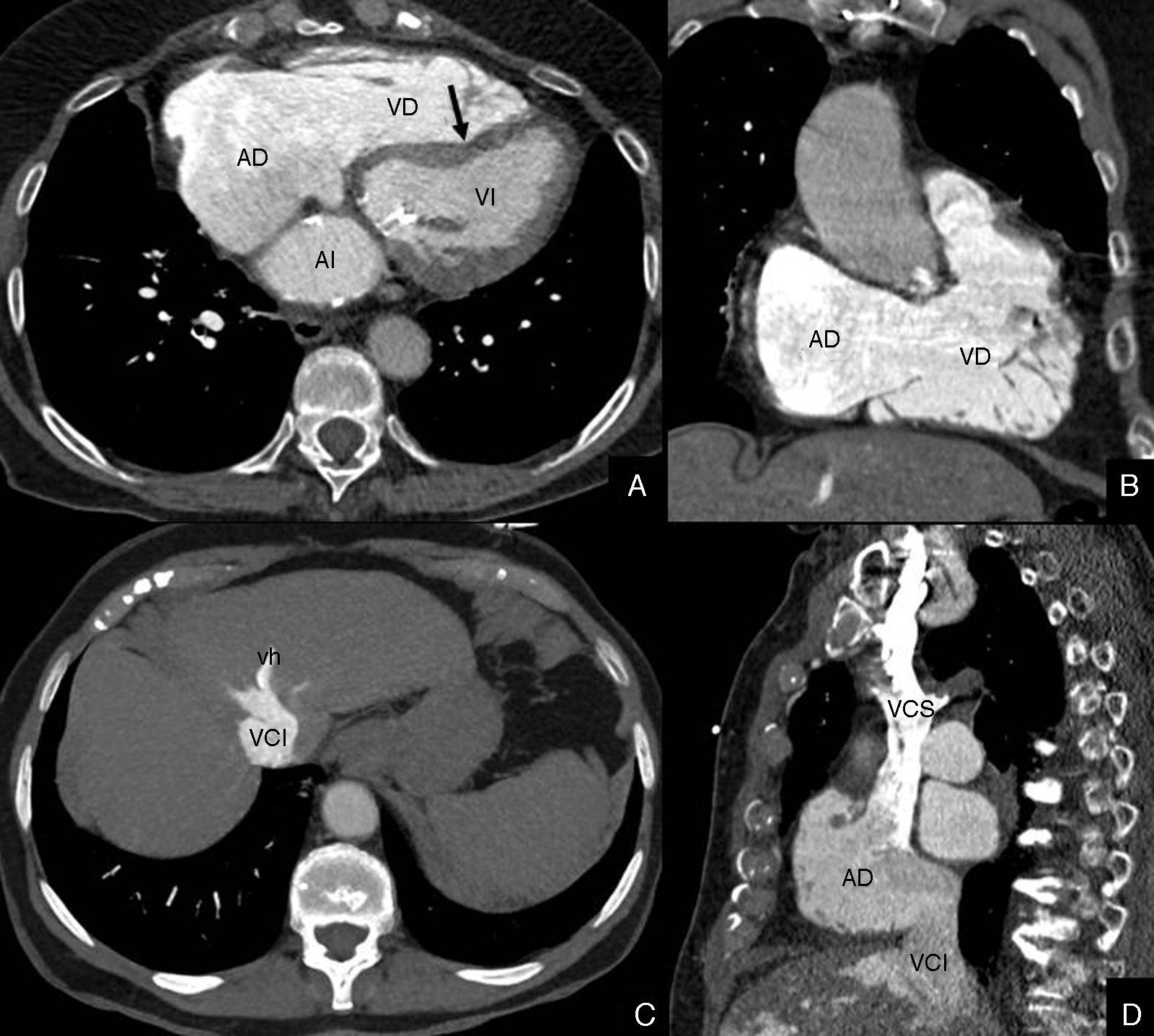
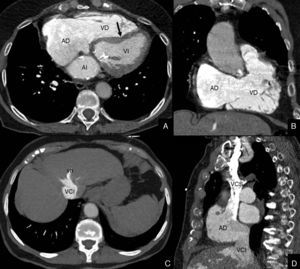
Dada su forma compleja, resulta difícil valorar el ventrículo derecho mediante técnicas de imagen no seccionales. Así, además de la RM, la TCMD se perfila como una técnica apropiada para estudiarlo43. Diversos signos morfológicos como la dilatación del ventrículo derecho (relación del diámetro ventrículo derecho/ventrículo izquierdo mayor de 1) (sensibilidad: 78-91,6%; especificidad: 100%)44,45, dilatación de la aurícula derecha, reflujo del contraste a las venas hepáticas y dilatación de las venas cavas, seno coronario y sistema venoso hepático, orientan hacia la disfunción ventricular derecha46,47. En caso de aumento de presión en las cavidades derechas se observa, además, un aplanamiento o inversión y abombamiento del tabique interventricular hacia el ventrículo izquierdo48 (fig. 5).
Estudio cardiotorácico con sincronización ECG de un paciente varón de 62 años, con EPOC, e hipertensión pulmonar. A) Imagen axial. B) Imagen coronal oblicua que muestra el trayecto de entrada y salida del ventrículo derecho. C) Imagen axial con proyección de máxima intensidad (MIP). D) Imagen sagital oblicua de las venas cavas. El estudio mostró signos sugestivos de disfunción ventricular derecha como dilatación comparativa del ventrículo derecho (VD) y aurícula derecha (AD) respecto al ventrículo izquierdo (VI) y aurícula izquierda (AI), desplazamiento paradójico del tabique interventricular (flecha), reflujo del contraste a las venas hepáticas (vh) y dilatación de las venas cavas superior (VCS) e inferior (VCI).
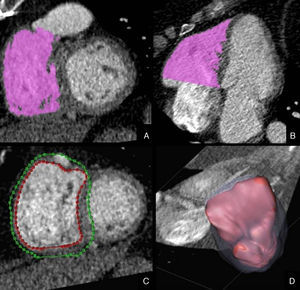
La sincronización ECG en los estudios de TCMD permite estimar la disfunción ventricular derecha al obtener parámetros como el TAPSE (tricuspid annular plane systolic excursion), medir el tracto de salida del ventrículo derecho y su fracción de eyección. El valor del TAPSE se correlaciona bien con la estimación de la función sistólica global del ventrículo derecho, de manera que un TAPSE <16mm en ecocardiografía indica una disfunción sistólica49. Esta medida tiene una relación inversa con las resistencias vasculares pulmonares y posee valor pronóstico. En la TCMD, este parámetro se calcula dibujando una línea a través del anillo tricúspide en un plano de 4 cámaras y midiendo su desplazamiento anterior (fig. 6). La medida sistólica y diastólica del grosor miocárdico subvalvular en el infundíbulo del ventrículo derecho, el diámetro anteroposterior del tracto de salida del ventrículo derecho y el diámetro seccional del tracto de salida del ventrículo derecho derivados de la TCMD también permiten estimar la función ventricular derecha40. Sin embargo, la manera más exacta de calcular la función del ventrículo derecho radica en la cuantificación directa de sus volúmenes y la fracción de eyección mediante el método Simpson, bien dibujando los contornos endocavitarios de manera manual o bien empleando programas de segmentación semiautomática (fig. 7). En un estudio reciente realizado en pacientes con EPOC se ha demostrado que tanto la fracción de eyección del ventrículo derecho como su masa miocárdica estimadas mediante TCMD-64 se correlacionan bien con la gravedad de la enfermedad determinada según las pruebas de función respiratoria50.
Estudio cardiotorácico con sincronización ECG de un paciente varón de 58 años, con EPOC, hipertensión pulmonar y sospecha de disfunción ventricular derecha. Cálculo del TAPSE (tricuspid annular plane systolic excursion). A) Imagen volumétrica del corazón en el plano 4 cámaras obtenida en diástole. B) Imagen volumétrica del corazón en el plano 4 cámaras obtenida en sístole. En TCMD el TAPSE se calcula dibujando una línea a través del anillo tricúspide en un plano de 4 cámaras y midiendo su desplazamiento anterior (un TAPSE<16mm indica disfunción sistólica del ventrículo derecho). En este caso, el TAPSE era de 17mm.
Estudio cardiotorácico sincronizado con ECG en un paciente varón de 69 años, con EPOC, hipertensión pulmonar y sospecha de disfunción ventricular derecha. Cuantificación de los parámetros del ventrículo derecho mediante el método Simpson con un programa de segmentación semiautomática de las cavidades cardíacas basado en umbrales de atenuación.
Dada la interdependencia ventricular, en el caso de los pacientes con EPOC la disfunción del ventrículo derecho influye de manera significativa en la función del ventrículo izquierdo. Así, el grado de disfunción ventricular izquierda secundario a la disfunción ventricular derecha adquiere una importancia especial en estos pacientes. La dilatación del ventrículo derecho, debida tanto al aumento de las resistencias arteriales pulmonares que se da en pacientes con EPOC, como a la sobrecarga crónica de presión de las cavidades derechas presente en la EPOC y HTP, provoca un desplazamiento hacia la izquierda del tabique interventricular, que impide el llenado adecuado del ventrículo izquierdo. Como consecuencia, la dilatación del ventrículo derecho tiende a aumentar la presión telediastólica del ventrículo izquierdo y provoca un descenso tanto del volumen latido de este ventrículo como del retorno venoso pulmonar, con la consiguiente disfunción ventricular izquierda. Desde el punto de vista clínico, estos pacientes manifiestan signos y síntomas de insuficiencia cardíaca y disfunción diastólica del ventrículo izquierdo con función sistólica normal o ligeramente deprimida. Este cuadro se conoce como insuficiencia cardíaca con fracción de eyección normal o preservada51. En su evolución, los pacientes con EPOC avanzada y disfunción diastólica del ventrículo izquierdo pueden progresar hacia la disfunción sistólica, con descenso de la fracción de eyección42. Además, los pacientes con EPOC muestran rigidez diastólica del ventrículo izquierdo secundaria a inflamación e hipoxia, hipertrofia del ventrículo izquierdo y enfermedad coronaria, que contribuyen aún más a la disfunción ventricular izquierda.
La adquisición de los estudios de TCMD con sincronización ECG permite cuantificar la función ventricular izquierda, aunque no de manera exactamente superponible a la de la RM, dada su menor resolución temporal52. En estudios de TCMD también se puede analizar la función cardíaca regional o contractilidad segmentaria del ventrículo izquierdo, que han demostrado una concordancia aceptable respecto a la ecocardiografía y RM53. Al igual que en el caso del ventrículo derecho, la cuantificación de los parámetros ventriculares izquierdos requiere delinear los contornos endo y epicárdicos del corazón54,55. Desde el punto de vista de los protocolos de estudio de TCMD, resulta necesario recalcar que la valoración de la función ventricular viene añadida al análisis de la vascularización coronaria, de manera que la misma exploración adquirida para estudiar las arterias coronarias permite conocer los volúmenes ventriculares y su fracción de eyección56,57. Hay que señalar que hacer exploraciones de TCMD estrictamente dirigidas a estudiar la función ventricular se limita a circunstancias clínicas muy concretas, por ejemplo a situaciones en las que la información diagnóstica aportada por los métodos convencionales se considere insuficiente8. Por tanto, hoy en día no es apropiado utilizar la TCMD como técnica de primera elección para estudiar la función cardíaca.
Estudio de la enfermedad coronariaNumerosos estudios han demostrado que existe una asociación directa entre la EPOC y la enfermedad coronaria. El mecanismo causal clásicamente reconocido de dicha asociación es el consumo de tabaco. Sin embargo, la evidencia epidemiológica actual sugiere que, independientemente del consumo de tabaco, existen otros factores de riesgo que incrementan la morbimortalidad cardiovascular58. Así, el papel que posee la inflamación sistémica crónica en la patogénesis de la placa de ateroma y el desarrollo de cardiopatía isquémica suscita un interés creciente59–61. Se conoce que, en pacientes con EPOC, determinados marcadores inflamatorios sistémicos como la IL-6, IL1-(, TNF-(, MMP-9, MCP-1 y la proteína C-reactiva se encuentran elevados62. Por otra parte, se ha descrito que los agentes farmacológicos empleados para tratar la EPOC también pueden influir en el desarrollo de eventos cardíacos63.
El estándar de referencia actual para diagnosticar la enfermedad coronaria es la coronariografía invasiva convencional. Sin embargo, las técnicas de diagnóstico no invasivo adquieren una gran relevancia en estudios poblacionales, dado que permiten descartar enfermedad coronaria significativa con mínima morbilidad asociada al procedimiento. No obstante, en los pacientes con EPOC, determinadas técnicas para detectar isquemia, como la prueba de esfuerzo convencional o la ecocardiografía de estrés, tienen un rendimiento diagnóstico limitado dado que la condición física de los pacientes con EPOC avanzada y las características fisiopatológicas propias de la enfermedad las dificultan64.
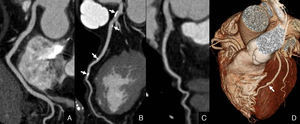
Numerosos estudios han demostrado que la TCMD es una técnica de gran utilidad clínica para diagnosticar la enfermedad coronaria. En la tabla 2 se propone un protocolo de estudio de coronariografía mediante TCMD-64 con sincronización ECG-retrospectiva. La TCMD permite detectar y cuantificar la calcificación coronaria «Agatston Score», un indicador y marcador cuantitativo de arteriosclerosis que refleja la carga total de placa de ateroma65, permite estratificar el riesgo cardiovascular66, y aporta valor pronóstico67–70. Por otra parte, respecto a la coronariografía convencional, los valores de sensibilidad y especificidad de la coronariografía realizada con equipos TCMD-64 y TC de doble fuente para detectar enfermedad coronaria, oscilan entre 86-99% y 92-98%, con un valor predictivo negativo en torno al 92-100%71. De hecho, el elevado valor predictivo negativo de la coronariografía por TCMD es la razón principal por la que esta tecnología se pueda utilizar para excluir enfermedad coronaria significativa en sujetos con sospecha de padecerla y evitar realizar exploraciones complementarias o cateterismos diagnósticos innecesarios72 (fig. 8). No existen datos acerca del rendimiento diagnóstico de la coronariografía por TCMD en pacientes con EPOC, aunque cabe esperar que dichas cifras sean parecidas.
Protocolo de estudio de coronariografía mediante TCMD-64 con sincronización ECG-retrospectiva
| Exploración | Rango | Carina-diafragma |
| Dirección | Cráneo-caudal | |
| Tiempo | ∼9-12s | |
| Radiación | Voltaje | 120kVp |
| Corriente | 500-800mAs | |
| Modulación de la dosis | Modulación de la corriente del tubo (ECG-tube current modulation) | |
| Adquisición | Colimación | 64×0,6mm |
| Tiempo de rotación | 330ms | |
| Pitch | 0,2 | |
| Medicación | Bloqueadores beta | Si FC>65lpm |
| Nitroglicerina | 0,4mg sublingual (comprimido/spray) | |
| Contraste | Vía | Vena antecubital derecha |
| Tamaño de la aguja | 18-20G | |
| Concentración de contraste | 350-400mgI/ml | |
| Cantidad | 80ml | |
| Bolo | 50ml (30% contraste/70% suero salino)+50ml de suero salino | |
| Flujo | 5ml/s | |
| Técnica | Bolus tracking | |
| Región de interés | Aorta descendente | |
| Umbral | 100UH | |
| Retardo | 6s | |
| Reconstrucción | Arterias coronarias (GC/IR) | 0,75mm/0,4mm |
| Ventana de reconstrucción | Si FC<80 lpm, 70% del ciclo cardíaco | |
| Si FC>80 lpm, 40% del ciclo cardíaco | ||
| Parénquima pulmonar (GC/IR) | 3mm/3mm |
Fuente: modificado de Bastarrika72
FC: frecuencia cardíaca; G: gauge; GC/IR: grosor de corte/incremento de reconstrucción; kVp: kilovolt pico; lpm: latidos por minuto; mAs: miliamperio por segundo; mg; miligramo; mgI: miligramos de yodo; mGy: miliGray; ml: mililitro; mm: milímetro; ms: milisegundo; s: segundos; sincr.: sincronización; TCMD: tomografía computarizada multidetector; UH: Unidades Hounsfield.
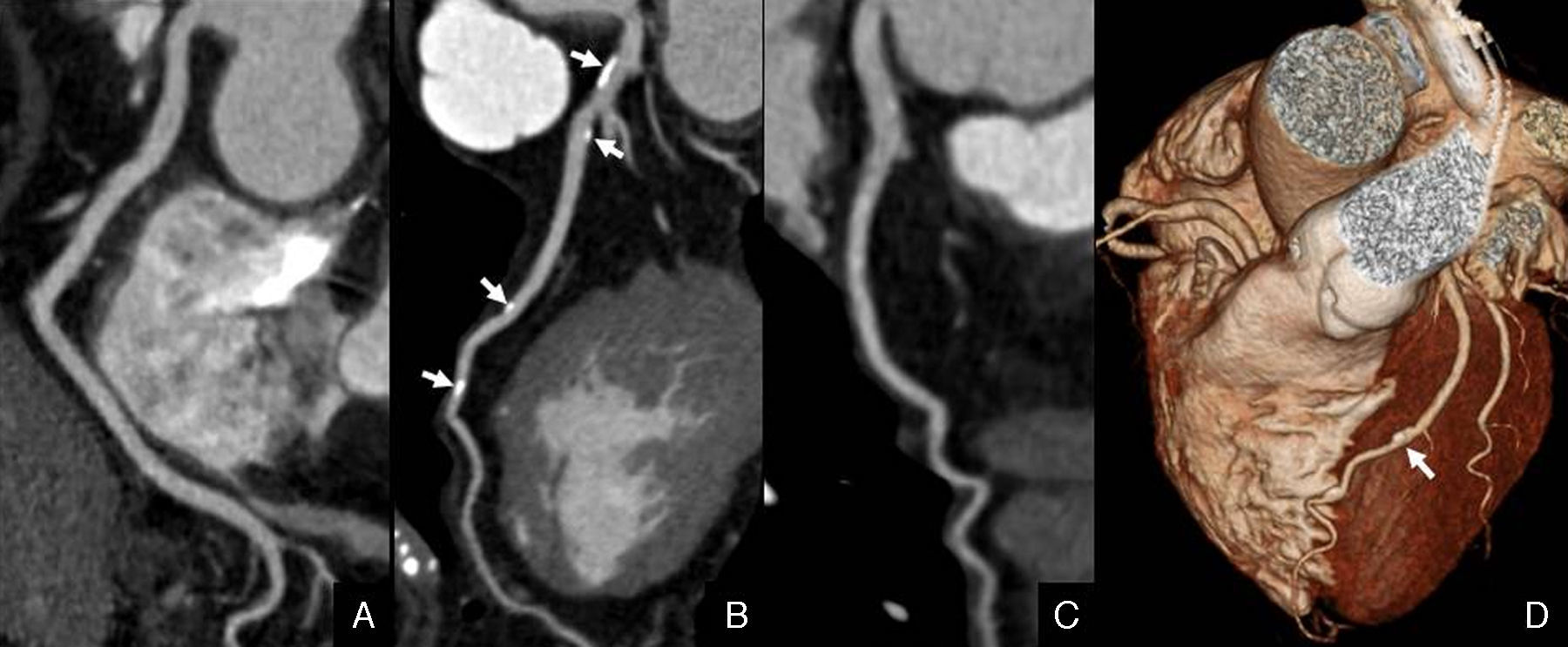
Coronariografía por TCMD con sincronización ECG retrospectiva de un paciente varón de 67 años, con EPOC y dolor torácico. Estudio cardíaco realizado para descartar enfermedad coronaria. A- C) Reconstrucciones multiplanares curvas de las arterias coronarias derecha (A), descendente anterior (B) y circunfleja (C). D) Reconstrucción volumétrica del corazón. El estudio mostró placas calcificadas excéntricas en la arteria coronaria descendente anterior (flechas). El estudio descartó estenosis coronaria significativa.
La comorbilidad cardíaca implica mal pronóstico en pacientes con EPOC. Las manifestaciones clínicas de dicha comorbilidad son variables, incluyendo HTP, disfunción ventricular, enfermedad coronaria y arritmias. Además de los factores de riesgo clásicos, la evidencia científica actual sugiere que la inflamación sistémica crónica contribuye al desarrollo de arteriosclerosis y enfermedad coronaria en pacientes con EPOC. Entre las técnicas de diagnóstico no invasivo disponibles para establecer la comorbilidad cardíaca en estos pacientes destaca la TCMD. Dada su gran versatilidad y potencial para hacer una valoración cardiotorácica anatómica y funcional íntegra, la TCMD se presenta como una herramienta de gran relevancia clínica para el diagnóstico y seguimiento de la comorbilidad cardíaca asociada a la EPOC. Con todo, dada la dosis de radiación administrada, es necesario individualizar los protocolos de adquisición, establecer el beneficio/riesgo de los distintos tipos de exploración para cada paciente y, realizar una investigación profunda acerca del grupo de pacientes que más se beneficiaría de estudios de estas características.
Responsabilidades éticasProtección de personas y animales. Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datos. Los autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informado. Los autores declaran que en este artículo no aparecen datos de pacientes.
Autorías- 1.
Responsable de la integridad del estudio: GB e ISY.
- 2.
Concepción del estudio: GB e ISY.
- 3.
Diseño del estudio: GB, ISY y GV.
- 4.
Obtención de los datos: GB, ISY y GV.
- 5.
Análisis e interpretación de los datos: GB, ISY, GV, JE y PJS.
- 6.
Tratamiento estadístico: no procede.
- 7.
Búsqueda bibliográfica: GB e ISY.
- 8.
Redacción del trabajo: GB e ISY.
- 9.
Revisión crítica del manuscrito con aportaciones intelectualmente relevantes: GB, ISY, GV, JE y PJS.
- 10.
Aprobación de la versión final: GB, ISY, GV, JE y PJS.
Los autores declaran no tener ningún conflicto de intereses.