Determinar si existe una relación significativa entre la morfología de la curva intensidad-tiempo del estudio de resonancia magnética (RM) dinámica con gadolinio de los tumores ováricos ecográficamente indeterminados y el tipo de lesión (benigna, borderline o maligna), para poder realizar un diagnóstico prequirúrgico correcto.
Material y métodosSe analizaron 68 tumoraciones ováricas ecográficamente indeterminadas, valoradas mediante RM con secuencia dinámica. Únicamente se incluyeron los casos con diagnóstico histológico o con estabilidad en pruebas de imagen tras al menos un año de seguimiento. Cada caso se clasificó en benigno, borderline o maligno.
Para su análisis, se marcaron regiones de interés en la lesión y en el miometrio (como referencia). Se obtuvo una curva definida por la relación entre la intensidad del realce y el tiempo, cuya morfología permitió clasificar cada tumor dentro de uno de los cuatro tipos de curva predefinidos. También se analizaron parámetros semicuantitativos. Finalmente, se compararon los resultados de cada uno de los tres grupos de tumores.
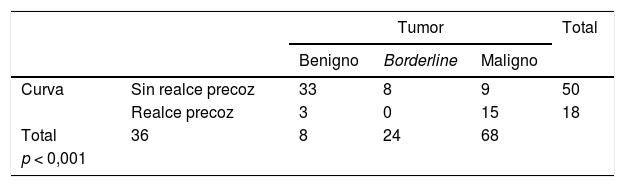
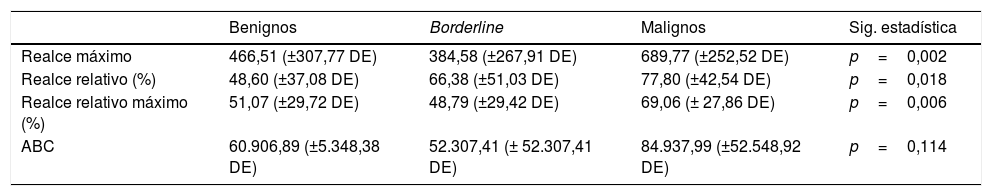
ResultadosSe demostró una relación significativa (p <0,001) entre las curvas sin realce precoz con las lesiones benignas y borderline, y entre las malignas con curvas con realce precoz. Las lesiones malignas se asociaron de forma significativa con los parámetros semicuantitativos de realce: máximo (p=0,002), relativo máximo (p=0,006) y relativo (p=0,018).
ConclusionesEn tumores ováricos ecográficamente indeterminados, la RM dinámica con contraste puede ser útil a la hora de clasificarlos como benignos, borderline o malignos, al mostrar las neoplasias malignas una asociación estadísticamente significativa con curvas con realce precoz.
To determine whether there is a significant relationship between the shape of the time-intensity curve on dynamic gadolinium-enhanced magnetic resonance imaging (MRI) of ovarian tumors classified as indeterminate at ultrasonography and the type of lesion (benign, borderline, or malignant) to enable an accurate presurgical diagnosis.
Material and methodsWe used dynamic contrast-enhanced MRI to study 68 ovarian tumors that were classified as indeterminate at ultrasonography. We included only cases for which a definitive diagnosis (histologic diagnosis or ≥1 year stability on imaging tests) was available. Each case was classified as benign, borderline, or malignant.
To analyze the MRI studies, we marked regions of interest in the lesion and in the myometrium (as a reference). We obtained a curve defined by the relation between the intensity of enhancement and time and classified each tumor according to four predefined curve types. We also analyzed semiquantitative parameters. Finally, we compared the results for each of the three groups of tumors.
ResultsWe found significant associations (p <0.001) between the curves without early enhancement and benign and borderline lesions as well as between the curves with early enhancement and malignant lesions. Malignant lesions were significantly associated with the semiquantitative enhancement parameters: maximum (p=0.002), maximum relative (p=0.006), and relative (p=0.018).
ConclusionsIn ovarian tumors classified as indeterminate at ultrasonography, dynamic contrast-enhanced MRI can be useful for classification as benign, borderline, or malignant because the malignant lesions are significantly associated with early enhancement curves.
Los tumores de ovario se dividen, en función de su comportamiento, en benignos, borderline y malignos. Estos últimos constituyen la 7.ª neoplasia más frecuente en mujeres1, con una alta mortalidad asociada2,3, así como la primera indicación de cirugía ginecológica oncológica4. Por este motivo, es primordial un correcto diagnóstico prequirúrgico de estas lesiones.
Ante una tumoración anexial, la ecografía es habitualmente la primera prueba que se realiza5, pero en algunas ocasiones no permite esclarecer su naturaleza, y se caracterizan como tumoraciones anexiales indeterminadas5. En estos casos, la prueba de imagen recomendada por la European Society of Urogenital Radiology (ESUR) es la resonancia magnética (RM)6.
En algunos casos, las secuencias convencionales de RM no van a ser suficientes para categorizar la tumoración anexial, lo que puede pasar a la hora de diferenciar una lesión borderline de una maligna7. Dada la trascendencia de realizar un diagnóstico prequirúrgico lo más exacto posible de cara al planteamiento terapéutico (diferente en ambos casos)8,9, en los últimos años ha crecido el interés acerca de incluir en el protocolo de estudio habitual5,10–18, secuencias avanzadas como la difusión y el estudio dinámico con gadolinio, con el fin de poder alcanzar un diagnóstico más preciso.
Este estudio tiene como objetivo principal valorar el papel de la secuencia dinámica a la hora de categorizar tumores ováricos ecográficamente indeterminados. Para ello, se centra en su análisis descriptivo a partir de la morfología en las curvas obtenidas (que relacionan el realce lesional y el tiempo), aunque también valorando parámetros semicuantitativos (realces relativo, máximo y relativo máximo y área bajo la curva [ABC]). Especialmente, lo que pretende es valorar la eficacia de esta secuencia para detectar lesiones malignas con el fin de optimizar su diagnóstico mediante RM y, así, contribuir a un correcto planteamiento quirúrgico.
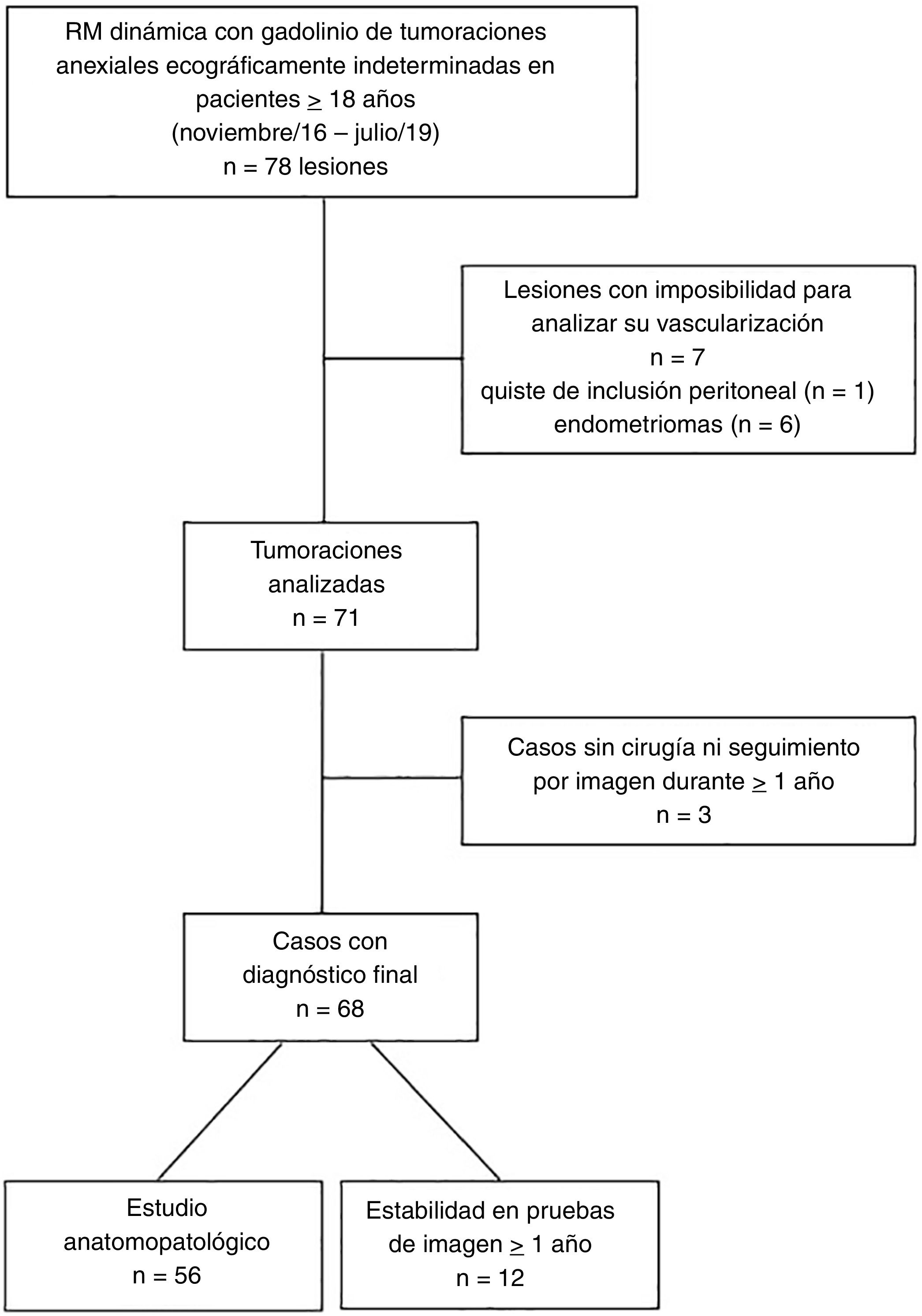
Material y métodosDescripción de la muestraSe realizó un estudio retrospectivo observacional partiendo de una revisión de los estudios de RM pélvica realizados entre noviembre de 2016 (con anterioridad no se realizaba estudio dinámico en nuestro servicio) y julio de 2019, solicitados desde el Servicio de Ginecología para completar el estudio de una tumoración anexial ecográficamente indeterminada. Por tanto, estos casos partían de una exploración ginecológica inicial categorizada mediante el score IOTA (International Ovarian Tumor Analysis)19 con resultado “intermedio o no concluyente”. Para ello, se hizo una búsqueda en el Sistema de Información del Servicio de Radiodiagnóstico con la siguiente estrategia: Sistema genitourinario – Genitales – Ovario – Neoplasia, condiciones “Neoplasia-like”. Solo se incluyeron las pruebas realizadas a mujeres mayores de 18 años. En caso de lesiones bilaterales, se decidió analizar cada tumoración de forma independiente. Una vez realizada esta búsqueda, se excluyeron, en primer lugar, aquellas lesiones sobre las que no se pudo analizar su vascularización en la secuencia dinámica y, por último, los casos en los que no se pudo llegar a un diagnóstico definitivo de la lesión. Este último se estableció por su resultado anatomopatológico (estándar de referencia) o por su estabilidad en pruebas de imagen durante al menos un año (ecografía o RM), en casos en los que no se dispuso de pieza quirúrgica. Finalmente, cada caso se clasificó dentro de uno de los tres grupos establecidos: benignos, borderline y malignos.
Todo el estudio se llevó a cabo siguiendo los principios para las investigaciones médicas en seres humanos, según los criterios de la declaración de Helsinki20. No se requirió consentimiento informado de las pacientes, ya que al tratarse de un estudio retrospectivo sobre datos obtenidos de RM ya realizadas, este no implicaba ningún cambio de actitud en su manejo diagnóstico.
Descripción técnicaLos estudios anteriores a septiembre de 2017 se realizaron en una máquina de RM Philips Intera 1.0T, y los posteriores a dicha fecha, en una Philips Ingenia 1.5T. Se empleó una antena phased-array de pelvis.
El estudio se realizó tras, por lo menos, 3 horas de ayuno. No se administró ningún fármaco para combatir el efecto del peristaltismo.
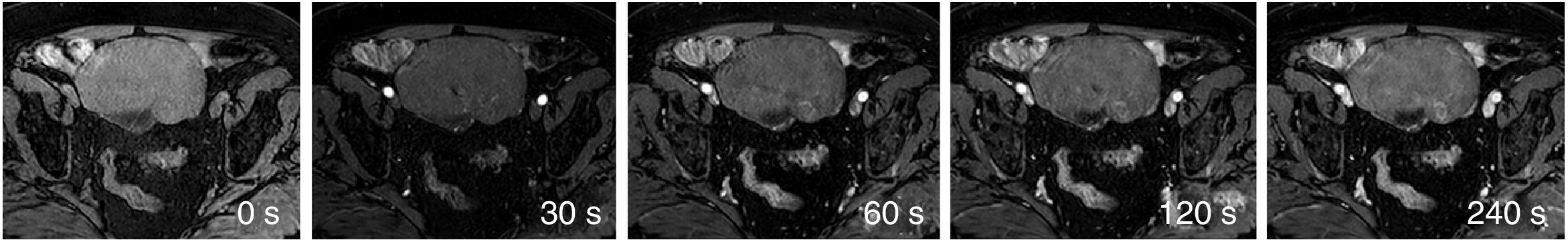
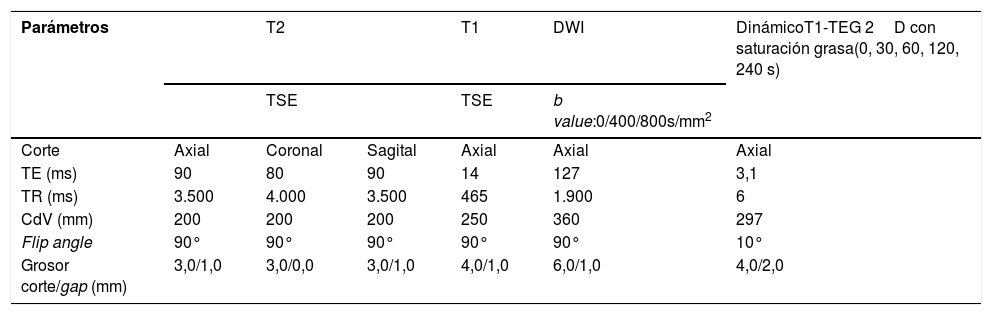
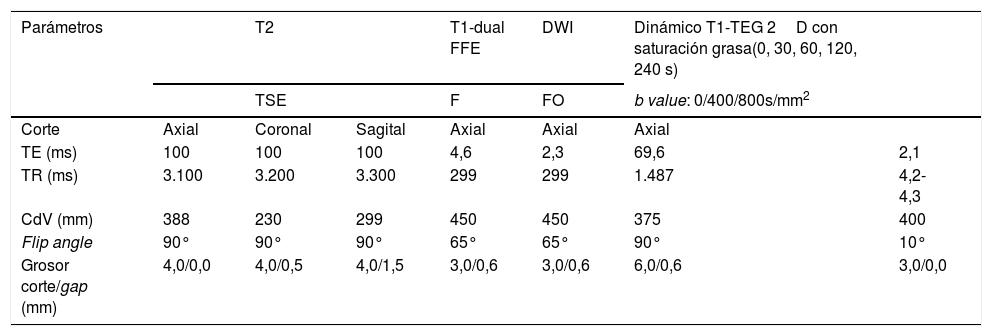
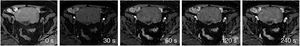
En las tablas 1 y 2 se describen las secuencias incluidas en el protocolo de estudio. En cuanto al estudio dinámico, se adquirieron imágenes sin contraste y tras la administración de este a los 30, 60, 120 y 240 segundos (fig. 1). Para este estudio, se empleó ácido gadotérico intravenoso a dosis de 0,1 mmol/kg a 4 ml/s.
Protocolo de estudio realizado en RM Philips Intera 1.0T
| Parámetros | T2 | T1 | DWI | DinámicoT1-TEG 2D con saturación grasa(0, 30, 60, 120, 240 s) | ||
|---|---|---|---|---|---|---|
| TSE | TSE | b value:0/400/800s/mm2 | ||||
| Corte | Axial | Coronal | Sagital | Axial | Axial | Axial |
| TE (ms) | 90 | 80 | 90 | 14 | 127 | 3,1 |
| TR (ms) | 3.500 | 4.000 | 3.500 | 465 | 1.900 | 6 |
| CdV (mm) | 200 | 200 | 200 | 250 | 360 | 297 |
| Flip angle | 90° | 90° | 90° | 90° | 90° | 10° |
| Grosor corte/gap (mm) | 3,0/1,0 | 3,0/0,0 | 3,0/1,0 | 4,0/1,0 | 6,0/1,0 | 4,0/2,0 |
CDV: campo de visión; TE: tiempo de eco; TEG: turbo eco de gradiente; TR: tiempo de repetición; TSE: turbo spin eco.
Protocolo de estudio realizado en RM Philips Ingenia 1.5T
| Parámetros | T2 | T1-dual FFE | DWI | Dinámico T1-TEG 2D con saturación grasa(0, 30, 60, 120, 240 s) | |||
|---|---|---|---|---|---|---|---|
| TSE | F | FO | b value: 0/400/800s/mm2 | ||||
| Corte | Axial | Coronal | Sagital | Axial | Axial | Axial | |
| TE (ms) | 100 | 100 | 100 | 4,6 | 2,3 | 69,6 | 2,1 |
| TR (ms) | 3.100 | 3.200 | 3.300 | 299 | 299 | 1.487 | 4,2-4,3 |
| CdV (mm) | 388 | 230 | 299 | 450 | 450 | 375 | 400 |
| Flip angle | 90° | 90° | 90° | 65° | 65° | 90° | 10° |
| Grosor corte/gap (mm) | 4,0/0,0 | 4,0/0,5 | 4,0/1,5 | 3,0/0,6 | 3,0/0,6 | 6,0/0,6 | 3,0/0,0 |
CDV: campo de visión; EG: eco de gradiente; F: fase; FFE: Fas Field Echo; FO: fase opuesta; TE: tiempo de eco; TEG: turbo eco de gradiente; TR: tiempo de repetición; TSE: turbo spin eco.
Todos los estudios fueron analizados en la estación de trabajo Portal IntelliSpace de Philips. El procesamiento de estos y la recogida de los resultados obtenidos corrió a cargo de dos radiólogos: un médico adjunto con más de 20 años de experiencia y un médico residente de segundo o tercer año que había recibido adiestramiento específico en este campo. A la hora de analizar las secuencias dinámicas, no tuvieron acceso al resto de secuencias del estudio de RM ni al informe de esta, ni a los datos de la historia clínica de las pacientes, por lo que desconocían el diagnóstico final de cada caso.
Análisis de la secuencia dinámicaSe marcaron dos regiones de interés: una en el miometrio (como referencia interna, con el fin de superar la limitación de la falta de reproducibilidad)14,21 y otra en el área de mayor realce de la porción sólida de la lesión (evitando áreas de necrosis o hemorragia).
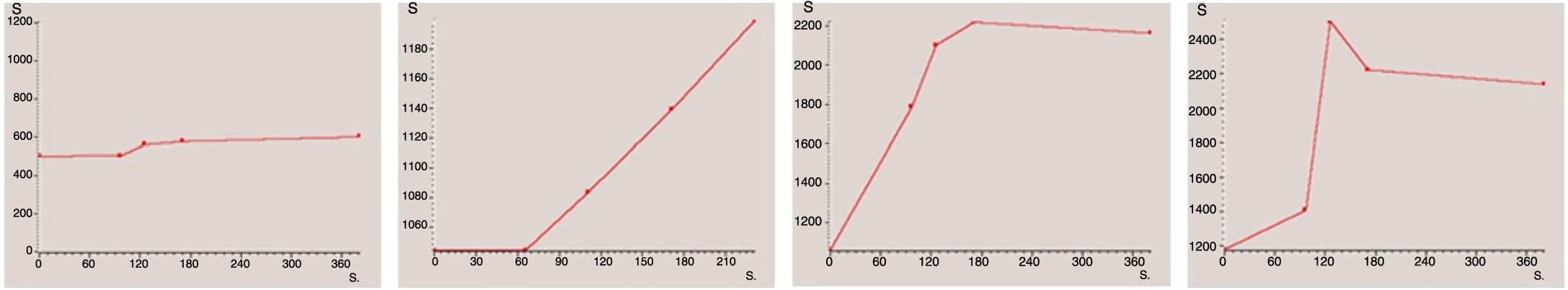
Para el análisis descriptivo, se clasificó cada caso en función de la morfología de la curva obtenida. Para este estudio, se decidió realizar una clasificación basada en cuatro tipos de curva (fig. 2): tipo 1 (sin realce o muy escaso), tipo 2 (realce progresivo), tipo 3 (realce temprano máximo seguido de fase de meseta) y tipo 4 (realce temprano máximo seguido de un lavado precoz)22. Finalmente, para el análisis estadístico se agruparon los dos primeros tipos como curvas “sin realce precoz” y los dos últimos como “con realce precoz”, por su asociación con benignidad y malignidad, respectivamente. Muchos de los trabajos publicados acerca del papel de la secuencia dinámica, incluidos aquellos sobre tumores de ovario revisados para este estudio4,11,14,23–29, clasifican las curvas de realce en solo tres tipos. En este trabajo, las curvas tipo 3 y 4 estarían englobadas dentro de las curvas tipo 3 del resto, donde agrupan todas aquellas curvas con un realce precoz máximo, tanto si se siguen de una fase de meseta como si presentan un lavado precoz.
Por último, se recogieron los datos necesarios para el análisis semicuantitativo: el realce máximo, considerado como la máxima intensidad de señal de la lesión (unidades arbitrarias de intensidad); el realce relativo, como el incremento de señal con respecto a la fase sin contraste (%); el realce relativo máximo, como “señal máxima”-”señal basal”/”señal basal (%), y el ABC, que hace referencia al número de píxeles de la lesión que presentan realce, en la suma de todas las fases. No se analizaron las velocidades de entrada y de salida debido a la falta de estandarización en los tiempos de inyección del medio de contraste.
Análisis estadísticoTodos los análisis estadísticos fueron realizados mediante el programa IBM SPSS Statistics, versión 21. La relación entre el tipo de tumor y los tipos de curva se analizó mediante la prueba de χ2, mientras que para su relación con los valores semicuantitativos se empleó la prueba no paramétrica de Kruskal-Wallis. Se consideraron significativos los resultados con p <0,05.
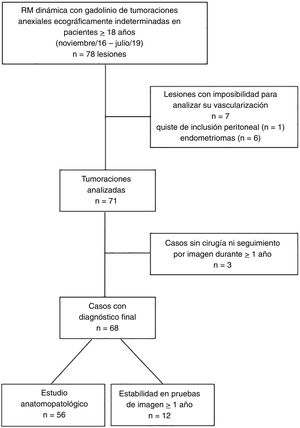
ResultadosEn total se preseleccionaron 62 estudios de RM pélvica con secuencia dinámica realizados entre noviembre de 2016 y julio de 2019: 29 realizados en la máquina de 1.0T y 33 en la de 1.5T. Las pacientes tenían una edad media de 55,4 años (rango 18-88). En 16 casos se identificaron tumoraciones ováricas bilaterales, por lo que en total se preseleccionaron 78 lesiones (fig. 3). Se excluyeron 7 lesiones (unilaterales todas), en las que no fue posible detectar ninguna zona en la que analizar su vascularización y en las que finalmente se confirmó una etiología no neoplásica: 6 endometriomas y 1 quiste de inclusión peritoneal. De las 71 lesiones analizadas, se excluyeron 3 lesiones (unilaterales) que hasta la fecha no contaban con estudio anatomopatológico ni cumplían los criterios de seguimiento: 2 pacientes con sospecha de teratomas maduros y una paciente con sospecha de un tumor borderline (diagnosticada de otro proceso neoplásico maligno, por lo que se pospuso el manejo de esta lesión). Por tanto, el diagnóstico final se obtuvo en 68 lesiones: 56 por estudio anatomopatológico de la pieza quirúrgica y 12 por su estabilidad en el tiempo en pruebas de imagen. Estas últimas, todas sospechosas por imagen (tanto ecográfica como de RM) de lesiones benignas: 2 adenomas serosos y 1 mucinoso, 1 adenofibroma, 2 fibromas y 4 teratomas maduros. En cuanto a la naturaleza de las lesiones presentes en el total de la muestra final: 36 tumores resultaron ser benignos, 8 borderline y 24 malignos (tabla 3).
Desglose de los tipos de tumores que conforman el total de la muestra del estudio
| Benignos(n=36) | Epiteliales | Adenomas mucinosos | 8 |
| Adenomas serosos | 9 | ||
| Adenofibromas serosos | 5 | ||
| Tumores de células germinales | Teratomas maduros | 6 | |
| Struma ovarii | 1 | ||
| Fibroma/Fibrotecoma | 7 | ||
| Borderline(n=8) | Serosos | 1 | |
| Seromucinosos | 2 | ||
| Mucinosos | 5 | ||
| Malignos(n=24) | Epiteliales | Serosos | 10 |
| Mucinosos | 2 | ||
| Células claras | 2 | ||
| Endometrioides | 2 | ||
| Cordones sexuales-Estroma | Células de la granulosa | 1 | |
| Metástasis | Sarcomas endometriales | 2 | |
| Intestinal y colon | 5 |
Se obtuvo un resultado de 15 curvas tipo 1, 35 curvas tipo 2, 16 curvas tipo 3 y 2 curvas tipo 4. Tras agruparlas, se englobaron, dentro del grupo “sin realce precoz”, un total de 50 curvas (15 + 35), y dentro del grupo denominado “con realce precoz”, un total de 18 curvas (16 + 2).
Presentaron curvas “sin realce precoz” el 91,67% de los tumores benignos y el 100% de los tumores borderline (figs. 4 y 5), así como el 37,5% de los tumores malignos. Mostraron curvas “con realce precoz” un 62,5% de los tumores malignos (fig. 6) y solo un 8,3% de los benignos. Las diferencias entre las curvas de los tumores benignos y borderline con las de los malignos fueron significativas (p <0,001 en la prueba de χ2) (tabla 4).
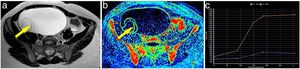
Ejemplo de tumor ovárico benigno. Mujer de 23 años con una tumoración en anejo derecho a estudio. En la secuencia T2 del estudio de resonancia magnética se observa una lesión quística con tabiques finos (A). Estos tabiques presentaban una captación muy escasa tras la administración de contraste, como se puede apreciar en el mapa de realce máximo (B). Tras marcar la región de interés, se obtiene sobre uno de ellos (flecha) una curva de tipo 1 (curva azul: lesión; curva naranja: miometrio) (C). El resultado anatomopatológico de la lesión confirmó el diagnóstico de cistoadenoma mucinoso de ovario.
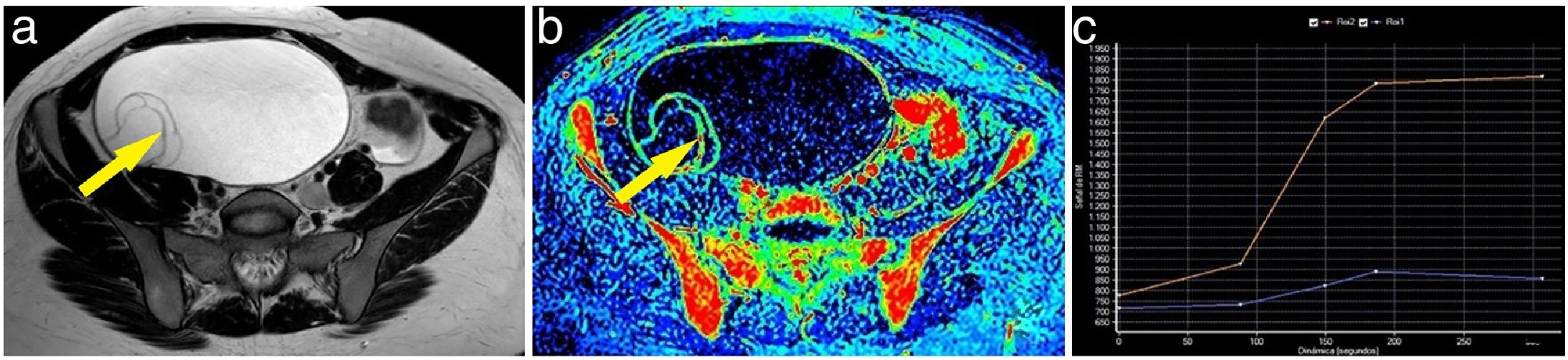
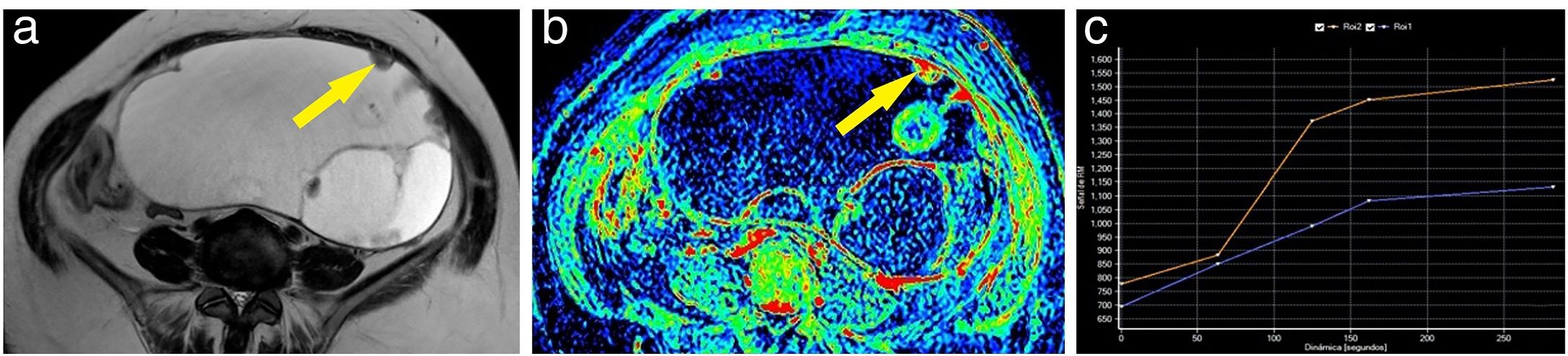
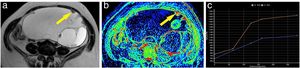
Ejemplo de tumor ovárico borderline. Mujer de 62 años con una lesión abdominopélvica dependiente del anejo izquierdo, quística, con múltiples tabiques finos y algún nódulo y lóculos de diferentes intensidades en la secuencia T2 (A). Tras la administración de gadolinio, algunas zonas de la lesión presentaban un realce discreto como se aprecia en el mapa de realce máximo (B). Se marcó como región de interés uno de los nódulos (flecha), obteniendo una curva (curva azul: lesión; curva naranja: miometrio) que mostraba un realce progresivo; por tanto, curva de tipo 2 (C). Se intervino a la paciente, y se confirmó el diagnóstico de un tumor anexial mucinoso borderline.
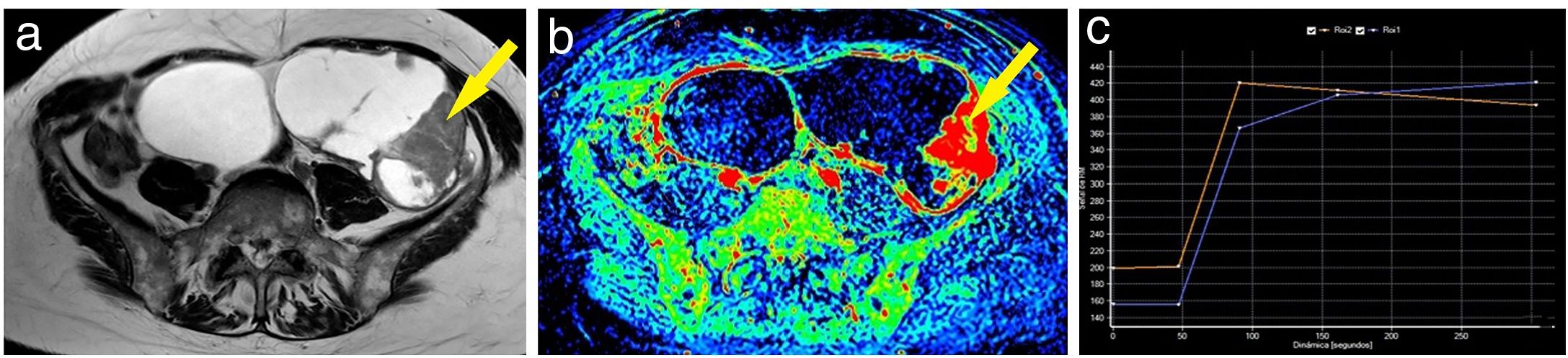
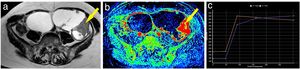
Ejemplo de tumor ovárico maligno. Mujer de 60 años con tumoraciones ováricas bilaterales, ambas poliquísticas y multitabicadas con tabiques gruesos; la izquierda (de mayor tamaño) presentaba además múltiples nódulos sólidos (A). En el mapa de realce máximo se pudo apreciar cómo tanto los tabiques gruesos como los nódulos izquierdos captaban gadolinio de forma intensa (B). En la imagen se aprecia la curva (curva azul: lesión; curva naranja: miometrio) obtenida sobre uno de los nódulos murales izquierdos (flecha), con un realce temprano máximo seguido de una fase de meseta y, por tanto, curva de tipo 3 (C). Se realizó una anexectomía bilateral cuyo resultado anatomopatológico fue de carcinoma seroso bilateral.
La prueba de Kruskal-Wallis mostró una relación estadísticamente significativa entre el grupo de tumores malignos y los valores más altos de los siguientes parámetros: realce máximo (p=0,002), porcentaje de realce relativo máximo (p=0,006) y porcentaje de realce relativo (p=0,018); por el contrario, no se obtuvo una relación estadísticamente significativa entre el valor de ABC y estos tumores (p=0,114) (tabla 5). El realce máximo fue el parámetro que demostró presentar mayor fiabilidad para la detección de lesiones malignas, con una sensibilidad del 70,8% y una especificidad del 72,7% en aquellas tumoraciones con un realce máximo superior a 568,45 (en unidades arbitrarias de intensidad).
Medias y desviaciones estándar de los valores de los parámetros semicuantitativos en cada grupo de tumores. Significación estadística (prueba de Kruskal-Wallis) de las diferencias entre el grupo de tumores malignos y los otros dos
| Benignos | Borderline | Malignos | Sig. estadística | |
|---|---|---|---|---|
| Realce máximo | 466,51 (±307,77 DE) | 384,58 (±267,91 DE) | 689,77 (±252,52 DE) | p=0,002 |
| Realce relativo (%) | 48,60 (±37,08 DE) | 66,38 (±51,03 DE) | 77,80 (±42,54 DE) | p=0,018 |
| Realce relativo máximo (%) | 51,07 (±29,72 DE) | 48,79 (±29,42 DE) | 69,06 (± 27,86 DE) | p=0,006 |
| ABC | 60.906,89 (±5.348,38 DE) | 52.307,41 (± 52.307,41 DE) | 84.937,99 (±52.548,92 DE) | p=0,114 |
Los resultados del presente trabajo demuestran que incluir la secuencia dinámica en el protocolo de RM del estudio de una tumoración anexial contribuye a identificar tumores malignos de ovario.
El estudio dinámico permite valorar los cambios en la intensidad de señal que experimenta una lesión en distintos tiempos tras la administración de gadolinio, lo que tiene relación con la neoangiogénesis tumoral. Esto la hace más sensible que otras secuencias para detectar lesiones malignas30, las cuales, al estar más neovascularizadas presentarán un realce más rápido e intenso. Aunque el uso de esta secuencia está cada vez más estandarizado en el estudio de neoplasias en otras localizaciones (mama, próstata, etc.31–33), no es así en el ovario; si bien, cada vez existe mayor interés acerca de su papel en la categorización de los tumores anexiales.
El estudio dinámico permite realizar un análisis cuantitativo (en relación con parámetros farmacocinéticos), semicuantitativo y/o descriptivo; este último, basado en el análisis de la morfología de la curva obtenida que relaciona la intensidad de realce con el tiempo.
Centrándonos en el objetivo principal de nuestro estudio, que es valorar el papel del tipo de curva para identificar tumores ováricos malignos y diferenciarlos de los borderline, nuestros resultados muestran una relación significativa entre las curvas con un realce precoz y las lesiones malignas, mientras que las borderline y benignas se asocian a curvas con un patrón de realce tardío. Estos datos parecen corroborar los resultados obtenidos en los escasos estudios publicados hasta la fecha4,11,24–29. Parte importante de la bibliografía a este respecto la constituyen los estudios y revisiones de Thomassin-Naggara4,11,14,23, que relacionan las curvas con realce precoz y los tumores malignos.
Con respecto al análisis semicuantitativo, entre los estudios publicados4,24–26,28,29,34–36 existen discrepancias con respecto a qué parámetros dar mayor importancia. En nuestro caso, los resultados obtenidos muestran una relación significativa entre la amplitud de los parámetros semicuantitativos relacionados con el realce (máximo, relativo y relativo máximo) y la posibilidad de lesiones anexiales malignas.
Aunque existen otros trabajos que analizan más específicamente la morfología de las curvas intensidad-tiempo y los parámetros semicuantitativos del estudio dinámico24–26,28,29, solo unos pocos categorizan como el nuestro los tumores en benignos, borderline y malignos. Esta diferenciación es crucial a la hora determinar el tratamiento que debe seguirse en cada caso: mientras que los tumores benignos no suelen requerir resección quirúrgica (salvo casos individualizados como presencia de manifestaciones clínicas, riesgo de torsión, voluntad expresa de la paciente, etc.), los borderline y los malignos sí8,9. Además, estos dos últimos requieren diferentes tipos de cirugía, cuya planificación se ve facilitada por los resultados de la RM, pudiendo llegar a implicar en algunos casos un cambio de centro para realizar el procedimiento.
Excluyendo el trabajo de Singla et al29, con un número de casos bajo y solo dos tumores borderline, solamente el de Li et al.26 contempla el comportamiento de los tumores borderline como grupo de tumor independiente. Encuentran que el tipo de curva permite diferenciar las lesiones malignas de las borderline y benignas (sensibilidad del 83% y especificidad del 75%); concretamente, al igual que en nuestro estudio, observan que las borderline se asocian de forma estadísticamente significativa a tipos de curva sin realce precoz. Con respecto a su análisis semicuantitativo (tiempo medio de realce, pendiente máxima y realce máximo), a diferencia de nuestro trabajo, el suyo no mostró diferencias significativas entre tumores malignos y borderline.
También parece interesante el hecho de que algunos de los trabajos previamente mencionados hayan valorado simultáneamente el valor de las secuencias de difusión para este mismo cometido. Sin embargo, encuentran que estas, a pesar de ser útiles, los son en menor grado que los estudios dinámicos11,29.
Dentro de las limitaciones del presente estudio, se encuentran el hecho de que se trate de un estudio retrospectivo, que esté realizado en un solo centro y que se hayan empleado dos equipos de RM con diferente intensidad de campo magnético, lo que puede afectar al tipo de muestra analizada, si bien no se efectuó un estudio comparativo entre los exámenes realizados en uno y otro equipo. Además, como limitación principal, hay que destacar el hecho de que se realizó un estudio dinámico con varias adquisiciones, lo que puede suponer una desventaja clara con respecto al estudio de perfusión: una menor resolución temporal30 y, por tanto, menor exactitud a la hora de determinar el tipo de curva y valorar patrones semicuantitativos como “realce temprano” o “velocidades de entrada y de salida”. Sin embargo, cabe destacar que los resultados obtenidos tanto en nuestro estudio en el de Mansour25 no aportan apenas diferencias con respecto a los de perfusión4,11,24,26–29 en cuanto al valor del análisis descriptivo del tipo de curva. Otra limitación que nos encontramos es el escaso número de tumores borderline, con solo 8 de los 68 casos de nuestro estudio.
ConclusionesCon el presente estudio se demuestra que, a la hora de valorar tumoraciones ováricas ecográficamente indeterminadas, la secuencia dinámica con gadolinio resulta de gran utilidad para categorizarlas, en función de su naturaleza, en benignos, borderline o malignos. Concretamente, la asociación de los tumores malignos con las curvas con realce precoz y con parámetros de realce semicuantitativos permite diferenciar estos tumores de los benignos y borderline.
Por tanto, en este contexto, incluir dicha secuencia en el protocolo de estudio por RM puede ser de gran ayuda a la hora de realizar un diagnóstico prequirúrgico más fiable.
Autoría- 1.
Responsable de la integridad del estudio: SAC y JCGO.
- 2.
Concepción del estudio: SAC y JCGO.
- 3.
Diseño del estudio: SAC y JCGO.
- 4.
Obtención de los datos: SAC y MFC.
- 5.
Análisis e interpretación de los datos: SAC y JCGO.
- 6.
Tratamiento estadístico: SAC y JCGO.
- 7.
Búsqueda bibliográfica: SAC y MFC.
- 8.
Redacción del trabajo: SAC.
- 9.
Revisión crítica del manuscrito con aportaciones intelectualmente relevantes: SAC, MFC y MFC.
- 10.
Aprobación de la versión final: SAC, MFC y MFC.
La presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.