Conocer el rendimiento diagnóstico de la biopsia con aguja gruesa (BAG) ecoguiada en nódulos tiroideos con dos punciones aspirativas con aguja fina (PAAF) previas no diagnósticas. Evaluar complicaciones de la BAG. Analizar la fiabilidad de los diagnósticos obtenidos mediante BAG. Medir el impacto económico de evitar lobectomía tras BAG con resultado benigno.
Material y métodosRevisión retrospectiva de 195 BAG realizadas en 178 pacientes. Las referencias utilizadas para medir la fiabilidad de los resultados de la BAG fueron el análisis de la pieza quirúrgica tras una biopsia con malignidad o proliferación folicular (PF) y la estabilidad ecográfica superior a 1 año tras una BAG benigna. Se compararon costes directos de BAG más seguimiento ecográfico frente al que hubiera tenido realizar lobectomía sin complicaciones en los pacientes con estabilidad ecográfica superior a 1 año tras BAG benigna.
ResultadosDe los 195 nódulos sometidos a BAG, el resultado fue diagnóstico en 179 (91,7%), incluyendo 122 benignos (62,5%), 50 PF (25,6%) y 7 malignos (3,6%). No fue diagnóstico en 16 nódulos (8,3%). Hubo complicaciones menores en 4 pacientes (2%) y mayores en ninguno. La sensibilidad de la BAG para el diagnóstico de cáncer de tiroides fue baja (42,8%) por su incapacidad para detectar invasión capsular o vascular, aunque con especificidad y valor predictivo positivo (VPP) del 100%. Al considerar los diagnósticos de malignidad y PF como positivos, pues ambos obligan a resección quirúrgica, la sensibilidad ascendió al 97,5%, con descenso al 83,3% del VPP. Hubo 79 nódulos con seguimiento ecográfico superior a 1 año, 76 con BAG benigna (96,2%), de los cuales mostraron estabilidad 74 (97,3%). El valor predictivo negativo (VPN) para malignidad de los nódulos benignos fue del 98,6%, aunque no se detectó ninguna transformación maligna. Sin embargo, el análisis estadístico no permite recomendar la supresión del seguimiento ecográfico tras BAG benigna. La reducción del coste diagnóstico respecto a lobectomía en pacientes con nódulos benignos y estabilidad ecográfica superior a 1 año fue próxima al 90%.
ConclusionesLa BAG de tiroides es efectiva porque diagnostica más del 90% de los nódulos con PAAF no diagnósticas; segura si es realizada por personal experimentado; fiable porque presenta especificidad y VPP del 100% en nódulos malignos, sensibilidad del 97,5% para detectar que nódulos necesitan cirugía y VPN del 98,6% en nódulos benignos; y eficiente porque reduce los costes diagnósticos respecto a lobectomía en nódulos benignos.
To determine the diagnostic performance of ultrasound-guided core-needle biopsy in thyroid nodules after two inconclusive fine-needle aspiration biopsies. To assess the complications of core-needle biopsy. To analyze the reliability of diagnoses obtained with core-needle biopsy. To measure the economic impact of avoiding lobectomies in patients with benign core-needle biopsy findings.
Material and methodsThis retrospective study reviewed 195 core-needle biopsies in 178 patients. To determine the reliability of the core-needle biopsy findings, we compared the diagnosis from the core-needle specimen versus the histologic findings in the surgical specimens when core-needle biopsy findings indicated malignancy or follicular proliferation and versus the stability of the nodule on ultrasound follow-up for one year when core-biopsy findings indicated benignity.
ResultsCore-needle biopsy yielded a diagnosis for 179 (91.7%) nodules, of which 122 (62.5%) were classified as benign, 50 (25.6%) as follicular proliferation, and 7 (3.6%) as malignant. The findings were inconclusive for 16 (8.3%) nodules. Minor complications were observed in 4 (2%) patients; no major complications were observed. The sensitivity of core-needle biopsy for the diagnosis of thyroid cancer was low (42.8%) because the technique was unable to detect capsular or vascular invasion, although the specificity and positive predictive value (PPV) were 100%. However, when we considered histologic findings of malignancy and follicular proliferation positive because both require surgical resection, the sensitivity increased to 97.5% and the PPV decreased to 83.3%. There were 79 nodules with ultrasound follow-up for at least one year; 76 (96.2%) had negative core-needle biopsy findings, and 74 (97.3%) of these remained stable. The negative predictive value (NPV) for malignancy of the benign nodules was 98.6%, although no malignant transformation was observed. Nevertheless, the results of the statistical analysis do not allow us to recommend forgoing ultrasound follow-up in patients with benign core-biopsy findings. The cost savings of avoiding lobectomy in patients with benign nodules and stability of the nodule on ultrasound follow-up for at least one year was about 90%.
ConclusionsCore-needle biopsy of thyroid nodules is effective because it diagnoses more than 90% of nodules with inconclusive findings after fine-needle aspiration biopsy. It is safe if done by experienced professionals. It is reliable because it yields 100% specificity and 100% PPV for malignant nodule, 97.5% sensitivity for the detection of nodules that require surgery, and 98.6% NPV for benign nodules. It is efficient because it reduces the costs of diagnosis compared to lobectomy in benign nodules.
La punción aspirativa con aguja fina (PAAF) ecoguiada es la técnica de elección para valorar la patología nodular tiroidea por su facilidad de realización, rendimiento diagnóstico y mínimas complicaciones. Su principal inconveniente es la proporción de punciones no diagnósticas, debido a obtención de material insuficiente o hemático (categoría I del Bethesda System For Reporting Thyroid Cytopathology, TBSRTC)1. Supone un 10-33% de las punciones1–9, con un riesgo estimado de malignidad del 5-10%1. Otras causas de punciones no diagnósticas son aquellas con atipia o lesión folicular de significado indeterminado (Bethesda III), suponen un 15-40% de las punciones2,4–7 y tienen un riesgo estimado de malignidad del 6-18%1. Otras publicaciones describen genéricamente un 20-30% de punciones no diagnósticas10–12.
Repetir la PAAF consigue diagnosticar un 60-80% de los casos2,4,8,10–13. En los nódulos con PAAF repetidamente no diagnósticas se recomienda lobectomía, especialmente en aquellos con alta sospecha ecográfica de malignidad, crecimiento significativo en los controles ecográficos o cuando existen factores clínicos de riesgo de cáncer de tiroides1,2,4,8,11,14. Sin embargo, esta estrategia implica asumir los riesgos y costes de la cirugía, lo que provoca una sobrecarga en el sistema sanitario por la gran prevalencia de los nódulos tiroideos, especialmente en mujeres mayores de 50 años2,3.
La biopsia con aguja gruesa (BAG) ecoguiada ha mostrado resultados prometedores en cuanto a rendimiento diagnóstico y seguridad en estos pacientes3–9,12–15. La guía de la American Thytoid Association (ATA) no la incluye aún entre sus recomendaciones por ausencia de evidencias suficientemente fuertes2, mientras que la American Association of Clinical Endocrinologists, el American College of Endocrinology y la Associazione Medici Endocrinologi (AACE/ACE/AME) sugieren su utilización en nódulos con PAAF repetidamente no diagnósticas16, y la Korean Society of Thyroid Radiology (KSThR) amplia las recomendaciones a nódulos con PAAF indeterminada o con diagnóstico citológico dificultoso4,6. También se han descrito buenos resultados como técnica diagnóstica inicial, sin PAAF previa10,11. Las principales limitaciones de la BAG son el riesgo de complicaciones cervicales, ya que exige una realización cuidadosa y mayor tiempo de aprendizaje que la PAAF4, la ausencia de estandarización en sus categorías diagnósticas4,8–10 y el pequeño tamaño de las muestras, que impide detectar invasión capsular o vascular tras un diagnóstico de proliferación folicular, lo que obliga a realizar lobectomía para diferenciar entre adenoma y carcinoma folicular3,4,6,9–12,15.
Nuestros objetivos son conocer el rendimiento diagnóstico de la BAG en nódulos con dos PAAF previas no diagnósticas, evaluar sus complicaciones, analizar la fiabilidad de los diagnósticos obtenidos y medir el impacto económico de evitar lobectomía tras BAG con resultado benigno.
Material y métodosDiseño del estudioAnte la elevada proporción de PAAF no diagnósticas en nuestro centro y los consiguientes problemas de demora y sobrecoste asistencial, en 2011 se creó una unidad multidisciplinar (UM) compuesta por un radiólogo, un patólogo, una especialista en medicina interna y una cirujana endocrina, todos ellos con una experiencia de más de 8 años en sus respectivas áreas de conocimiento sobre patología nodular tiroidea, para que consensuaran en reuniones periódicas el manejo de estos pacientes. La realización de las PAAF por varios radiólogos con diverso nivel de experiencia y la limitada disponibilidad para valorar la idoneidad de las muestras in situ debido al consumo de tiempo que genera este procedimiento para ecografistas y patólogos (ambos con elevada carga asistencial en sus jornadas de trabajo), dificultaba mejorar significativamente el rendimiento de las PAAF. Con base en algunas publicaciones3,12 se decidió realizar BAG en todos los nódulos con dos PAAF no diagnósticas y que cumpliesen los criterios para punción de la guía de la ATA vigente en ese momento17.
Este estudio es una revisión retrospectiva de todas las BAG realizadas entre diciembre del 2011 y enero del 2019. Ha sido aprobado por el comité de ética del centro, el cual ha precisado que no se necesita el consentimiento informado de los participantes por presentar datos agregados y considerar que la investigación es sobre una actividad instaurada previamente en la práctica asistencial de la institución.
La información sobre técnica, complicaciones y resultados de las biopsias, así como de los seguimientos ecográficos, se obtuvo del sistema radiológico local. La información sobre cirugía, anatomía patológica de las piezas quirúrgicas y número de consultas de revisión se obtuvo de la historia clínica digital de cada paciente.
Procedimiento de la biopsiaTras la decisión colegiada de BAG y antes de asignar una cita para su realización, el radiólogo miembro de la UM revisa el historial clínico del paciente en busca de alteraciones analíticas o toma de medicamentos que aumenten la posibilidad de hemorragia, aunque la biopsia tiroidea es considerada un procedimiento con bajo riesgo de sangrado18,19. Si no se dispone de ningún análisis en el último año en el que figuren los niveles de plaquetas o el índice internacional normalizado (INR), se solicita uno para ser realizado pocos días antes de la biopsia. En caso de alteraciones significativas (plaquetas<50.000/μl, INR> 2) o de recibir medicamentos que precisen cambiar su dosificación antes de la BAG, se comunica al servicio de hematología o al responsable del tratamiento el día en que se realizará la biopsia, para que adopten las medidas apropiadas en cuanto a su modificación y reintroducción tras la BAG.
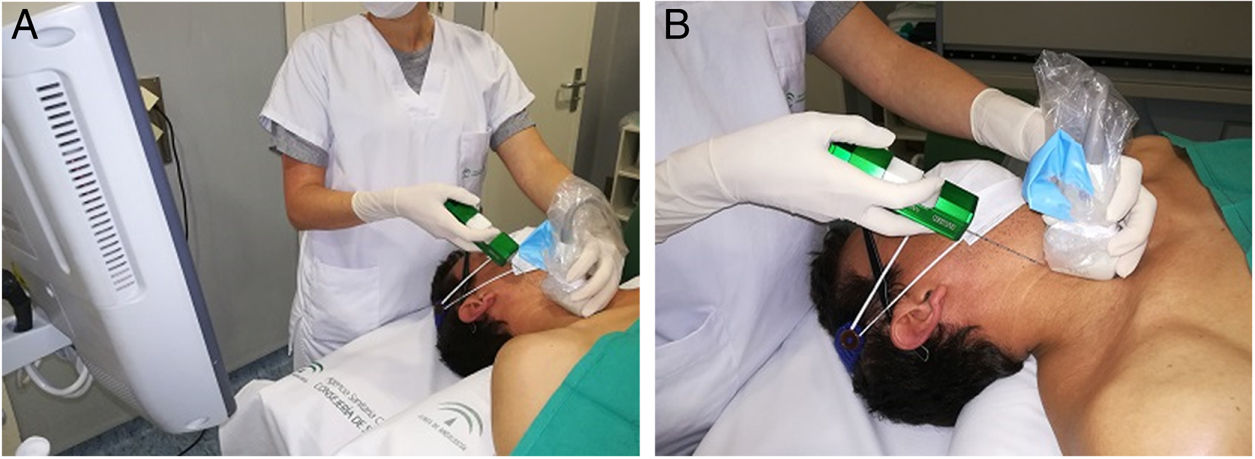
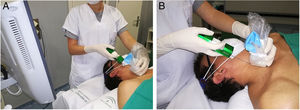
El radiólogo miembro de la UM realizó todas las BAG. Se obtuvo consentimiento por escrito en todos los casos tras informar de las ventajas y riesgos de la prueba. Con el cuello hiperextendido y generalmente situándose detrás del paciente (fig. 1) para permitir un abordaje longitudinal en sentido craneocaudal que permita visualizar en un mismo plano la aguja y el objetivo, se esteriliza la piel con povidona yodada o clorhexidina, se administran 10ml (200mg) de mepivacaína subcutánea al 2%, se realiza pequeña incisión cutánea que facilite la entrada de la aguja en la grasa subcutánea cervical, y tras posicionar la punta de la aguja en el borde del nódulo, se realiza BAG con aguja de calibre 18 G y pistola de avance automático (Magnum®, Bard Medical Division, Covington, Georgia, EE.?UU.), con la que se obtienen cilindros de 15 o 22 mm de longitud, según el tamaño y posición del nódulo. Se realizan dos pases con técnica de manos libres, y excepcionalmente un tercero si la inspección visual muestra escasez de tejido. Tras comprimir una media de 5 minutos y en ausencia de hemorragia u otras complicaciones, la incisión cutánea es cubierta con adhesivos cutáneos más apósito estéril y se despide al paciente, con la recomendación de que acuda a nuestro servicio al día siguiente para revisión. Los cilindros se envían en formol al laboratorio y son examinados siempre por el patólogo miembro de la UM. En caso de resultado maligno se comunica este dato a los demás miembros de la UM y se asigna una cita preferente en el servicio de cirugía. El resto de los resultados son presentados en la siguiente reunión de la UM, para toma colegiada de decisiones.
Abordaje para realizar biopsia con aguja gruesa. A) El paciente está en decúbito supino. El cuello se coloca hiperextendido y girado en sentido contrario a la localización del nódulo. Se ayuda a la hiperextensión colocando una almohada bajo los hombros. La radióloga se sitúa a la cabecera del paciente, de pie o sentada, según la altura de la camilla, con el ecográfo situado a su lado y la pantalla girada hacia ella para controlar continuamente la progresión de la aguja en el interior del cuello, en dirección longitudinal y sentido craneocaudal, dejando normalmente fuera del plano de punción a la vía aérea y los vasos cervicales. Si el nódulo se localiza en el polo inferior del lóbulo tiroideo y mide menos de 15mm de diámetro en el eje longitudinal se plantea el abordaje transístmico, para evitar punción en las confluencias vasculares cervicosubclavias o en los vértices pulmonares y el riesgo de hematoma mediastínico o neumotórax al utilizar una pistola de biopsia con avance mínimo de la aguja de 15mm. B) Se muestran el transductor y la aguja en el mismo plano, en el eje craneocaudal. El transductor se cubre con una funda estéril, para mantener la asepsia de la zona de punción.
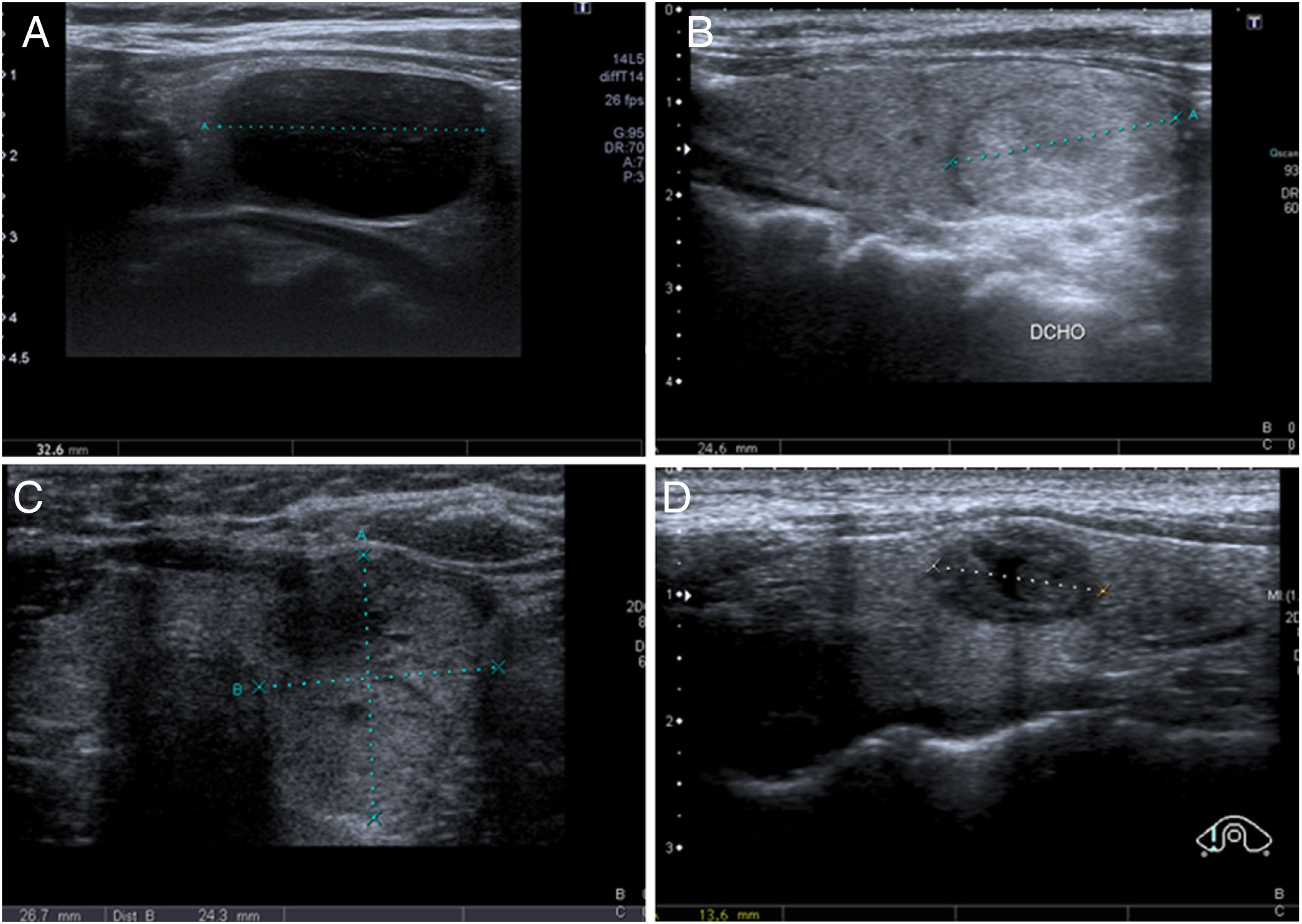
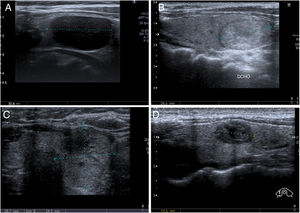
Los diagnósticos obtenidos mediante BAG de tiroides no están estandarizados, al contrario que en la PAAF. En nuestra institución utilizamos una clasificación similar a la descrita en sus artículos por Paja et al.10,11, con cuatro categorías diagnósticas principales: insuficiente (I); benigna (B), que incluye hiperplasia adenomatosa y tiroiditis; proliferación folicular o de células de Hürthle (PF), incluyendo adenoma y carcinoma folicular/de células de Hürthle; y malignas (M), que incluyen el carcinoma papilar, el medular y otros tipos menos frecuentes (linfoma, metástasis, etc.). En la figura 2 se muestran ejemplos de cada categoría. En algunos trabajos utilizan el mismo TBSRTC de las PAAF8,9,20, mientras que en otros proponen una adaptación con leves modificaciones4,6.
Categorías diagnósticas de la biopsia con aguja gruesa (BAG) de tiroides. A) Insuficiente (I): Mujer de 58 años. Nódulo con sospecha ecográfica intermedia de malignidad (nódulo sólido e hipoecogénico, de contorno ovalado y sin microcalcificaciones) y con diámetro superior a 1cm. BAG con resultado insuficiente. En la unidad multidisciplinar (UM) se decidió realizar lobectomía diagnóstica, con resultado de carcinoma papilar con márgenes libres, en contexto de nódulo coloide y bocio. B) Benigno (B): Mujer de 56 años. Nódulo con baja sospecha ecográfica de malignidad (sólido e isoecogénico, de contorno ovalado y sin microcalcificaciones) y con diámetro superior a 1,5cm. BAG con resultado de hiperplasia adenomatosa. Estabilidad ecográfica posterior de 18 meses. C) Proliferación folicular (PF): Mujer de 55 años. Nódulo con alta sospecha ecográfica de malignidad (sólido e isoecogénico, sin microcalcificaciones, pero “más alto que ancho” en el plano axial) y con diámetro superior a 1cm. BAG con resultado de PF. En cirugía se diagnosticó carcinoma folicular. D) Malignidad (M): Mujer de 34 años. Nódulo con alta sospecha ecográfica de malignidad (sólido e hipoecogénico, con pequeña área central quística y de contornos microlobulados) y con diámetro superior a 1cm. Se realizó una punción aspirativa con aguja fina, con resultado Bethesda III, y en la UM se decidió realizar BAG, con la que se obtuvo un resultado de carcinoma medular, confirmado posteriormente por cirugía.
Los diagnósticos M y PF obligan a realizar lobectomía. Un diagnóstico benigno (salvo en nódulos muy sintomáticos, que serían candidatos a cirugía) acarrea seguimiento ecográfico y clínico para descartar cambios en las características ecográficas o crecimiento significativo que sugieran un falso negativo (FN) para cáncer de tiroides, lo que obligaría a repetir la biopsia. Tanto los signos ecográficos de sospecha como el crecimiento significativo se definen en diversas guías2,16,21. Se recomienda, al igual que tras PAAF con resultado benigno, realizar la primera ecografía a los 12 meses de la biopsia y dos posteriores cada 18 meses. No prolongar el seguimiento más de 5 años si no hay cambios2.
Hay otros resultados (tejido tiroideo normal, fibrosis/tejido fibromuscular, esclerosis) que normalmente indican punción fallida del nódulo y obtención de muestra del tejido circundante, ya sea por pequeño tamaño del nódulo, por su localización posterior o inferior que dificulta el acceso y aumenta el riesgo de lesión de estructuras circundantes, o por ambas razones4,10–12. Tanto en estos casos, que definimos como muestra inadecuada, como en los de diagnóstico I, la decisión de repetir BAG, realizar cirugía o iniciar seguimiento se tomó en la UM en función de las características ecográficas y factores de riesgo para malignidad.
Análisis de costes tras biopsia con aguja gruesa con resultado benignoEl coste total del diagnóstico en cada paciente con BAG benigna incluye un análisis de sangre previo si no existe ninguno reciente, la BAG, el análisis histopatológico de las muestras, una revisión en consulta de medicina interna para comunicar el resultado y prescribir el seguimiento, una ecografía de control en 12 meses, y otra revisión con medicina interna y alta de seguimiento hospitalario si no hay cambios, con derivación a atención primaria para controles sucesivos. Si se hubiera realizado lobectomía diagnóstica en estos pacientes, el coste total incluiría preoperatorio completo, cirugía, tiempo de hospitalización, análisis histopatológico de la pieza quirúrgica, una revisión de la herida quirúrgica en consulta de enfermería y una revisión en consulta de cirugía, con alta de seguimiento hospitalario y derivación a atención primaria. Consideramos un día como el tiempo de hospitalización estándar tras una lobectomía sin complicaciones porque así fue en el 86,2% de las 503 lobectomías realizadas en nuestra institución desde 2011. La información sobre estos costes se muestra en la tabla 1.
Comparación de costes entre biopsia con aguja gruesa guiada por ecografía de la glándula tiroides y lobectomía no complicada
| BAG | Lobectomía | ||||
|---|---|---|---|---|---|
| Procedimiento | Código (1) | Costes (euros) | Procedimiento | Código (1) | Costes (euros) |
| Preoperatorio | (2) | 10,07 | Preoperatorio | (3) | 263,93 |
| BAG | III.1.1.8.18 | 244,20 | Lobectomía sin complicaciones | III.2.1.6.2 | 3428,61 |
| Hospitalización | III.1.4.5 | 603,7/día | |||
| Análisis histopatológico | III.3.1.1.5.18 | 73,36 | Análisis histopatológico | III.3.1.1.5.18 | 73,36 |
| Revisión médica ambulatoria posbiopsia | III.2.3.2 | 54,58 | Revisión médica ambulatoria poscirugía | III.2.3.2 | 54,58 |
| Ecografía de seguimiento posbiopsia | III.3.1.2.1.5.1 | 36,92 | Revisión de enfermería ambulatoria poscirugía | I.3.1 | 20,88 |
BAB: biopsia con aguja gruesa.
1. Códigos para cada procedimiento. Disponibles en: https://www.juntadeandalucia.es/servicioandaluzdesalud/profesionales/recursos-para-profesionales/precios-publicos
2. Incluye análisis de sangre con hemograma (III.3.1.3.1.309, 5,30 euros) y test de hemostasia (III.3.1.3.1.444, 4,77 euros).
3. Incluye: valoración preoperatoria por anestesia y cirugía (III.2.3.1; 114, 12 euros cada consulta), radiografía de tórax (III.3.1.2.1.1.1, 9,23 euros), electrocardiograma (III.3.4.11, 16,23 euros), análisis de sangre con hemograma (III.3.1.3.1.309, 5,30 euros) y test de hemostasia (III.3.1.3.1.444, 4,77 euros).
No se incluyen los costes de PAAF previas (238,91 euros cada PAAF, código III.3.1.1.2.14), del seguimiento extrahospitalario, ni costes indirectos, como el número de horas de trabajo perdidas.
Análisis estadísticoSe realiza un análisis descriptivo de distribución de frecuencias para variables cualitativas.
En los pacientes sometidos a cirugía, la referencia utilizada para medir la fiabilidad de la BAG fue el resultado del análisis anatomopatológico de la pieza quirúrgica. Inicialmente consideramos BAG positivas solo a aquellas con diagnóstico de malignidad. La detección en la pieza quirúrgica de carcinoma en el área biopsiada se consideró verdadero positivo (VP), mientras que su ausencia se consideró falso positivo (FP). Por el contrario, consideramos BAG negativas aquellas sin diagnóstico de malignidad, y la detección en la pieza quirúrgica de carcinoma en el área biopsiada se consideró falso negativo (FN), mientras que su ausencia se consideró verdadero negativo (VN).
Posteriormente, consideramos los diagnósticos de M y PF como positivos, al igual que en publicaciones precedentes10,11, pues ambos obligan a realizar lobectomía. La detección en la pieza quirúrgica de carcinoma o adenoma folicular en el área biopsiada se consideró VP, mientras que su ausencia se consideró FP. Por el contrario, consideramos BAG negativas aquellas sin diagnóstico de M o PF, y la detección en la pieza quirúrgica de carcinoma o adenoma folicular en el área biopsiada se consideró FN, mientras que su ausencia se consideró VN.
En los pacientes no sometidos a cirugía, la referencia para medir la fiabilidad de la BAG fue estabilidad ecográfica superior a 1 año, que es la más utilizada7,9,13,15. Consideramos BAG positivas aquellas con resultado no benigno, y la detección de crecimiento o cambios ecográficos significativos se consideró VP, mientras que la estabilidad ecográfica se consideró FP. Consideramos BAG negativas aquellas con diagnóstico benigno, y la detección de crecimiento o cambios ecográficos significativos se consideró FN, mientras que la estabilidad ecográfica se consideró VN.
En ambos grupos de pacientes se midieron la sensibilidad (S), la especificidad (E), el valor predictivo positivo (VPP) y el valor predictivo negativo (VPN) para cáncer de tiroides. En los pacientes no sometidos a cirugía también se valoró la relación entre BAG con resultado benigno y estabilidad ecográfica superior a 1 año mediante la prueba exacto de Fisher, considerando significativo un valor de p <0,05.
El análisis estadístico fue realizado con el software EPIDAT, versión 3.1 (Departamento de Epidemiología, Dirección Xeral de Sáude Pública de la Xunta de Galicia, Santiago de Compostela, España).
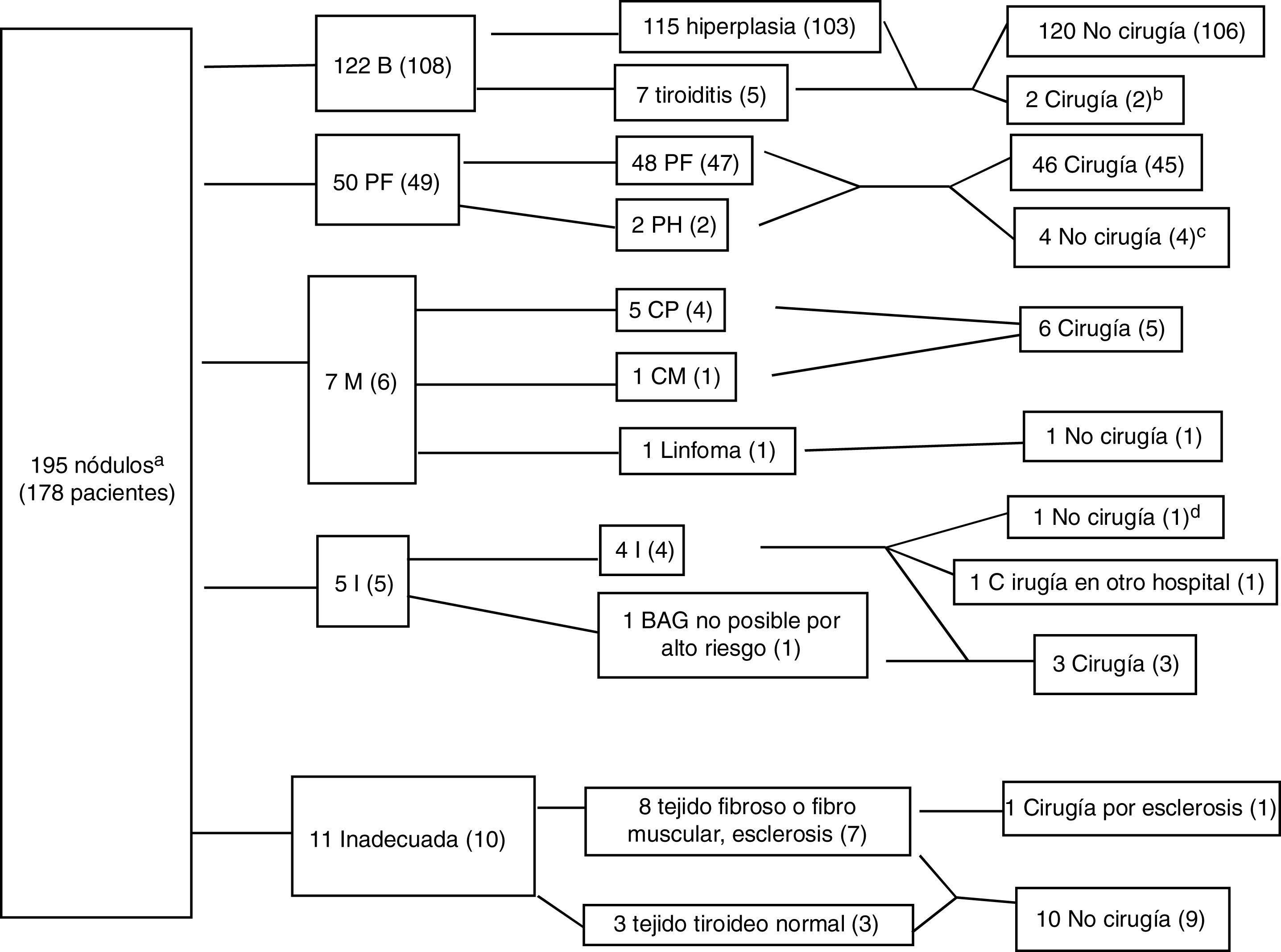
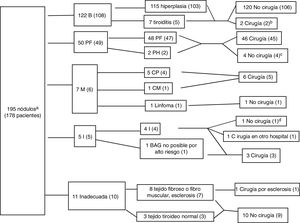
ResultadosSe realizo BAG en 195 nódulos de 178 pacientes (83,1% mujeres, edad media 55,2 años con desviación estándar de 12,56 años), con diagnóstico citológico previo Bethesda I en el 98,4% de los nódulos. La figura 3 muestra los diagnósticos y la distribución entre pacientes sometidos y no sometidos a cirugía para cada resultado. La BAG fue diagnóstica en 179 nódulos (91,7%), incluyendo 122 nódulos benignos (62,5%), 50 PF (25,6%) y 7 malignos (3,6% del total). No fue diagnóstica en 16 nódulos por material insuficiente o inadecuado (8,2%), y fue insuficiente en 5 pacientes (2,5% de todas las biopsias), de los que 4 fueron sometidos a cirugía, detectándose cáncer en dos casos (uno intervenido en otro hospital) e hiperplasia adenomatosa en otros dos, mientras que en el caso restante se realizó seguimiento ecográfico (leyenda de la fig. 3). En los restantes 11 nódulos, la UM recomendó seguimiento ecográfico en todos salvo en uno con alta sospecha ecográfica, y el análisis de la pieza quirúrgica confirmó el resultado de la BAG (esclerosis y necrosis, sin evidencia de malignidad).
Algoritmo con los resultados de biopsia con aguja gruesa (BAG). Los datos son el número de nódulos, con número de pacientes entre paréntesis. Benigno (B), proliferación folicular (PF), proliferación de Hürthle (PH), malignos (M), carcinoma papilar (CP), carcinoma medular (CM), insuficiente (I). Hubo 4 pacientes con dos nódulos de diferente histología: uno con nódulos insuficiente e hiperplásico, uno con nódulos fibromuscular e hiperplásico y dos con nódulos con proliferación folicular e hiperplásicos.
a 192 nódulos con citología Bethesda I y 3 nódulos con citología Bethesda III que en la BAG fueron diagnosticados respectivamente de bocio, carcinoma medular confirmado por cirugía y proliferación folicular que en cirugía mostró ser carcinoma papilar variante folicular.
b Hubo dos nódulos benignos (hiperplásicos) que fueron sometidos a cirugía porque ambos pacientes tenían otros nódulos con proliferación folicular.
c Un paciente fue rechazado para cirugía por el servicio de anestesia por padecer una lesión cardiaca grave, un paciente no fue operado al presentar carcinoma de mama en estadio avanzado, y dos rechazaron la cirugía.
d El paciente tenía también un nódulo benigno. En gammagrafía no se detectaron áreas frías. Se decidió manejo conservador, mostrando estabilidad ecográfica mayor de un año.
Hubo complicaciones en cuatro procedimientos (2%). Utilizando las definiciones de la Society of Interventional Radiology sobre complicaciones22, hubo cuatro complicaciones menores (tres hematomas superficiales resueltos espontáneamente y un síncope vasovagal durante el procedimiento que obligó a la interrupción temporal del mismo, con recuperación mediante sueroterapia y medidas posturales) y ninguna mayor (aquellas que requieren tratamiento mediante hospitalización, provocan secuelas adversas permanentes o muerte).
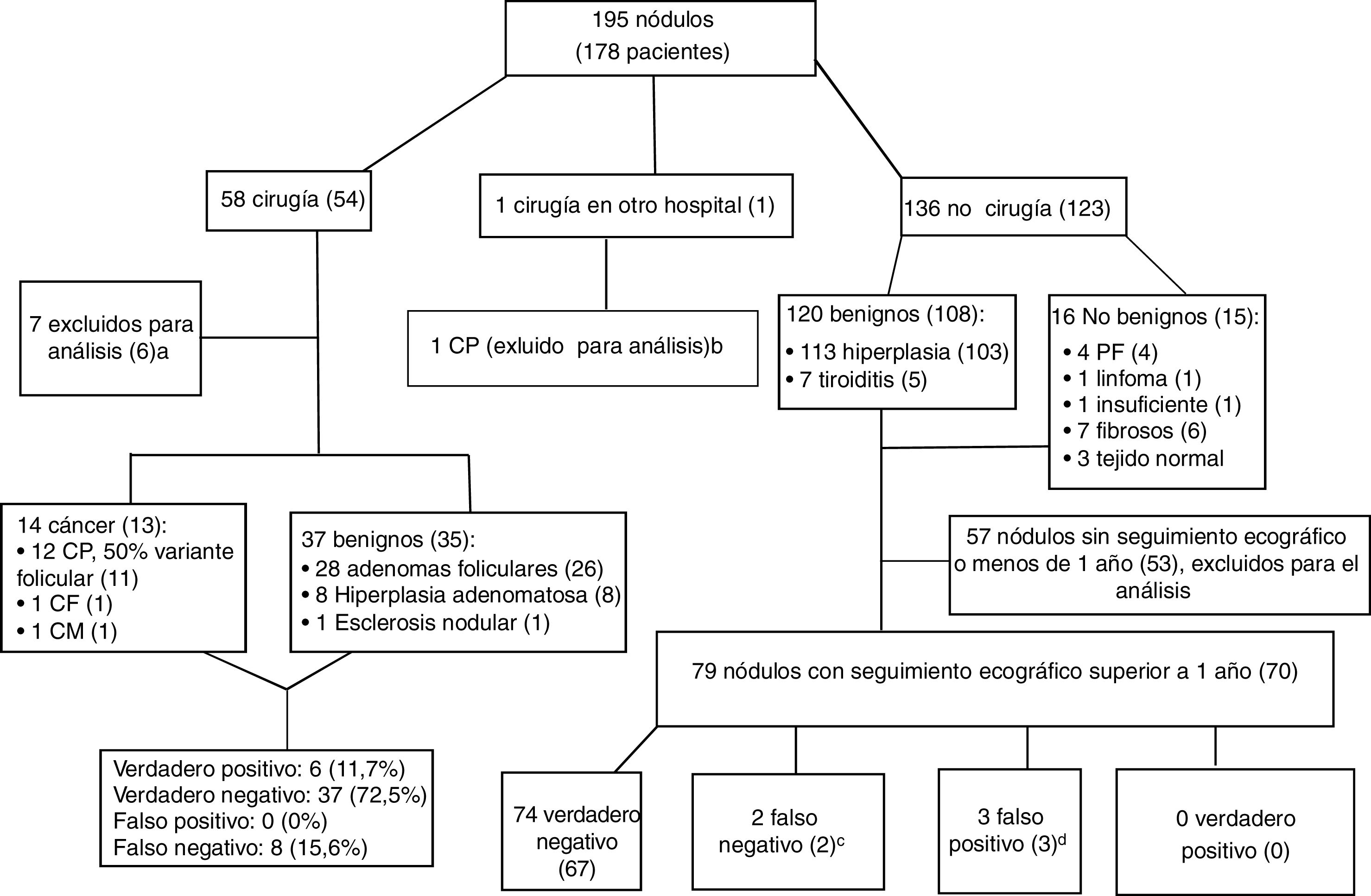
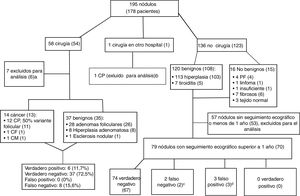
La figura 4 muestra el manejo de los pacientes tras la BAG y los diagnósticos finales. Para medir la fiabilidad de los resultados de la BAG, solo fueron útiles 130 de los 195 nódulos de la muestra (66,6%): 51 nódulos en 48 pacientes sometidos a cirugía y 79 nódulos con seguimiento ecográfico superior a 1 año en 70 pacientes no sometidos a cirugía. En los 13 pacientes con diagnóstico final de cáncer se observa similar distribución por sexo (84,6% mujeres) y edad (52,69+7,69 años) respecto al total de la muestra.
Algoritmo de manejo de pacientes después de biopsia con aguja gruesa y diagnósticos finales. Los datos son el número de nódulos, con el número de pacientes entre paréntesis. Carcinoma papilar (CP), carcinoma folicular (CF), carcinoma medular (CM).
a Cinco cánceres detectados en la muestra quirúrgica en áreas no biopsiadas y dos biopsias insuficientes para el diagnóstico (una no realizada después de varios intentos por alto riesgo debido a localización y tamaño del nódulo), con resultado benigno en cirugía, por lo que no son verdaderos negativos ni falsos positivos.
b BAG insuficiente para el diagnóstico. Cirugía y análisis histopatológico realizado en otro hospital.
c En un paciente, la biopsia se repitió, con resultado benigno otra vez. El otro paciente se perdió para el seguimiento tras detectar crecimiento.
d Dos nódulos con resultados fibromuscular e insuficiente en 2 pacientes con nódulos benignos adicionales, y un paciente con un nódulo con proliferación folicular desestimado para cirugía por el servicio de anestesia debido a lesión cardiaca asociada.
La tabla 2 muestra la correlación entre los resultados de la BAG y los de la cirugía. Los valores de S, E, VPP y VPN de la BAG para cáncer de tiroides fueron 42,8%, 100%, 100% y 82,2%, respectivamente. Existe un alto porcentaje de FN (8 de los 14 nódulos con diagnóstico final de carcinoma, 57%) que justifican la baja sensibilidad, aunque en 7 nódulos el diagnóstico obtenido mediante BAG fue PF (87,5%), y de ellos, el diagnóstico final tras la cirugía fueron lesiones con patrón folicular en 4 nódulos (1 carcinoma folicular y 3 carcinomas papilares, variante folicular, con invasión del margen quirúrgico en un caso), y pequeños focos de carcinoma papilar con márgenes quirúrgicos libres en tiroides con adenomas foliculares en los tres nódulos restantes. Al considerar M y PF como positivos, solo hubo un FN, un nódulo con BAG insuficiente y carcinoma papilar con márgenes libres tras la cirugía. En este caso se decidió cirugía en la UM ante la moderada sospecha ecográfica de malignidad (fig. 2A). Hubo 40 VP (34 PF más 6M), 8 FP por diagnóstico de PF en BAG e hiperplasia adenomatosa en cirugía, y dos VN con concordancia entre BAG y cirugía (hiperplasia adenomatosa y esclerosis nodular). Los valores obtenidos de S, E, VPP y VPN fueron 97,5%, 20%, 83,3% y 66,6%, respectivamente.
Correlación entre biopsia con aguja gruesa y cirugía
| BAG (n=51) | Diagnóstico final por cirugía (n=51) | ||
|---|---|---|---|
| Benigno (hiperplasia, esclerosis) (n=10) | Adenoma folicular (n=27) | Maligno (n=14) | |
| Hiperplasia (n=1) | 1 | 0 | 0 |
| Proliferación folicular (n=42) | 8 | 27 | 7 |
| Maligno (n=6) | 0 | 0 | 6 |
| Insuficiente (n=1) | 0 | 0 | 1 |
| Esclerosis (n=1) | 1 | 0 | 0 |
De los 79 nódulos sometidos a seguimiento ecográfico superior a 1 año, hubo dos FN por aumento de tamaño (fig. 4), aunque no se diagnosticó transformación maligna en ningún caso, y en uno se repitió BAG volviendo a obtener benignidad, por lo que realmente fue un VN (leyenda fig. 4). Los valores de S, E, VPP y VPP y VPN fueron 0%, 96,1%, 0% y 98,6%, respectivamente. No se observa relación estadísticamente significativa entre benignidad y estabilidad ecográfica de más de 1 año (p> 0,05).
La tabla 3 compara el coste diagnóstico en los 68 pacientes con BAG benigna y estabilidad ecográfica superior a 1 año frente al que habría tenido realizar 68 lobectomías sin complicaciones. La BAG reduce el coste un 89,4%.
Comparación de costes entre diagnóstico de benignidad con biopsia con aguja gruesa más estabilidad ecográfica mayor de un año frente a lobectomía sin complicaciones
| Procedimientos | Costes BAGa | Costes lobectomíaa |
|---|---|---|
| Preoperatorio | 684,76 | 17.947,24 |
| Procedimiento (BAG, lobectomía) | 16.605,6 | 233.145,48 |
| Hospitalización | – | 41.051,6 |
| Análisis histopatológico | 4.988,48 | 4.988,48 |
| Revisión ambulatoria de enfermería tras cirugía | – | 1.419,84 |
| Revisión médica ambulatoria tras el procedimiento (medicina interna, cirugía) | 7.422,88b | 3.711,44b |
| Control ecográfico tras biopsia | 2.510,56 | – |
| Coste total | 32.212,28 | 302.264,08 |
En nuestra serie de 195 nódulos tiroideos con dos PAAF previas no diagnósticas, la BAG obtiene un rendimiento diagnóstico del 91,7%, con complicaciones menores en el 2% de los casos y ausencia de complicaciones mayores. Muestra especificidad y VPP del 100% para detección de malignidad, y sensibilidad del 97,5% para detección de nódulos que precisan cirugía como tratamiento (malignos) o para completar su diagnóstico (proliferación folicular). En los nódulos benignos muestra un VPN del 98,4% y ausencia de casos con transformación maligna comprobada, lo que sugiere que puede sustituir a la lobectomía con gran reducción del coste diagnóstico, aunque necesitando seguimiento ecográfico tras la BAG para confirmar benignidad. Estos resultados concuerdan con los descritos en otras publicaciones.
Las BAG con material insuficiente o inadecuado fueron un 8,3%, similar a lo descrito en otros artículos, 5%3, 8%4 o 12,9%8. Es ligeramente superior a lo descrito por Paja et al. (3,4-5,8%), que utilizan la BAG como primera herramienta diagnóstica10,11. Nuestro equipo realiza BAG tras dos PAAF no diagnósticas, es decir, en nódulos que por tamaño, localización o composición presentan cierta dificultad para obtener muestras útiles, y este sesgo puede explicar nuestro mayor porcentaje. Si comparamos rendimiento BAG vs. PAAF (p. ej., de las 314 PAAF realizadas en nuestra institución en 2018, 42,4% fueron no diagnósticas, la inmensa mayoría Bethesda I, y un 10,7% fueron nódulos puncionados dos veces), observamos una diferencia similar a la descrita por Suh et al. en su metaanálisis20, aunque ellos utilicen el sistema Bethesda para comunicar los diagnósticos obtenidos mediante ambas técnicas. Estos resultados, junto a la similitud de costes entre PAAF y BAG en nuestro medio (238,91 vs. 244,20 euros, respectivamente) podrían ser un argumento a favor de utilizar BAG como primera herramienta diagnóstica. Sin embargo, pese a resultados positivos en series con muestras de gran tamaño10, aún no existen suficientes evidencias para recomendar su uso generalizado4,6. Además, exigiría el aprendizaje de la técnica por varios radiólogos del servicio para responder a la gran demanda y posiblemente la utilización de criterios más restrictivos que los de la ATA2 en la indicación de biopsias, como el TIRADS21.
Nuestro porcentaje de complicaciones es similar al de otros estudios3–6,10. Aquellos que comparan entre las complicaciones de BAG y PAAF no observan diferencias significativas5,20. Además de la experiencia del operador, es importante, para minimizar riesgos, la revisión de la historia clínica en busca de trastornos analíticos o toma de medicamentos que aumenten el riesgo de hemorragia, y la planificación de la punción en función de la imagen ecográfica. Hemos utilizado normalmente el abordaje longitudinal, que permite excluir del recorrido de la aguja la tráquea (más medial) y los vasos cervicales (más laterales) y visualizar toda la longitud de la aguja en su acceso al nódulo. Aunque en la literatura especializada se recomienda generalmente el abordaje transístmico para evitar la lesión del nervio laríngeo recurrente y la consiguiente parálisis de cuerda vocal4,10,11, no hemos sufrido esta complicación en nuestra serie. Aplicamos una compresión breve (aproximadamente 5 minutos) en la herida cutánea tras finalizar la BAG, similar a lo recomendado por Paja et al.10, e inferior a los 20-30 minutos recomendados por KSThR4,6.
Si tan solo consideramos M como positivo para cáncer de tiroides, nuestros resultados son comparables con el metaanálisis de Suh et al.13, en el que, tras analizar cuatro estudios con 496 nódulos, obtuvieron una sensibilidad del 44,7% al 85%, E y VPP del 100% y VPN del 65% al 94%. Cuando consideramos M y PF como resultados positivos, al igual que Paja et al.10,11, obtenemos S (97,5%) y VPP (83,3%) similares a los suyos, 95% y 88,7%, respectivamente11. La elevada sensibilidad de la BAG para diagnosticar nódulos con patrón folicular, que necesitarán cirugía para distinguir entre carcinoma y adenoma mediante la detección de invasión capsular o vascular, es clínicamente relevante porque el carcinoma folicular (aproximadamente 12% de los cánceres de tiroides, incluyendo el tipo Hürthle; 7,14% en nuestra serie, con un caso, fig. 2C) es un tumor agresivo en sus variantes pobremente diferenciada o con amplia invasión vascular, con supervivencia aproximada del 50% en 10 años, mientras que el adenoma folicular es una lesión frecuente y benigna2,12,17. El descenso del VPP del 100% al 83,3% posiblemente es debido a que se realizó punción de la zona central, que suele presentar áreas cicatriciales o esclerosas con microfolículos asociados en los nódulos hiperplásicos, simulando un adenoma folicular en las muestras BAG12. Si es técnicamente posible, es preferible obtener muestras de la periferia de los nódulos, menos propensas a necrosis o esclerosis12.
En los nódulos con BAG benigna, el VPN ha sido del 98,6%, con un FN (1,4%), aunque este diagnóstico está solamente basado en el crecimiento durante el seguimiento ecográfico, sin confirmación histopatológica de cáncer. Paja et al. obtuvieron un VPN del 99,6% con un 0,4% de FN, tras seguimiento ecográfico de más de 2 años de 3.223 nódulos benignos, lo que sugiere que la BAG es suficiente para confirmar benignidad, lo que hace innecesaria la cirugía, una biopsia confirmatoria o incluso el seguimiento ecográfico10. La ausencia de relación estadísticamente significativa entre benignidad y estabilidad ecográfica superior a 1 año en nuestra serie (p> 0,05), posiblemente debido al escaso número de casos disponibles (fig. 4), no nos permite sugerir la supresión del seguimiento ecográfico. Las recomendaciones sobre utilidad y duración del seguimiento están definidas básicamente para el diagnóstico citológico. Según la AACE/ACE/AME16, el riesgo de FN en nódulos con citología benigna es del 1-2%, y al igual que la ATA2 recomiendan seguimiento ecográfico con un primer control a los 12 meses. No existen evidencias que justifiquen una duración superior a 5 años2, aunque es un debate abierto, ya que el cáncer de tiroides puede crecer o variar sus características ecográficas muy lentamente2,3,7,9,15.
En los nódulos con BAG benigna más estabilidad ecográfica superior a 1 año hemos estimado una reducción del coste diagnóstico respecto a lobectomía cercano al 90%, incluyendo solo costes directos. Trimboli et al.14 estiman una reducción de un tercio, aunque en su análisis también incluyen nódulos malignos e indeterminados, que precisan cirugía posterior, y no incluyen seguimiento ecográfico en los nódulos benignos. Mejorar la eficiencia diagnóstica permite derivar los limitados recursos hacia otras prioridades, lo cual es una necesidad organizativa y un imperativo ético. La toma colegiada de decisiones en la UM es fundamental para conseguir este objetivo12.
Nuestro estudio tiene varias limitaciones: en primer lugar, es una revisión retrospectiva de una muestra sesgada al incluir solamente nódulos con dos PAAF previas no diagnósticas, lo que puede influir en que nuestro porcentaje de malignidad sea menor que en series sin este sesgo10,11. En segundo lugar, al ser una revisión únicamente descriptiva, solo encontramos controles ecográficos tras biopsia en el 63,3% de los nódulos benignos (76 de 120, fig. 4), lo que posiblemente afecta a la relación estadística entre benignidad y estabilidad ecográfica y a la reducción de costes, que podría ser mucho mayor. En tercer lugar, la estabilidad ecográfica superior a 1 año tras una biopsia benigna puede ser un intervalo de tiempo insuficiente para descartar falsos negativos3,7,9,15. Finalmente, no existe consenso sobre las categorías diagnosticas de la BAG, lo que puede afectar a la reproducibilidad del estudio.
En conclusión, la BAG de tiroides es efectiva porque permite diagnosticar la mayoría de nódulos con PAAF repetidamente no diagnósticas; segura si es realizada por personal experimentado; fiable para diagnósticar malignidad y benignidad, y para detectar qué nódulos necesitan completar su diagnóstico mediante cirugía por su histología folicular; y eficiente porque reduce costes repecto a lobectomía diagnóstica. Por tanto, es una herramienta prometedora para nódulos difíciles de diagnosticar mediante PAAF, lo que podría evitar muchas cirugías innecesarias.
Puntos principales- •
La BAG de tiroides es muy efectiva en nódulos con varias PAAF no diagnósticas.
- •
Realizada por personal experimentado presenta mínimas complicaciones.
- •
Es fiable detectando malignidad y qué nódulos necesitan lobectomía diagnóstica.
- •
Un resultado benigno más estabilidad ecográfica descartan razonablemente malignidad.
- •
Reduce espectacularmente el coste del diagnóstico respecto a lobectomía.
- 1.
Responsable de la integridad del estudio: RCG.
- 2.
Concepción del estudio: RCG.
- 3.
Diseño del estudio: RCG y MDME.
- 4.
Obtención de los datos: RCG, MDME, LRC y CMS.
- 5.
Análisis e interpretación de los datos: RCG, MDME, LRC y CMS.
- 6.
Tratamiento estadístico: RCG, MDME, LRC y CMS.
- 7.
Búsqueda bibliográfica: RCG, MDME, LRC y CMS.
- 8.
Redacción del trabajo: RCG, MDME, LRC y CMS.
- 9.
Revisión crítica del manuscrito con aportaciones intelectalmente relevantes: RCG, MDME, LRC y CMS.
- 10.
Aprobación de la versión final: RCG, MDME, LRC y CMS.
Esta investigación no ha recibido financiación de ningún sector, sea público, comercial o sin ánimo de lucro.
Conflicto de interesesLos autores declaran que no tienen intereses financieros o relaciones personales que pudieran haber parecido influir en el trabajo reportado en este artículo.
A Francisco Rivas-Ruiz y al resto del personal de la Unidad de Investigación por su asesoramiento en la elaboración del manuscrito. A Alberto Jiménez-Puente (Unidad de Evaluación) por obtener y analizar los datos sobre la duración del tiempo de hospitalización por lobectomía desde 2011.