La resonancia magnética multiparamétrica (RMmp) prostática ha tenido recientemente un extenso desarrollo, convirtiéndose en una herramienta clave en el diagnóstico y la toma de decisiones terapéuticas en relación al carcinoma prostático (CaP). El rápido desarrollo tecnológico, así como de lectura (PIRADS V2), exigen una permanente actualización del conocimiento en esta área. El objetivo de este artículo es presentar una revisión actualizada sobre los aspectos técnicos, los modelos de lectura y las indicaciones de la RMmp prostática en relación al CaP, en el marco de una visión multidisciplinaria. Actualmente está establecida la utilidad de la RMmp ante un antígeno específico de próstata elevado y una biopsia prostática previa negativa; para estadificación tumoral; en la evaluación de candidatos a vigilancia activa; en la planificación de tratamientos focales y para la evaluación de la recurrencia tumoral. Otras indicaciones, como su uso en pacientes con sospecha de CaP pero sin biopsia previa, aunque se realizan en algunos centros, aún requieren una exhaustiva valoración coste-beneficio para extender su empleo.
Prostatic multi-parametric magnetic resonance imaging (MP-MRI) has recently had a wide development becoming a key tool in the diagnostic and therapeutic decisions in prostate cancer (Pca). The fast development both in technology and in reading (PIRADS V2) requires a continuous updating of knowledge within this area. The aim of this article is to present an updated revision of technical aspects, reading patterns and prostatic MP-MRI in Pca, with a multidisciplinary approach. Currently guidelines establish the use of the MP-MRI when there is a high PSA and a negative prostatic biopsy; tumor staging; evaluation in candidates to active surveillance; focal treatments plans and tumoral recurrence evaluation. Although it is used in other indications in some centers, like its use in patients suspicious of Pca but with no previous biopsy, there is still the need of a cost/benefit assessment for its use to be wider.
En Europa, el carcinoma prostático (CaP) es el cáncer no cutáneo más frecuente en hombres mayores de 70 años, convirtiéndose en una preocupación sanitaria mayor en los países desarrollados dado el envejecimiento que presentan sus poblaciones1. Hasta hace no mucho tiempo, su detección y tratamiento se basaban casi exclusivamente en el antígeno prostático específico (PSA), los hallazgos del tacto rectal y los resultados anatomopatológicos de la biopsia prostática. Sin embargo, estos parámetros poseen importantes limitaciones.
En los últimos años, la resonancia magnética multiparamétrica (RMmp) se ha convertido en una herramienta de gran utilidad en relación al CaP. Existen importantes y permanentes avances tecnológicos, así como en el modelo de lectura de la RMmp. Muy recientemente, la European Society of Urogenital Radiology (ESUR) y el American College of Radiology han realizado una actualización de los aspectos diagnósticos clave vinculados a la RMmp y el CaP, plasmada en la versión 2 del Prostate Imaging Reporting and Data System (PIRADS v2)2.
Algunas indicaciones para su uso están incorporadas a guías clínicas o avaladas por extensas revisiones sistemáticas, tales como la valoración ante una biopsia prostática previa negativa y la sospecha persistente de CaP; la evaluación de candidatos a vigilancia activa según criterios iniciales de PSA/primera biopsia, y la estadificación tumoral (principalmente en pacientes con CaP que ofrecen dudas clínicas sobre su posible extensión extraprostática y cuya presencia condicionaría la decisión terapéutica)3,4. Otras indicaciones, como la planificación de tratamientos focales5, la recurrencia tumoral6 y los pacientes con sospecha de CaP pero sin biopsia previa7,8, si bien no están totalmente establecidas, se encuentran cada vez más avaladas por la literatura.
Para brindar toda la información necesaria, el radiólogo debe conocer aspectos fundamentales anatomopatológicos y clínico-terapéuticos del CaP.
Este artículo tiene como objetivo realizar una actualización sobre el papel actual de la RMmp prostática, desde un enfoque interdisciplinario, destacando los avances sobre los aspectos técnicos, el modelo de lectura y las indicaciones de esta técnica.
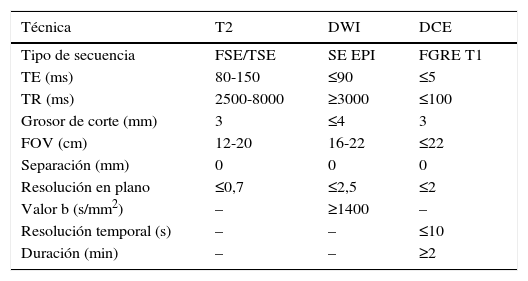
Aspectos técnicos y secuenciasEl protocolo de la RMmp debe realizarse en relación a la indicación clínica, las características del paciente y el equipo de RM. Los avances técnicos permiten realizar secuencias de alta resolución en T2 y en difusión con factor b alto, lo que mejora el rendimiento diagnóstico. El protocolo de estudio debe incluir secuencias ponderadas en T1, T2, difusión y contraste9. La secuencia T1 debe realizarse con un campo de visión (FOV) que visualice la pelvis hasta la bifurcación aòrtica. El estudio de la próstata y las vesícules seminales en secuencias T2, difusión y contrastadas (DCE) requiere un FOV reducido, como se describe en la recomendación de la guía PIRADS v2 (tabla 1). Es de utilidad añadir una secuencia de difusión adicional de toda la pelvis para el análisis de la pelvis ósea y ganglios. La exploración requiere un equipo de RM como mínimo de 1,5T. La utilización de la antena endorrectal combinada con la de superficie no es imprescindible, aunque sí debe hacerse en los equipos antiguos. Existen otros factores técnicos que influyen en la calidad técnica del estudio, aparte de la antena endorrectal, tales como el ancho de banda, los canales de la antena y la potencia de radiofrecuencia. Los resultados del estudio pueden ser óptimos en equipos tanto de 1,5T como de 3T, con o sin antena endorrectal. La ventaja de los equipos de 3T es la posibilidad de obtener imágenes con mejor resolución temporal y espacial; sin embargo, dependiendo de la secuencia, los artefactos de susceptibilidad pueden incrementarse. Los equipos actualizados con antenas de superficie multicanal de 16 o más elementos pueden obtener una buena calidad de imagen sin necesidad de antena endorrectal. Los equipos de 1,5T tienen menos artefactos del aire en la antena endorrectal con la secuencia de difusión que los equipos de 3T. Para minimizarlo pueden utilizarse líquidos, como el sulfato de bario, y así evitar distorsiones de susceptibilidad.
Características técnicas recomendadas para la resonancia magnética multiparamétrica en la guía PIRADS v2
| Técnica | T2 | DWI | DCE |
|---|---|---|---|
| Tipo de secuencia | FSE/TSE | SE EPI | FGRE T1 |
| TE (ms) | 80-150 | ≤90 | ≤5 |
| TR (ms) | 2500-8000 | ≥3000 | ≤100 |
| Grosor de corte (mm) | 3 | ≤4 | 3 |
| FOV (cm) | 12-20 | 16-22 | ≤22 |
| Separación (mm) | 0 | 0 | 0 |
| Resolución en plano | ≤0,7 | ≤2,5 | ≤2 |
| Valor b (s/mm2) | – | ≥1400 | – |
| Resolución temporal (s) | – | – | ≤10 |
| Duración (min) | – | – | ≥2 |
DCE: secuencia de contraste intravenoso; DWI: secuencia ponderada en difusión; FGRE: secuencia fast gradiente eco; FOV: campo de visión; FSE: fast espín eco; SE EPI: secuencia espín eco imagen eco planar; TSE: turbo espín eco.
Las secuencias morfológicas consisten en adquisiciones espín eco (SE) o fast espín eco (FSE) ponderadas en T1 y T2. La secuencia ponderada en T1 permite detectar posibles adenopatías pélvicas, analizar la pelvis ósea para descartar metástasis y valorar la posibilidad de cambios hemorrágicos en la glándula prostática posbiopsia. La secuencia ponderada en T2 debe realizarse con alta resolución (3mm de grosor, sin separación) para poder valorar la anatomía normal de la próstata, preferiblemente en los tres planos9.
Las secuencias funcionales consisten en secuencias de difusión y dinámica contrastada (DCE). La secuencia de difusión DWI (diffusion weighted imaging) es fundamental en el análisis de la próstata, conjuntamente con el análisis independiente del ADC (coeficiente de difusión aparente) en forma de mapa, para poder detectar el cáncer clínicamente significativo en la zona periférica. Debe disponerse de imágenes de DWI con factor b ≥1400 s/mm2, como se recomienda en la guía. La obtención de imágenes con factor b alto puede realizarse directamente de adquisición o computadas (extrapoladas) de las obtenidas con un factor b más bajo2. Para las imágenes del mapa ADC, si solo pueden adquirirse dos valores b, es preferible que el valor b más bajo sea de 50-100 s/mm2 y el más alto sea de 800-1000 s/mm2. Es decir, si no es posible adquirir en una única secuencia múltiples valores b altos es preferible adquirir dos secuencias de difusión, una con valor b alto y otra con dos valores b para poder realizar cálculo de ADC.
La secuencia DCE debe adquirirse ponderada en T1 con alta resolución temporal (≤10 s por fase) después de administrar gadolinio intravenoso durante un tiempo no inferior a 2 minutos, y abarcando la glándula y las vesículas seminales. La reciente versión de PIRADS concede escaso valor añadido a las secuencias poscontraste en la detección del cáncer clínicamente significativo en combinación con las secuencias T2 y difusión10. De todas formas, se recomienda su inclusión en el protocolo de examen de RMmp de próstata para ayudar a detectar pequeños focos de cáncer clínicamente significativo, diagnosticar causas benignas que justifiquen la elevación del PSA (p. ej., de origen inflamatorio) o proporcionar información suplementaria cuando la secuencia de difusión no ha sido técnicamente óptima. Así mismo, la secuencia DCE es imprescindible en la monitorización terapéutica y la valoración posprostatectomía.
Si una de las secuencias del estudio de la RMmp (T2, DWI, ADC, DCE) resulta técnicamente no valorable, debe indicarse en el informe. Esto es más frecuente en la DWI, especialmente por la presencia de prótesis de cadera o por la mayor susceptibilidad al movimiento. Si esto ocurre, y dado que esta secuencia es clave en el análisis, debe repetirse dicha secuencia y solo si no fuera posible, o si también la segunda adquisición fuera subóptima, realizar el análisis únicamente con las restantes secuencias.
La secuencia de espectroscopía no se incluye en el protocolo de la guía PIRADSv2. Su menor disponibilidad, la complejidad de adquisición y posprocesado, juntamente con no haber demostrado mejorar la capacidad diagnóstica que ofrecen los parámetros combinados T2 y DWI/ADC, han justificado su exclusión en el protocolo sistemático de la RMmp de próstata.
Modelo de lectura PIRADSUno de los objetivos en la lectura de un estudio de RMmp, según la estandarización de la guía PIRADS v2, es identificar y localizar alteraciones que se correspondan con la presencia de cáncer clínicamente significativo, es decir, para el diagnóstico. La guía PIRADS v2 no establece criterios en la monitorización terapéutica. Se define cáncer significativo el que se corresponde histológicamente con un grado Gleason ≥7 o un volumen ≥0,5 cc o con extensión extraglandular9. La guía PIRADS v2 utiliza cinco categorías (tabla 2), indicando la probabilidad de la presencia de cáncer clínicamente significativo en la RMmp en una escala de 1 a 5 (de menor a mayor grado de probabilidad). La decisión sobre la categorización PIRADS debe basarse únicamente en los hallazgos de la imagen en la RMmp, sin tener en cuenta otros factores como los valores del PSA, el tacto rectal, la historia clínica o los tratamientos previos. Aunque es recomendable realizar biopsia en caso de PIRADS 4 o 5, y no realizarla en PIRADS 1 o 2, la guía PIRADS v2 no establece recomendaciones de manejo para PIRADS 3.
Clasificación PIRADS v2. Categorías de la probabilidad de la presencia de cáncer significativo
| Puntuación PIRADS | Criterio |
|---|---|
| 1 | Muy baja probabilidad de presencia de cáncer clínicamente significativo |
| 2 | Baja probabilidad de presencia de cáncer clínicamente significativo |
| 3 | La presencia de cáncer clínicamente significativo es equívoca |
| 4 | Alta probabilidad de presencia de cáncer clínicamente significativo |
| 5 | Muy alta probabilidad de presencia de cáncer clínicamente significativo |
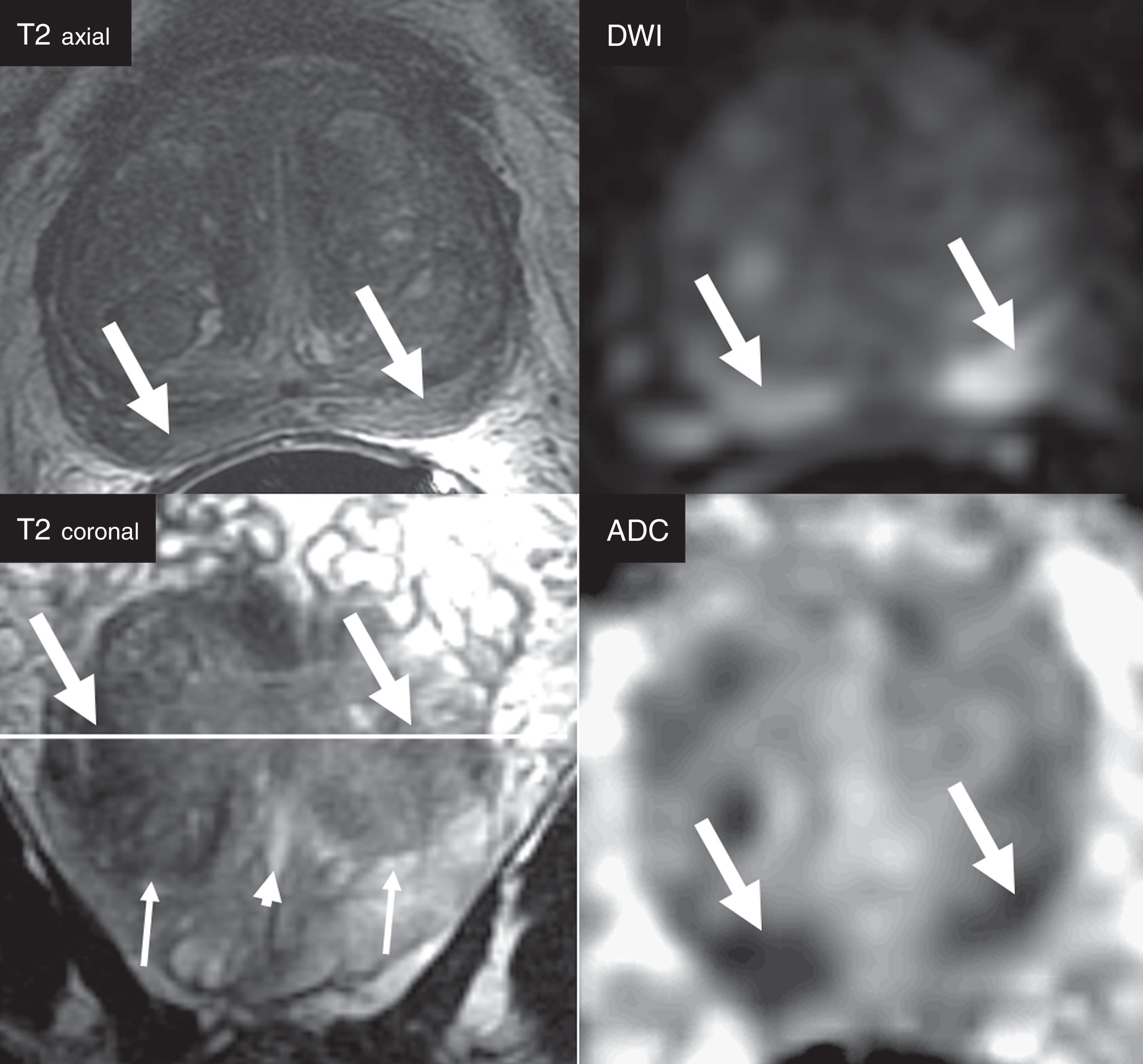
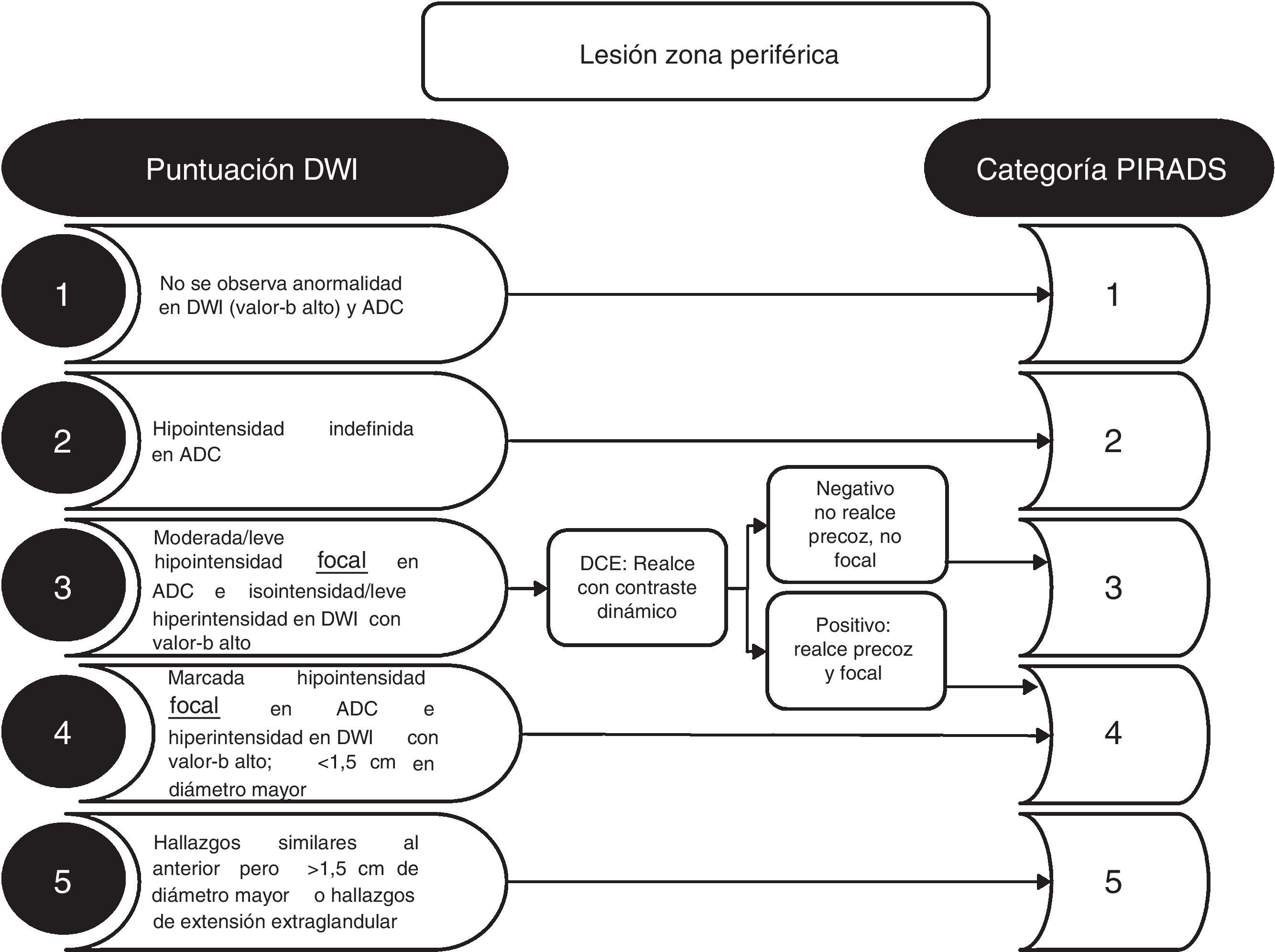
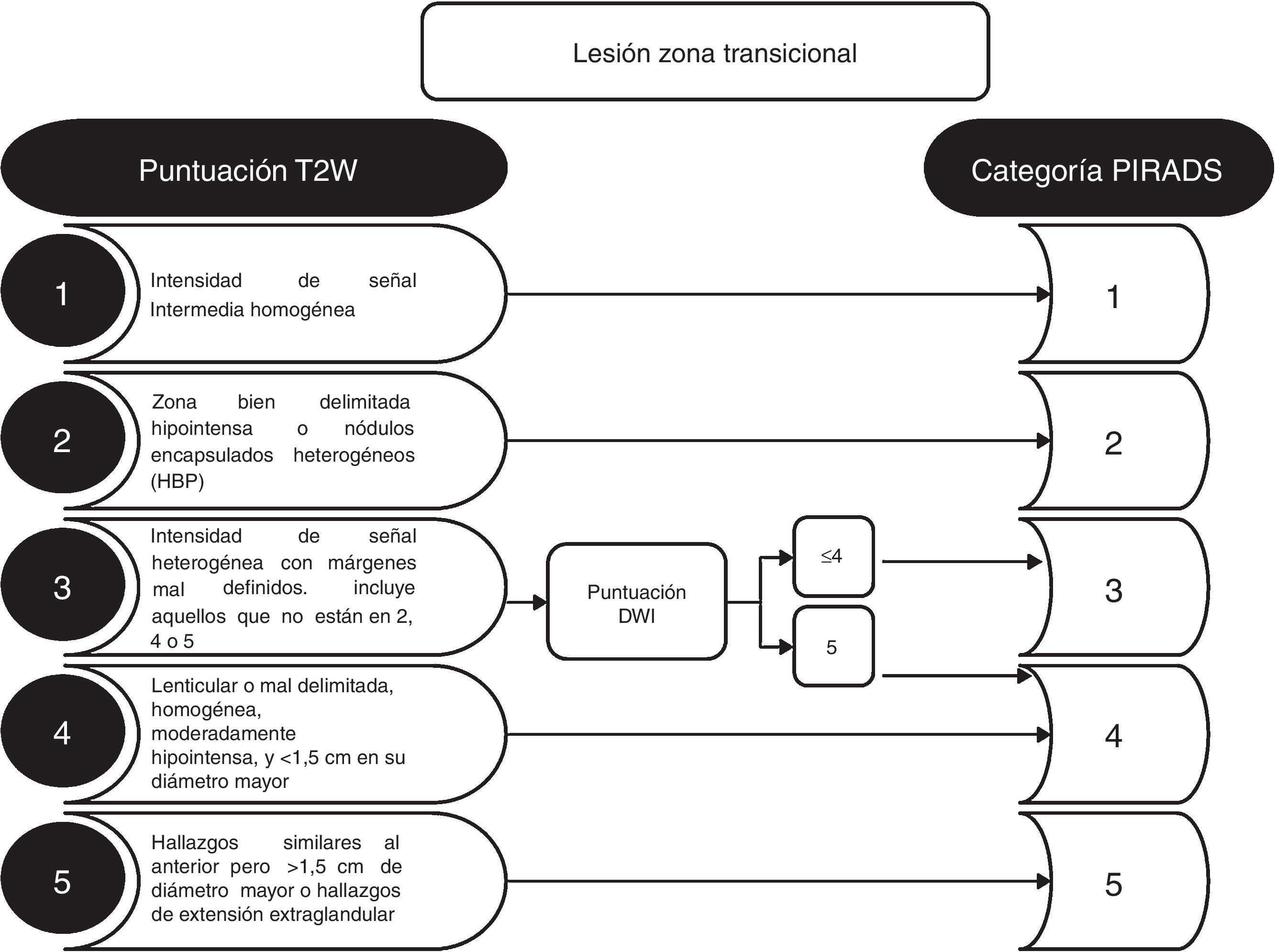
El criterio de lesión significativa se realiza evaluando la localización anatómica zonal y los hallazgos de la secuencia dominante para la zona determinada. Es imprescindible localizar la lesión en la zona correcta, para evitar escoger de manera incorrecta la secuencia dominante para su interpretación (fig. 1). Las zonas anatómicas problemáticas son la transición entre la zona central y la zona periférica en la base (fig. 1), y la interfaz entre la zona anterior periférica, la transicional y el fibroestroma. En la zona periférica, la secuencia dominante para determinar la significación es la DWI, y en la zona transicional es la T2. Es decir, una lesión de la zona periférica con una puntuación 4 en DWI (lesión focal marcadamente hiperintensa en DWI con valor b alto y marcadamente hipointensa en ADC <1,5cm), con independencia de cualquier criterio en las otras secuencias, será categorizada como PIRADS 4 (fig. 2). Así mismo, una lesión con una puntuación 2 en T2 en la zona transicional (nódulo hipointenso o heterogéneo encapsulado), independientemente de cualquier otro criterio en otras secuencias, será categorizada como PIRADS 2 (fig. 3).
Selección de la secuencia dominante en relación a la zona anatómica. Iso/hiposeñal difusa posterior en secuencia T2 axial (flechas) con hiperseñal focal bilateral en DWI (b=1400s/mm2) e hiposeñal en ADC (flechas). La incorrecta localización de las focalidades como zona periférica llevaría a valorar las lesiones en la secuencia DWI (secuencia dominante en la zona periférica), con categoría PIRADS 4. Los hallazgos se localizan en la zona central, en la base proximal posterior de la glándula. El corte coronal en T2 permite localizar en el corte de referencia del plano axial (línea blanca) la región correcta como la zona central (base glandular), y no como la zona periférica. Anatómicamente, la zona central, en general, no se extiende distal al verumontarum (flecha corta), posteriormente de la glándula. El corte coronal permite valorar la transición entre la zona central (flechas finas) y la zona periférica posterior distal. La correcta localización de la zona central establece la secuencia T2 como dominante (y no la DWI), siendo normal el patrón homogéneo isointenso en T2 de la zona central. Es fisiológica la restricción de la difusión de la zona central, mostrando un aspecto relativamente simétrico, bilateral, descrito como signo del bigote, por su apariencia en el plano axial en ADC o DWI (flechas).
La secuencia DCE solo tiene relevancia en la guía PIRADS v2 para lesiones en la zona periférica con puntuación 3 en DWI (fig. 2). También tiene utilidad en casos de deficiencia técnica, como puede ser por artefactos en la secuencia de difusión.
La secuencia de DWI tiene relevancia en la zona transicional para lesiones categorizadas como PIRADS 3 en la secuencia T2. Una puntuación de 5 en DWI incrementa la categorización PIRADS a 4 en la zona transicional (fig. 3).
La guía PIRADS v2 recomienda proporcionar la medición de la lesión en su diámetro mayor del plano axial, en el mapa ADC para lesiones de la zona periférica y en T2 para la zona transicional. Si la lesión es mayor en otro plano, deben indicarse el plano y el tamaño.
Es necesario realizar la lectura simultánea de las secuencias T2 axial, DWI (valor b alto) axial, ADC axial y T2 coronal o sagital (fig. 4). Los mapas ADC tienen un rango dinámico estrecho, por lo que es clave el ajuste correcto de la ventana de visualización10. Dada la subjetividad en la interpretación de las imágenes en DWI y ADC para establecer el criterio de alteración de señal (hiperintensidad en DWI o hipointensidad en ADC) como leve, moderada o marcada, que sirva para determinar la puntuación PIRADS, es necesario remarcar que el criterio de sospecha en DWI y T2 en la zona periférica es tener morfología nodular (fig. 2); es decir, una lesión no nodular en la zona periférica y con leve restricción de la DWI será categorizada como PIRADS 2 (fig. 2). Leves cambios de señal no nodulares, mal delimitados, lineales, lobulares o difusos, es poco probable que sean de origen neoplásico en la zona periférica.
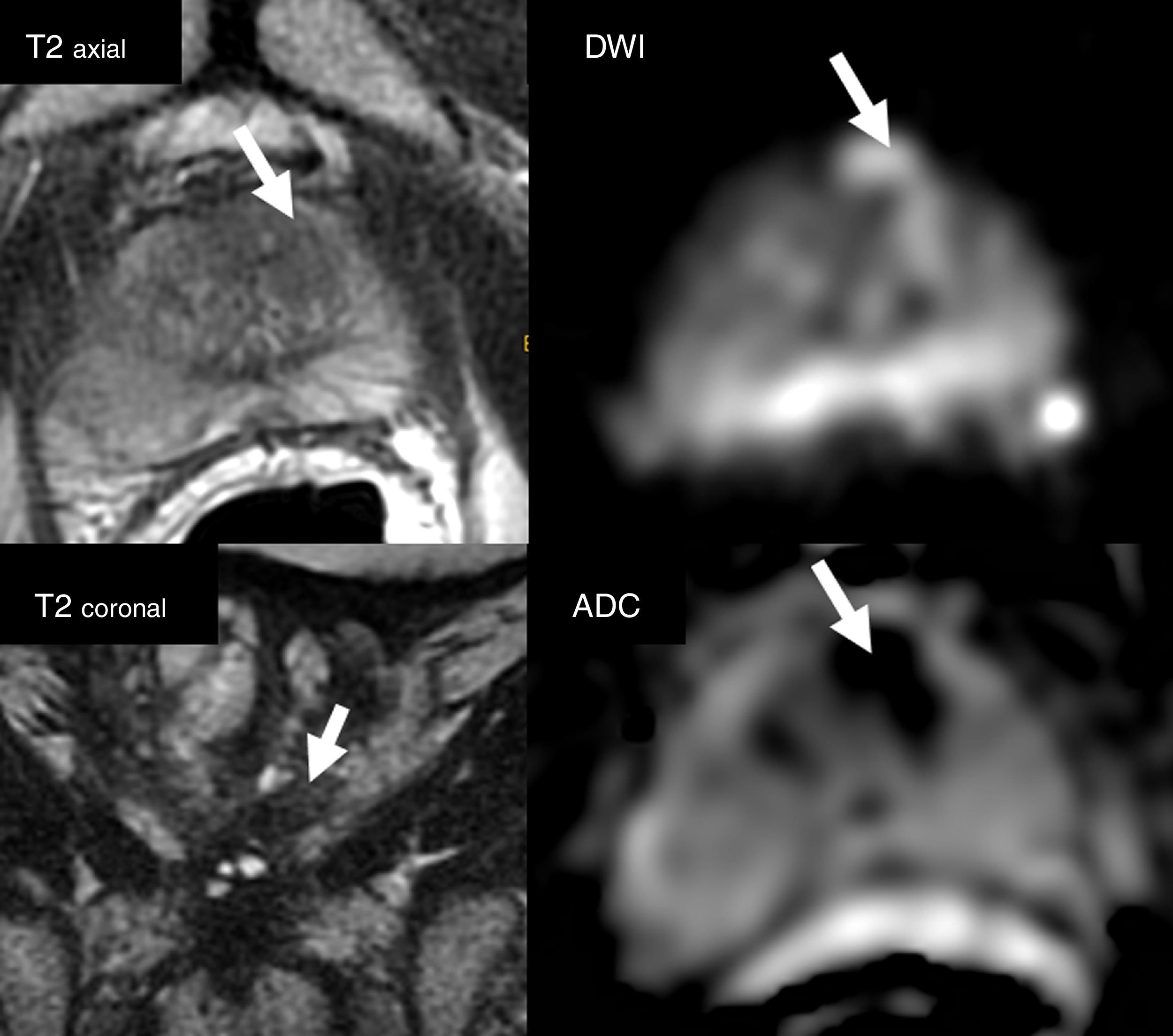
Lectura del estudio de resonancia magnética multiparamétrica. Visualización de las cuatro secuencias (axial, coronal T2, DWI [valor b alto] y ADC) en una misma ventana para una valoración eficaz de la morfología, la señal y la localización zonal de una lesión PIRADS 4 (flecha) en la zona transicional anterior izquierda. Debe ajustarse el nivel óptimo de ventana para visualizar de forma correcta la imagen en DWI y el mapa ADC.
En la actualidad, la capacidad de detectar de forma fiable y caracterizar el CaP clínicamente significativo con RMmp en la zona transicional es menor que en la zona periférica11. La presencia de nódulos homogéneos o heterogéneos en la zona transicional, redondos u ovalados, bien delimitados y encapsulados, es un hallazgo frecuente en los varones mayores de 40 años. En DWI/ADC, estos nódulos pueden mostrar restricción y realce con DCE; criterios también de benignidad en el contexto de la hipertrofia benigna de próstata. Estos hallazgos no requieren asignación en la valoración PIRADS; de otra forma, prácticamente todas las asignaciones serían PIRADS 2. Es aconsejable, en todo caso, describir en la conclusión final, aparte de la asignación de la categoría PIRADS, la presencia del grado de hipertrofia de próstata. Un grado moderado o importante de hipertrofia de próstata puede permitir justificar los valores altos del PSA. La presencia de alteraciones de señal simétricas bilaterales en cualquier secuencia a menudo se debe a la anatomía normal prostática o a cambios benignos (fig. 1). En estos casos resulta de utilidad cuantificar el valor de ADC. Se considera que el cáncer clínicamente significativo muestra un valor de ADC <750-900μm2/s, a diferencia de los procesos inflamatorios crónicos, que generalmente muestran valores de ADC más altos10.
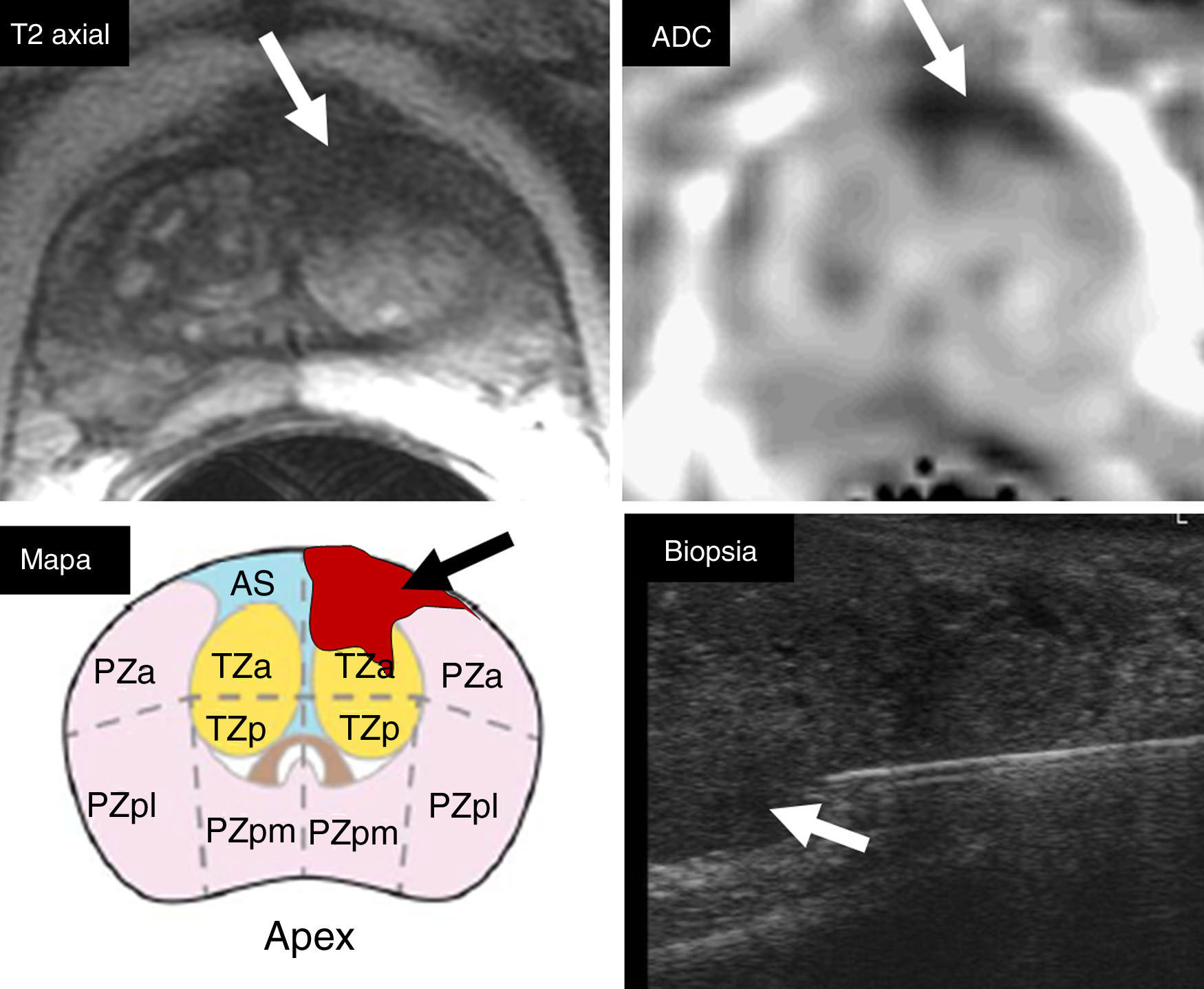
La localización de la lesión significativa debe marcarse en la plantilla según los 39 segmentos zonales topográficos de la glándula, definidos en la guía PIRADS v2, e incluirla en el informe para una óptima comunicación en el momento de realizar la biopsia, poder realizar un correcto procedimiento dirigido mediante fusión cognitiva o software (fig. 5), y obtener así el material de la zona de sospecha definida en la RMmp11.
Localización topográfica cognitiva. La lesión de categoría PIRADS 5 en el segmento anterior transicional del ápex izquierdo demostrada en T2 y DWI (flechas) debe localizarse en la plantilla sectorial del mapa topográfico conjuntamente con el informe (flecha). Esta información es imprescindible para realizar la fusión cognitiva durante el procedimiento de la biopsia con ecografía, y poder dirigir la aguja al segmento sospechoso (flecha) detectado en la RMmp.
Más del 90% de los CaP tienen un fenotipo acinar, lo que significa que están formados por pequeñas glándulas de células secretoras neoplásicas. El grado de una neoplasia valora la cantidad de alteraciones genéticas acumuladas; a mayor cantidad de alteraciones, mayor agresividad. El acúmulo de alteraciones genéticas puede valorarse por el aumento y la irregularidad del núcleo o por la progresiva pérdida de la arquitectura. El sistema de puntuación Gleason se basa en la pérdida de la arquitectura12. Así pues, se definen una serie de patrones con diferencias en el tamaño de las luces glandulares y un acúmulo de núcleos que pueden correlacionarse con el contenido hídrico, alteraciones en el espacio extracelular y la vascularización. Estas diferencias histológicas y arquitecturales entre los diferentes patrones serían el fundamento del diverso aspecto de las lesiones en las imágenes de RMmp, y de ahí la importancia para el radiólogo de tener al menos un somero conocimiento de dichos patrones. El patrón 3 se caracteriza por glándulas individualizadas de distintos tamaños con estroma intermedio que pueden infiltrarse entre las glándulas no neoplásicas. El patrón 4 puede tener diversas morfologías, que oscilan desde grupos de glándulas con luz ausente o deforme y estroma fibroso prominente (patrón de glándulas malformadas) hasta agregados de glándulas no totalmente separadas entre sí, o de distribución cribosa con bandas estromales circunscribiendo grandes agregados neoplásicos. El patrón 5 también es variable, ya que puede estar formado por acúmulos de células neoplásicas sin prácticamente nada de estroma hasta áreas colágenas con regueros de células neoplásicas. Esta acentuación en la distorsión de la arquitectura a medida que el tumor es más agresivo probablemente explique las diferencias en las secuencias de difusión (DWI/ADC) entre los tumores bien diferenciados, de Gleason bajo, que presentan nula o poca restricción a la difusión, y los tumores más agresivos, de mayor Gleason, que presentan una restricción a la difusión más acentuada.
La mayoría de los CaP tienen diversos patrones que se reflejan en la gradación de Gleason que consiste en el sumatorio de dos patrones. Según los criterios establecidos en 2005, en dicho sumatorio hay que poner como patrón primario el más frecuente presente en la muestra y como patrón secundario el menos representado. Así, en un patrón Gleason 3+4, el patrón 3 es el más representado en la muestra. En caso de existir un patrón terciario (habitualmente hay solo dos patrones, pero en ocasiones puede haber representación de un tercer patrón), si este es de mayor grado que el secundario, por su relevancia, pasa a ocupar la segunda posición en el sumatorio.
En la biopsia se unifican los patrones 1, 2 y 3 en un patrón común, el 3. En los pacientes con un solo patrón de Gleason se repite el patrón en el sumatorio (3+3, 4+4 o 5+5).
Como una forma evolutiva del sistema de gradación de Gleason, y para poder adecuar la biología de los sumatorios de los distintos patrones según los criterios actuales, se ha propuesto una agrupación de dichos sumatorios en cinco grupos pronósticos: 3+3 (grupo 1); 3+4 (grupo 2); 4+3 (grupo 3); 4+4, 3+5, 5+3 (grupo 4); y sumatorios 9 y 10 (grupo 5)13.
Con estas agrupaciones se ha observado una buena estratificación pronóstica tanto en las biopsias como en las piezas de prostatectomía y en enfermos irradiados12–15, siendo el consenso general utilizar conjuntamente la denominación de los patrones de Gleason y los grupos de grados pronósticos.
Indicaciones de la resonancia magnética multiparamétrica prostáticaDetección del cáncer de próstataPara la detección precoz del CaP no parece adecuado practicar un cribado colectivo y se aconseja realizar una estrategia individualizada basada en el riesgo para cada paciente. Para ello, hay que estimar al menos una esperanza de vida mayor o igual a 10-15 años y se debe informar del riesgo de un posible sobrediagnóstico16.
Hasta hace poco tiempo, ante la sospecha de CaP por elevación del PSA o tacto rectal sospechoso, era la biopsia prostática sistemática la única técnica diagnóstica utilizada para su detección. Sin embargo, esta técnica posee importantes limitaciones: el ápex, la zona medial y anterior suelen ser mal valoradas; diagnostica un porcentaje importante de cáncer clínicamente no significativo, lo que en ocasiones lleva a un «sobretratamiento»; y existe una discrepancia del 30% respecto a la puntuación Gleason posteriormente obtenida según la pieza de prostatectomía, lo que condiciona en no pocas ocasiones una toma de decisiones terapeúticas desacertadas. En este escenario, actualmente la RMmp cobra fundamental relevancia.
Una revisión sistemática de la literatura que selecciona 50 estudios para su análisis compara la rentabilidad de la biopsia con guía RMmp en comparación con la biopsia sistemática17. Los autores concluyen que ambas técnicas detectan el CaP en un porcentaje similar (43%), habiéndose podido evitar las biopsias realizadas en pacientes sin lesiones sospechosas en la RMmp (aproximadamente un tercio de los casos). De este modo, la eficiencia (cánceres detectados/pacientes biopsiados) hubiera sido claramente favorable para la biopsia bajo guía con RMmp (70%) respecto a la biopsia sistemática (40%). Asimismo, la biopsia guiada por RMmp evitó la detección del 10% de cánceres clínicamente no significativos.
De Visschere et al.18 valoraron retrospectivamente 830 pacientes con PSA elevado y RMmp con el objetivo de evaluar las características de los CaP que se presentaron en el seguimiento (2 años) de aquellos cuya RMmp había sido negativa. Dicho seguimiento se realizó mediante control del PSA, tacto rectal, biopsia prostática o nueva RMmp. La RMmp fue negativa en 391 pacientes (47,1%). Se detectó CaP en el seguimiento de las mismas en 124 pacientes (31,7%), siendo en su mayoría (67,7%) de bajo grado y confinados al órgano (96,0%). El valor predictivo negativo para CaP de alto grado fue del 95,4%. Los autores concluyen que, ante un PSA elevado y una RMmp negativa, podría considerarse la vigilancia en lugar de la biopsia inmediata.
A pesar de que existiría evidencia para utilizar la RMmp como guía para la primera biopsia, la mayoría de los centros aún utilizan la RMmp sistemáticamente solo como guía en casos de persistencia de sospecha de CaP y biopsia negativa previa. En estos pacientes, la RMmp es de particular utilidad porque permite dirigir la biopsia a regiones prostáticas mal valoradas por la biopsia sistemática, y dado su alto valor predictivo negativo evita rebiopsiar en casos innecesarios. Roethke et al.19 evaluaron 100 pacientes con al menos una biopsia negativa previa y persistencia de elevación del PSA, realizando RMmp como guía. Se detectó CaP en el 52,0% de los casos, siendo el 80,8% CaP clínicamente significativo. Numerosos estudios apoyan la utilidad de la RMmp en esta población de pacientes20,21.
No obstante, deben tenerse en cuenta las limitaciones de la RMmp en la detección de tumores de escaso volumen. Vargas et al.22 evaluaron retrospectivamente 150 pacientes con antecedente de CaP sometidos a RMmp (modelo de lectura PIRADS v2) y posterior prostatectomía radical. Estos autores identifican aproximadamente el 95% de los tumores ≥0,5ml, independientemente de su puntuación Gleason. Sin embargo, solo identifican el 26% y el 20% (zona periférica y transicional, respectivamente) de los tumores <0,5ml y con puntuación Gleason ≥4+3 (o sea, pequeños, pero clínicamente significativos por su predominio de patrón Gleason 4). Los resultados de estos autores señalan una clara limitación de la técnica para la detección del CaP clínicamente significativo de pequeño volumen.
Se requiere un análisis de coste-beneficio para determinar el papel exacto de la RMmp en la detección del CaP antes de la primera biopsia.
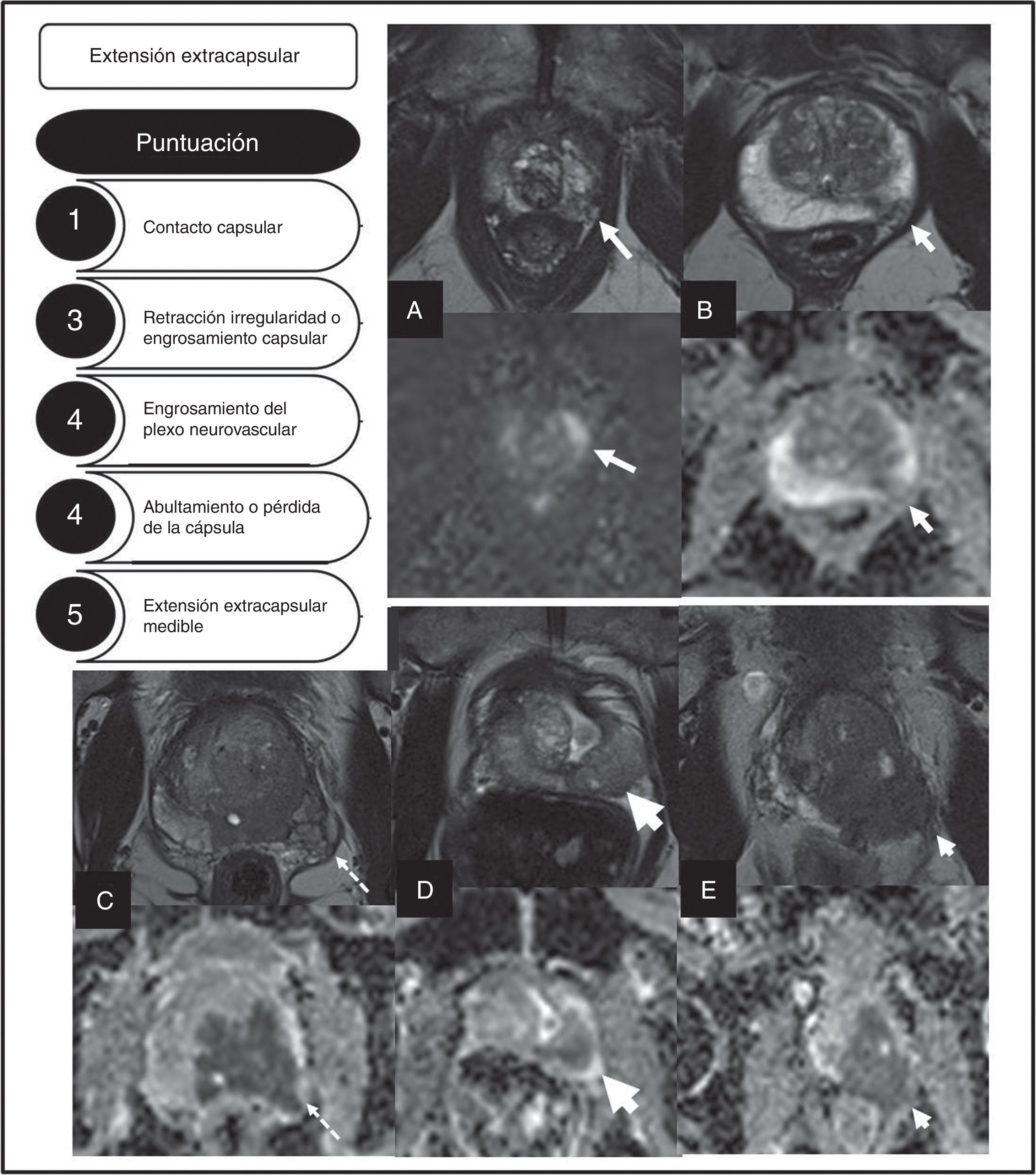
EstadificaciónUna correcta estadificación local es fundamental para poder decidir el tipo de tratamiento más adecuado. La ESUR ha propuesto una puntuación con una escala del 1 al 5 (utilizando la secuencia T2) para valorar el riesgo de extensión extraprostática23 (fig. 6). Boesen et al.24 evaluaron la utilidad de este modelo en 87 pacientes, utilizando la pieza de prostatectomía como referente diagnóstico. Los autores reportan que una puntuación ≥4, según dicha escala, muestra una sensibilidad y una especificidad del 81% y el 78%, respectivamente, para diagnosticar extensión extracapsular. Por otra parte, una puntuación ≥3 muestra una sensibilidad del 94%, una especificidad del 68% y un valor predictivo negativo del 95%, lo que permitiría excluir, con muy alta probabilidad, la extensión extracapsular. Los resultados mejoraban de manera significativa cuando los lectores añadían su opinión personal, que incluía la valoración de las secuencias de difusión. Otros autores25 también demuestran la utilidad de la RMmp para predecir la extensión extracapsular.
Descripción de los distintos tipos de extensión local del CaP definidos por la European Society of Urogenital Radiology y su puntuación. Se muestran ejemplos de las distintas categorías definidas. A) Contacto capsular, secuencias T2 y ADC (flechas). B) Retracción, irregularidad o engrosamiento capsular, imágenes T2 y ADC (flechas). C) Engrosamiento del plexo neurovascular, imágenes T2 y ADC (flechas). D) Abultamiento de la cápsula, imágenes T2 y ADC (flechas). E) Extensión extracapsular medible, secuencias T2 y ADC (flechas).
La RMmp actualmente está aceptada por la ESUR como técnica de utilidad en la evaluación de la extensión local23, y la Asociación Europea de Urología propone su utilización en los pacientes del grupo de riesgo intermedio y alto.
Vigilancia activaEn los tumores de bajo riesgo puede realizarse una vigilancia activa (también conocida como seguimiento activo), sin que sea necesario llevar a cabo ningún tratamiento de forma inicial, con muy buenos resultados oncológicos. El concepto se basa en la idea de no producir morbilidad innecesaria en aquellos pacientes que tienen un tumor clínicamente no significativo. La vigilancia activa supone y obliga a un estrecho seguimiento de estos pacientes con PSA, tacto rectal y biopsias periódicas, y a un tratamiento activo cuando el tumor progresa, ya sea clínicamente o según la histología. En un principio, los criterios de inclusión para vigilancia activa eran muy estrictos: puntuación Gleason ≤6 en menos de un 5% del tejido de la biopsia, PSA <10 y tacto rectal anodino (cT1c). Los buenos resultados oncológicos y de calidad de vida han hecho que la tendencia actual sea ampliar los criterios e incluir pacientes con tumores localizados de riesgo intermedio26. Con el fin de no incluir en los protocolos de vigilancia activa a pacientes con tumores clínicamente significativos, las guías europeas de urología recomiendan la realización previa de una RMmp para detectar focos de CaP clínicamente significativos que podrían ser omitidos por la biopsia prostática sistemática16 (fig. 7). La RMmp puede predecir el grado de agresividad tumoral, fundamentalmente a través de las secuencias de difusión. De este modo, los tumores mejor diferenciados (clínicamente no significativos) suelen tener poca o nula traducción en estas secuencias, al contrario de lo que sucede a medida que progresa el grado de agresividad (clínicamente significativos)27,28.
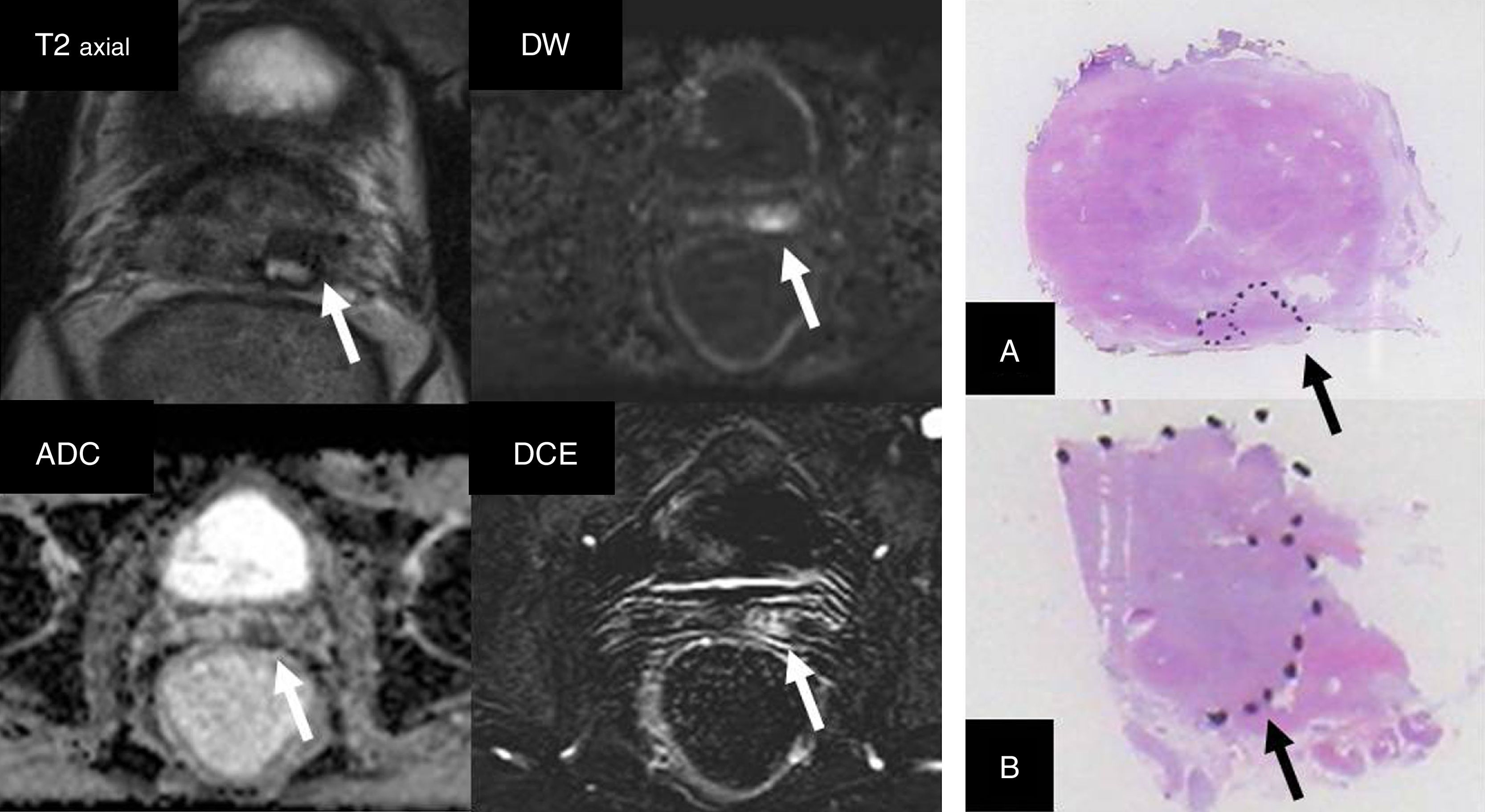
Paciente sometido a biopsia sistemática por una elevación del antígeno específico de próstata. Se diagnostica cáncer de próstata (CaP) con Gleason 3+3 que afecta a un pequeño porcentaje de un solo cilindro. Siendo candidato a vigilancia activa, se realiza estudio mediante resonancia magnética multiparamétrica. Se identifica un área apical derecha en la zona periférica (flechas) de categoría PIRADS 4 (puntuación 4 en la secuencia DWI [b=1400s/mm2]) que sugiere un Gleason ≥7. Al realizar la biopsia dirigida se diagnostica CaP con Gleason 4+4 que afecta a tres cilindros en un 30% del tejido remitido.
Una revisión sistemática4 sobre RMmp y vigilancia activa reporta que dos tercios de los pacientes candidatos a vigilancia presentaron una lesión sospechosa en RMmp. La presencia de lesiones sospechosas en la RMmp se asoció más frecuentemente con un aumento del grado de Gleason (43%) según la pieza de prostatectomía respecto a los casos en que no existían lesiones visibles con esta técnica (27%). La RMmp condicionó una reclasificación del paciente en 1:2 a 1:3 de los casos. De este modo se concluye que la RMmp es una técnica de utilidad en la valoración del paciente candidato a vigilancia según la biopsia sistemática inicial. Esta indicación está avalada por la guía de la European Association of Urology16.
Si bien la RMmp está aceptada para la evaluación inicial de pacientes potencialmente candidatos a vigilancia activa23, no existe aún una sólida evidencia que determine su papel en el seguimiento.
Planificación de terapias focalesEl tratamiento focal está indicado en aquellos casos de tumor localizado en un único lóbulo prostático, usualmente Gleason ≤7 y sin evidencia de extensión extraprostática29. La estrategia es tratar únicamente el lóbulo afecto, sin tratar el resto de la glándula, disminuyendo así los efectos secundarios del tratamiento y la toxicidad, e intentando preservar bandeletas neurovasculares, la uretra y la musculatura esfinteriana. El objetivo primario es la erradicación de enfermedad medible y biológicamente agresiva en una sola sesión. Las dos técnicas más utilizadas y consideradas como opción terapéutica por la European Association of Urology, una vez excluidas la braquiterapia y la radioterapia externa16, son los ultrasonidos focalizados de alta intensidad (HIFU) y la crioterapia. Ambas presentan una eficacia oncológica equivalente, pero efectos secundarios relacionados con el tratamiento significativamente diferentes. La decisión de qué terapia utilizar en cada caso dependerá de la edad, la comorbilidad y la decisión del paciente.
En relación a las terapias focales, la RMmp tiene valor para localizar y definir la extensión de la lesión, así como descartar la bilateralidad. Si bien el CaP es con más frecuencia multifocal (67-87%) valorando la pieza de prostatectomía30, suele existir una lesión índice, definida como la lesión de mayor tamaño, mayor agresividad y, en consecuencia, mayor valor pronóstico. De este modo, aunque existe un amplio espectro de resultados en relación a la capacidad de la RMmp para detectar el CaP31–33, está demostrado que la rentabilidad diagnóstica de esta técnica aumenta para lesiones de mayor tamaño y más indiferenciadas, tal como suele suceder en la lesión índice. Un reciente panel interdisciplinario de consenso5 concluye que la RMmp, siempre que se realice con tecnología adecuada y sea interpretada por radiólogos experimentados, es la técnica de elección para la planificación de dichas terapias. Las biopsias por saturación, entendidas como biopsias con un número de disparos mayor que el habitual (rango de cilindros aproximado entre 16 y 26), quedarían reservadas solo para los pacientes con RMmp no concluyente. El objetivo, en estos casos, sería determinar la localización tumoral, no visible de manera clara por dicha técnica.
Sospecha de recidiva tras el tratamiento del cáncer de próstataLa recidiva de la enfermedad local puede ser abordada con distintas técnicas terapéuticas, por lo que se requieren una correcta evaluación y un certero diagnóstico que permitan diseñar un segundo tratamiento.
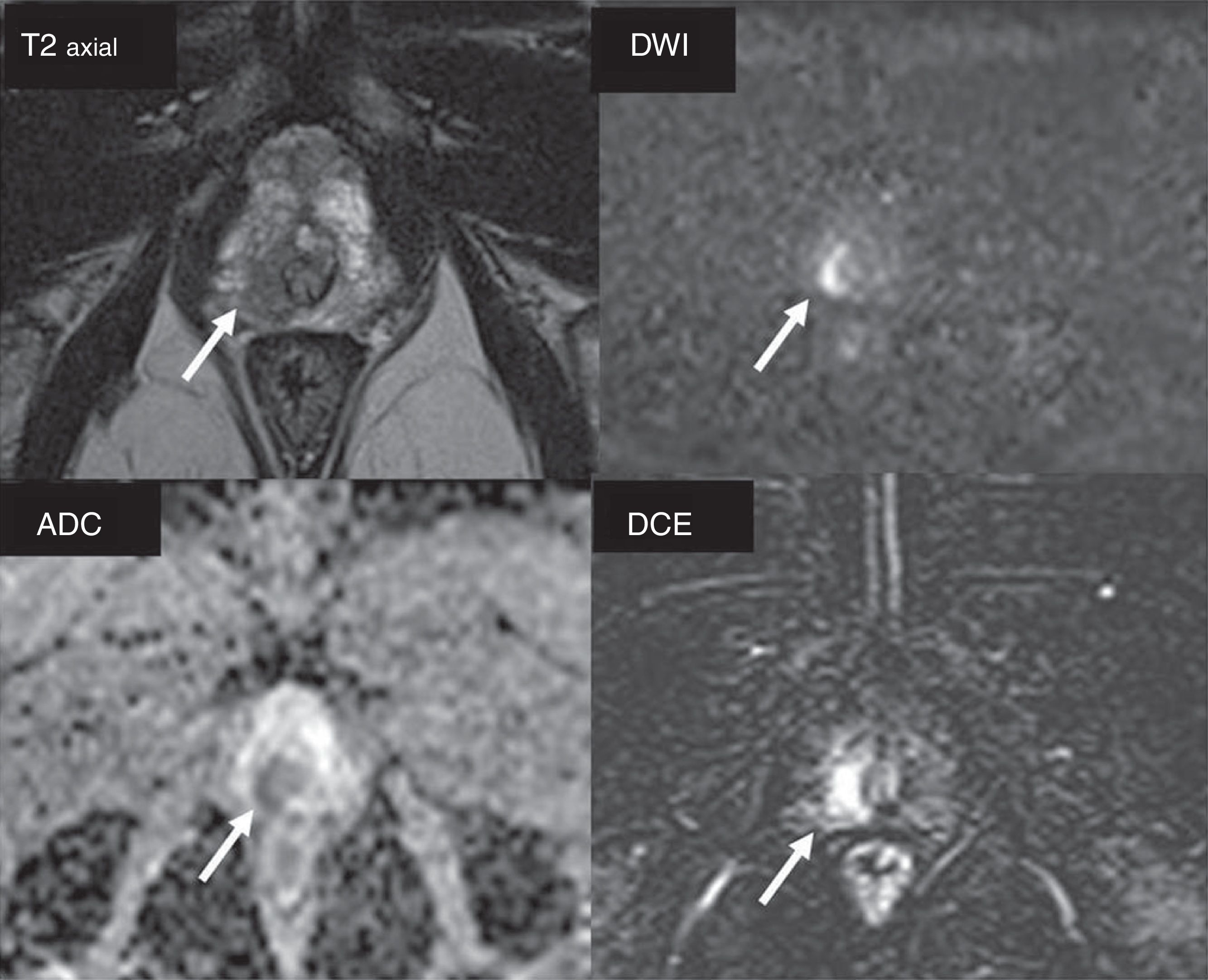
La RMmp es una herramienta de utilidad para la valoración de la persistencia o la recurrencia tumoral. Independientemente del tratamiento inicial del CaP, es relevante la valoración de las secuencias de difusión y dinámicas, ya que la zona de recurrencia tumoral suele ser poco evidente en la secuencia T2, mientras que en las secuencias de difusión se evidencia una clara restricción34 y en las dinámicas hay presencia de captación27,35–37 (fig. 8).
Paciente con antecedente de braquiterapia por cáncer de próstata (CaP) con Gleason 3+3. Acude con un antígeno específico de próstata de 8ng/ml (valor nadir: 1,94ng/ml). Secuencia T2 con hipointensidad en una pequeña área de la vesícula seminal izquierda (flecha), con restricción al agua en secuencias DWI (b=1400s/mm2) y ADC, y clara captación de contraste (DCE con sustracción), que sugiere resto o recidiva tumoral (flechas). El paciente fue tratado con prostatectomía de rescate. En la pieza quirúrgica se delimita la presencia del CaP (flechas) en la región de la ampolla deferencial (A) y en la vesícula seminal izquierda (B).
Kitajima et al.38, en pacientes prostatectomizados (n=115), comparan la rentabilidad de la RMmp pelviana en comparación con la PET/TC con 11C-colina para la detección de la recurrencia local (AUC de 0,90 y 0,76, respectivamente; p <0,05), de adenopatías locales (AUC de 0,81 y 0,95, respectivamente; p <0.05) y de metástasis óseas (AUC de 0,92 y 0,89, respectivamente; p=NS). Los autores concluyen que la RMmp fue superior para la detección de la recidiva local, mientras que la PET/TC con 11C-colina fue superior para la evaluación de adenopatías, y ambas técnicas igualmente óptimas para la detección de metástasis ósea pélvica, aportando información complementaria.
La finalidad principal de la RMmp es ofrecer información (localización y extensión tumoral) de cara a la planificación de una posible terapia de rescate, como por ejemplo la crioterapia focal en recidivas posprostatectomía o prostatectomías radicales en recidivas posradioterapia. Es relevante tener información acerca del tratamiento inicial realizado, así como información clínica y antecedentes anatomopatológicos, ya que permite una mejor interpretación de las imágenes y orienta sobre el sitio más probable de recidiva.
En la actualidad, la RMmp es una técnica aceptada para la valoración de una posible recurrencia en pacientes sometidos a las diferentes modalidades terapéuticas (fig. 8).
ConclusiónEn la actualidad, la RMmp puede realizarse de manera óptima con tecnología ampliamente distribuida siempre que se optimicen los parámetros técnicos de forma rigurosa. El modelo de lectura PIRADS v2 es clave para lograr una alta rentabilidad en la detección del carcinoma clínicamente significativo. Está bien establecido que la RMmp tiene un papel clave en el diagnóstico y el tratamiento de los pacientes con CaP, habiéndose convertido en una herramienta imprescindible en este campo. Muchas de las indicaciones ya están establecidas en las guías clínicas y son habituales en la práctica asistencial cotidiana; otras están cada vez más avaladas por la literatura. La evidencia científica y el análisis de coste-beneficio determinarán el lugar exacto de esta técnica en un futuro próximo.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Autoría- 1
Responsables de la integridad del estudio: VC, JCV y TM.
- 2
Concepción del estudio: VC.
- 3
Diseño del estudio: VC.
- 4
Búsqueda bibliográfica: VC, JCV, JMG, FA y TM.
- 5
Redacción del trabajo: VC, JCV, JMG, FA y TM.
- 6
Revisión crítica del manuscrito con aportaciones intelectualmente relevantes: VC, JCV y TM.
- 7
Aprobación de la versión final: VC, JCV, JMG, FA y TM.
Los autores declaran no tener ningún conflicto de intereses.
FinanciaciónTodos los autores confirman que no ha habido fuente de financiación para la realización de este artículo.
A Ricard Pellejero, por su soporte en las búsquedas bibliográficas. A Seila Ballerini, por su eficiente apoyo para adecuar los aspectos formales del manuscrito. A Carles Fernández y Sònia Sala, por su colaboración con el material gráfico.










![Lectura del estudio de resonancia magnética multiparamétrica. Visualización de las cuatro secuencias (axial, coronal T2, DWI [valor b alto] y ADC) en una misma ventana para una valoración eficaz de la morfología, la señal y la localización zonal de una lesión PIRADS 4 (flecha) en la zona transicional anterior izquierda. Debe ajustarse el nivel óptimo de ventana para visualizar de forma correcta la imagen en DWI y el mapa ADC. Lectura del estudio de resonancia magnética multiparamétrica. Visualización de las cuatro secuencias (axial, coronal T2, DWI [valor b alto] y ADC) en una misma ventana para una valoración eficaz de la morfología, la señal y la localización zonal de una lesión PIRADS 4 (flecha) en la zona transicional anterior izquierda. Debe ajustarse el nivel óptimo de ventana para visualizar de forma correcta la imagen en DWI y el mapa ADC.](https://static.elsevier.es/multimedia/00338338/0000005900000003/v1_201705111011/S0033833817300061/v1_201705111011/es/main.assets/thumbnail/gr4.jpeg?xkr=ue/ImdikoIMrsJoerZ+w96p5LBcBpyJTqfwgorxm+Ow=)


![Paciente sometido a biopsia sistemática por una elevación del antígeno específico de próstata. Se diagnostica cáncer de próstata (CaP) con Gleason 3+3 que afecta a un pequeño porcentaje de un solo cilindro. Siendo candidato a vigilancia activa, se realiza estudio mediante resonancia magnética multiparamétrica. Se identifica un área apical derecha en la zona periférica (flechas) de categoría PIRADS 4 (puntuación 4 en la secuencia DWI [b=1400s/mm2]) que sugiere un Gleason ≥7. Al realizar la biopsia dirigida se diagnostica CaP con Gleason 4+4 que afecta a tres cilindros en un 30% del tejido remitido. Paciente sometido a biopsia sistemática por una elevación del antígeno específico de próstata. Se diagnostica cáncer de próstata (CaP) con Gleason 3+3 que afecta a un pequeño porcentaje de un solo cilindro. Siendo candidato a vigilancia activa, se realiza estudio mediante resonancia magnética multiparamétrica. Se identifica un área apical derecha en la zona periférica (flechas) de categoría PIRADS 4 (puntuación 4 en la secuencia DWI [b=1400s/mm2]) que sugiere un Gleason ≥7. Al realizar la biopsia dirigida se diagnostica CaP con Gleason 4+4 que afecta a tres cilindros en un 30% del tejido remitido.](https://static.elsevier.es/multimedia/00338338/0000005900000003/v1_201705111011/S0033833817300061/v1_201705111011/es/main.assets/thumbnail/gr7.jpeg?xkr=ue/ImdikoIMrsJoerZ+w96p5LBcBpyJTqfwgorxm+Ow=)


