Determinar la reproducibilidad de la escala visual de Scheltens para establecer la atrofia del lóbulo temporal medial.
Material y métodosReunimos 25 pacientes con diagnóstico clínico de enfermedad de Alzheimer leve o deterioro cognitivo leve (DCL) y 25 sujetos sin deterioro cognitivo. Todos fueron estudiados con RM 1,5 Tesla utilizando secuencias de inversión recuperación ponderadas en T1 en el plano coronal. Cinco neurorradiólogos fueron entrenados para aplicar la escala de Scheltens y analizaron las imágenes. Se utilizó el coeficiente de correlación intraclase para valorar el grado de acuerdo inter e intraobservadores.
ResultadosEl 80% de los pacientes con deterioro cognitivo leve o enfermedad de Alzheimer obtuvieron puntuaciones entre 2 a 4, mientras que 21 de los 25 controles sanos (84%) fueron puntuados entre 0-1. La concordancia entre observadores fue consistentemente mayor de 0,82, con un intervalo de confianza del 95% (0,7-0,9). La concordancia intraobservador varió entre 0,82 y 0,87, con un intervalo de confianza del 95% (0,56-0,93).
ConclusiónLa clasificación de Scheltens es un método reproducible entre observadores, lo que apoya su uso en la práctica clínica.
To determine the reproducibility of the Scheltens visual rating scale in establishing atrophy of the medial temporal lobe.
Material and methodsWe used coronal T1-weighted inversion recovery sequences on a 1.5 Tesla MRI scanner to study 25 patients with clinically diagnosed Alzheimer's disease or mild cognitive decline and 25 subjects without cognitive decline. Five neuroradiologists trained to apply the Scheltens visual rating scale analyzed the images. We used the interclass correlation coefficient to evaluate interrater and intrarater agreement.
ResultsRaters scored 20 (80%) of the 25 patients with mild cognitive decline or Alzheimer's disease between 2 and 4; by contrast, they scored 21 (84%) of the 25 subjects without cognitive decline between 0 and 1. The interrater agreement was consistently greater than 0.82, with a 95% confidence interval of (0.7-0.9). The intrarater agreement ranged from 0.82 to 0.87, with a 95% confidence interval of (0.56-0.93).
ConclusionThe Scheltens visual rating scale is reproducible among observers, and this finding supports its use in clinical practice.
El envejecimiento de la población ha aumentado significativamente la prevalencia de las enfermedades neurodegenerativas, especialmente de la enfermedad de Alzheimer (EA)1. Por su parte, el deterioro cognitivo leve (DCL) es un síndrome clínico que permite clasificar a personas con déficit cognitivo que no cumplen criterios de demencia2. Aunque es conocido que muchas de las personas de este grupo progresan a EA en un período aproximado de 9,5 años, el porcentaje de estos pacientes es difícil de predecir y calcular. La tasa de progresión a EA depende de muchas variables que incluyen las demográficas, las genéticas y la presencia de otras enfermedades en el momento del diagnóstico2,3. Establecer de forma precoz el diagnóstico de EA y diferenciar esta enfermedad de otras causas de deterioro cognitivo es relevante para establecer el pronóstico e instaurar posibles tratamientos. Por tanto, hay un gran interés científico para identificar biomarcadores capaces de predecir el riesgo de que pacientes con DCL progresen a la EA4.
Los estudios estructurales de RM en pacientes con diagnóstico de EA o DCL muestran con frecuencia atrofia de la corteza entorrinal y del hipocampo. Establecer el grado de atrofia de estas estructuras temporales es relevante para predecir el riesgo de conversión a EA, pero aún lo es más valorar los cambios volumétricos que se producen en períodos relativamente cortos5–8. Scheltens et al.9 desarrollaron un sistema de clasificación visual para evaluar el grado de atrofia del lóbulo temporal medial (LTM) que, aplicado transversal y longitudinalmente en un entorno clínico adecuado, permitiría identificar a sujetos con alto riesgo de progresar a EA9,10. El sistema es reproducible, no requiere programas de procesamiento de imágenes y es fácil de aprender4,6,9.
En este estudio se pretende validar el análisis cualitativo de la atrofia del LTM como un método reproducible entre neurorradiólogos previamente entrenados para aplicar la escala visual de Scheltens. La hipótesis es que, tras entrenarse adecuadamente, la reproducibilidad entre diferentes evaluadores es buena, lo que permitiría poder aplicar la escala en otros centros.
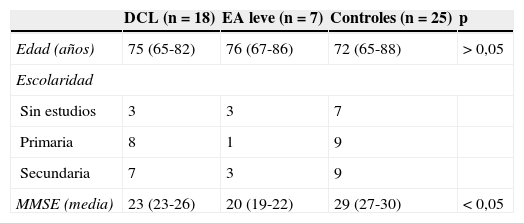
Material y métodosSe realizó una RM cerebral en 25 pacientes con diagnóstico clínico de EA leve o DCL y 25 sujetos controles sin deterioro cognitivo (13 hombres y 12 mujeres en cada grupo). De los 50 sujetos estudiados, 13 (26%) no tenían ningún grado de escolaridad, 18 (36%) tenían grado de primaria y 19 (38%) tenían escolaridad secundaria o superior. El comité ético del hospital aprobó la realización del estudio. Dado que este se llevó a cabo utilizando exámenes de RM realizados dentro de la práctica clínica y el riesgo de daño no fue superior al habitual, se solicitó una dispensa del requisito de pedir el consentimiento informado a los titulares del estudio, que fue aprobado por el comité de ética PR (IDI) 130/2013.
Los pacientes fueron incluidos como DCL o EA leve según los criterios NINCDS-ADRDA11 y se clasificaron neuropsicológica y neurológicamente según la gravedad de la demencia con las escalas Blessed Dementia Rating Scale, Mini-Mental State Examination (MMSE) y Global Deterioration Scale-Functional Assessment Staging12. La RM fue realizada no más de 2 meses después del diagnóstico clínico, como parte del protocolo para el diagnóstico de EA (tabla 1). El grupo control se formó con pacientes sin síntomas de deterioro cognitivo verificados en la historia clínica.
Datos demográficos
| DCL (n=18) | EA leve (n=7) | Controles (n = 25) | p | |
|---|---|---|---|---|
| Edad (años) | 75 (65-82) | 76 (67-86) | 72 (65-88) | > 0,05 |
| Escolaridad | ||||
| Sin estudios | 3 | 3 | 7 | |
| Primaria | 8 | 1 | 9 | |
| Secundaria | 7 | 3 | 9 | |
| MMSE (media) | 23 (23-26) | 20 (19-22) | 29 (27-30) | < 0,05 |
MMSE: DCL=23-26, EA leve = 19-22.
DCL: deterioro cognitivo leve; EA: enfermedad de Alzheimer; MMSE: Mini-Mental State Examination.
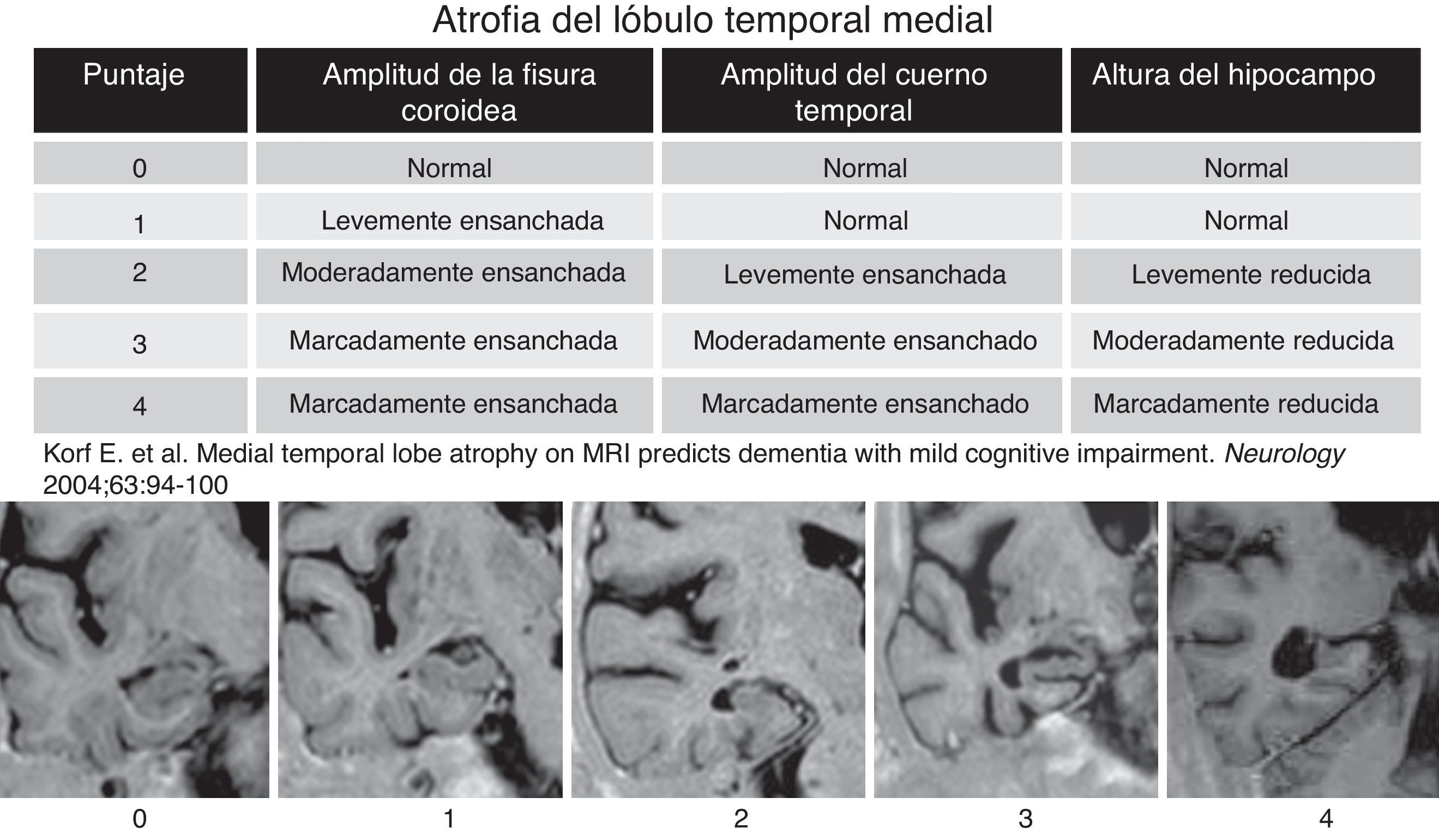
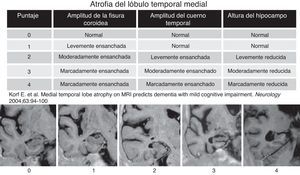
Revisando la historia clínica, se excluyó a los pacientes con evidencia de otra enfermedad neurológica que no fuera EA, incluyendo causas traumáticas, desmielinizantes, neoplásicas y cerebrovasculares. También los cuadros tóxicos y metabólicos. Todos los pacientes fueron estudiados con una RM Symphony 1,5 Tesla (Siemens, Erlangen, Alemania) mediante un protocolo estandarizado que incluía secuencias en inversión recuperación ponderadas en T1 (con cortes coronales perpendiculares al eje longitudinal del lóbulo temporal), con un grosor de corte de 4mm, matriz de 230×100, TR=7.000, TE=72, TI=350 y una resolución en plano de 0,8×1mm. A partir de esta secuencia, se consideraron para el análisis 5 cortes que abarcaban desde la región premamilar hasta el suelo del iv ventrículo. Los cortes obtenidos de cada uno de los pacientes fueron analizados con la escala visual propuesta por Scheltens et al.9, que gradúa la atrofia de las estructuras internas del lóbulo temporal. Esta escala utiliza una puntuación de 0-4 (fig. 1) basada en el tamaño de la circunvolución hipocámpica, la amplitud de la cisura coroidea y la del asta temporal del ventrículo lateral. Esta escala se aplicó de forma independiente en cada lóbulo temporal. La escala fue aplicada independientemente por 5 neurorradiólogos sin información de la edad y los datos clínicos del paciente (SSE, CA, LF, SSM, RM, con 6-10 años de experiencia en neurorradiología). Para estratificar la atrofia del LTM se utilizaron como referencia ejemplos comunes de cada uno de los grados de la escala. Antes del análisis, los 5 observadores se entrenaron con la escala de Scheltens. Una vez familiarizados con ella, procedieron inmediatamente a aplicarla en los sujetos del estudio. Una semana después del análisis, 2 de los observadores repitieron la evaluación de los pacientes, sin información de sus puntuaciones previas ni las de los otros neurorradiólogos para estudiar la concordancia intraobservador.
Escala del grado de atrofia medial del lóbulo temporal (Scheltens et al.). La evaluación visual de la atrofia del lóbulo temporal fue realizada en 5 cortes coronales obtenidos paralelos al suelo del iv ventrículo, usando una secuencia inversión recuperación ponderada en T1. Los cortes obtenidos en nuestro estudio fueron analizados con la escala de Scheltens, que incluye puntuaciones de 0 a 4.
Las variables cuantitativas se compararon con el test de análisis de varianza y las cualitativas, con el de la χ2. Para medir el grado de acuerdo en la puntuación del grado de atrofia del LTM inter e intraobservadores, se utilizó el coeficiente de correlación intraclase (CCI) usando el programa SPSS 17.0 para Windows. El grado de concordancia con el CCI se clasificó en muy bueno (> 0,9); bueno (0,9-0,8); moderado (0,8-0,65) y pobre (< 0,65).
ResultadosNo se encontraron diferencias significativas en edad, género ni grado de escolarización entre los 2 grupos estudiados, aunque sí en la puntuación del MMSE (tabla 1). El 80% de los pacientes que tenían DCL o EA fueron puntuados entre 2 y 4 en la escala de Scheltens, mientras que 21 de los 25 controles (84%) entre 0 y 1 (fig. 1). La concordancia tanto inter como intraobservador se encontró en el rango de 0,80-0,90, que indica un buen grado de acuerdo para la prueba. La concordancia interobservador varió entre 0,84 y 0,86 para el lóbulo temporal derecho e izquierdo, respectivamente (IC del 95%, 0,7-0,9). En la evaluación intraobservador, el CCI varió entre 0,82 y 0,87 (IC del 95%, 0,56-0,93).
DiscusiónLa atrofia de las estructuras mediales del lóbulo temporal durante el curso de la EA ha sido ampliamente documentada en estudios anatomopatológicos y neurorradiológicos. En nuestro estudio, se demuestra que la escala de Scheltens creada para valorar subjetivamente la atrofia del LTM es reproducible, lo que permite grados de concordancia inter e intraobservadores elevados tras aprenderla correctamente.
Aunque no todos los pacientes con atrofia del LTM desarrollan demencia, la RM en el momento de la primera evaluación y las sucesivas pueden ser un biomarcador importante en el proceso diagnóstico de la enfermedad5. Se ha demostrado en diferentes estudios que medir el volumen de la región medial del lóbulo temporal (de forma manual o automática) puede diferenciar a pacientes con EA leve de controles sanos, con una especificidad del 95% y una sensibilidad del 85%13,14. Sin embargo, este tipo de medidas requieren programas de segmentación que consumen tiempo, lo que hace difícil aplicarlas en la práctica clínica. En nuestro estudio, utilizamos la escala propuesta por Scheltens et al.9 para establecer visualmente el grado de atrofia del LTM en pacientes con EA y DCL, así como en un grupo de sujetos sin deterioro cognitivo, y demostramos que es reproducible. El método utilizado es simple y puede ser fácilmente trasladado a la práctica clínica estándar.
Este estudio se ha diseñado para evaluar el grado de concordancia entre diferentes neurorradiólogos y no la capacidad de discriminación entre pacientes con y sin deterioro cognitivo. Tal y como se esperaría, las puntuaciones mayores correspondieron a los pacientes con DCL o EA leve, lo que apoya el uso de la RM como biomarcador para predecir el riesgo de conversión a EA5.
Las principales limitaciones del estudio incluyen la inclusión de una muestra pequeña de pacientes con EA o DCL y que, al tratarse de un estudio de carácter transversal, impide hacer una valoración sobre el valor clínico/pronóstico de la escala de Scheltens. Por otro lado, todos los estudios fueron realizados por neurorradiólogos experimentados de un único centro, por lo que habría que determinar si la escala es reproducible también entre radiólogos de diferentes centros y sin dedicación exclusiva a la neurorradiología.
En conclusión, el análisis visual del grado de atrofia de las estructuras mediales del lóbulo temporal mediante la escala de Scheltens es un método reproducible y fácil de implementar. El buen grado de concordancia inter e intraobservador obtenido tras un adecuado aprendizaje apoya su utilización como método de análisis del grado de atrofia del lóbulo temporal en la práctica clínica.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Autoría- 1
Responsable de la integridad del estudio: SSE, CA, AR.
- 2
Concepción del estudio: AR, SSE, CA.
- 3
Diseño del estudio: CA, SSE, AR.
- 4
Obtención de los datos: CA, SSE, RM, LF, SS, CA.
- 5
Análisis e interpretación de los datos: CA, SSE, RM, LF, SS, CA.
- 6
Búsqueda bibliográfica: CA, SSE.
- 7
Redacción del trabajo: CA, SSE, AR.
- 8
Revisión crítica del manuscrito con aportaciones intelectualmente relevantes: SSE, CA, RM, LF, SS, CA, AR.
- 9
Aprobación de la versión final: SSE, CA, RM, LF, SS, CA, AR.
Los autores declaran no tener ningún conflicto de intereses.