Establecer la capacidad diagnóstica de la RM para distinguir las lesiones vertebrales benignas de las malignas.
Material y métodosIncluimos en el estudio a 85 pacientes con un total de 213 vértebras estudiadas (tanto patológicas como normales). Para cada vértebra determinamos si la lesión era hipointensa en T1 y si era hiperintensa o no en las secuencias STIR y potenciada en difusión. Calculamos el valor del cociente fuera de fase/en fase y el valor del coeficiente de difusión aparente de cada vértebra. A partir de los parámetros T1, difusión y STIR establecimos una combinación diagnóstica de lesión maligna.
ResultadosEl grupo comprendía 60 (70,6%) mujeres y 25 (29,4%) hombres con una edad media de 67±13,5 años (33-90 años). De los 85 pacientes, un total de 26 (30,6%) tenían antecedentes de tumor primario. Cuando la lesión era hipointensa en las imágenes potenciadas en T1, hiperintensa en STIR y en las imágenes potenciadas en difusión, y con un cociente de intensidad de señal mayor de 0,8, la sensibilidad fue del 97,2%; la especificidad del 90% y la exactitud diagnóstica del 91,2%. Si el paciente tenía un tumor primario conocido, los valores se incrementaron hasta el 97,2; 99,4 y 99%, respectivamente.
ConclusiónEs posible distinguir las lesiones benignas de las malignas si valoramos de forma conjunta la señal en T1, STIR y difusión y el cociente fuera de fase/en fase de la lesión detectada con RM en el cuerpo vertebral.
To determine the ability of MRI to distinguish between benign and malignant vertebral lesions.
Material and methodsWe included 85 patients and studied a total of 213 vertebrae (both pathologic and normal). For each vertebra, we determined whether the lesion was hypointense in T1-weighted sequences and whether it was hyperintense in STIR and in diffusion-weighted sequences. We calculated the in-phase/out-of-phase quotient and the apparent diffusion coefficient for each vertebra. We combined parameters from T1-weighted, diffusion-weighted, and STIR sequences to devise a formula to distinguish benign from malignant lesions.
ResultsThe group comprised 60 (70.6%) women and 25 (29.4%) men with a mean age of 67±13.5 years (range, 33-90 y). Of the 85 patients, 26 (30.6%) had a known primary tumor. When the lesion was hypointense on T1-weighted sequences, hyperintense on STIR and diffusion-weighted sequences, and had a signal intensity quotient greater than 0.8, the sensitivity was 97.2%, the specificity was 90%, and the diagnostic accuracy was 91.2%. If the patient had a known primary tumor, these values increased to 97.2%, 99.4%, and 99%, respectively.
ConclusionBenign lesions can be distinguished from malignant lesions if we combine the information from T1-weighted, STIR, and diffusion-weighted sequences together with the in-phase/out-of-phase quotient of the lesion detected in the vertebral body on MRI.
La tomografía computarizada (TC) y la resonancia magnética (RM) son las técnicas más útiles para realizar el diagnóstico diferencial de una lesión vertebral y están disponibles en la mayoría de los hospitales. Determinar la naturaleza benigna o maligna de una lesión vertebral no siempre es posible. Es especialmente difícil discriminar si las fracturas patológicas en el paciente oncológico son de naturaleza osteoporótica o metastásica. Algunas características puramente morfológicas tienen valores de sensibilidad, especificidad y exactitud diagnóstica que superan el 90%, tanto con la TC1 como con la RM2,3. Ello no impide que el diagnóstico de un porcentaje no desdeñable de lesiones requiera pruebas más sofisticadas o, incluso, biopsias. En los últimos años se han publicado diversos artículos sobre el empleo de secuencias de RM como los estudios en fase/fuera de fase4–9, las secuencias potenciadas en difusión10–18 o el coeficiente de difusión aparente (CDA)19–22 para tratar de diferenciar mejor una lesión vertebral benigna de una maligna. Los resultados de estos estudios no son del todo claros y muestran discrepancias. Por otra parte, la mayoría se han centrado en establecer la diferencia entre fractura osteoporótica y fractura metastásica.
El objetivo de nuestro estudio es determinar la capacidad diagnóstica de la RM para discriminar entre lesión vertebral benigna y maligna valorando la combinación de las características de señal en las secuencias potenciadas en T1, STIR y potenciadas en difusión, así como el cociente de señal fuera de fase/en fase y el CDA.
Material y métodosPacientesIncluimos prospectivamente en el periodo comprendido entre marzo de 2011 y septiembre de 2012 a 85 pacientes con un cuadro clínico de dolor agudo de espalda a los que se hizo una RM de columna dorsal o lumbar con el objetivo de descartar una fractura vertebral. La decisión de incluir a un paciente se tomaba tras adquirir y revisar inmediatamente la secuencia sagital potenciada en T1. Si se observaba una vértebra con una lesión hipointensa (alteración de señal, focal o difusa, igual o menor que la del músculo) o hiperintensa (alteración de señal, focal o difusa, similar a la de la grasa subcutánea), se realizaba el protocolo completo de secuencias y medidas. Este protocolo también se aplicaba cuando existía una alteración morfológica del cuerpo vertebral (acuñamiento igual o superior al 25%). No solo se incluían lesiones sospechosas de malignidad sino cualquier lesión hipointensa o hiperintensa en la secuencia potenciada en T1. En cada paciente se estudiaron una vértebra normal (sin alteración morfológica ni lesiones hipo o hiperintensas) y una, 2 o 3 vértebras patológicas. Incluir un número variable de vértebras patológicas dependía del número de vértebras que presentaban lesiones en un mismo paciente. El número total de vértebras estudiadas (tanto patológicas como normales) fue de 213, una media de 2,5 vértebras por paciente. El diagnóstico definitivo de cada lesión se estableció con las diferentes pruebas de imagen (radiografía, ecografía, TC, RM, PET-TC), la analítica y la evolución clínica. Por ejemplo, en los pacientes con metástasis, la presencia de lesiones similares en otras vértebras, los marcadores tumorales elevados y la historia oncológica del paciente permitían hacer un diagnóstico con alta certeza. Además de esos criterios, se añadió el seguimiento durante al menos 6 meses en todos los pacientes para garantizar la estabilidad tanto en el número como en las características de la lesión. En 6 casos fue necesaria la realización de biopsia.
Todos los pacientes firmaron el consentimiento informado que habitualmente se entrega cuando se realiza una RM de columna. No se consideró necesario incluir un consentimiento especial ni la aprobación del comité de ética ya que el protocolo que se aplicó no requería medidas agresivas, no se administraba contraste intravenoso ni se empleaban radiaciones ionizantes, y es el protocolo habitual cuando se considera necesario establecer un diagnóstico diferencial de lesión benigna/maligna en nuestro departamento.
Técnica de estudioTodas las exploraciones fueron realizadas en un equipo de RM de 1,5T (Signa Excite; General Electric). El protocolo de imágenes incluyó secuencias SE potenciada en T1 (TR/TE 500/16ms) y FSE potenciada en T2 en planos axial (TE/TE 3700/110ms) y sagital (TR/TE 4225/110ms); STIR (TR/TE/TI 3975/50/150ms) en el plano sagital; secuencias en fase (TR/TE 175/4,2ms; ángulo de inclinación 30°) y fuera de fase (TR/TE 175/2ms; ángulo de inclinación 30°) en el plano sagital; y secuencia potenciada en difusión single-shot SE EPI (TR/TE 3200/78,5ms con valores b=0 y b=400), también en el plano sagital
Recogida de datosDos radiólogos con más de 15 años de experiencia en radiología musculoesquelética (primer y segundo autor) revisaron las imágenes y determinaron para cada uno de los 213 cuerpos vertebrales si existía alteración de señal o morfológica en la secuencia potenciada en T1 y si la lesión era o no hiperintensa con respecto a la médula ósea normal en las secuencias STIR y potenciada en difusión. En la estación de trabajo calculamos el valor del cociente fuera de fase/en fase tras colocar un ROI en cada cuerpo vertebral, ubicándolo en el centro de la vértebra (si esta era normal) o en la lesión focal. También se obtuvo el valor del CDA de cada vértebra.
Análisis estadísticoLas variables cualitativas se presentan como frecuencias absolutas y relativas, y las cuantitativas como media y desviación estándar.
Para estudiar la validez de los parámetros en el diagnóstico de metástasis estimamos la sensibilidad, especificidad y exactitud diagnóstica. Para evaluar la capacidad discriminatoria de los marcadores cuantitativos, cociente fuera de fase/en fase y CDA, se estimó el área bajo la curva ROC y calculamos el punto de corte que maximizaba los valores de sensibilidad y especificidad con sus intervalo de confianza al 95%. Combinamos los parámetros evaluados buscando un algoritmo diagnóstico con sensibilidad y especificidad máximas. Los cálculos estadísticos se realizaron con el programa SPSS Statistics 17 (IBM, Armonk. Nueva York. EE. UU.)
ResultadosLa edad media fue de 67±13,5 años (rango 33-90 años). El grupo comprendía 60 (70,6%) mujeres y 25 (29,4%) hombres. De los 85 pacientes, 26 (30,6%) tenían antecedentes personales de neoplasia primaria (11 pacientes con neoplasia de mama, 6 de origen pulmonar, 5 neoplasias de próstata y 4 otras localizaciones). Del total de 213 vértebras, 85 (39,9%) eran normales y 128 (60,1%) patológicas. La distribución de las lesiones fue: metástasis (35 casos; 27%), fracturas agudas osteoporóticas (28 casos; 22%), hemangiomas (19 casos; 15%), fracturas crónicas osteoporóticas (16 casos; 12,5%), espondilosis (14 casos; 11%) y miscelánea (16 casos; 12,5%). Estos últimos incluyeron casos de espondilodiscitis, nódulos de Schmörl y otros tumores benignos.
De los 35 casos de metástasis estudiados, la mayoría eran lesiones focales o difusas sin alteración de la altura del cuerpo vertebral. Solo había 4 fracturas metastásicas. El número de pacientes que presentaban metástasis fue 17/85 lo que supone una prevalencia del 20% en nuestra serie.
Los hemangiomas fueron todos típicos (hiperintensos en las imágenes potenciadas en T1 y T2), salvo uno hipointenso en las imágenes potenciadas en T1 y otro que clínicamente cursaba con dolor (ambos casos confirmados mediante biopsia).
Los casos de espondilosis consistieron en cuerpos vertebrales que presentan lesiones tipo Modic de cualquier tipo.
Entre las 6 biopsias realizadas, el estudio histopatológico demostró 2 metástasis (carcinoma de mama y fractura metastásica única) y 4 lesiones benignas (2 hemangiomas, una espondilodiscitis y un caso con cambios inflamatorios).
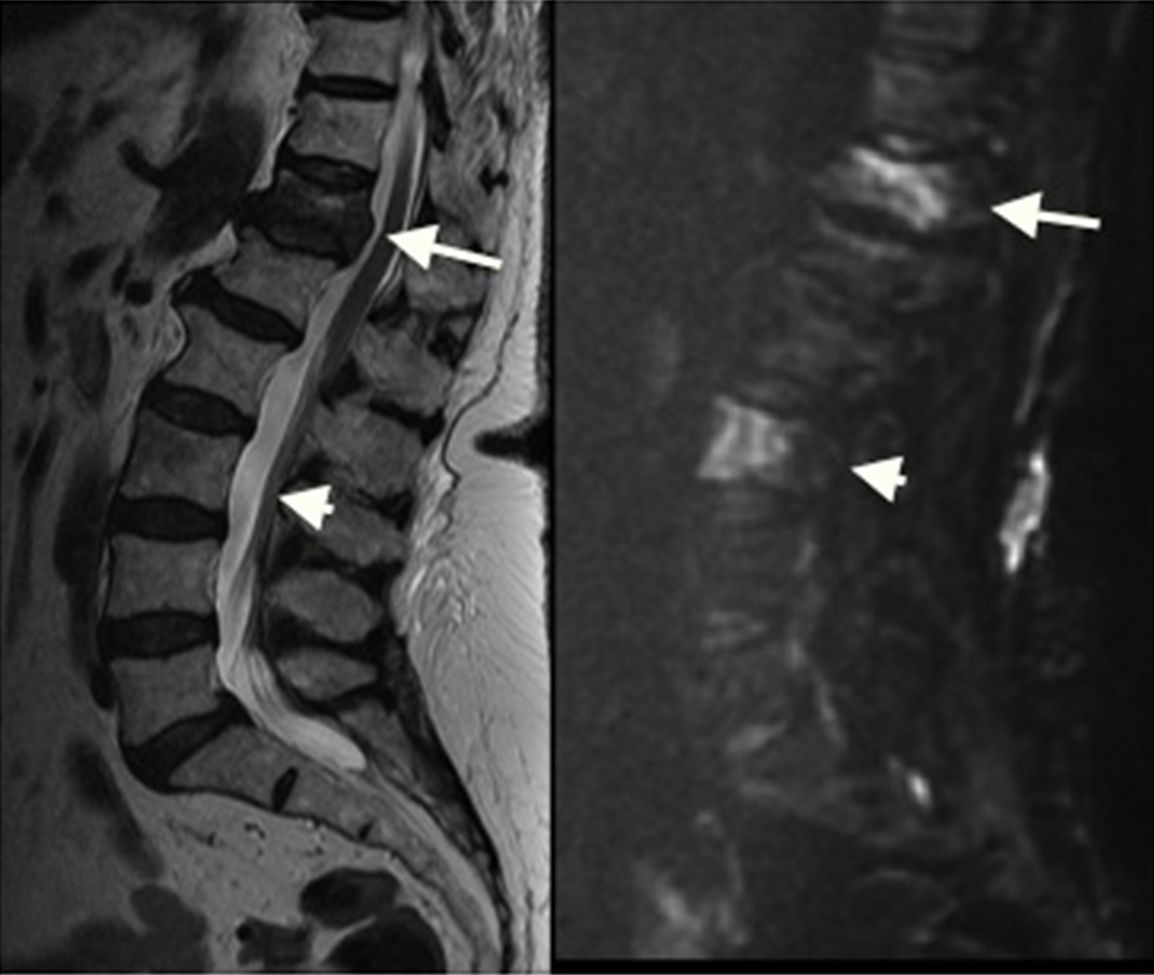
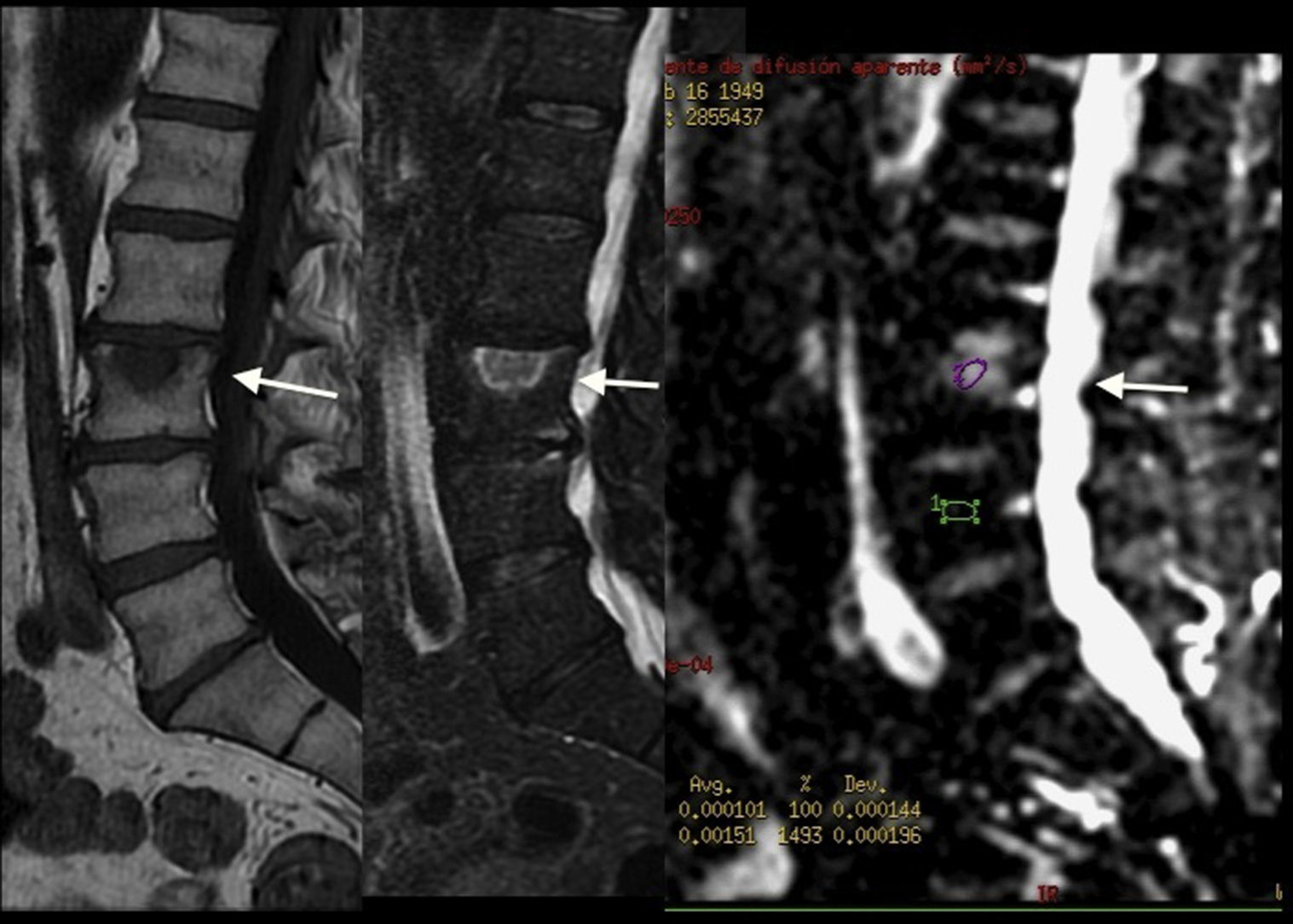
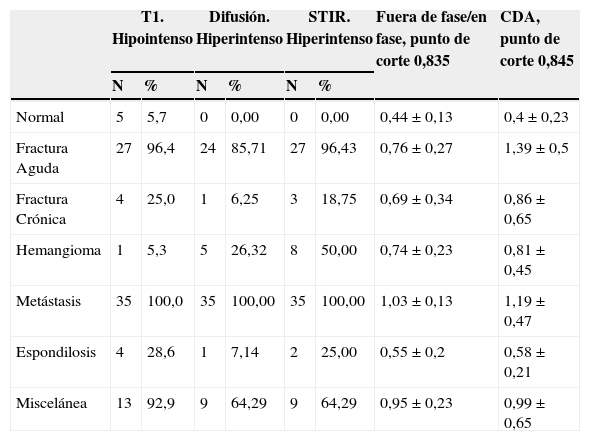
En la tabla 1 se muestran los resultados de los diversos parámetros evaluados: vertebral normal, espondilosis, hemangioma, fractura crónica, fractura aguda (fig. 1) o metástasis (fig. 2). Las características de las fracturas agudas y las metástasis fueron similares, porque en ambos casos la vértebra era hipointensa en las secuencias potenciadas en T1 e hiperintensa en STIR y en las secuencias potenciadas en difusión. Los valores de CDA pueden ser muy variables. En general, los más elevados corresponden a las fracturas agudas pero todas las entidades estudiadas mostraron gran variabilidad. Por el contrario, el cociente de fuera de fase/en fase>0,8 resultó ser muy sugestivo de lesión maligna. De los 19 hemangiomas vertebrales, en 10 el cociente de intensidad de señal fue>0,8. También superaban este valor algunas fracturas agudas.
Hallazgos en la RM en función de la patología
| T1. Hipointenso | Difusión. Hiperintenso | STIR. Hiperintenso | Fuera de fase/en fase, punto de corte 0,835 | CDA, punto de corte 0,845 | ||||
|---|---|---|---|---|---|---|---|---|
| N | % | N | % | N | % | |||
| Normal | 5 | 5,7 | 0 | 0,00 | 0 | 0,00 | 0,44±0,13 | 0,4±0,23 |
| Fractura Aguda | 27 | 96,4 | 24 | 85,71 | 27 | 96,43 | 0,76±0,27 | 1,39±0,5 |
| Fractura Crónica | 4 | 25,0 | 1 | 6,25 | 3 | 18,75 | 0,69±0,34 | 0,86±0,65 |
| Hemangioma | 1 | 5,3 | 5 | 26,32 | 8 | 50,00 | 0,74±0,23 | 0,81±0,45 |
| Metástasis | 35 | 100,0 | 35 | 100,00 | 35 | 100,00 | 1,03±0,13 | 1,19±0,47 |
| Espondilosis | 4 | 28,6 | 1 | 7,14 | 2 | 25,00 | 0,55±0,2 | 0,58±0,21 |
| Miscelánea | 13 | 92,9 | 9 | 64,29 | 9 | 64,29 | 0,95±0,23 | 0,99±0,65 |
CDA: coeficiente de difusión aparente; STIR: short-tau inversion-recovery.
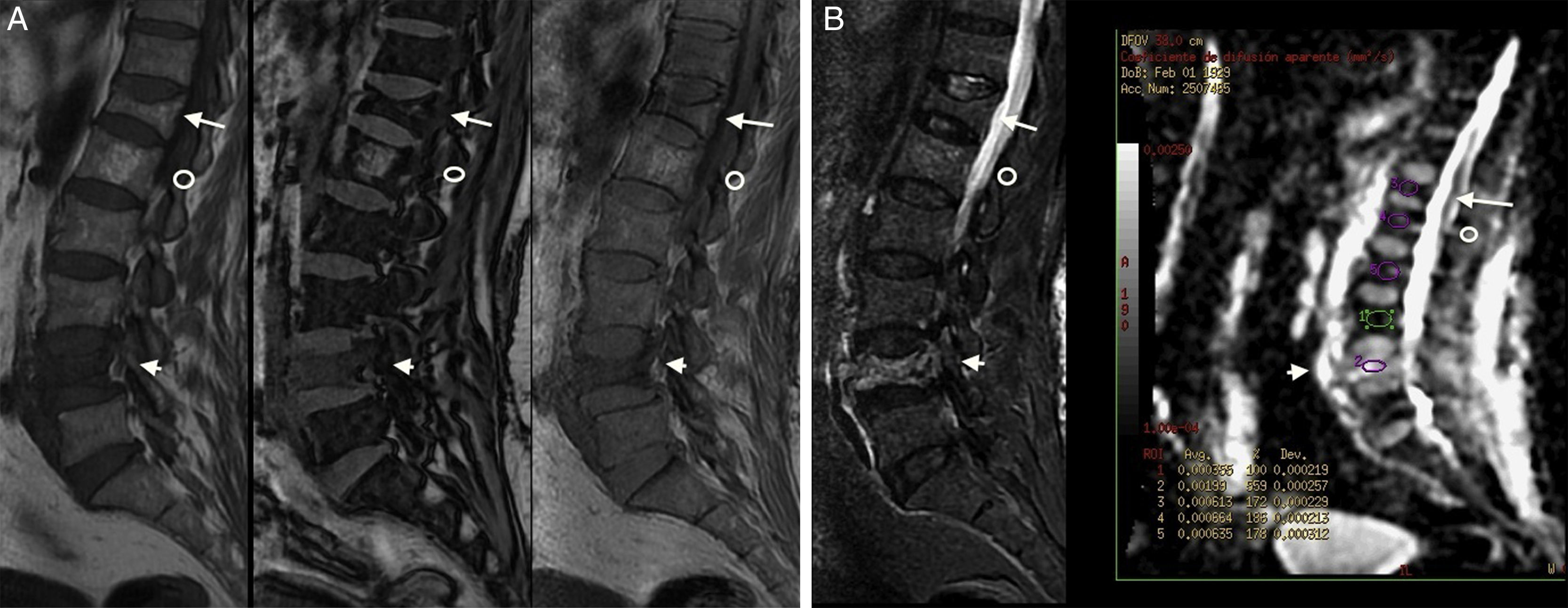
A) Imágenes sagitales SE T1 (izquierda), fuera de fase (centro) y en fase (derecha) de la columna lumbar de una paciente con neoplasia mamaria en la que se identifica una fractura crónica en T12 (flecha), un hemangioma en L1 (círculo) y una fractura aguda en L4 (cabeza de flecha). La fractura crónica no presenta alteración de señal en ninguna secuencia. El hemangioma muestra el aumento de señal típico en T1 y la fractura aguda presenta alteración de señal en todas las secuencias con un cociente de fuera de fase/en fase (no mostrado en la imagen) de 0,8. B) Imágenes sagitales STIR (izquierda) y potenciada en difusión con valores de coeficiente de difusión aparente-CDA (derecha) de la misma paciente. La fractura crónica (flecha) no muestra hiperintensidad en STIR ni en la imagen potenciada en difusión. El hemangioma (círculo) brilla ligeramente en STIR pero no en la imagen potenciada en difusión; y la fractura aguda brilla (cabeza de flecha) tanto en la imagen potenciada en difusión como en STIR. El valor de CDA es alto (mayor de 1,9).
Por último, existe una miscelánea de entidades no malignas como la espondilodiscitis, nódulos de Schmörl (fig. 3) y otros tumores benignos, que pueden tener un comportamiento muy similar al de las lesiones metastásicas pero no es posible extraer conclusiones estadísticamente significativas por el tamaño de nuestra muestra.
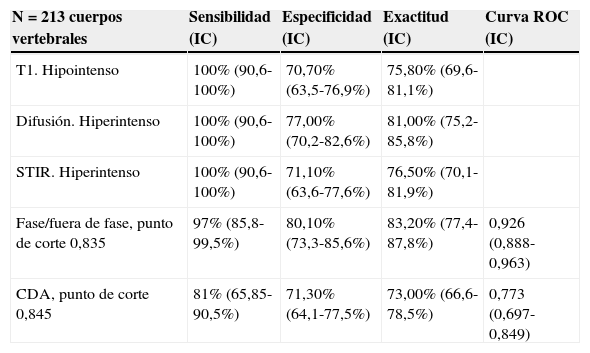
En la tabla 2 se reflejan los resultados de la validación de los diferentes parámetros considerados para el diagnóstico de metástasis. Los valores de sensibilidad de los cambios de intensidad de señal en las secuencias potenciadas en T1, STIR y difusión son muy altos, del orden del 100%. La especificidad es también aceptable, del orden del 70-80%.
Valores de sensibilidad, especificidad y exactitud diagnóstica
| N=213 cuerpos vertebrales | Sensibilidad (IC) | Especificidad (IC) | Exactitud (IC) | Curva ROC (IC) |
|---|---|---|---|---|
| T1. Hipointenso | 100% (90,6-100%) | 70,70% (63,5-76,9%) | 75,80% (69,6-81,1%) | |
| Difusión. Hiperintenso | 100% (90,6-100%) | 77,00% (70,2-82,6%) | 81,00% (75,2-85,8%) | |
| STIR. Hiperintenso | 100% (90,6-100%) | 71,10% (63,6-77,6%) | 76,50% (70,1-81,9%) | |
| Fase/fuera de fase, punto de corte 0,835 | 97% (85,8-99,5%) | 80,10% (73,3-85,6%) | 83,20% (77,4-87,8%) | 0,926 (0,888-0,963) |
| CDA, punto de corte 0,845 | 81% (65,85-90,5%) | 71,30% (64,1-77,5%) | 73,00% (66,6-78,5%) | 0,773 (0,697-0,849) |
CDA: coeficiente de difusión aparente; IC: intervalo de confianza; ROC: receiver operating characteristic; STIR: short time inversion recovery.
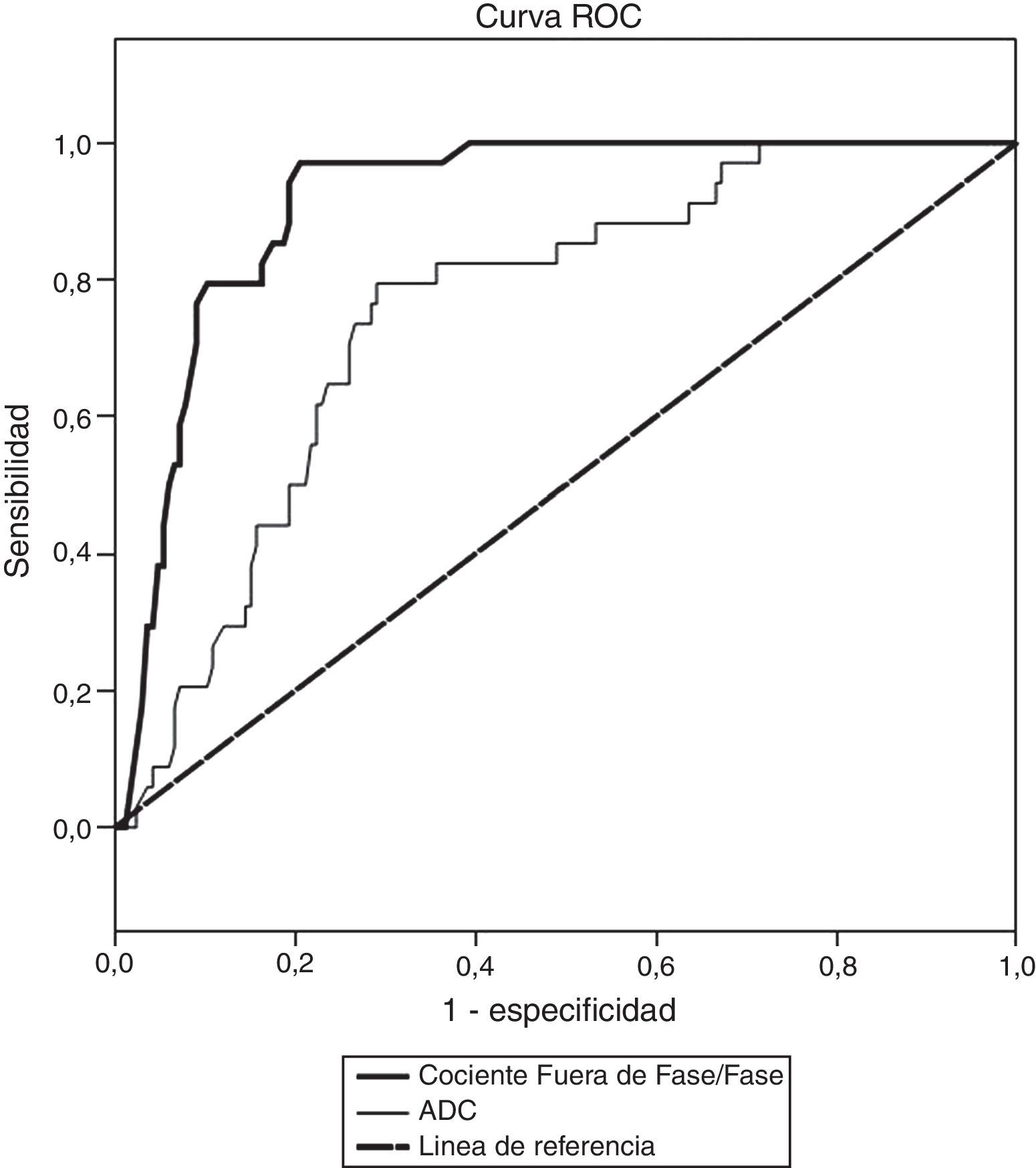
En cuanto al cociente de intensidad de señal y el CDA, las áreas bajo la curva fueron de 0,926 y 0,773 respectivamente (fig. 4). El punto de corte que maximiza la especificidad y sensibilidad es 0,83 para el cociente y 0,85 para el CDA. Si se toma 1,05 como punto de corte del cociente, la especificidad mejora hasta el 95%, especialmente cuando es necesario disminuir la probabilidad de un falso positivo.
A partir de los parámetros que ofrecen alta sensibilidad en T1, difusión y STIR, y buscando un punto de corte de alta especificidad en el cociente, establecimos una prueba combinada diagnóstica de lesión maligna, de forma que un estudio que muestre una lesión hipointensa en las imágenes potenciadas en T1, hiperintensa en STIR y en las imágenes potenciadas en difusión, y con un cociente de intensidad de señal fuera de fase/en fase>0,8, tendrá una sensibilidad del 97,2%, una especificidad del 90% y una exactitud diagnóstica del 91,2%. Si estas variables aparecen en un paciente con un tumor primario conocido, los valores son del 97,2; 99,4; y 99%, respectivamente, es decir, se incrementan sobre todo la especificidad y la exactitud diagnóstica.
DiscusiónNuestro estudio ha estado dirigido a evaluar los cambios de señal en los cuerpos vertebrales, tanto en lesiones benignas como malignas, en secuencias potenciadas en T1, STIR y difusión, así como el valor discriminatorio del cociente fuera de fase/en fase y de los valores de CDA. Según nuestros resultados, una lesión hipointensa en las imágenes potenciadas en T1, hiperintensa en STIR y en las imágenes potenciadas en difusión, y un cociente fuera de fase/en fase>0,8 tiene una sensibilidad del 97,2%, una especificidad del 99,4% y una exactitud diagnóstica del 99% para diagnosticar una lesión maligna si el paciente tiene un tumor primario conocido.
El diagnóstico diferencial de una fractura vertebral es especialmente importante en el paciente oncológico ya que es trascendental diferenciar un origen metastásico de una causa osteoporótica. Los primeros trabajos sugirieron que la combinación de parámetros morfológicos que individualmente no son específicos permite alcanzar valores de sensibilidad y especificidad muy altos (mayores del 90%) tanto por TC1 como por RM2,3, lo que parece suficiente para el diagnóstico diferencial en la mayoría de los casos de la práctica clínica. El empleo de nuevas secuencias como las potenciadas en difusión y el cálculo de parámetros cuantitativos como el cociente fuera de fase/en fase o el CDA han demostrado su utilidad en el diagnóstico de estos pacientes.
Ha sido ampliamente descrito en la bibliografía que las metástasis aparecen hipointensas en las imágenes potenciadas en T1, excepto las metástasis hiperintensas del melanoma, que son raras23. En nuestro estudio, el 100% de las metástasis fueron hipointensas en las imágenes potenciadas en T1. Sin embargo, las fracturas agudas se manifiestan igual (96,4% de casos en nuestra serie). Algo similar ocurre en la secuencia STIR, donde ambos tipos de lesiones son hiperintensas, datos que concuerdan con los de otros estudios14; o, incluso, en la secuencia potenciada en difusión, en la que la variabilidad en la bibliografía es alta. La secuencia potenciada en difusión es una técnica de imagen funcional que aporta información complementaria a las secuencias convencionales18. Baur et al.10 fueron los primeros en afirmar la gran utilidad de esta secuencia para diferenciar la fractura metastásica de la osteoporótica aguda. Estudiaron a 22 pacientes con fracturas agudas y a 17 con fracturas metastásicas. Todas las vértebras con lesiones benignas aparecieron iso o hipointensas en la secuencia potenciada en difusión, mientras que las vértebras metastásicas fueron hiperintensas. Estos prometedores resultados no fueron corroborados por otros autores11 que no obtenían beneficio en el empleo de la difusión para realizar el diagnóstico diferencial aunque resulta llamativo que su muestra solo incluía 15 pacientes. El primer metaanálisis publicado por Karchevsky et al.12 puso de manifiesto la variabilidad de resultados y comprobó que en 8 de los estudios analizados tanto las fracturas metastásicas como las osteoporóticas agudas tenían un aumento de señal en las imágenes potenciadas en difusión por el efecto T2, que enmascaraba el auténtico valor de la difusión, y que podría solventarse calculando el CDA. Otros autores han aportado datos similares13. En una serie de 64 lesiones con 27 fracturas benignas y 27 tumorales, estudiadas con secuencias potenciadas en T1, T2, STIR y difusión, la hiperintensidad en las secuencias potenciadas en difusión tuvo una sensibilidad y una especificidad del 93 y el 90%, respectivamente14.
En nuestra serie, todas las metástasis restringían la difusión y, por tanto, eran hiperintensas. Sin embargo, muchas fracturas agudas evidenciaban un aumento de señal sutil en las imágenes potenciadas en difusión, quizá atribuible al efecto T2, y solo 4 casos (16%) mostraban una hiperintensidad evidente. Pese a ello, esta secuencia no es suficiente para el diagnóstico diferencial, porque es muy sensible pero poco específica15. Los hallazgos en las imágenes potenciadas en difusión y los valores CDA tienen que interpretarse junto con otros signos. Además, las metástasis escleróticas dan lugar a falsos negativos porque no aumentan la señal en las imágenes potenciadas en difusión.
En algunos trabajos anteriores el valor del CDA ha sido útil para diferenciar las lesiones benignas de las malignas16,19,21–24. Pozzi et al.16 estudiaron 33 casos (23 fracturas malignas y 10 osteoporóticas) y tanto las imágenes potenciadas en difusión como el valor del CDA fueron útiles. Balliu et al.21 estudiaron a 45 pacientes (16 fracturas osteoporóticas, 15 metástasis y 14 procesos infecciosos) en los que el valor de CDA fue útil para diferenciar la fractura osteoporótica de la metastásica pero no para distinguir la osteoporosis de la infección. Por el contrario, Maeda et al.20 estudiaron 36 casos de fracturas vertebrales malignas y benignas y concluyeron que los valores de CDA se solapan. En la misma línea de estos autores, el CDA, aunque es mayor en las fracturas osteoporóticas agudas de nuestra serie, se solapa con el de las metástasis y, sobre todo, hay solapamiento entre metástasis y fracturas crónicas.
Otro parámetro estudiado en diversos artículos4–9 es el cociente entre la señal en las secuencias en fuera de fase y en fase. Todos ellos encontraron resultados significativos cuando consideraban como punto de corte para discriminar benigno/maligno el valor 0,8. Por ejemplo, para Erly et al.8 la sensibilidad fue del 95% y la especificidad del 89%. Estos hallazgos coinciden con los nuestros, y es un parámetro diferencial mucho más relevante que el CDA.
Nuestros resultados muestran que no hay un único parámetro óptimo para separar las lesiones benignas de las malignas. Un metaanálisis reciente revisó sistemáticamente 31 artículos publicados que buscaban diferenciar las fracturas vertebrales malignas de las benignas17. Su conclusión fue que hay 6 criterios morfológicos que demuestran que la fractura es maligna, 3 criterios morfológicos que sugieren que la fractura es benigna, otros 2 criterios morfológicos que orientan hacia malignidad (otras metástasis) o benignidad (fracturas osteoporóticas) y 2 parámetros cuantitativos (cociente fuera de fase/en fase y CDA) que tienen sensibilidad excelente (mayor del 95%) y una especificidad algo mayor del 80%.
Nuestro trabajo tiene la peculiaridad de haber integrado las características de señal de los cuerpos vertebrales con el cálculo de variables cuantitativas, con lo que pudimos diagnosticar las metástasis con una sensibilidad del 97,2%, una especificidad del 90% y una exactitud diagnóstica del 91,2%. Pero si estas variables (lesión hipointensa en las imágenes potenciadas en T1, hiperintensa en STIR e imágenes potenciadas en difusión, y cociente>0,8) se dan en pacientes con un tumor primario conocido, los valores se incrementan hasta el 97,2;, 99,4; y 99% respectivamente25.
En nuestra opinión, diferenciar entre fractura vertebral osteoporótica y tumoral no suele ser un problema en la mayoría de los casos. De acuerdo con nuestra experiencia, cuando un paciente con un tumor primario conocido tiene una lesión vertebral sospechosa, es una metástasis en el 99% de casos. Por el contrario, en pacientes sin antecedentes oncológicos conocidos pero con síntomas que llevan a realizar una RM vertebral, hay lesiones benignas con características de malignas que obligan a hacer biopsias, aunque en ninguna de ellas la lesión fue maligna.
Nuestro estudio tiene algunas limitaciones. En primer lugar, hay un sesgo de selección de pacientes porque se solicitan muchas más RM a pacientes oncológicos que a pacientes con fracturas osteoporóticas que, siendo mucho más frecuentes, no están representadas con arreglo a dicha frecuencia. Igual ocurre con el mieloma múltiple, una entidad relativamente frecuente pero que, en nuestro medio, no se suele estudiar mediante RM. Tampoco están suficientemente representadas otras entidades que nosotros hemos agrupado bajo el epígrafe de miscelánea y de las que no podemos hacer un análisis estadístico adecuado. En segundo lugar, el valor b=400 que permite nuestro equipo de RM es un poco bajo y puede favorecer el efecto T2 en la imagen potenciada en difusión, pero era un parámetro que no podíamos modificar. En tercer lugar, también puede considerarse una limitación el hecho de no haber evaluado parámetros morfológicos puros por considerarlos suficientemente estudiados en la bibliografía. Finalmente, el diagnóstico anatomopatológico solo fue posible en 6 pacientes, si bien los hallazgos en las imágenes, la historia clínica y la evolución (todos los pacientes fueron seguidos al menos durante 6 meses) nos permiten decir que el diagnóstico de enfermedad benigna o maligna fue correcto.
En resumen, el diagnóstico diferencial entre lesión benigna y maligna se puede realizar mediante RM si valoramos conjuntamente las características de señal en las secuencias potenciadas en T1, STIR y difusión y el cociente de fuera de fase/en fase de la lesión detectada en el cuerpo vertebral, y solo en un número reducido de pacientes hay que recurrir a la biopsia. Será muy interesante realizar estudios prospectivos que eviten los sesgos que hemos mencionado y que incluyan todas las variables morfológicas, de intensidad de señal y cualitativas.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de paciente
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Autorías- 1.
Responsable de la integridad del estudio: JMV
- 2.
Concepción del estudio: JMV
- 3.
Diseño del estudio: JMV, ABH
- 4.
Obtención de los datos: JMV, ABH
- 5.
Análisis e interpretación de los datos: JMV, ABH, SMM
- 6.
Tratamiento estadístico: EPF
- 7.
Búsqueda bibliográfica: JMV
- 8.
Redacción del trabajo: JMV
- 9.
Revisión crítica del manuscrito con aportaciones intelectualmente relevantes: ABH, EPF, SMM
- 10.
Aprobación de la versión final: JMV, ABH, EPF, SMM
Los autores declaran no tener ningún conflicto de intereses.