Desde su introducción, el objetivo principal de un PET/TAC fue proporcionar estudios de alta calidad clínica tanto de PET como de TAC, y presentarlos a los médicos nucleares y radiólogos como una imagen fusionada y perfectamente alineada. El uso de las imágenes de PET y TAC fusionadas se convirtió en muy poco tiempo en rutina clínica, lo que demuestra el gran potencial que tienen estos equipos híbridos. Gracias a este éxito, los fabricantes se han centrado en diseñar sistemas PET y TAC de alto rendimiento y prestaciones, en lugar de ver al TAC en una función más reducida como la de mero corrector de la atenuación para PET. Desde el primer sistema PET/TAC comercial en 2001, tanto la componente PET como la TAC han mejorado enormemente. En el caso del PET, cristales centelleadores más rápidos y con alto poder de frenado como el LYSO han posibilitado la construcción de dispositivos con una mayor sensibilidad, con reducción en el número de coincidencias no deseadas y el uso de la técnica de tiempo de vuelo (TOF, Time of Flight). Todos estos avances llevan a un aumento de la detección de lesiones, especialmente en situaciones con fondo muy ruidoso. Los métodos de reconstrucción iterativos junto con las correcciones implementadas durante la reconstrucción y el uso de la función de dispersión de punto han proporcionado mejoras en la calidad de la imagen. Paralelamente, se han producido mejoras significativas en la instrumentación del TAC, y se puede considerar que los TAC de 64 y 128 filas de detectores han sido incorporados a los PET/TAC actuales. Con ello se pueden obtener imágenes anatómicas de alta calidad diagnóstica en unos pocos segundos y estas se usan tanto para la corrección de atenuación del PET como para proporcionar información diagnóstica. Además, en la actualidad casi todos los escáneres PET/TAC cuentan con su sistema de modulación de la dosis en función de la región escaneada que se imparte al paciente por estudio de TAC. En este artículo se revisarán las bases físicas del PET y del TAC por separado, se describirán las modificaciones realizadas en la instrumentación y los protocolos estándar de un sistema conjunto PET/TAC y se finalizará destacando los avances más importantes de este sistema híbrido.
Since it was first introduced, the main goal of PET/CT has been to provide both PET and CT images with high clinical quality and to present them to radiologists and specialists in nuclear medicine as a fused, perfectly aligned image. The use of fused PET and CT images quickly became routine in clinical practice, showing the great potential of these hybrid scanners. Thanks to this success, manufacturers have gone beyond considering CT as a mere attenuation corrector for PET, concentrating instead on design high performance PET and CT scanners with more interesting features. Since the first commercial PET/CT scanner became available in 2001, both the PET component and the CT component have improved immensely. In the case of PET, faster scintillation crystals with high stopping power such as LYSO crystals have enabled more sensitive devices to be built, making it possible to reduce the number of undesired coincidence events and to use time of flight (TOF) techniques. All these advances have improved lesion detection, especially in situations with very noisy backgrounds. Iterative reconstruction methods, together with the corrections carried out during the reconstruction and the use of the point-spread function, have improved image quality. In parallel, CT instrumentation has also improved significantly, and 64- and 128-row detectors have been incorporated into the most modern PET/CT scanners. This makes it possible to obtain high quality diagnostic anatomic images in a few seconds that both enable the correction of PET attenuation and provide information for diagnosis. Furthermore, nowadays nearly all PET/CT scanners have a system that modulates the dose of radiation that the patient is exposed to in the CT study in function of the region scanned. This article reviews the underlying physics of PET and CT imaging separately, describes the changes in the instrumentation and standard protocols in a combined PET/CT system, and finally points out the most important advances in this hybrid imaging modality.
Un sistema PET/TAC junta las capacidades de un tomógrafo por emisión de positrones (PET) y un tomógrafo axial computarizado (TAC) en un solo dispositivo con camilla y sistema de adquisición compartidos, de manera que el examen médico del paciente se puede realizar por ambas modalidades en una única cita sin tener que cambiar de camilla. Con este diseño se eliminan prácticamente diferencias en el posicionamiento del paciente y se reduce la desalineación debida a movimientos involuntarios e internos del paciente. Ambos dispositivos proporcionan una imagen tomográfica que representa un corte transversal del cuerpo y cada modalidad da un tipo de información. Mientras el PET da la distribución de emisores de positrones en el cuerpo proporcionando información funcional de los tejidos y molecular de los procesos biológicos a través del uso de radiofármacos, el TAC informa de las distintas densidades de los tejidos generando una imagen anatómica de alta resolución del cuerpo del paciente. Por tanto, la combinación de ambos sistemas ofrece información metabólica y estructura anatómica, presentándose como un dispositivo superior a cualquiera de los sistemas PET y TAC por separado. Esto último genera que los diagnósticos clínicos surgidos de la unión PET/TAC sean notablemente mejores tanto a nivel de sensibilidad como de especificidad1–3.
Además de la ganancia obtenida en la combinación de informaciones, existe una serie de ventajas cuando se añade un TAC a un PET. Por un lado, se consigue una corrección de atenuación rápida y poco ruidosa para los datos de emisión del PET. Por otro lado, el hecho de tener ambos tipos de imagen corregistrados con una gran resolución permite distinguir captación fisiológica de captaciones debidas a neoplasias malignas. Cambiando el punto de vista, el hecho de unir un PET a un TAC genera un dispositivo que permite distinguir tejido maligno de benigno, lo que ayuda a la detección precoz de tumores que aún no son visibles en un escáner TAC solo4. A nivel administrativo, el beneficio potencial es el ahorro que supone realizar una adquisición que proporciona las dos modalidades de imagen frente a la situación en la que se deben de realizar las dos adquisiciones por separado. Finalmente, para el paciente implica una mayor comodidad, ya que en una sola visita al hospital se consigue el estudio combinado. Las desventajas potenciales son la inversión inicial, la necesidad de una sala mayor para alojar ambos sistemas y la complejidad del dispositivo dual, pero todas ellas quedan superadas por los beneficios de la combinación, y por ello en los últimos años la mayoría de los escáneres PET se compran acoplados con TAC.
El primer prototipo PET-TAC se desarrolló en la Universidad de Pittsburgh, en mayo de 19985, y se dedicó a la investigación en pacientes oncológicos durante los primeros años. Desde la comercialización en 2001 del primer PET/TAC, la modalidad ha tenido un impacto fundamental en la imagen médica y desde entonces se han instalado más de 2500 sistemas en EE.UU., Europa, Asia y Australia6.
La principal aplicación del PET/TAC es en oncología1; los estudios oncológicos representan un 95% del total de estudios clínicos del PET, y se emplean para el diagnóstico, estadificación y monitorización de la respuesta al tratamiento. En el caso de la oncología, el PET/TAC es capaz de detectar pequeñas diferencias en el metabolismo de diferentes tejidos estudiados con diferentes radiotrazadores, como es el caso del 18F-FDG o del 18F-FLT. El FDG es un análogo de la glucosa, y como las células malignas crecen de una manera significativamente más rápida, captan más 18F-FDG de lo que lo hacen las células normales. Por la capacidad de diferenciar entre las células malignas y benignas, el PET/TAC se ha convertido en un método muy popular en el diagnóstico y la visualización de tumores. Otras indicaciones son la planificación del tratamiento en radioterapia (RT)7,8 y servir como guía para facilitar la realización de biopsias. Otras especialidades que se benefician de la combinación de ambas tecnologías son la cardiología y la neurología. Dentro de la investigación se ha convertido en un escáner para el estudio del mapeo del cerebro humano, estudios de función cardiaca y desarrollo de nuevos fármacos.
En este trabajo revisaremos la parte instrumental del escáner PET/TAC comenzando por las bases físicas de ambos dispositivos. Posteriormente se resumirán las principales características de funcionamiento de los escáneres que se encuentran en la actualidad instalados en los hospitales. Para finalizar, se hará una revisión de lo que ofrecen los nuevos PET/TAC de las principales casas comerciales.
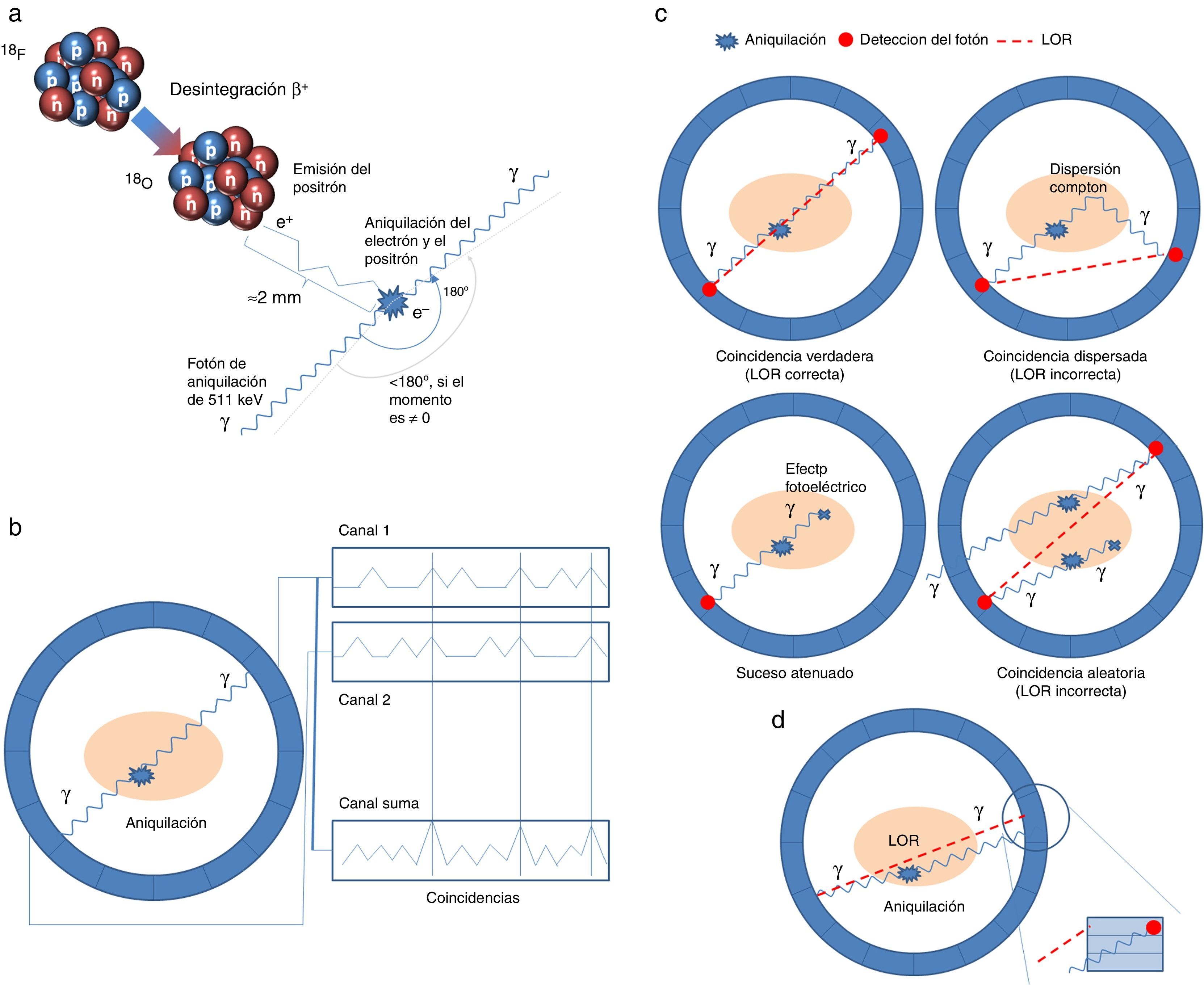
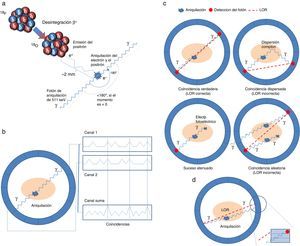
Bases físicas e instrumentaciónPETEn un PET, un fármaco marcado con un isótopo emisor de positrones se inyecta por vía venosa en el paciente, se distribuye por el cuerpo a través del torrente sanguíneo y entra en los órganos. En función del radiofármaco empleado se deja un tiempo de distribución entre la inyección y el estudio PET; para el caso de la FDG, este tiempo suele ser de unos 60min. Cuando el radioisótopo sufre una desintegración β+, se emite un positrón que viaja una distancia de hasta unos pocos milímetros antes de aniquilarse con un electrón de los materiales que forman los tejidos. En la aniquilación se generan un par de fotones que se mueven casi en direcciones opuestas (v. fig. 1a). Los pares de fotones de aniquilación que salen del cuerpo humano y se detectan en coincidencia (coincidencias) por el escáner PET son la base de la imagen de esta modalidad. Los fotones de aniquilación son detectados por detectores que rodean el paciente dispuestos en forma de anillo (ilustrado en la figura 1b). A las detecciones individuales de estos fotones se las conoce como sucesos únicos, y la tasa de sucesos procesada por cada detector individual es la tasa de sucesos únicos. Dentro de las coincidencias podemos distinguir las coincidencias verdaderas de las coincidencias dispersadas y las aleatorias. La figura 1c ilustra los tres tipos de coincidencias que tienen lugar en un escáner PET convencional. Las primeras son las deseadas, ya que implica que la detección en coincidencia es debida a una única aniquilación que ha tenido lugar dentro del paciente y los fotones han mantenido su dirección original. Las coincidencias dispersadas tienen lugar cuando uno de los fotones de la aniquilación ha sido dispersado y no viaja en la dirección original. Las coincidencias aleatorias o accidentales se corresponden con detecciones en coincidencia de dos fotones que originariamente provienen de dos aniquilaciones distintas. El objetivo fundamental de la imagen en PET es, a partir de las detecciones, reconstruir la distribución original del radiofármaco dentro del cuerpo que se corresponde con las coincidencias verdaderas. Por tanto, se han de minimizar, estimar y corregir por las coincidencias dispersadas y las aleatorias. Hay que señalar que mientras las coincidencias verdaderas y las dispersadas aumentan linealmente con la actividad en el paciente, el incremento de las coincidencias accidentales es cuadrático con la actividad en el paciente, y estas últimas dominan cuando las actividades son altas. Varios trabajos9–12 sobre las bases físicas del PET se resumen a continuación.
Los detectores PET consisten en cristales centelleadores acoplados con tubos fotomultiplicadores (PMT). Cuando el fotón de aniquilación interacciona en el cristal centelleador se produce el centelleo (haz de luz visible o próxima al visible) y este es convertido en señal eléctrica en un fotodetector (un material fotosensible convierte los fotones del centelleo en electrones y estos son multiplicados y acelerados para formar el pulso eléctrico). Generalmente, el bloque de cristales centelleadores es leído por varios PMT, y la luz detectada es empleada en identificar el cristal en el que se ha producido la interacción. Los cristales centelleadores más usados en PET son el óxido germanato de bismuto (BGO), el ortosilicato de gadolinio (GSO) y el ortosilicato de lutecio (LSO). El cristal ideal se debería caracterizar por un alto poder para detener los fotones incidentes de 511 keV, por su capacidad para producir un corto y muy intenso haz de luz (fotofluorescencia), por medir de forma exacta la energía y tener un tiempo muerto corto. La capacidad para frenar los fotones viene determinada por el coeficiente de atenuación lineal (que es función de la densidad y del número atómico efectivo del material) y el espesor del cristal. La probabilidad de detección aumenta cuanto mayor es el coeficiente de atenuación lineal o el espesor del cristal. El valor del coeficiente de atenuación lineal para el BGO es de 0,95cm−1, el del LSO es de 0,88 y el del GSO de 0,70. Tener una buena resolución energética permite reducir el número de coincidencias dispersas al poder estrechar la ventana energética. Si el cristal centelleador es, además, muy rápido, también puede utilizarse una ventana de coincidencia temporal más corta y reducir así la tasa de coincidencias aleatorias. El LSO permite adquisiciones más rápidas, de 2-3min por cada posición de la camilla, sin comprometer la capacidad de detección de las lesiones, en comparación con los 4-6min que requiere el PET con cristales de BGO. Para profundizar en las características de los detectores en PET se recomienda la revisión de la cita bibliográfica12. En la tabla 1 se resumen los cristales centelleadores aquí comentados con los parámetros que los caracterizan. La disposición de los detectores (cristales centelleadores más fotodetectores) más extendida es en forma de anillo, y varios anillos de detectores representan la geometría más generalizada de una cámara PET en el ámbito clínico.
Propiedades de los cristales centelleadores usados en PET. Zefectivo: número atómico efectivo
| Densidad (g/cm3) | Zefectivo | Producción de luz (%NaI) | Tiempo de centelleo (ns) | |
|---|---|---|---|---|
| BGO | 7,1 | 73 | 15 | 300 |
| GSO | 6,7 | 58 | 30 | 60 |
| LSO | 7,4 | 65 | 75 | 40 |
| LYSO | 7,2 | 64 | 80 | 41 |
| Densidad alta y Zefectivoalto: • Alta eficiencia de detección • Tamaño del cristal pequeño → buena resolución espacial | Gran producción de luz: • Buena resolución energética • Ventana energética estrecha → reducción de coincidencias dispersadas | Tiempo de centelleo corto: • Ventana de coincidencia pequeña → reducción de coincidencias aleatorias • Menor tiempo muerto • Buena resolución temporal (TOF) | ||
BGO: óxido germanato de bismuto; GSO: ortosilicato de gadolinio; LSO: ortosilicato de lutecio; LYSO:; TOF: tiempo de vuelo.
La resolución espacial en PET es la capacidad que tiene el escáner de reproducir con fidelidad las variaciones en la distribución de actividad del radiofármaco en el objeto a examen. Como en otras modalidades, se define como la distancia mínima que permita diferenciar dos puntos en la imagen. La resolución espacial en un PET está limitada por la naturaleza del proceso de aniquilación del positrón13–15. Por un lado, los positrones no se aniquilan exactamente donde se crearon, sino que viajan una distancia antes de aniquilarse, lo que se conoce como alcance del positrón, que depende de la energía inicial del positrón. Por otro lado, idealmente se espera la emisión de dos fotones antiparalelos por conservación del momento, pero como el positrón cuando se aniquila no tiene momento cero, existe una indeterminación angular en la dirección de emisión de los fotones y se dice que no son colineales16. Además, el proceso de detección también limita la resolución espacial del PET17. Para evaluar la resolución intrínseca del detector se emplea la función dispersión de punto (PSF), que se caracteriza por la anchura a mitad altura (FWHM). Cuando la fuente puntual está situada en el centro de los detectores, la PSF de los detectores en coincidencia es una función triangular cuya base es igual al tamaño del cristal18. Por tanto, la FWHM es la mitad del tamaño del cristal centelleador. Relacionado con la detección, la forma en que el bloque de PMT detecta el cristal donde ha tenido lugar la interacción también degrada la resolución espacial, ya que siempre habrá un error en la determinación del cristal debido a fluctuaciones estadísticas de las señales de los PMT. En el caso de acoplamiento individual (cristal con fotodetector) este factor reductor de la resolución espacial desaparecería. Hay un tercer factor que limita la resolución espacial fundamentalmente a lo largo de la dirección radial de un PET y que se conoce como error de paralaje (v. fig. 1d). Su origen está en el desconocimiento del lugar exacto de interacción del fotón de 511 keV dentro del cristal centelleador, conocido como profundidad de interacción (DOI). Cuando un fotón entra muy oblicuo respecto la superficie del detector, puede que la interacción tenga lugar en un punto muy distinto a la entrada o incluso que interaccione en un cristal adyacente. Esto hace que la línea de respuesta asignada (LOR) a ese evento no represente la dirección original del par de fotones, ya que la LOR normalmente se atribuye a la línea que une las superficies de los cristales detectores que intervienen en la coincidencia. El error de paralaje empeora cuando la fuente está más cerca del borde del campo de visión (FOV), porque en esta localización muchos de los fotones que salen inciden oblicuamente en los cristales. Finalmente, la resolución espacial en un estudio clínico viene afectada también por el algoritmo de reconstrucción empleado y por el filtro de posprocesado.
SensibilidadLa sensibilidad de un escáner PET es una característica fundamental de su funcionamiento y nos indica el número de coincidencias medidas respecto de las emitidas, medida de la habilidad que tiene el sistema PET para convertir la actividad inyectada en señal. Interesa que la sensibilidad sea alta para reducir el ruido en la imagen reconstruida y aumentar la detección de lesiones. La PET es una técnica de imagen intrínsecamente tridimensional (3D), ya que no necesita de la colimación física usada en la tomografía por emisión de fotón único (SPECT) para el conocimiento de la dirección de los fotones19. La colimación física es sustituida por la colimación electrónica de la detección de la coincidencia. Sin embargo, los primeros PET estuvieron trabajando en modo bidimensional (2D) con un septo de plomo o tungsteno entre los anillos de detectores para limitar los fotones que venían dispersados de anillos adyacentes y poder usar algoritmos de reconstrucción en 2D. Esta forma de trabajar no aprovecha toda la radiación emitida por el paciente, y con la llegada de los centelleadores LSO y BGO, que permitieron reducir la ventana de coincidencia (4,5-6ns) y aplicar umbrales energéticos más altos (reducción de radiación dispersa), se comenzó a trabajar en modo 3D con un aumento significativo de la sensibilidad. Otra manera de aumentar la sensibilidad de un escáner es añadiendo más material centelleador. Un aumento del 50% en el espesor del cristal (de 2mm a 3mm) lleva a un aumento del 40% en la sensibilidad. Sin embargo, si el aumento se produce en la cobertura axial, añadiendo un 33% de material para una cobertura convencional (más anillos detectores) sin cambiar el espesor, se produce un 78% de aumento de la sensibilidad19.
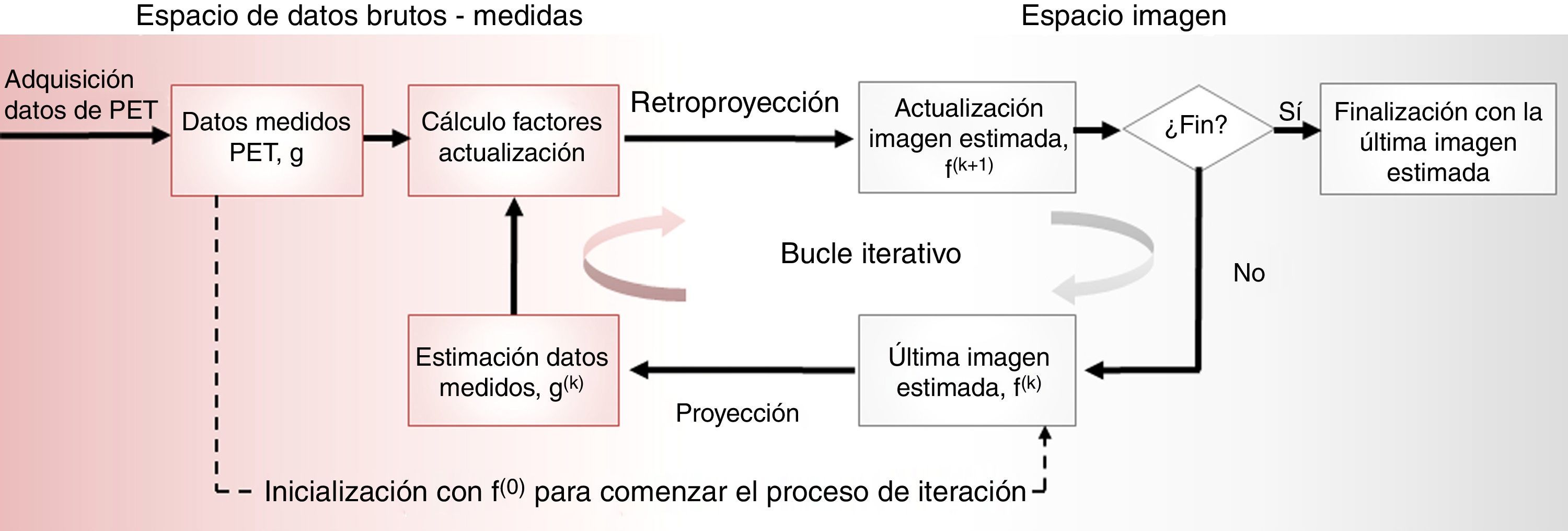
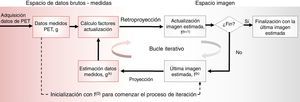
Reconstrucción de la imagenEl número de coincidencias verdaderas medidas en un par de detectores es proporcional a la actividad de radiofármaco en la LOR. Por tanto, tenemos información sobre la distribución del radioisótopo en el paciente a través de las coincidencias. El objetivo de la reconstrucción de la imagen en PET es obtener cortes transversales de la distribución de radioisótopo dentro del paciente. Existen dos clases fundamentales de algoritmos de reconstrucción: los métodos analíticos y los iterativos. Para más detalles respecto a ambos tipos de algoritmos se aconseja consultar las referencias20,21. Los algoritmos analíticos son rápidos y suponen un modelo lineal de detección. El método analítico de reconstrucción más común es el conocido como la retroproyección filtrada (referido como FBP por sus siglas en inglés). Por el contrario, los métodos iterativos son más lentos y no lineales. A pesar de esto, su uso se ha convertido en estándar en la mayoría de los escáneres clínicos gracias a la posibilidad de modelar la distribución estadística de los datos brutos e incluir modelos más detallados de la física del proceso de detección y de la distribución del radiofármaco. Además, el aumento en las capacidades computacionales de los sistemas actuales permite reconstruir la imagen un tiempo factible para la realidad clínica. Los algoritmos iterativos de reconstrucción están basados en que el proceso de imagen se puede representar con una ecuación matricial g=Hf, donde f=(f1,…, fj…., fM) es un vector de dimensión M que representa los valores de las imágenes y g=(g1, …, gi, …, gN) es un vector de dimensión N y representa las coincidencias detectadas. El proceso de imagen viene representado por la matriz H, que se conoce como matriz del sistema, y sus elementos Hij nos indican la probabilidad de que un par de fotones emitidos por el vóxel j sea detectado por la pareja de detectores i. En general, la matriz del sistema es muy grande y sus valores se calculan solo cuando se necesitan durante la reconstrucción, de modo que se usan varios métodos para reducir el tiempo de cálculo de los elementos de la matriz. En la figura 2 se representa el esquema general de los algoritmos iterativos. El método iterativo más extendido es el conocido como estimación de la máxima verosimilitud (maximum likelihood estimation, ML). Este es un método estadístico estándar que maximiza la función verosimilitud y, aplicado a la reconstrucción de imágenes, proporciona una imagen que con alta probabilidad producirían los datos brutos medidos. Los métodos de reconstrucción iterativos basados en principios estadísticos mejoran el cociente señal-ruido de la imagen. De entre los métodos iterativos, uno de los más útiles es el algoritmo de maximización del valor esperado (expectation maximization, EM) que es muy eficiente para encontrar el estimador de máxima verosimilitud. El método que combina la máxima verosimilitud como criterio de optimización y el algoritmo de maximización del valor esperado para encontrar la solución óptima se conoce como MLEM22, aunque clínicamente se emplea con más frecuencia una versión acelerada de este método que organiza los datos medidos en subconjuntos ordenados, conocida como OSEM23. Con esta versión se consigue una reducción del tiempo de reconstrucción de un factor 20-30, que junto con el aumento de las capacidades computacionales y los algoritmos numéricos de proyección24, han hecho que sea factible el uso de los métodos iterativos en la rutina clínica.
TACEl objetivo de la adquisición de datos y reconstrucción en un TAC es asignar un valor de atenuación a cada vóxel perteneciente a un volumen tridimensional. La adquisición se produce a partir de la transmisión de un haz de fotones, generados en un tubo de rayos X, en diferentes ángulos a través del cuerpo del paciente, y la detección de estos por una matriz de detectores. La señal en cada elemento del detector se corresponde con la suma de la atenuación de todos los tejidos que atraviesa el haz a su paso por el paciente. Esto se conoce como los datos brutos. En el proceso de reconstrucción se utilizan los datos brutos para obtener los valores de atenuación de cada uno de los vóxeles que forman la imagen. Desde su desarrollo a principios de la década de 1970, el TAC se ha convertido en la referencia para evaluar a los pacientes oncológicos gracias a su excelente definición para los detalles anatómicos. La tecnología de anillos deslizantes y los ordenadores más potentes fueron la base de la adquisición helicoidal a principios de la década de 199025. Sin embargo, el gran avance en el rendimiento de los TAC tuvo lugar con la llegada de los escáneres multidetectores (MDTAC26–28). Las primeras generaciones (de 2 a 16 filas de detectores) de los escáneres multidetectores permitieron aumentar las velocidades del estudio y obtener una mayor resolución axial. Actualmente, casi todas las casas comerciales ofrecen TAC multicorte de 6429, 25630 y 32031 filas de detectores. Estos producen una resolución espacial isotrópica y al mismo tiempo tienen una excelente resolución temporal (óptima para cardiología) y cobertura axial (4-8cm/s). El aumento del número de filas de detectores ha venido acompañado de tiempos de rotación más cortos, lo que permite hasta 3 rotaciones por segundo. En cuanto a la reconstrucción de la imagen, en los estudios de TAC se ha utilizado de manera generalizada la aproximación analítica con el algoritmo FBP. Con este método se consigue una imagen de calidad diagnóstica en poco tiempo a pesar del modelo simplificado que supone y las aproximaciones que se realizan (fuente puntual de rayos X, haz muy colimado, detectores puntuales) para poder implementar la transformada de Radon.
Funcionamiento de un equipo PET/TACDiseño de un PET/TACDe manera general, un escáner PET/TAC se compone de tres elementos: un escáner PET, un escáner TAC y una camilla para el paciente. La mayoría de los sistemas comerciales cuentan con un PET, que tiene sus detectores, electrónica y sistema de adquisición independiente de los módulos propios del TAC. El diseño de un PET/TAC ha venido influenciado por su aplicación en oncología, que necesita de dispositivos de gran apertura, con una gran sensibilidad y resolución espacial. Si el escáner se quiere usar además para planificación de RT, se necesita un calibre mayor de 70cm (entre unos 80cm y 90cm) para poder incluir los complementos necesarios para el posicionamiento del paciente en el acelerador. Actualmente, casi todas las casas comerciales ofrecen una versión del sistema PET/TAC para esta aplicación.
Un elemento que ha tenido que ser rediseñado para el sistema combinado es la camilla, ya que tiene que reducirse al máximo la deflexión vertical que se produce debida al peso del paciente cuando atraviesa el túnel. Al estar los dos campos de visión separados, si no se corrigiera, las imágenes del PET y del TAC no estarían bien alineadas verticalmente, y por tanto quedarían mal registradas. Las casas comerciales han propuesto diferentes diseños de camilla que minimizan la flexión vertical. Los diseños van desde camillas con un punto de apoyo fijo y la camilla completa moviéndose sobre unos raíles situados en el suelo, a camillas con puntos de apoyo variable, uno para el TAC y otro para el PET. Una modificación de este último diseño incluye un apoyo entre los dos escáneres a mitad del túnel. Finalmente, también se propuso la camilla fija, en la que los escáneres se desplazan usando los raíles montados en el suelo. Con los diseños actuales se consiguen deflexiones de menos de 0,25mm para un peso de 181 kg19.
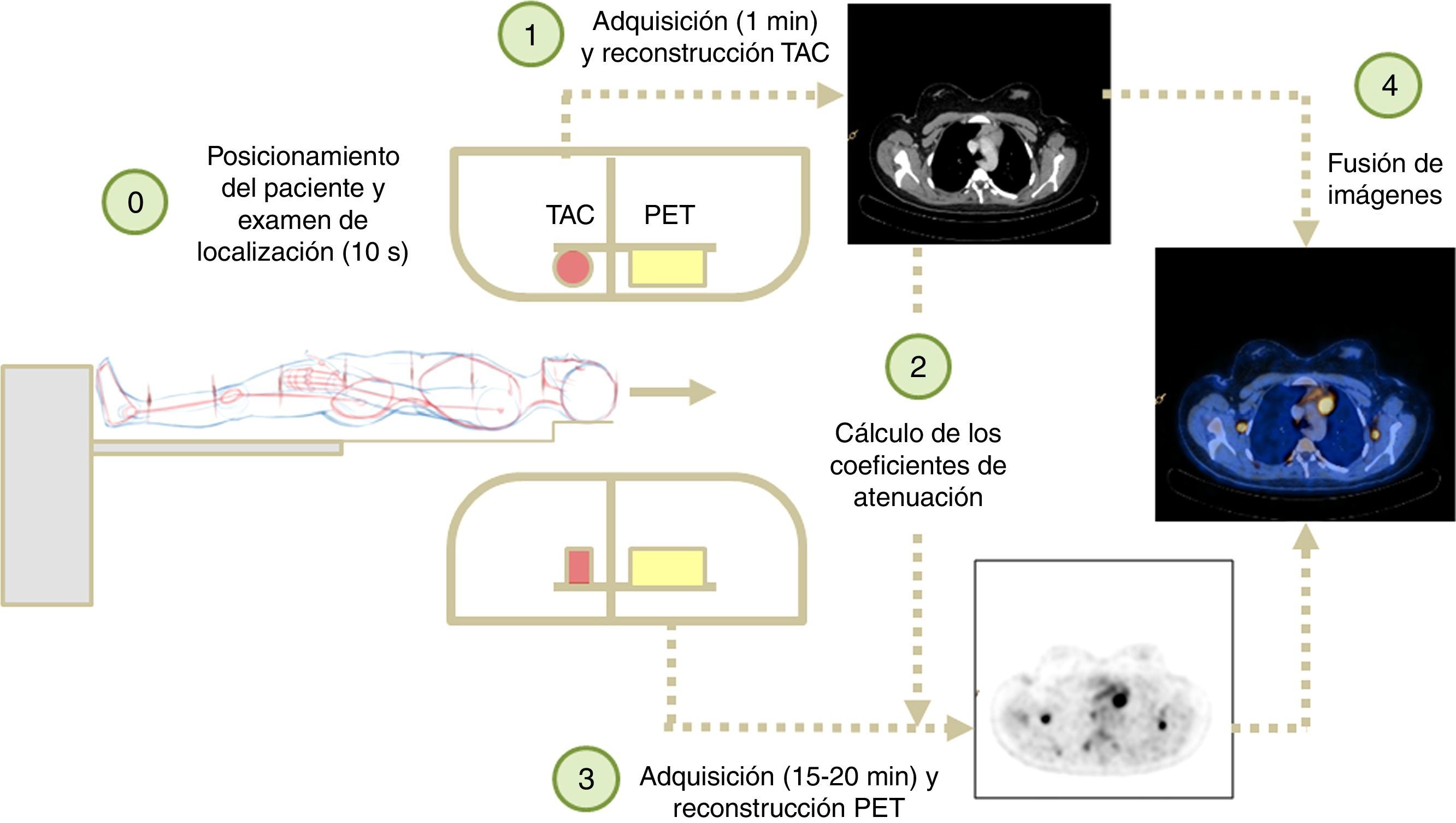
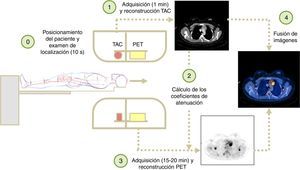
ProtocolosEl protocolo típico de un PET/TAC comienza con una radiografía de localización realizada con el TAC que dura entre 2 s y 10 s y permite planificar la región que se va a examinar. Posteriormente, el TAC helicoidal planificado (duración entre 30 s y 2min) precede a la adquisición del PET (entre 5min y 30min de duración). Ambas adquisiciones implican múltiples espirales de TAC y posiciones de camilla en PET para obtener la imagen final de cuerpo completo que se requiere en las aplicaciones oncológicas. La figura 3 muestra los distintos pasos que intervienen en la adquisición, reconstrucción y visualización de un estudio PET/TAC.
Junto con el protocolo estándar explicado en el párrafo anterior, existen múltiples protocolos de TAC que se pueden realizar en combinación con el estudio de PET. En un examen PET/TAC se distinguen fundamentalmente dos tipos de imagen de TAC, la de baja dosis (BD-TAC) y la de calidad diagnóstica (D-TAC). En ambos casos, la imagen de TAC sirve para la localización anatómica y para la corrección de atenuación de la imagen de PET. En el primer caso, los parámetros de la adquisición son tales que la dosis del estudio es baja y producen una imagen de calidad reducida. En el segundo caso, la calidad de la imagen de TAC es diagnóstica y la dosis recibida por el paciente es mayor. Por tanto, si se dispone de un TAC diagnóstico previo al estudio PET/TAC es aconsejable realizar un BD-TAC para la localización anatómica y la corrección de atenuación; de esta manera reducimos la dosis que recibe el paciente. Otro punto a considerar es si la necesidad de calidad diagnóstica es para toda la región anatómica que incluye el estudio PET/TAC o es suficiente solo en ciertas zonas anatómicas. De esta manera se puede combinar un estudio completo de TAC con baja dosis para localización y atenuación junto con un estudio de una región anatómica de mayor calidad, aunque con mayor dosis al paciente. En resumen, existen varias posibilidades dentro de los protocolos en un sistema PET/TAC; por tanto, se han de elegir y optimizar los protocolos de acuerdo a la aplicación, teniendo en cuenta criterios de calidad de imagen y la dosis de radiación que recibe el paciente.
Registro de imagenLa exactitud en el registro de la imagen de PET y de TAC es crítica, no solo para poder visualizar correctamente la imagen fusionada, sino también para calcular y aplicar correctamente la corrección por atenuación para la imagen PET basada en los valores de la imagen de TAC. Con los diseños de las camillas se consigue una desalineación inferior a 1mm; por tanto, es necesario corregir la desviación entre la imagen TAC y PET a partir de maniquíes de calibración, cuyas posiciones y volúmenes son conocidos con gran exactitud. Otro punto a considerar dentro del registro de imagen es la diferencia entre los campos de visión del PET y del TAC. Estos tienen distinto diámetro y distinto tamaño de vóxel, por lo que para representar ambas imágenes fusionadas es necesario que una de ellas o las dos sean interpoladas a una cuadrícula común. Finalmente, para representar las imágenes corregistradas en el monitor de visualización, la técnica más utilizada es el mezclado alfa. Esta técnica promedia las imágenes píxel a píxel y utiliza un factor de transparencia modificable de valores entre 0 y 1. Estos valores extremos implican que solo se vea la imagen de TAC o la imagen de PET. Este método no funciona si se combinan las imágenes de PET y las de TAC con escala de grises.
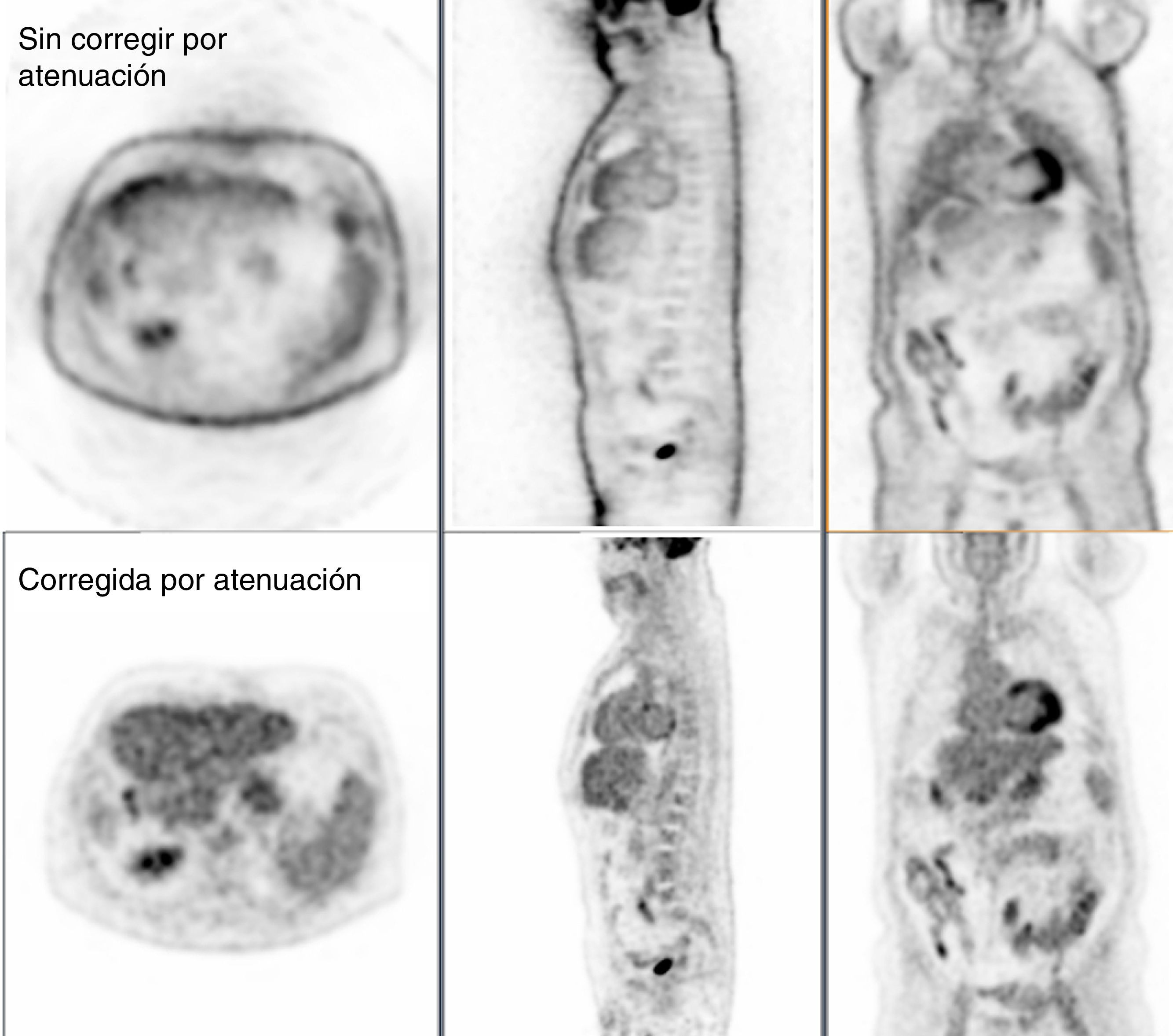
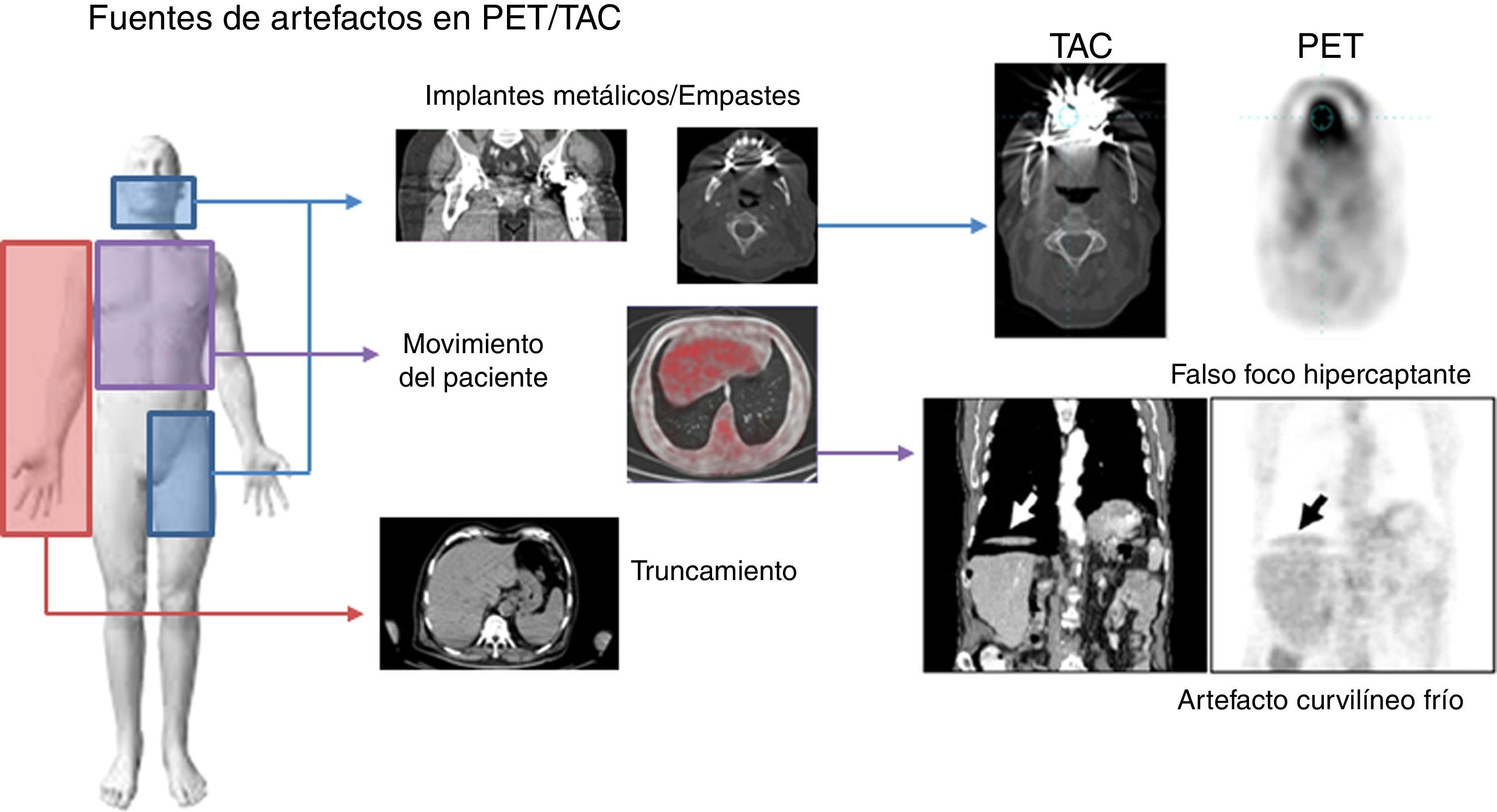
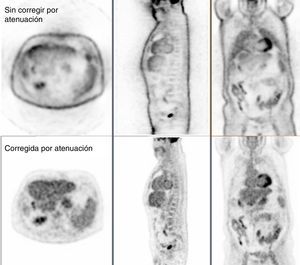
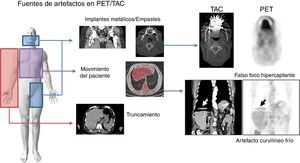
Corrección de atenuaciónLos pares fotones de 511 keV que se crean dentro del paciente, debido al efecto fotoeléctrico o a la dispersión Compton (principalmente), pueden absorberse dentro del paciente y o escapar del sistema y, por tanto, no detectarse la coincidencia. Este efecto de atenuación de la radiación produce degradación en la imagen de PET que ha corregirse. En la figura 4 se muestra una imagen PET sin corregir (arriba) y corregida (abajo) por el efecto de la atenuación. La corrección por atenuación en PET proporciona imágenes con mejor delineación anatómica y además ofrece la posibilidad de tener una imagen con información cuantitativa del grado de captación que una lesión tiene usando el valor de captación estandarizado (SUV). Una característica fundamental del PET es que los factores para la corrección de atenuación no dependen de la posición de la fuente a lo largo de la LOR. Por tanto, se puede usar una fuente externa al paciente para estimar la corrección que necesitan los datos de emisión debida a la atenuación (estudio de transmisión). La fuente utilizada es de 68Ge y necesita de unos 10-15min para estimar la corrección de una posición de camilla. Además, los factores de corrección sufren de la baja estadística de las cuentas registradas y por tanto tienen bastante ruido32. Una de las principales ventajas de tener el sistema híbrido PET/TAC es el uso de las imágenes de TAC para la corrección de atenuación de los datos de emisión del PET33. De esta manera se elimina la necesidad de realizar la medida de transmisión con una fuente externa, ahorrando tiempo de estudio (con los TAC multidetectores se necesita menos de 1min para la adquisición de cuerpo completo). Además, los factores de corrección que se calculan son muy poco ruidosos en comparación con los del estudio de transmisión gracias a la gran cantidad de fotones inherente a la técnica de TAC. Los factores de atenuación obtenidos a partir de la imagen de TAC (energía promedio del haz de fotones emitidos es 70 keV) se han de escalar a los factores de atenuación para la energía de 511 keV de los fotones básicos del PET, ya que los valores de atenuación son dependientes de la energía del fotón. Para un grupo de tejidos biológicos (tejido pulmonar, hígado, grasa, músculo y otros tejidos blandos), con un único factor de escala es suficiente para convertir el coeficiente de atenuación de rayos X al de los fotones de 511 keV. Por otro lado, para el hueso esponjoso y cortical, este simple factor de escala no es válido por el contenido en calcio y fósforo del tejido óseo. Para solucionar esta diferencia de comportamiento se utiliza una transformación bilineal con diferentes escalas por encima y por debajo de un valor umbral. Sobre los distintos modelos para tener en cuenta estas diferencias en la conversión de los coeficientes de atenuación y los distintos valores umbrales empleados se recomienda la lectura de las referencias34–38. Esta aproximación para convertir la imagen de TAC a coeficientes de atenuación a energías de los fotones de aniquilación deja de funcionar cuando se encuentra con materiales de alto número atómico que están dentro del cuerpo del paciente y que no se pueden representar como una combinación de agua, hueso y aire. Los empastes dentales, implantes metálicos y los contrastes usados en TAC para realzar ciertas partes de la anatomía son ejemplos de dichos materiales, y estos pueden generar artefactos en la imagen de PET. Los artefactos más comunes se presentan en la figura 5. Se han explorado varias técnicas para reducir dichos artefactos39, incluyendo protocolos específicos y optimizados40, algoritmos de reconstrucción41 y métodos de segmentación42,43. Otra fuente de artefactos debida al uso del TAC para la corrección de atenuación del PET es la que tiene como origen la discordancia entre el TAC y el PET por los movimientos tanto voluntarios como involuntarios del paciente (la respiración, el movimiento del miocardio y las asas intestinales). Para reducir los artefactos debidos a la respiración se recomienda emplear protocolos específicos de respiración usando algún tipo de señal externa que sirva para sincronizar el movimiento externo del paciente con el interno durante la adquisición. Dentro de la bibliografía destacamos los trabajos de las referencias44–46. Para finalizar con los artefactos debidos al uso de la imagen de TAC para la corrección de atenuación en PET comentamos que la diferencia de campos de visión axiales entre PET y TAC genera artefactos de truncamiento (normalmente el FOV del PET es de unos 60-70cm, mientras que el del TAC es de 50cm). El artefacto es debido a la falta de valores para la corrección de atenuación en los límites del campo de visión axial de PET. El truncamiento se visualiza en la imagen de PET como una subestimación de la concentración de actividad en el área afectada. Se aconseja la serie publicada por la IAEA47 (International Atomic Energy Agency) para profundizar en el tema de artefactos de la imagen de PET. figura 6
Hay que considerar la dosis que recibe un paciente en un examen médico realizado con un escáner combinado PET/TAC, pues ambas técnicas usan radiaciones ionizantes y es importante asegurarse de la necesidad de hacer los dos estudios. Por un lado, el paciente recibe la dosis que viene del tubo de rayos X del TAC. Por otro, está la dosis de radiación recibida internamente a través del radiofármaco inyectado. La dosis total del estudio es la suma de ambas componentes.
La dosis que recibe un paciente a través del TAC varía enormemente dependiendo de las características de la máquina, la técnica empleada en el estudio, el tamaño del paciente y el procedimiento usado (zona anatómica examinada). Las dosis típicas en exámenes diagnósticos,48 están comprendidas entre 1 mSv y 30 mSv. El procedimiento más común en un PET/TAC es el conocido como “cuerpo completo”, que se extiende de la base del cráneo hasta la pelvis. Esta localización no es estándar en los estudios de TAC. Por tanto, para tener la dosis de un estudio de cuerpo completo hay que sumar la dosis que se espera por separado en exámenes de cabeza, tórax, abdomen y pelvis, que resulta una dosis total de 18 mSv49. Cabe destacar que estos valores son estimaciones aproximadas de valores típicos y que se corresponden con los de TAC con fines y calidad diagnóstica. Como se comentó anteriormente, las finalidades de la imagen de TAC de un estudio PET/TAC son la localización anatómica y la corrección de atenuación. Para estos casos no es necesario tener imágenes de TAC de alta calidad diagnóstica y se puede reducir la dosis en un factor, dos o más usando una técnica con menor miliamperaje.
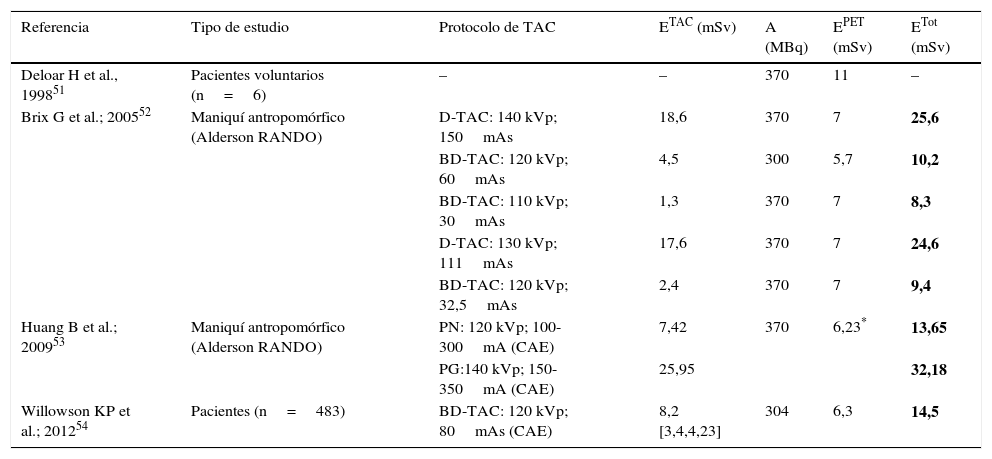
En lo que respecta a la dosis que se recibe en un examen de PET, ya que no hay fuente de transmisión en un escáner PET/TAC, la dosis es la debida al radiofármaco inyectado. Los avances en detectores, electrónica, blindaje, correcciones y algoritmos de reconstrucción permiten una reducción en la actividad inyectada al paciente y, por tanto, una menor dosis efectiva. Centrándonos en el radiofármaco usado más comúnmente en los estudios de PET, 18F-FDG, la dosis efectiva por unidad de actividad es 0,019 mSv/MBq50. Este valor se corresponde con el promedio de dosis efectiva. Cabe destacar un estudio51 basado en voluntarios y que combinaba exámenes de PET calibrados para las curvas de actividad-tiempo con imágenes de resonancia magnética para el cálculo de volúmenes en el que se da una dosis efectiva mayor, 0,029 mSv/MBq. En la tabla 2 se dan valores aproximados de las dosis efectivas que se reciben en un examen PET/TAC a partir de estudios con maniquíes, voluntarios y pacientes51–54.
Dosis efectiva (E) por examen PET/TAC
| Referencia | Tipo de estudio | Protocolo de TAC | ETAC (mSv) | A (MBq) | EPET (mSv) | ETot (mSv) |
|---|---|---|---|---|---|---|
| Deloar H et al., 199851 | Pacientes voluntarios (n=6) | – | – | 370 | 11 | – |
| Brix G et al.; 200552 | Maniquí antropomórfico (Alderson RANDO) | D-TAC: 140 kVp; 150mAs | 18,6 | 370 | 7 | 25,6 |
| BD-TAC: 120 kVp; 60mAs | 4,5 | 300 | 5,7 | 10,2 | ||
| BD-TAC: 110 kVp; 30mAs | 1,3 | 370 | 7 | 8,3 | ||
| D-TAC: 130 kVp; 111mAs | 17,6 | 370 | 7 | 24,6 | ||
| BD-TAC: 120 kVp; 32,5mAs | 2,4 | 370 | 7 | 9,4 | ||
| Huang B et al.; 200953 | Maniquí antropomórfico (Alderson RANDO) | PN: 120 kVp; 100-300mA (CAE) | 7,42 | 370 | 6,23* | 13,65 |
| PG:140 kVp; 150-350mA (CAE) | 25,95 | 32,18 | ||||
| Willowson KP et al.; 201254 | Pacientes (n=483) | BD-TAC: 120 kVp; 80mAs (CAE) | 8,2 [3,4,4,23] | 304 | 6,3 | 14,5 |
A: actividad inyectada promedio; EPET: dosis efectiva por exploración de PET; ETAC: dosis efectiva por exploración TAC; ETot: dosis efectiva total debida a ambas exploraciones; PG: pacientes grandes; PN: pacientes normales; TAC diagnóstico (D-TAC) y TAC de baja dosis (BD-TAC) para localización y corrección de atenuación solo.
En los últimos años se han comercializado nuevos centelleadores inorgánicos. Algunos de estos son una derivación de centelleadores ya conocidos, como por ejemplo el LYSO del LSO y el LuYAP del LuAlO:Ce. Estos cristales son muy atractivos por su alta eficiencia de detección y rápida respuesta. Otros han sido nuevos descubrimientos, como el LaCl3:Ce y el LaBr3:Ce. Los centelleadores haloideos tienen una resolución energética excelente. Mientras que el LYSO se está utilizando en escáneres comerciales que ofrecen TOF, el LaBr3:Ce está siendo estudiado por sus capacidades para proporcionar información de TOF también. Nuevos materiales están siendo objeto de investigación; se recomienda la lectura de la referencia55.
La producción en masa de nuevos fotodetectores basados en semiconductores ha permitido su investigación en prototipos de sistemas PET y ha posibilitado el realizar adquisiciones de PET simultáneamente con resonancia magnética. En función del proceso de producción y del modo de operación de estos fotodetectores, reciben nombres distintos. Entre otros se encuentran los de fotomultiplicadores de silicio, contador de fotones multipíxel, fotodiodos de avalancha y diodo de avalancha de fotón único; todos ellos utilizan una matriz de fotodiodos que opera en o casi modo avalancha. La suma de las señales de los fotodiodos individuales es una medida de la cantidad de luz que se ha generado en el cristal centelleador. Estos nuevos fotodetectores se caracterizan por: un área sensible mejorada y más eficiente que los tradicionales tubos fotomultiplicadores; una resolución temporal que posibilita su uso para proporcionar información de TOF; requisitos de potencia bajos; un empaquetamiento robusto y compacto; y compatibilidad con el campo magnético presente en la resonancia magnética. El contador de fotones digital (DPC) es una variante de los fotomultiplicadores de silicio que opera intrínsecamente como en modo digital56 y ofrece la posibilidad de generar medidas de tiempo de alta resolución. En la actualidad existe un sistema PET/TAC que tiene estos DPC en lugar del tubo fotomultiplicador.
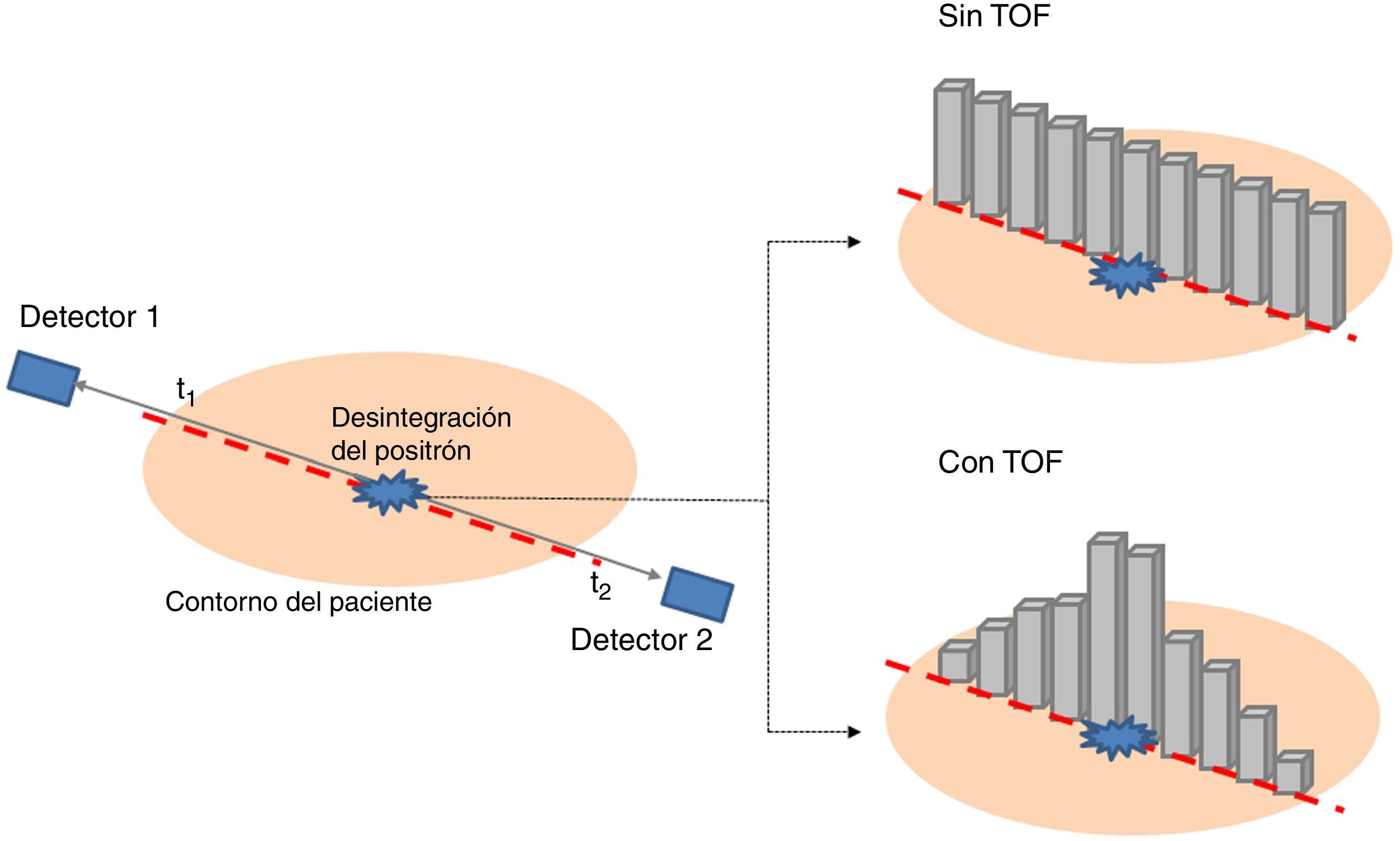
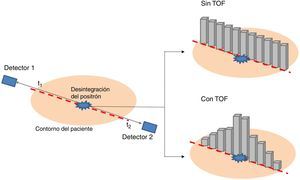
Tiempo de vueloEl tener información de TOF en un escáner PET significa conocer de manera precisa el momento en el que se han detectado cada uno de los fotones de aniquilación. Como los fotones de aniquilación se emiten simultáneamente, la diferencia en los tiempos de detección de los fotones de la coincidencia nos da una idea de la diferencia de recorridos de cada uno de los fotones. Esto permite una mejor localización de la aniquilación a lo largo de la LOR y un aumento de la calidad de la imagen. La figura 6 representa cómo se localiza la aniquilación entre un sistema que tiene TOF y otro que no tiene. Actualmente, los escáneres comerciales no poseen resoluciones temporales mejores de 200 ps, que implica una indeterminación en la posición de la aniquilación de unos 3cm. Esta indeterminación de 3cm no permite aún la reconstrucción directa (la indeterminación debería de ser mucho más baja) y por tanto es necesario seguir usando los métodos de reconstrucción si se desea obtener una imagen de alta resolución espacial. Pero se observa una mejora significativa en la imagen si se incluye las medidas de TOF en el proceso de reconstrucción como información a priori. Para más información sobre el uso y la ganancia de TOF se recomienda la lectura de la referencia57.
Algoritmos de reconstrucciónEn cuanto a la reconstrucción de la imagen, dos innovaciones se pueden señalar como las más importantes: reconstrucción con recuperación de resolución (o función dispersión de punto) y reconstrucción incluyendo la información de TOF. La primera se caracteriza por una reducción significativa del ruido de la imagen y un realce del contraste. La información de TOF usada durante la reconstrucción permite acelerar la convergencia y reduce la propagación del ruido. Además, es menos sensible a imprecisiones en la corrección por atenuación o por dispersión de los fotones. Junto con las anteriores ventajas, el uso del TOF en la generación de la imagen funciona como un amplificador virtual de la sensibilidad. La combinación de ambas técnicas ha tenido un gran impacto en la calidad de imagen y la detección de las lesiones. Además de estas dos innovaciones, para mantener las propiedades estadísticas de los datos crudos del PET deben de incluirse en el paso de proyección las estimaciones del efecto de atenuación (A), las coincidencias dispersas (s) y las coincidencias aleatorias (r) de la siguiente manera: E{g}=AHf+s+r, donde E{} es el operador valor esperado.
Avances en los sistemas TACComo se ha explicado en las bases físicas del TAC, los avances en instrumentación en TAC no han cesado y se espera que continúen haciéndolo hasta llegar a las limitaciones físicas que tiene esta tecnología. Además, el aumento de potencia computacional ha hecho que se abran nuevas vías realzando los métodos de procesado y los algoritmos de reconstrucción. Uno de los ejemplos más claros en los últimos años ha sido el resurgir de los algoritmos iterativos (métodos estándar dentro de la imagen de PET) para la imagen TAC. Hasta hace poco tiempo, el algoritmo por excelencia era el FBP, que a pesar de proporcionar una calidad de la imagen adecuada, tenía limitaciones en situaciones con mucho ruido en la imagen (estudios con pacientes obesos), artefactos (estructuras de alta densidad, implantes metálicos) o baja detección a bajo contraste. La reducción de dosis en los estudios de TAC es un área activa de investigación y desarrollo entre las principales casas comerciales. Estas limitaciones, junto con el aumento de la capacidad de cálculo computacional, ha hecho que los métodos iterativos puedan convertirse en rutina clínica. La base teórica de estos algoritmos es similar a la explicada para el caso del PET, y cada fabricante ha desarrollado su propio algoritmo en función de unas hipótesis iniciales sobre la adquisición de datos, su procesado, geometría del sistema y características del ruido. Una interesante y reciente revisión sobre dichos algoritmos para TAC se encuentra en la referencia58. Los algoritmos iterativos, además de proporcionar una mejor calidad de imagen, especialmente en pacientes obesos y supresión de artefactos, puede ser una herramienta para la reducción de dosis; para ello es necesario revisar los protocolos usados en la rutina clínica y que están optimizados en función de la reconstrucción analítica. Como la dosis recibida es una preocupación en esta tecnología, ya que implica dos tercios de la dosis total que se da en imagen médica59, se están siguiendo otros caminos para conseguir una optimización en la dosis impartida. Entre otros se trabaja en la mejora de los colimadores, el uso eficiente de los detectores multicorte y la modulación de intensidad de corriente entre regiones del paciente que presentan distinta atenuación60.
Nuevos sistemas PET/TAC comercialesEl PET/TAC Philips Vereos es el primero que utiliza los DPC. Con estos detectores digitales, que permiten un acoplamiento individual con el cristal centelleador y mejora de la resolución temporal, muestran una imagen más clara en comparación con las imágenes obtenidas con los PMT. El uso de los fotomultiplicadores de silicio leídos digitalmente, al tener muy buena resolución temporal, permite incrementar la sensibilidad, la resolución volumétrica y la precisión cuantitativa. Según Miller et al.61 la resolución temporal de este sistema es de 311 ps, la espacial de 4,11mm y la sensibilidad efectiva considerando TOF es de 24 kcps/MBq.
Como muestra del papel tan fundamental que tiene el PET/TAC, Toshiba ha presentado oficialmente en el mercado de la imagen molecular su PET/TAC Celestion. Como características importantes destacan el amplio calibre y campo de visión, y su tecnología para la reducción de dosis y adquisiciones rápidas. El calibre es de 90cm para TAC y 88cm para PET. El campo de visión axial es de 70cm para TAC y PET, con una extensión de 85cm. La dosis se minimiza gracias a la reducción de dosis adaptativa e iterativa de Toshiba y a la tecnología Smart Dose Standard Alliance's XR-29. La resolución temporal es de 450 ps ofreciendo TOF, y el TAC realiza rotaciones de 0,5 s con cortes de 0,5mm en un detector de 32 cortes.
General Electric (GE) introduce su PET/TAC Discovery IQ, que se caracteriza por tener la sensibilidad más alta según el protocolo NEMA (22 cps/kBq) y el campo de visión más largo (26cm). El software de reconstrucción Q. Clear es una parte importante del sistema, y proporciona una buena calidad de imagen y cuantificación. La reconstrucción está basada en los métodos iterativos bayesianos. Además, utiliza los detectores LightBurst (tecnología desarrollada por GE), que permiten hacer una imagen del órgano completo usando barridos rápidos a baja dosis. También emplea electrónica de alta velocidad y un canal de adquisición dual que proporciona una alta precisión cuantitativa para todos los trazadores clínicos.
Para finalizar, Siemens ofrece en su nuevo PET/TAC Biograph mCT Flow el movimiento continuo de la camilla que supera las limitaciones del movimiento convencional basado en posiciones fijas de camilla. La tecnología Siemens de Flow Motion mueve de manera suave al paciente a través del sistema de imagen mientras se adquiere continuamente con los detectores de PET. El escáner tiene un calibre de 78cm con un tiempo de adquisición de 5min. Los PET/TAC convencionales sufren de degradación de la sensibilidad del centro al borde del campo de visión axial. El solapamiento de las distintas posiciones de la camilla se realiza para compensar esta degradación, pero esto produce que la sensibilidad al ruido varíe axialmente. Este ruido puede distorsionar los valores cuantitativos de la lesión detectada. Al mover continuamente al paciente a través del sistema de imagen se eliminan las adquisiciones solapadas y se mantiene uniforme la sensibilidad al ruido a lo largo del todo examen. La resolución espacial, la sensibilidad, la fracción de coincidencias dispersadas y las curvas de tasa de cuentas son similares a las de su predecesor Biograph mCT62.
ConclusiónTranscurridos 15 años desde el primer prototipo, el sistema híbrido PET/TAC ya cuenta con un gran número de aplicaciones clínicas y se esperan muchas más en los próximos años. Debido al interés que ha suscitado esta modalidad dual, se han producido avances tanto en la instrumentación como en el procesado y la reconstrucción de las imágenes. Por tanto, se espera que se continúe mejorando la tecnología de los detectores en la integración de ambos sistemas y en el desarrollo de algoritmos de reconstrucción más avanzados.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
AutoríaLa autora es la responsable de la integridad, concepción y diseño del estudio, la obtención de los datos, el análisis e interpretación de los mismos, la búsqueda bibliográfica, la redacción del trabajo, la revisión crítica del manuscrito y aprobación de la versión final.
Conflicto de interesesLa autora declara no tener ningún conflicto de intereses económicos ni de otro tipo relacionados con este artículo.
Coincidencia: es cuando la detección de dos fotones tiene lugar dentro de la ventana de temporal y ambos fotones están dentro de la ventana energética.
Coincidencia verdadera: es cuando los dos fotones detectados provienen de la misma aniquilación y no se han dispersado dentro del paciente.
Coincidencia dispersada: es cuando uno de los dos fotones de la aniquilación ha interaccionado antes de ser detectado y ha cambiado su dirección original.
Coincidencia aleatoria: es cuando los dos fotones detectados provienen de dos aniquilaciones distintas.
Cristal centelleador: es el material que se utiliza para detectar el par de fotones que se generan en la aniquilación. Cuando los fotones interaccionan en el cristal depositando su energía, se produce un pulso de luz proporcional a la energía depositada en un tiempo idealmente muy corto.
Tubo fotomultiplicador: es el fotodetector que se emplea convencionalmente para convertir la señal de luz generada en el cristal centelleador en pulso eléctrico para su posterior procesado.
Resolución energética: es un parámetro que caracteriza la capacidad de un detector para reproducir la energía de la partícula detectada. En un detector, si todas las partículas depositan la misma energía, las lecturas de estos valores estarán repartidas según una distribución gaussiana centrada en el valor de la energía depositada por las partículas. Cuando más estrecha sea dicha distribución, mejor será la resolución energética del detector.
Ventana energética: representa los valores mínimo y máximo de energía que ha de tener el fotón detectado en la coincidencia. El tamaño de esta ventana está en función de la resolución energética del detector. Idealmente, los fotones de la aniquilación han de depositar toda su energía (511 keV) en el detector, pero no siempre ocurre. En algunos casos, los fotones han interaccionado anteriormente, cambiando su dirección inicial y reduciendo su energía (fotones dispersados). Para reducir el número de fotones dispersados se utiliza la ventana energética.
Ventana de coincidencia temporal: es la condición temporal que deben cumplir los dos fotones detectados para considerarlos una coincidencia. Los fotones de la aniquilación se emiten simultáneamente y, salvo la diferencia de camino recorridos, deben detectarse casi en el mismo momento. Como la producción de la señal y el análisis de esta por parte del sistema no es instantánea, hay diferencias temporales inevitables durante el proceso de detección de la coincidencia. Para tener en cuenta esto, se utiliza una ventana de coincidencia temporal, cuya anchura está en función de la resolución temporal.
Resolución espacial: es la capacidad que tiene el sistema de reproducir con fidelidad las variaciones en la distribución de actividad del radiofármaco en el objeto a examen. Se define como la mínima distancia a la que se encuentren dos puntos que permita distinguirlos.
Función de dispersión de punto: describe la respuesta de un sistema de imagen a una fuente puntual. Es una medida de la resolución espacial de dicho sistema.
Anchura a mitad altura: es un parámetro que se usa para caracterizar las distribuciones gaussianas proporcionando su extensión y representa la anchura a media altura de la distribución. Está relacionado con la sigma de la distribución gaussiana mediante la expresión FWHM≈2.35σ.
Indeterminación angular: es la variación en la dirección de los fotones de 511 keV debido al momento del positrón. Se espera que la emisión de los dos fotones de la aniquilación sea en la misma dirección pero en sentidos opuestos (antiparalelos) porque el momento del positrón cuando se aniquila es cero. Pero existe una variación en el momento del positrón que produce una variación en la emisión antiparalela y se dice que no son colineales.
Profundidad de interacción: es el lugar dentro del cristal centelleador donde el fotón ha interaccionado. El fotón de 511 keV viaja una distancia desconocida dentro del cristal antes de interaccionar y esta distancia se conoce como la profundidad de interacción.
Error de paralaje: es el error que se produce cuando se desconoce la profundidad de interacción. Si el fotón entra muy oblicuo dentro del cristal puede ocurrir que la localización donde ha interaccionado y el punto de entrada en el cristal no sean el mismo, o incluso se entre por un cristal y se interaccione en otro. En estos casos se asignará una línea de respuesta incorrecta. El efecto del error de paralaje es el de empeorar la resolución espacial radialmente conforme nos alejamos del centro del campo de visión.
Sensibilidad: se define como el número de cuentas por unidad de tiempo detectadas por el dispositivo divididas por la actividad presente en la fuente. La sensibilidad depende de la eficiencia geométrica, la eficiencia de los detectores, las ventanas energéticas y temporales y el tiempo muerto del sistema.
Colimación electrónica: en PET expresa el hecho de por detectar los dos fotones emitidos antiparalelamente en coincidencia se conoce la dirección de la que provienen y no es necesario tener un colimador físico para conocer esta. La colimación electrónica tiene dos ventajas fundamentales sobre la física: aumenta la sensibilidad del sistema y mejora la uniformidad de la función de dispersión de punto (relacionada con la resolución espacial del sistema).
Septo: se conoce como el material puesto entre los anillos detectores de un PET para que la detección fuera en dos dimensiones y se redujera el número de coincidencias dispersadas entre planos. Con el septo se divide la cámara en una serie de anillos detectores contiguos e independientes.
Corrección de la atenuación: la atenuación de la radiación es el efecto físico más importante en PET e implica una reducción en el número de coincidencias detectadas frente a las emitidas debido al objeto a examinar. Los pares fotones de 511 keV que se crean dentro del paciente, debido al efecto fotoeléctrico o a la dispersión Compton, pueden ser absorbidos dentro del paciente o escapar del sistema; por tanto, no detectarse la coincidencia. Este efecto produce imágenes de PET donde la actividad se sobrestima en zonas superficiales o áreas poco densas (pulmones) porque los fotones emitidos en estas regiones tienen menos probabilidad de interaccionar. Además, se pierde el valor cuantitativo de la imagen de PET. Por tanto, es necesario corregir la atenuación y en un sistema PET/TAC se utiliza el TAC para obtener el mapa de los coeficientes de atenuación lineal del objeto a estudiar.
Tiempo de vuelo: implica que para cada suceso de aniquilación (emisión de dos fotones de 511 keV) se registra el tiempo en que cada fotón de la coincidencia ha llegado de manera muy precisa y se calcula la diferencia de estos tiempos. Ya que el fotón que ha recorrido menos trayectoria (estaba más cerca) llegará antes (pues ambos fotones viajan a la misma velocidad), la diferencia de tiempos nos ayudará a situar dónde ha tenido lugar la aniquilación a lo largo de la línea de respuesta del detector.