Describir los hallazgos radiológicos más característicos de la peritonitis esclerosante encapsulante en los diferentes métodos de imagen, con énfasis en la tomografía computarizada.
ConclusiónLa peritonitis esclerosante encapsulante es una enfermedad de baja incidencia, aunque desconocida, su fisiopatología no está clara y se reconocen dos tipos: idiopática y secundaria; esta última generalmente como complicación de la diálisis peritoneal. Su diagnóstico suele ser tardío debido a la presentación clínica inespecífica y a la ausencia de marcadores serológicos. Por este motivo es importante conocer los signos radiológicos, que incluyen engrosamiento y calcificación del peritoneo, dilatación de asas intestinales con engrosamiento y calcificación de sus paredes, ya sea aislados o asociados con ascitis loculada. Si bien la ecografía permite valorar la complejidad de las colecciones, la tomografía computarizada es el método de mayor valor para la delineación general de los signos radiológicos mencionados.
To describe the most characteristic imaging findings for sclerosing encapsulating peritonitis, with an emphasis on the computed tomography findings.
ConclusionThe incidence of sclerosing encapsulating peritonitis is low. The pathophysiology of this condition is unclear. Two types are recognized: idiopathic and secondary; the secondary type is generally a complication of peritoneal dialysis. Its nonspecific clinical presentation and the absence of blood markers mean that sclerosing encapsulating peritonitis is usually diagnosed late. Thus, it is important to know the imaging signs; these include thickening and calcification of the peritoneum and dilation of bowel loops with thickening and calcification of bowel walls, whether in isolation or in association with loculated ascites. Although ultrasonography allows the complexity of the collections to be evaluated, computed tomography is the most useful technique for the general assessment of the signs mentioned above.
La peritonitis esclerosante encapsulante (PEE) es una rara enfermedad caracterizada por infiltrado inflamatorio y formación de tejido fibroso en el peritoneo que causa su engrosamiento y rigidez. Las asas de intestino delgado afectadas pierden motilidad, lo que puede conducir a obstrucción intestinal.
Owtschinnikow definió la entidad por primera vez en 1907. Describió la encapsulación del intestino por una membrana fibrocolágena y la denominó “peritonitis crónica fibrosa incapsulata”1. Debido a sus diferentes causas y manifestaciones clínicas inespecíficas no suele considerarse inicialmente entre los posibles diagnósticos, lo que demora su tratamiento y se asocia con elevada morbimortalidad.
Se puede clasificar en idiopática y secundaria. La primera afecta principalmente a mujeres jóvenes de países tropicales o subtropicales2–4 u hombres de países no tropicales5,6. Sin embargo, Akbulut7 realizó en 2015 una revisión bibliográfica sobre PEE de origen idiopático e identificó una relación de 2:1 con predominio en hombres de regiones tropicales o subtropicales. China, India, Turquía y Nigeria son los países con más casos comunicados7.
Su origen estaría vinculado a la irritación crónica del peritoneo, que genera una respuesta inflamatoria no controlada con desarrollo de fibrosis. Se han propuesto múltiples hipótesis sobre la etiología idiopática: menstruación retrógrada con sobreinfección viral, daño tisular por células inmunológicas secundario a infecciones ginecológicas y peritonitis crónica asintomática. También se han postulado trastornos embriológicos como la displasia congénita del epiplón mayor y anomalías vasculares, aunque ninguna ha sido confirmada7. Los casos descritos en varones y niños tampoco apoyarían algunas de estas hipótesis.
Es importante diferenciar la PEE de la encapsulación peritoneal, la cual corresponde a una rara malformación congénita caracterizada por una membrana peritoneal accesoria que cubre el intestino delgado de forma parcial o total. Generalmente es asintomática y un hallazgo incidental durante la cirugía8.
Las causas de PEE secundaria son factores irritativos peritoneales locales o sistémicos como diálisis peritoneal continua ambulatoria (DPCA), infecciones fúngicas, tuberculosis, tecoma luteinizante ovárico, derivaciones ventriculoperitoneales y peritoneovenosas, enfermedad hepática terminal9, trasplante ortotópico hepático10, cirugías abdominales previas11, sarcoidosis, lupus eritematoso sistémico y fiebre mediterránea familiar. Otras causas sistémicas incluyen asbestosis, uso prolongado del betabloqueante practolol, metotrexato y deficiencia de la proteína S7.
La DPCA es la causa más frecuente, con una prevalencia de PEE del 0,4-8,9%12. El tiempo de DPCA es el principal factor de riesgo, presumiblemente por la exposición del peritoneo a las soluciones de diálisis. El riesgo de desarrollar la enfermedad después de 5 años varía entre el 0,6 y el 6,6%, incluso puede ocurrir ante la suspensión de la DPCA12. También se ha demostrado que la exposición a soluciones dialíticas glucosadas no libres de productos de la degradación de la glucosa se asocia a mayor riesgo13. Otros factores relacionados son el uso de soluciones dialíticas convencionales, episodios de peritonitis, fallo de la ultrafiltración, alto transporte de membrana y edad temprana de inicio de la DPCA12,13.
El mecanismo fisiopatológico se atribuye a un proceso inflamatorio peritoneal crónico desencadenado por las soluciones dialíticas que activan una cascada proinflamatoria [factor de crecimiento transformante β1 (TGF-β1), interleucina 6 (IL-6)] y proangiogénica [factor de crecimiento endotelial vascular (VEGF)]. Dicha actividad genera depleción de células mesoteliales peritoneales, producción de matriz extracelular (colágeno tipo 1) con formación de tejido fibrocolágeno14,15.
El mecanismo de acción de los betabloqueantes es desconocido, pero probablemente se relacione con la inhibición de la liberación del tensioactivo14. Además del practolol, otros betabloqueantes como el timolol, el metoprolol, el propranolol y el atenolol se han asociado al desarrollo de esta entidad7,14. En los pacientes con enfermedad hepática terminal se cree vinculado a irritación peritoneal por peritonitis bacteriana espontánea y ascitis, y puede ocurrir a pesar del trasplante hepático9,14.
El espectro clínico de la enfermedad es variable. Puede presentarse de manera asintomática, con cuadros inespecíficos como dolor y distensión abdominal, náuseas y vómitos. En otros casos, el cuadro clínico es más significativo, con masa palpable, anorexia, pérdida de peso y obstrucción intestinal. En los casos más graves puede conducir a malnutrición, sepsis y muerte.
En pacientes dializados se observa la disminución de la ultrafiltración y efluente dialítico sanguinolento12,14. Aunque en el análisis sérico es posible hallar aumento de la proteína C reactiva, anemia e hipoalbuminemia, no existen marcadores sanguíneos específicos ni otros métodos fiables de cribado12.
El sustrato histológico se caracteriza por la capa de células mesoteliales parcialmente reemplazada por tejido fibrocolágeno compuesto por proliferación de fibroblastos y depósito de fibrina16,17. En ocasiones se puede encontrar infiltración por células plasmáticas y linfocíticas5,16 (fig. 1 H a I). Estos cambios son inespecíficos y también pueden observarse en casos de fallo del ultrafiltrado, diálisis peritoneal existente desde hace tiempo y peritonitis de etiología infecciosa3.
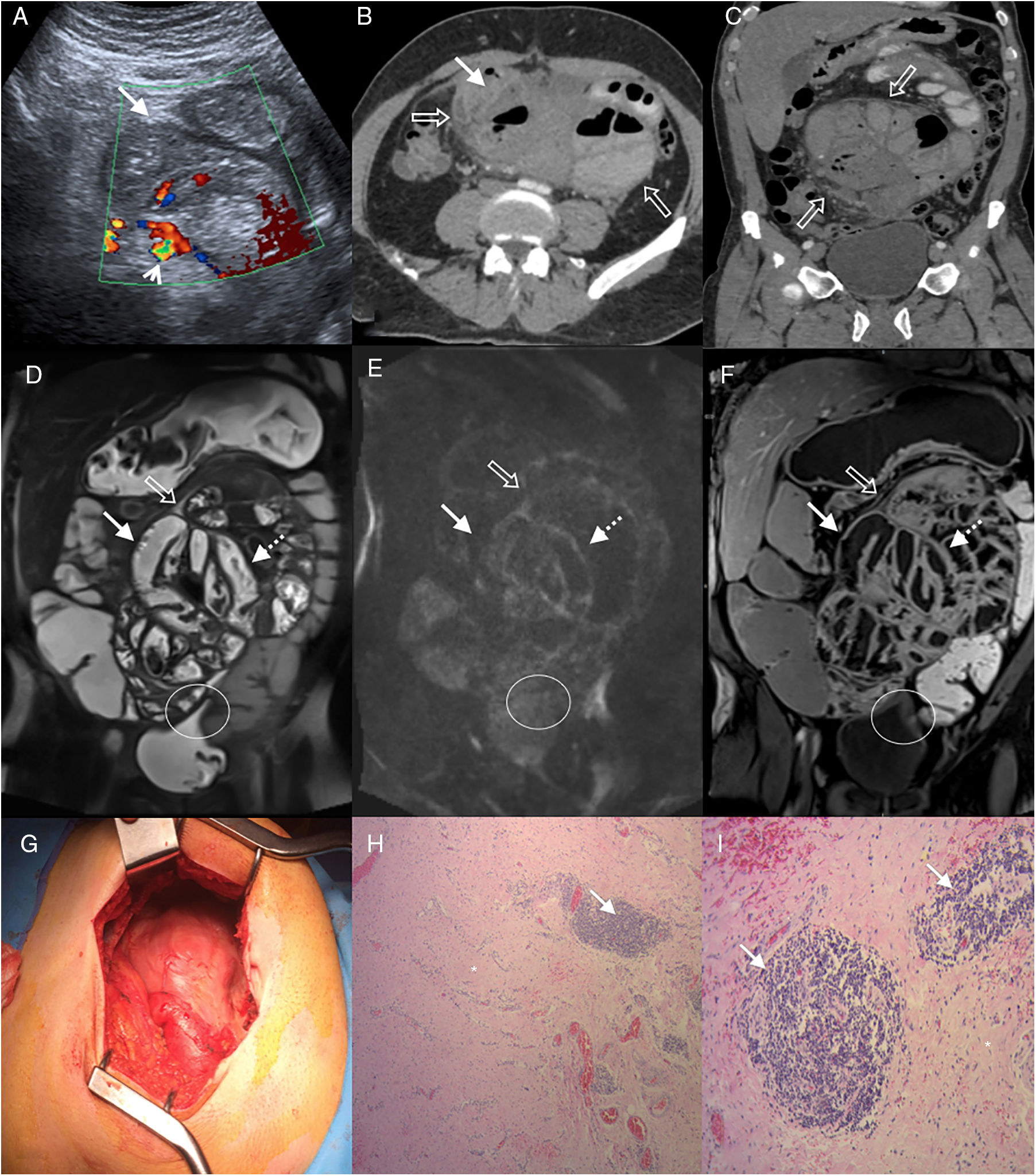
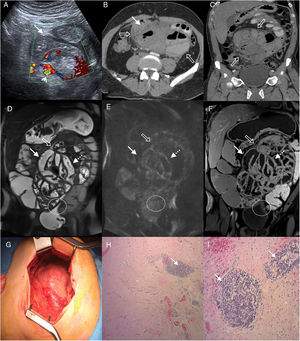
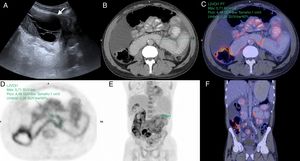
Varón de 55 años en estudio por dolor abdominal intermitente y distensión abdominal, sin antecedentes clínicos de relevancia. A) Ecografía Doppler, corte transversal del abdomen que muestra asas de intestino delgado agrupadas (flecha blanca) con engrosamiento mural y signos de aumento del flujo parietal (cabeza de flecha). B y C) Tomografía computarizada multidetector (TCMD) con contraste endovenoso (B) corte transversal (C) y reconstrucción coronal oblicua, donde se observa conglomerado centroabdominal de asas de intestino delgado dilatadas, de paredes moderadamente engrosadas y “encapsuladas” por una membrana peritoneal engrosada (flechas huecas). D a F) Entero-RM con contraste, cortes coronales (D) secuencia TSE T2 (E), difusión b 800 (F) y secuencia VIBE T1 con saturación grasa tras la administración de gadolinio (fase portal), que ponen de manifiesto engrosamiento parietal con disminución de pliegues (flechas blancas) de las asas encapsuladas por la membrana peritoneal engrosada (flechas huecas) y líquido laminar circundante. Signos de restricción en difusión y realce con contraste en las paredes y la membrana peritoneal (flechas punteadas), hallazgos relacionados con cambios inflamatorios y fibrosis. Nótese la retracción del techo vesical en la zona de contacto con la superficie peritoneal (círculo). G) Fotografía intraoperatoria que muestra una gruesa membrana que encapsula el intestino delgado. H e I) Histología del peritoneo con hematoxilina-eosina 40x (H) y 100x (I), que muestra fibrosis con fibras de colágeno denso (asterisco) e inflamación crónica por infiltrado linfocitario y células plasmáticas perivascular (flechas).
Por su apariencia macroscópica se distinguen tres fenotipos17: tipo I, caracterizado por un peritoneo engrosado, recubierto por fibrina y membranas interasas; tipo II, donde la cubierta que tapiza las asas adquiere un aspecto reticulado, y tipo III, en el que la cápsula que engloba el intestino adquiere rigidez con tendencia a la retracción y convergencia de las asas involucradas, lo que le otorga el aspecto de “capullo intestinal” (fig. 1 G). Este subtipo se caracteriza por menor depósito de fibrina17.
El diagnóstico de PEE se basa en la sospecha clínica y confirmación por técnicas de imagen o abordaje quirúrgico. Las alteraciones observadas en las imágenes se pueden agrupar en presencia de colecciones líquidas, afectación del peritoneo y alteraciones del intestino delgado.
Pueden ser únicas o múltiples y se presentan hasta en el 90% de los casos18. La ecografía es útil en su estudio inicial y en la valoración del contenido o la presencia de septos (fig. 2 A), aunque limitada cuando las colecciones son de gran tamaño. La tomografía computarizada multidetector (TCMD) facilita la delineación general de las loculaciones con una valoración panorámica del abdomen y la pelvis (fig. 3). Es importante recordar que estas colecciones aumentan de tamaño al progresar la enfermedad.
Debe recordarse que: el engrosamiento del peritoneo es el signo más característico de la enfermedad, evidenciado en la totalidad de los casos18,19.
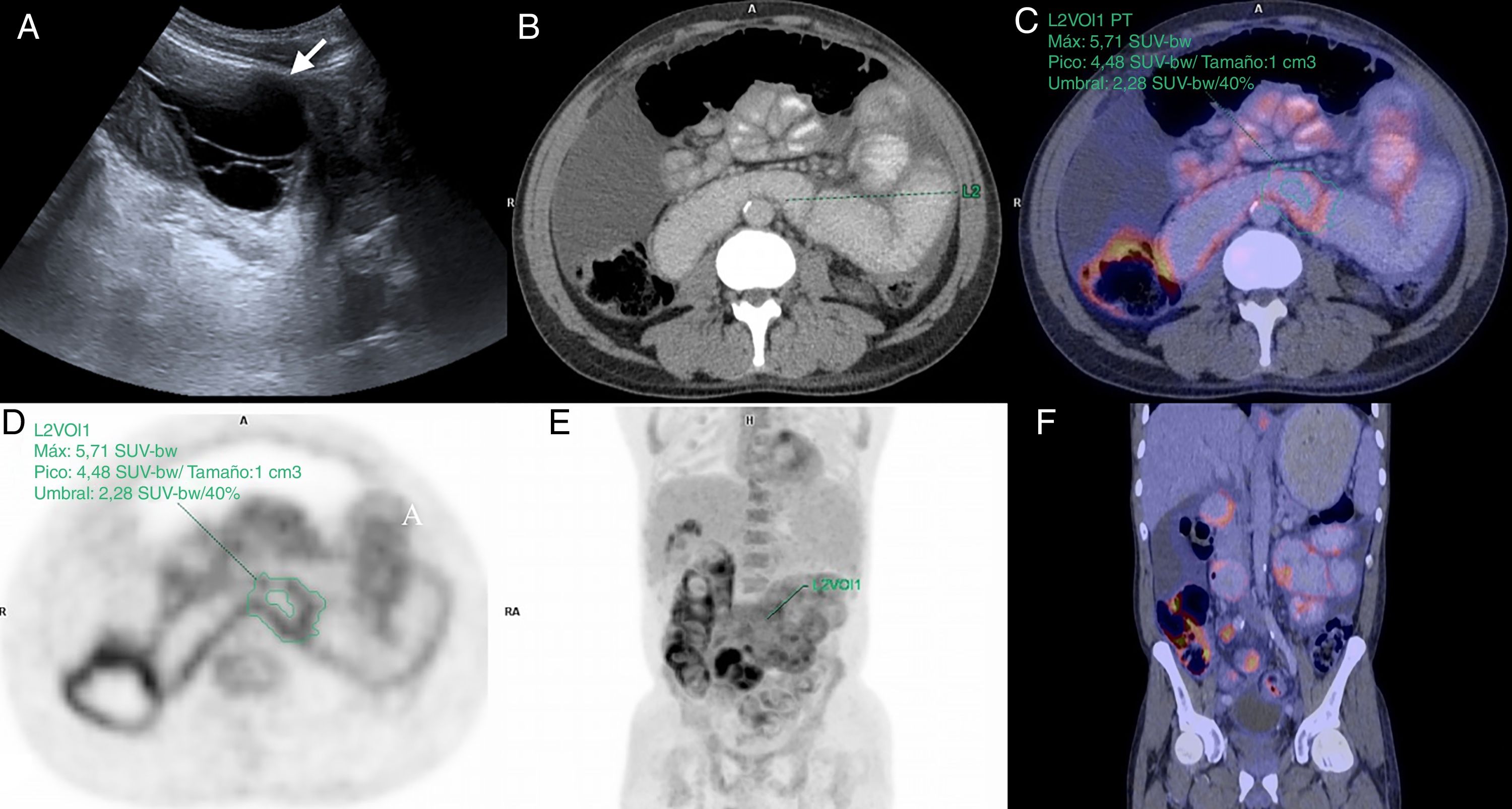
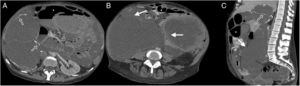
Varón de 49 años, en estudio por dolor abdominal, con antecedente de enfermedad renal crónica en estadio V, en diálisis peritoneal desde hace 5 años. A) Ecografía abdominal en modo B, corte transversal del flanco izquierdo donde se evidencia una colección líquida loculada (flecha). B a F) Tomografía por emisión e positrones-tomografía computarizada, cortes transversal (B, C y D) y coronal (E y F) que muestran aumento de la captación del radiotrazador (18F-FDG) de manera difusa en las paredes del intestino delgado. SUV máximo: 5,71.
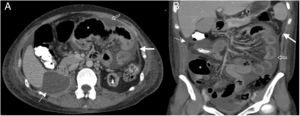
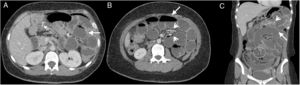
Mujer de 57 años, en estudio por cuadros de obstrucción intestinal repetidos, con antecedente de enfermedad renal crónica y diálisis peritoneal. Tomografía computarizada multidetector de abdomen con contraste endovenoso, fase portal, corte transversal (A) y reconstrucción sagital (B), donde se observa una colección líquida loculada (flechas) con pared definida que realza con contraste. Produce efecto de masa rechazando hacia posterior las asas de intestino delgado (cabezas de flechas).
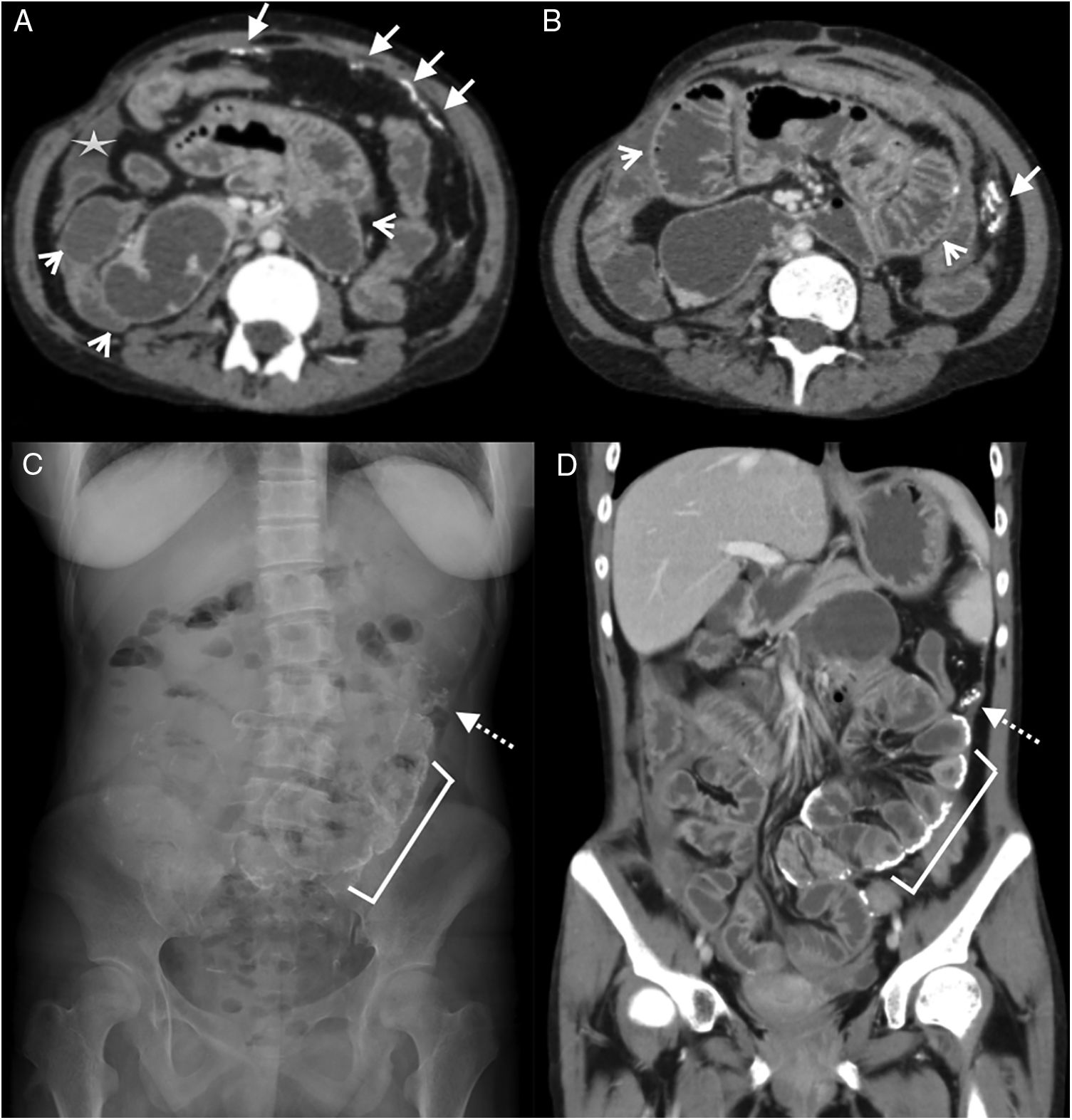
Las calcificaciones peritoneales se aprecian en fases avanzadas20. La TCMD es el método de mayor utilidad para demostrar el compromiso del peritoneo parietal y visceral. Se presenta engrosado y con captación de contraste endovenoso debido a la infiltración inflamatoria y los cambios fibróticos difusos (fig. 4). Al inicio el engrosamiento se presenta en forma de placas aisladas, y después es difuso21. El realce con contraste resulta más evidente cuando el peritoneo se encuentra rodeado por estructuras de baja atenuación como el líquido o la grasa18. También facilita la valoración del engrosamiento peritoneal en estudios sin contraste. Sin embargo, hay que considerar que estos hallazgos son inespecíficos y similares en patologías infecciosas peritoneales18.
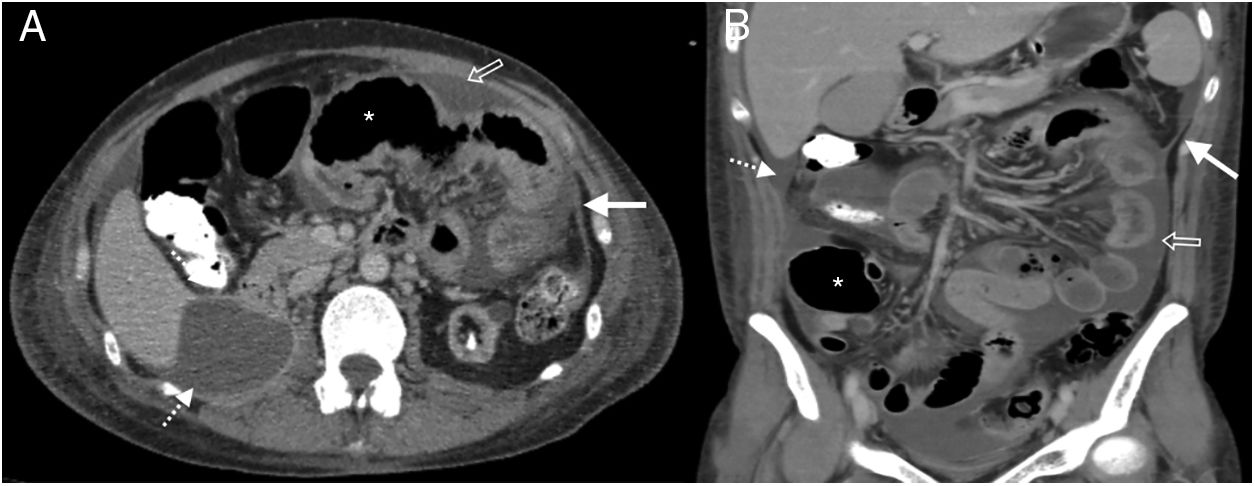
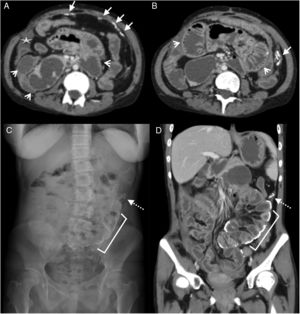
Mujer de 38 años ingresada por dolor abdominal. Antecedente de lupus eritematoso sistémico e insuficiencia renal crónica, en diálisis peritoneal. Tomografía computarizada multidetector de abdomen y pelvis con contraste oral y endovenoso, corte transversal del abdomen superior (A) y reconstrucción coronal (B), donde se aprecia engrosamiento y realce de la superficie peritoneal en flanco izquierdo (flechas blancas), ascitis loculada subhepática (flecha punteada), líquido libre interasas (flecha hueca) y distensión de asas de intestino delgado (asterisco). Mala evolución con óbito al cabo de 6 meses del estudio.
La TCMD es el método por imágenes más sensible para la detección de las calcificaciones22, presentes en el 70% de los casos19. Inicialmente son lineales y pueden afectar a ambas hojas peritoneales. Con la progresión de la enfermedad se constituyen placas “en sábana” y conglomerados18,21 (fig. 5). El aumento en el número o tamaño se asocia a empeoramiento sintomático18.
Debe recordarse que: la calcificación peritoneal difusa se asocia con enfermedad avanzada; no obstante, la encapsulación grave puede ocurrir en ausencia de calcificaciones20.
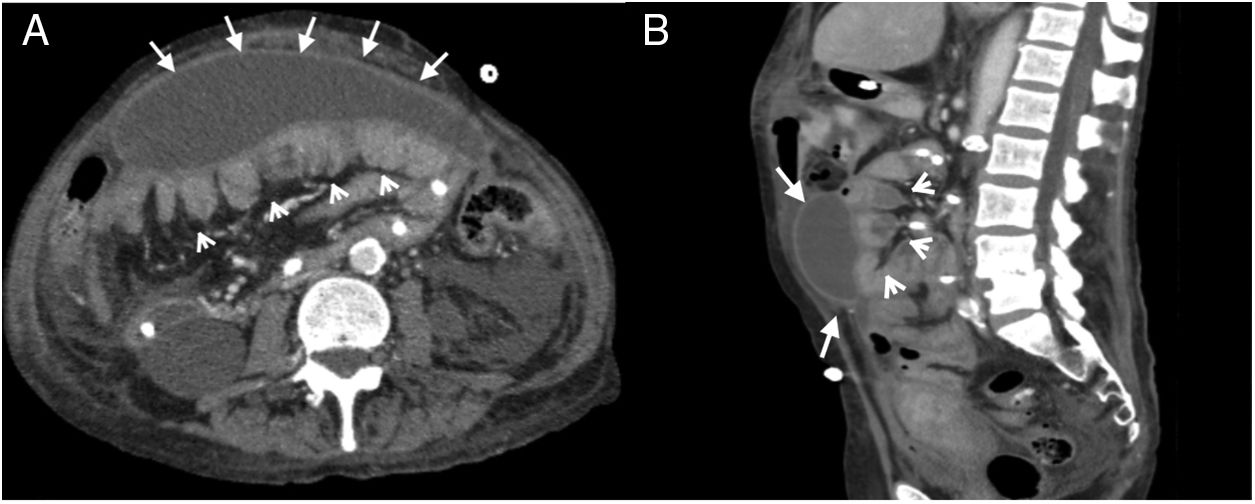
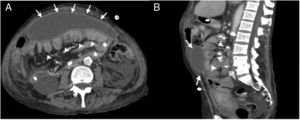
Mujer de 25 años con dolor abdominal difuso. Antecedente de enfermedad renal crónica por nefropatía congénita (esclerosis mesangial difusa), en diálisis peritoneal desde hace 10 años. Tomografía computarizada multidetector (TCMD) con contraste endovenoso, fase portal: A) Corte transversal donde se evidencian calcificaciones lineales peritoneales (flechas blancas) y tramos dilatados de intestino delgado (cabezas de flechas), además de una pequeña colección subhepática (estrella). B) Corte transversal, caudal a A, donde se aprecian calcificaciones en forma de conglomerado en el peritoneo parietal del flanco izquierdo (flecha blanca) y dilatación de asas de intestino delgado (cabezas de flechas). C) Radiografía de abdomen de pie (anteroposterior) en donde se evidencian múltiples calcificaciones lineales correspondientes a la pared intestinal (corchete) y peritoneo (flecha punteada). D) TCMD, reconstrucción coronal con hallazgos similares a la radiografía.
En radiografías, la distribución centroabdominal y el aspecto curvilíneo de las calcificaciones indica su dependencia de la pared intestinal o del peritoneo visceral. Las calcificaciones periféricas lineales suelen asentar en el peritoneo parietal (fig. 5C).
El compromiso del intestino delgado es secundario a la afectación peritoneal visceral, con disminución en su motilidad y distensión progresiva (fig. 5). En ocasiones puede constituir conglomerados a expensas de la encapsulación peritoneal y/o debido al efecto de masa generado por las colecciones líquidas23. El proceso fibrótico peritoneal puede progresar y causar fibrosis mural con calcificaciones (fig. 5 D). En fases avanzadas, el engrosamiento mural y las adherencias de las asas generan obstrucción23. Si bien estos hallazgos son valorables con ecografía, resultan más evidentes en la TCMD.
Otro método que permite valorar la cavidad peritoneal es la TC-peritoneografía utilizando contraste yodado intraperitoneal. A pesar de que no aporta más información para el diagnóstico de PEE, es útil en la detección de complicaciones de la DPCA como fugas, hernias y abscesos. Además, permite evaluar la dinámica del fluido peritoneal18.
Existen escasas comunicaciones respecto al uso de resonancia magnética (RM), aunque los hallazgos son similares a los observados en TCMD24 (fig. 1 D-F).
En un estudio preliminar en el que se utilizaron secuencias dinámicas “cine” se observó alteración en el patrón de los movimientos intestinales, lo que podría ayudar al diagnóstico inicial25. Otra alternativa es la utilización de la RM sin gadolinio aprovechando el líquido peritoneal como medio de contraste, pero no hay experiencia en esta técnica para evaluar pacientes con PEE.
La ausencia de exposición a la radiación ionizante es una ventaja de la RM; no obstante, su mayor coste y el riesgo potencial de fibrosis sistémica nefrogénica constituyen desventajas que restringen su uso22,26. Es relevante recordar la limitación en la detección de calcificaciones que posee esta técnica.
La tomografía por emisión de positrones (PET) puede ser útil durante la fase inflamatoria aguda donde se evidencia un aumento de la captación del radiotrazador por el peritoneo26. En nuestro caso (fig. 2) se evidenció hipercaptación de fluorodesoxiglucosa en la pared intestinal, aunque no hemos hallado comunicaciones sobre este comportamiento. La inespecificidad de los signos, que también se observan en otras causas de peritonitis agudas, limita el uso de este método. Los estudios de pacientes asintomáticos en DPCA tampoco han demostrado hallazgos de valor27. Existe muy poca experiencia en la utilización de este método14,26.
Entre los diagnósticos diferenciales debe considerarse la hernia interna en pacientes con signos de oclusión o suboclusión intestinal20,28 (fig. 6). Los principales hallazgos en TCMD son la localización y/o agrupación con tracción de asas de intestino delgado, signos de obstrucción, arremolinamiento e ingurgitación de vasos mesentéricos y desplazamiento por efecto de masa de órganos adyacentes28. Otro diagnóstico diferencial es el pseudomixoma peritoneal. Presenta colecciones de baja atenuación en peritoneo, omento y mesenterio, incluso calcificaciones (fig. 7). La ausencia de compromiso intestinal ayuda al diagnóstico radiológico. También deben considerarse patologías que pueden causar calcificaciones peritoneales, como tuberculosis, amiloidosis, hiperparatiroidismo y carcinomatosis peritoneal20. En estos casos, los antecedentes, el cuadro clínico y los marcadores sanguíneos facilitarán la orientación diagnóstica.
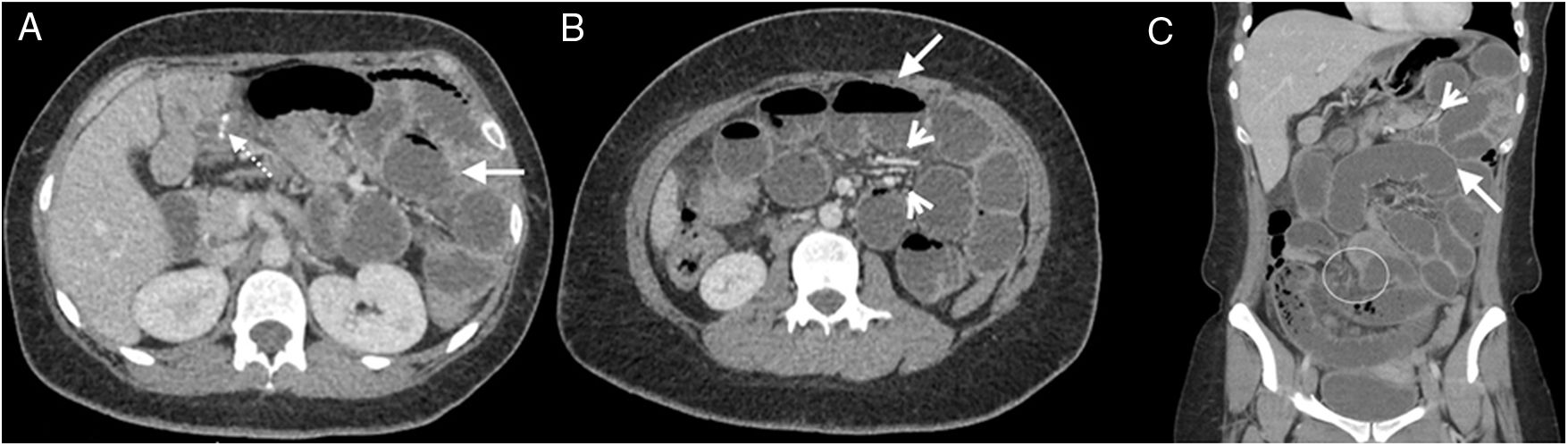
Mujer de 28 años con antecedente de bypass gástrico hace un año y reciente apendicectomía, ingresada por dolor abdominal en epigastrio con irradiación a flanco izquierdo de 24 horas de evolución, sin otros síntomas asociados. Tomografía computarizada multidetector de abdomen con contraste endovenoso, fase portal, corte transversal (A y B) y reconstrucción coronal (C) donde se evidencian huellas quirúrgicas de la anastomosis yeyuno-yeyunal en flanco derecho (flecha punteada), ligera ingurgitación de vasos mesentéricos (cabezas de flechas) y dilatación del intestino delgado (flecha blanca). A nivel centroabdominal, se evidencia un sitio de obstrucción con transición asa fina-asa gruesa (círculo). La laparoscopia exploradora reveló una hernia a través del espacio de Petersen y bridas centroabdominales.
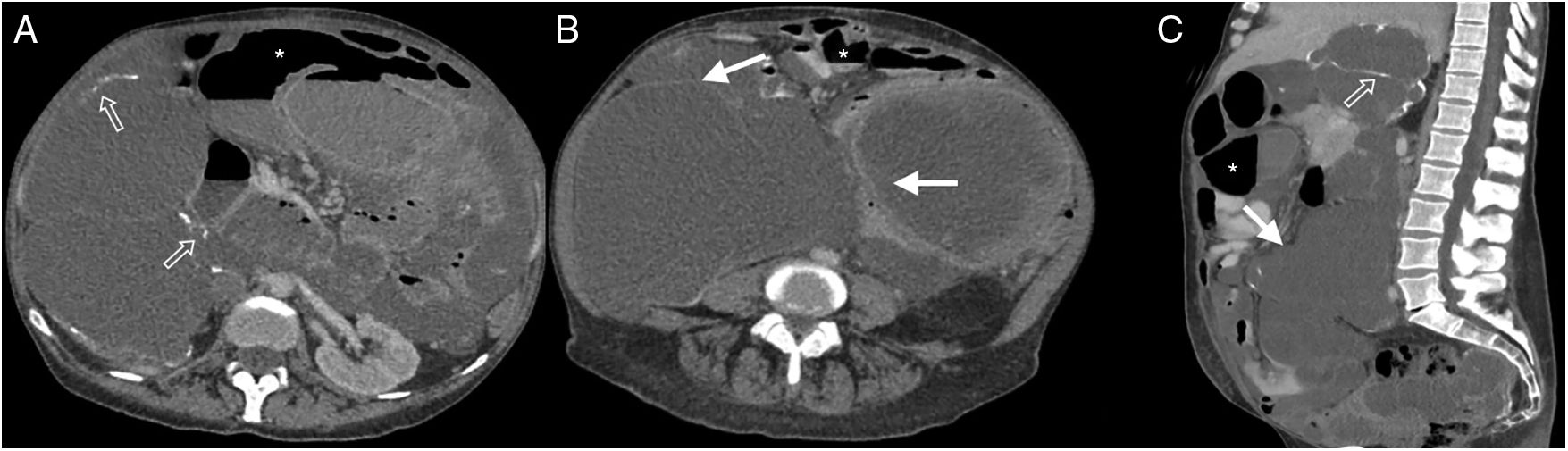
Mujer de 51 años con múltiples intervenciones quirúrgicas por pseudomixoma peritoneal. Tomografía computarizada multidetector de abdomen con contraste endovenoso, fase portal, corte transversal (A y B) y reconstrucción sagital (C) donde se observan colecciones de baja atenuación loculadas sin realce (flechas blancas) y con paredes calcificadas (flechas huecas). Las asas intestinales se encuentran comprimidas y con material de contraste oral en su interior (asterisco).
No existe consenso para el tratamiento de esta enfermedad7. La mayoría coincide en un abordaje inicial con reposo intestinal y soporte nutricional enteral o parenteral7,12,13. En pacientes con PEE en DPCA se recomienda la medicación antiinflamatoria y antifibrogénica como corticoesteroides13,29 o tamoxifeno12,13. También se pueden utilizar otros fármacos como colchicina, azatrioprina y micofenolato de mofetilo, aunque la experiencia en su uso es limitada7. La DPCA debe ser interrumpida y el paciente ser transferido a hemodiálisis12.
En casos de oclusión intestinal, cuando se confirma el engrosamiento peritoneal por TCMD, está indicado el abordaje quirúrgico para la escisión de la membrana fibrótica y la adhesiólisis7. La resección intestinal solo se realiza ante la presencia de necrosis30. La cirugía no está indicada en pacientes asintomáticos30.
En conclusión, la PEE es una enfermedad rara que representa una complicación grave de la DPCA y causa importante de obstrucción intestinal. Conocer su existencia y signos radiológicos permiten sospechar su diagnóstico para implementar el tratamiento adecuado.
Autoría- 1.
Responsables de la integridad del estudio: R.LG y JAO.
- 2.
Concepción del estudio: RLG, AHM y JAO.
- 3.
Diseño del estudio: RLG, AHM, MA y JAO.
- 4.
Obtención de los datos: RLG, AHM, MA, JADP y JAO.
- 5.
Análisis e interpretación de los datos: RLG, MA y JAO.
- 6.
Tratamiento estadístico: RLG y JAO.
- 7.
Búsqueda bibliográfica: RLG, AHM, MA, JADP y JAO.
- 8.
Redacción del trabajo: RLG, MA y JAO.
- 9.
Revisión crítica del manuscrito con aportaciones intelectualmente relevantes: AHM, JADP y JAO.
- 10.
Aprobación de la versión final: RLG, AHM, MA, JADP y JAO.
Los autores declaran no tener ningún conflicto de intereses.