La séptima edición de la clasificación TNM para los carcinomas broncogénicos no microcíticos incluye una serie de cambios en los descriptores T y M, particularmente una reclasificación de los derrames malignos pleurales y pericárdicos y de los nódulos tumorales separados, nuevos valores de corte de tamaño tumoral y subdivisiones de las categorías T1-T2 y M1. Revisamos estas correcciones, que generan cambios en el sistema de estadificación que afectan a los estadios II-III. Además, describimos e ilustramos el papel de las diferentes técnicas de imagen en la estadificación tumoral (TC, PET, PET-TC y RM), resaltando sus respectivas indicaciones, ventajas y desventajas, así como su función complementaria.
The Seventh Edition of the TNM Classification for non-small cell bronchogenic carcinomas include a series of changes in the T and M descriptor, in particular a re-classification of malignant pleural and pericardial effusions and of separated tumour nodes, new tumour size cut-off values and sub-divisions of the T1-T2 and M1 categories. We review these corrections that led to the changes in the staging system that affects stages II-III. Furthermore, we describe and illustrate the role of the different imaging techniques in tumour staging (CT, PET, PET-CT and MRI), highlighting their respective indications, advantages and disadvantages, as well their complementary function.
La clasificación TNM para el carcinoma broncogénico no microcítico (CBNM) es un sistema internacionalmente aceptado y validado para guiar el manejo del paciente, planificar el tratamiento y valorar el pronóstico. Categoriza el tumor dependiendo de sus características primarias (T), afectación ganglionar regional (N) y metástasis a distancia (M)1–7. De su combinación obtenemos el estadio tumoral en la etapa clínico-diagnóstica (basado en la historia clínica, pruebas de imagen y muestras histológicas pretratamiento) o quirúrgico-patológica (resultado histológico del tumor resecado)1,3,5,6.
La séptima edición de la clasificación TNM (TNM-7)8 fue desarrollada por la «International Association for the Study of Lung Cancer» (IASLC) a partir del «Lung Cancer Study Project», que realizó un análisis estadístico retrospectivo del valor pronóstico (expresado en supervivencia) de los descriptores TNM sobre una base de datos internacional con 100.869 pacientes con CBNM tratados entre 1990 y 2000. Posteriormente, fue aprobada por el «American Joint Committee on Cancer» (AJCC) y la «International Union Against Cancer» (UICC) para su uso a partir del 1 de enero de 2010, sustituyendo a la sexta edición (TNM-6)3,4,6–15.
En este artículo describiremos los cambios introducidos en la TNM-7, fundamentalmente una reclasificación de la afectación pleuropericárdica y los nódulos tumorales separados (antes «satélites»), la introducción de nuevos valores de corte de tamaño tumoral, y subdivisiones de las categorías T1-T2 y M11,3-6,9-11,14,15. Aunque el descriptor N no presenta cambios, se describen límites anatómicos más precisos entre estaciones ganglionares y su distribución en «zonas ganglionares»1,4,7,11,14,16. Además, se recomienda su uso para los carcinomas microcíticos y los tumores carcinoides.
La TNM-7 analiza retrospectivamente las tasas de supervivencia, reflejando los métodos de evaluación clínica (particularmente las técnicas de imagen) y tratamientos aplicados9,12,13. Dado que ambos experimentan continuos avances, con repercusión en la supervivencia, las revisiones periódicas son imprescindibles. Resumiremos también el papel de las técnicas de imagen en la estadificación del CBNM (tomografía computarizada [TC], tomografía por emisión de positrones [PET], tomografía por emisión de positrones-tomografía computarizada [PET-TC] y resonancia magnética [RM]), resaltando sus indicaciones, ventajas, desventajas y su papel complementario.
TNM-7: cambios introducidosLos descriptores T describen parámetros anatómicos del tumor como el tamaño, la localización endobronquial, la distancia hasta la carina, la invasión de estructuras próximas, la atelectasia, los nódulos separados, etc.17. Los cambios introducidos, validados para todos los subtipos histológicos, incluyen9,13:
- –
Creación de valores de corte de 2, 3, 5 y 7cm, que subdividen las categorías T1-T2 en función del eje mayor de la lesión. Aunque el punto de corte entre ambas sigue siendo 3cm, T1 se subdivide en T1a (≤2cm) y T1b (>2cm y ≤3cm); y T2 en T2a (>3cm y ≤5cm) y T2b (>5cm y ≤7cm).
- –
Cualquier tumor >7cm se reclasifica como T3.
- –
Los nódulos separados localizados en el mismo lóbulo que el primario son considerados T3 (antes T4), y los localizados en un lóbulo diferente del pulmón ipsilateral se reclasifican como T4 (antes M1).
- –
Los implantes pleurales y el derrame pleuro-pericárdico son reclasificados como M1 (antes T4).
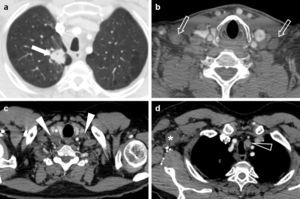
Sobre el descriptor N, no hubo recomendaciones de cambio, aunque la IASLC propone un nuevo mapa ganglionar que reconcilia las diferencias entre los mapas preexistentes (el de Naruke de la Japan Lung Cancer Society, y el de Mountain-Dresler de la American Thoracic Society) y que, para homogeneizar la nomenclatura, agrupa las 14 estaciones ganglionares en 6 zonas anatómicas (superiores, aortopulmonares, subcarinales, inferiores, hiliares y periféricas). Además, se describen con precisión los límites anatómicos entre estaciones ganglionares (en particular, el límite entre las estaciones paratraqueales derecha e izquierda, que ahora es el borde lateral izquierdo traqueal y no la línea media traqueal; así, los ganglios pretraqueales pertenecen a una u otra cadena paratraqueal). Los ganglios cervicales bajos, supraclaviculares y de la escotadura esternal ahora son reconocidos como estación independiente (estación 1)1,4,6,7,11,14-16 (fig. 1).
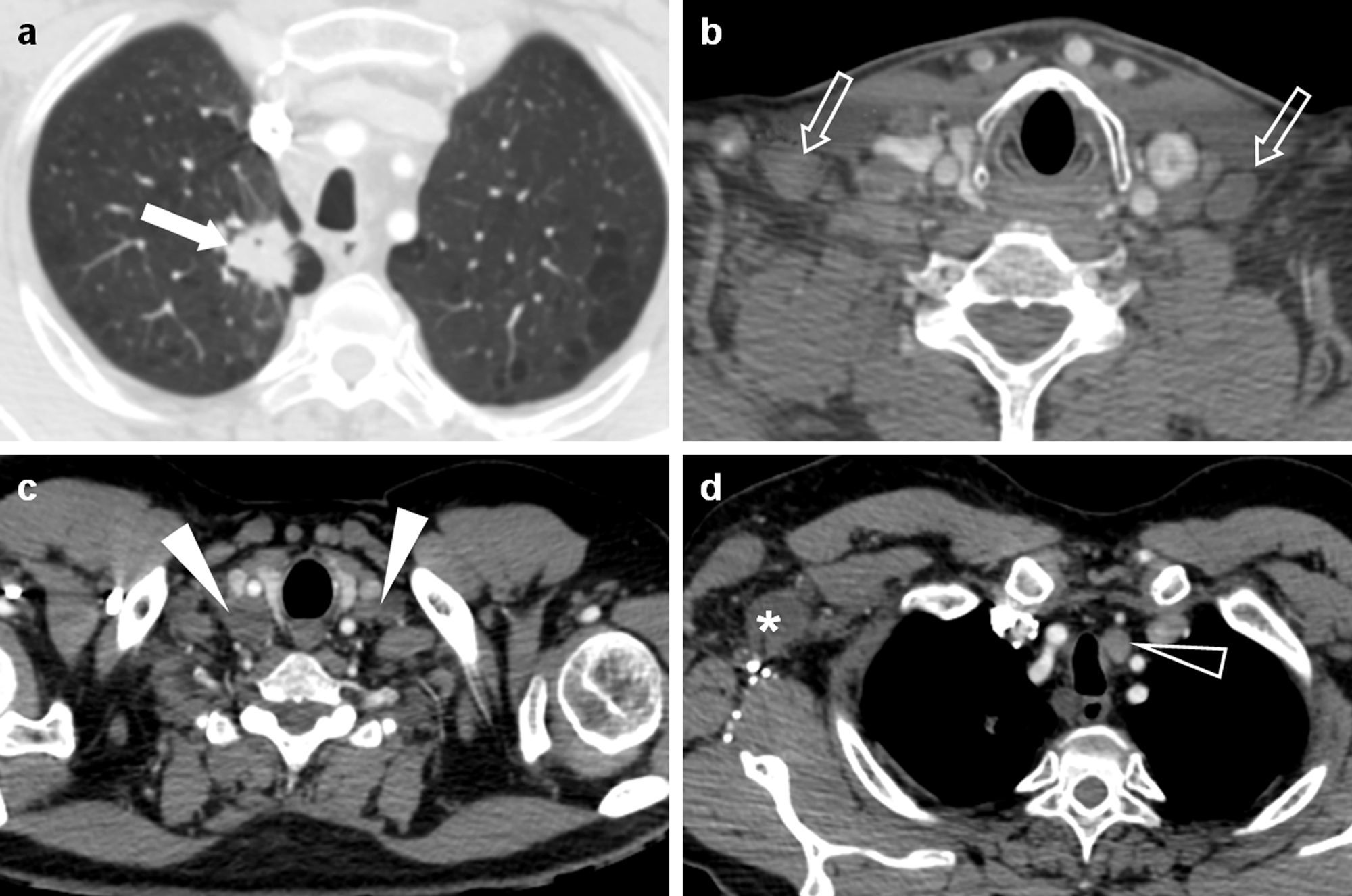
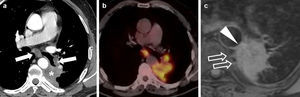
Adenocarcinoma de pulmón en un paciente de 47 años. Imágenes de tomografía computarizada multidetector (TCMD) al diagnóstico, con contraste intravenoso. En la imagen axial con ventana de pulmón (a) se apreciaba una masa espiculada en el lóbulo superior derecho de 33mm de eje mayor (flecha). En las imágenes axiales con ventana de mediastino (b, c y d) se veían adenopatías en los huecos supraclaviculares (flechas en b), cervicales inferiores bilaterales (cabezas de flecha en c) y paratraqueales izquierdas (cabeza de flecha en d). Es importante recalcar que las adenopatías supraclaviculares, las de la escotadura esternal y las cervicales inferiores corresponden a la estación ganglionar 1, y que el límite entre las estaciones paratraqueales derechas e izquierdas es el borde izquierdo traqueal. Los hallazgos se confirmaron mediante PET-TC sin que hubiesen signos de afectación metastásica a otros niveles (no mostrado). Por lo tanto, los datos obtenidos correspondían a los de un tumor cT2aN3M0 (estadio IIIB). Sin embargo, una de las limitaciones de la TNM-7 es la ausencia de una codificación explícita de las adenopatías axilares (asterisco en d), retropectorales, mamarias internas, frénicas y abdominales.
Se analizó la relación entre supervivencia y número de estaciones afectadas dentro de cada categoría N (única o múltiple), observándose mayor supervivencia con la afectación de una sola estación, aunque la evidencia no fue suficiente para recomendar subdivisiones de N1-N2 en N1a-N2a (única) y N1b-N2b (múltiple)1,4,6,9,15,16.
Asimismo, se evaluó la relación entre la localización del tumor primario y sus adenopatías, y las metástasis discontinuas (skip metastases, N2 sin evidencia de N1), aunque sin resultados significativos1,11,15,16.
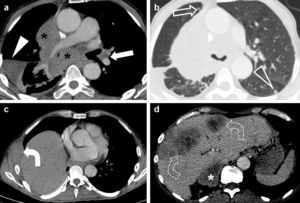
En cuanto al descriptor M, la categoría M1 se divide en M1a (metástasis intratorácicas: derrame pleuro-pericárdico maligno, implantes pleurales, nódulos pulmonares contralaterales) y M1b (metástasis extratorácicas)1,9,12,13,18 (fig. 2). Aunque existe una posible relación entre supervivencia y número de órganos metastatizados, no hay evidencia que justifique una subdivisión de la categoría M1b11.
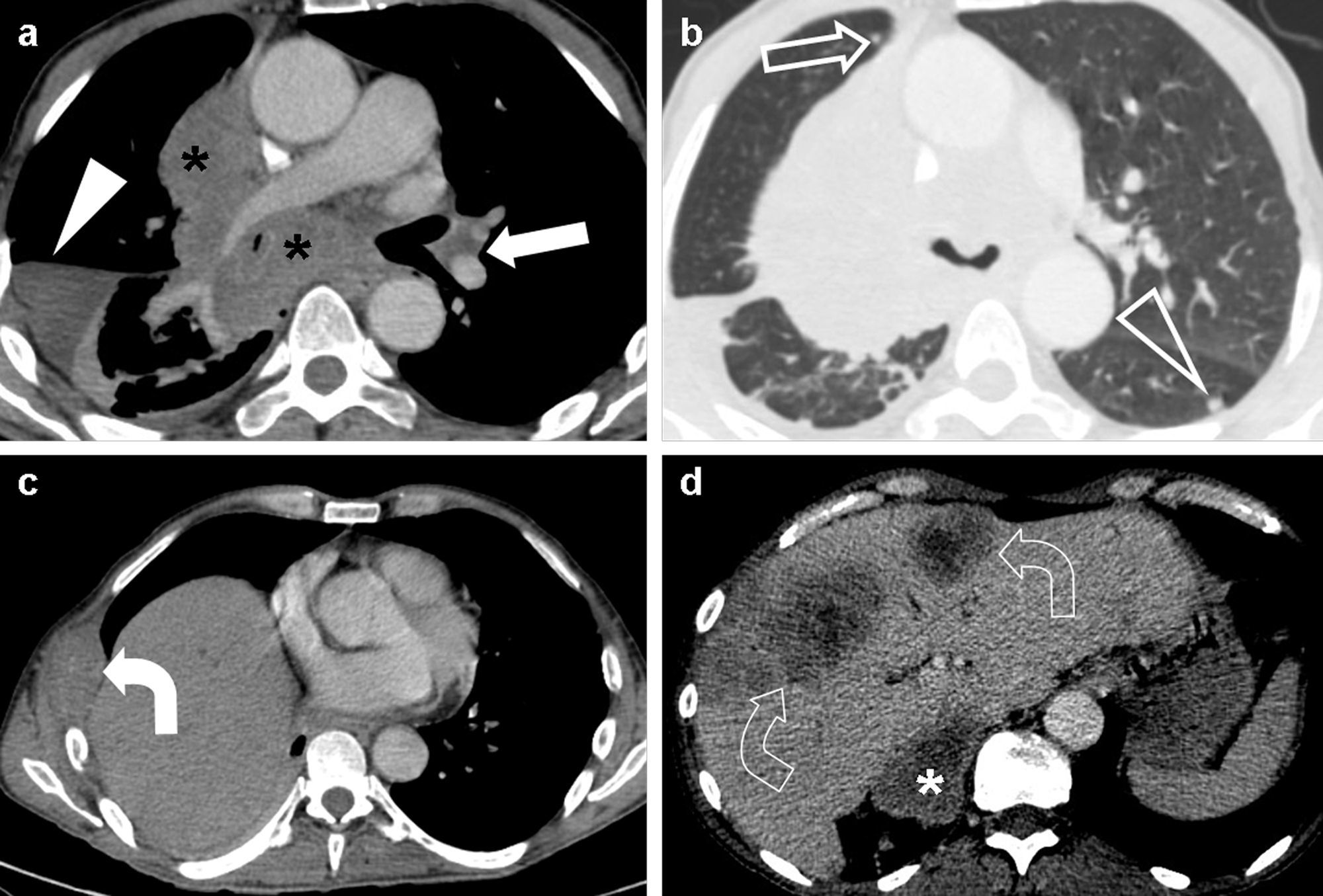
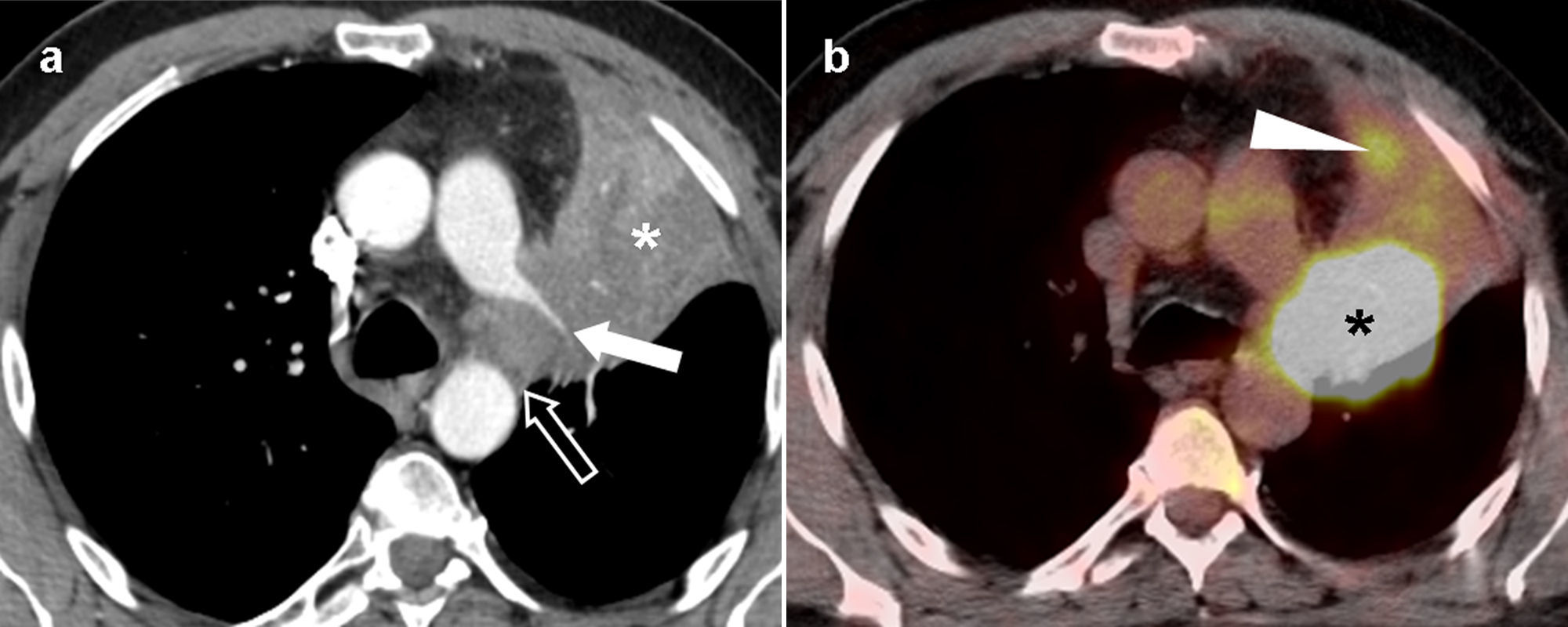
Ejemplo de estadificación tumoral según la TNM-7. Carcinoma epidermoide de pulmón en un paciente de 54 años. En la imagen de tomografía computarizada multidetector (TCMD) en el plano axial con contraste intravenoso y ventana de mediastino (a) se observaba una masa hiliar derecha voluminosa (asteriscos) que infiltraba masivamente el mediastino (englobaba a la tráquea, la carina, el esófago, la arteria pulmonar derecha y sus ramas lobares, y los bronquios lobares superior e inferior. En esta imagen, se apreciaba la invasión del bronquio lobar inferior derecho, que presentaba una luz filiforme). Esta lesión cumpliría criterios para clasificarse como T4. Se observaban además adenopatías hiliares contralaterales (flecha), por lo que correspondía a un tumor N3. Sin embargo, era difícil determinar si había adenopatías hiliares derechas asociadas a la masa tumoral. En la imagen de TCMD axial con ventana pulmonar (b) se observaban nódulos separados en el lóbulo medio (flecha) —indicativo también de T4—, y en el pulmón contralateral (cabeza de flecha), que unidos al derrame pleural derecho (cabeza de flecha en a), lo clasificaban como M1a. En las imágenes axiales con ventana de mediastino (c) y (d) se veía una lesión osteolítica costal derecha con una masa de partes blandas (flecha curva), metástasis hepáticas (flechas curvas huecas), y una metástasis suprarrenal derecha (asterisco), que lo clasificaban como M1b. Así pues, se trataba de un tumor T4N3M1b (estadio IV).
Igualmente, la IASLC recomienda la utilización de la TNM-7 para el carcinoma microcítico de pulmón y los tumores carcinoides, al observarse una relación inversamente proporcional entre supervivencia y estadio tumoral4,6,7.
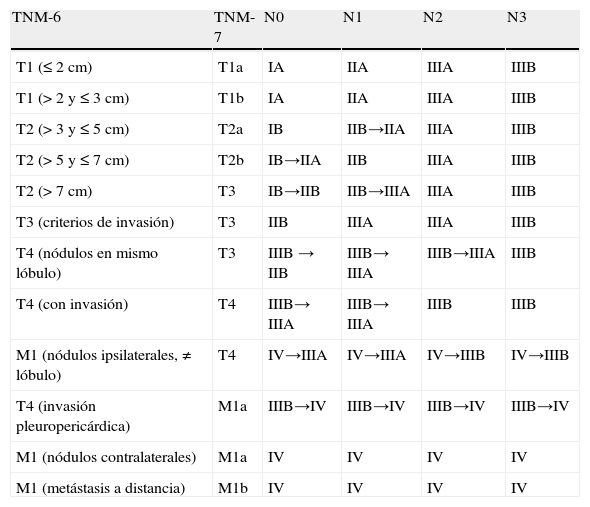
La tabla 1 resume los descriptores T, N y M de la TNM-78,9, resaltando sus diferencias con respecto a la TNM-63,5,19,20, y las figuras 3 y 4 las ilustran.
Definiciones de los descriptores T, N y M propuestos por la IASLC en la TNM-7
| T | TX | T primario que no puede ser evaluado.T probado por la presencia de células malignas en el esputo o el aspirado bronquial, pero no visible por imagen ni broncoscopia. |
| T0 | No evidencia de T primario. | |
| Tis | T in situ. | |
| T1 | T ≤3cm Ø, rodeado por pulmón o pleura visceral, sin evidencia de invasión proximal al bronquio lobar.(T1a: tumor ≤2cm Ø, y T1b: tumor >2 y ≤3cm Ø) | |
| T2 | T>3cm y ≤7cm Ø, o con cualquiera de las siguientes características: | |
| – Invasión del bronquio principal a más de 2cm de la carina. | ||
| – Invasión de la pleura visceral o la cisura (entendida como una reflexión de la pleura visceral), salvo que además reúna criterios de otra categoría superior. | ||
| – Atelectasia o neumonitis obstructiva con extensión hiliar sin compromiso completo del pulmón afecto (atelectasia parcial). | ||
| (T2a: tumor >3 y ≤5cm Ø, y T2b: tumor >5 y ≤7cm Ø) | ||
| T3 | T>7cm Ø o T que invade cualquiera de las siguientes estructuras: | |
| – Pared torácica (incluyendo al tumor del sulcus superior), diafragma, pleura mediastínica, pericardio parietal, nervio frénico. | ||
| – T en el bronquio principal a <2cm de la carina. | ||
| – Atelectasia completa del pulmón afecto. | ||
| Nódulos pulmonares tumorales separados, localizados en el mismo lóbulo que el T primario. | ||
| T4 | T de cualquier tamaño que invade el mediastino, el corazón, los grandes vasos, la tráquea, el esófago, los cuerpos vertebrales, la carina, el nervio laríngeo recurrente, o nódulos tumorales separados, localizados en un lóbulo ipsilateral diferente del T primario. | |
| N | NX | No puede evaluarse. |
| N0 | Ausencia de AG regional. | |
| N1 | AG ipsilateral intrapulmonar, peribronquial o perihiliar, incluyendo la afectación por extensión directa. | |
| N2 | AG mediastínica y/o subcarinal ipsilateral. | |
| N3 | AG del mediastino o del hilio contralateral. | |
| AG ipsilateral o contralateral de ganglios escalenos o supraclaviculares. | ||
| M | MX | No puede evaluarse. |
| M0 | Ausencia de M a distancia. | |
| M1 | M1a: M intratorácicas: | |
| – Derrame pleural (no paraneumónico) o pericárdico maligno. | ||
| – Implantes pleurales. | ||
| – Nódulos metastásicos en el pulmón contralateral. | ||
| M1b: M extratorácicas. |
En negrita aparecen resaltados los cambios con respecto a la TNM-6.
AG: afectación ganglionar; IASLC: International Association for the Study of Lung Cancer; M: metástasis; T: tumor; Ø: diámetro mayor.
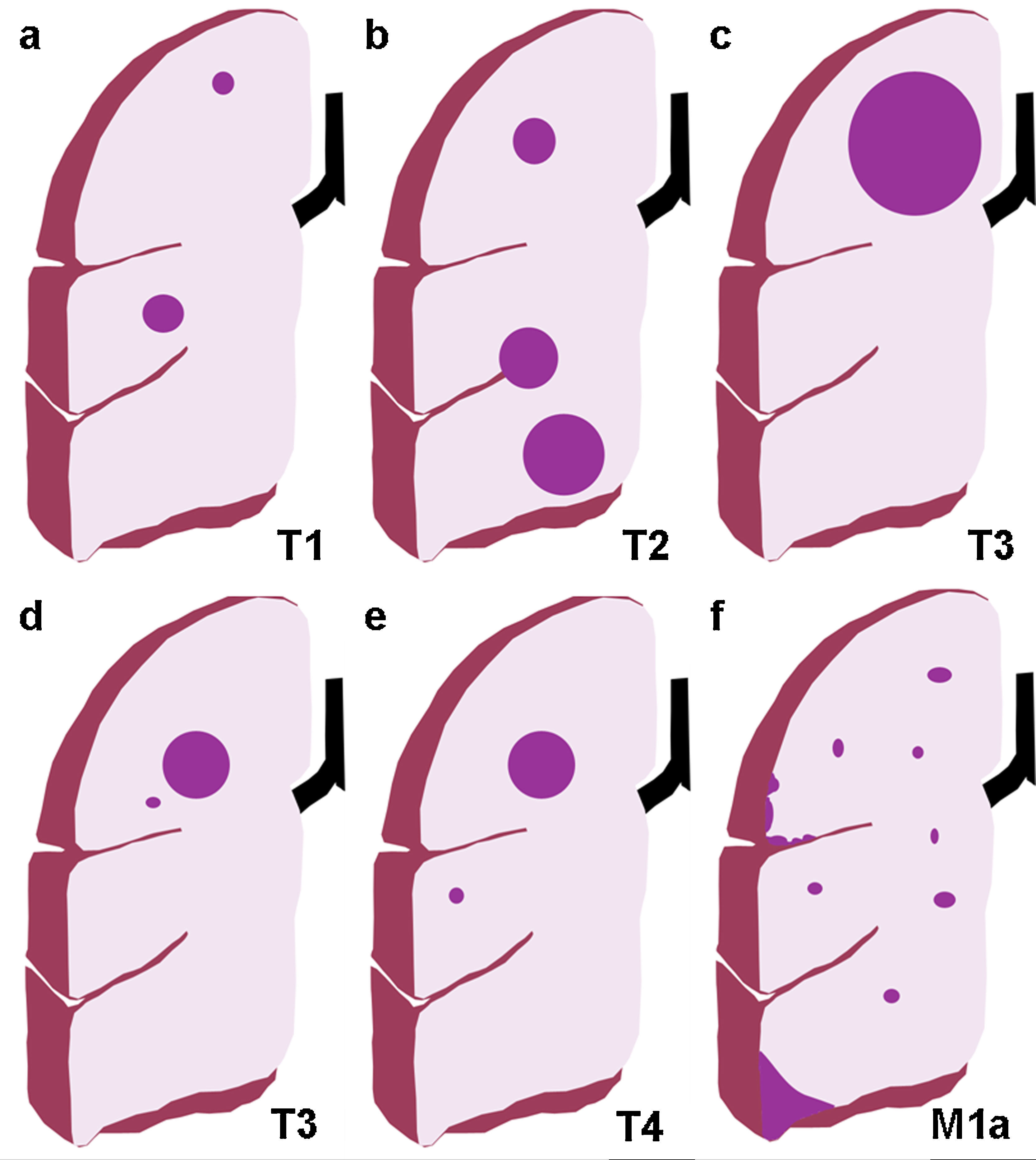
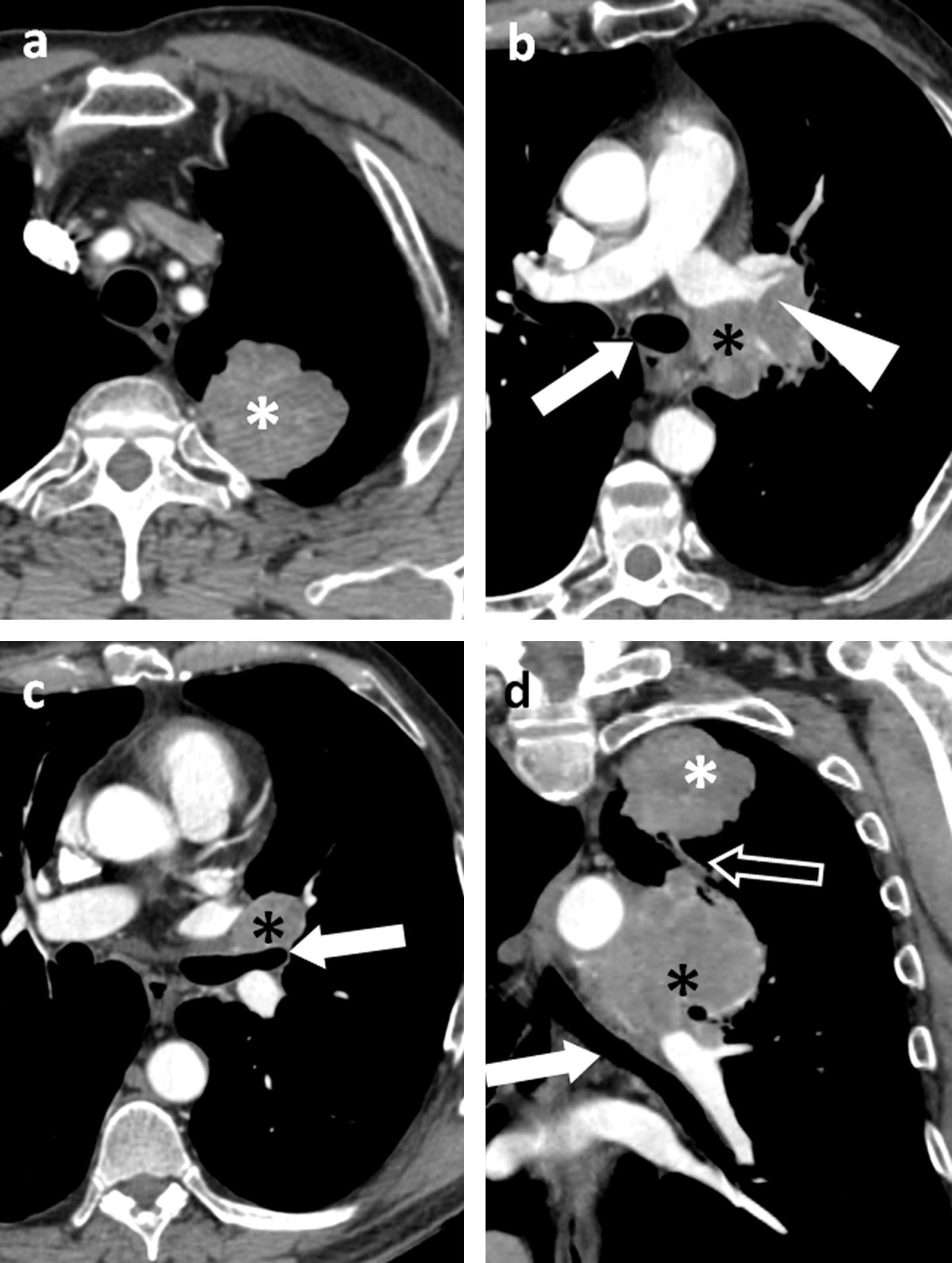
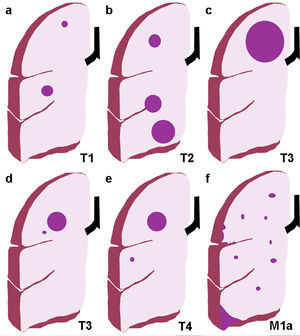
Ilustración de los cambios introducidos en la TNM-7; a) Categoría T1, con tumores T1a ≤2cm de eje mayor y T1b con eje mayor >2 y ≤3cm; b) Categoría T2, subdividida en T2a si el eje mayor es >3cm y ≤5cm, y T2b si es >5 y ≤7cm. Un tumor que invade la pleura visceral o atraviesa una cisura es un tumor T2; c) Categoría T3: cualquier tumor de más de 7cm de eje mayor; d) Categoría T3: nódulos tumorales separados en el mismo lóbulo que el tumor primario; e) Categoría T4: nódulos tumorales separados en un lóbulo diferente del pulmón ipsilateral, y f) Categoría M1a: metástasis intratorácicas como derrame pleural maligno, implantes pleurales y nódulos metastásicos en el pulmón contralateral (en la ilustración no aparece el tumor primario en el pulmón izquierdo).
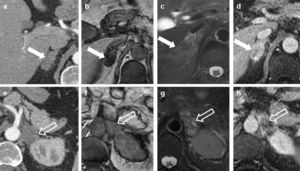
Ejemplo de estadificación tumoral según la TNM-7. Carcinoma epidermoide de pulmón en un paciente de 81 años. Imágenes axiales (a y c) y reconstrucción sagital oblicua (b) de tomografía computarizada multidetector torácica con contraste, ventana de parénquima pulmonar, en las que se apreciaba una masa cavitada de contornos espiculados, de 55×41×36mm, situada en el lóbulo inferior derecho (asteriscos negros). La lesión infiltraba y retraía la confluencia de las cisuras menor y mayor derechas (flechas), invadiendo el lóbulo medio derecho y el lóbulo superior derecho. Este tumor, por tamaño y por atravesar una cisura, sería un tumor T2b. Sin embargo, la masa también infiltraba la pleura parietal (engrosada y retraída, cabeza de flecha negra en a) y la pleura mediastínica (cabeza de flecha hueca en a), así como un pequeño nódulo separado de 8mm en su vertiente superior, dentro del mismo lóbulo inferior derecho (cabeza de flecha en c), lo que lo convertía en un tumor T3.
De la combinación de los descriptores se obtiene el estadio tumoral. En la TNM-7 la estadificación resulta más compleja, pues aunque las subdivisiones de los descriptores T y M no implican la creación de nuevos subgrupos, se produjeron 17 migraciones de estadio (10 a la baja, 7 al alza). La supervivencia media en cada estadio se correlaciona con las estadificaciones clínico-diagnóstica y quirúrgica-patológica1,10,11.
La tabla 2 resume estas migraciones y resalta las principales diferencias entre la TNM-61,3,5,20 y TNM-79,10. Los cambios principales son:
- –
T2aN1M0 se clasifica como IIA (antes IIB).
- –
T2bN0M0 se clasifica como IIA (antes IB).
- –
T3 (>7cm) N0M0 se clasifica como IIB (antes IB).
- –
T3 (>7cm) N1M0 se clasifica como IIIA (antes IIB).
- –
T3N0M0 (nódulos en el mismo lóbulo) se clasifica como IIB (antes IIIB).
- –
T3N1-N2M0 (nódulos en el mismo lóbulo) se clasifican como IIIA (antes IIIB).
- –
T4M0 (nódulos pulmonares ipsilaterales) se clasifican como IIIA si N0-N1, y IIIB si N2-N3 (antes IV).
- –
T4N0-1M0 (extensión directa) se clasifica como IIIA (antes IIIB).
- –
El derrame pleural maligno (M1a) se clasifica como estadio IV (antes IIIB).
Estadificación tumoral (estadios I a IV) de acuerdo con los descriptores TNM-6 y TNM-7
| TNM-6 | TNM-7 | N0 | N1 | N2 | N3 |
| T1 (≤2cm) | T1a | IA | IIA | IIIA | IIIB |
| T1 (>2 y ≤3cm) | T1b | IA | IIA | IIIA | IIIB |
| T2 (>3 y ≤5cm) | T2a | IB | IIB→IIA | IIIA | IIIB |
| T2 (>5 y ≤7cm) | T2b | IB→IIA | IIB | IIIA | IIIB |
| T2 (>7cm) | T3 | IB→IIB | IIB→IIIA | IIIA | IIIB |
| T3 (criterios de invasión) | T3 | IIB | IIIA | IIIA | IIIB |
| T4 (nódulos en mismo lóbulo) | T3 | IIIB → IIB | IIIB→ IIIA | IIIB→IIIA | IIIB |
| T4 (con invasión) | T4 | IIIB→ IIIA | IIIB→ IIIA | IIIB | IIIB |
| M1 (nódulos ipsilaterales, ≠ lóbulo) | T4 | IV→IIIA | IV→IIIA | IV→IIIB | IV→IIIB |
| T4 (invasión pleuropericárdica) | M1a | IIIB→IV | IIIB→IV | IIIB→IV | IIIB→IV |
| M1 (nódulos contralaterales) | M1a | IV | IV | IV | IV |
| M1 (metástasis a distancia) | M1b | IV | IV | IV | IV |
Se indican con flechas las migraciones de estadio producidas tras las modificaciones introducidas con la TNM-7 (modificado a partir de NCCN Guidelines™, versión 3.2011, staging non-small cell lung cancer y Goldstraw P., et al.9).
Una correcta estadificación tiene implicaciones terapéuticas. En general, los estadios I, II y IIIA son candidatos a cirugía, y los estadios IIIB-IV son considerados irresecables (algunos T4, tumores N3 y M1), pero se beneficiarán del tratamiento quimioterápico y/o radioterápico. El papel de la quimioterapia neoadyuvante seguida de cirugía en tumores en el estadio IIIA es aún controvertido, pero los avances quirúrgicos han alterado las nociones de resecabilidad, y hoy día es posible aplicar este esquema en casos seleccionados con invasión del mediastino o de los cuerpos vertebrales2,7,11,17,18,21,22.
TNM-7: limitacionesBasándose en la supervivencia, la TNM-7 revisa sus descriptores y reorganiza la estadificación tumoral, disminuyendo la heterogeneidad de las tasas de supervivencia en los estadios II-III de la TNM-6. Sin embargo, al ser un estudio retrospectivo, la validez de sus resultados para cohortes terapéuticas prospectivas está limitada1,11.
La IASLC reconoce que no pudo evaluar el impacto de la PET/PET-TC en la estadificación por su limitada disponibilidad en el período estudiado4,11. Sin embargo, hoy son técnicas más accesibles, existen recomendaciones sobre su uso y forman parte del algoritmo diagnóstico del CBNM. La consideración de las técnicas de imagen en futuras revisiones es una expectativa razonable, no solo para cuantificar su impacto en la estadificación clínica, sino también para consensuar algoritmos diagnósticos.
La TNM-7 no especifica cómo medir las lesiones en TC11,15. Aunque deben considerarse los ejes máximos de la lesión, no se indica si debe hacerse en las reconstrucciones multiplanares o en los planos axiales. Tampoco se especifica cómo medir las lesiones mal delimitadas (cavitadas o infiltrativas)4,11, y es particularmente difícil aplicarla al carcinoma bronquioloalveolar (en la más reciente clasificación del adenocarcinoma de pulmón se desaconseja seguir empleando los términos carcinoma bronquioloalveolar y adenocarcinoma de tipo mixto, y se proponen unos criterios de nomenclatura y diagnósticos con el fin de fomentar una mayor uniformidad terminológica)23.
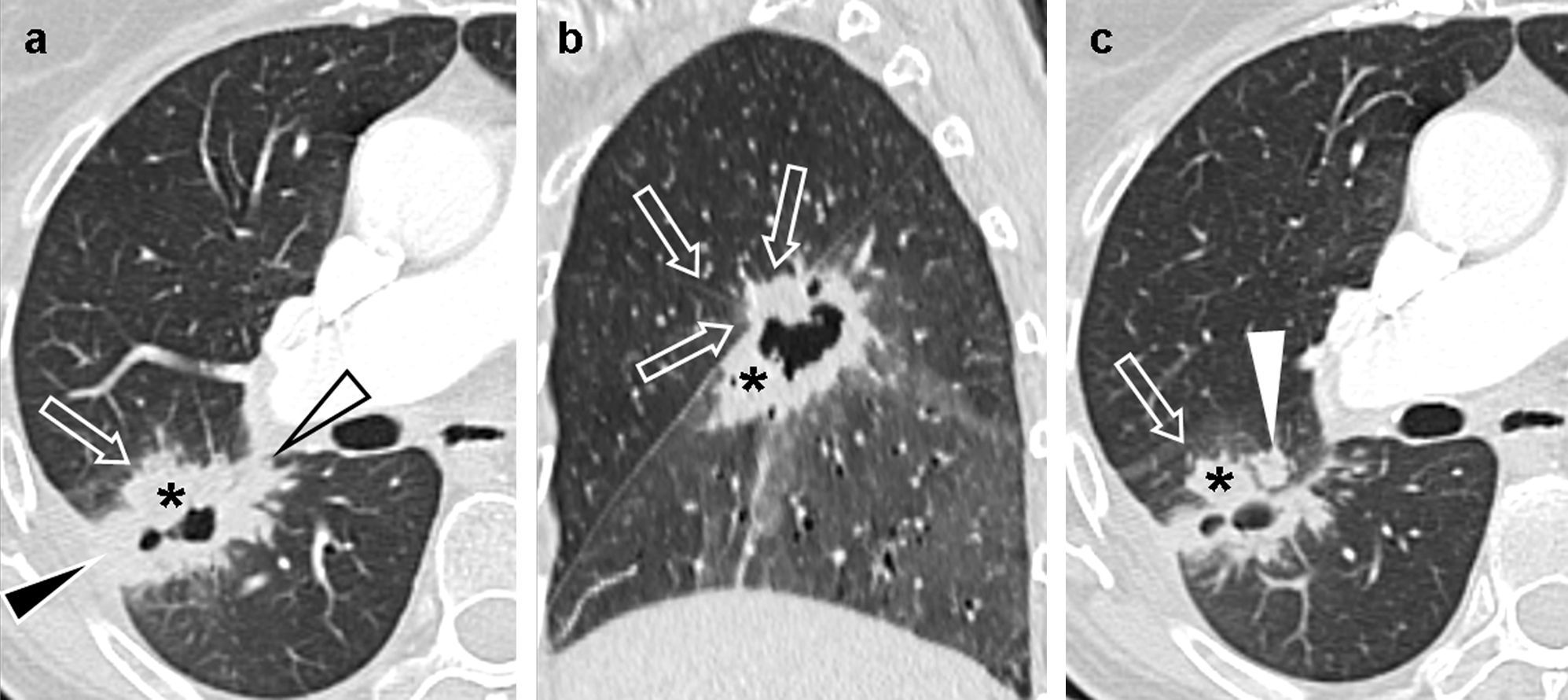
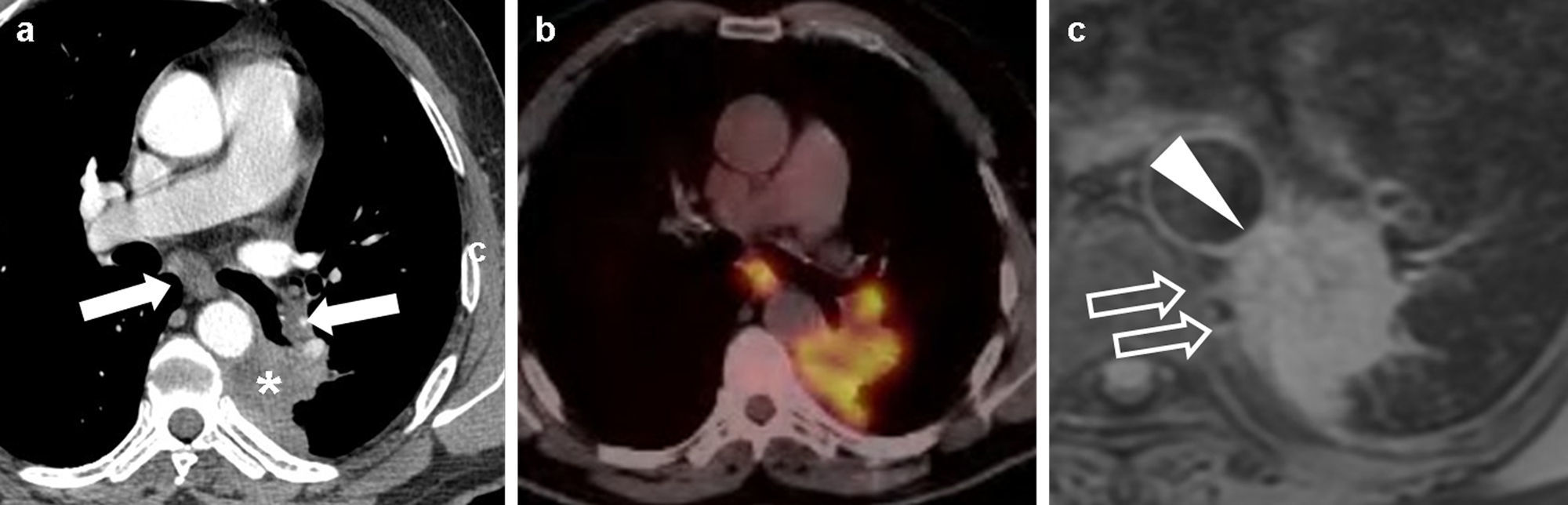
No se mencionan las limitaciones de la TC para medir lesiones endobronquiales o con neumonitis obstructiva asociada, ni el papel de la PET/PET-TC en este aspecto4,11 (fig. 5). Igualmente, delimitar un tumor T4 con infiltración mediastínica y conglomerados adenopáticos adyacentes puede ser problemático, ya que sus límites pueden ser borrosos o inexistentes; sin embargo, es importante distinguir entre N0-1 y N2-3, pues los primeros son candidatos a cirugía11,17 (fig. 6).
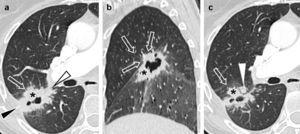
Carcinoma epidermoide de pulmón pobremente diferenciado en un paciente de 54 años; a) Imagen axial de tomografía computarizada multidetector torácica con contraste en la que se observaba una lesión parahiliar en el lóbulo superior izquierdo que amputaba el bronquio lobar superior izquierdo (no mostrado), con atelectasia del lóbulo (asterisco). La lesión afilaba el trayecto de la arteria pulmonar izquierda (flecha sólida) y borraba el plano graso de separación con la aorta torácica descendente (flecha hueca). Debido a la atelectasia, resultaba difícil valorar la verdadera extensión del tumor. b) Imagen fusionada PET-TC en la que se apreciaba con claridad un foco anómalo de hipermetabolismo (asterisco), con valores elevados de SUV, de hasta 18. Este hallazgo permitía determinar los límites y el tamaño del tumor y diferenciarlo de la atelectasia obstructiva. Se apreciaba un área de menor actividad en situación anterolateral a la masa (cabeza de flecha), que sugería un foco de neumonitis en el seno la atelectasia.
Dificultad para estadificar afectación adenopática invasiva. Carcinoma epidermoide de pulmón en un paciente de 60 años, que debutó con disfonía. En la exploración laríngea se observó una parálisis de la cuerda vocal izquierda. En las imágenes axiales con ventana de mediastino de la tomografía computarizada multidetector torácica con contraste intravenoso (imágenes a, b y c) se visualizó una masa de 53×47mm en el lóbulo superior izquierdo con áreas hipodensas irregulares en su interior (asterisco blanco en a). Se veía también un voluminoso conglomerado adenopático de 87×68mm que afectaba fundamentalmente a la ventana aortopulmonar (hallazgo que justificaba la parálisis del nervio laríngeo recurrente) y al hilio pulmonar izquierdo (asteriscos negros en b y c). En la reconstrucción coronal oblicua (d) se apreciaba cómo la masa lobar superior izquierda entraba en contacto con el conglomerado adenopático por medio de un septo irregular (flecha hueca). Nótese cómo el conglomerado ejercía un efecto de masa —sin ocluirlas— sobre la arteria pulmonar izquierda y sus divisiones lobares (cabeza de flecha en b), mientras que el bronquio principal izquierdo no se estaba obstruido (flechas sólidas en b, c y d), ni tampoco sus ramas lobares (no mostradas). No se observaron otras lesiones a distancia. De este modo, se trataría de un tumor T2bN2M0. No es infrecuente en el diagnóstico de carcinoma broncogénico central confundir adenopatías con el tumor primario. Un tumor central del volumen mostrado en las imágenes obstruiría los bronquios, no así las adenopatías. Sin embargo, si se tratara de un caso de afectación adenopática con invasión extracapsular, podría existir una invasión de tejidos vecinos que produjese una estenosis de las arterias (como en nuestro caso) o de los bronquios.
Sobre los descriptores T no basados en el tamaño (distancia hasta la carina, invasión de pleura visceral o mediastino), cabe plantearse si son factores pronósticos independientes o dependen del tamaño tumoral, aunque la evidencia no fue suficiente para introducir nuevas recomendaciones1,4,11,15.
Aunque los nódulos separados se clasifican como T3-T4 o M1a, no se menciona cómo diferenciar nódulos metastáticos de primarios sincrónicos-metacrónicos, ganglios intrapulmonares o incluso lesiones benignas, ni se ha asignado un descriptor específico a la linfangitis carcinomatosa7,11.
Además, no es infrecuente detectar adenopatías axilares, retropectorales, mamarias internas, frénicas e incluso abdominales, que no están codificadas explícitamente y no pueden considerarse metástasis, entendida como diseminación no linfática (fig. 1). Tampoco se analiza el valor de una afectación N2 bulky, que lleva implícito un peor pronóstico4,11.
La IASLC reconoce que los aspectos que no pudieron ser demostrados deberán ser evaluados en estudios prospectivos. Con los continuos avances en medicina, en futuras clasificaciones también tendrán su lugar los datos relacionados con la biología y genética tumoral1,4,11.
Técnicas de imagenTodos los pacientes con sospecha de CBNM precisan técnicas de imagen para estadificar el tumor y planificar el tratamiento.
La TC con contraste es esencial para caracterizar el tumor primario, pero normalmente se requieren pruebas adicionales para planificar la toma de muestras histológicas, confirmar el diagnóstico y estadificar la enfermedad. En general, se tomarán muestras de aquellas lesiones supuestamente metastásicas que marcarán el estadio más avanzado y proporcionarán información adicional para la estadificación24. La excepción la representan los pacientes con una lesión primaria pequeña, bien definida, periférica y sin evidencia mediante técnicas no invasivas de enfermedad ganglionar o a distancia, que pueden recibir cirugía precoz sin muestras histológicas. Por tanto, el diagnóstico y la estadificación se confirman tras la cirugía, eludiendo la posibilidad de falsos negativos en la estadificación clínico-patológica17,22.
Radiografía de tóraxAunque las radiografías seriadas a las que se someten los pacientes con CBNM pueden ser el primer indicador de aparición de nuevas lesiones o crecimiento de las preexistentes, la TC ha desplazado a la radiografía en la estadificación y seguimiento de los nódulos pulmonares, pues permite una mejor valoración su densidad, márgenes, tamaño, volumen y tiempo de duplicación6,17. El tiempo de duplicación de las lesiones malignas oscila entre 30-480 días, pero existen amplios márgenes de error en la medición de lesiones de pequeño tamaño y se refiere a la duplicación de volumen, no de diámetro (así, duplicación de volumen de nódulos de 1, 2 y 3cm implica incrementos de diámetro de 2,6; 5,2 y 7,8mm respectivamente). Además, el hasta ahora llamado carcinoma bronquioloalveolar —como se comentó previamente—23 y el tumor carcinoide pueden presentar tiempos de duplicación lentos, que pueden sobrepasar los dos años, lo que implica un desafío a la clásica afirmación de que la estabilidad radiológica de una lesión durante dos años sugiere benignidad25-27.
Tomografia computarizadaNumerosas citas bibliográficas y guías clínicas recomiendan que los pacientes con sospecha de CBNM sean estudiados con TC con contraste del toráx y el abdomen superior que incluya al hígado y a las suprarrenales2,6,17,22. Se recomienda que la exploración no tenga más de 4 semanas en el momento de iniciar el tratamiento, y que incluya la región cervical inferior (desde las cuerdas vocales) para valorar la estación ganglionar 122,28 (fig. 1).
Gracias a la reducción de los tiempos de exploración, los equipos de TC-multidetector (TCMD) son capaces de detectar más nódulos, debido a la disminución de artefactos por movimiento respiratorio y volumen parcial. Además, permiten realizar un análisis densitométrico y volumétrico, y reconstrucciones multiplanares y tridimensionales con resolución espacial prácticamente isotrópica25.
La TC es generalmente suficiente para caracterizar los descriptores T relacionados con el tamaño tumoral. No obstante, presenta ciertas limitaciones: a) solo puede estimar la extensión proximal de un tumor endobronquial (que se confirma mediante broncoscopia), b) visualiza con dificultad los verdaderos límites del tumor cuando existe una atelectasia obstructiva asociada (la PET-TC es superior en este aspecto, fig. 5)18,29,30, y c) diferencia con dificultad entre invasión pleuropericárdica o de la pared torácica y contigüidad anatómica o la reacción desmoplásica. Su valor predictivo positivo aumenta si la invasión es importante (derrame con engrosamientos nodulares o masas con clara disrupción de planos grasos). Así, una evidencia equívoca de invasión requiere de técnicas complementarias2,7,22,31. La PET puede ayudar en el diagnóstico de la afectación pleuropericárdica, aunque establecer la organodependencia de los depósitos anómalos del trazador es en ocasiones difícil. Por ello, la PET-TC es superior a la PET y la TC por separado, aunque la toracocentesis sigue siendo esencial en la confirmación diagnóstica del derrame maligno7,18.
Aunque la TC es muy sensible para valorar los nódulos separados, es poco específica, pues pueden existir nódulos pulmonares no metastásicos en pacientes con CBNM (infecciones granulomatosas, Wegener, amiloidosis, nódulos reumatoideos, etc.)31.
En cuanto al descriptor N, se consideran patológicos en la TC aquellos ganglios cuyo eje corto sea ≥10mm, independientemente de su localización. Sin embargo, el empleo de este umbral presenta ciertas limitaciones6,7,17,18, pues hasta un 21% de las metástasis ocurren en ganglios <10mm, y hasta un 40% de los ganglios >10mm son benignos/hiperplásicos17,21,30,31. La PET-TC tiene aquí un gran papel, como se discutirá posteriormente (fig. 7).
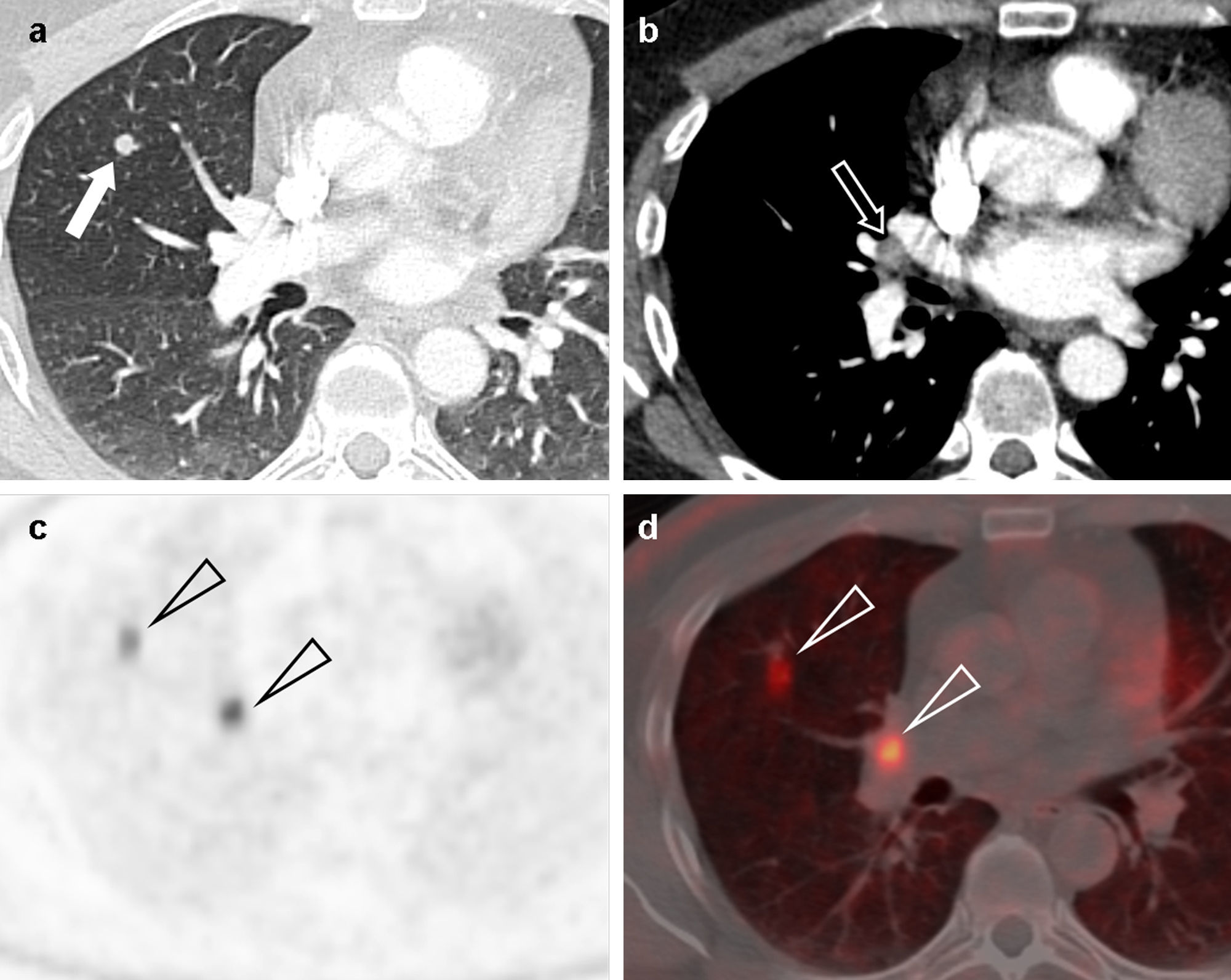
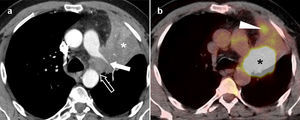
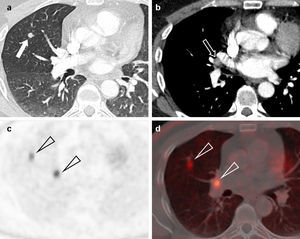
Adenocarcinoma de pulmón en un paciente de 45 años. (a) Imagen axial de tomografía computarizada multidetector (TCMD) torácica con contraste, ventana de pulmón, en la que se apreciaba un nódulo pulmonar solitario (flecha) bien delimitado en el lóbulo superior derecho de 7,2mm de eje mayor. (b) En la imagen axial de TCMD con ventana de mediastino no se observaron adenopatías, solo un ganglio aislado hiliar derecho de 8,3mm de eje corto (flecha). Por sus características, cumplía criterios para ser clasificado como un tumor cT1aN0M0 (estadio IA). Se realizó PET-TC. La imagen PET (c) mostraba dos depósitos patológicos (cabezas de flecha), con escasa resolución espacial. La fusión de imágenes PET-TC (d) permite una mejor caracterización de los hallazgos, y confirmó que los depósitos correspondían al nódulo y al ganglio visualizados en la TCMD (cabezas de flecha). Por tanto, este tumor se estadificó como cT1aN1M0 (estadio IIA).
Con respecto a las metástasis, la presencia de síntomas o signos en la evaluación inicial de los pacientes con CBMN se asocia hasta en un 50% con hallazgos de imagen patológicos17. La TC es capaz de valorar la presencia de metástasis cerebrales, hepáticas y suprarrenales. Su papel, comparado con otras técnicas, se discutirá posteriormente. También es útil en la detección de lesiones óseas líticas o esclerosas, aunque en ocasiones se precisa un estudio adicional con técnicas de medicina nuclear. La evaluación de los nódulos separados, implantes pleurales y derrame pleuro-pericárdico (estadio M1a) ya fue comentada.
En cualquier caso, la afectación ganglionar o metastásica a distancia debe ser confirmada histológicamente para una correcta estadificación tumoral.
Tomografìa por emisión de positronesLa PET de cuerpo entero aporta información metabólica mediante la inyección de un radiotrazador ligado a un análogo de la D-glucosa (18F-FDG,18-fluoro-2-desoxi-D-glucosa)30. La PET mide la captación de FDG en una lesión, reflejando su consumo glicídico, que se correlaciona con la vascularización tisular, la celularidad y la capacidad proliferativa. El resultado se expresa de manera cualitativa (considera malignas a aquellas lesiones con hipermetabolismo superior al del mediastino mediante inspección visual) o semicuantitativa, expresada en forma de valores de captación estandarizados (Standardized Uptake Value, [SUV])17,18. El SUV es un parámetro pronóstico independiente del estadio clínico y del tamaño (las lesiones más activas presentan SUV mayores, y valores≥7 se asocian a tumores con peor pronóstico)32. Aunque no existen criterios cuantitativos estandarizados, se acepta que valores de SUV>2,5 indican malignidad en el nódulo pulmonar solitario17,18, aunque el análisis visual puede ser más sensible en lesiones<1,5cm.
Aunque la IASLC no pudo evaluar el rol de la PET en la estadificación tumoral, el empleo de la PET/PET-TC es hoy una realidad más accesible, como se indicó previamente.
La PET carece de resolución espacial como para asignar al tumor una categoría T6,17,30, pero aporta evidencia adicional de malignidad en los tumores ≥1cm30,33, con valores de sensibilidad y especificidad del 97 y 79% respectivamente, y mayor exactitud diagnóstica que la TC30,33,34.
Sin embargo, sus mayores aportaciones son: a) valorar la extensión intra y extratorácica de la enfermedad, con importantes implicaciones terapéuticas35, y b) evitar procedimientos invasivos innecesarios (existe evidencia de que su uso disminuye las toracotomías innecesarias)11,21,36-38.
La PET es capaz de identificar metástasis ganglionares incluso en ganglios de tamaño normal, superando una de las mayores limitaciones de la TC (fig. 7), con sensibilidad, especificidad, y valores predictivos positivo y negativo superiores a los de ésta2,6,7,17,18,33,35,39,40.
Además, es más sensible que la TC para detectar metástasis en los lugares más frecuentemente afectados, salvo en el cerebro (debido al elevado consumo metabólico del tejido cerebral)6,7,30. Algunas series han descrito que la PET de cuerpo entero detecta metástasis que modifican el descriptor M hasta en un 14-50% de los pacientes2,17,30,36,41,42.
Con respecto a las metástasis hepáticas, la PET reduce los posibles falsos positivos detectados por TC2 y confirma los hallazgos dudosos, aunque las lesiones subcentimétricas pueden ser causa de falsos negativos21.
Su rendimiento para detectar las metástasis suprarrenales es elevado, especialmente si la apariencia en la TC y la RM no es concluyente. Un depósito anómalo del trazador es sugestivo de malignidad con sensibilidad del 100% y especificidad del 80-90%2,17,18,21,43.
Ya se indicó que puede ayudar a caracterizar implantes pleurales, aunque por su resolución anatómica limitada, es inferior a la PET-TC18.
La PET/PET-TC ha desplazado a la gammagrafía ósea en la valoración de metástasis óseas, pues aunque presentan valores de sensibilidad comparables7,30, la primera presenta mayor especificidad y detecta metástasis a distancia en un mismo acto diagnóstico, incluso en pacientes asintomáticos. Es cierto que el CBNM produce lesiones osteolíticas (con o sin masa de partes blandas) con mayor frecuencia que osteoblásticas, pero la gammagrafía presenta menor probabilidad de falsos negativos para las lesiones osteoblásticas, pudiendo tener un papel complementario2,7,30,42,44.
Globalmente, la PET presenta un alto valor predictivo negativo33,45 (excluye malignidad correctamente), pero un bajo valor predictivo positivo, lo que implica falsos positivos con cierta frecuencia ante procesos inflamatorios/infecciosos7,17,18,21,30,33,46. Generalmente, la captación en estos casos será inferior que en procesos malignos, pero en algunos casos de granulomatosis o infecciones agudas, la captación puede ser intensa. Por tanto, hallazgos sugestivos por PET de afectación ganglionar o a distancia precisan confirmación histológica para eludir la posibilidad de sobreestadificación, mientras que dado su elevado valor predictivo negativo, se puede prescindir de ella cuando las exploraciones son negativas7,17. Aunque menos frecuentes, existen falsos negativos en tumores con baja actividad metabólica (el hasta ahora carcinoma bronquioloalvelolar, los tumores carcinoides, los adenocarcinomas bien diferenciados, y, en ocasiones, las metástasis del carcinoma renal, prostático y testicular), lesiones <10mm (se precisa una masa crítica de células malignas activas para su detección), e y la hiperglucemia no controlada (la captación de FDG estará retardada por su interacción antagonista con la glucosa para ligarse al receptor de membrana)7,17,18,30,35,47.
Tomografía por emisión de positrones-tomografía computarizadaEsta técnica fusiona la información aportada por la PET y la TC (metabólica y anatómica), y ha desplazado a la PET aislada. Constituye una alternativa aceptable a la realización de una TC inicial seguida de PET de cuerpo entero en un paciente con diagnóstico reciente o sospecha de CBNM18,39.
Su resolución espacial permite valorar las categorías del descriptor T, diferenciar lesiones malignas de benignas y caracterizar nódulos pulmonares solitarios en pacientes oncológicos, con una sensibilidad, especificidad y valores predictivos positivo y negativo mayores que la PET o la TC por separado35,48-50. Recordemos que el SUV puede subestimarse en lesiones pequeñas, por lo que su corrección en función del tamaño mediante TC puede mejorar la seguridad diagnóstica.
La PET-TC es útil para a) valorar correctamente la T en el tumor con pulmón consolidado o colapsado distalmente, pues diferencia masa tumoral con depósito anómalo del radiotrazador de atelectasia o neumonitis (fig. 5)30,50; b) valorar los nódulos separados; c) estudiar la posible afectación pleural (focos hipermetabólicos en una pleura engrosada o nodular indican malignidad), y d) determinar el lugar adecuado para tomar muestras histológicas (zonas de mayor hipermetabolismo). Además, puede utilizarse como parte del protocolo de planificación del tratamiento radioterápico.
Con respecto a la estadificación ganglionar, presenta una elevada sensibilidad (98%, mayor que la estimada para la TC y la PET aisladamente) y un alto valor predictivo negativo (98%). Sin embargo, también presenta falsos positivos con cierta frecuencia (bajo valor predictivo positivo), con posibilidad de sobreestadificación, como se comentó anteriormente2,7,50. Aunque la mediastinoscopia es la prueba de referencia, la PET-TC es el método no invasivo más apropiado para la estadificación ganglionar18, pues permite diferenciar adenopatías o ganglios mediastínicos de estructuras vasculares en la imagen TC aislada, ayuda a distinguir entre adenopatías y afectación ganglionar granulomatosa o con un SUV subestimado mediante PET aislado, y permite valorar fácilmente las captaciones fisiológicas de la grasa parda.
En cuanto a la diseminación a distancia, la PET-TC detecta metástasis extratorácicas con una sensibilidad, especificidad y valores predictivos positivo y negativo superiores a los obtenidos con PET y TC por separado51.
Aunque la PET-TC contribuye a una estadificación clínico-diagnóstica más exacta y evita toracotomías innecesarias, puede sobreestadificar (falsos positivos) el tumor con respecto a la TC y, con ello, impedir que se lleve a cabo una intervención quirúrgica indicada. De ahí la importancia de confirmar histológicamente los hallazgos sospechosos6,11,30,37-39,42. Los falsos negativos son los ya descritos en el apartado de PET48. Por su baja tasa de falsos negativos, los pacientes con TC y PET/PET-TC sin evidencia de afectación ganglionar o metástasis a distancia no precisan estudios adicionales. Sin embargo, la necesidad de un estudio histológico tiene que individualizarse para cada paciente. Si la presencia de depósitos tumorales pudiera alterar la decisión terapéutica, y en función del flujo de trabajo de cada institución, puede realizarse intraoperatoriamente en pacientes seleccionados, o mediante toracotomía de confirmación, antes de la cirugía2.
Resonancia magnéticaSu papel en la estadificación local del CBNM está limitado por la pérdida de señal secundaria a los movimientos respiratorios y la heterogeneidad del campo magnético creada por las interfases tejido/aire31,52. Se reserva para casos con sospecha de irresecabilidad y hallazgos no concluyentes en la TC, y para los pacientes con contraindicaciones para el empleo de contrastes yodados2,31,53, por la mejor tolerancia del contraste paramagnético.
Se utilizado para estadificar los ganglios mediastínicos (fundamentalmente las adenopatías subcarinales y aortopulmonares), aunque presenta valores globales de sensibilidad y especificidad semejantes a los de la TC31,54. El empleo de gadolinio parece mejorar la exactitud diagnóstica40. Existen líneas de investigación que están estudiando la utilidad de la secuencia potenciada en difusión y el mapa de coeficiente de difusión aparente (ADC) en la estadificación ganglionar (con elevado valor predictivo negativo)54,55, para diferenciar entre tumor y atelectasia postobstructiva56, y diferenciar nódulos pulmonares benignos de malignos sin diferencias aparentes con respecto al SUV, aunque éste se correlacione mejor con el grado de actividad tumoral32,57. Otros estudios están analizando el rol de la RM de perfusión en la caracterización de los nódulos pulmonares57.
Sin embargo, la RM con contraste es de indudable ayuda para caracterizar las metástasis hepáticas6 gracias a los estudios dinámicos y los mapas de ADC. Además, es la técnica de elección para valorar metástasis cerebrales en pacientes con síntomas o signos neurológicos2,31 pues detecta más lesiones y más pequeñas que la RM sin contraste o la TC sin/con contraste. La TC con contraste es una alternativa razonable cuando no hay disponibilidad de RM, ya que no supone diferencias en la supervivencia17. Los pacientes asintomáticos no la precisan salvo que existan otros criterios clínicos para sospecharlas (enfermedad local extensa, afectación ganglionar u otras metástasis a distancia, fundamentalmente en pacientes candidatos a tratamiento radical)2,17. Así, una TC con contraste negativa debe seguirse de RM con contraste si existe una alta sospecha clínica de afectación del SNC.
La RM también ayuda a diferenciar los adenomas suprarrenales de las metástasis. Los primeros pierden señal en las secuencia de eco de gradiente en fase opuesta (y densidad baja en TC), por su contenido graso intracelular31. Hallazgos sugestivos de afectación metastásica son un tamaño >3cm, los márgenes mal delimitados, un realce en anillo irregular, y la hiperseñal en las secuencias potenciadas en T22 (fig. 8). La PET y la PET-TC son también útiles ya que un depósito anómalo del trazador indica malignidad con una alta sensibilidad y especificidad.
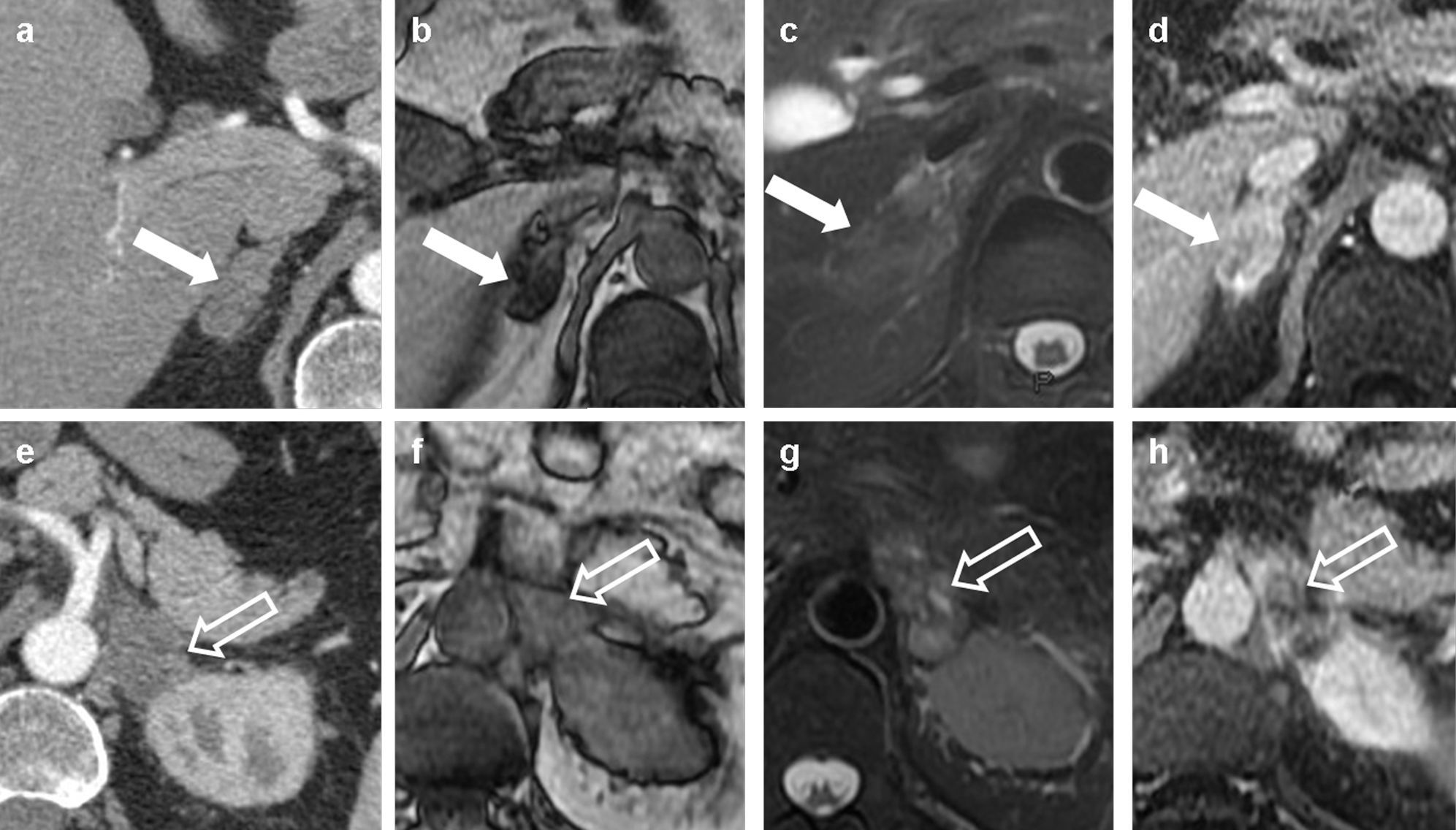
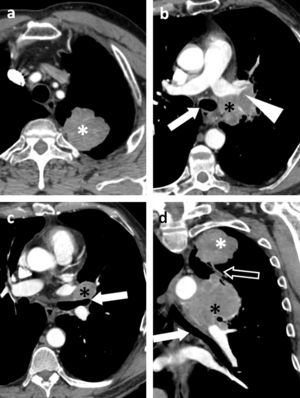
Carcinoma epidermoide (no mostrado) en el lóbulo superior derecho en un paciente de 67 años. a) En la imagen axial de tomografía computarizada multidetector (TCMD) se observaba un engrosamiento nodular de la glándula suprarrenal derecha (flecha sólida), que perdía señal en la secuencia de eco de gradiente en fase opuesta (b), sin hiperseñal en la secuencia T2 con supresión grasa (c), y se realzaba homogéneamente tras la inyección de gadolinio (d). Las características de la lesión la hacían compatible con un adenoma. Por otro lado, la glándula suprarrenal izquierda estaba engrosada de manera irregular (flecha hueca) en la TCMD (e), no perdía señal en fase opuesta (f), pero sí hiperseñal en T2 (g), y mostraba un realce periférico e irregular. La PET-TC y una PAAF confirmaron que se trataba de una metástasis (no mostrado).
La RM es capaz de valorar la infiltración de la médula ósea en pacientes sintomáticos o con alteraciones analíticas sospechosas, como técnica complementaria a la TC.
Además, la RM es muy útil para valorar las lesiones que afectan a los vértices pulmonares y plexo braquial, diafragma, canal raquídeo (masas paraespinales), invasión mediastínica, vascular (fig. 9), pleural y de la pared torácica (figs. 4)2,6,17,31. Aunque los equipos de TC multidetector han acortado distancias con la RM, ésta última es igual o superior a la TC en los casos mencionados, pues sigue aportando mejor contraste entre tejido normal y patológico. Sin embargo, aunque ambas pueden detectar la invasión extensa de estas estructuras, existen limitaciones para diferenciar entre invasión real y contigüidad anatómica o reacción desmoplásica2,31.
Adenocarcinoma de pulmón en un paciente de 64 años. En la imagen axial de tomografía computarizada multidetector con contraste intravenoso y ventana de mediastino (a) se apreciaba una masa paravertebral en el lóbulo inferior izquierdo que englobaba el bronquio del segmento VI (asterisco), la arteria pulmonar lobar inferior izquierda y las venas pulmonares izquierdas (no mostrado), sin plano graso de separación con la aorta descendente y el cuerpo vertebral D6, y adenopatías subcarinales e hiliares izquierdas (flechas). La imagen fusionada PET-TC (b) confirmó el hipermetabolismo de estas lesiones, sin otras alteraciones. Se realizó una RM torácica para caracterizar mejor la afectación aórtica y vertebral. En la imagen axial T1 con contraste y supresión grasa (c) se apreciaba la invasión de la grasa paravertebral izquierda, con tractos espiculados hipercapatantes que contactaban con la cortical ósea de la vértebra D6 (flechas), así como la ausencia del plano graso de separación entre la masa y la pared posterolateral izquierda de la aorta torácica descendente (cabeza de flecha blanca), con mejor resolución espacial que la TC. Estos signos se interpretaron como una invasión por contigüidad y el tumor se estadificó como cT4N2M0 (estadio IIIB). Durante el seguimiento, se produjo la invasión del cuerpo vertebral y del canal raquídeo.
La TNM-7 para el cáncer de pulmón es la primera clasificación basada en datos realmente internacionales. Concede mayor importancia al tamaño tumoral, establece mejor el pronóstico del paciente, y tendrá impacto en los nuevos ensayos clínicos sobre tratamiento adyuvante y sus indicaciones. Esta clasificación se ha revisado e ilustrado para facilitar la familiarización del radiólogo con esta herramienta en la práctica clínica diaria. Además, hemos destacado la utilidad concreta de cada modalidad de imagen, resaltando su papel complementario.
Autoría- 1.
Responsable de la integridad del estudio: Raquel Cano Alonso.
- 2.
Concepción del estudio: Raquel Cano Alonso y Luis Herráiz Hidalgo.
- 3.
Diseño del estudio: Raquel Cano Alonso, Luis Herráiz Hidalgo y Elena Álvarez Moreno.
- 4.
Obtención de los datos: Raquel Cano Alonso, Luis Herráiz Hidalgo y Elena Álvarez Moreno.
- 5.
Análisis e interpretación de los datos: Raquel Cano Alonso, Luis Herráiz Hidalgo y Elena Álvarez Moreno
- 6.
Tratamiento estadístico: No procede.
- 7.
Búsqueda bibliográfica: Raquel Cano Alonso, Luis Herráiz Hidalgo y Elena Álvarez Moreno.
- 8.
Redacción del trabajo: Raquel Cano Alonso, Luis Herráiz Hidalgo, Elena Álvarez Moreno y Cándida Paniagua Correa.
- 9.
Revisión crítica del manuscrito con aportaciones intelectualmente relevantes: Cándida Paniagua Correa y Vicente Martínez de Vega.
- 10.
Aprobación de la versión final: Raquel Cano Alonso, Luis Herráiz Hidalgo, Elena Álvarez Moreno, Cándida Paniagua Correa y Vicente Martínez de Vega.
Los autores declaran no tener ningún conflicto de intereses.