La pancreatitis crónica es un proceso fibroinflamatorio progresivo del páncreas que produce un daño estructural permanente y condiciona un deterioro de la función exocrina y endocrina. La aparición de brotes de pancreatitis aguda, seudoquistes y masas inflamatorias forman parte de la historia de la enfermedad. Otras complicaciones son vasculares, digestivas o el riesgo aumentado de adenocarcinoma pancreático. Por todo ello, se requiere de pruebas diagnósticas capaces de detectarla, especialmente en las etapas iniciales de la enfermedad. Se propone un algoritmo diagnóstico que debe progresar desde técnicas no invasivas a procedimientos invasivos. La tomografía computarizada descarta otras causas de dolor abdominal e identifica complicaciones de la pancreatitis. La colangiografía por resonancia magnética puede ser la prueba de elección, ya que permite la evaluación de los cambios ductales y posiblemente evita la necesidad de una colangiopancreatografía retrógrada endoscópica. Cuando las pruebas de imagen son normales y persiste la sospecha clínica, deben considerarse las pruebas de función pancreática o una ecoendoscopia.
Chronic pancreatitis is a progressive fibroinflammatory process in the pancreas that causes permanent structural damage and leads to a deterioration in exocrine and endocrine function. The appearance of flares of acute pancreatitis, pseudocysts, and inflammatory masses all form part of the natural history of this disease. Vascular and / or digestive complications may occur, and patients with chronic pancreatitis have an increased risk of pancreatic adenocarcinoma. For all these reasons, diagnostic tests that can detect chronic pancreatitis are necessary, especially in the early stages of the disease. We propose a diagnostic algorithm that should progress from noninvasive techniques to invasive procedures. Computed tomography can rule out other causes of abdominal pain and identify complications of pancreatitis. Magnetic resonance cholangiography can be the method of choice because it enables changes in the ducts to be assessed and might obviate the need for endoscopic retrograde cholangiopancreatography. When the findings on imaging tests are normal but clinical suspicion persists, pancreatic function tests or endoscopic ultrasound should be considered.
La pancreatitis crónica (PC) es un proceso fibroinflamatorio progresivo del páncreas que produce un daño estructural permanente en respuesta a unos factores de riesgo y puede dar lugar a atrofia glandular, fibrosis, distorsión ductal, cicatrices, calcificaciones, disfunción pancreática exocrina o endocrina y displasia1.
Es una enfermedad grave que tiene un impacto considerable en la calidad de vida de los pacientes2. La incidencia en países europeos es de 5 a 10 casos por cada 100.000 habitantes, con una mediana de supervivencia de 20 años desde el comienzo de la enfermedad3,4.
El factor de riesgo más frecuente de PC es el consumo excesivo de alcohol. El tabaco es un factor de riesgo independiente. Existen factores genéticos que también contribuyen al desarrollo de PC. Otras etiologías incluyen hiperlipidemia, hiperparatiroidismo, autoinmune, traumatismos y el páncreas divisum (asociado a otros factores de riesgo). La obstrucción postraumática debido a estenosis ductales o cambios estructurales en el conducto pancreático también se han propuesto como posibles etiologías. Entre el 30% y el 40% de los pacientes con PC carecen de causa subyacente conocida y se consideran como “idiopáticas”5. El curso de la enfermedad varía considerablemente entre las diferentes etiologías; por ejemplo, estudios epidemiológicos han demostrado que el desarrollo de insuficiencia pancreática es más rápido en pacientes alcohólicos en comparación con otras etiologías. Por otra parte, en pacientes con PC de inicio temprano, especialmente de causa genética, aumenta el riesgo de cáncer de páncreas considerablemente4. Los principales sistemas de clasificación etiológica para ayudar a evaluar los factores de riesgo en el desarrollo de PC son: TIGAR-O y M-ANNHEIM (tabla 1) y son importantes para estructurar las directrices del diagnóstico y las estrategias terapéuticas6,7.
Clasificaciones etiológicas y de factores de riesgo para pancreatitis crónica6,7
| Tradicional |
| Alcohol, idiopática, hereditaria, obstructiva, hiperlipidémica |
| TIGAR-O |
| Tóxico-metabólica: alcohol, tabaco, hipercalcemia, fallo renal crónico, fármacos, toxinas |
| Idiopática: inicio precoz, inicio tardío, tropical |
| Mutaciones Genéticas: PRSS1, CFTR, SPINK1, otras |
| Autoinmunitaria: aislada, sindrómica |
| Pancreatitis crónica Recurrente o asociada a pancreatitis aguda grave: posnecrótica, vascular, isquémica, posradiación |
| Obstructiva: páncreas divisum, trastornos del esfínter de Oddi, obstrucción ductal (tumores), cicatriz ductal postraumática |
| M-ANNHEIM |
| M-factores de riesgo múltiples que incluyen: |
| Consumo de Alcohol: excesivo (>80g/d), aumentado (20-80g/d), moderado (<20g/d) |
| Consumo de Nicotina |
| Factores Nutricionales: alta proporción calórica de grasas y proteínas, hiperlipidemia |
| Factores Hereditarios: hereditarios, familiares, idiopáticos (inicio precoz o tardío), tropical |
| Factores ductales Eferentes: páncreas divisum, páncreas anular u otras anomalías congénitas del páncreas, obstrucción ductal pancreática (tumores), cicatriz ductal postraumática, disfunción del esfínter de Oddi |
| Factores Inmunológicos: pancreatitis autoinmunitaria |
| Miscelánea y enfermedades metabólicas raras: hipercalcemia, hiperparatiroidismo, fallo renal crónico, fármacos, toxinas |
Clasificación etiológica de la pancretitis crónica.
El cuadro clínico viene dado por la respuesta inflamatoria a una agresión al parénquima pancreático que inicialmente da lugar a pancreatitis aguda y puede perpetuarse, por respuesta inflamatoria anómala, con fibrosis, daño estructural y funcional (pancreatitis crónica) y condicionar finalmente neoplasia8. En fases iniciales, la PC no suele ser clínicamente reconocible. La progresión hacia PC establecida y estadios finales condiciona cambios irreversibles con pérdida gradual de las funciones exocrina y endocrina. Los signos y síntomas más frecuentes son esteatorrea, dolor abdominal y diabetes9. El síntoma predominante es el dolor abdominal intenso y recurrente que puede suponer un manejo médico difícil y ser resistente a la mayoría de los tratamientos médicos convencionales y endoscópicos, requiriendo en numerosos casos la necesidad de narcóticos.
En la historia natural de la enfermedad pueden aparecer complicaciones como desnutrición, seudoquistes, masas inflamatorias y, menos frecuentemente, trombosis venosa, seudoaneurismas, hemorragias, estenosis biliares e intestinales, así como adenocarcinoma ductal pancreático, por lo que todos los pacientes con diagnóstico de PC requieren un seguimiento clínico y analítico periódico10. Todo esto hace necesario disponer de pruebas diagnósticas capaces de detectar la PC.
DiagnósticoNo existe consenso respecto al diagnóstico de inicio de la PC, que se basa generalmente en una combinación de clínica, prueba de función pancreática y cambios morfológicos en técnicas de imagen11.
Un número no despreciable de pacientes, sin embargo, puede permanecer asintomático o mostrar síntomas muy leves hasta que aparecen las complicaciones. Layer et al. presentan una serie, en la que el 20% de los pacientes con PC tuvieron disfunción pancreática exocrina o endocrina en ausencia de dolor12. Estos datos concuerdan con otro estudio en el que había evidencia histológica de PC en autopsias de pacientes con alcoholismo, sin diagnóstico previo de la enfermedad13. Por otra parte, la deficiencia clínicamente significativa de proteínas y grasas (esteatorrea y creatorrea) no ocurre hasta que se pierde más del 90% de la función pancreática14.
Para el diagnóstico histológico de PC se requiere la presencia de fibrosis parenquimatosa, atrofia acinar junto a un componente variable de infiltrado inflamatorio crónico con distorsión ductal y calcificación intraductal. Sin embargo, existen hallazgos incidentales relacionados con la edad o secundarios al consumo de alcohol o tabaco que pueden simular una PC15. Por otra parte, la realización de una punción puede ser dificultosa por la localización retroperitoneal del páncreas y asociar complicaciones, lo que unido a que la distribución de la enfermedad no es uniforme puede limitar el valor diagnóstico de la biopsia. Todo ello implica que en términos generales no se recomiende la biopsia en el diagnóstico de inicio de una PC15,16.
La demostración de insuficiencia exocrina es signo patognomónico de la enfermedad, pero suele identificarse en estadios avanzados17. Las pruebas de función pancreática (PFP) se clasifican típicamente como indirectas (no invasivas) o directas (invasivas). Las PFP indirectas evalúan la función exocrina pancreática sin estimulación hormonal directa de la glándula, e incluyen la medición del tripsinógeno sérico, la elastasa fecal y mediciones de grasa fecal. Las PFP directas se basan en la medición directa de enzimas pancreáticas y salida de bicarbonato obtenidas tras la estimulación con secretina y colecistoquinina intravenosa o ceruleína (test de la secretina-colecistoquinina o secretina-ceruleína) y muestran sensibilidad y especificidad para el diagnóstico de PC superiores al 90% (teniendo en cuenta la limitación de no disponer de un estándar de referencia adecuado en la mayor parte de estudios). La estimulación única con secretina intravenosa (test de la secretina) se usa en los llamados tests endoscópicos, basados únicamente en la concentración de bicarbonato. En la práctica habitual, las PFP se limitan a la determinación de elastasa fecal (que ofrece baja sensibilidad), ya que en muy pocos centros se utilizan otras pruebas de función más sensibles, pues resultan invasivas, caras y de escasa disponibilidad. Actualmente, se reservan para aquellos casos donde los hallazgos morfológicos en técnicas de imagen no son concluyentes de PC18.
Estudios de imagen en el diagnóstico de la pancreatitis crónicaExisten múltiples técnicas de imagen que permiten llegar al diagnóstico de PC, tales como la tomografía computarizada (TC), resonancia magnética (RM), ecoendoscopia (EE), ecografía abdominal o colangiopacreatografía retrógrada endoscópica (CPRE).
Según una revisión sistemática reciente de la bibliografía11, los resultados para la EE, CPRE, colangiopancreatografía por resonancia magnética (CPRM), TC y ecografía en el diagnóstico inicial de la PC fueron una sensibilidad estimada de 81%, 82%, 78%, 75% y 67%, y una especificidad estimada de 90%, 94%, 96%, 91% y 98%, respectivamente. La EE, la CPRE, la TC y la RM son comparables por su alta precisión, y la ecografía abdominal es la de menor precisión.
Colangiografía retrógrada endoscópica. La CPRE ha sido tradicionalmente la prueba de elección en el diagnóstico de PC cuando las calcificaciones pancreáticas no están presentes en los estudios de imagen y no hay evidencia de esteatorrea. Sin embargo, con los avances de la RM, muchos centros limitan el uso de la CPRE a aquellos casos con necesidad potencial de intervención terapéutica.
La irregularidad característica del conducto pancreático principal y los conductos secundarios ectásicos es diagnóstico de PC. El sistema de clasificación de Cambridge19 divide a los pacientes en cuatro categorías basadas en cambios ductales en la CPRE: El grado Cambridge I o grado inconcluyente se diferencia del grado II o leve en el número de conductos secundarios alterados (menor o mayor de 3, siendo el conducto pancreático principal morfológicamente normal). El grado Cambridge III o moderado presenta además alteración del conducto pancreático principal. Por último, al grado Cambridge IV o grave se le añade dilatación quística del conducto, defectos de repleción intraductales, dilataciones o irregularidades del conducto, calcificaciones pancreáticas o invasión de órganos contiguos.
Este esquema de clasificación se ha correlacionado con el grado de insuficiencia pancreática. Cuando los conductos pancreáticos son normales, no existe deterioro funcional; sin embargo, cuando aparecen cambios Cambridge II, existen alteraciones funcionales hasta en el 50% de los casos 20. Sin embargo, algunos pacientes con PC precoz tienen un pancreatograma normal. Por lo tanto, a menos que haya habido síntomas de larga evolución (p. ej., más de 4 años), un estudio normal no debería descartar el diagnóstico de PC21. Si se sospecha el trastorno a pesar de una CPRE normal, se deben considerar otros estudios de imagen (por ejemplo, EE) o pruebas de función pancreática, dependiendo de la experiencia individual con estas técnicas.
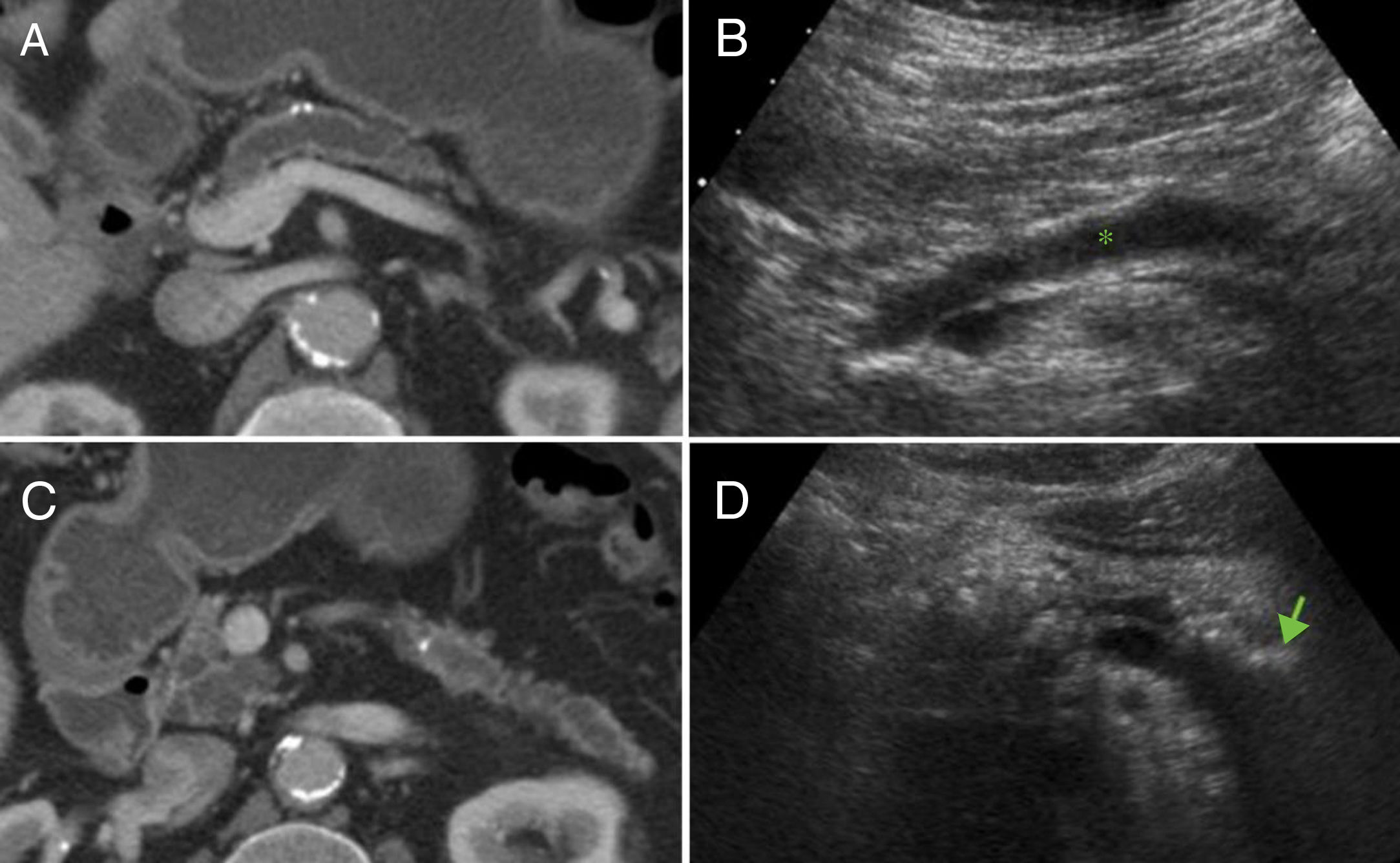
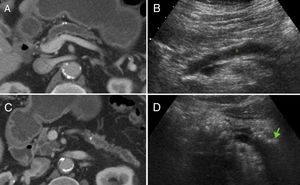
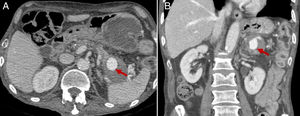
Tomografía computarizada. Los hallazgos clásicos de PC en TC son tres: atrofia glandular, dilatación del conducto pancreático principal y la presencia de calcificaciones pancreáticas16 (fig. 1). La dilatación del conducto pancreático es el hallazgo más frecuentemente encontrado (68%); sin embargo, no es específico de la PC y puede observarse en tumores periampulares o neoplasias papilares intraductales16. La atrofia se observa en el 54% de los pacientes con PC, pero tampoco es un hallazgo sensible ni específico, y se visualiza con frecuencia como hallazgo normal en pacientes ancianos. Las calcificaciones intraductales se estima que aparecen en el 90% de los pacientes durante su evolución y son prácticamente patognomónicas en estudios de TC con contraste en el contexto adecuado, con especificidad cercana al 100%, y moderada sensibilidad, que aumenta en estudios de TC sin contraste22. Estos cambios morfológicos tienen lugar en los estadios finales de la enfermedad, y existen numerosos casos de insuficiencia exocrina grave con una apariencia normal en la TC. Así pues, existe una correlación deficiente entre la morfología pancreática y la deficiencia endocrina y exocrina de la PC.
Hallazgos clásicos de pancreatitis crónica en tomografía computarizada (TC) y ecografía. Se observa atrofia glandular, dilatación del conducto pancreático principal y calcificaciones en TC (A y C). B) La dilatación del conducto pancreático (*) y las calcificaciones (flecha en D) también pueden identificarse en ecografía.
A pesar de no tener una alta sensibilidad en el diagnóstico precoz de PC, la TC se ha convertido en la prueba de imagen inicial en la evaluación diagnóstica de la PC9, pues resulta accesible y es de gran utilidad en la evaluación de las complicaciones relacionadas con la PC (figs. 2 y 3).
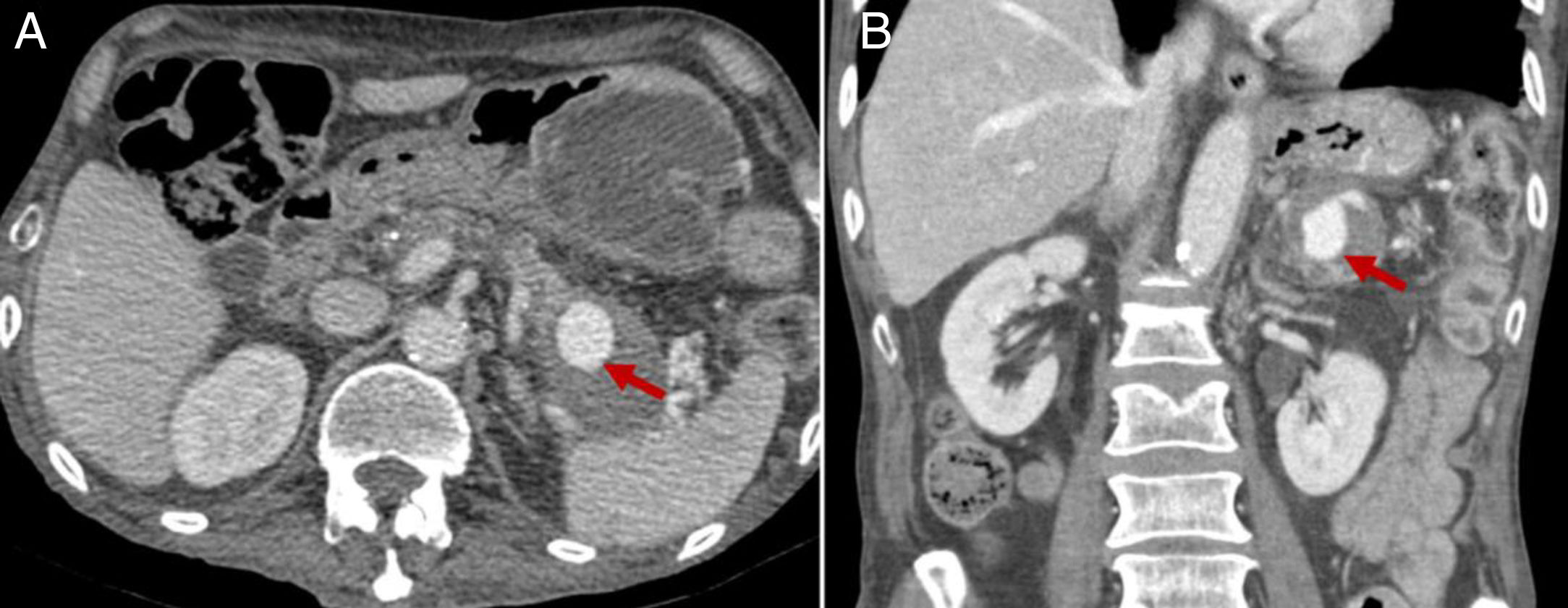
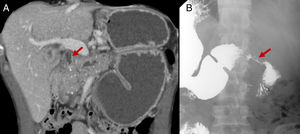
Complicaciones de la pancreatitis crónica: seudoaneurisma en el interior de un seudoquiste pancreático (flechas). Imágenes de tomografía computarizada abdominal en planos transversal (A) y coronal (B) con contraste intravenoso, en fase portal. Obsérvese seudoaneurisma en el interior del seudoquiste (flecha).
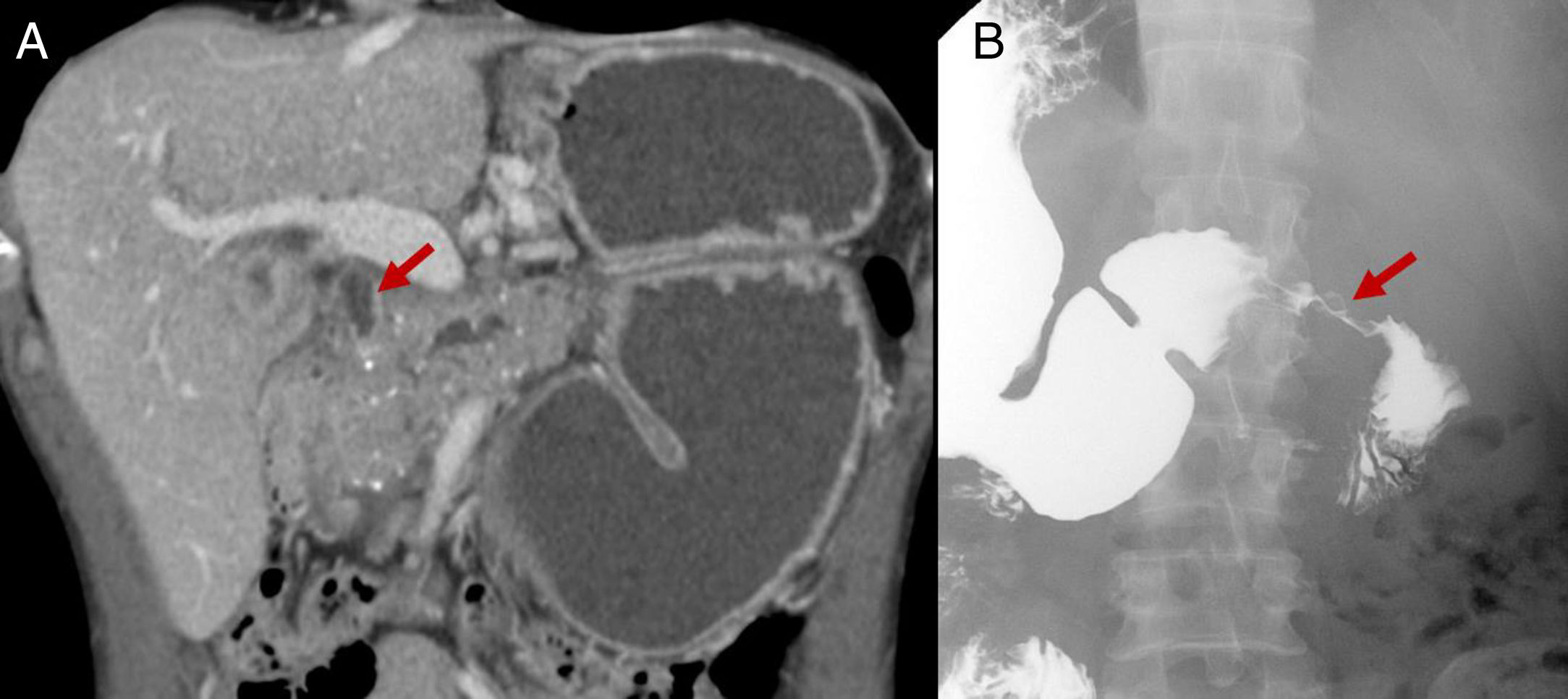
Complicaciones de la pancreatitis crónica (PC): estenosis duodenal y biliar en paciente con PC de origen alcohólico. A) Imagen coronal de tomografía computarizada abdominal con contraste intravenoso donde se aprecian calcificaciones pancreáticas y masa inflamatoria en cabeza pancreática que condiciona estenosis distal del colédoco y estenosis duodenal. Obsérvese la dilatación secundaria del colédoco proximal (flecha) y del estómago. B) Tránsito esofagogástrico-duodenal donde se pone de manifiesto la estenosis duodenal (flecha).
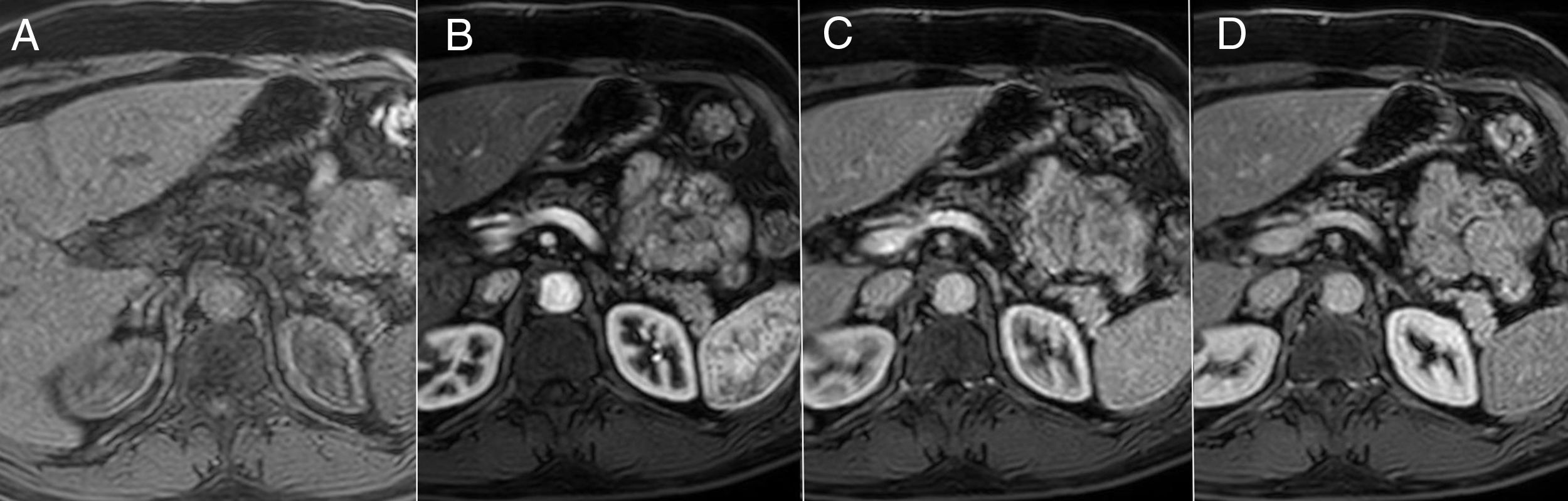
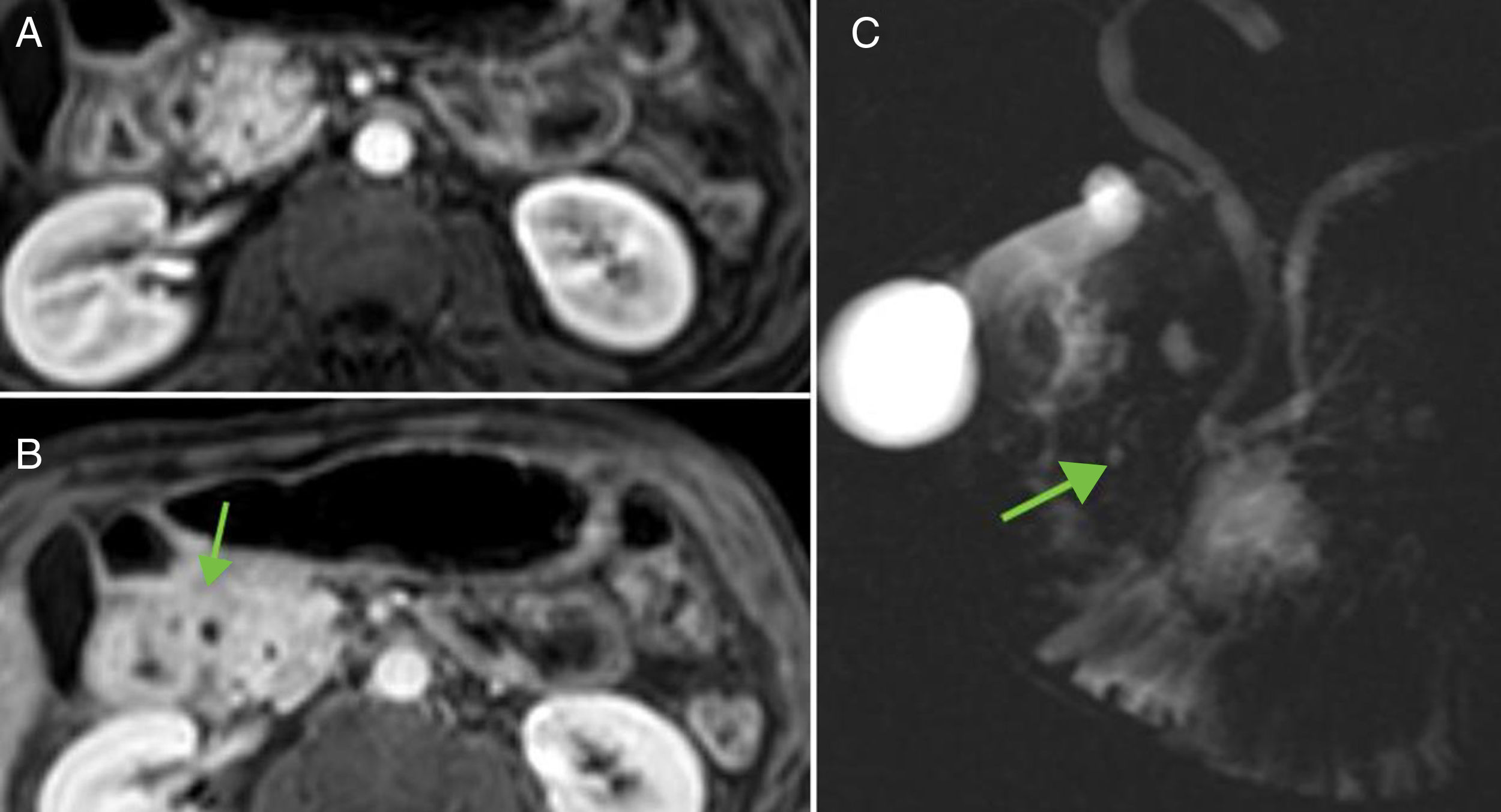
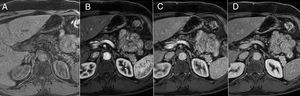
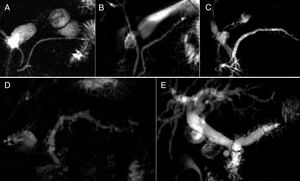
RM, CPRM y CPRM tras administración de secretina (CPRMs). La RM, debido a su excelente contraste tisular, presenta la ventaja, respecto a otras modalidades de imagen, de tener una mayor sensibilidad para detectar cambios más precoces de PC. El páncreas normal en RM debe tener una intensidad de señal ligeramente hiperintensa respecto al hígado en las imágenes potenciadas en T1 con supresión grasa. Tras la administración de contraste intravenoso, en fase arterial tardía, presenta un realce intenso y homogéneo que es hiperintenso respecto al parénquima hepático. En fase portal y tardía lava contraste. Los cambios precoces de PC (fig. 4) consisten en la disminución de la intensidad de señal del páncreas en las imágenes potenciadas en T1 con supresión grasa (condicionada por la disminución de proteínas). Tras la administración de contraste, el realce puede estar disminuido y heterogéneo en fase arterial tardía, y ser progresivo en fases tardías, debido a la disminución de la vascularización de la glándula por inflamación crónica y fibrosis16. Sin embargo, no siempre resulta sencillo valorar estos cambios en la práctica clínica, pues factores técnicos, episodios de pancreatitis aguda y otras situaciones pueden alterar la intensidad de señal del páncreas y crear confusión.
Cambios precoces de la pancreatitis crónica en resonancia magnética. A) Imagen potenciada en T1 con supresión grasa donde se pone de manifiesto pérdida de señal pancreática. B) En fase arterial tardía, realce disminuido y heterogéneo. C y D) Realce progresivo en fases portal y de equilibrio.
La CPRM, además, puede valorar el conducto pancreático de una forma similar a la CPRE con la ventaja de ser una modalidad de imagen no invasiva23. Permite una magnífica visualización del conducto pancreático principal a pesar de ser menos precisa en la valoración de los conductos secundarios24. La presencia de hallazgos morfológicos en los conductos pancreáticos es suficiente para el diagnóstico de PC; sin embargo, la ausencia de estos no lo descarta4,11.
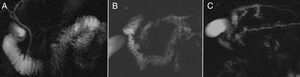
La administración de secretina estimula la secreción de fluidos pancreáticos en el sistema ductal y aumenta el tono del esfínter de Oddi durante los primeros 5 minutos, lo que dificulta la secreción a través la papila de Vater. Ante la ausencia de hallazgos de PC en CPRM, la CPRMs permite valorar de forma más precisa estenosis sutiles de conducto principal y visualizar mejor los conductos secundarios24, por lo que aumenta la sensibilidad en la detección de PC de un 77% a un 89%25,26. También puede ser de utilidad en la valoración semicuantitativa pancreática exocrina basada en la cuantificación del relleno y distensión duodenal27 (fig. 5).
Evaluación pancreática exocrina basada en la cuantificación del relleno y distensión duodenal en colangiopancreatografía por resonancia magnética (CPRM) tras administración de secretina*. A) Páncreas normal con buena reserva exocrina, relleno y distensión de todo el duodeno. Conducto pancreático principal de calibre y morfología normal. B) Cambios morfológicos de pancreatitis crónica (PC) avanzada (dilatación e irregularidad de conducto pancreático principal y de conductos secundarios) con buena reserva exocrina. C) Cambios morfológicos de PC (menos evidentes que en B) con escasa reserva exocrina (se rellena únicamente la primera y segunda porción duodenal).
* La secuencia CPRM tras administración de secretina se realiza administrando oralmente solución de 200ml de agua y 1ml de gadolinio 15 minutos antes de la realización de la secuencia para suprimir la señal del estómago y duodeno. La secretina se inyecta durante 20 segundos, 5ml de vial (24,4mg+10ml de solución). Se realizan 25 imágenes coronales colangiográficas 2D visualizando el conducto pancreático principal en el mayor trayecto posible, el primero sin secretina; posteriormente, se administra secretina en 20 segundos y se inician 20 dinámicos cada 30 segundos, y los 4 últimos cada 60 segundos.
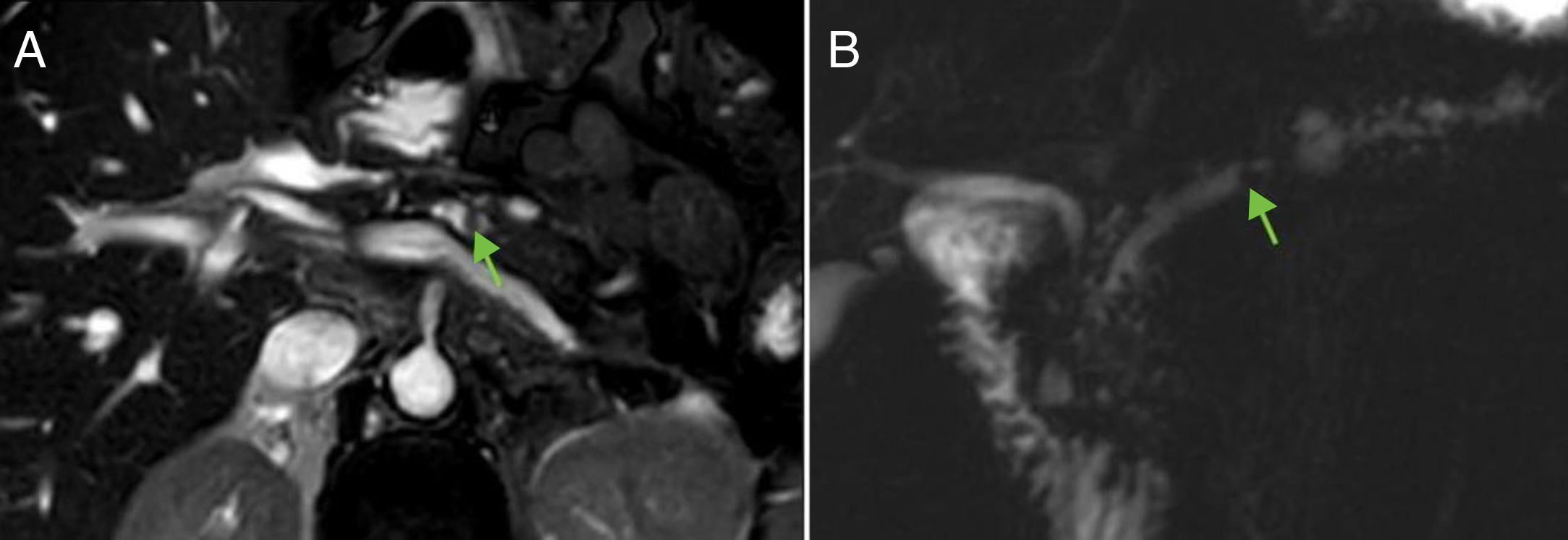
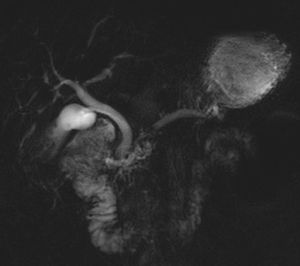
Las calcificaciones pueden identificarse en RM, pero con mucha mayor dificultad que en la TC. Sin embargo, la CPRM define con mayor precisión litiasis intraductales que puedan ocasionar obstrucción. Las litiasis intraductales se observan como vacíos de señal rodeados por secreción pancreática hiperintensa en el interior del conducto (fig. 6).
No existen criterios estandarizados para diagnosticar la PC con el uso de CPRM. Sin embargo, se han propuesto clasificaciones que evalúan los cambios de PC y establecen categorías de normalidad: PC leve, moderada o grave9. También pueden adaptarse los criterios de Cambridge de CPRE28 para clasificar los hallazgos observados en CPRM (fig. 7). Con el uso creciente de CPRMs, se necesita un sistema de clasificación definitivo que evalúe los cambios parenquimatosos y ductales, ya que puede ser de utilidad en el diagnóstico precoz de PC.
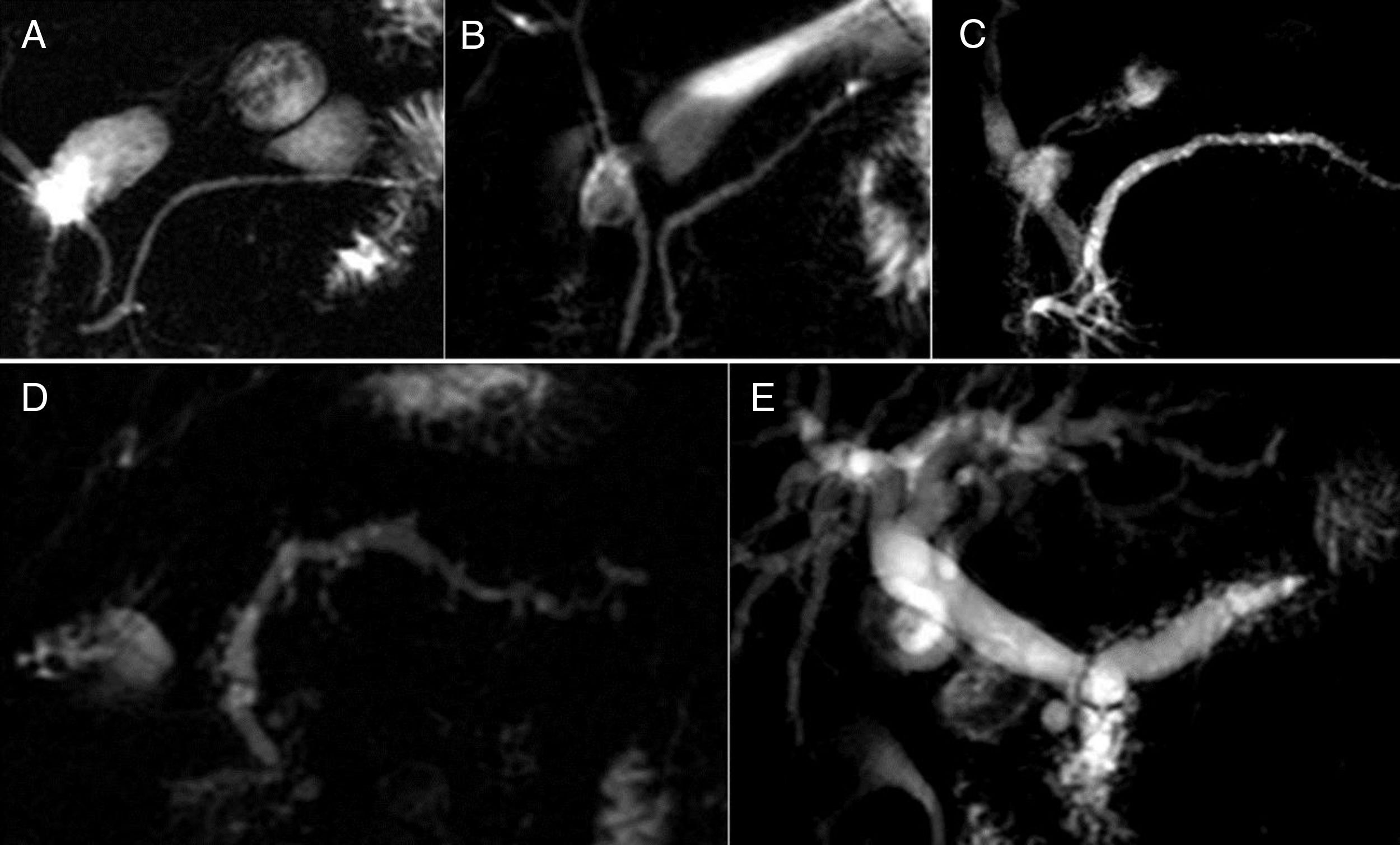
Clasificación de Cambridge en resonancia magnética. A) Cambridge 0 y I: Páncreas normal. B) El grado de Cambridge II debe presentar dos o más de los siguientes cambios: conducto pancreático de entre 2 y 4mm en el cuerpo del páncreas, leve engrosamiento del páncreas, parénquima heterogéneo, cambios quísticos (<10mm), conducto irregular y tres o más ductos ectásicos. C) El grado Cambridge III debe presentar todos los cambios especificados en Cambridge II añadiendo un conducto pancreático de más de 4 mm. D y E) El grado Cambridge IV se caracteriza por presentar uno de los cambios especificados en Cambridge II o III más uno de los siguientes: estructuras quísticas de más de 10mm, calcificaciones intraductales e irregularidades graves en el conducto pancreático.
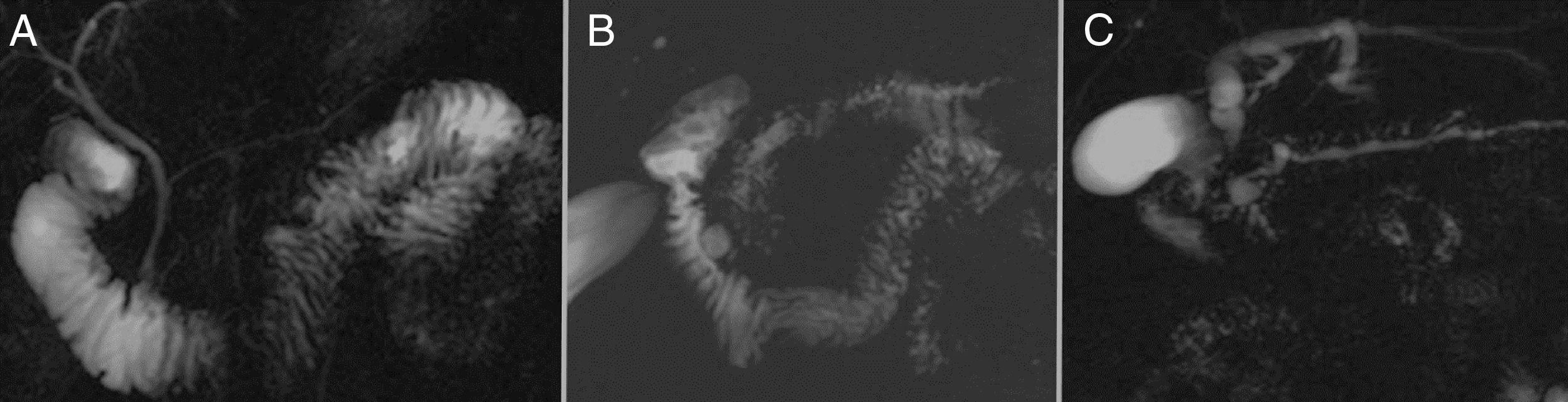
La RM es también una herramienta excelente en la evaluación de las complicaciones de la PC. Por otra parte, es una de las técnicas de imagen más precisas en la valoración de la etiología de la PC, ya que puede diferenciar las principales causas de pancreatitis crónica obstructiva (fig. 8), de las causas no obstructivas (fig. 9).
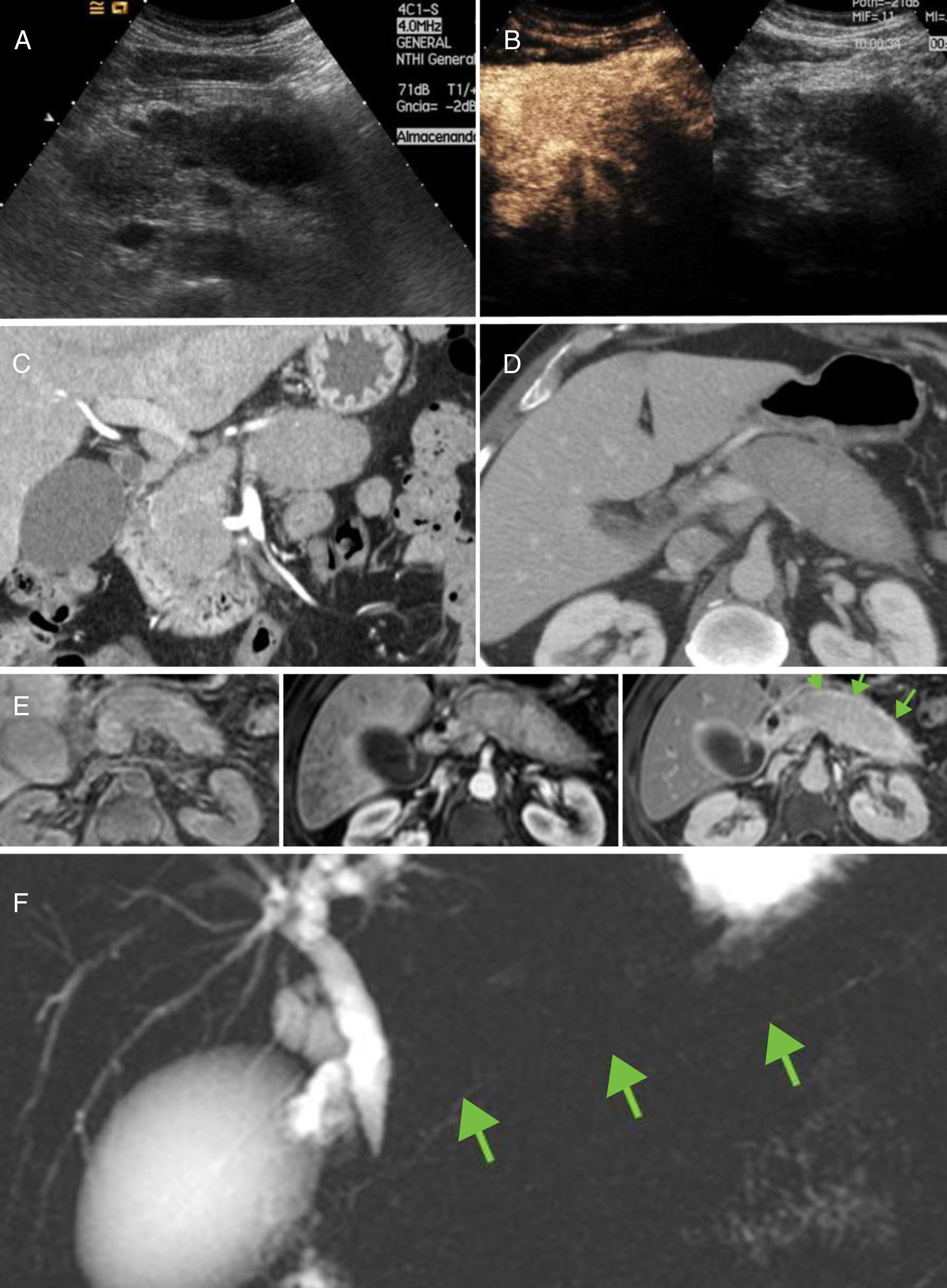
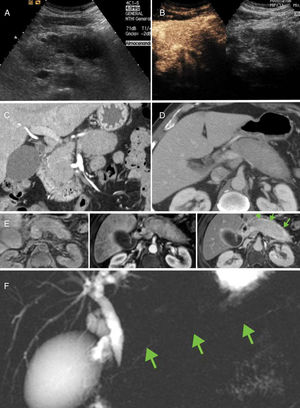
Pancreatitis crónica de etiología no obstructiva: pancreatitis autoinmunitaria. A y B) Páncreas aumentado de tamaño representado ecográficamente como masa hipoecoica que realza tras la administración de contraste ecográfico. C y D) Hallazgos, en tomografía computarizada, en fases arterial tardía y portal. Se constata páncreas aumentado de tamaño de forma difusa, “en salchicha” con escaso líquido pancreático. E) Hallazgos en resonancia magnética dinámica. Páncreas ligeramente hipointenso en T1 sin contraste, que realza de forma tenue en fase arterial tardía y progresivamente en fase tardía, identificando anillo hipercaptante en relación con seudocápsula fibrosa (flechas). F) Colangiopancretografía por resonancia magnética que muestra la típica estenosis difusa del conducto (flechas).
La RM se considera la técnica de imagen de elección en la evaluación de la PC en aquellos casos donde la TC no muestra hallazgos concluyentes, al ser más sensible que esta17.
Ecoendoscopia. Por su alta resolución, es el método de imagen más sensible en la detección de cambios estructurales precoces asociados a la PC4. Los criterios de Rosemont29 valoran alteraciones parenquimatosas y ductales pancreáticas, y dependiendo del número de alteraciones identificables se aplica la siguiente clasificación: “hallazgos diagnósticos de PC”, “hallazgos indicativos de PC”, “PC indeterminada” o “páncreas normal” (tabla 2).
Criterios de Rosemont para el diagnóstico de pancreatitis crónica a través de ecoendoscopia29
| Criterios mayores |
| A1. Focos hiperecogénicos parenquimatosos de 2mm o más con sombra acústica |
| A2. Litiasis en el conducto principal |
| B. Lobularidad difusa del páncreas (3 lóbulos contiguos o más) |
| Criterios menores |
| 1. Quistes |
| 2. Conducto principal dilatado |
| 3. Contorno del conducto irregular |
| 4. Tres o más conductos secundarios dilatados (>1mm) |
| 5. Pared del conducto principal hiperecogénica en más del 50% en cuerpo o cola |
| 6. Estrías (líneas hiperecogénicas de 3mm o más en al menos dos direcciones de plano diferentes) |
| 7. Focos hiperecogénicos sin sombra posterior de 2mm o menos |
| 8. Lobularidad focal (lóbulos no contiguos) |
| Hallazgos diagnósticos de PC: |
| A. A1+A2 |
| B. Un criterio mayor A+criterio mayor B |
| C. Un criterio mayor A y 3 criterios menores o más |
| Hallazgos indicativos de PC: |
| A. (A1 o A2) y menos de 3 criterios menores |
| B. Criterio mayor B y 3 criterios menores o más |
| C. 5 criterios menores o más sin ningún criterio mayor |
| PC indeterminada: |
| A. 3 o 4 criterios menores sin ningún criterio mayor |
| B. Criterio mayor B con menos de 3 criterios menores |
| Páncreas normal: |
| Dos o menos criterios menores |
El hallazgo ecoendoscópico más predictivo es la presencia de litiasis pancreáticas (ductales y parenquimatosas). Otros signos sugestivos son: conductos secundarios ectásicos, quistes, contorno lobulado, conducto pancreático principal irregular, focos y bandas hiperecogénicas, dilatación del conducto pancreático principal y márgenes hiperecogénicos del conducto pancreático principal30. La especificidad de la técnica aumenta con el número de criterios diagnósticos4.
Sus principales limitaciones son la falta de homogeneidad en los criterios diagnósticos y la escasa correlación interobservador31. Sin embargo, tiene un papel potencial en el seguimiento de pacientes con PC, especialmente en la detección y diferenciación de adenocarcinoma, masas inflamatorias y pancreatitis autoinmunitaria, por la posibilidad de obtener muestra histopatológica32.
Ecografía abdominal. Los hallazgos de PC tardía incluyen alteraciones en el tamaño y la ecogenicidad de la glándula, calcificaciones pancreáticas, dilatación e irregularidad del conducto pancreático y dilatación de la vía biliar (v. fig. 1). El signo ecográfico clásico son las calcificaciones, que se observan como múltiples focos hiperecogénicos en el 40% de los pacientes. El parénquima pancreático puede visualizarse de ecogenicidad heterogénea con áreas mixtas de hiper e hipoecogenicidad. Las regiones hiperecogénicas están probablemente relacionadas con fibrosis y cálculos, mientras que las regiones hipoecogénicas lo están con áreas de inflamación16.
Como la TC, la ecografía abdominal puede ser de utilidad en la valoración de complicaciones (v. fig. 2). Sin embargo, la evaluación ecográfica puede estar limitada por la complexión del paciente o la presencia de gas intestinal; por ello, las guías clínicas no la incluyen como herramienta en la detección de PC.
En conclusión, dado que la elección de la técnica de imagen debe basarse tanto en su precisión para el diagnóstico como en la disponibilidad, la experiencia del centro, el coste y si es o no invasiva, la CPRE ha sido sustituida por la TC, la CPRM y la EE, y son las mejores para establecer el diagnóstico de PC11.
Guías diagnósticas para la pancreatitis crónicaEl diagnóstico de la PC se basa en parámetros clínicos, morfológicos y funcionales, pero debido a la insuficiente correlación entre estos tres pilares, es necesario usarlos de forma complementaria.
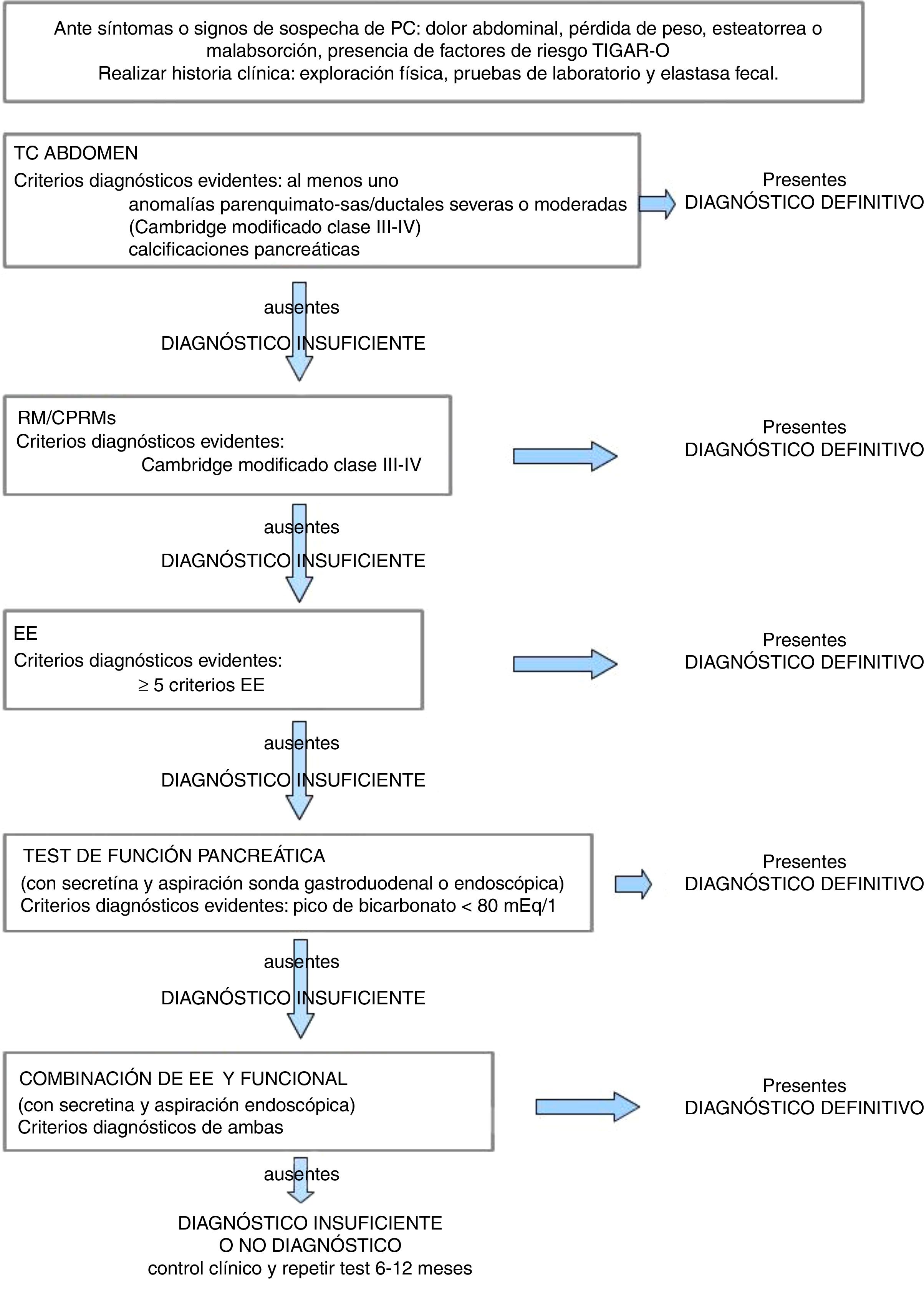
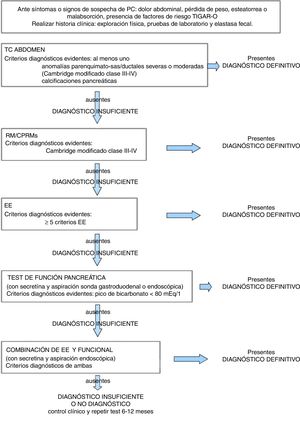
Las guías clínicas americanas9 proponen el uso de un algoritmo diagnóstico que combina datos clínicos, de imagen y funcionales, que progresa desde técnicas no invasivas a procedimientos invasivos. Dichas guías definen unos criterios para considerar el diagnóstico de PC como definitivo cuando hay una alta sospecha clínica, con esteatorrea, pérdida de peso y cambios morfológicos pancreáticos moderados o marcados, y como probable e insuficiente cuando existe una baja sospecha clínica o cambios morfológicos leves, equívocos o ausentes9.
Si la evidencia diagnóstica no es suficiente, se recomienda infradiagnosticar y realizar seguimiento con imágenes y pruebas fisiológicas hasta que el diagnóstico sea definitivo, ya que no hay una terapia que frene la progresión de la enfermedad9. No obstante, es importante que el diagnóstico sea definitivo en las fases menos avanzadas posibles ya que se ha demostrado que el dolor asociado a la PC mejora con medidas higiénicas (cese de alcohol y tabaco) o se consigue alivio del mismo a más largo plazo si la cirugía se realiza en fases más tempranas de la enfermedad4.
En la figura 10 describimos un algoritmo diagnóstico modificado de Conwell et al.9, donde se elimina la CPRE como técnica para el diagnóstico de PC4,11 y se incluyen los criterios para el diagnóstico definitivo del resto de técnicas morfológicas y funcionales. Una estrategia diagnóstica útil en la evaluación de un paciente con sospecha de PC, donde los resultados de las pruebas de laboratorio son normales, es considerar un estudio de imagen abdominal (en función del grado de evidencia científica basado en la clasificación propuesta por el Oxford Center of Evidence-Based Medicine) para establecer un diagnóstico definitivo. La TC abdominal es la técnica más adecuada para identificar calcificaciones pancreáticas (nivel de evidencia 2C), puede descartar otras causas de dolor abdominal e identificar complicaciones de la pancreatitis. En ámbitos donde la CPRM está disponible y es de alta calidad, puede ser la prueba de imagen de elección, pues los hallazgos típicos son suficientes para el diagnóstico (nivel de evidencia 1C), y en caso de no ser concluyentes, la administración de secretina aumenta el potencial diagnóstico (nivel de evidencia 1C). En pacientes con pruebas de imagen no invasivas normales se debe considerar la realización de una EE, ya que es la técnica de imagen más sensible, incluso en fases menos avanzadas de la enfermedad (nivel de evidencia 1B). Las pruebas de función pancreática con secretina comparadas con la EE aumentan la sensibilidad para el diagnóstico de PC y la combinación de ambas alcanza el 100% (nivel de evidencia 1B).
Las técnicas de imagen también tienen un papel en el diagnóstico etiológico de la PC, que también se basa en la historia clínica y en estudios de laboratorio. Son de especial relevancia en el diagnóstico de la pancreatitis autoinmunitaria, de la pancreatitis paraduodenal y en la detección de anomalías anatómicas como el páncreas divisum33.
La pancreatitis autoinmunitaria debe sospecharse cuando no se encuentran otras causas de PC. Los hallazgos clínicos típicos son: la elevación de inmunoglobulina G4 en sangre, su respuesta marcada a esteroides y la dificultad en diferenciarla del cáncer de páncreas. En imagen son característicos el aumento difuso del páncreas, pérdida de la arquitectura lobular, conducto pancreático difusamente estenosado y anillo periférico de realce tardío (fig. 9). La forma focal requiere en ocasiones confirmación histológica para descartar cáncer pancreático.
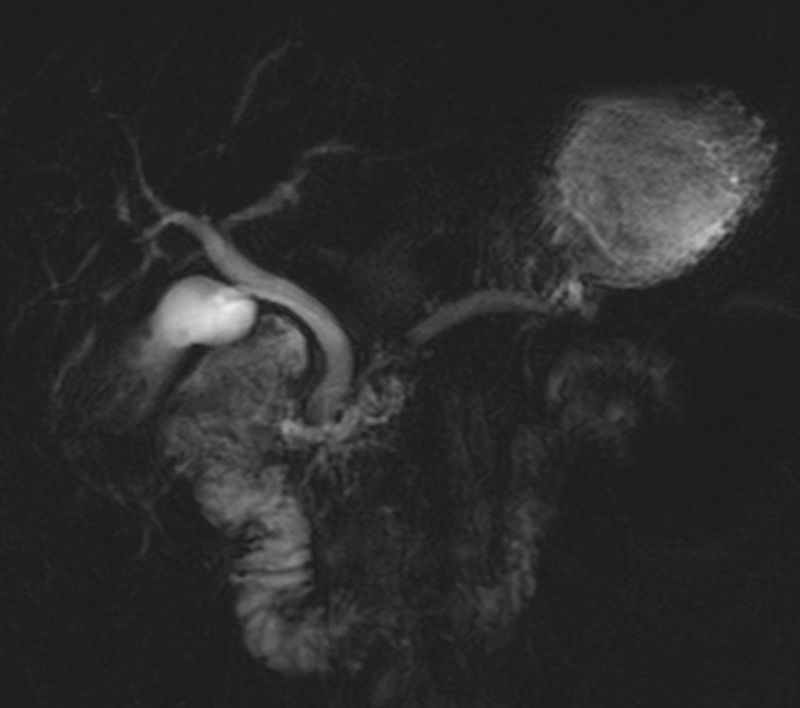
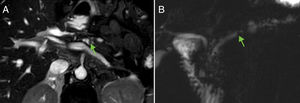
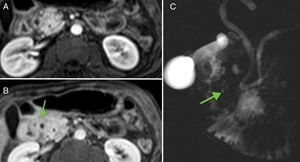
La pancreatitis del surco o paraduodenal es una forma rara de PC probablemente debida a la existencia de tejido pancreático ectópico en la hendidura entre el páncreas y el duodeno o en la pared duodenal. En imagen es característica la presencia de tejido que ocupa la hendidura pancreaticoduodenal, que presenta realce tardío, asocia pequeños quistes en la pared medial del duodeno (fig. 11), puede condicionar estenosis duodenal o biliar y el diagnóstico diferencial más importante es con el cáncer de páncreas33.
Pancreatitis paraduodenal. A y B) Imagen de RM potenciada en T1 con contraste en fase arterial tardía y portal donde se evidencia ocupación del surco pancreatoduodenal por tejido que realza progresivamente (flecha). C) En colangiopancretografía por resonancia magnética se observan pequeños quistes de la pared duodenal, hallazgo característico de esta entidad (flecha).
La anomalía congénita más frecuente del sistema ductal pancreático es el páncreas divisum y se ha demostrado la asociación con la pancreatitis. Debe sospecharse ante pacientes jóvenes con episodios recurrentes de pancreatitis aguda o PC sin otra causa aparente (fig. 8).
En cuanto al seguimiento, en los pacientes con PC estable se recomienda hacer un control clínico y analítico cada 6 meses. En los pacientes con complicaciones, el seguimiento ha de hacerse de forma individualizada. No existe una clara opinión de consenso sobre cómo realizar el cribado del carcinoma de páncreas10. Muchos centros recomiendan la utilización de la EE, basándose en su capacidad en identificar masas pancreáticas de tamaño menor de 1cm y la posibilidad de practicar una punción con aguja fina. Sin embargo, la naturaleza invasiva del procedimiento hace que la TC y la CPRM puedan ser las técnicas iniciales para la valoración pancreática. El momento adecuado de iniciar el cribado también es discutible y se basa en las recomendaciones de los expertos. Se ha establecido que debería iniciarse a los 45 años o 15 años antes del caso de cáncer de páncreas más joven aparecido en la familia, si existe en ella el antecedente de pancreatitis hereditaria. En el caso de los fumadores debería iniciarse antes. Tampoco existe acuerdo sobre la frecuencia con la que debe realizarse la vigilancia; las recomendaciones oscilan en un intervalo de entre 1 y 3 años.
ConclusionesEl diagnóstico clínico de la PC es difícil, principalmente en estadios precoces, por lo que las técnicas de imagen tienen un importante papel en la valoración de la enfermedad (tanto en la detección de los hallazgos clásicos como en los atípicos, incluyendo la identificación de posibles causas subyacentes), en la búsqueda de las complicaciones por su relevancia terapéutica y en la detección del carcinoma pancreático asociado.
Autoría- 1.
Responsable de la integridad del estudio: JSG y FDC.
- 2.
Concepción del estudio: JSG y FDC.
- 3.
Diseño del estudio: JSG y FDC.
- 4.
Obtención de los datos: JSG y FDC.
- 5.
Análisis e interpretación de los datos: JSG y FDC.
- 6.
Tratamiento estadístico: N.A.
- 7.
Búsqueda bibliográfica: JSG y FDC.
- 8.
Redacción del trabajo: JSG y FDC.
- 9.
Revisión crítica del manuscrito con aportaciones intelectualmente relevantes: JSG y FDC.
- 10.
Aprobación de la versión final: JSG y FDC.
Los autores declaran no tener ningún conflicto de intereses.