El síndrome de distrés respiratorio grave por el virus coronavirus 2, conocido como SARS-CoV-2, fue declarado pandemia mundial en marzo de 2020 por la Organización Mundial de la Salud y sigue activo actualmente en casi todos los países del mundo. Aunque los síntomas y manifestaciones en pruebas de imagen predominan en el aparato respiratorio, conocer las manifestaciones y posibles complicaciones en otros órganos será fundamental para ayudar al diagnóstico y orientar hacia el pronóstico de la enfermedad. Saber cuándo están indicadas las pruebas de imagen extratorácicas y cuáles son más rentables en cada circunstancia será crucial para mejorar el proceso diagnóstico sin aumentar innecesariamente el riesgo de contagio. En este trabajo hemos tratado de proporcionar estas respuestas, y hemos descrito iconográficamente las manifestaciones radiológicas de la enfermedad COVID-19 en regiones extratorácicas en adultos, así como en su conjunto en el paciente pediátrico.
In March 2020, the World Health Organization declared a global pandemic of COVID-19, caused by the severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2); epidemic conditions continue in nearly all countries today. Although the symptoms and imaging manifestations of COVID-19 predominantly involve the respiratory system, it is fundamental to know the manifestations of the disease and its possible complications in other organs to help in diagnosis and orient the prognosis. To improve the diagnostic process without increasing the risk of contagion unnecessarily, it is crucial to know when extrathoracic imaging tests are indicated and which tests are best in each situation. This paper aims to provide answers to these questions. To this end, we describe and illustrate the extrathoracic imaging manifestations of COVID-19 in adults as well as the entire spectrum of imaging findings in children.
La afectación pulmonar es la principal manifestación de la COVID-19; sin embargo, la infección por SARS-CoV-2 no se limita al aparato respiratorio, sino que pueden verse afectados otros órganos, a veces de forma dominante. En este artículo se hará una revisión de los conocimientos que se tienen hasta el momento sobre el daño extratorácico por COVID-19. En la segunda parte se repasarán las manifestaciones de la enfermedad en niños.
Imagen de las manifestaciones extratorácicas de la COVID-19 en adultosAunque la literatura científica es creciente, las evidencias acerca de las manifestaciones extratorácicas se basan en parte en conjeturas clínicas y comunicación de casos o datos post mortem, y en muchos órganos resulta difícil diferenciar las alteraciones debidas al propio virus de los fenómenos trombóticos y del cuadro de activación inmunitaria y shock secundario que conducen a la muerte1–3. Esto impide extraer conclusiones definitivas acerca de la verdadera prevalencia de afectación extrapulmonar por el virus y, por tanto, de sus manifestaciones radiológicas.
Se han postulado diversos mecanismos fisiopatológicos responsables de la afectación extratorácica por la COVID-19. Valdés et al.4 exponen un esquema de estos mecanismos. La existencia de receptores ECA-2 (por los que el virus SARS-CoV-2 tiene gran afinidad) en las células de los diferentes órganos sugeriría un daño directo por el virus, aunque su demostración anatomopatológica todavía está poco reportada1–3. Por ello y por la aparición tardía y en pacientes más graves de algunos de estos síntomas, la fisiopatogenia de estas manifestaciones se ha relacionado también con una exagerada respuesta inmunitaria sistémica, hipoxia, coagulopatía, afectación vascular multifactorial e incluso toxicidad farmacológica.
Las principales manifestaciones extrapulmonares que se describen son hematológicas, neurológicas, cardíacas, gastrointestinales, hepáticas, renales, cutáneas y oculares5,6.
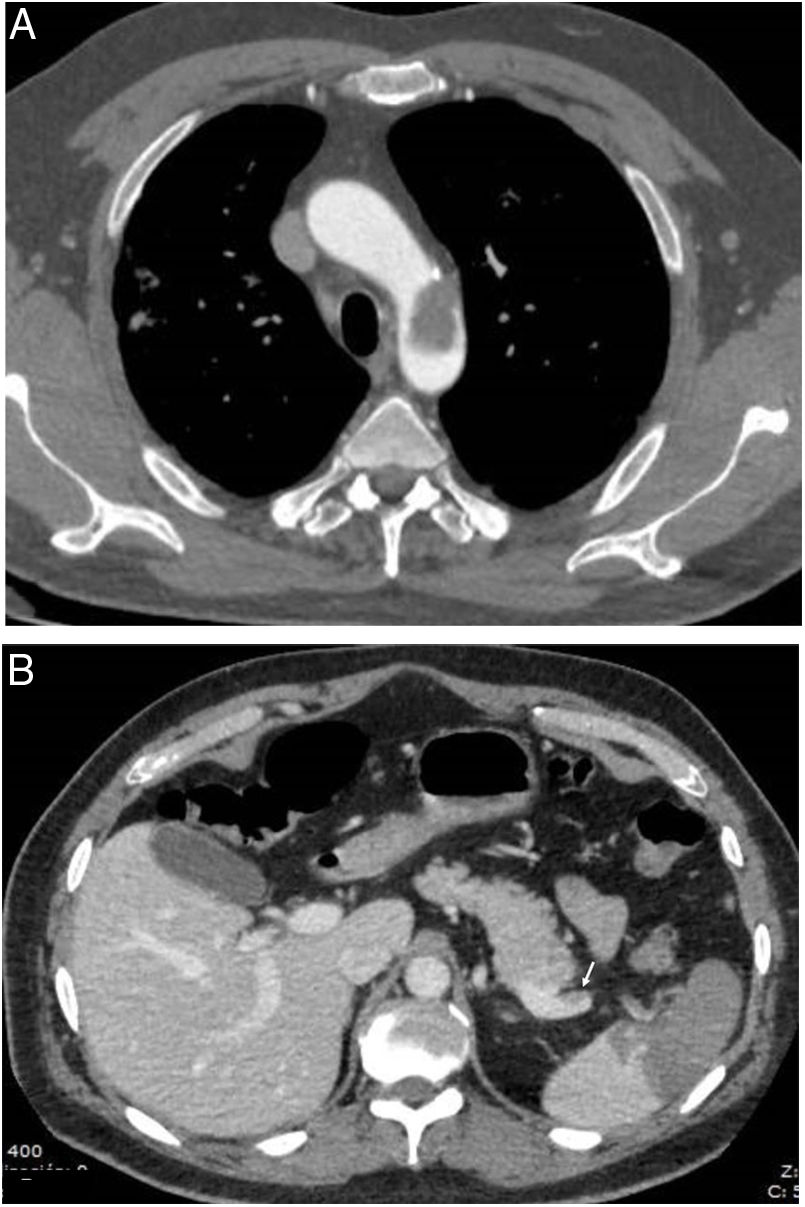
Manifestaciones hematológicas y de laboratorioHay numerosas alteraciones analíticas en la COVID-19 que se relacionan con el pronóstico de la enfermedad5,7 y que traducen en muchos casos ese estado de activación del sistema inmunitario y de shock. Entre ellas destacan por su trascendencia las alteraciones de la coagulación, que clínicamente se manifiestan como un aumento de la incidencia de fenómenos trombóticos a múltiples niveles tanto en forma de enfermedad tromboembólica venosa como trombosis arterial y venosa en cualquier localización, evidenciándose por imagen tanto los propios trombos como las lesiones isquémicas viscerales secundarias (fig. 1), constituyendo un hallazgo autópsico frecuente1,2. En la COVID-19 existe un aumento en la incidencia de este tipo de eventos frente a las causadas por otros virus8, tanto en pacientes graves9 como en no hospitalizados10, siendo una de las principales causas por las que estos pacientes tienen que ser valorados con pruebas de imagen.
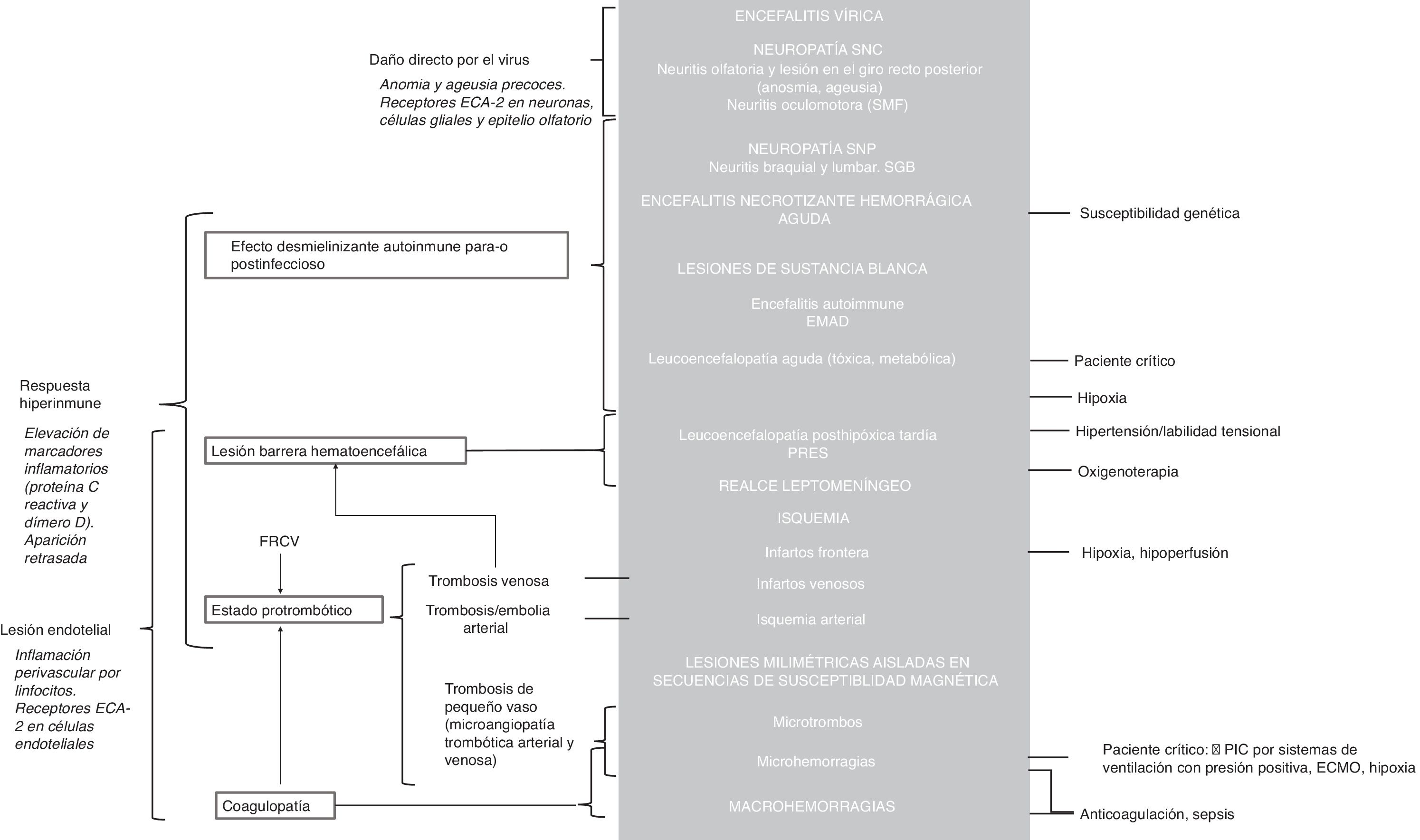
Manifestaciones neurológicasLas manifestaciones neurológicas derivadas de la infección aguda por la COVID-19 resultan especialmente relevantes por su frecuencia, relativa especificidad y gravedad, y porque se traducen en alteraciones en estudios neurorradiológicos. Su fisiopatología no es bien conocida. Se han postulado tres mecanismos principales con probable efecto sinérgico6,11: a) daño neuronal directo del virus, b) efecto desmielinizante de origen autoinmune para- o postinfeccioso secundario a la hiperrespuesta inflamatoria y c) lesión del endotelio vascular. No obstante, hay otras circunstancias concurrentes, habituales en el paciente crítico, que también podrían contribuir12 (fig. 2).
Posibles mecanismos fisiopatológicos implicados en las lesiones neurológicas por el virus SARS-CoV-2 con sus respectivas manifestaciones en las pruebas de imagen (fondo gris). En cursiva, los argumentos a favor de cada uno de los mecanismos principales. Ver la explicación fisiopatológica detallada en el material suplementario.
ECA-2: enzima convertidora de la angiotensina 2; ECMO: sistema de oxigenación por membrana extracorpórea; EMAD: encefalomielitis aguda diseminada; FRCV: factores de riesgo cardiovascular; PIC: presión intracraneal; PRES: síndrome de encefalopatía posterior reversible; RT-PCR: reacción en cadena de la polimerasa con transcriptasa inversa; SGB: síndrome de Guillain Barré; SMF: síndrome de Miller Fisher; SNC: sistema nervioso central; SNP: sistema nervioso periférico.
Clínicamente se manifiestan con anosmia, ageusia, mialgia, cefalea, mareo, disautonomía, focalidad por episodios cerebrovasculares, crisis convulsivas y encefalopatía13,14, presentes entre el 36%15 y el 50% de pacientes con infección aguda por COVID-19 que ingresan en centros hospitalarios. De estos, entre el 21%16 y el 60%11,17 muestran alteraciones en tomografía computarizada (TC) y/o resonancia magnética (RM), que alcanzan el 84% en pacientes ingresados en la unidad de cuidados intensivos (UCI)18. La incidencia podría ser aún mayor, dada la dificultad para la exploración y para realizar pruebas de imagen (aislamiento, agitación, traslado dificultoso) en estos pacientes19. Por ello, las pruebas de neuroimagen están indicadas ante síntomas neurológicos o psiquiátricos nuevos, salvo en síntomas leves característicos del cuadro clínico (ageusia y anosmia). La TC es de elección ante la sospecha de lesiones cerebrovasculares, que serán en su mayoría ictus isquémicos. Si persiste la sospecha clínica y la TC es negativa, puede realizarse un protocolo abreviado de RM, con secuencias ponderadas en T1, T2-FLAIR y difusión, y secuencias T1 con contraste si se sospecha meningitis o encefalitis6.
El espectro de manifestaciones neurorradiológicas es amplio, con patrones en ocasiones difícilmente clasificables:
- A.
Sistema nervioso central (SNC):
- a)
Lesiones isquémicas agudas. Representan el 27-65% de todas las lesiones neurológicas agudas11,16,19. Se dan entre un 1,1%19 y un 11%16 de pacientes hospitalizados, siendo un marcador de mal pronóstico, con elevada mortalidad19,20. Predominan en hombres, ancianos y pacientes con factores de riesgo vascular11. Suelen desarrollarse a partir de una semana del comienzo del cuadro clínico. Son más graves en pacientes con afectación pulmonar grave por COVID-1915. En comparación con los ictus isquémicos en sujetos sin infección por SARS-CoV-2, son más graves y afectan a pacientes más jóvenes20.
En los estudios neurorradiológicos se manifiestan como infartos agudos/subagudos, multiterritoriales (fig. 3)16, supra- e infratentoriales, por lesión de gran vaso (45% del total) (fig. 4) y pequeño vaso (21% del total6), y por hipoperfusión, con desarrollo de infartos en territorio frontera18. El origen más frecuente es el criptogenético (52%), seguido del cardioembólico (25%)16.
- b)
Lesiones no isquémicas:
Varón de 71 años con antecedentes de insuficiencia renal crónica, insuficiencia hepática, hipertensión arterial e infección aguda por COVID-19. La tomografía computarizada (TC) de tórax (A) muestra opacidades bipulmonares parcheadas en vidrio deslustrado atribuibles a infección por COVID-19. El paciente presenta durante su ingreso una hemiparesia derecha y disartria. La resonancia magnética cerebral (B, secuencia de difusión) identifica múltiples y pequeños infartos corticales multiterritoriales, y la angio-TC (C y D), placas ateromatosas calcificadas en ambas bifurcaciones carotídeas.
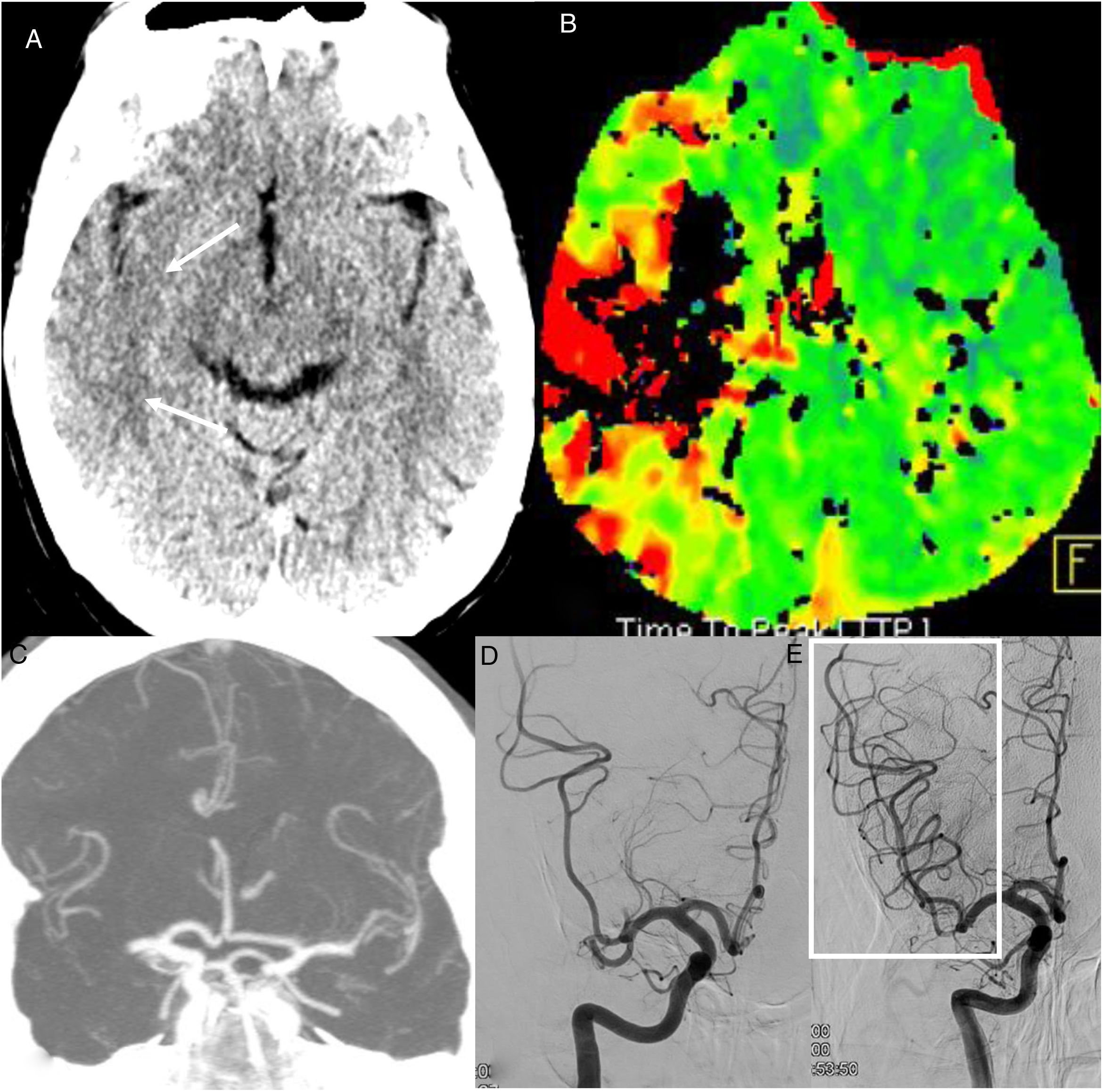
Lesiones isquémicas agudas arteriales. Varón de 63 años, que acude al hospital con ictus en territorio de la arteria cerebral media derecha de 4 horas de evolución. PCR positiva frente a COVID-19. La tomografía computarizada (TC) simple (A) muestra una hipodensidad cortical temporal derecha (flechas) y la TC de perfusión (mapa de tiempo hasta el pico) (B) un retraso circulatorio en el territorio de la arteria cerebral media derecha. La angio-TC muestra una oclusión de la arteria cerebral media derecha (C). La arteriografía mostró una oclusión de dos divisiones del segmento M2 de la arteria cerebral media (D) que se recanalizaron mediante trombectomía mecánica (recuadro en E).
- i.
Lesiones en sustancia blanca (SB). Suelen ser supratentoriales. En un 25% de casos se combinan dos patrones o más21:
- 1.
Lesiones de SB no confluentes. De frecuencia desconocida (infrecuente11 vs. 30%21). Se trata de lesiones no confluentes, hiperintensas en T2-FLAIR e hipodensas en TC, con un grado de realce variable con contraste. Pueden asociar lesiones microhemorrágicas. Se ha sugerido que semejan la presentación radiológica de la encefalomielitis aguda diseminada (EMAD), con afectación predominante de centros semiovales, así como la leucoencefalitis aguda hemorrágica, si bien para estos diagnósticos se requieren anomalías específicas del LCR que no se han encontrado en las muestras de pacientes con infección respiratoria constatada por SARS-CoV-2. La SB subcortical se afecta más frecuentemente en pacientes graves22. Su origen más probable es el desmielinizante inflamatorio parainfeccioso, dados los signos de EMAD hiperaguda en muestras histológicas23, el decalaje en su presentación de al menos una semana tras la infección y los hallazgos radiológicos.
- 2.
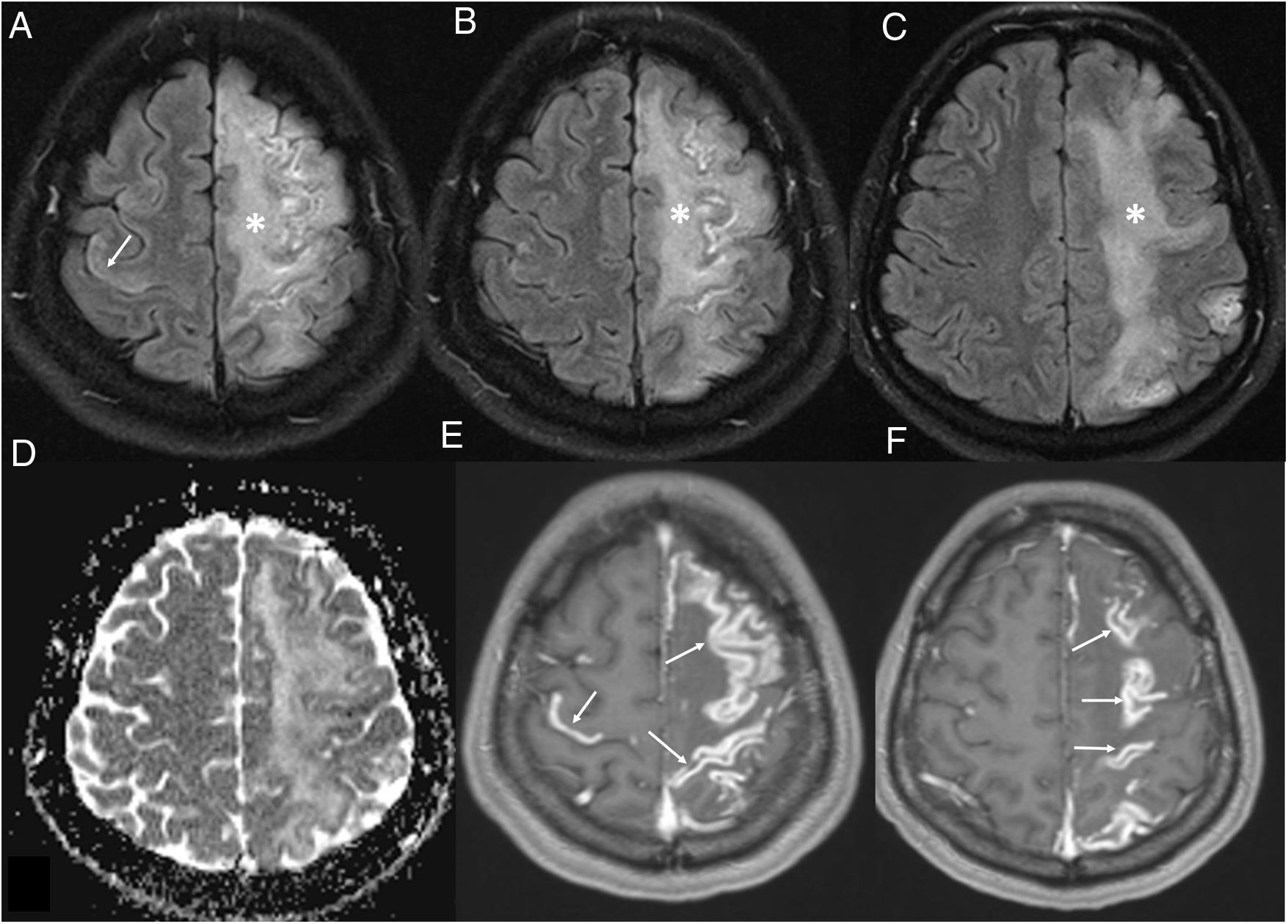
Lesiones de SB confluentes o leucoencefalopatía difusa (fig. 5). Lesiones hiperintensas en T2-FLAIR, más extensas, confluentes12,21,24 y simétricas25 con restricción moderada de la difusión. Afectan a la SB profunda periventricular y subcortical, con cierto respeto de la yuxtacortical, excepcional afectación infratentorial, y respetan la sustancia gris profunda24. Se han descrito en pacientes críticos, con síndrome de distrés respiratorio agudo y alteración persistente del estado mental, lo que sugiere un mecanismo lesional hipóxico y, dada la restricción en difusión24, un componente desmielinizante. Se ha asemejado a: la leucoencefalopatía posthipóxica tardía24,26, con lesión en territorios frontera; a la encefalopatía asociada a sepsis, de origen metabólico y tóxico, y al síndrome de encefalopatía posterior reversible (PRES)27 con lesiones confluentes hiperintensas en T2-FLAIR en SB subcortical típicamente occipital28, aunque no exclusivamente, relacionadas con aumento o labilidad de la presión arterial11, e insuficiencia renal (fig. 6).
Figura 5.Varón de 60 años ingresado en la UCI por neumonía por COVID que requirió intubación. Durante el ingreso presenta una hemiparesia izquierda. La tomografía computarizada simple muestra lesiones hipodensas en la sustancia blanca periventricular y subcortical (asteriscos) en ambos lóbulos temporales y parietales. Se orientó como una leucoencefalopatía difusa aguda en paciente crítico. Figura cortesía de la Dra. Cristina Utrilla. Hospital La Paz, Madrid.
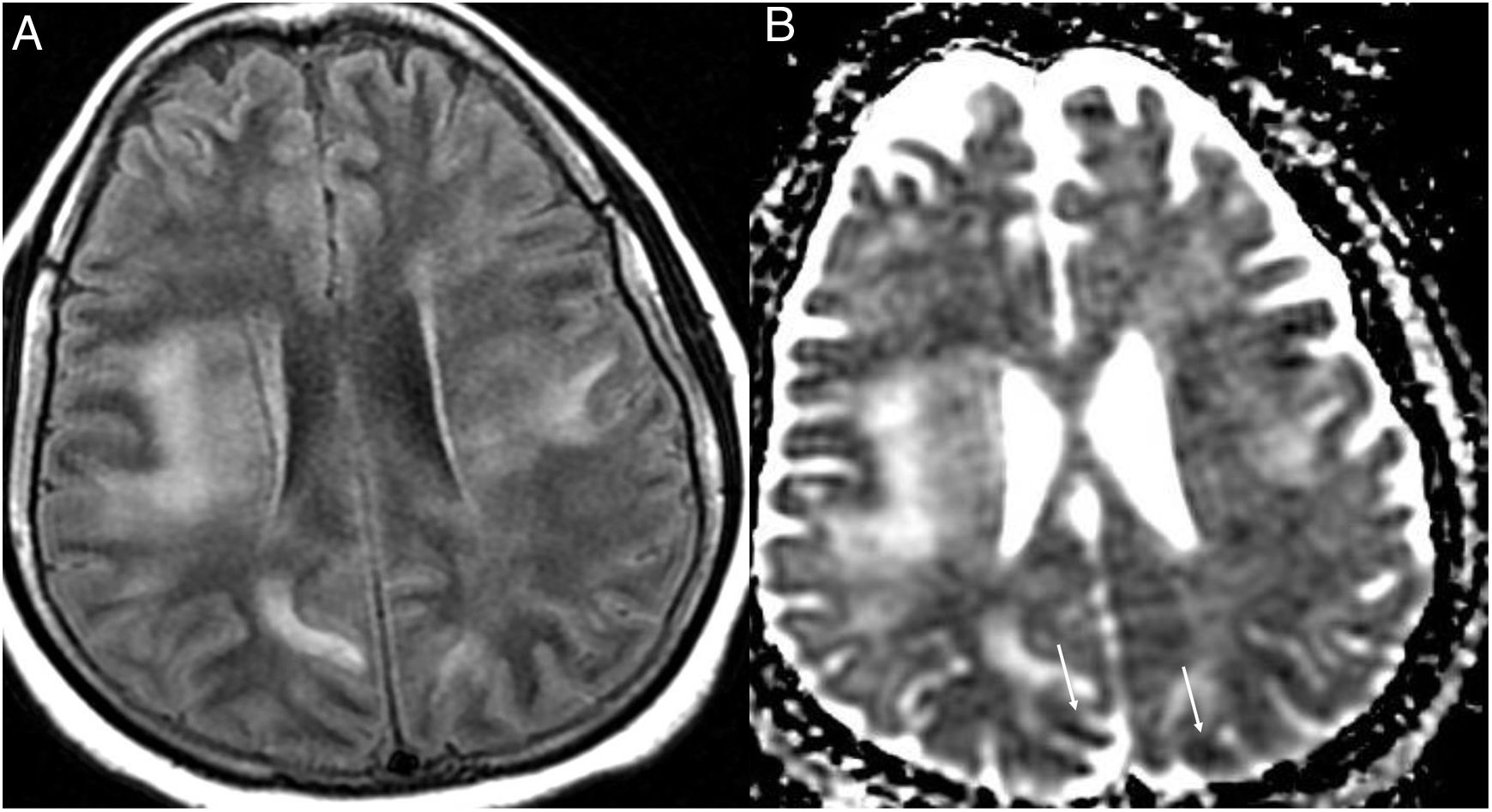
(0,08MB).Figura 6.Mujer de 35 años con infección nosocomial por SARS-CoV-2, con cefalea y febrícula. La resonancia magnética muestra lesiones en la sustancia blanca supratentorial periventricular y subcortical confluentes hiperintensas en la secuencia T2-FLAIR (A) y con restricción de la difusión en el ADC (flechas) (B). Se orientó como un síndrome de encefalopatía posterior reversible. Figura cortesía de la Dra. Cristina Utrilla. Hospital La Paz, Madrid.
(0,16MB).
- ii.
Lesiones en localizaciones específicas:
- 1.
Tálamo medial, lóbulo temporal medial y región subinsular, como encefalitis necrotizante hemorrágica aguda. Son lesiones hipodensas en TC, con componente hemorrágico y realce en anillo en RM, generalmente bilaterales y simétricas (fig. 7). Se han relacionado con la hiperrespuesta inflamatoria29 en pacientes susceptibles genéticamente.
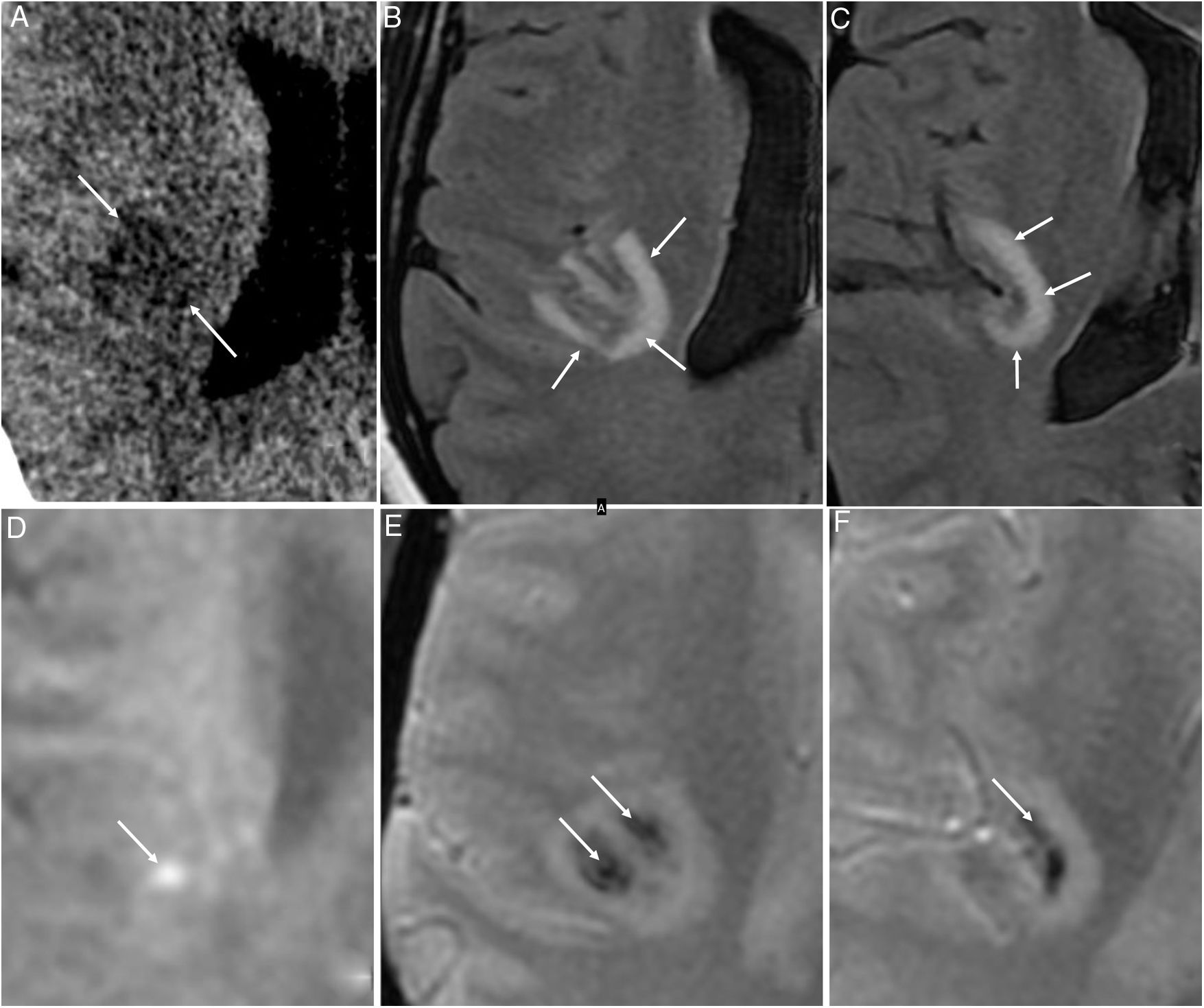
Figura 7.Mujer de 48 años con infección aguda por COVID-19 que presenta una alteración sensitiva en el hemicuerpo izquierdo de 4-5 días de evolución. Una tomografía computarizada inicial muestra una lesión hipodensa insular derecha (flechas en A). Una resonancia magnética posterior localiza la lesión a nivel yuxtacortical, la cual es hiperintensa en T2-FLAIR (flechas en B y C), con algún foco de brillo en la secuencia de difusión (flecha en D), y con focos hemorrágicos en las imágenes T2* (flechas en E y F). Se orientaron los hallazgos como una encefalitis necrotizante hemorrágica aguda.
(0,16MB). - 2.
Lóbulo temporal medial. Lesiones unilaterales hiperintensas en T2-FLAIR o difusión, similares a la encefalitis vírica (por virus herpes del simple, human herpesvirus 6 o Epstein-Barr) o a la encefalitis límbica autoinmune21. Según algunas series, es el hallazgo neurológico más frecuente (43%)21. Sin embargo, no se han encontrado datos de encefalitis con presencia de coronavirus en estudios histológicos30.
- 3.
Esplenio del cuerpo calloso, afectado por lesiones hiperintensas en T2-FLAIR y microhemorragias. Se ha asemejado al síndrome Susac, relacionado con oclusión arteriolar inmunomediada. Es infrecuente31.
- c)
Hemorragias11:
- i.
Parenquimatosas. Descritas en un 3,6% de pacientes con pruebas de neuroimagen16. Pueden ser hemisféricas, lobares, cerebelosas y/o en ganglios basales, y tener apertura a ventrículo o a espacio subaracnoideo11. En una serie larga16, el 60% fueron mayores de 5 cm, abiertas a ventrículo, con desplazamiento de línea media y hernia cerebral. Pueden asociarse a lesiones isquémicas, a las no isquémicas descritas6,21,23, o ser espontáneas. El 24% de todos los infartos en pacientes con COVID-19 son hemorrágicos6, empeorando su pronóstico19, con mortalidad intrahospitalaria superior al 50%.
- ii.
Subdurales16.
- iii.
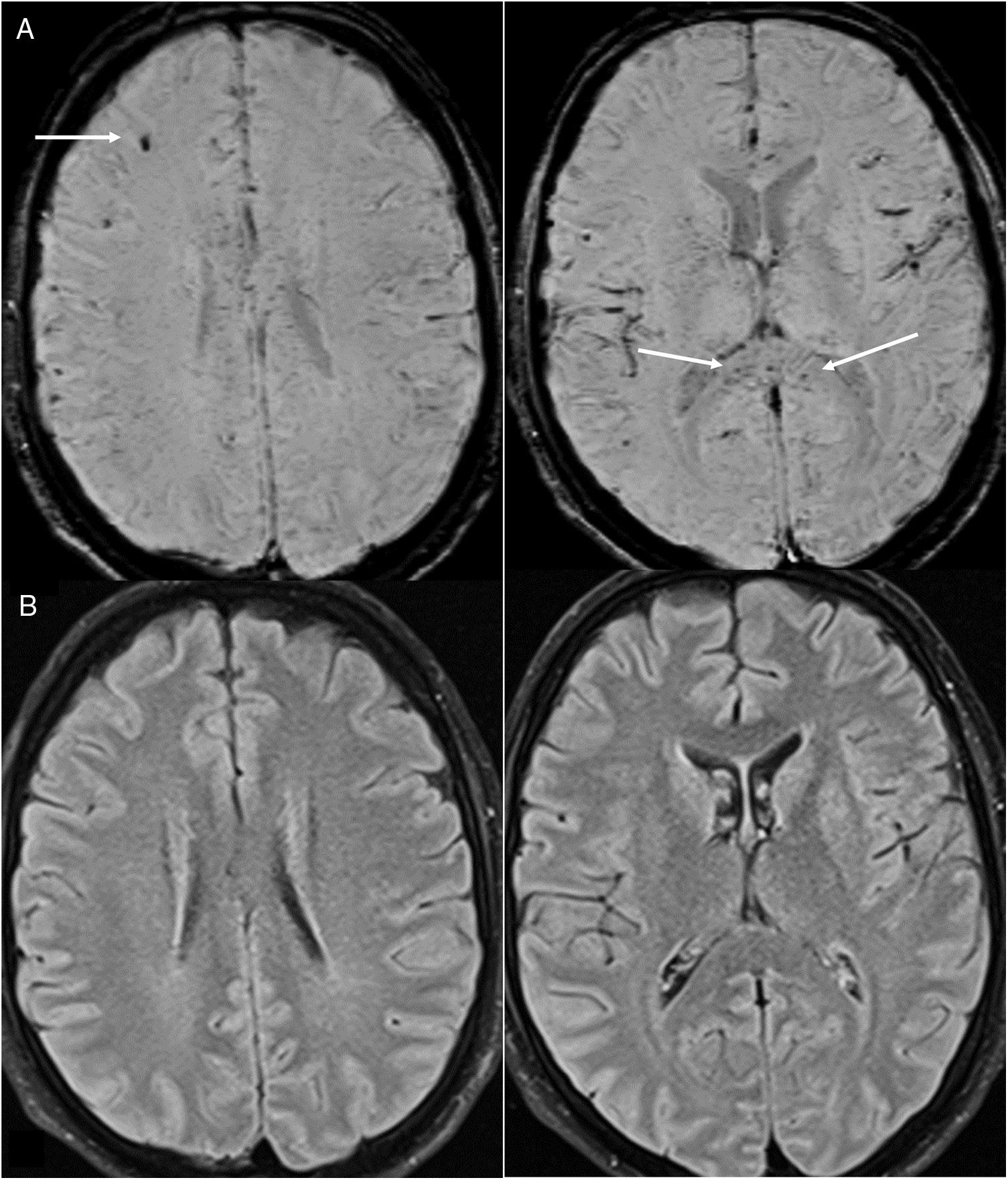
Lesiones milimétricas en secuencias de susceptibilidad magnética. Descritas hasta en el 24% de pacientes sometidos a una RM21, mayoritariamente críticos24. Son múltiples focos milimétricos (más de 15), hipointensos en las secuencias de susceptibilidad magnética, en la SB yuxtacortical y/o cuerpo calloso (fig. 8). Pueden acompañarse de lesiones confluentes en la SB. Se han atribuido a microhemorragias23 originadas por disfunción endotelial, microsangrados del paciente crítico16,23,24 y, las del cuerpo calloso, a alteración del retorno venoso cerebral por aumento de la presión intratorácica en pacientes con ventilación con presión positiva32. Otros consideran que se deben a microangiopatía trombótica33. Los trombos podrían estar localizados tanto en arterias, lo que explicaría los focos de infarto cortical visibles en la RM, como en pequeñas venas corticales, dada su hiperdensidad, posiblemente por flujo lento.
Figura 8.Varón de 35 años que ingresa por infección aguda por COVID-19 y grave afección pulmonar que requirió tratamiento con sistema de oxigenación por membrana extracorpórea. Presenta alteración de conciencia. La resonancia magnética cerebral muestra múltiples focos hipointensos yuxtacorticales y en cuerpo calloso en imagen de susceptibilidad magnética de RM (flechas en A) atribuibles a microhemorragias o microtrombosis, no asociadas a lesiones parenquimatosas en las imágenes T2-FLAIR (B).
(0,37MB).
- d)
Otras lesiones:
- i)
Alteraciones de señal corticales en T2-FLAIR en pacientes ingresados en UCI12.
- ii)
Lesiones hiperintensas en T2-FLAIR en pedúnculos cerebelosos medios y porción medial de hemisferios cerebelosos23.
- iii)
Pseudotumor cerebri.
- iv)
Aumento del espacio subaracnoideo alrededor de los nervios ópticos, posiblemente por aumento de presión intracraneal por los mecanismos de ventilación25.
- e)
Lesiones extraaxiales:
- i)
Meninges. Se ha descrito realce leptomeníngeo en un 17% de pacientes con síntomas neurológicos19,34,35. Refleja inflamación leptomeníngea, también descrita en muestras anatomopatológicas, aunque también podría ser consecuencia de la oxígenoterapia18. Puede asociar leucoencefalopatía (fig. 9).
Figura 9.Mujer de 36 años ingresada por neumonía por COVID-19 que presenta un déficit neurológico agudo en el hemicuerpo derecho. La resonancia magnética cerebral muestra una alteración difusa corticosubcortical frontoparietal izquierda (asteriscos en A-C) y prefrontal derecha (flecha en A) en las imágenes T2-FLAIR, sin restricción en el mapa del coeficiente de difusión aparente (D), que se asocia con un intenso realce leptomeníngeo en las imágenes T1 con contraste (flechas en E-F). Se orientó como una meningoencefalitis.
(0,2MB). - ii)
Vasos. Se han documentado trombos flotantes en arterias carótidas11, disección carotídea y trombosis de senos venosos. Los infartos venosos deben sospecharse ante lesiones en áreas no correspondientes a territorios arteriales. Frecuentemente son lesiones bilaterales y hemorrágicas.
- B.
Neuropatía:
- a.
Nervios intracraneales. Se afectan en un 2,2% de los pacientes16:
- i.
Neuritis olfatoria. La anosmia y la ageusia de aparición súbita y precoz (durante la primera semana) se han descrito en más del 50% de casos, y se consideran un posible biomarcador de la enfermedad16, principalmente cuando no asocian congestión nasal. Es más frecuente en mujeres jóvenes y en cuadros leves. En pacientes con anosmia se han descrito lesiones hiperintensas en bulbos olfatorios16 y en la región cortical del giro recto posterior (relacionado con el olfato5,36–38). La mayoría son reversibles en semanas. No se asocian con alteraciones de los senos paranasales39.
- ii.
Neuritis de nervios oculomotores. Se ha relacionado con el síndrome de Miller Fisher (SMF)16, variante intracraneal del síndrome Guillain Barré (SGB), que cursa con diplopia, ataxia y arreflexia. En la RM se ha encontrado aumento de tamaño e hiperintensidad de nervios oculomotores en secuencias T2-FLAIR, con marcado realce con contraste.
- b.
Nervios periféricos. Descrita exclusivamente en hombres, con una edad media de 60 años, tras 1-2 semanas desde el inicio del cuadro vírico, con pronóstico variable23:
- i)
SGB23,34,40. Aparece de forma más precoz que en otras infecciones víricas. No hay manifestaciones neurorradiológicas específicas.
- ii)
Plexopatía. Cursa con debilidad indolora. En la RM se ha encontrado aumento de señal y realce en nervios del plexo braquial y lumbar.
En los pacientes con infección por SARS-CoV-2 se ha descrito una incidencia de afectación cardíaca entre el 7% y el 30%, y mayor en pacientes de UCI y con factores de riesgo cardiovascular (55%) (FRCV)6,41. Sin embargo, puede darse con síntomas respiratorios leves6. Las cifras elevadas de dímero D, troponina y la existencia de FRCV se han asociado con mortalidad mayor. Aunque el mecanismo lesional se desconoce, se cree que es multifactorial, con posible efecto directo del virus, así como del desequilibrio entre las necesidades y aportes de oxígeno al miocardio, trombosis en arterias coronarias, reacción inmune sistémica y efecto de los tratamientos administrados41. El infarto agudo de miocardio es una de las manifestaciones más frecuentes, siendo otras la miocardiopatía de estrés, miocarditis, pericarditis, arritmias, shock cardiogénico41, además de los fenómenos tromboembólicos multiterritoriales. La mejor técnica para evaluar los efectos cardíacos es la RM6.
Manifestaciones hepáticas y del sistema digestivoLos síntomas abdominales no son excepcionales en la COVID-19, describiéndose diarrea, vómitos y dolor abdominal42, en ocasiones como únicos síntomas43. Por ese motivo, resulta de enorme interés clínico el hallazgo de lesiones en las bases pulmonares sugestivas de COVID-19 en estudios de TC abdominal realizados a pacientes con clínica abdominal y sin sospecha de la enfermedad44.
Las alteraciones en la bioquímica hepática son frecuentes en pacientes con COVID-197 y se relacionan con las formas más graves de la enfermedad y los tratamientos administrados45. Sus manifestaciones radiológicas pueden ser inespecíficas, como la presencia de edema periportal, alteración difusa del hígado o esteatosis6,46. Un estudio47 describe la presencia de distensión y barro vesicular debido a colestasis en el 54% de los pacientes estudiados, más frecuentemente en enfermos en cuidados intensivos.
Las manifestaciones radiológicas de la afectación intestinal descritas son el engrosamiento y realce de la pared intestinal tanto colorrectal como del intestino delgado43,46,47, y la presencia de neumatosis y gas portal (en el 20% de los ingresados en UCI estudiados por imagen47) que se relacionó con isquemia en la laparotomía.
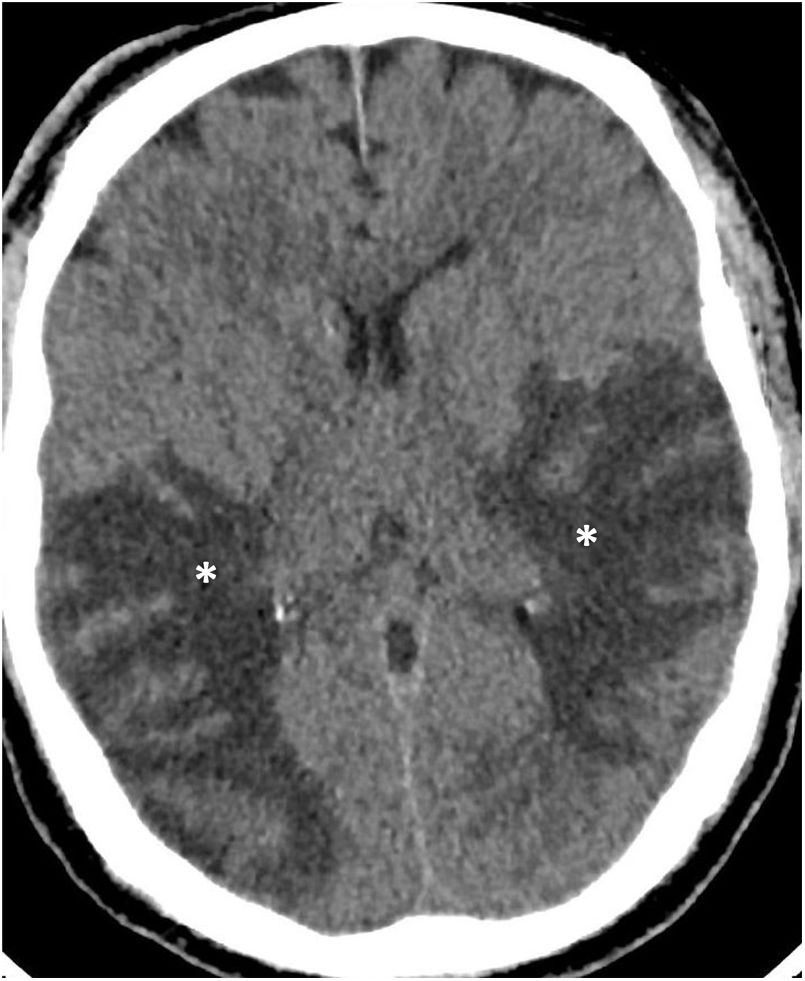
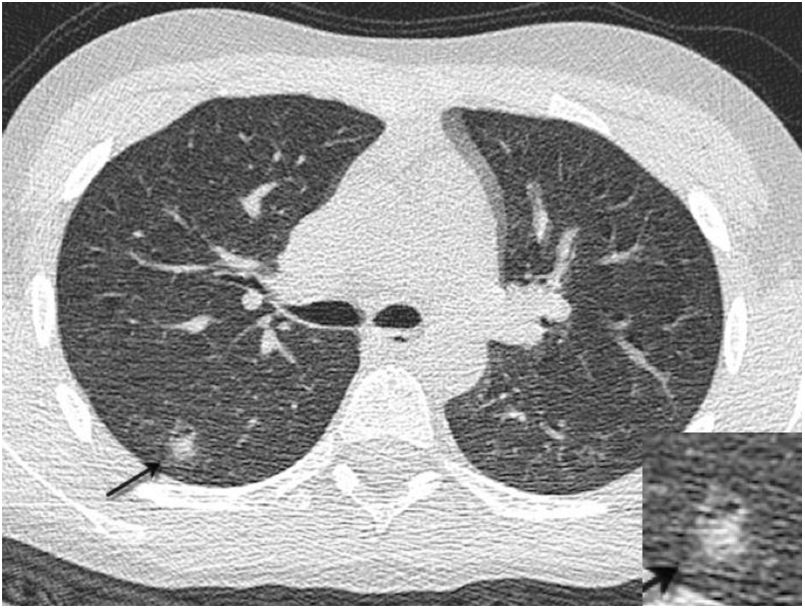
También se ha encontrado asociación de COVID-19 y pancreatitis aguda48, así como esplenomegalia e infartos esplénicos (fig. 1B) en un pequeño porcentaje de enfermos46.
Manifestaciones renales y genitourinariasSe han descrito alteraciones renales frecuentes en COVID-19, manifestándose principalmente con insuficiencia renal, con una etiología habitualmente multifactorial que incluye la propia afectación por el virus, el cuadro inflamatorio sistémico y las alteraciones de la coagulación y en algunos casos secundarias a rabdomiólisis3,6,49, y que se asocian con mayor gravedad y mortalidad de la infección50.
No se han publicado series amplias de la valoración ecográfica de estos pacientes, aunque son esperables un aumento de la ecogenicidad y la alteración de la diferenciación corticomedular6,51.
En la TC sin contraste se puede identificar disminución de la atenuación del parénquima renal y alteraciones de la grasa perirrenal52 que se correlacionan con la alteración de los niveles de creatinina, y en los estudios con contraste se describen infartos renales47 (hasta en el 20% en una serie46) y se puede demostrar disminución de la perfusión renal, hallazgo que puede incluso preceder a la alteración de la función renal53.
La pared vesical puede estar engrosada o mostrar signos de cistitis46.
Finalmente, en el espectro de lesiones genitourinarias se observa asociación de COVID-19 con dolor testicular y casos de orquitis en relación con la infección54.
Alteraciones musculoesqueléticasLa afectación del sistema musculoesquelético que requiera ser evaluada por imagen es infrecuente, a pesar de que las mialgias y las artralgias son un síntoma muy frecuente55. Se han descrito miositis y rabdomiólisis que se manifiestan como edema en las diferentes técnicas de imagen, que en casos avanzados pueden conducir a necrosis6. La artritis por el virus es infrecuente, aunque se ha descrito también el desencadenamiento de alguna enfermedad reumatológica por la enfermedad55. Por último, pueden presentarse lesiones de origen vascular en las partes blandas, tanto por trombosis con gangrena como complicaciones hemorrágicas; entre ellas destacan los hematomas de los rectos y una localización inusual, pero que puede ser característica de estos pacientes, que son los hematomas de los músculos iliopsoas, descritos en una serie hasta en 7,8 por cada 1000 hospitalizados56.
Manifestaciones cutáneas y ocularesIncluyen sabañones, erupción eritematosa, exantema viral y urticaria generalizada, habitualmente autolimitadas. Su interés radica en que constituyen un marcador de la infección, siendo a veces su única manifestación6. Las manifestaciones oculares más frecuentes son dolor, secreción, enrojecimiento y conjuntivitis folicular6.
Imagen de la afectación por COVID-19 en niñosLa infección por SARS-CoV-2 puede afectar a niños de todas las edades, con manifestaciones clínicas menos graves que en los adultos57–59. Fiebre, tos y disnea son los síntomas más frecuentes, siendo los síntomas gastrointestinales, la rinorrea, el dolor torácico o la cefalea menos comunes60,61. Se ha descrito la transmisión perinatal materna, que se traduce en una enfermedad asintomática o leve en los recién nacidos62.
Afectación pulmonar pediátricaHasta la fecha hay pocos estudios sobre el diagnóstico por imagen de la COVID-19 en edad pediátrica. En un estudio con 91 casos confirmados, el hallazgo más frecuente en la radiografía de tórax fue el engrosamiento de la pared peribronquial/perihiliar61. Los niños que tienen una evolución más grave y requieren ingreso en UCI muestran opacidades en vidrio deslustrado y consolidaciones multifocales bilaterales en la radiografía de tórax63.
El hallazgo radiológico más frecuente en TC son las opacidades en vidrio deslustrado, visibles entre el 62% y el 81% de los casos, afectando predominantemente a los lóbulos inferiores. Las consolidaciones, las lesiones intersticiales y el patrón en árbol en brote también han sido descritos60,61. El engrosamiento de la pared peribronquial/perihiliar64 y el signo del “halo”65 (fig. 10), definido como un área de consolidación rodeado de un anillo de opacidad en vidrio deslustrado, son más frecuentes en niños que adultos con COVID-19. Las adenopatías, la cavitación y el derrame pleural son raros en esta enfermedad60. La mayoría de los casos en los que se obtuvieron estudios de seguimiento mostraron mejoría radiológica.
Niño de 12 años con tumor de Wilms con fiebre, tos y PCR positiva para SARS-CoV-2. En la tomografía computarizada prequirúrgica se observaron múltiples pequeñas consolidaciones seudonodulares (flecha) con un halo en vidrio deslustrado (signo del “halo”) en la periferia de ambos lóbulos inferiores, que desaparecieron en la TC obtenida dos semanas después.
Los estudios realizados hasta la fecha han mostrado que los hallazgos de imagen de la infección por SARS-CoV-2 en niños son inespecíficos, sin poder distinguir esta infección de otras enfermedades virales ni bacterianas de la vía aérea61.
Dada la ausencia de hallazgos o su poca especificidad en la radiografía y la TC de tórax, es poco probable que la imagen apoye o descarte el diagnóstico de sospecha o cambie el manejo clínico. Por lo tanto, no se recomienda hacer estudios de imagen para el cribado de la infección por SARS-CoV-2 en la edad pediátrica66. Si clínicamente se considera indicado, la radiografía debe ser la primera prueba de imagen66..La TC debe reservarse para casos en los que se sospechen complicaciones, en particular en niños con otras patologías asociadas (fig. 10). La ecografía puede tener un papel en el seguimiento de la COVID-19 en las UCI pediátricas67, pero no se recomienda de rutina por el riesgo al que se expone el personal sanitario66. En edad pediátrica no se recomienda el uso de informes estandarizados que sugieran o descarten la presencia de esta infección66.
Afectación neurológica pediátricaLos hallazgos de neuroimagen más frecuentemente encontrados en niños con afectación neurológica asociada a infección por SARS-CoV-2 fueron patrones similares a la encefalomielitis diseminada aguda, focos de mielitis y realce neural. Las complicaciones neurovasculares son menos frecuentes que en adultos y la mayoría de estos pacientes evolucionan favorablemente68.
Afectación abdominal pediátricaHay poca bibliografía referente a patología abdominal asociada a la infección por SARS-CoV-269, siendo más frecuentemente descrita asociada al síndrome inflamatorio multisistémico pediátrico temporalmente asociado con SARS-CoV-2. Dolor abdominal, vómitos y diarrea pueden ser síntomas de presentación de esta infección en la edad pediátrica61. Los hallazgos más frecuentemente encontrados en niños que requirieron pruebas de imagen fueron cambios inflamatorios en el íleon terminal, ligera cantidad de ascitis y adenopatías mesentéricas69.
Síndrome inflamatorio multisistémico pediátrico temporalmente asociado con SARS-CoV-2En abril de 2020, pediatras de Inglaterra y Estados Unidos detectaron un aumento de casos con características similares al shock séptico, con signos de miocarditis y síntomas parecidos a la enfermedad de Kawasaki y sugirieron una posible relación con la infección por SARS-CoV-270,71. Desde entonces se han descrito más de mil casos en centros de todo el mundo72,73.
El diagnóstico del síndrome inflamatorio multisistémico pediátrico (MIS-C) que se ha asociado con la infección por SARS-CoV-2 es complejo y multidisciplinar. Requiere elevación de los marcadores bioquímicos de inflamación, ausencia de otra causa infecciosa, signos de disfunción orgánica (p. ej., hipotensión, shock o disfunción miocárdica) y que se dé en regiones con alta prevalencia de infección por SARS-CoV-274,75. Las formas de presentación más frecuentes son fiebre, síntomas gastrointestinales, exantema cutáneo y conjuntivitis. Muchos de los niños muestran hallazgos de imagen y laboratorio sugestivos de afectación cardiaca, con un deterioro clínico que requiere ingreso en la UCI. Los síntomas respiratorios al inicio son infrecuentes y sugieren infección pulmonar aguda por SARS-CoV-276.
La fisiopatología de esta enfermedad parece relacionada con una reacción inmunológica posviral tardía mediada por citoquinas, más que a un ataque directo del virus a los órganos77. Por lo tanto, los estudios de serología deben presentar aumento de la inmunoglobulina G con RT-PCR negativa76.
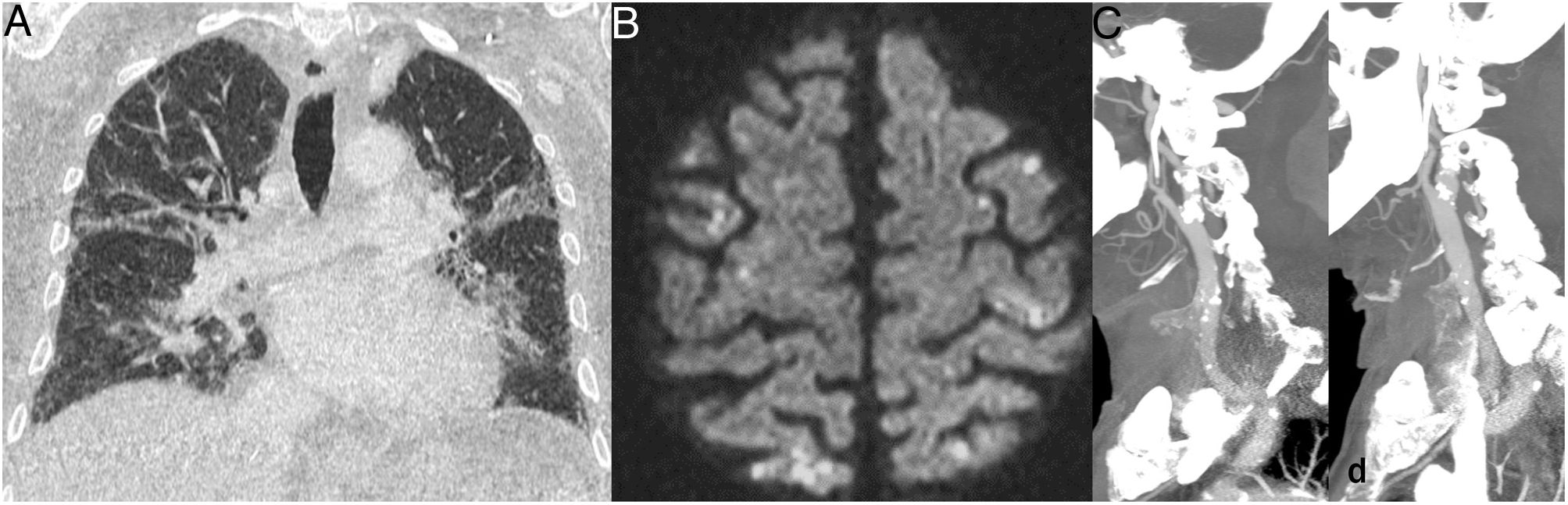
Los hallazgos más frecuentes en la radiografía y TC de tórax son signos de congestión venosa pulmonar y de un proceso inflamatorio pulmonar agudo, que van desde una afectación leve a signos de síndrome de distrés respiratorio agudo (fig. 11A). Cardiomegalia, engrosamiento peribronquial/perihiliar bilateral, opacidades perihiliares en vidrio deslustrado o consolidaciones son algunos de los hallazgos radiológicos más frecuentes76.
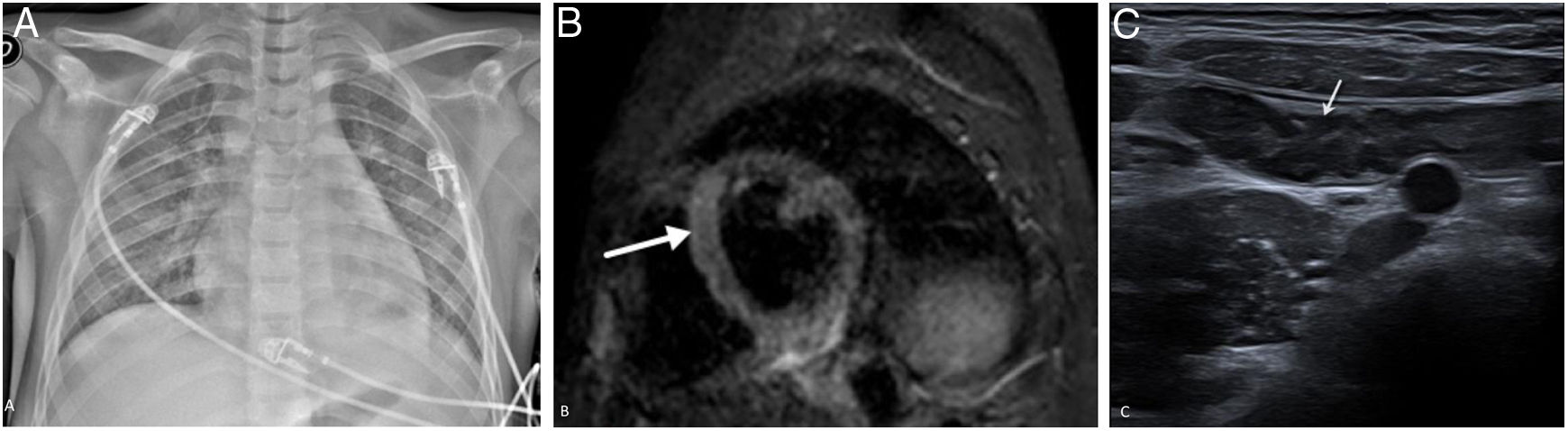
Niño de 10 años con fiebre, exantema, dolor abdominal, torácico y diarrea. Mostró signos clínicos, analíticos y de imagen sugestivos de miocarditis, por lo que requirió ingreso en la UCI, donde se le diagnosticó de MIS-C asociado a SARS-CoV-2. La PCR para SARS-CoV-2 realizada 6 días tras el inicio de síntomas fue negativa y la inmunoglobulina G, positiva a los 8 días. La radiografía (A) al ingreso en la UCI mostró signos de edema pulmonar, cardiomegalia, opacidades en vidrio deslustrado bilaterales, atelectasias laminares basales y ligero derrame pleural izquierdo. En la resonancia magnética cardiaca se identificó un foco de miocarditis en el septo del ventrículo izquierdo (flecha) y ligero derrame pericárdico en la secuencia STIR eje corto (B). En la ecografía abdominal se observó, ileitis (C), así como una ileitis hepatoesplenomegalia, ascitis y material hiperecogénico inespecífico en la vesícula (no mostrados).
Mediante ecocardiografía y RM se detectaron signos de disfunción del ventrículo izquierdo, con disminución de la fracción de eyección y en algunos casos, derrame pericárdico78,79. La RM cardiaca es útil en este escenario para detectar edema, fibrosis/isquemia del miocardio y, en un algún caso, dilatación de las arterias coronarias73. El patrón de la imagen de esta enfermedad se asemeja más a una miocarditis (edema y derrame pericárdico) (fig. 11B) que a la enfermedad de Kawasaki (aneurismas).
Esta patología también puede afectar al tracto gastrointestinal, y los hallazgos más frecuentes son inflamación del íleon terminal y ligera ascitis (fig. 11C). Hepatomegalia, esplenomegalia, infartos de los órganos sólidos abdominales, edema perivesicular/periportal, aumento de la ecogenicidad de la corteza renal y adenopatías son también hallazgos comunes76,80. La afectación del sistema nervioso central es posible en esta enfermedad, mostrando focos de restricción de la difusión en el cuerpo calloso y realce leptomeníngeo en la imagen en RM81.
ConclusiónConocer las manifestaciones en pruebas de imagen de las alteraciones neurológicas, vasculares, gastrointestinales, genitourinarias y cutáneas de la infección por el virus SARS-CoV-2 en el adulto, así como la expresión de la enfermedad en niños, será primordial para mejorar el manejo. El daño multiorgánico de la COVID-19 sugiere una fisiopatogenia compleja, multifactorial y poco conocida, y conlleva una elevada morbimortalidad. Las manifestaciones neurológicas y cutáneas pueden aumentar la especificidad de nuestro diagnóstico, y las complicaciones trombóticas, por su gravedad y frecuencia, determinan especialmente el pronóstico.
Autoría- 1.
Responsable de la integridad del estudio: JMPM.
- 2.
Concepción del estudio: JJAJ.
- 3.
Diseño del estudio: JJAJ. JMPM.
- 4.
Obtención de los datos: N/A.
- 5.
Análisis e interpretación de los datos: N/A.
- 6.
Tratamiento estadístico: N/A.
- 7.
Búsqueda bibliográfica: JMPM, AR, PCD, IB, EGG, JJAJ.
- 8.
Redacción del trabajo: JMPM, AR, PCD, IB, EGG, JJAJ.
- 9.
Revisión crítica del manuscrito con aportaciones intelectualmente relevantes: JMPM, AR, PCD, IB, EGG, JJAJ.
- 10.
Aprobación de la versión final: JMPM, AR, PCD, IB, EGG, JJAJ.
Los autores declaran no tener ningún conflicto de intereses.
Queremos agradecer al Dr. Luis Gorospe (Sección de Radiología Tóracica, Hospital Ramón y Cajal, de Madrid) y a la Dra. Cristina Utrilla (Sección de Neurorradiología. Hospital La Paz, de Madrid) la cesión de algunas de las imágenes para la preparación del trabajo.