La densidad mamaria elevada y su relación con el riesgo de cáncer de mama se ha convertido en un tema muy presente en la literatura médica y en la prensa no especializada, fundamentalmente en Estados Unidos, donde en los últimos años ha generado cambios legislativos que obligan a informar sobre la densidad a médicos y a pacientes.
El radiólogo, responsable principal de esta información, debe conocer la evidencia científica y las controversias existentes en este tema centradas en la importancia real del riesgo, la limitación que supone no disponer de métodos de medición estandarizados y la posible aplicación de técnicas complementarias de cribado (la ecografía, la resonancia magnética o la tomosíntesis), sobre las que no existen recomendaciones claras.
Son necesarios estudios controlados que valoren la aplicación de estas técnicas en mujeres con mamas densas, incluido el estudio del posible sobrediagnóstico que podría producirse.
High breast density and its relationship to the risk of breast cancer has become a hot topic in the medical literature and in the lay press, especially in the United States, where it has brought about changes in the legal framework that require radiologists to inform clinicians and patients about breast density.
Radiologists, who are mainly responsible for this information, need to know the scientific evidence and controversies regarding this subject. The discussion is centered on the real importance of the risk, the limitation that not having standardized methods of measurement represents, and the possible application of complementary screening techniques (ultrasound, magnetic resonance imaging, or tomosynthesis) for which clear recommendations have yet to be established.
We need controlled studies that evaluate the application of these techniques in women with dense breasts, including the possibility that they can lead to overdiagnosis.
La densidad mamaria elevada es un factor de riesgo de cáncer de mama en sí mismo y, además, condiciona un efecto de enmascaramiento que limita la detección de las lesiones. No es un problema menor, ya que afecta a casi el 50% de las mujeres incluidas en los programas de cribado1.
En Estados Unidos ha condicionado cambios legislativos2–4 que obligan a informar a médicos y a pacientes sobre la densidad mamográfica para que decidan conjuntamente si son necesarias otras técnicas complementarias a la mamografía en el cribado de estas pacientes.
Nuestro objetivo es revisar la importancia de la densidad mamaria como factor de riesgo y la reducción de sensibilidad que condiciona en la mamografía, analizar los diferentes sistemas de medición con sus limitaciones y las técnicas de imagen complementarias que se proponen en estas mujeres.
Densidad mamaria y riesgo de cáncer de mamaEl riesgo de cáncer de mama en las mujeres con densidad elevada se define en relación con dos aspectos:
- 1.
Factor de riesgo per se.
El mayor porcentaje de tejido epitelial en las mamas densas actuaría como factor favorecedor del desarrollo de un cáncer de mama y supondría un incremento del riesgo, si bien se debate ampliamente en qué grado lo es.
El metaanálisis de Mc Cormack5 obtiene un riesgo relativo (RR) asociado a mamas densas de 2,92 para mamas de densidad 50-74% (C) y 4,64 para mamas con densidad mayor o igual al 75% (D).
Otros trabajos publicados concluyen que la densidad mamaria elevada puede aumentar hasta 6 veces el riesgo, y que este riesgo se mantiene en el tiempo6,7, si bien es importante destacar que en general en estos trabajos se compara el riesgo entre mujeres con patrones extremadamente densos frente a patrones casi completamente grasos, comparación válida solo para el 20% de las mujeres, no extrapolable a las pacientes con patrones B y C, el 80% restante.
Cuando se expresa relativo a densidad mamaria media, el riesgo para la categoría C es 1,2 veces mayor y para la categoría D, 2,1 veces mayor8; supone, por tanto, un incremento moderado del riesgo, menor que la edad, el historial familiar, los antecedentes personales o las mutaciones genéticas.
En el metaanálisis de Pettersson, que incluía 13 estudios en los que se midió la densidad de forma automática, el riesgo (odds ratio) fue de 1,37 (intervalo de confianza [IC] al 95%, 1,29-1,47) en premenopáusicas y de 1,38 en posmenopáusicas (IC 95%, 1,31-1,44)9.
También es un tema controvertido el efecto que tiene la disminución de la densidad en el riesgo. En estudios realizados en pacientes con cáncer de mama tratadas con tamoxifeno se ha demostrado que un descenso de la densidad mamaria va asociado a una mayor supervivencia10.
- 2.
Efecto enmascaramiento de lesiones.
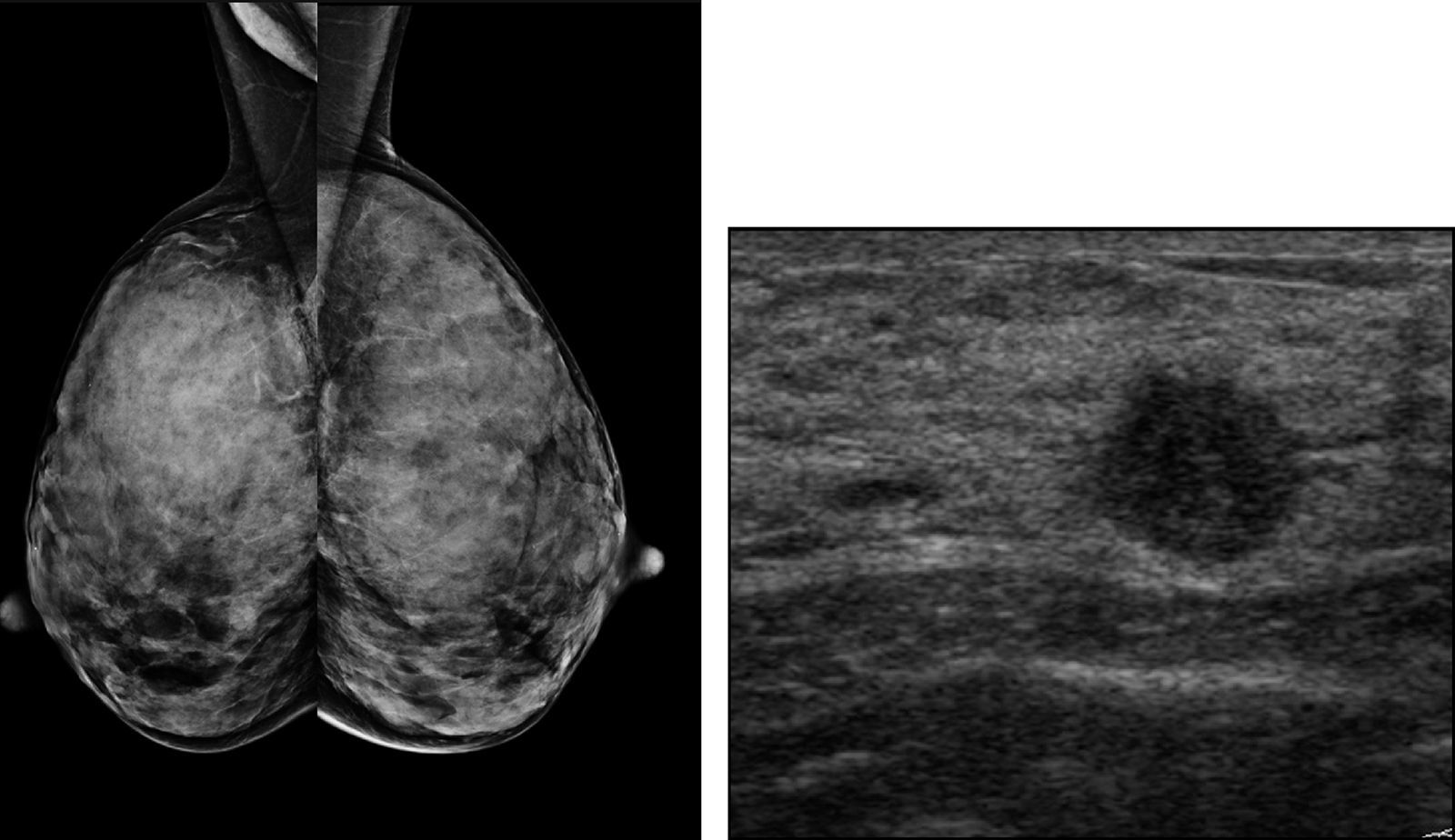
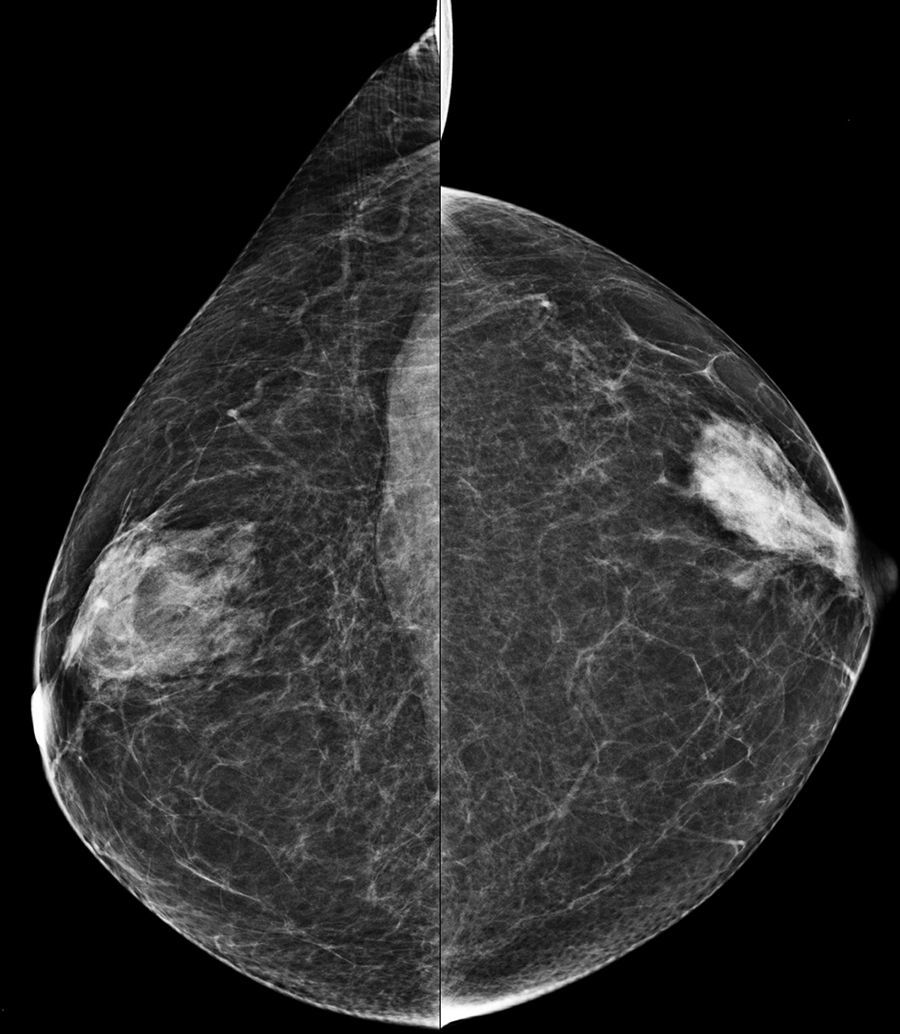
La densidad mamaria elevada oculta la visualización de lesiones de similar densidad radiológica, lo que disminuye la sensibilidad de la mamografía, llegando hasta el 30-48% en mujeres con mamas extremadamente densas11. Además, está demostrado un mayor porcentaje de carcinomas de intervalo y de tumores de mayor tamaño con ganglios positivos en el cribado de mujeres con patrones densos6 (fig. 1).
Densidad mamográfica. Métodos de mediciónLa densidad mamográfica representa la cantidad relativa de tejido fibroglandular que atenúa los rayos X en la mamografía. Se han desarrollado varias clasificaciones de la densidad a partir de la primera clasificación de Wolfe, todas ellas subjetivas12.
El método más utilizado es la categorización BI-RADS (tabla 1), que clasifica la densidad en cuatro patrones, inicialmente desde un abordaje cualitativo y posteriormente basándose en porcentajes de tejido fibroglandular13. La 5.a edición del BI-RADS14 desaconseja la utilización de porcentajes y considera más importante la posibilidad de que una lesión quede oscurecida por tejido denso (fig. 2).
Descripción del patrón de densidad. Clasificación BI-RADS (Breast Imaging-Reporting and Data System)
| ATLAS BI-RADS 2013 | ATLAS BI-RADS 2003 | ATLAS BI-RADS 1998 |
|---|---|---|
| a=las mamas son casi totalmente grasas | 1=las mamas son casi totalmente grasas (<25% glandular) | 1=las mamas son casi totalmente grasas |
| b=hay áreas dispersas de tejido fibroglandular | 2=hay áreas dispersas de tejido fibroglandular (aproximadamente 25-50% glandular) | 2=hay áreas dispersas de tejido fibroglandular |
| c=las mamas son heterogéneamente densas, lo que puede ocultar masas pequeñas | 3=las mamas son heterogéneamente densas, lo que puede ocultar masas pequeñas (51-75% glandular) | 3=las mamas son heterogéneamente densas, lo que puede disminuir la sensibilidad de la mamografía |
| d=las mamas son extremadamente densas, lo que disminuye la sensibilidad de la mamografía | 4=las mamas son extremadamente densas, lo que disminuye la sensibilidad de la mamografía (>75% glandular) | 4=las mamas son extremadamente densas, lo que puede ocultar una lesión en la mamografía |
Por consenso, se consideran como mamas densas las categorías C y D, y mamas no densas las categorías A y B. La distribución de estas categorías en la población cribada sería aproximadamente del 10% la A, 40% la B, 40% la C y 10% la D1.
No existe un estándar de medición de la densidad mamográfica. La revisión sistemática (2016) de la U.S. Preventive Service Task Force recoge cinco estudios que evalúan la reproducibilidad secuencial de la categoría BI-RADS y concluye que esta es moderada y mayor cuando los estudios son leídos por el mismo radiólogo (a una de cada cinco mujeres se le modifica la categoría en el segundo cribado cuando la lectura la realiza el mismo radiólogo frente a una de cada tres cuando el estudio es leído por radiólogos diferentes)15 y lo que es más importante, si se agrupa a las mujeres en categorías “densa y no densa”, de un 12,6% a un 18,7% son reclasificadas en un sentido o en otro en estudios consecutivos14. Esta variabilidad disminuye la confianza de la mujer, limita la inclusión de la densidad en los modelos de riesgo y por tanto dificulta la implantación de cribados específicos para pacientes con otros riesgos añadidos.
Se han desarrollado métodos cuantitativos (semiautomáticos y automáticos) que pretenden conseguir un modelo reproducible, más exacto y fiable del porcentaje de densidad mamaria a partir de la imagen mamográfica en 2D. Estos métodos calculan la relación entre el área o volumen de tejido denso respecto al total de la mama, y convierten este porcentaje a la categoría BI-RADS correspondiente. Actualmente hay dos programas de software aprobados por la Food and Drug Administration, Quantra® (Hologic-Bedford, Massachusetts) y Volpara® (Matakina International, Wellington, New Zeeland)12. Estos sistemas son caros, no están exentos de variabilidad y podrían no reflejar las modificaciones de la 5.a edición del BI-RADS. También se están desarrollado sistemas volumétricos de cálculo de densidad mamaria en modalidades 3D (RM y tomosíntesis)16.
No hay consenso en determinar cuáles son los sistemas más fiables y reproducibles para valorar la densidad mamaria; no obstante, los estudios más recientes confirman que los métodos volumétricos son más exactos.
Cribado complementario. Evidencias y controversiasLa menor sensibilidad, el mayor porcentaje de falsos negativos y el incremento de carcinomas de intervalo en mujeres con mamas densas han generado la necesidad de plantear técnicas de imagen complementarias a la mamografía digital (MD) que es de elección en estas mujeres17. Se han evaluado como técnicas complementarias la ecografía manual, la automática (ABUS), la RM y la tomosíntesis.
Cribado ecográficoLa ecografía complementaria ha demostrado un incremento en la tasa de detección (4,4/1000), fundamentalmente a expensas de cánceres invasivos y de pequeño tamaño, pero tiene inconvenientes como son valores predictivos positivos (VPP3) bajos (10-11%) y un incremento de la tasa de rellamadas y de biopsias11,17–19 como demuestran los resultados del primer estudio prospectivo y multicéntrico (ACRIN 6666), que incluye tres rondas con periodicidad anual. El incremento en la tasa de detección con ecografía en este estudio fue de 4,2/1000 (5,3/1000 en primera ronda y 3,7/1000 en sucesivas), con un VPP3 del 6,8%, una tasa de biopsias de 68/1000 y de rellamadas del 13,9%. El 92% de los cánceres detectados fueron invasivos, con tamaño medio de 10mm y el 89% con ganglios negativos. El tiempo medio por estudio fue de 19min en la primera ronda11,19. La población incluida fue muy heterogénea, con un elevado porcentaje de pacientes de riesgo incrementado. Una vez eliminadas las pacientes de riesgo incluidas en el estudio, el VPP fue del 3% y valor predictivo negativo (VPN), del 99%15.
La revisión de Scheel18 pone de manifiesto la gran heterogeneidad de los estudios publicados en cuanto al diseño, la técnica de mamografía empleada, la clasificación de patrones y los criterios de inclusión de las mujeres, con un alto porcentaje de mujeres de riesgo incluidas en las series, lo que limita la extrapolación de estos datos a la población general.
Los tres estudios retrospectivos realizados en Connecticut tras la aprobación de la legislación sobre densidad mamaria reflejan mejor la práctica habitual del cribado. En estos, la tasa de detección incremental fue de 1,8-3,2/100017.
Hay poca evidencia sobre el efecto del cribado con ecografía sobre la tasa de carcinomas de intervalo. Corsetti no demostró descenso en los carcinomas de intervalo al añadir ecografía en mujeres con mamas densas20; sin embargo, en el primer ensayo clínico aleatorizado publicado, realizado en población japonesa (J-START) se objetiva una disminución significativa en el porcentaje de carcinomas de intervalo (18 frente a 35; p=0,034)21.
Con el objeto de disminuir la variabilidad condicionada por el operador, acortar los tiempos de radiólogo y disminuir los costes, se han desarrollado sistemas automáticos de ecografía (ABUS) como alternativa a la ecografía manual. Hay poca evidencia al respecto y la calidad de los estudios es limitada15. Los resultados son variables: tasas de detección de 3,6/1000 con tasa de rellamadas de 87/100022 frente a tasas de detección de 15,21/1000 (4,6/1000 utilizando solo mamografía) con un porcentaje de rellamadas de 15/1000, inusualmente bajo23. Se precisan estudios que determinen su utilidad y el coste-beneficio de estos equipos en mujeres con mamas densas.
Cribado con resonancia magnéticaHay pocos estudios que evalúen la RM en este contexto; la tasa de detección del estudio ACRIN 6666 fue de 14,7/100016,19, de 14,9/1000 en el estudio EVA24 y de 18,2/1000 en un estudio con protocolo abreviado posterior25, con un VPP del 22,2% y un VPN del 99,9% y sin carcinomas de intervalo en 2 años de seguimiento.
Pese a su tasa de detección elevada, la especificidad es moderada y son frecuentes los falsos positivos. No obstante, es una técnica cara, larga y poco accesible que condiciona exposición reiterada al gadolinio. La secuencia de difusión podría incrementar la especificidad y evitar el uso de contraste intravenoso.
Se ha demostrado un aumento de la supervivencia utilizando la RM en mujeres con riesgo familiar, pero no hay estudios específicos en mujeres con mamas densas26. El estudio DENSE (en fase de reclutamiento) pretende definir el papel de la RM en este subgrupo de pacientes15,17.
Cribado con tomosíntesisLa tomosíntesis podría ser una técnica de cribado en esta población, ya que ha demostrado una tasa de detección incremental del 1,9-2,7/1000, con una disminución del porcentaje de rellamadas y de biopsias27,28, pero hay poca evidencia específicamente en mujeres con mamas densas.
Hay estudios que comparan MD frente a MD + tomosíntesis que muestran mejores resultados en patrones C y D29. Sin embargo, en otros (STORM)30, el incremento en la tasa de detección es similar en mamas densas y no densas. El informe de la U.S. preventive Service Task Force15, que analiza este aspecto, no encuentra diferencias entre mamas densas y no densas (4,0-5,2/1000).
En resumen, disponemos de datos insuficientes sobre la efectividad del cribado complementario. Los resultados se han obtenido a partir de estudios observacionales diseñados para determinar el impacto incremental en la detección con cada técnica y la evidencia sobre el impacto en la tasa de carcinomas de intervalo es poca20,21. Además, la población incluida es muy heterogénea (incluyen mujeres de riesgo variable) y por lo tanto es difícil extrapolar los datos a la población general.
No hay estudios sobre el efecto del cribado complementario en la mortalidad por cáncer de mama o beneficios en la supervivencia, a diferencia de los existentes para la mamografía.
No hay organizaciones médicas ni guías clínicas (ACR, NCCN, ACS, ACOG, etc.) que recomienden el cribado complementario con ecografía de modo sistemático15,17,18. Su aplicación se limita a las pacientes de alto riesgo que no toleran la RM.
La American Cáncer Society (ACS) recomienda el uso de la RM como herramienta de cribado en mujeres con riesgo superior al 20-25%, pero no hay evidencia en mujeres exclusivamente con mama densa y son necesarios estudios prospectivos que evalúen el impacto de la tomosíntesis en mujeres con mamas densas frente a la ecografía o la RM.
Legislación. Información a pacientesA partir de una denuncia de una paciente en Connecticut (Estados Unidos) diagnosticada de cáncer de mama, con mamografía reciente normal, que no había sido informada de que sus mamas presentaban elevada densidad surge un movimiento político y social que promueve la legislación, con diferentes matices, sobre la comunicación de la densidad mamaria1–4,28 pese a la cautela de la comunidad médica, dada la falta de evidencia que soporte el cribado complementario2.
La Breast Density and Mamography Reporting Act, presentada en el congreso en octubre de 2013, obliga a enviar a las pacientes una carta tipo que incluye información sobre su densidad mamográfica y la posibilidad de pruebas de cribado complementarias. Lamentablemente, el médico responsable del proceso de información posterior no dispone de guías clínicas que puedan orientarle en la toma de decisiones.
En España, pese a que la población femenina, en general, está bastante sensibilizada respecto a la importancia del diagnóstico precoz en el cáncer de mama, no se ha generado ninguna corriente de opinión que presione para legislar al respecto. En cualquier caso, es recomendable que se incluya el patrón de densidad en el informe mamográfico y su efecto sobre la sensibilidad de la mamografía.
ConclusionesLa densidad mamaria es un factor de riesgo independiente de cáncer de mama de mediana importancia frente a otros como la edad, el estado menopáusico y hormonal o el riesgo familiar, pero tiene una importancia estadística significativa, ya que afecta a casi el 50% de la población1.
No se dispone de un estándar de medición y la reproducibilidad del sistema BI-RADS es moderada, lo que dificulta la inclusión de la densidad en los modelos de riesgo.
La mamografía es la técnica de elección, ya que ha demostrado reducción de la mortalidad en el cribado. La aplicación de técnicas adicionales es controvertida, no hay una técnica ideal; la ecografía genera un coste considerable, rellamadas, seguimientos y biopsias innecesarias por falsos positivos; además, su aplicación de forma masiva en los cribados poblacionales exigiría de una inversión elevada en radiólogos expertos en ecografía o, en su defecto, técnicos debidamente acreditados (este aspecto no es una realidad en nuestro país). La opción más realista es su aplicación individual, en función del riesgo general de la paciente y explicando ventajas e inconvenientes.
La RM es la técnica más sensible, pero no está claro que el beneficio se vea compensado por el coste y los riesgos asociados; tanto para la RM como para la tomosíntesis, que a priori parece una técnica aplicable en este contexto, se precisa de más evidencia.
La legislación, que regula la información a pacientes y facultativos, hace copartícipes a las pacientes de su cribado. No obstante, tiene inconvenientes: genera ansiedad en las pacientes e inseguridad en la mamografía. Estas difícilmente comprenden algunos aspectos que se han tratado aquí: que un riesgo potencialmente grave y con implicaciones se base en una evaluación subjetiva de la densidad (se precisan métodos de medida seguros y reproducibles) y que no existan claras alternativas de cribado complementario (se precisan estudios controlados que valoren las técnicas alternativas de cribado en este contexto incluido el posible sobrediagnóstico) ni modelos de cálculo del riesgo que incluyan a la densidad mamaria. En estos aspectos, los radiólogos tenemos un papel decisivo.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Autoría- 1.
Responsabilidad de la integridad del estudio: CCG.
- 2.
Concepción del estudio: CCG.
- 3.
Diseño del estudio: CCG y CEB.
- 4.
Obtención de los datos: CCG y CEB.
- 5.
Análisis e interpretación de los datos: CCG y CEB.
- 6.
Tratamiento estadístico: no procede.
- 7.
Búsqueda bibliográfica: CCG y CEB.
- 8.
Redacción del trabajo: CCG, CEB.
- 9.
Revisión crítica del manuscrito con aportaciones intelectualmente relevantes: CCG y CEB.
- 10.
Aprobación de la versión final: CCG y CEB.
Las autoras declaran no tener ningún conflicto de intereses.