Las malformaciones vasculares y los tumores, también conocidos como «anomalías vasculares», comprenden una extensa variedad de lesiones en diferentes partes del cuerpo. Conocer su clasificación y características en las imágenes es de vital importancia. Si bien los hemangiomas son tumores vasculares benignos caracterizados por proliferación celular e hiperplasia, las malformaciones vasculares no son verdaderos tumores y muestran, típicamente, una renovación endotelial normal. Las malformaciones vasculares se clasifican, según el vaso predominante, en arteriales, capilares, venosas, linfáticas o mixtas. La ecografía y la resonancia magnética son las técnicas de imagen que se usan en el diagnóstico y la clasificación de las anomalías vasculares. En esta serie de dos artículos revisaremos la clasificación de las anomalías vasculares, describiremos el papel que desempeñan las pruebas de imagen, resumiremos sus características histopatogénicas, clínicas y de imagen, y comentaremos las posibles opciones terapéuticas. En este primer artículo hablamos de las lesiones de alto flujo, y en el segundo lo haremos de las de bajo flujo. También trataremos los síndromes complejos asociados tanto a los tumores vasculares como a las malformaciones.
Vascular malformations and tumors, also known as “vascular anomalies”, comprise an extensive variety of lesions involving all parts of the body. Knowledge of their classification and imaging characteristics is paramount. Whereas hemangiomas are benign vascular tumors, characterized by cellular proliferation and hyperplasia; vascular malformations are not real tumors and characteristically exhibit normal endothelial turnover. Vascular malformations are classified according to the predominant vascular channel as arterial, capillary, venous, lymphatic, or mixed. Ultrasound and MRI are the main imaging modalities used in the diagnosis and classification of the vascular anomalies. In this series of two articles we review the classification of vascular anomalies, describe the role of imaging, summarize their distinctive histopathogenic, clinical and imaging features, and discuss the treatment options. On the first article we discuss the high-flow lesions, whereas the slow-flow lesions will be reviewed on the second. Complex syndromes with associated vascular tumors and malformations will be also presented.
Las malformaciones vasculares y los tumores, también conocidos como «anomalías vasculares», comprenden una extensa variedad de lesiones en diferentes partes del cuerpo, siendo los tumores infantiles de partes blandas los más comunes1. Conocer su clasificación y características clínicas y de imagen es de vital importancia en el manejo de estos pacientes.
El origen y la histopatología de estas lesiones no es del todo conocido, por ello este campo se ha visto ensombrecido por el uso de una nomenclatura poco clara. Por ejemplo, el término «hemangioma cavernoso» se utiliza indistintamente para describir tanto tumores vasculares infantiles benignos (hemangiomas infantiles) como malformaciones vasculares de alto flujo no neoplásicas (malformaciones venosas). Esto puede generar confusión, diagnósticos erróneos y tratamientos incorrectos, ya que las opciones terapéuticas dependen en gran medida de una clasificación precisa.
Aunque su diagnóstico suele ser clínico, las pruebas de imagen desempeñan un papel importante en casos dudosos. Además, la imagen es crucial en la valoración del tamaño y la relación con los tejidos adyacentes, así como su respuesta al tratamiento.
El objetivo de esta serie de dos artículos es revisar la actual clasificación de las anomalías vasculares, describir el papel de las pruebas de imagen en su diagnóstico, resumir sus características histopatogénicas, clínicas y de imagen, y comentar las posibles opciones de tratamiento. En este primer artículo hablamos de las lesiones de alto flujo, y en el segundo lo haremos de las de bajo flujo. También trataremos los síndromes complejos asociados tanto a los tumores vasculares como a las malformaciones.
Clasificación de las anomalías vascularesLo que sabemos sobre anomalías vasculares se lo debemos, en gran medida, al trabajo de Mulliken y Glowacki2, quienes establecieron la clasificación de las lesiones vasculares más aceptada. Esta se basa en la renovación celular, la histología, la evolución natural y los hallazgos físicos. Básicamente dividen las anomalías vasculares en dos clases: hemangiomas y malformaciones vasculares.
Los hemangiomas son tumores vasculares benignos que se caracterizan por la presencia de proliferación celular e hiperplasia, que inicialmente muestran una rápida fase proliferativa, seguida de una fase involutiva. Las malformaciones vasculares no son verdaderos tumores; se cree que son el resultado de un error congénito de morfogénesis vascular entre las semanas 4 y 10 de vida intrauterina3. Las malformaciones vasculares muestran, de manera característica, una renovación endotelial normal y aumentan de tamaño proporcionalmente durante el crecimiento del niño, sin regresión. Las malformaciones vasculares se subclasifican, según el vaso predominante, en arteriales, capilares, venosas, linfáticas o mixtas.
Posteriormente se propuso una clasificación radiológica de las malformaciones vasculares que pretendía ayudar a planificar el tratamiento y las clasificaba, atendiendo a su dinámica de fluidos, como malformaciones de alto y de bajo flujo4. Las malformaciones que tienen un componente arterial se consideran de alto flujo, y las que carecen de dicho componente arterial son malformaciones de bajo flujo.
Incorporando la clasificación radiológica y la descripción original de Mulliken y Glowacki, la Sociedad Internacional para el estudio de Anomalías Vasculares5 propuso dos amplios grupos de anomalías vasculares: tumores vasculares (siendo los hemangiomas infantiles los más característicos de este grupo) y malformaciones vasculares (tabla 1).
Clasificación de las anomalías vasculares según la Sociedad Internacional para el Estudio de Anomalias Vasculares
| Tumores vasculares | Malformaciones vasculares | |
|---|---|---|
| Malformaciones vasculares de bajo flujo | Malformaciones vasculares de alto flujo | |
| Hemangioma infantil Hemangioma congénito Hemangioendotelioma kaposiforme Angioma en penacho Hemangiopericitoma Granuloma piogénico | Malformación venosa Malformación linfática Malformación capilar Malformación mixta de bajo flujo | Malformación arteriovenosa Fístula arteriovenosa |
La presentación clínica y la exploración física de las anomalías vasculares suele bastar para establecer el diagnóstico correcto. La ecografía Doppler y la resonancia magnética (RM) suelen ser útiles en casos clínicamente dudosos.
Debido a su gran disponibilidad, no utilización de radiación ionizante y bajo coste, la ecografía suele ser la técnica que primero se realiza6. Tradicionalmente se ha considerado la prueba por excelencia7, aunque presenta limitaciones tales como los limitados campo de visión y penetración y la dependencia del operador8. Se utilizan transductores de diferente frecuencia en función de la profundidad de la lesión. Tanto la ecografía en escala de grises como la ecografía Doppler color ayudan a diferenciar las características de la lesión.
En la actualidad, la RM es la herramienta más útil para la valoración de las anomalías vasculares. Permite establecer el diagnóstico y la clasificación, y ofrece una definición excelente tanto del tamaño de la lesión como del compromiso de estructuras adyacentes9. El protocolo de RM debe incluir imágenes potenciadas en T1 para una valoración anatómica básica, imágenes potenciadas en T2 con supresión de grasa o STIR (short tau inversion recovery) para valorar la extensión de la lesión, y una angiografía (angio-RM) con contraste para evaluar las características vasculares de la lesión. Además, las imágenes potenciadas en T2* con eco de gradiente permiten evaluar la presencia de hemosiderina y calcificación (mostrando, característicamente, una señal baja), y de vasos sanguíneos de alto flujo (que muestran una alta intensidad de señal). La angio-RM con contraste debería realizarse en fase arterial y en varias fases venosas. Además de la angio-RM con contraste tradicional, también se recomienda la “angio-RM con contraste de resolución temporal (“time-resolved” MRA), en caso de que esté disponible. La angio-RM con contraste tradicional obtiene datos en 3D de alta resolución espacial, aproximadamente cada 15-20 segundos, y la angio-RM dinámica con resolución temporal permite obtener datos en 3D cada 1-2 segundos, lo cual ofrece un conjunto de imágenes rápidamente continuas similar a la angiografía por sustracción digital convencional Esta permite una excelente descripción de la hemodinámica de la malformación vascular, la detección del componente arterial y la diferenciación arterial y venosa, lo cual suele ser imposible de lograr con la angio-RM con contraste tradicional, y es importante para poder planificar el tratamiento. La descripción detallada del protocolo de RM seguido en nuestro centro ya ha sido publicada9.
Lesiones de alto flujoComo hemos explicado con anterioridad, las anomalías vasculares con componente arterial se clasifican como de alto flujo, mientras que las que no tienen dicho componente son de bajo flujo. Los tumores vasculares (a excepción de los hemangiomas infantiles en fase involutiva), las malformaciones arteriovenosas y las fístulas arteriovenosas se consideran anomalías vasculares de alto flujo.
Tumores vascularesLos tumores vasculares tienen su origen en angioblastos que dan lugar a vasos sanguíneos10. Pueden subclasificarse según la presencia o ausencia de la proteína transportadora de glucosa (GLUT1) a las células endoteliales, un transportador de glucosa de tipo eritrocitario. Tanto la placenta como los hemangiomas infantiles son los únicos tejidos humanos que expresan esta proteína10; el resto de los tumores vasculares no lo hacen. De hecho, se ha planteado la hipótesis de que los hemangiomas podrían originarse de implantes de placenta embolizados10.
Hay un amplio espectro de tumores vasculares. A continuación, hacemos una revisión de los más comunes.
Hemangioma infantilLos hemangiomas infantiles son tumores mesenquimales. Histopatológicamente muestran varios canales vasculares arteriales alineados por una única capa de células endoteliales gruesas con abundantes mastocitos y tejido fibroso11. Presentan factor de crecimiento endotelial vascular (VEGF) y otras proteínas de superficie que reflejan la rápida renovación celular del tumor10. Como ya se ha mencionado, los hemangiomas infantiles son, característicamente, GLUT positivos10,11, lo que permite distinguirlos del resto de las anomalías vasculares, lo cual posibilita a su vez un mejor diagnóstico y un adecuado tratamiento.
Presentación clínicaSon uno de los tumores más habituales durante la infancia y la niñez1,10,11, y se observan aproximadamente en un 3-10% de los lactantes12,13. No son clínicamente evidentes en el nacimiento y se manifiestan durante las primeras semanas de vida, siendo completamente visibles a los 3 meses. Los hemangiomas infantiles son más habituales en niños caucásicos12,14, sobre todo en las niñas (4:1), y en prematuros de bajo peso8,11,13,15. La preeclampsia, la placenta previa y embarazos múltiples son posibles factores de riesgo materno12. Aparecen en la cabeza y el cuello en el 60% de los casos, en el tronco en el 25%, y en las extremidades en el 15%16–18.
Siguen un patrón bifásico de evolución: proliferación e involución. Durante la fase proliferativa, se manifiestan como una masa subcutánea brillante, de color rojo, con relieve, en forma de fresa, con murmuro audible, pulso y calor8, características todas ellas de una lesión de alto flujo. Cuando la lesión se localiza en la dermis profunda, debajo del cutis o en los músculos, puede presentar una tonalidad azulada y confundirse con una malformación venosa11. En función de su tamaño y ubicación, pueden ser masas muy desfigurantes, e incluso potencialmente letales si provocan la compresión de estructuras vitales como la vía aérea. En muy raras ocasiones, puede provocar insuficiencia cardiaca.
Normalmente, transcurrido un año, la lesión suele remitir (fase involutiva) pasando a tener un tono rojizo tirando a gris oscuro5,13. En la histología se observa una deposición perivascular progresiva de tejido fibrograso y adelgazamiento endotelial8,16. La involución completa se alcanza, en el 50% de los casos, a la edad de 5 años; en el 70% de los casos, a los 7 años; y prácticamente en todos los casos en torno a los 8-12 años de edad17.
Cuando un paciente presenta cinco o más hemangiomas cutáneos debe realizarse una ecografía abdominal para descartar la presencia de hemangiomas en órganos sólidos. Si un paciente presenta un hemangioma en la órbita, debe realizarse una RM para valorar la extensión de la lesión y descartar un hemangioma intraorbitario oculto.
Características de imagenSu apariencia puede variar en la ecografía en escala de grises, pero en la ecografía Doppler color se identifica una masa de tejido blando con una vascularización característicamente alta. Las ondas arterial y venosa pueden observarse en la ecografía Doppler espectral18. El flujo arterial tiene una resistencia baja y velocidades relativamente altas19. Durante la fase involutiva, tienen una menor vascularización19 y una mayor resistencia vascular.
Los hallazgos en la RM dependen de la fase de la lesión. Durante la fase proliferativa se presentan como masas bien definidas, hipointensas en las secuencias potenciadas en T1 e hiperintensas en las secuencias potenciadas en T2 (fig. 1), a menudo con vacíos de flujo interno en las secuencias de espín eco que representan los vasos de alto flujo9 (fig. 1). Estos vasos de alto flujo se muestran hiperintensos en las secuencias eco de gradiente, tal como ya mencionamos antes, lo cual permite distinguirlos de flebolitos y otras calcificaciones que son hipointensas en todas las secuencias9. La fase proliferativa1 se caracteriza por el realce de contraste homogéneo temprano (fig. 1), y las grandes arterias nutricias suelen ser visibles en la angio-RM11. Durante la fase involutiva aparecen como masas heterogéneas con deposición progresiva de grasa interna (focos hiperintensos en las secuencias potenciadas en T1), menos vacíos de flujo que durante la fase proliferativa12 y un realce de contraste más heterogéneo1. Finalmente, tras una involución completa se observa una cicatriz residual que se muestra hipointensa en las imágenes potenciadas tanto en T1 como en T212. Jamás debe observase edema perilesional7,20; de ser así, se sospechará la presencia de otros tumores de partes blandas (p. ej., metástasis de neuroblastoma o rabdomiosarcoma, entre muchos otros) y deberá realizarse una biopsia.
Lactante de 1 mes de vida con un hemangioma infantil proliferativo en la región supraclavicular izquierda. La RM coronal potenciada en T1 (a) revela una masa hipointensa lobulada. La masa es hiperintensa en la imagen STIR (b). También se observan vacíos de señal dentro de la lesión que reflejan vasos de flujo rápido (flechas) (a, b). No se identifica edema perilesional. La imagen de angio-RM en 3D en fase arterial (c) revela el característico realce precoz de la lesión sin derivación arteriovenosa.
Los hemangiomas infantiles suelen involucionar espontáneamente no siendo necesario ningún tratamiento. En caso de que la lesión sea sintomática o cuando se localice en una región anatómica donde pueda condicionar un importante deterioro funcional o estético, sí suele optarse por tratamiento médico. El propranolol es el tratamiento de primera línea; reduce la expresión tanto del VEGF como de otros factores proangiogénicos a la vez que induce la apoptosis de las células endoteliales vasculares17, y se han descrito excelentes resultados7,21. Cuando el propranolol está contraindicado, puede utilizarse prednisolona oral; se han descrito tasas de involución del 30% y de detención del crecimiento del 40%. La embolización y la cirugía suelen reservarse para casos que no responden al tratamiento7. La embolización puede llevarse a cabo para controlar el crecimiento tumoral, y perioperatoriamente para reducir o minimizar las hemorragias y la coagulopatía de consumo.
Hemangioma congénitoLos hemangiomas congénitos son mucho más frecuentes que los hemangiomas infantiles. Se clasifican en rápidamente involutivos y no involutivos. El marcador GLUT-1 es negativo.
Presentación clínicaA diferencia de los hemangiomas infantiles, los hemangiomas congénitos están presentes al nacimiento1,8 e incluso pueden observarse in utero12. Suelen aparecer como lesiones solitarias, frecuentemente en la cabeza, el cuello o las extremidades17, sin predilección de género12.
Los hemangiomas congénitos rápidamente involutivos se presentan como lesiones de color azul grisáceo con un halo pálido periférico y depresión central, ulceración o cicatriz, y suelen involucionar mucho más rápido que los hemangiomas infantiles, durante los primeros 12-24 meses de vida1,7,12. Por el contrario, los hemangiomas congénitos no involutivos siguen creciendo proporcionalmente con el niño sin observarse retroceso alguno, y suelen ser lesiones en relieve de color púrpura rosáceo con prominente telangiectasia y palidez azulada de localización periférica o central17.
Características de imagenDebido a su importante solapamiento, las características de imagen no permiten distinguir los hemangiomas congénitos de los infantiles y la historia clínica del paciente es de gran importancia (figs. 2 y 3). Las arterias nutricias grandes e irregulares en patrones desorganizados, los aneurismas arteriales, las fistulas arteriovenosas y la trombosis son más frecuentes en los hemangiomas congénitos7,22. A diferencia de los hemangiomas congénitos no involutivos, los rápidamente involutivos pueden presentar un componente central, sin realce, hipoecoico e hiperintenso en las secuencias potenciadas en T2, representativo de necrosis11.
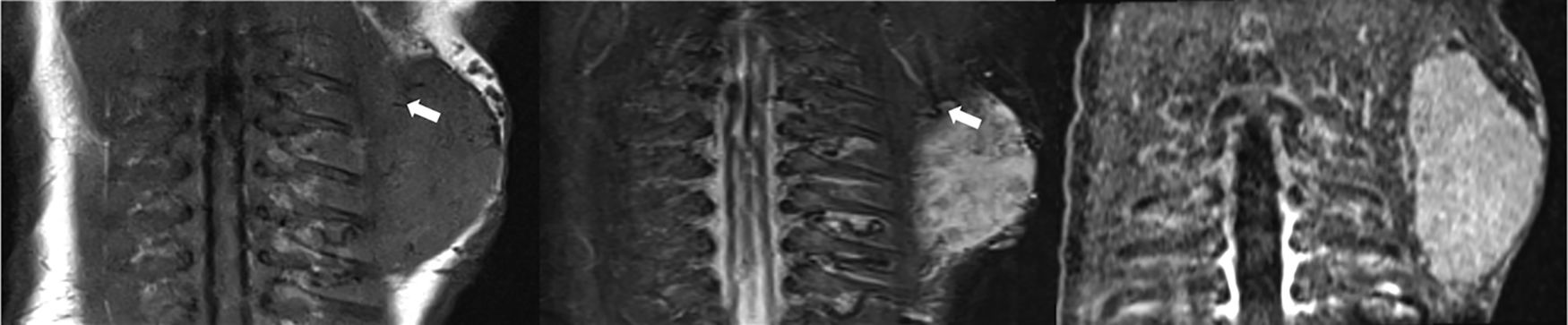
Recién nacido de 1 día de vida con un hemangioma congénito en el área escapular izquierda. En la RM se observa una masa de partes blandos bien definida, hipointensa en las imágenes coronales potenciadas en T1 (a) e hiperintensa en la imagen STIR (b). En estas imágenes (a, b) también se observan vacíos de señal dentro de la lesión, que corresponden a vasos de flujo rápido (flechas). No se identifica edema perilesional. La imagen de angio-RM con contraste en fase arterial (a) revela el característico realce precoz de la lesión.
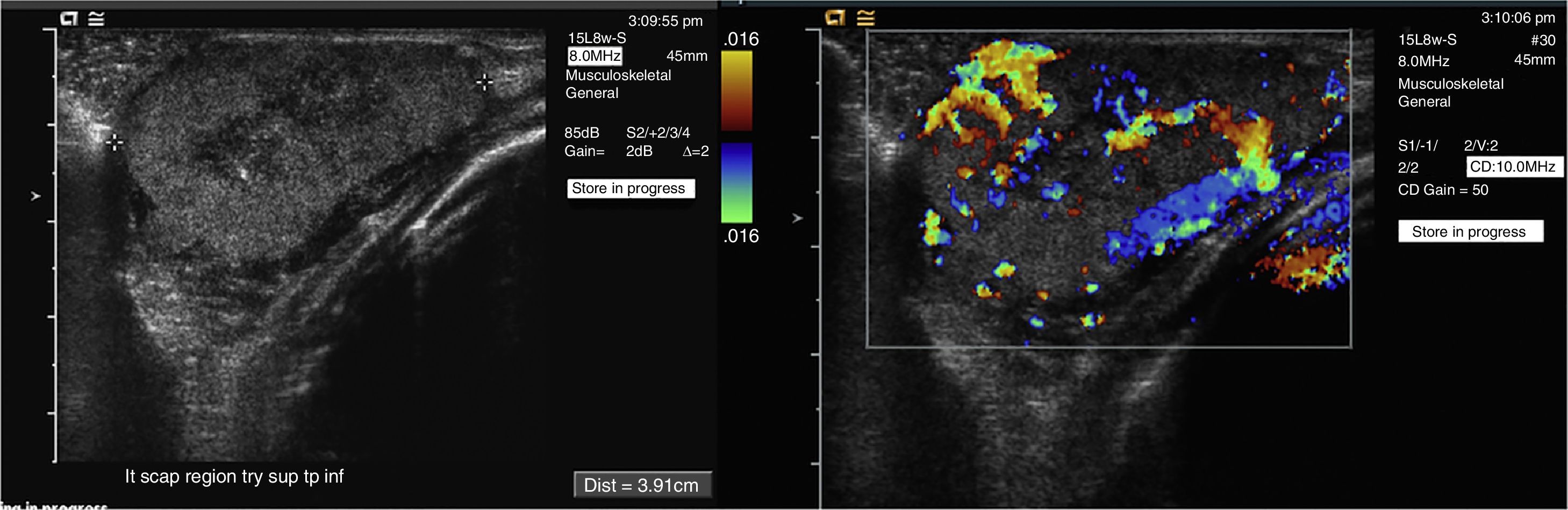
Recién nacido de 1 día de vida con un hemangioma congénito en el área escapular izquierda (mismo paciente de la Figura 2). La ecografía en escala de grises (a) revela una masa sólida de partes blandas bien definida. La ecografía Doppler color (b) muestra una alta vascularización.
Los hemangiomas congénitos no involutivos precisan tratamiento, siendo de elección la extirpación quirúrgica, pues la embolización no suele ser efectiva7.
Hemangioendotelioma kaposiformeEl hemangioendotelioma kaposiforme es un tumor raro, localmente agresivo, con GLUT-1 negativo, que suele presentarse en el nacimiento. Histológicamente muestra áreas irregulares y nodulares de vasos comprimidos que recuerdan a una malformación vascular de tipo capilar y al sarcoma de Kaposi. La ausencia de glóbulos PAS (ácido peryódico de Schiff) positivos lo distingue del sarcoma de Kaposi, y la ausencia de fascículos de células fusiformes23lo lo distingue del hemangioma capilar.
Presentación clínicaLos pacientes pueden presentar síndrome de Kasabach-Merritt (caracterizado por trombocitopenia potencialmente mortal, anemia y coagulopatía). Este tumor tiene un potencial muy poco maligno y las metástasis ganglionares regionales son raras1.
Suele aparecer durante la primera década de la vida y comprometer el espacio peritoneal o retroperitoneal, las extremidades superiores e inferiores, y la región del cuello y la cabeza. Al igual que ocurre con los hemangiomas infantiles, este tumor puede mostrar una rápida proliferación inicial seguida de remisión. También se han descrito la persistencia y la recurrencia11. Tanto los bordes irregulares de la lesión como las señales de infiltración en la piel14 son reflejo de la agresividad del tumor.
Características de imagenLa apariencia del hemangioendotelioma kaposiforme varía en función de su tamaño. Las lesiones grandes suelen mostrar una apariencia agresiva, vacíos de flujo interno y focos hemorrágicos en RM, y vasos intratumorales con espectro arterial en la ecografía Doppler.
Las lesiones pequeñas son inespecíficas, pero algunas pueden crecer abruptamente y tener características agresivas. Algunos de los rasgos distintivos de agresividad en la RM son: márgenes poco definidos (debido con frecuencia a edema perilesional), compromiso de múltiples planos tisulares con frecuente engrosamiento de la piel y trabeculación de la grasa subcutánea, realce de contraste precoz, arterias nutricias más pequeñas y venas de drenaje, depósitos de hemosiderina y cambios destructivos9,11.
TratamientoSe han publicado varias opciones terapéuticas. El tratamiento de elección de la afectación cutánea localizada suele ser la extirpación quirúrgica completa, que en ocasiones se combina con radiación. El diagnóstico temprano es muy importante, ya que puede permitir una extirpación total. En muchos casos, la extirpación quirúrgica es por la invasión tisular local y el fenómeno de Kasabach-Merritt asociado. En los casos graves con síndrome de Kasabach-Merritt se intenta un abordaje múltiple, con extirpación quirúrgica, esteroides, interferón, vincristina o radioterapia24, pero su eficacia es variable.
Malformaciones vasculares de alto flujoLas formaciones vasculares de alto flujo son aquellas lesiones que tienen un componente arterial, e incluyen las malformaciones arteriovenosas (MAVs) y las fístulas arteriovenosas (FAVs). Ambos tipos se caracterizan por la presencia de una conexión anómala entre venas y arterias con desviación de flujo del lecho capilar.
Malformaciones arteriovenosasMientras que las FAVs consisten en una conexión vascular única directa entre arteria y vena, las MAVs están formadas por una combinación variable de una o varias arterias nutricias y venas de drenaje separadas por un nido de vasos displásicos. Las arterias suelen ser más grandes y tortuosas, y a menudo con destrucción de su lámina elástica interna. Como resultado de la derivación de la presión arterial al sistema venoso de baja presión, las venas muestran hipertrofia muscular de la media, fibrosis de la íntima y ausencia de adventicia12.
Las MAVs congénitas suelen ser esporádicas, y con menor frecuencia forman parte de un síndrome, como el síndrome de Parkes-Weber, el síndrome del hamartoma homólogo de la fosfatasa y la tensina, el síndrome de Osler-Weber-Rendu y el síndrome CLOVES (sobrecrecimiento lipomatoso congénito, malformaciones vasculares, nevus epidérmico, anomalías esqueléticas)25.
Presentación clínicaAunque las MAVs ya están presentes en el momento del nacimiento13, su diagnóstico puede suponer un reto y demorarse hasta que clínicamente son evidentes por completo, durante la niñez o la edad adulta, o bien hasta que son lo bastante grandes como para provocar trastornos hemodinámicos. Al igual que ocurre con otras malformaciones vasculares, suelen aumentar de tamaño con el crecimiento del niño. El crecimiento puede desencadenarse por factores físicos, tales como trombosis, infecciones o traumatismos3, o por cambios hormonales como los que ocurren durante la pubertad o la gestación26.
En la exploración física, estas anomalías suelen observarse como masas calientes pulsátiles de color rojo con frémito palpable y posibles ruidos audibles que son reflejo de su alto flujo sanguíneo. En varios casos13 se ha observado sobrecrecimiento esquelético, hipertrofia de las extremidades14, fenómeno de robo arterial e isquemia cutánea con ulceración y hemorragias. Aunque raro, cuando las lesiones son muy extensas, puede producirse un estado de alto gasto cardiaco y sobrecarga cardiopulmonar como resultado del cortocircuito de izquierda a derecha causado por la lesión. El sistema de estadiaje clínico de Schobinger, presentado en 1990 en la reunión del International Workshop for the Study of Vascular Anomalies, en Ámsterdam, describe el curso clínico de las MAVs, especialmente las no tratadas (tabla 2).
Sistema de estadiaje clínico de Schobinger de las malformaciones arteriovenosas. Basado en la reunión del International Workshop for the Study of Vascular Anomalies, en Ámsterdam, en 1990. (Adaptada de ref. 11.)
| Estadio | Descripción |
|---|---|
| I: Quiescencia | Mancha de color rosa azulado con calor y comunicación objetivable en la ecografía Doppler |
| II: Expansión | Igual que en el estadio I más agrandamiento de la lesión, pulso, ruido, frémito |
| III: Destrucción | Igual que en el estadio II más ulceración, sangrado, dolor persistente o necrosis tisular |
| IV: Descompensación | Igual que en el estadio III más insuficiencia cardiaca de alto gasto |
La ecografía suele utilizarse como técnica inicial de cribado. Esta revela un área mal definida de ecogenicidad heterogénea sin una masa discreta y con una red hipervascular de vasos tortuosos y dilatados, incluyendo múltiples arterias nutricias y drenajes venosos, que pueden llegar a ser aneurismáticos como resultado de la arterialización de larga duración del sistema venoso25. La ecografía puede utilizarse para calcular, aproximadamente, el tamaño de la lesión y determinar su complejidad valorando el número de vasos de entrada y de salida, y su relación con estructuras adyacentes19. La ecografía Doppler espectral revela su flujo alto, lecho vascular de baja resistencia25 y ondas venosas arterializadas.
La RM suele utilizarse para llegar a un diagnóstico definitivo y poder evaluar la extensión de la lesión. A diferencia de los hemangiomas, las MAVs suelen presentarse como lesiones sin efecto de masa, mal definidas, que infiltran múltiples planos tisulares. Las grandes arterias nutricias de alto flujo y las venas de drenaje aparecen como marañas de vacío de señal de morfología serpiginosa en las secuencias de espín eco (figs. 4 y 5), focos de alta intensidad de señal en las imágenes con eco de gradiente9,27 y un intenso realce del contraste (figs. 4 y 5). Las áreas de hipointensidad potenciadas en T1 dentro de la médula ósea reflejan la extensión intraósea de la lesión13. Otras áreas intralesionales de acortamiento en T1 pueden representar hemorragia o trombosis20. La angio-RM con contraste en las fases arterial y venosa con reconstrucción multiplanar permite hacer una detallada descripción de la anatomía de las arterias nutricias y de las venas de drenaje (fig. 6). La secuencia de angio-RM 3D dinámica con resolución temporal permite una excelente valoración de la hemodinámica de los componentes de las MAV, incluido el nido. El drenaje venoso precoz es característico9,27 (figs. 4 a 6). La caracterización precisa de la lesión se logra, de una forma más integral, con la arteriografía convencional, que puede utilizarse para valorar la viabilidad del tratamiento endovascular y la subsiguiente terapia.
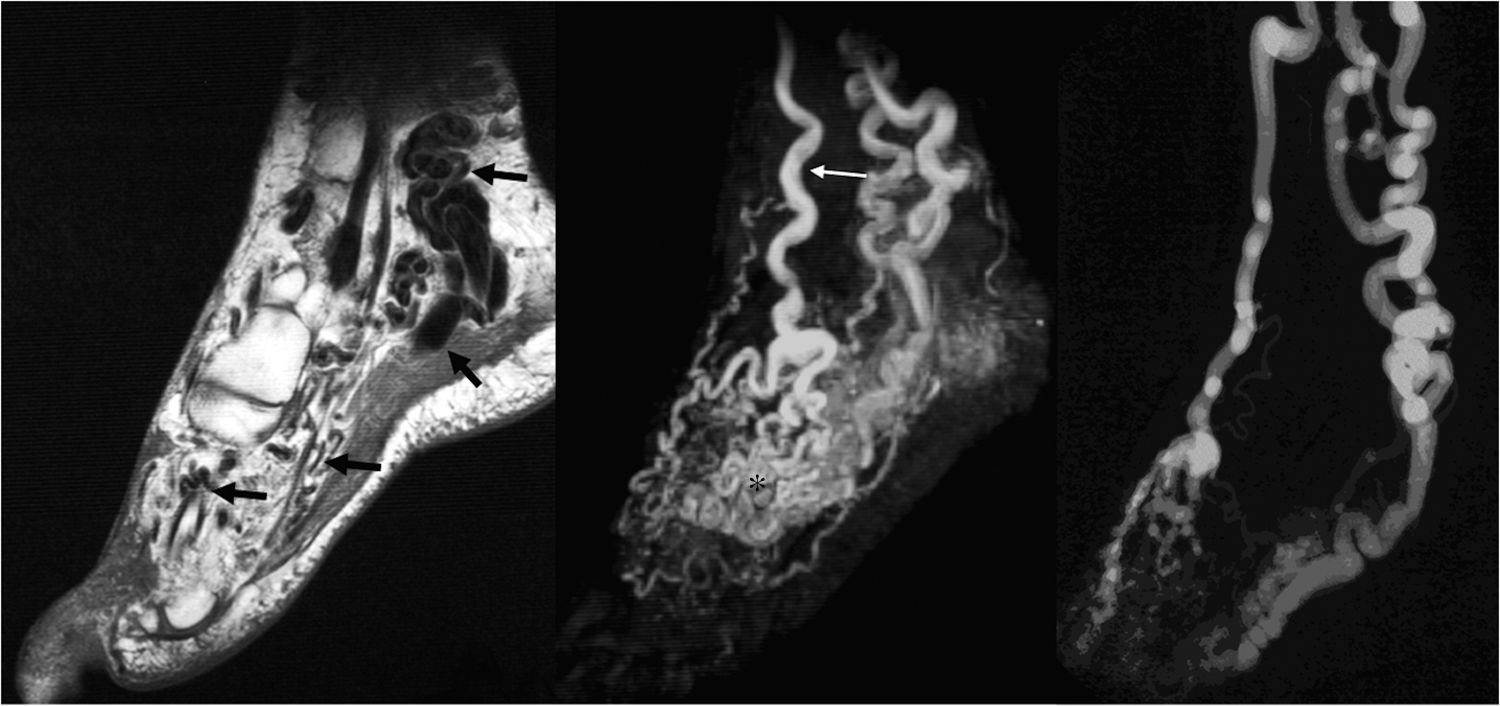
Mujer de 35 años con una malformación arteriovenosa (MAV) en el pie izquierdo. En las imágenes FSE (fast spin-echo) se aprecian arterias nutricias de alto flujo agrandadas, venas de drenaje, el nido de la MAV y vacíos de señal (a) (flechas). La angio-RM en fase arterial (b) muestra el aporte arterial de la MAV, principalmente a través de una arteria dorsal del pie tortuosa y dilatada (flecha fina), así como un llenado precoz del nido (asterisco), y las venas de drenaje (puntas de flecha). Excelente correlación con la angiografía (c).
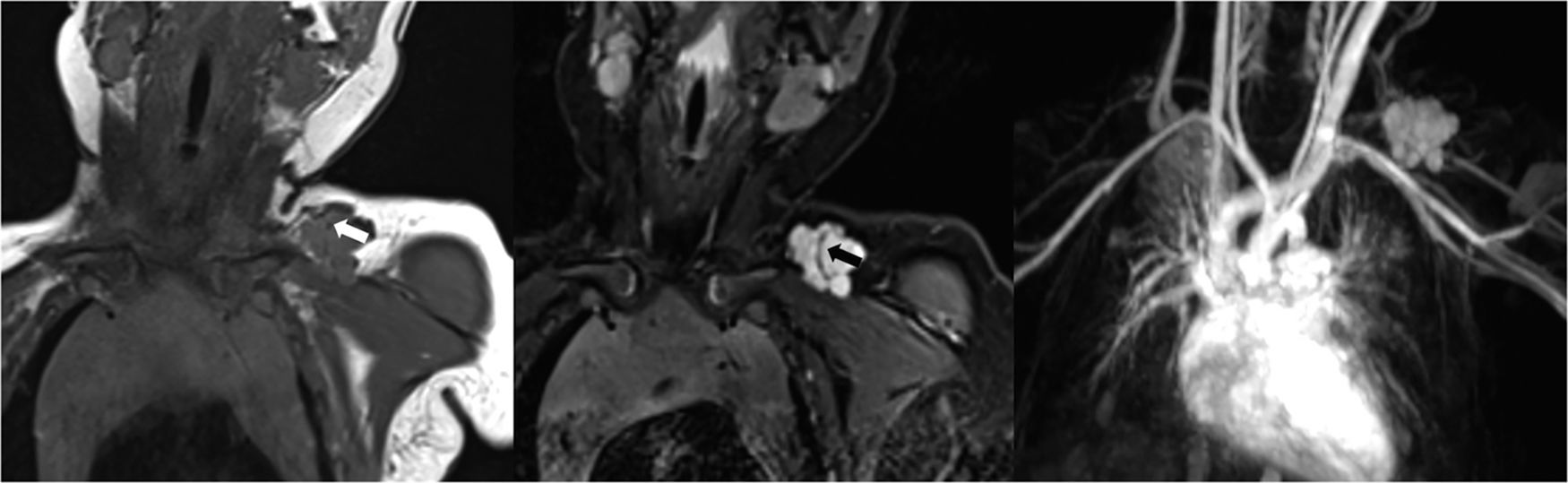
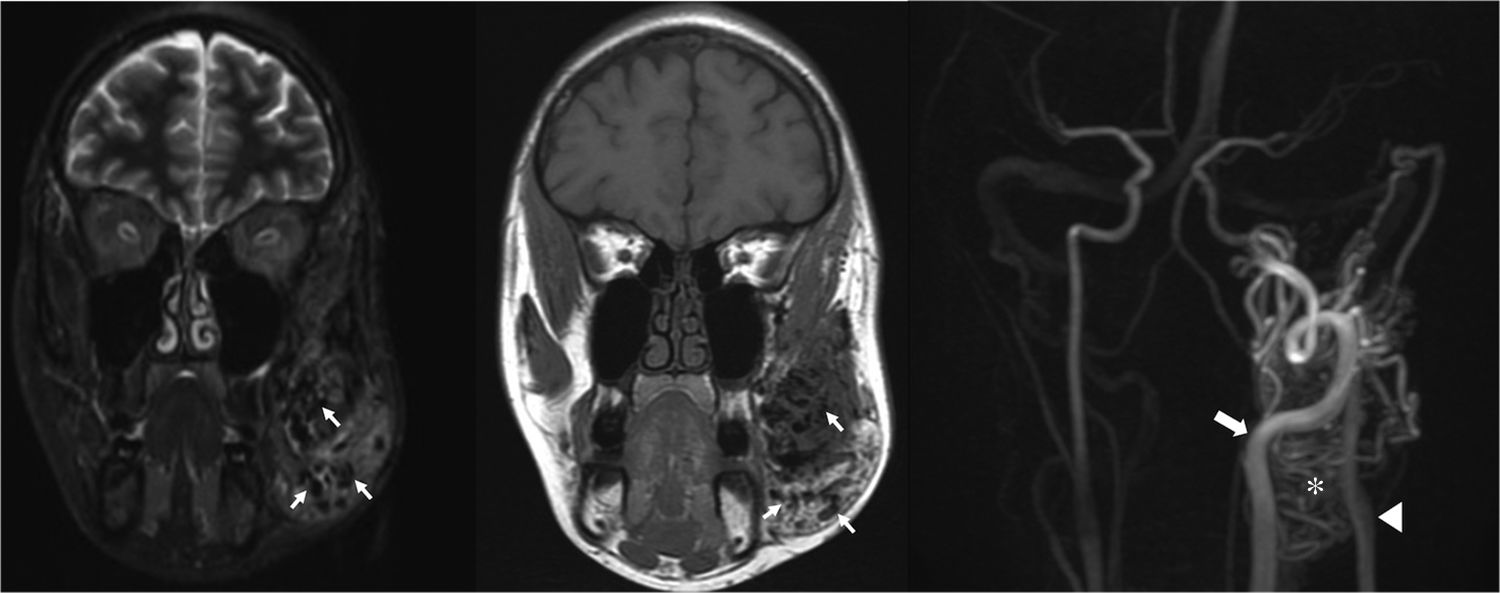
Mujer de 35 años con una malformación arteriovenosa facial izquierda. Las arterias, las venas y el nido aparecen como vacíos de señal (flechas) tanto en las imágenes coronales potenciadas en T1 (a) de espín eco como en las imágenes STIR (b). La angio-RM en fase arterial (c) muestra el aporte arterial a través de ramas tortuosas y dilatadas de la arteria carótida externa (flecha), el nido (asterisco) y el drenaje venoso (punta de flecha).
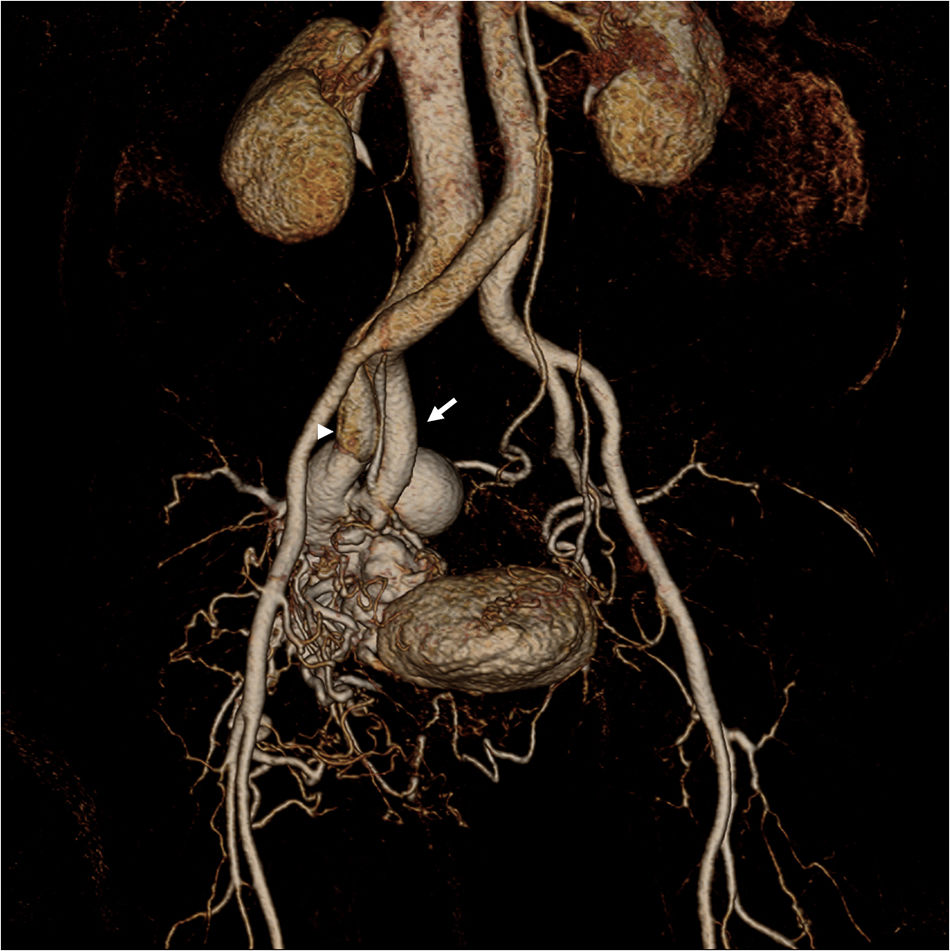
Mujer de 65 años con una malformación arteriovenosa (MAV) en la región derecha de la pelvis. Reconstrucción 3D (volumen rendering) de angio-RM con contraste revela que la MAV consiste en ramas procedentes de la arteria iliaca interna derecha hipertrofiada (flecha), un nido y una gran variz venosa que drena dentro de la vena ilíaca interna derecha (punta de flecha).
A diferencia de los hemangiomas infantiles, que suelen remitir sin tratamiento, las malformaciones vasculares suelen precisar un tratamiento adecuado en función de su tamaño, localización y gravedad de los síntomas. No es raro que se necesiten varias sesiones debido a la presencia de lesión residual o recurrente. El tratamiento dependerá de la dinámica de la malformación y debe orientarse a alcanzar una completa erradicación del nido, pues un tratamiento incompleto puede estimular el crecimiento más agresivo13 debido a la neovascularización y al reclutamiento de flujo de entrada colateral para alimentar el nido25.
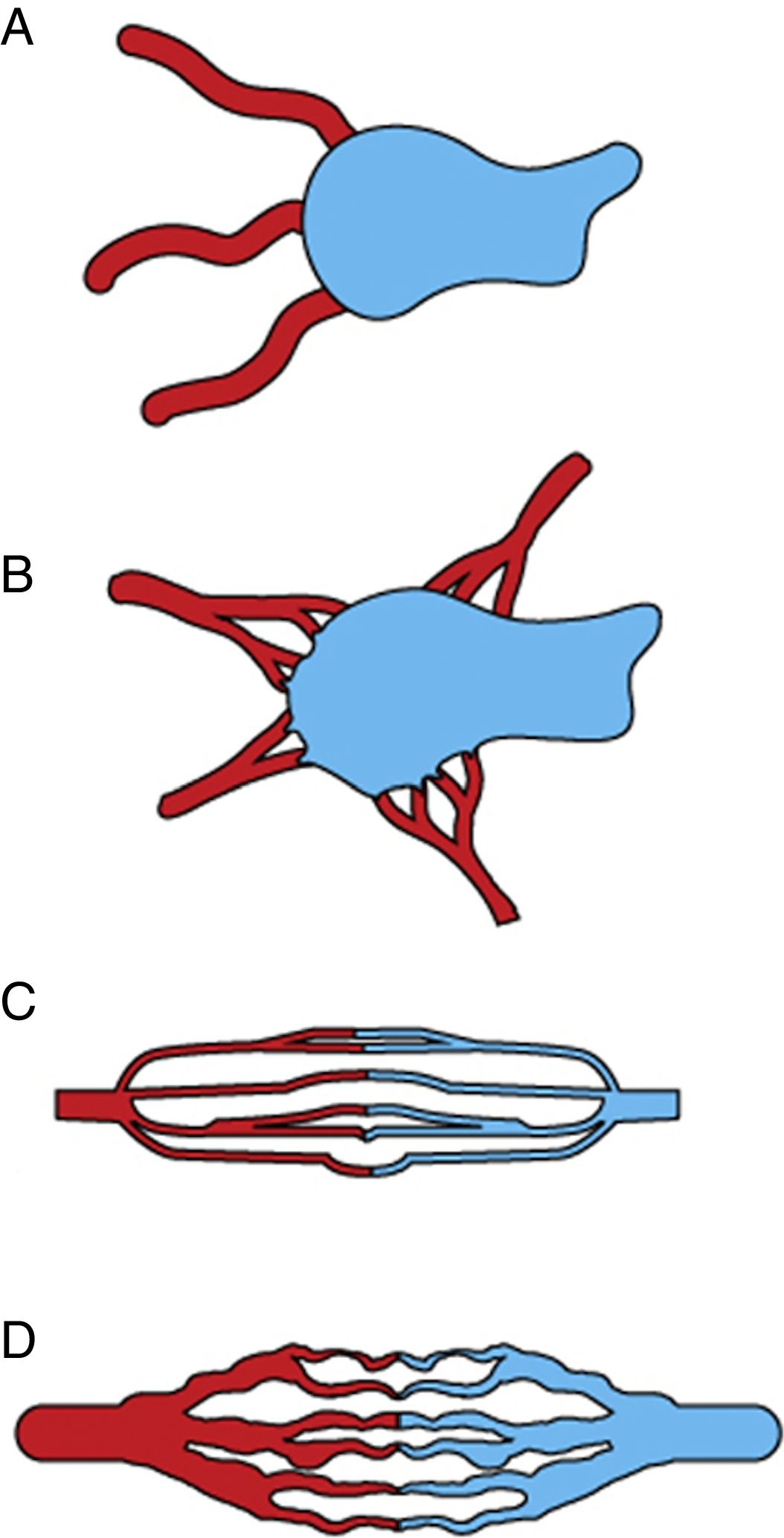
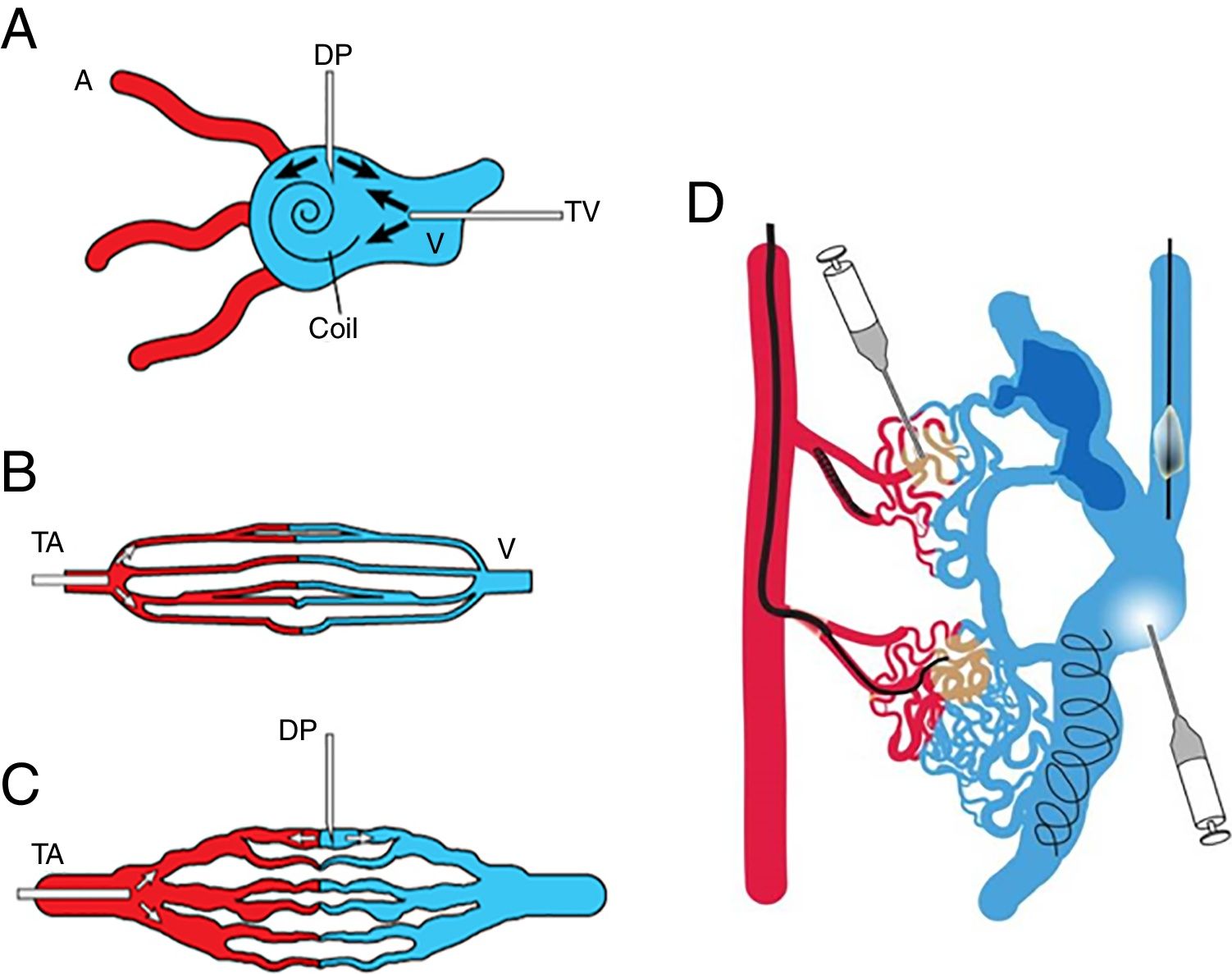
Es necesario realizar una angiografía selectiva y superselectiva basal, si se quiere determinar de forma precisa el flujo característico de la MAV. Nosotros seguimos la clasificación angiográfica propuesta por Cho et al.28 para las MAV en el cuerpo y las extremidades. Atendiendo a la forma del nido, las MAV se clasifican en cuatro categorías (fig. 7): tipo I, no más de tres arterias comunicando a única vena de drenaje; tipo II, múltiples arteriolas comunicando a una única vena de drenaje; tipo IIIa, múltiples comunicaciones finas entre arteriolas y vénulas que, en la angiografía, aparecen como finas estriaciones o como una “mancha”; tipo IIIb, múltiples comunicaciones entre arteriolas y vénulas que, en la angiografía, se muestran como una compleja red vascular. Pueden darse también tipos mixtos.
Representación esquemática de la clasificación angiográfica de las malformaciones arteriovenosas en cuatro tipos, adaptada de Cho et al.28. A) Tipo I (fístulas arteriovenosas), comunicación de no más de tres arterias a una única vena de drenaje; B) tipo II (fístulas arteriovenosas), comunicación de múltiples arteriolas a una única vena de drenaje; C) tipo III (fístula arteriovenosa con fistula no dilatada), múltiples comunicaciones finas entre arteriolas y vénulas; D) tipo IIIb (fistula arteriovenosa con fistula dilatada), múltiples comunicaciones entre arteriolas y vénulas que, en la angiografía, se muestran como una compleja red vascular.
El acceso al nido de la MAV puede ser por abordaje transarterial, transvenoso, o por punción directa. En ocasiones es necesario combinar varios abordajes. Tradicionalmente, estas lesiones se resuelven mediante embolización transarterial, si bien el abordaje transvenoso o la punción directa pueden ser necesarios, sobre todo en casos de una tortuosidad arterial extrema, presencia de arterias nutricias innumerables, importantes ramas arteriales normales en zonas muy próximas a la malformación, o ligadura quirúrgica o embolización de la arteria nutricia previas. En líneas generales, nosotros seguimos el esquema de tratamiento propuesto por Cho et al.28, que varía en función del tipo angiográfico de malformación a tratar (fig. 8). En las MAVs de los tipos I y II es importante abordar el componente venoso del nido, lo que se consigue mediante punción directa o abordaje transvenoso. Antes de proceder a la embolización con etanol suele ser necesaria la embolización con coils del componente venoso del nido, a fin de reducir la cantidad de etanol y estabilizar la trombosis dentro del componente venoso grande. Las MAVs de tipo IIIa precisan un abordaje transarterial, ya que el nido es demasiado fino como para acceder mediante punción directa. El abordaje transarterial es el preferido para el manejo de las MAV de tipo IIIb, si bien este tipo de MAV también puede ser intervenido mediante punción directa. Igualmente pueden utilizarse dispositivos oclusivos como tratamiento adyuvante para controlar el flujo dentro del drenaje aneurismático y así minimizar el riesgo de embolizar áreas no diana con los agentes embólicos líquidos durante el abordaje arterial o la punción directa25. La embolización transvenosa está contraindicada para el manejo de las MAVs de tipo III, ya que el material de embolización no solo no conseguiría alcanzar la comunicación, sino que además bloquearía el drenaje venoso con el consiguiente posible riesgo de hemorragias, roturas y crecimiento agresivo que ello implica. En el caso de las lesiones mixtas suele ser necesario combinar los distintos abordajes (fig. 8 D), aunque se prefiere un único abordaje que permita tratar todos los tipos de MAV simultáneamente28.
Representación esquemática de la vía de acceso para el tratamiento según el tipo angiográfico de malformaciones arteriovenosas. Adaptada de Cho et al.28. A) Abordaje transvenoso y punción directa del nido para los tipos I y III; B) abordaje transarterial para el tipo III; C) abordaje transarterial y punción directa para el tipo IIIb; D) las lesiones mixtas pueden requerir un abordaje combinado. A: arteria; V: vena; TV: transvenoso; PD: punción directa; TA: transarterial.
Tal como explicamos antes, la FAV es una conexión anómala entre una arteria y una vena sin intervención de un capilar. Las MAV pulmonares y la malformación aneurismática de la vena de Galeno son nombres poco apropiados para esta anomalía, pues en realidad estas lesiones son FAV.
Las FAV congénitas, que suelen ocurrir en la cabeza y el cuello, son distintas de las FAV adquiridas, que suelen ser consecuencia de una lesión penetrante yatrogénica o traumática.
Presentación clínicaAl igual que ocurre con las MAV, las FAV pueden presentarse como masas calientes con frémito. También puede desarrollarse insuficiencia cardíaca de alto gasto.
Características de las imágenesLa ecografía Doppler revela arterias nutricias de baja resistencia, venas de drenaje con flujo arterializado y un flujo turbulento en el punto de comunicación11. La RM muestra los componentes arterial y venoso como grandes vacíos de señal en las secuencias de espín eco, o como focos de alta intensidad de señal en las secuencias con eco de gradiente. Al igual que ocurre con las MAV, y a diferencia de los hemangiomas, las FAV se manifiestan sin una masa bien definida1.
TratamientoLas fístulas arteriovenosas directas pueden curarse con dispositivos de oclusión proximal tales como tapones y coils; sin embargo, en ocasiones es necesaria la extirpación quirúrgica.
Síndromes con anomalías vasculares de alto flujoSíndrome de Kasabach-MerrittEl síndrome de Kasabach-Merritt, descrito en 194029, se caracteriza por la combinación de hemangiomas pediátricos y trombocitopenia, anemia hemolítica y coagulopatía. Es potencialmente letal (muerte descrita en el 12-24% de los casos) característicamente en pacientes con hemangioendoteliomas kaposiformes o angiomas en penacho24. Se trata de una coagulopatía por atrapamiento que ocurre cuando los factores de coagulación de la sangre y las plaquetas se ven atrapados entre las células tumorales vasculares24.
Cabe destacar que los fenómenos de Kasabach-Merritt son una situación muy distinta que puede sobrevenir en pacientes con malformaciones venosas o con otro tipo de malformación vascular, y que se caracteriza por ser una coagulopatía de consumo que se produce cuando se consumen factores de coagulación de la sangre tras una hemorragia24.
Los pacientes con síndrome de Kasabach-Merritt pueden requerir extirpación quirúrgica, corticosteroides, interferón, quimioterapia y radioterapia; la terapia de reemplazo con factores de coagulación suele bastar para el manejo de los fenómenos de Kasabach-Merritt24.
Síndrome de PHACEEl síndrome de PHACE se caracteriza por la presencia de malformaciones de la fosa posterior, hemangiomas en la cara y el cuello, anomalías arteriales, defectos cardiacos o coartación de aorta, y anomalías endocrinas u oculares24. Las afecciones de la fosa posterior incluyen malformaciones de Dandy-Walker y dilatación ventricular. Suele ser característica la presencia de un gran hemangioma segmentario de cara (98% de los casos)30.
Las anomalías cardíacas y aórticas incluyen aneurismas aórticos, disecciones aórticas y defectos septales auriculares y ventriculares. Las anomalías oculares y endocrinas incluyen cataratas, glaucoma, microftalmos e hipoplasia del nervio óptico24. Cuando hay defectos del desarrollo ventral (como hendidura esternal o rafe supraumbilical), a este síndrome se le denomina PHACES30.
En los pacientes con hemangiomas infantiles grandes, de más de 5cm de diámetro, en la cara, la cabeza o el cuello, se recomienda realizar una RM cerebral para descartar la presencia de síndrome PHACE30.
Síndrome de Parkes-WeberEl síndrome de Parkes-Weber, descrito en 1907 por el dermatólogo británico que le da nombre31, se caracteriza por la presencia de malformación capilar cutánea con hipertrofia de las extremidades acompañado de MAVs-FAVsy de venas varicosas congénitas (figs. 9 y 10)7. La existencia de lesiones de alto flujo es la principal característica de este síndrome, que puede confundirse con facilidad con el síndrome de Klippel-Trénaunay, también caracterizdo por hipertrofia de las extremidades.
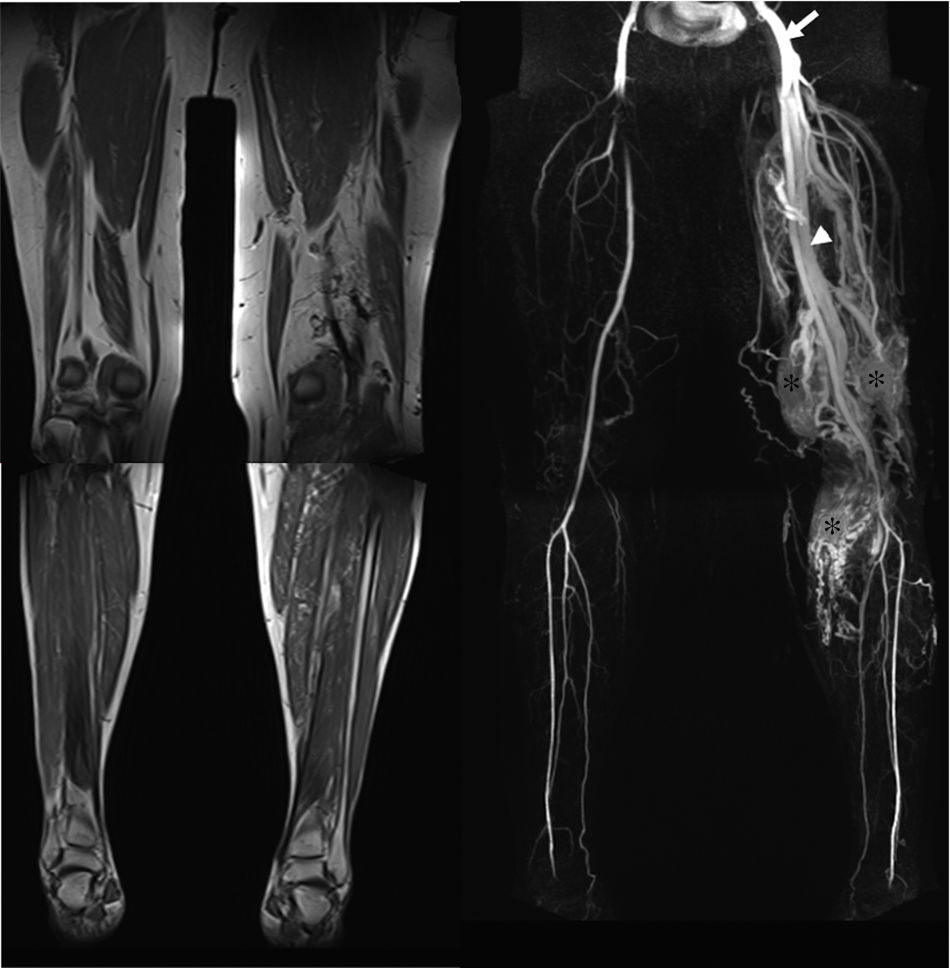
Mujer de 52 años con síndrome de Parkes-Weber. El examen clínico mostró malformaciones capilares cutáneas con marcada hipertrofia de la extremidad inferior. La imagen de RM potenciada en T1 (a) revela una marcada hipertrofia de las extremidades. La angio-RM con contraste en fase arterial (b) muestra una arteria femoral agrandada (flecha), numerosas malformaciones arteriovenosas en la extremidad (asterisco) y drenaje venoso precoz (punta de flecha).
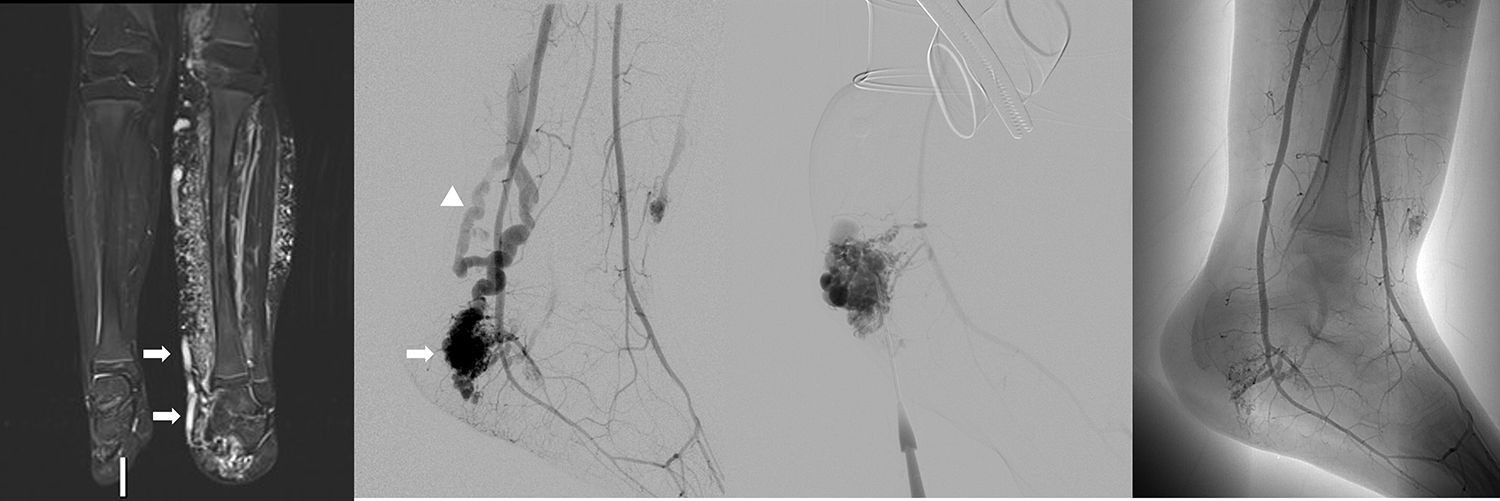
Varón de 9 años con síndrome de Parkes-Weber. La imagen RM coronal en STIR (a) revela una marcada hipertrofia de la extremidad izquierda, hiperintensidad subcutánea difusa y drenaje venoso dilatado (flechas) por múltiples malformaciones arteriovenosas (MAVs). La arteriografía de la extremidad inferior izquierda (b) muestra una gran MAV que cubre el maléolo medial del tobillo izquierdo (flecha), con drenaje venoso precoz (punta de flecha). Punción directa del componente venoso de la MAV del tobillo izquierdo (c), esclerosis con alcohol y disminución del flujo (d).
Esta malformación es evidente al nacimiento y se acompaña de un cuadro de agrandamiento y mácula eritematosa en la extremidad afectada. Las extremidades inferiores suelen verse más afectadas que las superiores32. La extremidad afectada agrandada suele ser caliente a la exploración, con posibles ruidos o frémito11 que confirman el diagnóstico32. El sobrecrecimiento de la extremidad es subcutáneo, muscular y óseo32. Puede provocar insuficiencia cardiaca de alto gasto secundaria a la MAV11,24. Las MAVs o FAVs difusas y el sobrecrecimiento adiposo y óseo son evidentes en las pruebas de imagen11 (fig. 10). El tratamiento va dirigido a las lesiones subyacentes (fig. 10), lo cual supone un desafío por la presencia de microfístulas difusas11.
Síndrome de Rendu-Osler-WeberEl síndrome de Rendu-Osler-Weber, también conocido como telangiectasia hemorrágica hereditaria (THH), es un trastorno autosómico dominante multiorgánico caracterizado por un cuadro de epistaxis recurrente, múltiples telangiectasias mucocutáneas y presencia de MAV o FAV24,33 (fig. 11). Se clasifica en cinco fenotipos según sus diferentes mutaciones genéticas. El primer subtipo, THH1, producido por una mutación del gen de la endoglina, es el más común y el que más frecuentemente presenta FAVs pulmonares24. Aunque la epistaxis es el síntoma clínico más frecuente, puede haber manifestaciones más graves por afectación hepática, cerebral o del tracto intestinal24,33.
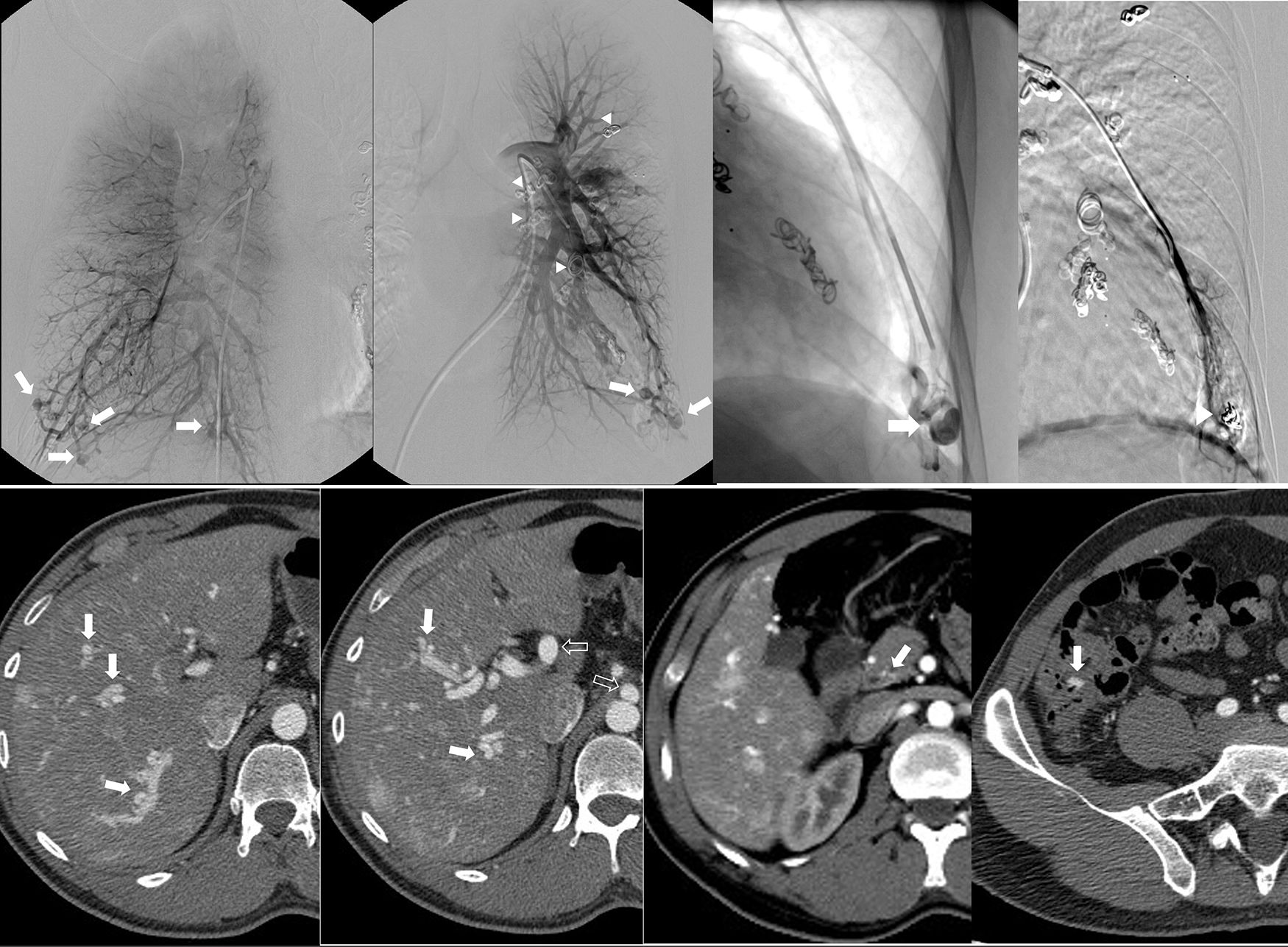
Varón de 33 años con diagnóstico de síndrome de Rendu-Osler-Weber. La arteriografía pulmonar (a-d) revela múltiples malformaciones arteriovenosas (MAV) que afectan, predominantemente, las bases pulmonares (flechas) (a, derecha; b, izquierda). Cateterización selectiva y embolización arterial de una MAV basilar izquierda (c, flecha) con buenos resultados (d, punta de flecha). Evidencia de embolización previa de las MAVs que también se observa en b (puntas de flecha). La TC abdominal (e-h) revela múltiples MAVs hepáticas (e y f, flechas) con derivación portal arterial e hipertrofia asociada del tronco celíaco y las arterias hepáticas (f, flechas huecas). También se observan múltiples telangiectasias en la mucosa entérica del píloro y la válvula ileocecal (g y h, flechas).
La embolización, principal tratamiento de las FAVs pulmonares, generalmente está indicada en lesiones con arterias nutricias de 3mm o más de diámetro33 (fig. 11).
ConclusiónLas malformaciones vasculares y los tumores son patologías raras, pero importantes, que tienen una morbilidad considerable y suelen requerir un tratamiento agresivo. Su diagnóstico y tratamiento adecuados se han visto ensombrecidos en parte por el uso de nomenclaturas poco claras, y clasificaciones y algoritmos diagnósticos inadecuados. Aunque el diagnóstico clínico es suficiente en algunos casos, a menudo se requieren pruebas de imagen, en concreto ecografía y RM, ambas con un papel complementario en su evaluación. La ecografía suele ser la primera técnica empleada por su gran disponibilidad, ausencia de radiación y su capacidad de distinción entre lesiones de alto y bajo flujo. La RM ofrece un diagnóstico de confirmación en casos dudosos, valora la extensión de la lesión, su relación con estructuras adyacentes y su hemodinámica.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses. No ha habido financiación externa para la realización de este trabajo. Klaus D. Hagspiel y Patrick T. Norton reciben apoyo financiero de Siemens Medical Solutions, Malvern, PA, EE.UU.