La aspergilosis pulmonar es una infección micótica causada la mayoría de las veces por la inhalación de esporas de Aspergillus fumigatus. Sin embargo, al hablar de aspergilosis, en realidad nos referimos a un abanico de manifestaciones clínicas y radiológicas que dependen directamente del estado del sistema inmune del paciente, de la existencia de enfermedad pulmonar previa y de la virulencia del organismo. Son 4 los tipos de aspergilosis pulmonar (aspergiloma, aspergilosis broncopulmonar alérgica, aspergilosis necrosante crónica y aspergilosis invasiva), cada uno con hallazgos radiológicos distintos. En este artículo revisamos el espectro de signos de la aspergilosis pulmonar en la tomografía computarizada multidetector y los correlacionamos con los síntomas y la respuesta inmune del paciente. Se abordarán asimismo los principales diagnósticos diferenciales.
Pulmonary aspergillosis is a fungal infection usually caused by inhaling Aspergillus fumigatus spores. However, when we talk about aspergillosis, we normally refer to the spectrum of clinical and radiological findings that depend directly on the patient's immune status, on the prior existence of lung disease, and on the virulence of the infective organism. There are four types of pulmonary aspergillosis (aspergilloma, allergic bronchopulmonary aspergillosis, chronic necrotizing pulmonary aspergillosis, and invasive aspergillosis), and each type has its own distinct radiologic findings. We review the signs of pulmonary aspergillosis on multidetector computed tomography and we correlate them with patients’ symptoms and immune responses. Likewise, we discuss the differential diagnoses.
La aspergilosis pulmonar es una infección fúngica causada por el hongo Aspergillus, en la mayoría de los casos de la especie Fumigatus, un hongo ubicuo que se adquiere inhalando sus esporas. La inhalación ocurre habitualmente en la población, por lo que aislar el hongo en el esputo no necesariamente implica una invasión o síntomas1–3. Hay 4 subtipos de aspergilosis pulmonar: aspergiloma (aspergilosis saprofítica), aspergilosis broncopulmonar alérgica (ABPA), aspergilosis semiinvasiva o necrosante crónica y aspergilosis invasiva.
El objetivo del artículo es revisar el espectro de signos de la aspergilosis pulmonar en la tomografía computarizada multidetector (TCMD), correlacionarlos con la respuesta inmune del paciente y las manifestaciones clínicas y discutir brevemente los principales diagnósticos diferenciales.
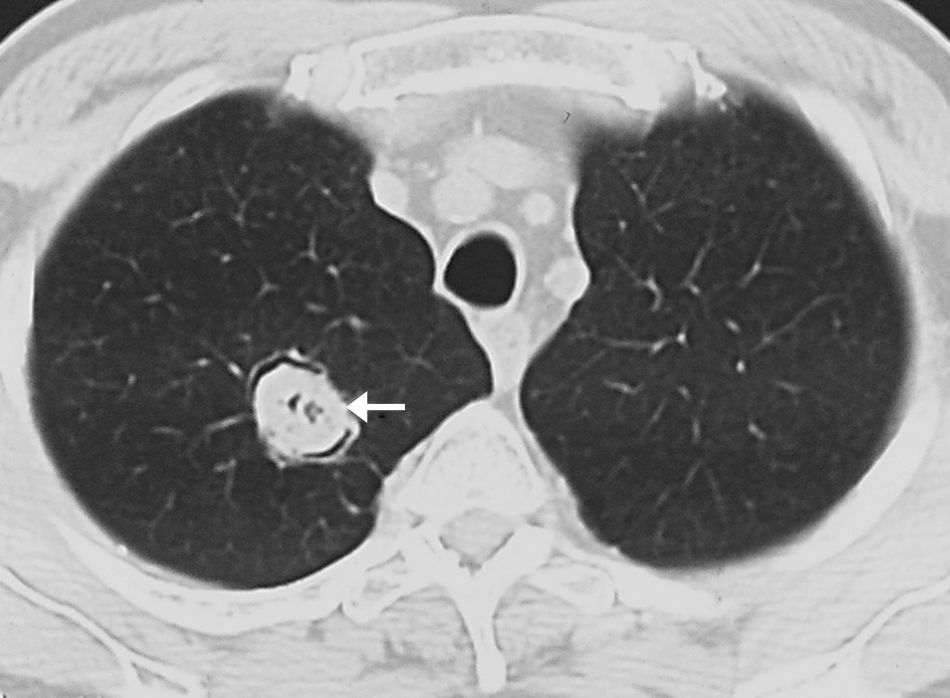
AspergilomaEl aspergiloma es una infección saprofítica por Aspergillus en un huésped inmunocompetente, por tanto no invade los tejidos sino que únicamente produce una reacción tisular leve. Desde el punto de vista anatomopatológico, un aspergiloma es un conglomerado de hifas, mucina, fibrina y células inflamatorias en el interior de una cavidad pulmonar preexistente (fig. 1) que puede ser causada por enfermedades muy diferentes, las más frecuentes la tuberculosis, la sarcoidosis y la enfermedad pulmonar obstructiva crónica (EPOC) tipo enfisema. También es posible encontrarlos en pacientes con bronquiectasias, neumoconiosis, fibrosis pulmonar, neoplasias, quistes broncogénicos, neumatoceles y en cavidades posquirúrgicas4–6. Normalmente son únicos y tienen predilección por los lóbulos superiores, probablemente por las altas concentraciones de oxígeno y la tendencia a la cavitación en los ápices pulmonares7.
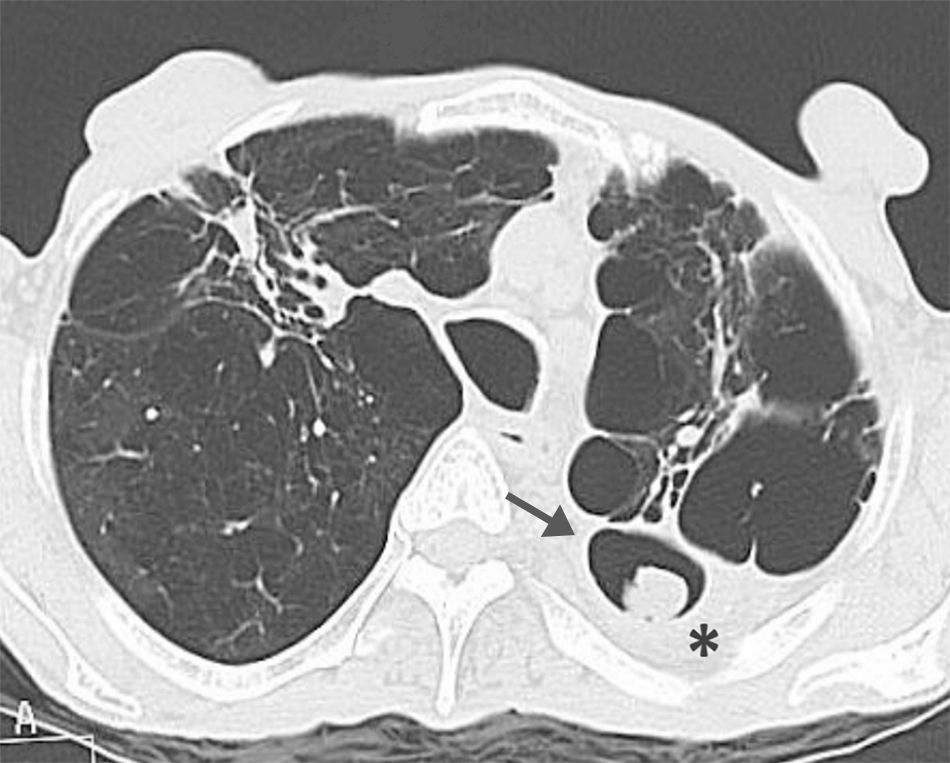
Varón de 63 años con EPOC grave. TCMD con ventana de pulmón donde se observa un nódulo en el interior de una cavidad (flecha gris) que corresponde a un aspergiloma situado en el lóbulo superior izquierdo, con engrosamiento de la pleura adyacente (estrella). Se observan asimismo signos de enfisema y lesiones cicatriciales en el lóbulo superior derecho.
Si bien los pacientes con aspergilomas pueden permanecer completamente asintomáticos y diagnosticarse incidentalmente, la manifestación clínica más frecuente es la hemoptisis, que puede ser mortal en aproximadamente el 5% de los pacientes3,5,6,8.
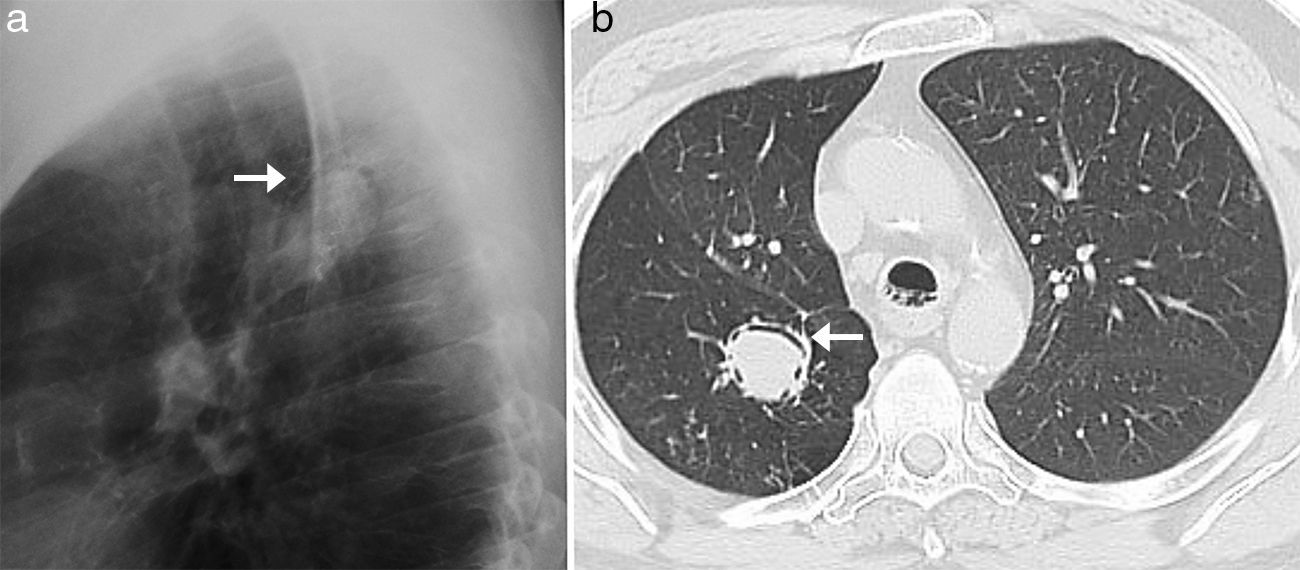
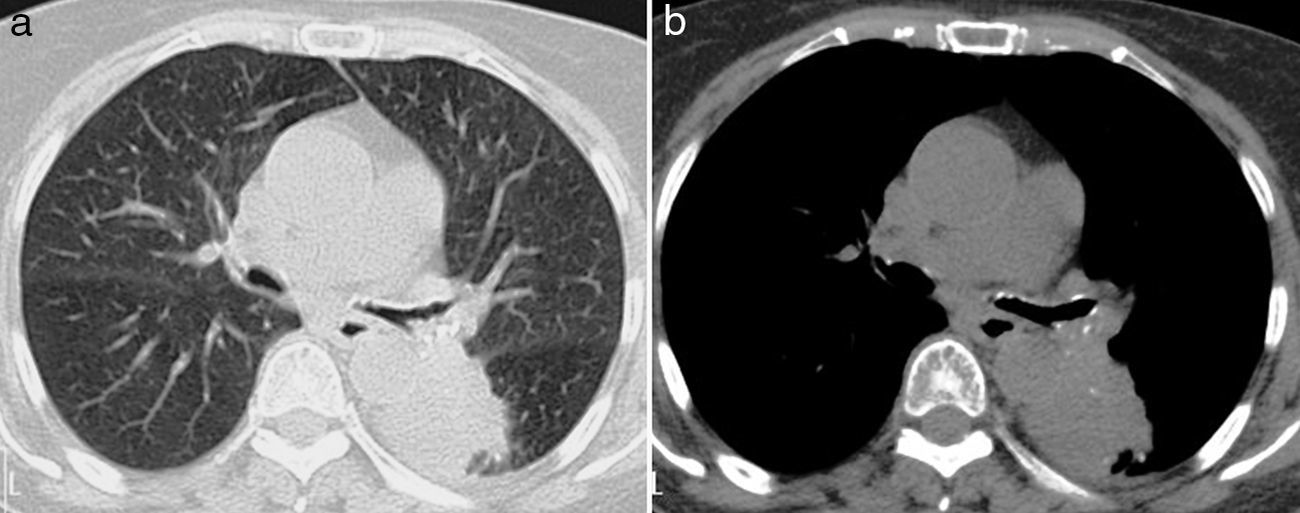
La TCMD muestra una masa sólida redondeada que ocupa parcialmente el interior de una cavidad pulmonar, separada de sus paredes por un anillo de aire. Esta característica radiológica, que se conoce como el signo de la semiluna aérea, es típica de los aspergilomas maduros (fig. 2). En fases más precoces de desarrollo del aspergiloma, el primer signo puede ser el engrosamiento de la pared de la cavidad o de la pleura adyacente. La bola de hongos puede ser móvil y obtener imágenes en decúbito prono permite demostrar un cambio de posición (fig. 3).
Aspergiloma en una mujer de 60 años con antecedente de lobectomía superior derecha. Detalle de la radiografía de tórax lateral ampliada (a) en la que se aprecia un nódulo rodeado parcialmente por un área radiolúcida en forma de semiluna. En la imagen del TCMD (b) se confirma el nódulo en el interior de una cavidad con el signo de la semiluna (flechas blancas).
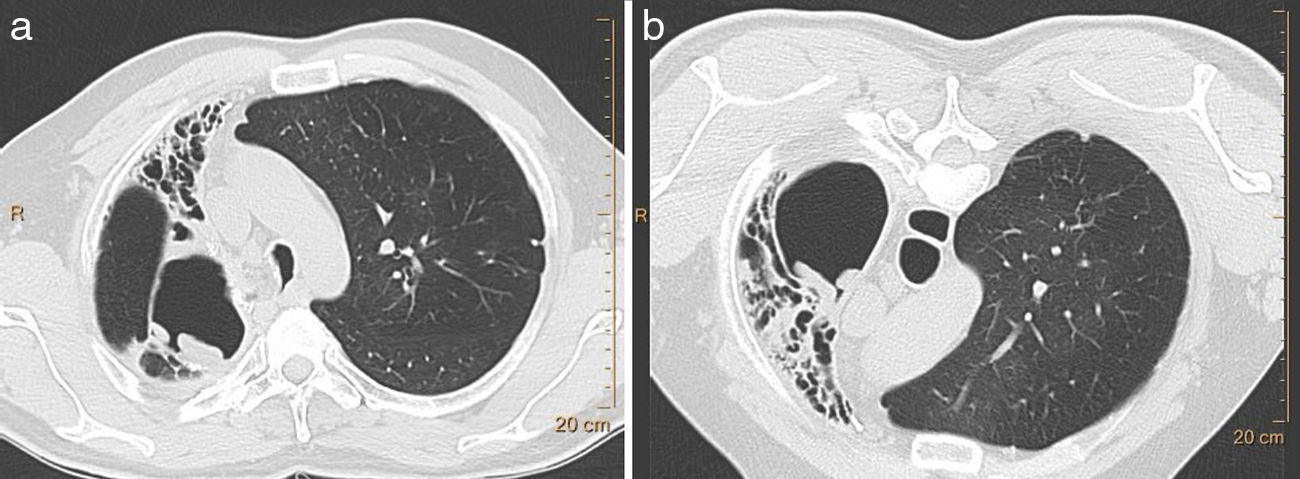
Aspergiloma saprofítico en un varón de 49 años con historia previa de lobectomía superior derecha. Imagen axial de TC con el paciente en supino (a) y prono (b), y ventana de pulmón donde se demuestra cómo las masas intracavitarias modifican su posición y se sitúan en posición declive.
El diagnóstico diferencial de las lesiones que pueden producir el signo de la semiluna incluye las formas de aspergilosis necrosante e invasiva, el hematoma, las neoplasias, los abscesos, el quiste hidatídico y la granulomatosis de Wegener3,5,7,9.
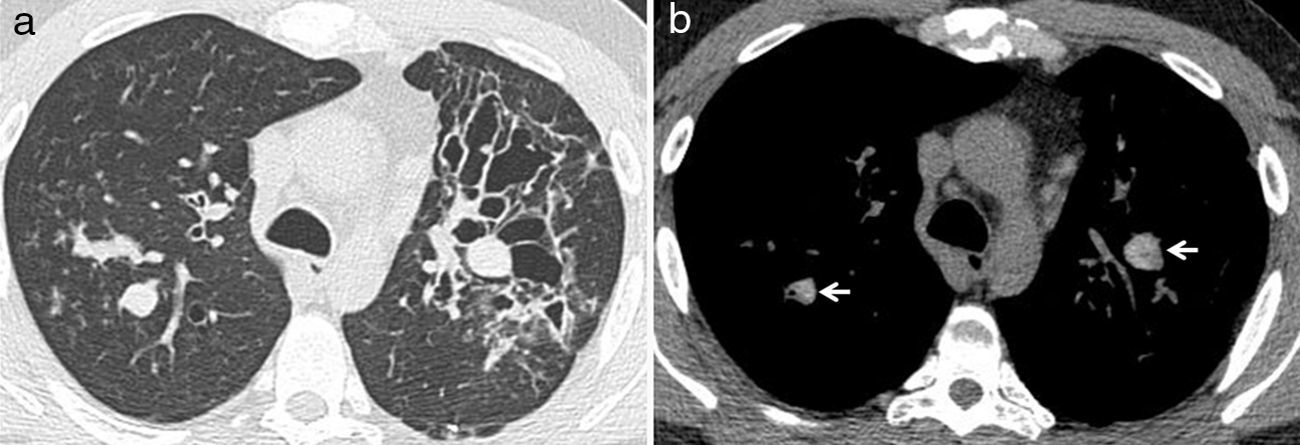
Es posible encontrar también formas inmaduras de aspergiloma en las cuales los filamentos del hongo están entrelazados, atrapan burbujas de aire y dan lugar a una retícula irregular de aspecto espongiforme que rellena una cavidad7,8 (fig. 4). Estas estructuras ramificadas pueden permanecer estables o confluir hasta formar la bola de hongos madura6.
Kang et al.10 describieron una forma de presentación del aspergiloma en pacientes sin cavidades pulmonares preexistentes y que se manifiesta como una consolidación localizada o bien en forma de un nódulo acompañado o no del signo de la semiluna (fig. 5). Estos casos pueden resultar indistinguibles desde el punto de vista radiológico de otro tipo de infección crónica o de una lesión maligna10,11.
Mujer de 74 años con adenocarcinoma ovárico y carcinomatosis peritoneal. Imágenes axiales de TCMD con ventana de pulmón (a) y de mediastino (b) en las que se observa una masa sólida en el lóbulo inferior izquierdo que ocluye el bronquio lobar, con pequeños focos de calcificación, y que no muestra el signo de la semiluna. Tras realizar una biopsia transbronquial se confirmó el diagnóstico de aspergiloma. La paciente evolucionó favorablemente con tratamiento antifúngico.
Aunque el aspergiloma representa una forma de colonización benigna, en determinadas circunstancias puede ser el origen de una aspergilosis necrosante o de una aspergilosis invasiva1,3,5,8,12.
Debe recordarse que: El aspergiloma es una infección saprofítica en un huésped inmunocompetente y se muestra en TCMD como una masa sólida que ocupa parcialmente el interior de una cavidad pulmonar y que queda separada de sus paredes por un anillo de aire, característica radiológica conocida como el signo de la semiluna aérea.
La aspergilosis broncopulmonar alérgica (ABPA) es una respuesta inmunológica exagerada a la colonización de la vía aérea por Aspergillus mediada por reacciones de hipersensibilidad tipo I y tipo III, lo que desencadena una reacción inflamatoria que acaba produciendo daño en las paredes bronquiales, bronquiectasias y, finalmente, fibrosis pulmonar. Ocurre casi exclusivamente en pacientes con asma de larga evolución y como complicación de la fibrosis quística3,6,13.
Clínicamente los pacientes presentan tos, sibilancias, dolor torácico y fiebre. Aproximadamente el 20-60% expectoran tapones mucosos espesos en los que es posible demostrar hifas de Aspergillus4,6.
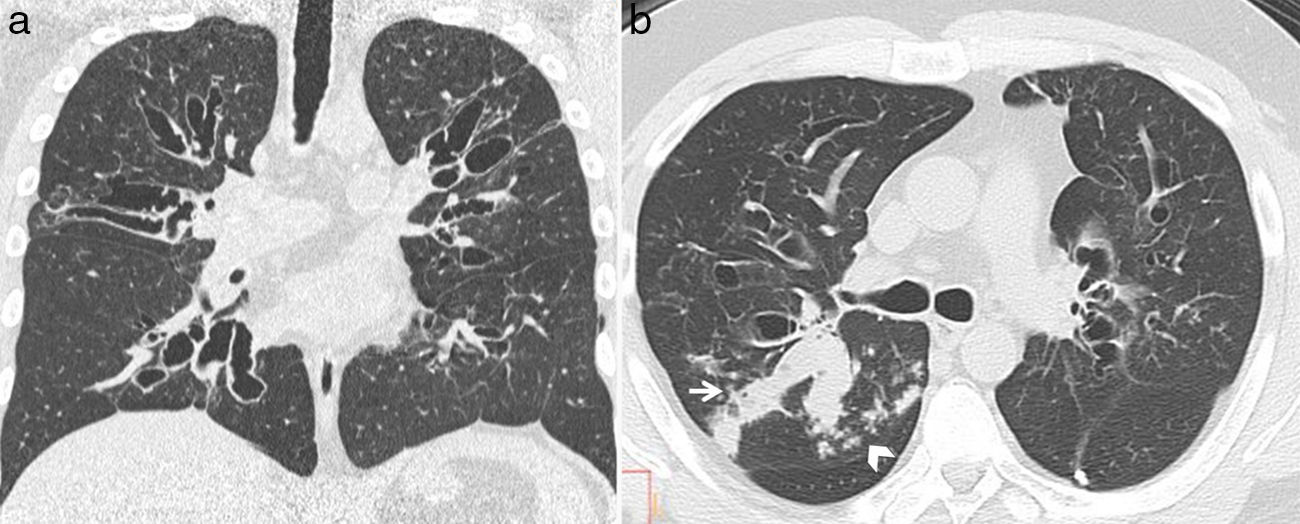
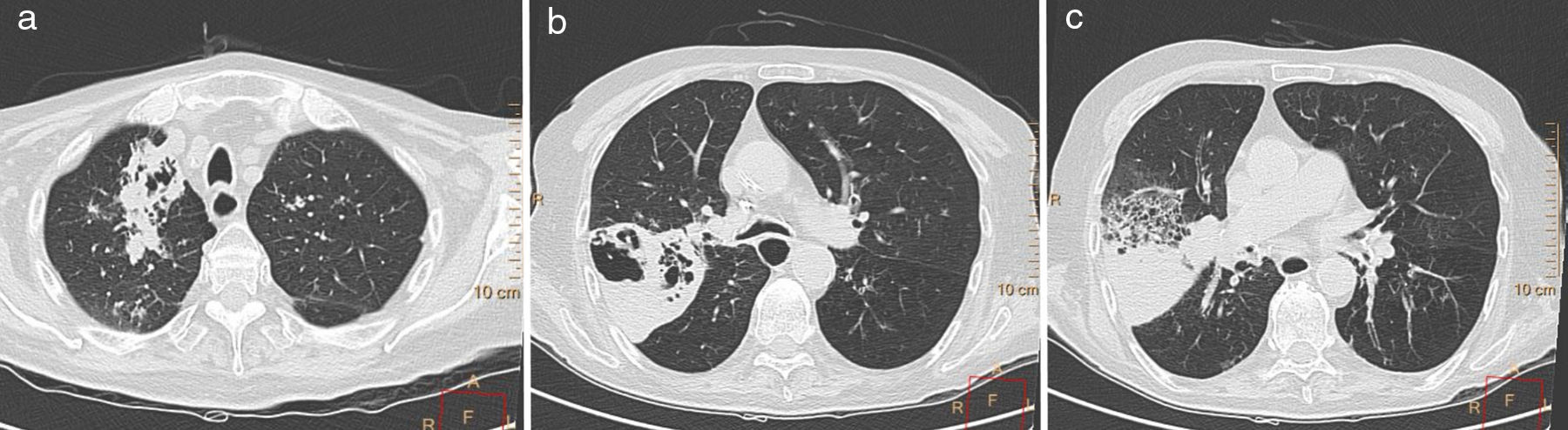
Radiológicamente se caracteriza por bronquiectasias centrales y episodios recurrentes de impactación mucosa que se ven en la TC como opacidades tubulares o saculares de distribución bronquial (signo del dedo de guante), y que se localizan principalmente en los lóbulos superiores3,9,14,15 (fig. 6). En aproximadamente el 30% de los pacientes, los tapones tienen una atenuación alta porque el moco está desecado y contiene metales (hierro y manganeso) y sales de calcio4,14 (fig. 7). Estas bronquiectasias centrales son tan sugestivas de ABPA que se consideran el marcador distintivo de la enfermedad1,6,11.
Varón de 40 años con historia de asma de larga evolución y aspergilosis broncopulmonar alérgica. Reconstrucción coronal de TCMD (a) donde se ven bronquiectasias varicosas centrales. Imagen axial de TCMD (b) que muestra bronquiectasias centrales y opacidades tubulares debidas a impactaciones mucosas (flecha blanca) en el lóbulo superior derecho. Se observa también el signo del árbol en brote periférico (cabeza de flecha).
Aspergilosis broncopulmonar alérgica en paciente con historia de asma de larga evolución. Imagen axial de TCMD con ventana de pulmón (a) que muestra bronquiectasias varicosas con impactaciones mucosas distales en ambos lóbulos superiores. Imagen axial de TCMD con ventana de mediastino (b) que demuestra la alta atenuación de los tapones mucosos (flechas blancas) como consecuencia de los depósitos de sales de calcio.
Otro tipo de reacción de hipersensibilidad al Aspergillus es la alveolitis alérgica extrínseca o neumonitis por hipersensibilidad. Este tipo de reacción es más frecuente que la ABPA y también puede evolucionar a fibrosis. Por ello es imprescindible conocerla para no diagnosticarla incorrectamente como fibrosis pulmonar idiopática13.
Aspergilosis pulmonar necrosante crónica o semiinvasivaLa aspergilosis pulmonar necrosante crónica es una forma de infección invasiva local causada por Aspergillus que cursa de manera más indolente y que progresa a lo largo de semanas o meses. Ocurre típicamente en pacientes con un grado de inmunosupresión leve o con una enfermedad crónica que les predispone a la infección. Los factores de riesgo incluyen: diabetes mellitus, alcoholismo, neumoconiosis, EPOC, malnutrición, infarto de miocardio o tratamiento con esteroides a bajas dosis2,3,5,6. Los pacientes refieren prácticamente siempre síntomas constitucionales que pueden acompañarse de tos crónica o hemoptisis2–5,12.
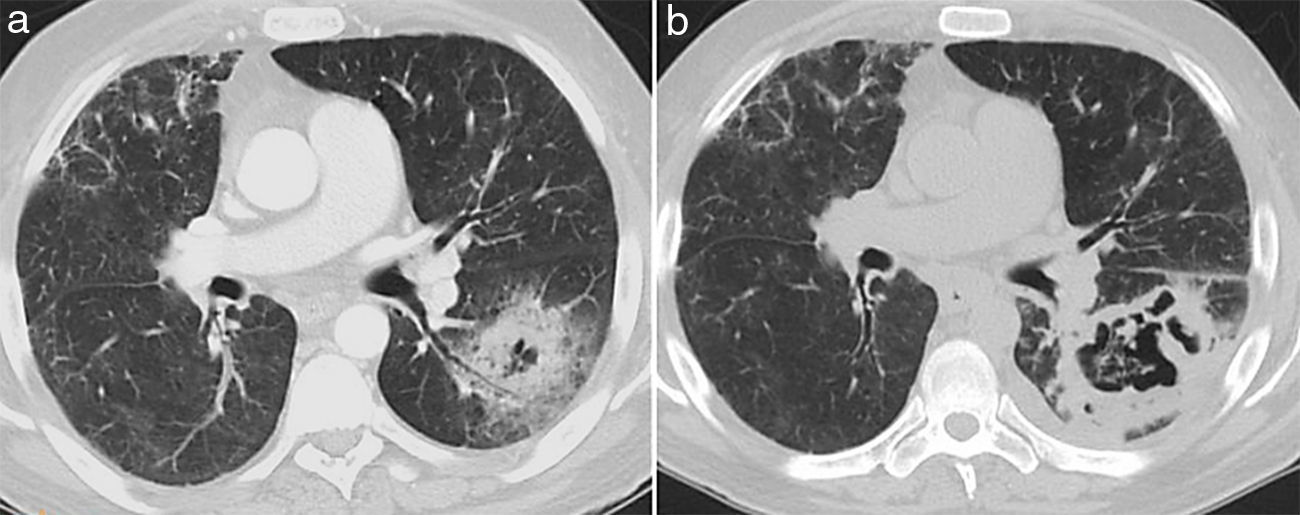
En la TCMD la aspergilosis semiinvasiva se manifiesta como una consolidación crónica o como nódulos múltiples en uno o ambos lóbulos superiores que se cavitan progresivamente3,4,12. Estos hallazgos son inespecíficos y parecidos a los de las infecciones por micobacterias, de modo que la tuberculosis es el principal diagnóstico diferencial (fig. 8).
Debe recordarse que: La aspergilosis pulmonar necrosante crónica es una forma de infección invasiva local que ocurre en pacientes con inmunosupresión leve o con una enfermedad crónica. Radiológicamente imita las infecciones por micobacterias, de modo que la tuberculosis es su principal diagnóstico diferencial.
Aspergilosis semiinvasiva en un varón de 68 años con EPOC estadio IV en tratamiento con esteroides. La TCMD revela una consolidación segmentaria multifocal cavitada en el ápex (a) y en el segmento posterior del lóbulo superior derecho (b-c). El cultivo de esputo fue positivo para Aspergillus.
Es una enfermedad relativamente frecuente y muy grave, cuya tasa de mortalidad alcanza el 85% en algunas series16. Ocurre principalmente en pacientes con inmunosupresión grave, particularmente en aquellos con neutropenia por enfermedades hematológicas malignas y tratamiento con quimioterapia. La enfermedad se desarrolla después de un periodo de 2-3 semanas de neutropenia grave (habitualmente menos de 500 células /mm3)3,5,16.
Dependiendo de la vía de diseminación, la aspergilosis puede ser angioinvasiva o broncoinvasiva, aunque pueden coexistir. La distinción no es clínicamente relevante porque no modifica el tratamiento. Ambas tienen manifestaciones clínicas parecidas: fiebre, tos y disnea progresiva. El grado de inmunosupresión es inversamente proporcional a la gravedad de las manifestaciones clínicas. Los pacientes más inmunocomprometidos tienden a presentar menos síntomas y desarrollan rápidamente una aspergilosis invasiva progresiva (entre 7 y 14 días desde el comienzo hasta el exitus). Por tanto, debe iniciarse el tratamiento con antifúngicos empíricamente incluso sin esperar la confirmación definitiva17.
Además de la TC, una de las herramientas más utilizadas en el diagnóstico precoz de la aspergilosis es la detección del galactomanano circulante. Este polisacárido, presente en la pared celular del hongo, puede detectarse en una media de 5-8 días antes del comienzo de los síntomas, y puede servir para monitorizar la respuesta al tratamiento, pues su concentración en suero se correlaciona con la carga fúngica3,18,19.
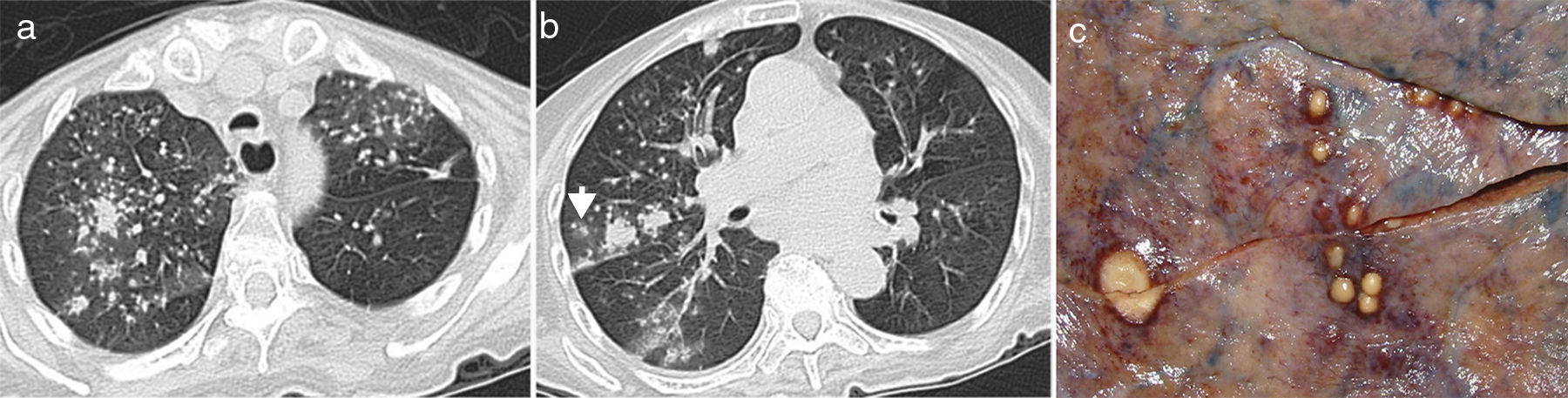
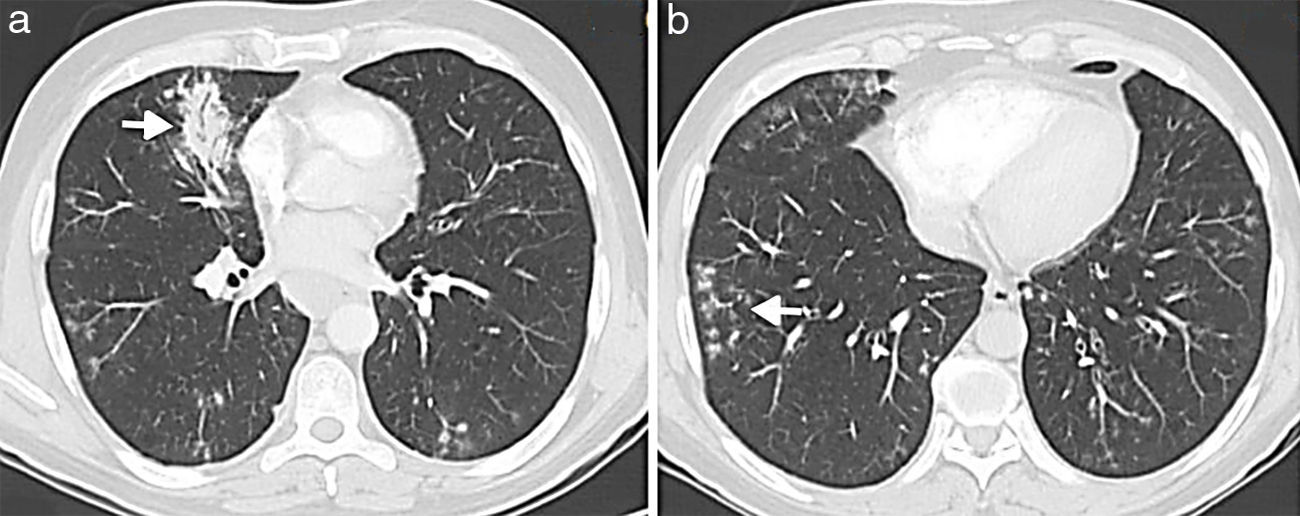
La aspergilosis angioinvasiva se caracteriza por la invasión de arterias pulmonares pequeñas y medianas por las hifas de Aspergillus que producen una trombosis con isquemia, necrosis tisular y, finalmente, diseminación hematógena sistémica. Estos infartos hemorrágicos se ven en la TC como pequeños nódulos y/o consolidaciones periféricas en forma de cuña rodeadas por un halo de aumento de atenuación en vidrio deslustrado. Este anillo periférico en vidrio deslustrado representa la hemorragia alveolar que acompaña a un foco de necrosis isquémica coagulativa y se conoce como «signo del halo»3,4,20,21 (fig. 9). En un estudio de 25 pacientes con neutropenia y aspergilosis invasiva confirmada, Caillot et al.22 establecieron que la incidencia del signo del halo variaba de un 100% en el día 0 hasta un 19% en el día 14, y que las 3/4 partes de los signos del halo vistos en la TC inicial desaparecían a la semana del diagnóstico (fig. 10). La conclusión del estudio fue que el signo del halo es un hallazgo radiológico precoz altamente sugestivo de aspergilosis angioinvasiva, por lo que recomendaban realizar una TC ante la menor sospecha clínica. No obstante, el signo del halo no tiene implicación pronóstica ni es patognomónico de la aspergilosis invasiva. Puede observarse en un amplio espectro de enfermedades pulmonares: granulomatosis de Wegener, neumonía eosinofílica, neumonía organizada criptogenética, infecciones (Herpes simples, Mycobacterium avium complex o Candida), neoplasias primarias (sarcoma de Kaposi, adenocarcinoma o linfoma) y metástasis de tumores hipervasculares (angiosarcoma, coriocarcinoma y osteosarcoma)4,20,21.
Aspergilosis angioinvasiva en una mujer de 86 años con carcinoma de cérvix y neutropenia grave secundaria a tratamiento con quimioterapia (20 neutrófilos/mm3). Imágenes axiales de TCMD con ventana de pulmón (a-b) en las que se aprecian múltiples nódulos mal definidos algunos de los cuales están rodeados por un halo en vidrio deslustrado (flecha blanca). Fotografía del lóbulo medio obtenida de la autopsia de la paciente (c) donde se aprecian múltiples nódulos de coloración amarillenta rodeados por un anillo mal delimitado de color violáceo. Estos hallazgos se corresponden con infartos pulmonares rodeados por una hemorragia periférica.
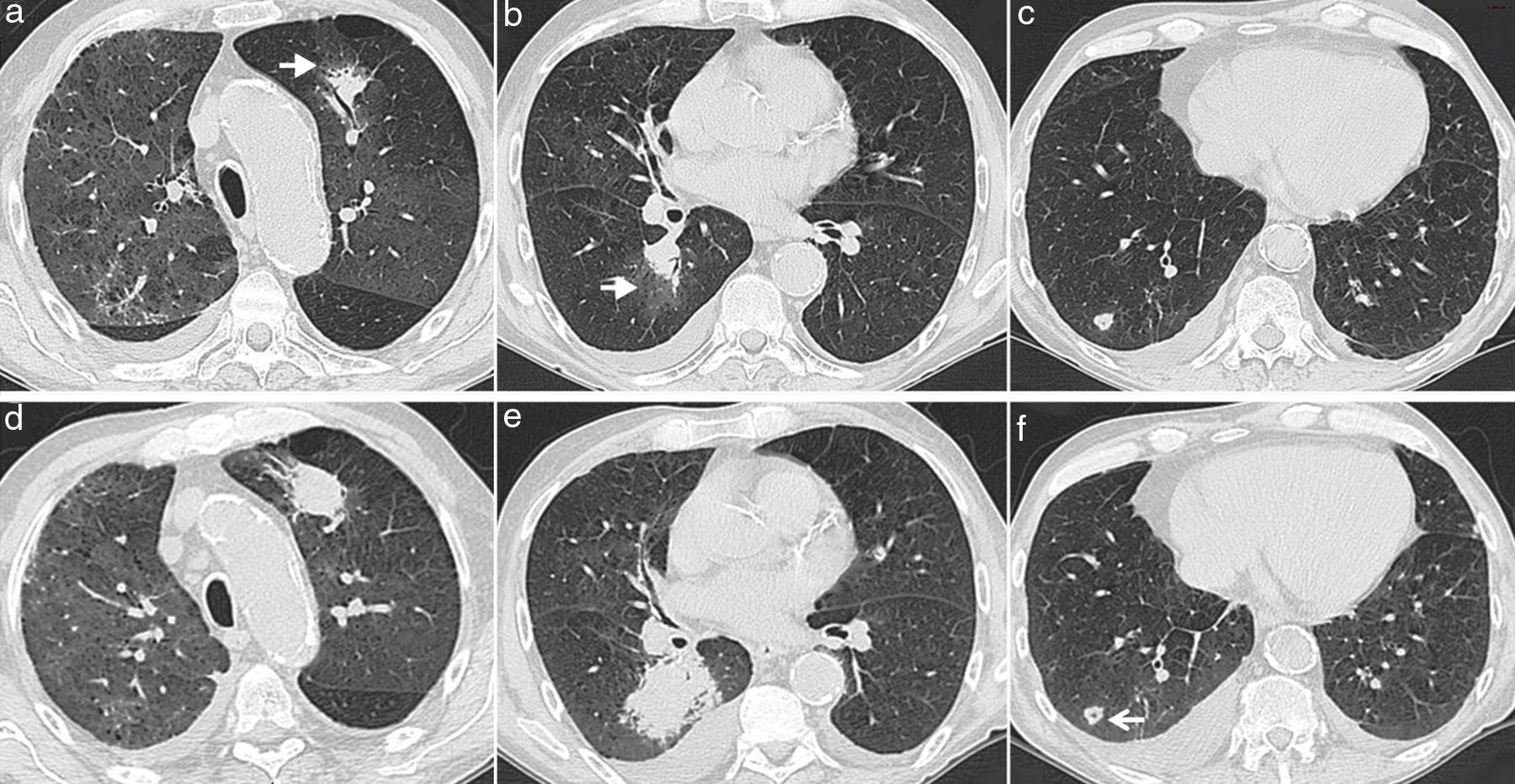
Aspergilosis angioinvasiva en un paciente con trasplante renal con tratamiento inmunosupresor. Se realiza TCMD (a-c) que muestra los hallazgos radiológicos típicos con nódulos/masas rodeados por un halo en vidrio deslustrado (flechas blancas). La TCMD de control obtenida una semana después (d-f) muestra la evolución de las lesiones que han aumentado de tamaño; la lesión localizada en el lóbulo inferior derecho muestra una cavitación central (flecha blanca). El signo del halo ha desaparecido. Existe también una pequeña cantidad de derrame pleural bilateral.
A medida que la enfermedad progresa, los nódulos pueden cavitarse, el parénquima necrótico se despega del parénquima sano que lo rodea formando una semiluna aérea parecida a la que se describe en el aspergiloma3. Este hallazgo se presenta normalmente a las 2-3 semanas de iniciar el tratamiento, y a medida que el paciente se va recuperando de la neutropenia, por lo que es considerado un signo de buen pronóstico6,22,23 (fig. 11).
Aspergilosis angioinvasiva en un paciente de 45 años con neutropenia grave después de un trasplante renal. La TCMD (a) muestra una consolidación parenquimatosa en el lóbulo inferior izquierdo con una cavitación central. b) Dos semanas más tarde, el halo ha desaparecido y la cavidad ha progresado.
La aspergilosis invasiva de la vía aérea o broncoinvasiva incluye bronquitis, bronquiolitis, bronconeumonía y neumonía lobar, todas ellas sin evidencia de invasión vascular. Aunque supone únicamente el 14-34% de los casos de aspergilosis invasiva, en determinados subgrupos de pacientes (trasplantados pulmonares y en inmunosuprimidos por causas no hematológicas) constituye la forma de presentación principal24–26
Los hallazgos más habituales en la TCMD son las consolidaciones parcheadas o nódulos centrolobulillares acompañados de un patrón de árbol en brote. Estos hallazgos son inespecíficos e indistinguibles de aquellos que se dan en las bronconeumonías causadas por otros microorganismos (fig. 12).
Aspergilosis broncoinvasiva en una mujer de 77 años con leucemia linfática crónica y neutropenia grave (270 neutrófilos/mm3). En la TCMD se ve un área de consolidación focal con broncograma aéreo en el lóbulo medio (flecha blanca) (a) y múltiples nódulos centrolobulillares ramificados en ambas bases (flechas blancas) (b). El cultivo de esputo fue positivo para Aspergillus.
Un subtipo especial de aspergilosis broncoinvasiva es la traqueobronquitis aspergilar aguda, también conocida como traquebronquitis seudomembranosa que supone hasta el 5% de los casos de aspergilosis invasiva y afecta principalmente a los pacientes con trasplante pulmonar y a los pacientes con sida3,27–29. La infección normalmente se limita a las paredes traqueales y bronquiales, sin afectar el parénquima pulmonar. Los pacientes refieren normalmente tos, disnea y hemoptisis, pero también pueden permanecer asintomáticos, lo que retrasa el diagnóstico y facilita la progresión de la infección a la pequeña vía aérea desde donde invade fácilmente el parénquima.
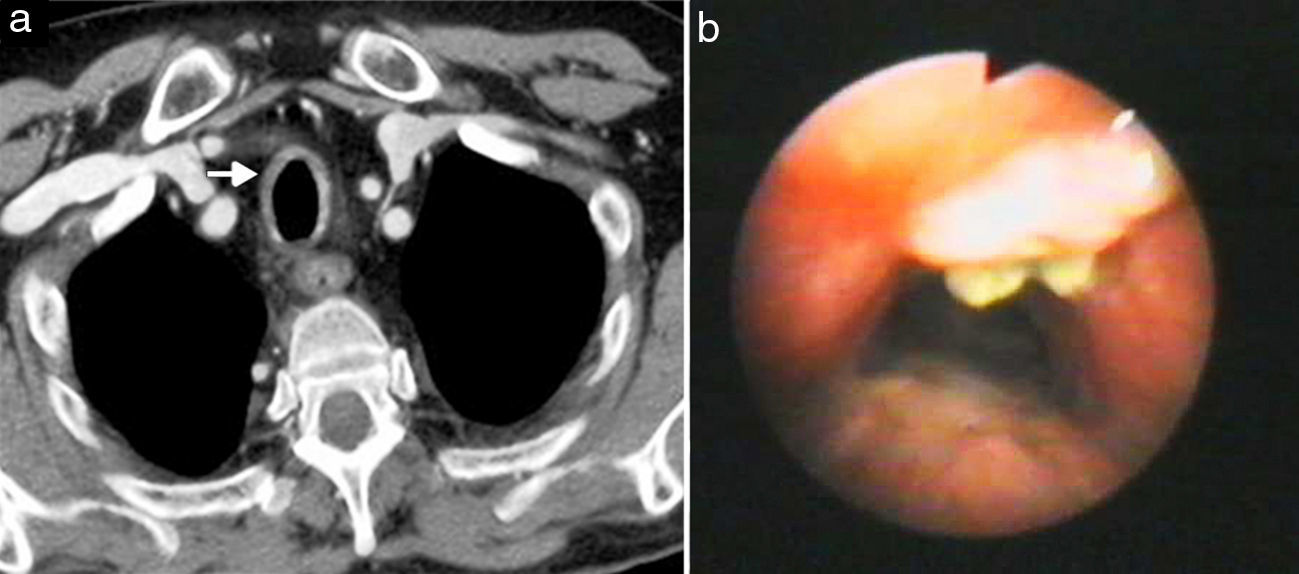
La TC suele ser normal o mostrar un engrosamiento traqueal inespecífico (fig. 13). La broncoscopia y el cultivo del esputo proporcionan el diagnóstico definitivo17,29,30.
Traqueobronquitis aguda por Aspergillus confirmada por broncoscopia en un varón de 52 años portador de trasplante renal. Imágenes axiales de TCMD con contraste intravenoso con ventana de mediastino (a) donde se aprecia un engrosamiento circunferencial de la pared de la tráquea (flecha blanca). Imagen de broncoscopia (b) en la que se observan varias lesiones nodulares blanquecinas sobreelevadas en la pared de la tráquea que correspondían a zonas de crecimiento endobronquial de Aspergillus que se asociaban a densos tapones mucosos.
La aspergilosis es una infección fúngica que produce un amplio espectro de manifestaciones clínico-radiológicas que vienen determinadas principalmente por el estado inmunológico del paciente.
El radiólogo ha de estar familiarizado con las diferentes formas de presentación y debe ser capaz de reconocerlas y evaluarlas en el contexto clínico adecuado. Esto es especialmente relevante en el caso de la aspergilosis invasiva donde la TC de tórax es la herramienta de elección para establecer un diagnóstico precoz.
Autorías- 1.
Responsable de la integridad del estudio: LKF.
- 2.
Concepción del estudio: LKF y SAC.
- 3.
Diseño del estudio: LKF y SAC.
- 4.
Obtención de los datos: LKF y SAC.
- 5.
Análisis e interpretación de los datos: LKF, SAC, AAGR y MASN.
- 6.
Tratamiento estadístico: No procede.
- 7.
Búsqueda bibliográfica: LK.
- 8.
Redacción del trabajo: LKF y SAC.
- 9.
Revisión crítica del manuscrito con aportaciones intelectualmente relevantes: LKF, SAC, AAGR y MASN.
- 10.
Aprobación de la versión final: LKF, SAC, AAGR y MASN.
Los autores declaran no tener ningún conflicto de intereses.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.