Evaluar el rendimiento diagnóstico de ARFI para detectar fibrosis hepática significativa en la edad pediátrica.
Material y métodosEl estudio fue aprobado por el comité de ética hospitalario, con el consentimiento informado de los pacientes o sus representantes. Estudiamos 96 niños (50 varones, 46 hembras; edad media 8 años); 16 voluntarios sin enfermedad hepática conocida y 80 con patologías que pueden evolucionar a fibrosis y cirrosis hepática. La muestra final incluyó 31 pacientes con biopsia y 16 controles sanos. En todos los casos se realizó ecografía abdominal incluyendo Doppler y elastografía con ARFI. El valor ARFI expresado como velocidad (m/s) de propagación de las ondas transversales a través del tejido se calculó promediando 16 medidas en ambos lóbulos hepáticos. Comparamos las medias con el test de ANOVA de un factor. Los tests t de Student y chi cuadrado se usaron para datos categóricos. La significación estadística se estableció para una p<0,05.
ResultadosLa velocidad en niños con fibrosis ≥ F2 fue significativamente más alta (1,80±0,45m/s) que en controles y pacientes con F0-F1 (1,38±0,22m/s) (p<0,001). La esteatosis no se relacionó con la velocidad. La actividad necroinflamatoria se relacionó muy significativamente con la velocidad (p<0,01). Fibrosis y actividad necroinflamatoria se relacionaron muy significativamente (p<0,0001).
ConclusiónLa velocidad de propagación de las ondas ARFI se relacionó significativamente en los niños con el grado de fibrosis hepática.
To evaluate the diagnostic performance of acoustic radiation force impulse imaging (ARFI) in detecting significant hepatic fibrosis in children.
Material and methodsOur hospital's ethics committee approved the study and all patients or their representatives provided informed written consent. We included 96 children (50 boys, 46 girls; mean age, 8 y). We also studied 16 volunteers without liver disease as controls and 80 patients with diseases that can lead to fibrosis and cirrhosis of the liver. The final sample included 31 patients with biopsies and the 16 controls.
All patients underwent abdominal ultrasonography including Doppler imaging and elastography with ARFI. The ARFI value, expressed as velocity (m/s) of shear wave propagation through the tissue, was calculated by averaging 16 measurements in both liver lobes.
We used one-way analysis of variance to compare means between groups; we set statistical significance at P<.05. We used Student's t-tests and chi-square tests for categorical data.
ResultsThe ARFI value in children with fibrosis ≥ F2 was higher (1.80±0.45m/s) than in controls and higher than in patients with F0-F1 (1.38±0.22m/s). The difference was significant (P<.001) for detecting F ≥ 2. Steatosis was not related with the ARFI value (Student's t-test, P>.84). Necroinflammatory activity was strongly associated with the ARFI value (Student's t-test, P<.01). Fibrosis and necroinflammatory activity were strongly associated with each other (chi-square test, P<.0001).
ConclusionThe speed of shear wave propagation is significantly associated with the degree of hepatic fibrosis in children.
Cuando se evalúa la enfermedad hepática crónica difusa, estimar el grado de fibrosis es clave para estadificar la enfermedad, tomar decisiones terapéuticas, monitorizar la enfermedad y establecer un pronóstico. La biopsia hepática es una técnica cruenta cara, con riesgo de complicaciones graves1,2, que además de la variabilidad inter e intraobservador al estimar el grado de fibrosis, puede no reflejar la actividad global de la enfermedad3-5. Frente a ella, los biomarcadores serológicos y la elastografía de transición (FibroScan®, Echosens, París, Francia)6, que mide la rigidez del hígado, son métodos incruentos desarrollados para valorar fibrosis hepática. Ambas técnicas son sencillas y bien toleradas por los pacientes. Pero FibroScan® también tiene limitaciones y en aproximadamente un 5% de los pacientes, sobre todo en casos de obesidad y ascitis, no puede medir fiablemente7. Entre las alternativas hay técnicas de imagen en desarrollo, como la elastografía y la difusión hepática por resonancia magnética, el análisis digital óptico de las imágenes del hígado por tomografía computarizada y la elastografía tisular en tiempo real8,9. Aunque los resultados preliminares son alentadores, estas técnicas son más caras, no están en muchos centros asistenciales y consumen demasiado tiempo para que puedan aplicarse clínicamente en la fibrosis hepática.
La técnica Acoustic Radiation Force Impulse (ARFI) es un método para cuantificar virtualmente la rigidez hepática con un software integrado (Virtual Touch Tissue Quantification, Siemens, Erlangen, Alemania) en un ecógrafo convencional. Consiste en emitir un tren de pulsos cortos (≈ 100μs) de alta energía y frecuencia de repetición baja (pulse repetition frequency) con un transductor modificado. Los pulsos alteran mecánicamente el tejido y provocan ondas que producen microdesplazamientos locales perpendiculares (transversales) a la dirección de los pulsos acústicos. ARFI permite medir la velocidad de propagación de las ondas, un parámetro biológico considerado análogo a la elasticidad. Varios estudios realizados en adultos han evaluado la utilidad clínica de ARFI para estimar y clasificar la fibrosis hepática10-14, valorar nódulos tiroideos, nódulos mamarios, tumores hepáticos y renales, caracterizar placas de ateroma y monitorizar los resultados de la ablación por radiofrecuencia15-18. En los niños, un grupo variado de enfermedades hepáticas puede producir fibrosis y evolucionar hacia la cirrosis a medio o largo plazo19. La fibrosis hepática no es una lesión estática20,21 y puede mejorar o empeorar dependiendo de la actividad de la enfermedad, lo que justifica la necesidad de monitorizarla.
Los estudios sobre la utilidad de ARFI en el seguimiento de la enfermedad hepática crónica en los niños son escasos22-27. El propósito de este es evaluar el rendimiento diagnóstico de la elasticidad hepática medida con ARFI para detectar fibrosis significativa en niños con hepatopatía crónica difusa progresiva.
Material y métodosPacientesEl estudio fue aprobado por el comité de ética del hospital y se obtuvo el consentimiento informado de los pacientes o sus representantes.
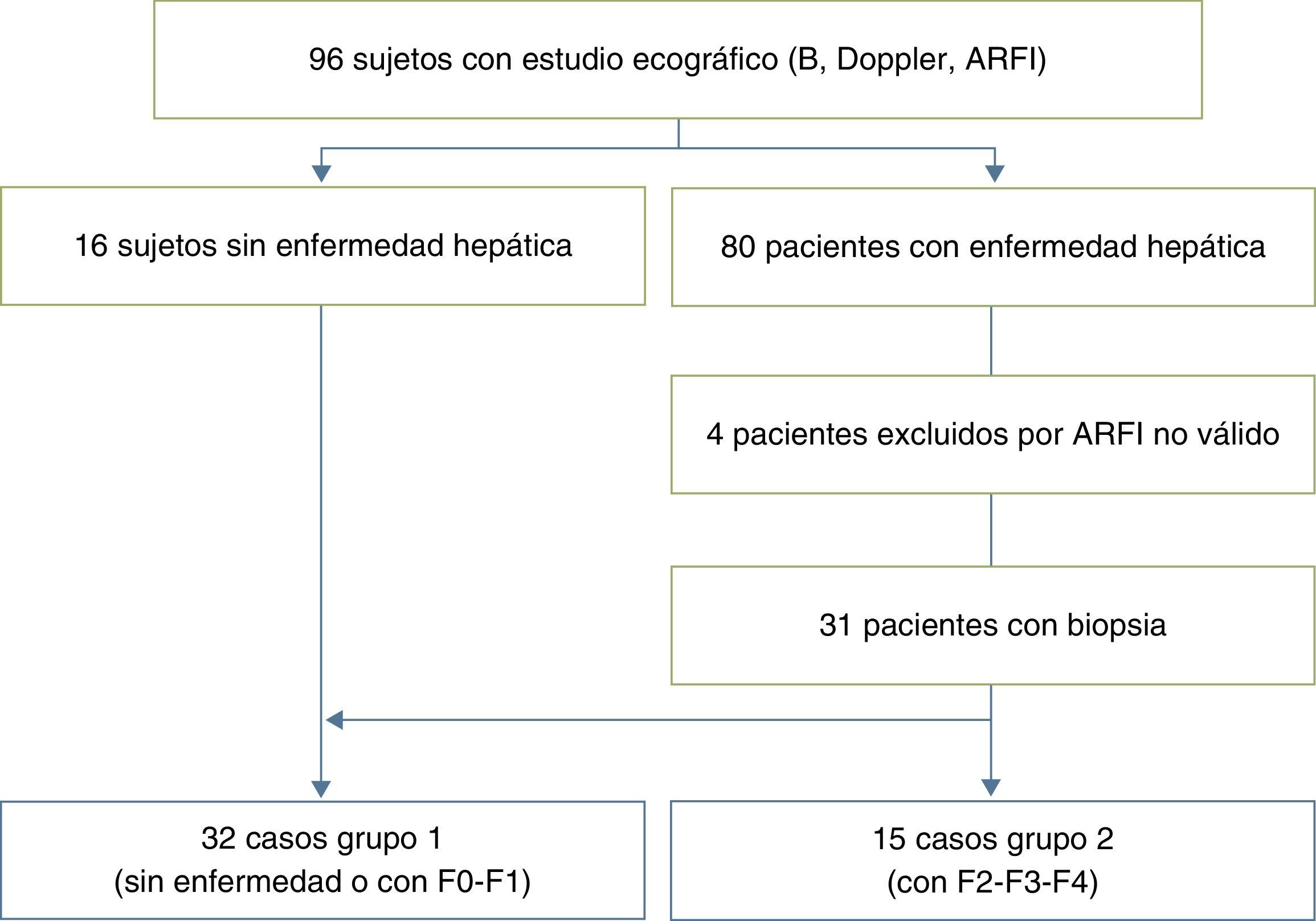
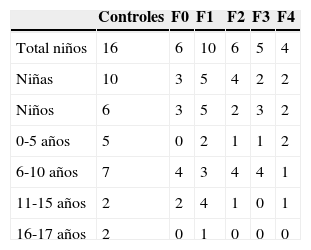
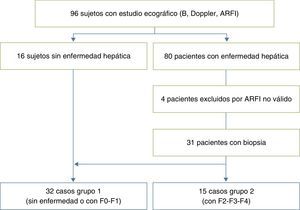
Estudiamos prospectivamente a 96 niños (50 varones, 46 mujeres; edad media 8 años; rango, 4 meses-17 años), divididos en 16 controles voluntarios sin enfermedad hepática conocida y 80 pacientes seguidos por enfermedades que pueden producir fibrosis y cirrosis hepática. De ellos fueron excluidos 4 por resultados ARFI no válidos. Del resto, 13 pacientes tenían fibrosis quística; 13 hepatitis vírica crónica (3 hepatopatía por virus B; 7 hepatopatía por virus C; 3 hepatopatía por citomegalovirus y virus de Epstein-Barr); 10 atresia de vías biliares; 6 síndrome metabólico; 5 hipertransaminasemia multifactorial; 4 pacientes alteraciones vasculares (canal auriculoventricular común y cavernomatosis portal); 4 déficit de alfa-1 antitripsina; 4 cirrosis criptogenética; 3 enfermedad de Wilson; 3 fibrosis hepática congénita; 3 cirrosis autoinmune; 3 pacientes tratados con fármacos quimioterápicos; 2 con tirosinema; 2 glucogenosis; 2 con esteatosis hepática, y 3 casos aislados de hepatitis de etiología desconocida, poliquistosis renal autosómica recesiva y anemia de Fanconi con hemosiderosis. De esta muestra se extrajo a 31 pacientes a los que se había hecho una biopsia en el año anterior al estudio ARFI (5 pacientes con atresia de vías biliares; 2 con síndrome Alagille; 2 con glucogenosis ix; uno con tirosinemia; uno con fibrosis hepática congénita; 2 con hepatitis autoinmune; uno con hiperplasia nodular regenerativa; 6 con hepatitis C crónica; 3 con hepatitis B crónica; uno con hepatitis por virus de Epstein-Barr; 3 con enfermedad de Wilson; uno con hipobetalipoproteinemia; uno con canal auriculoventricular común; uno con un quiste de colédoco IVA; uno con anemia de Fanconi), que, junto a los 16 controles, formaron la serie final de 47 niños seleccionada para el estudio.
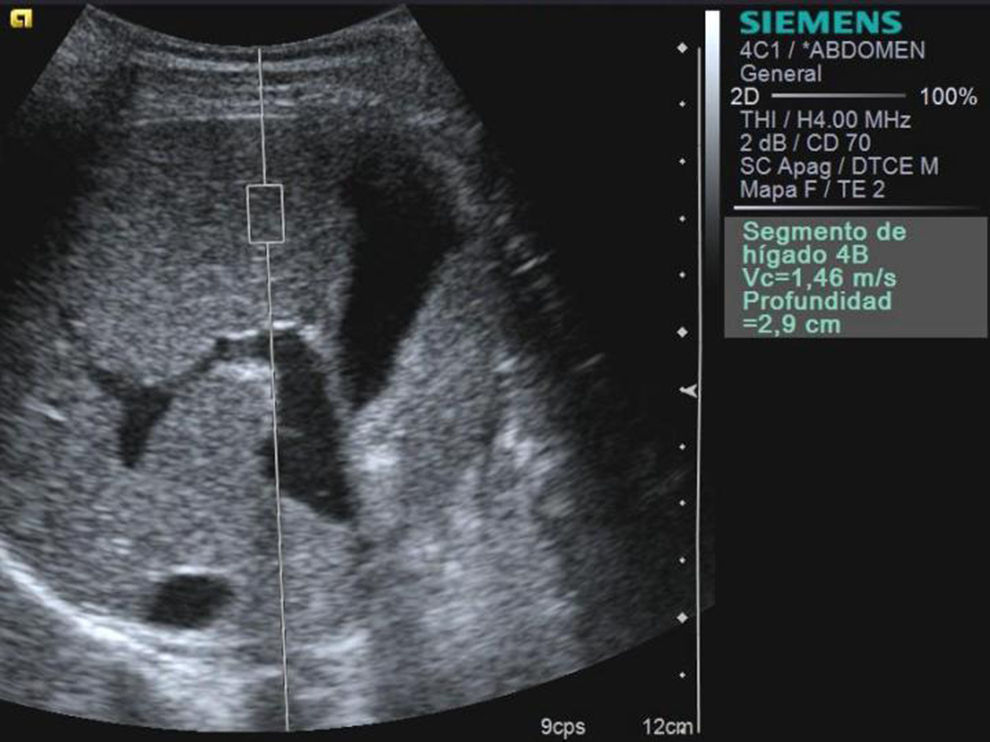
MétodoTodos los participantes se estudiaron en una misma sesión con ecografía abdominal en modo B, Doppler y elastografía hepática con técnica ARFI con un ecógrafo ACUSON S2000™ US system (Siemens Healthcare, Erlangen, Alemania) y un transductor convencional de 4MHz, pulsos ultrasónicos de alta energía y de corta duración. La evaluación se realizó independientemente por 3 radiólogas con experiencia de más de 10 años en ecografía abdominal y 2 años de experiencia en ARFI. Para ello, el operador fijó una región de interés (ROI) rectangular de tamaño predeterminado (10mm de longitud y 6mm de ancho; y 2 mm3 de volumen) a más de 1cm por debajo de la superficie del hígado y a una profundidad máxima de 8cm desde la superficie cutánea (fig. 1). Se escogieron zonas libres de vasos sanguíneos grandes. Los pacientes se examinaron en decúbito supino con el brazo derecho en abducción máxima. Se hicieron en total 16 medidas en ambos lóbulos hepáticos, con el paciente respirando suavemente y evitando las zonas próximas al corazón, entrando por los espacios intercostales para el lóbulo hepático derecho y por el espacio subxifoideo para el izquierdo. La velocidad de propagación de la onda transversal, expresada en m/s, se consideró como marcador de la elasticidad en la ROI28-30. El resultado de cada estudio fue la media de todos los valores obtenidos durante el examen.
Análisis anatomopatológicoSe obtuvieron muestras del hígado en 31 pacientes mediante punción biopsia TruCut, con una aguja automática BioPince Full Core Biopsy Instrument de 18G. Se realizó al menos un pase con acceso subcostal para obtener un cilindro de 23-33mm de longitud. Solo se usaron las muestras de biopsia con más de 4 tractos portales intactos. Se valoraron semicuantitativamente la actividad necroinflamatoria, la fibrosis hepática y la esteatosis, de acuerdo con el sistema METAVIR. La fibrosis se estratificó en una escala de 0-4: F0, sin fibrosis; F1, fibrosis portal sin septos; F2, fibrosis portal con algunos septos; F3, numerosos septos, sin cirrosis, y F4, cirrosis. La muestra de pacientes se clasificó en 2 grupos de acuerdo con esta escala: grupo i, controles y pacientes F0-F1, y grupo ii, pacientes F2-F4 (fig. 2). La actividad necroinflamatoria se clasificó en: A0, sin actividad necroinflamatoria; A1, escasa; A2, moderada, y A3, actividad importante. La esteatosis se clasificó según una valoración visual como: E0, no esteatosis; E1, esteatosis en menos del 33% de hepatocitos; E2, esteatosis entre el 33 y el 66% de los hepatocitos, y E3, esteatosis en más del 66% de los hepatocitos.
Análisis estadísticoLos valores de velocidad de la onda de cizallamiento se expresaron como media ± desviación estándar y se comprobó la distribución normal con la prueba Kolmogorov-Smirnov (p<0,0001). Las diferencias entre las medias se analizaron con el test ANOVA de un factor. Se consideró como estadísticamente significativa una p<0,05. Una vez comprobada la diferencia de las medidas ARFI entre los grupos i y ii, y tras representarla gráficamente en un plano cartesiano, se definieron los centroides (uno para cada grupo), que en este caso, al tratarse de un estudio monofactorial, coinciden con la media de medidas del grupo. El punto de corte se determinó identificando el punto intermedio de la línea que une ambos centroides (distancia euclidiana). Tras obtenerlo, se determinaron analíticamente los valores de sensibilidad y especificidad aplicando las fórmulas matemáticas que evalúan los verdaderos positivos, verdaderos negativos, falsos positivos y falsos negativos sobre los datos ya adquiridos. Para comparar esteatosis y actividad necroinflamatoria con los datos ARFI se aplicó el test t de Student, y la prueba de la chi cuadrado (χ2) para determinar la asociación de los datos ARFI con el grado de fibrosis y actividad necroinflamatoria en el hígado. El programa utilizado para el análisis estadístico fue el SPSS 12.0 (SPSS Inc., Chicago, EE. UU.).
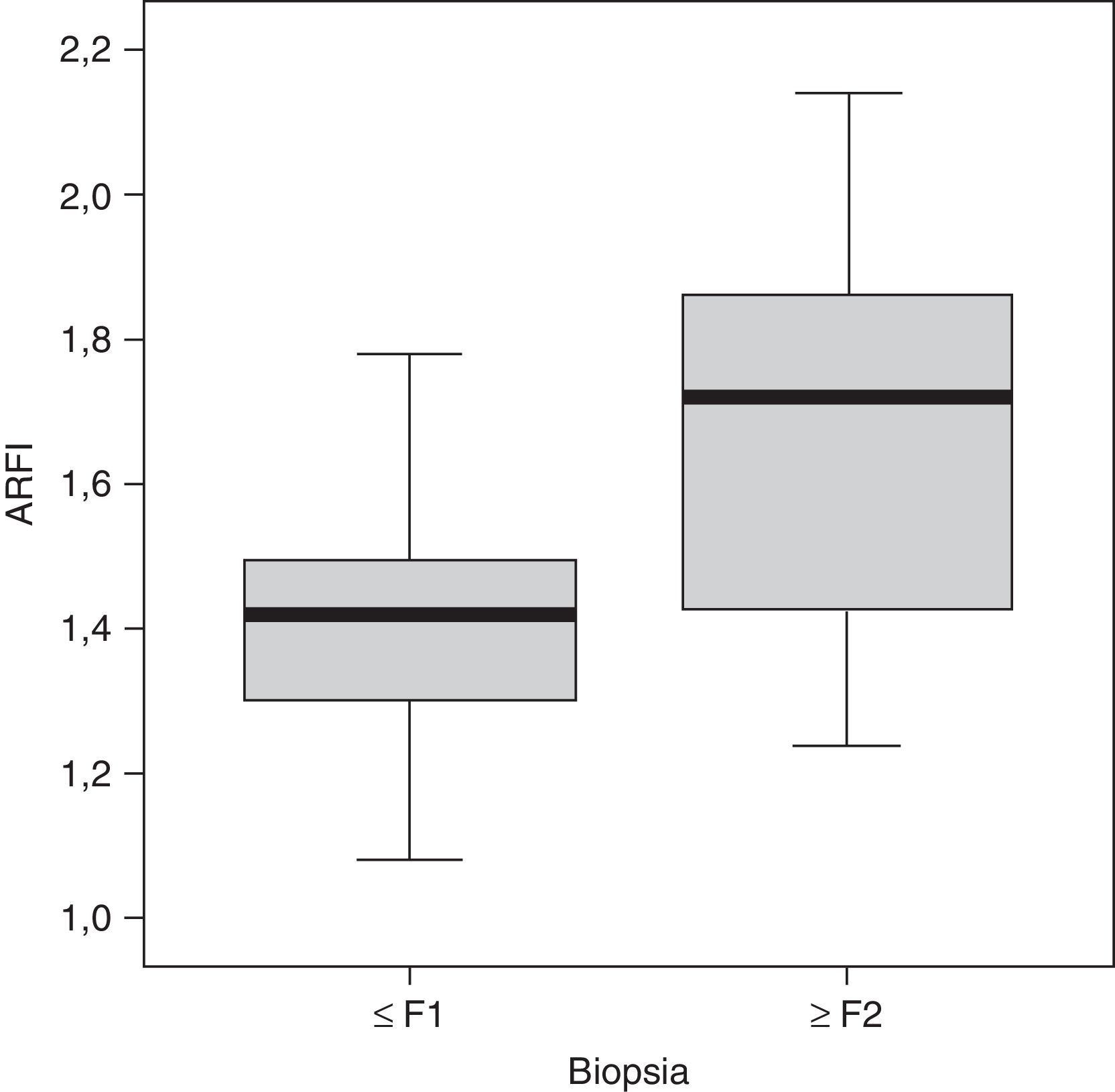
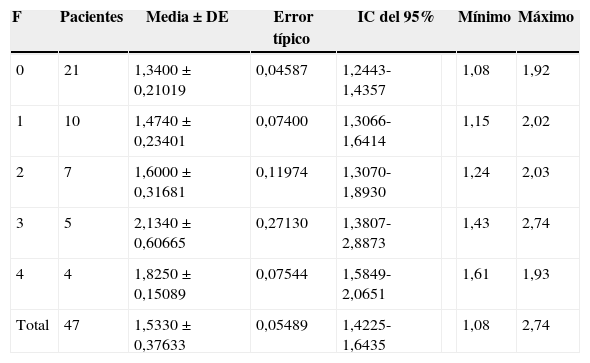
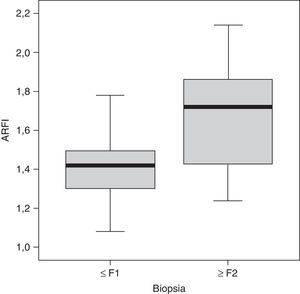
ResultadosSe realizó la biopsia en 31 pacientes con enfermedad hepática crónica difusa. En 16 el resultado fue de no fibrosis o de fibrosis no significativa (F0-F1), que, junto con los 16 controles, formaron el grupo i. En 15 pacientes, el resultado fue de fibrosis significativa (≥ F2) y formaron el grupo ii del estudio (tabla 1). Observamos una tendencia a la elevación de la velocidad en el estadio F2 y una elevación evidente en los estadios más avanzados (F3-F4). Los valores se solaparon entre individuos sin enfermedad hepática y estadios F0-F1 (tabla 2), lo que hacía difícil distinguirlos. El análisis de la varianza (ANOVA) mostró diferencias significativas (F[1,43]=17,81, p<0,000) entre el grupo i y el grupo ii. La velocidad media de la onda en los grupos i y ii fue de 1,38±0,22m/s y 1,80±0,45m/s, respectivamente. Los centroides de ambos grupos se separaron más con un valor de corte de 1,52m/s, para el que la sensibilidad, la especificidad, el valor predictivo positivo y negativo, y la precisión para diagnosticar la fibrosis hepática ≥ F2 fueron del 73,68, el 83,33, el 73,68, el 83,33 y el 79,59%, respectivamente (fig. 3). La esteatosis no se relacionó con la velocidad de propagación de la ondas pero la actividad necroinflamatoria lo hizo muy significativamente (p<0,01). Por su parte, fibrosis y actividad necroinflamatoria se relacionaron también muy significativamente (p<0,0001).
Velocidad de la onda en relación con el estadio anatomopatológico de fibrosis hepática (METAVIR)
| F | Pacientes | Media±DE | Error típico | IC del 95% | Mínimo | Máximo | |
|---|---|---|---|---|---|---|---|
| 0 | 21 | 1,3400±0,21019 | 0,04587 | 1,2443-1,4357 | 1,08 | 1,92 | |
| 1 | 10 | 1,4740±0,23401 | 0,07400 | 1,3066-1,6414 | 1,15 | 2,02 | |
| 2 | 7 | 1,6000±0,31681 | 0,11974 | 1,3070-1,8930 | 1,24 | 2,03 | |
| 3 | 5 | 2,1340±0,60665 | 0,27130 | 1,3807-2,8873 | 1,43 | 2,74 | |
| 4 | 4 | 1,8250±0,15089 | 0,07544 | 1,5849-2,0651 | 1,61 | 1,93 | |
| Total | 47 | 1,5330±0,37633 | 0,05489 | 1,4225-1,6435 | 1,08 | 2,74 | |
DE: desviación estándar; F: fibrosis; IC: intervalo de confianza.
Según nuestros datos, para conseguir una sensibilidad igual o superior al 95% la velocidad media de propagación de la onda debe ser inferior a 1,24m/s. Para conseguir una especificidad igual o superior al 95%, este valor debe estar por encima de 1,62m/s. De acuerdo con estos datos, podrían definirse 2 zonas de seguridad en las que, sin necesidad de biopsia, la fibrosis hepática puede cuantificarse con ARFI con sensibilidad o especificidad elevadas: hasta 1,23m/s, la sensibilidad es muy alta; de 1,24m/s a 1,62m/s, es una zona de incertidumbre; a partir de 1,62m/s, la especificidad es muy alta.
DiscusiónNuestros resultados indican que la velocidad media en niños con fibrosis hepática significativa (≥ F2) medida con ARFI es significativamente más alta (1,80±0,45m/s) que en niños sin fibrosis o fibrosis no significativa (1,38±0,22m/s).
Estratificar la fibrosis hepática es esencial para el diagnóstico precoz, seguimiento y tratamiento adecuado de los pacientes con enfermedad hepática crónica. La biopsia hepática, patrón de referencia1-5, no puede considerarse única herramienta para monitorizar estas enfermedades en la edad pediátrica porque es cruenta, necesita sedación y puede asociar complicaciones graves. Entre las técnicas no invasivas desarrolladas para valorar la fibrosis hepática están los marcadores serológicos (Fibrotest, APRI, entre otros), utilizados en adultos para predecir la fibrosis hepática, pero imprecisos en niños31, y FibroScan®, que tiene desventajas técnicas (profundidad de medida fija, no se ve en qué zona se toma la medida, uso limitado en caso de obesidad y ascitis). ARFI es una nueva herramienta con ventajas probadas en adultos32–36. La exactitud diagnóstica de ARFI es similar a la de FibroScan®, pero tiene ventajas añadidas: puede usarse en pacientes con los espacios intercostales estrechos, con ascitis y con obesidad mórbida37. Además, la esteatosis hepática no parece tener una influencia estadísticamente significativa en sus resultados21.
La mayoría de estudios sobre la utilidad de ARFI para estudiar la fibrosis hepática se han hecho en la población adulta. Son muy pocos los que hacen referencia al rango normal de velocidad de propagación de ondas en niños sanos y en grupos de niños afectados de enfermedad hepática crónica difusa22,31. No hay un protocolo estandarizado de las frecuencias, el número y la profundidad para medir la velocidad. Algunos trabajos refieren velocidades mayores en el lóbulo hepático izquierdo y recomiendan medir solo en el derecho32,38,39. En nuestro estudio con ARFI, la velocidad media en el grupo i fue de 1,38±0,22m/s. Este resultado se obtuvo considerando las medidas obtenidas en ambos lóbulos. En los niños, el lóbulo hepático izquierdo es proporcionalmente más grande que el derecho y no tiene las limitaciones descritas en los adultos. Por ello medimos también en los segmentos ii, iii, ivA y ivB, para valorar la situación global del hígado. Esto puede haber introducido un error en el promedio en nuestros resultados y explicar que nuestros valores en el grupo i sean más elevados que en otros estudios23,24,26, pero entendemos que medir solo en el lóbulo hepático derecho hubiera introducido un error de muestreo. No obstante, teniendo en cuenta los resultados publicados y las recomendaciones realizadas por otros autores, serán necesarios más estudios para llegar a un consenso en la realización de la técnica.
Al analizar las categorías de fibrosis, observamos una tendencia a la elevación de la velocidad con el aumento de la fibrosis (≥ 2), pero no permiten distinguir los niños normales de la fibrosis inicial, lo que coincide con otros trabajos publicados. No obstante, hay discordancia entre velocidad media en el grupo de individuos con enfermedad hepática crónica difusa de nuestra serie (1,80±0,45m/s) y los resultados de Noruegas et al. (1,42±0,07m/s), y Hanquinet et al. (1,99±0,99m/s). Esto puede deberse a los diferentes criterios para establecer los grupos de estudio22,24.
La principal aportación de nuestro estudio ha sido determinar el rendimiento diagnóstico de ARFI para detectar la fibrosis hepática significativa sin necesidad de biopsia. Sin embargo, hay que reconocer algunas limitaciones. En primer lugar, se trata de un estudio prospectivo, abierto, pero no controlado; la inclusión ha sido aleatoria y se hizo ARFI a pacientes con o sin enfermedad hepática conocida que pueda evolucionar a fibrosis. Por otro lado, no estudiamos la variabilidad interobservador ni pudimos disponer de resultados anatomopatológicos del hígado de todos los niños incluidos. La biopsia solo se hizo a los niños que se remitieron desde el departamento de gastroenterología por empeoramiento de los parámetros clínicos y biológicos de la función hepática, lo que supone un sesgo en la selección de la muestra. Además, la actividad necroinflamatoria se relacionó muy significativamente con los datos de ARFI (p<0,01), y la fibrosis y la actividad necroinflamatoria también lo hicieron muy significativamente (p<0,001). Por ello no se pudo determinar si la velocidad de propagación de las ondas estaba alterada por la fibrosis o por la actividad necroinflamatoria, presentes a la vez y de la misma forma (a más fibrosis, más actividad necroinflamatoria) en nuestra serie. Finalmente, debe tenerse también en cuenta que en la evolución de fibrosis a cirrosis hepática, la atrofia y la pérdida de masa del hígado, que aproxima tractos portales y venas hepáticas, y la congestión puedan intervenir en la pérdida de elasticidad hepática, sin olvidar los efectos de confusión que pueden tener la insuficiencia cardíaca y colestasis que puedan asociarse40. Pese a todo, nuestros resultados y los ya publicados en series pediátricas son congruentes con los de estudios en otros grupos de edad15,30,32,33,35 y muestran que ARFI es un método sencillo sin efectos secundarios y con buena rentabilidad diagnóstica para determinar la fibrosis midiendo la velocidad de propagación de las ondas transversales.
En conclusión, ARFI permite discriminar entre niños con fibrosis ≥ F2 de niños normales o con grados leves de fibrosis. Puesto que la fibrosis hepática es un proceso continuo y progresivo, que precisa controles repetidos, y que la biopsia (por ser una técnica cruenta y con riesgos) no es adecuada para monitorizar la enfermedad, la elastografía con técnica ARFI es un procedimiento incruento, sencillo y útil, bien aceptado por los niños y que puede repetirse muchas veces en el curso de la enfermedad.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Autoría- 1.
Responsable de la integridad del estudio: SDPA.
- 2.
Concepción y diseño del estudio: SDPA, DMV, CSN, LMB.
- 3.
Obtención de datos: SDPA, DMV, CSN.
- 4.
Análisis e interpretación de datos; tratamiento estadístico: SDPA, GGM, LMB.
- 5.
Búsqueda bibliográfica: SDPA.
- 6.
Redacción del trabajo: SDPA, DMV, GGM, CSN, LMB.
- 7.
Revisión crítica del manuscrito con aportaciones intelectualmente relevantes: SDPA, DMV, GGM, CSN, LMB.
- 8.
Aprobación de la versión final: LMB.
- 9.
Todos los autores han leído y aprueban la versión final del artículo.
Los autores declaran no tener ningún conflicto de intereses.
Queremos agradecer su generosa colaboración a los Dres. Fernando Aparici Robles y María Jesús Esteban Ricós del Servicio de Radiología del HUP La Fe de Valencia, que contribuyeron, respectivamente, a la creación de bases de datos y a la realización de biopsias hepáticas, cuyos resultados han sido utilizados en este trabajo.