La ecografía se ha convertido en una herramienta sumamente útil en la valoración de masas y lesiones en la cabeza y el cuello. Permite determinar la localización anatómica, así como las características del tejido que compone las lesiones en estudio. De esta manera conseguimos orientar el diagnóstico diferencial hacia lesiones inflamatorias, neoplásicas, congénitas, traumáticas o vasculares. Sí es cierto que para establecer la extensión completa de determinadas lesiones hay que apoyarse en el escáner o la resonancia. Los procedimientos intervencionistas, gracias a la guía ecográfica principalmente, han visto crecer sus indicaciones, por lo que actualmente pueden realizarse biopsias, drenajes, infiltraciones, tratamientos mediante esclerosis y ablaciones de tumores.
Ultrasonography has become extremely useful in the evaluation of masses in the head and neck. It enables us to determine the anatomic location of the masses as well as the characteristics of the tissues that compose them, thus making it possible to orient the differential diagnosis toward inflammatory, neoplastic, congenital, traumatic, or vascular lesions, although it is necessary to use computed tomography or magnetic resonance imaging to determine the complete extension of certain lesions. The growing range of interventional procedures, mostly guided by ultrasonography, now includes biopsies, drainages, infiltrations, sclerosing treatments, and tumor ablation.
Los procedimientos percutáneos pueden realizarse utilizando como guía cualquiera de los métodos de imagen radiológica. La selección de uno u otro depende de diversos factores, entre ellos la localización de la lesión, la disponibilidad del equipo, las características del paciente y, sobre todo, la preferencia o experiencia personal del radiólogo.
La ecografía es una técnica ideal para la evaluación de las lesiones cervicales, a excepción de aquellas de localización profunda, para las que es preciso utilizar otras técnicas de imagen, como la tomografía computarizada (TC) o la resonancia magnética (RM). Es por ello que la ecografía se considera la herramienta de elección para realizar procedimientos intervencionistas en el cuello en las lesiones que son visibles en la exploración sonográfica1. Tiene la ventaja añadida de que no emite radiaciones ionizantes y funciona en tiempo real, lo que permite monitorizar de forma continua cualquier procedimiento al visualizar la aguja o el instrumento utilizados. Además, puede emplearse para controlar el resultado de los procedimientos y para el seguimiento de las lesiones tratadas.
Los procedimientos que pueden llevarse a cabo con control ecográfico son diversos: biopsias de lesiones, aspiración y drenaje de quistes o abscesos, esclerosis, inyecciones de sustancias como toxina botulínica o corticoides, ablación, etc.
Estas intervenciones tienen las ventajas de su amplia versatilidad, disponibilidad y bajo coste en comparación con las alternativas diagnósticas o terapéuticas, y para realizar la mayoría de ellas sólo se requiere una moderada habilidad2. Sin embargo, también tienen limitaciones en el acceso a lesiones de localización profunda y a las situadas detrás de aire o hueso.
RequisitosConsentimiento informadoEs necesario el consentimiento informado del paciente.
HemostasiaLas alteraciones de la coagulación no son en general una contraindicación para procedimientos en lesiones superficiales, en las que puede obtenerse una adecuada hemostasia mediante presión directa, algo que casi siempre es posible en la cara y el cuello3.
Planificación del procedimientoEs preciso identificar, caracterizar y localizar de forma precisa la lesión mediante el estudio con cualquier técnica de imagen de que dispongamos. Para todo procedimiento intervencionista con ecografía, la lesión debe ser visible por esta técnica y la aguja tiene que visualizarse a lo largo de todo su trayecto.
Los transductores ideales en la región cervical son los lineales de alta resolución (7-12MHz). En ocasiones excepcionales, en lesiones de localización profunda puede ser necesario utilizar sondas de 3,5MHz. Es muy importante complementar la exploración con el uso del Doppler color para identificar posibles vasos cercanos, cuya lesión hay que evitar.
AsepsiaEs importante mantener una asepsia estricta del punto de punción mediante el uso de antisépticos tópicos, así como la esterilidad del material que se va a utilizar.
AnalgesiaLa mayor parte de los procedimientos pueden ser realizados con anestesia local. El óxido nitroso inhalado es otra alternativa interesante para lograr una analgesia de corta duración. En procedimientos dolorosos, como la ablación, o en pacientes pediátricos, a veces es imprescindible utilizar técnicas de sedación.
Técnica generalComo regla general, el trayecto ideal de las agujas en los procedimientos guiados por ecografía es el más paralelo a la superficie del transductor. Esa orientación aumentará la ecogenicidad de la aguja y permitirá que se visualice mejor.
Técnicas de guiado de los procedimientos- •
Técnica de manos libres:
Consiste en utilizar una mano para introducir el material mientras se controla su trayecto con la sonda que se sostiene libremente con la otra mano. Permite una mayor libertad al elegir el trayecto de entrada y poder ajustar el plano de acceso durante el procedimiento2.
- •
Sistemas de guía adaptados a la sonda:
Existen guías que se instalan en el transductor o sondas diseñadas con orificios para introducir el material o dirigir los procedimientos2. Estos sistemas hacen los procedimientos más asequibles a operadores inexpertos, pero son más caros.
BiopsiasLa biopsia suele ser necesaria para complementar el diagnóstico en muchas afecciones de cabeza y cuello. Las técnicas de biopsia, como la punción aspiración con aguja fina (PAAF) o la biopsia con aguja gruesa (BAG), son una alternativa muy eficaz a la biopsia quirúrgica2.
Técnicas de biopsia percutánea- •
PAAF:
Mediante esta técnica se obtiene un aspirado celular para su análisis citológico. Normalmente se usan agujas finas (20-25G). Es barata, relativamente no invasiva, bien tolerada y rápida, con amplia aceptación para el diagnóstico de adenopatías, patología de glándulas salivares y tiroidea4,5. Su principal inconveniente es la alta tasa de diagnósticos insuficientes (en torno al 10-30%) y que con frecuencia no permite más que un diagnóstico de benignidad o malignidad2,6. Es muy dependiente del operador, de la pericia del citólogo y de los medios disponibles en cuanto a posprocesado. La repetición de la PAAF no siempre proporciona el diagnóstico definitivo.
- •
BAG:
La BAG proporciona una muestra histológica conservando la arquitectura tisular. Esto permite obtener cilindros de tejido que pueden someterse a análisis histológico, incluyendo técnicas inmunohistoquímicas, y realizar además improntas del espécimen o centrifugado del líquido de transporte para realizar un análisis citológico añadido. La rentabilidad diagnóstica no depende tanto de la experiencia del patólogo2. En esta técnica se usan agujas más gruesas (14-18G), que pueden ser de manejo manual o automáticas. La BAG presenta una sensibilidad y una especificidad muy altas, con una tasa muy baja de complicaciones, y hoy se considera una técnica ampliamente establecida2,7–9. Los resultados publicados muestran igualmente un excelente rendimiento de la BAG para las lesiones de cabeza y cuello. Aunque su uso no está tan extendido como en otras localizaciones, la BAG es ampliamente reconocida como segura y efectiva en adenopatías cervicales, glándulas salivares y tiroides2. Además, el procedimiento puede realizarse de forma ambulatoria.
A pesar de que hay autores que no la consideran una alternativa a la PAAF, afirmando que no reemplaza a la biopsia escisional en lesiones de cabeza y cuello10, en nuestra experiencia presenta una correlación casi perfecta con el resultado de la cirugía, por lo que la consideramos el método de investigación más útil en esta área anatómica.
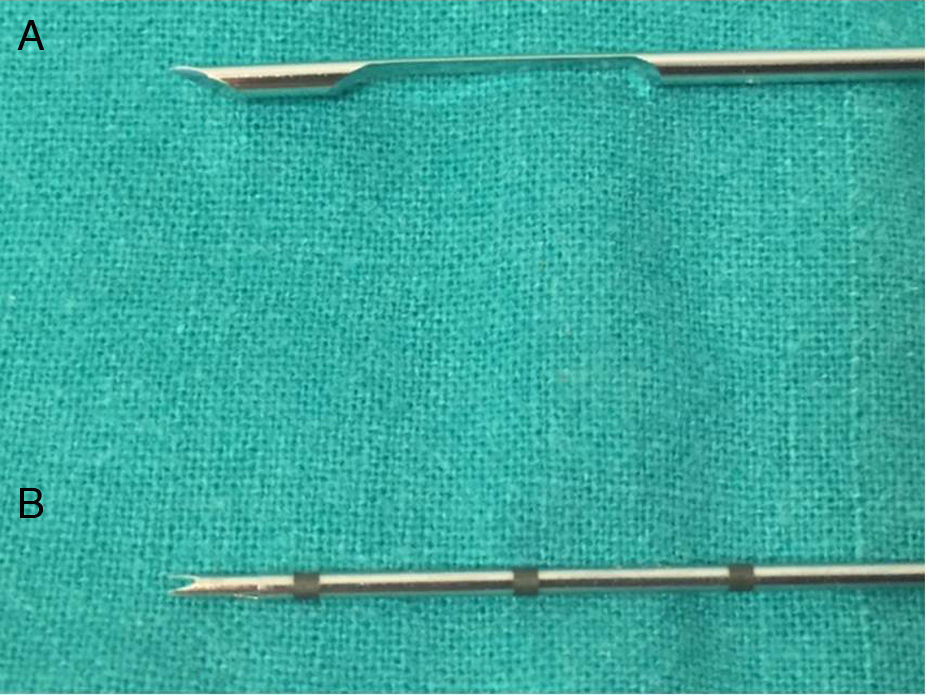
Las agujas de biopsia son de dos tipos2 (fig. 1):
- –
La aguja de corte lateral tiene un eje de corte externo (cánula externa) y un estilete interno con una muesca-cámara para el espécimen. La punta de la aguja se coloca en el borde del tejido diana y el estilete interno avanza de manera que el tejido se queda en la muesca central. El espécimen se obtiene cuando la cánula externa avanza sobre el estilete central, cortando el tejido y dejando un fragmento en la cámara de la aguja central. El mayor inconveniente de esta técnica es que tanto el eje de corte exterior como el estilete interno tienen que extenderse más allá de los márgenes de la lesión para que la muestra quede en una posición óptima en la cámara central, de tal modo que existe un mayor riesgo de lesionar las estructuras adyacentes, algo importante en el cuello, donde hay numerosas estructuras vasculares. Además, con estas agujas el avance del disparo está preestablecido y no puede modificarse.
- –
Con las agujas de corte frontal, cuando se dispara, la cánula externa avanza dejando el estilete central atrás y cortando un fragmento de tejido que queda en su interior. Permiten obtener especímenes más gruesos que las de corte lateral con diámetros de aguja similares. También permiten variar la longitud de muestreo sin cambiar de aguja, y avanzar más una vez realizado el disparo para obtener un pequeño fragmento adicional de tejido en caso de que el avance del disparo haya sido menor de lo esperado.
- •
Indicaciones:
Las patologías que pueden afectar a las glándulas salivares incluyen neoplasias benignas y malignas, y lesiones inflamatorias o pseudotumorales. La exploración física y las técnicas de imagen (TC, RM, ecografía) determinan la localización y la relación con estructuras vasculares y nerviosas, pero muchas veces el diagnóstico no puede hacerse basándose exclusivamente en el aspecto morfológico con métodos de imagen, por lo que suele ser necesario un análisis tisular para diferenciar y subclasificar las lesiones de glándulas salivares.
- •
Técnica:
La PAAF se ha usado clásicamente como primera línea diagnóstica para el manejo de la patología de las glándulas salivares, pero muchos estudios han demostrado una alta tasa de falsos negativos y poca exactitud para caracterizar los subtipos tumorales11. En los últimos años, la biopsia con aguja gruesa ha adquirido mayor aceptación y popularidad, y se considera una técnica muy fiable y segura12.
Algunos trucos útiles en la biopsia de glándulas salivares son:
- –
Es suficiente con utilizar agujas de 18 G y obtener dos pases.
- –
Es importante realizar la biopsia desde fuera de la lesión para obtener muestras de la zona más periférica del tumor, más rica en tejido válido para el diagnóstico.
- –
En lesiones profundas debe evitarse atravesar el territorio del nervio facial (referencia: la vena retromandibular).
- –
Realizar anestesia intraglandular en el trayecto de la biopsia en la glándula parótida por sus terminaciones sensitivas.
- –
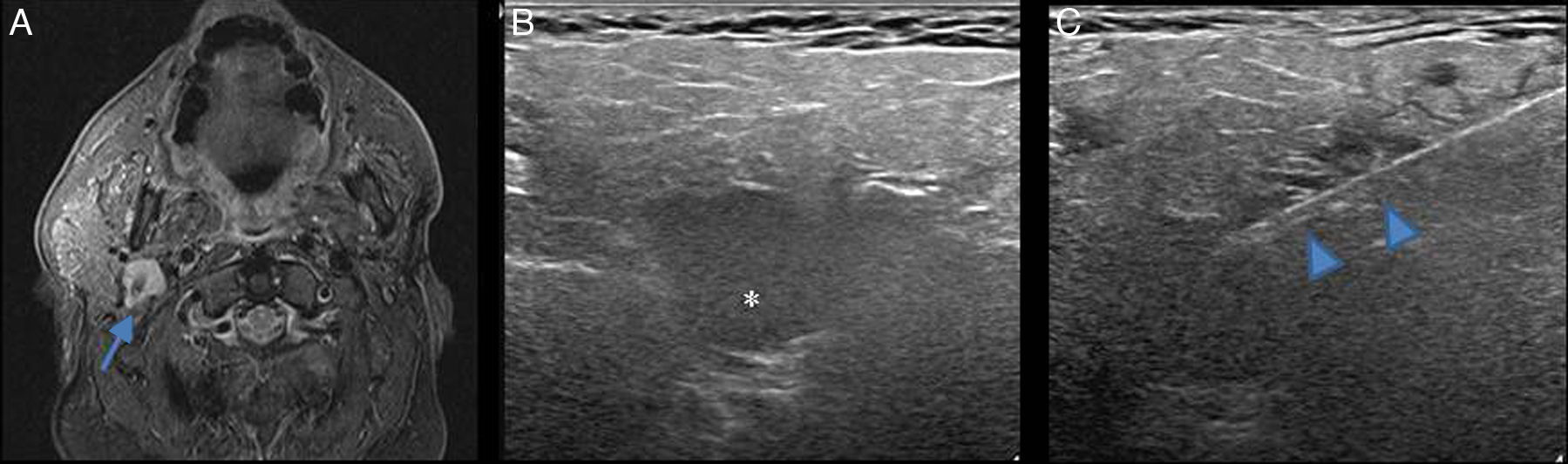
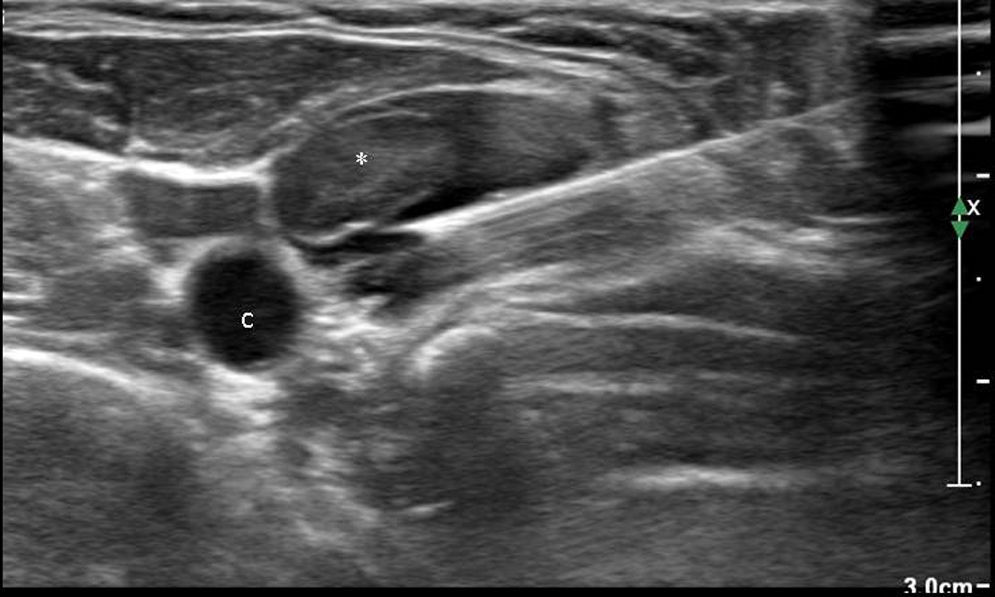
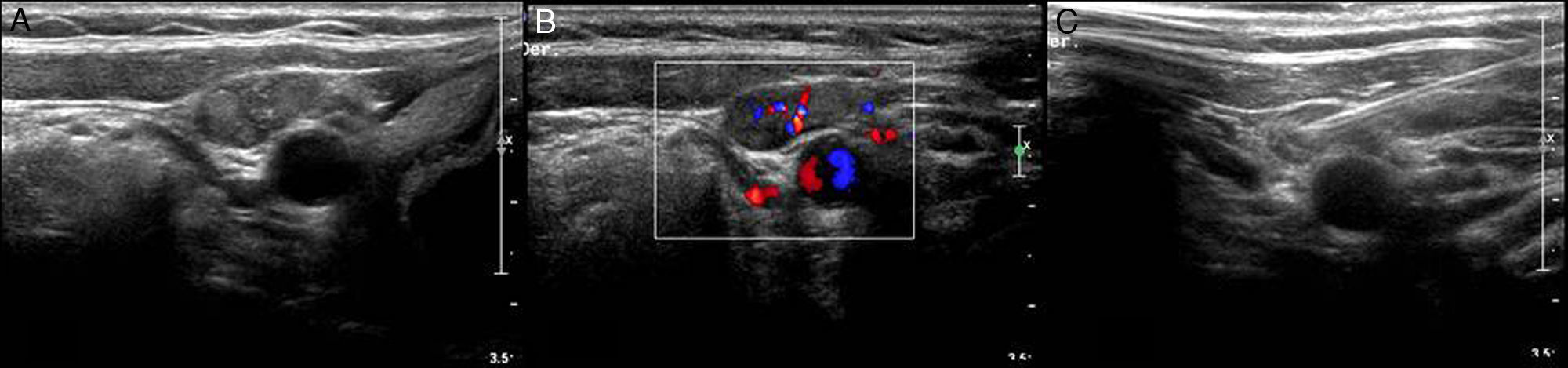
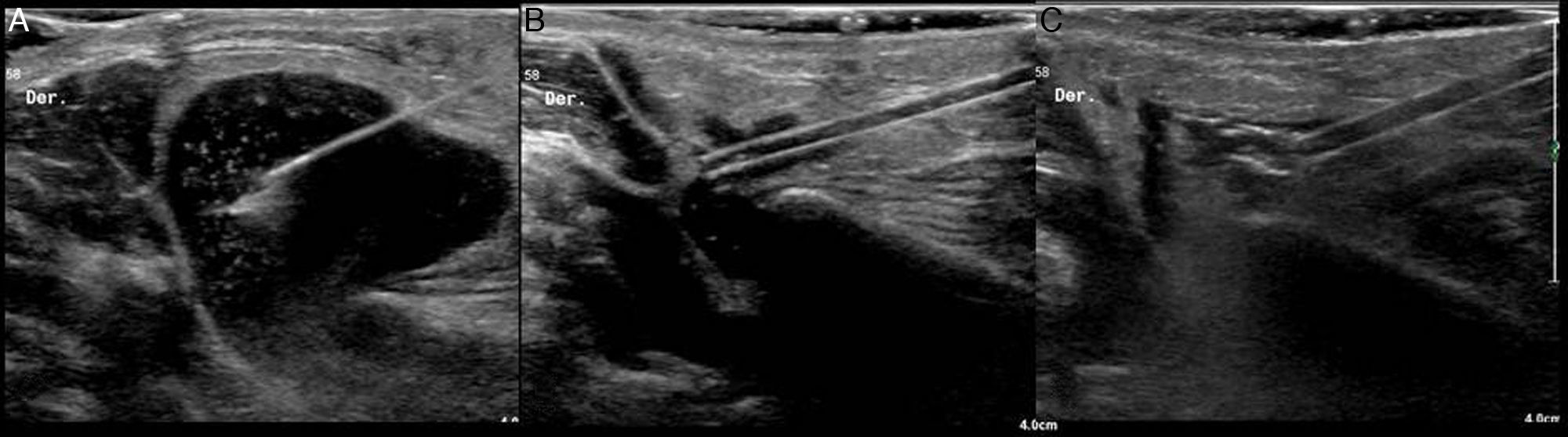
Pueden biopsiarse lesiones localizadas en el lóbulo profundo (fig. 2).
Figura 2.Biopsia de nódulo en el lóbulo profundo de una parótida. A) Corte axial de secuencia T1FS con gadolinio en el que se visualiza una lesión sólida en el lóbulo profundo de una glándula parótida derecha (flecha). B) Correlación del nódulo en la ecografía (asterisco). C) Aguja de biopsia (puntas de flecha) atravesando la lesión. El diagnóstico anatomopatológico fue de adenoma monomorfo.
(0,14MB).
- –
- •
Complicaciones:
- –
Siembra tumoral: hay pocos estudios que demuestren la siembra de células tumorales en la biopsia de glándulas salivares13. Aun así, cabe señalar la alta tasa de recidivas de los tumores de las glándulas salivares tras la cirugía, por lo que constituye un riesgo a considerar.
- –
Hemorragia: muy infrecuente y autolimitada12.
- –
Lesión del nervio facial: no se han descrito complicaciones relacionadas con su lesión durante procedimientos de biopsia12,14.
- –
Las adenopatías y las masas cervicales inespecíficas son una forma frecuente de presentación de la patología cervical maligna o benigna, con un amplio diagnóstico diferencial, y a menudo es necesario un análisis histológico para el diagnóstico final15.
- •
Indicaciones:
- –
Pacientes con un proceso neoplásico conocido para descartar diseminación metastásica. Las causas más frecuentes de adenopatías cervicales malignas son los linfomas y la diseminación metastásica del carcinoma epidermoide de cabeza y cuello, pero también otros tumores primarios fuera de esta área metastatizan en la región cervical (tiroides, pulmón, estómago, melanoma…).
- –
Pacientes sin enfermedad neoplásica conocida en quienes aparecen de novo, con persistencia o aumento de las adenopatías a pesar de recibir un tratamiento conservador. En estos casos, la prevalencia de lesión maligna es baja, sobre todo en niños y adolescentes, en los que hay una alta incidencia de adenopatías benignas inespecíficas16.
- –
- •
Técnica:
Para obtener muestras representativas deben tenerse en cuenta los siguientes aspectos:
- –
Debe biopsiarse la parte más alejada del hilio2, ya que es la zona más celular y además el riesgo de sangrado es mínimo.
- –
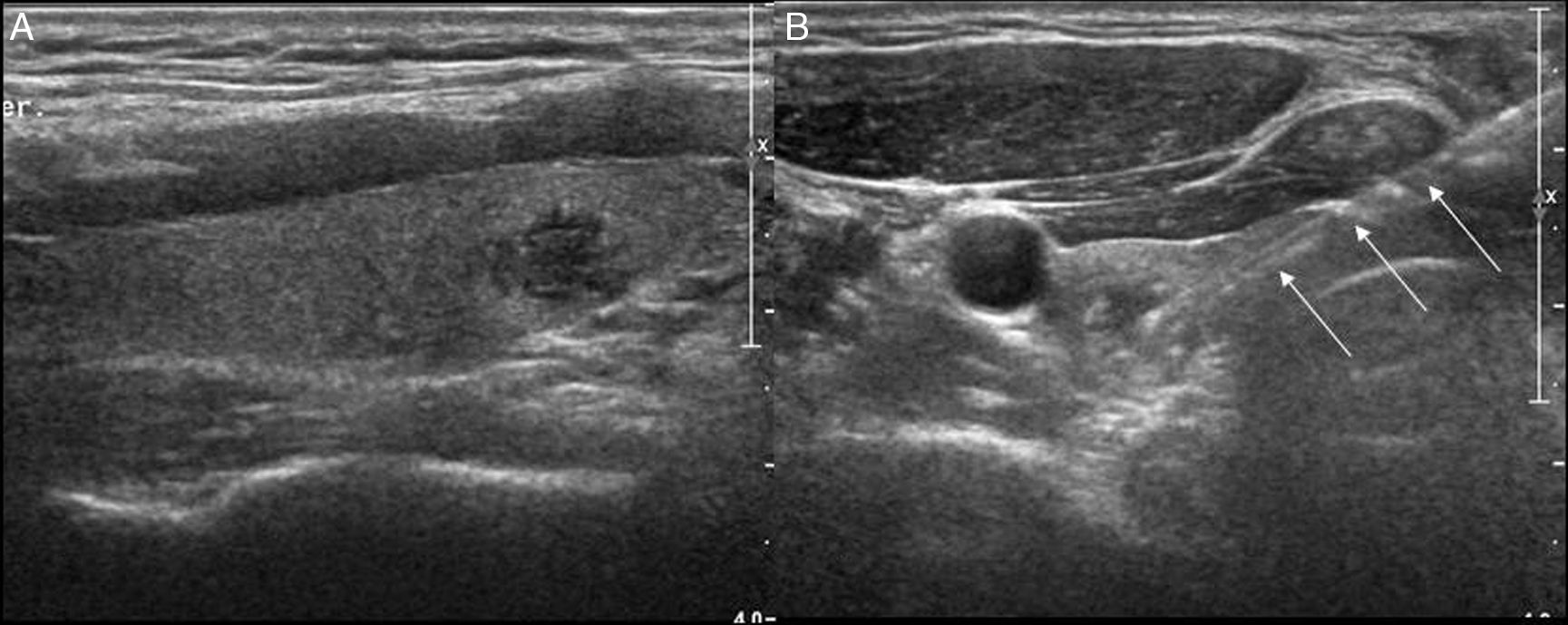
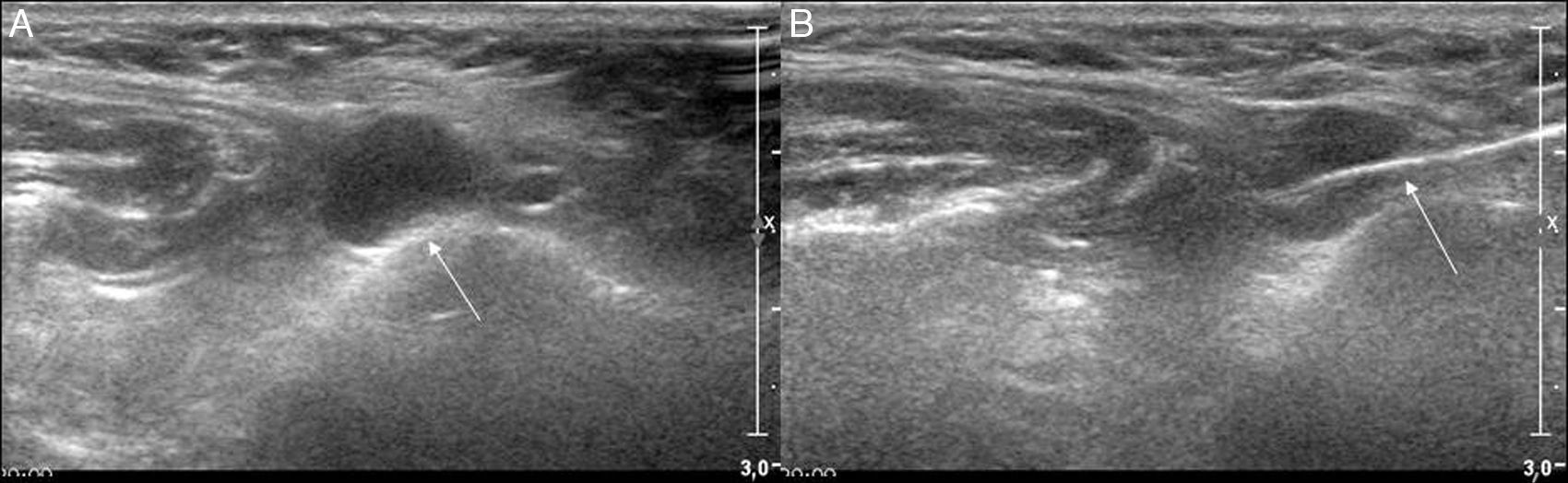
En adenopatías con centro necrótico-quístico puede realizarse un aspirado del área quística para su análisis microbiológico o citológico, y posteriormente realizar la biopsia del margen (fig. 3).
- –
Es necesario obtener muestras representativas del conjunto de la lesión para evitar errores de muestreo, por lo que conviene realizar varias punciones de la lesión2.
- –
En pacientes con sospecha de linfoma utilizaremos agujas de calibre más grueso (16G) y obtendremos un mayor número de muestras para técnicas inmunohistoquímicas y citometría de flujo2,7.
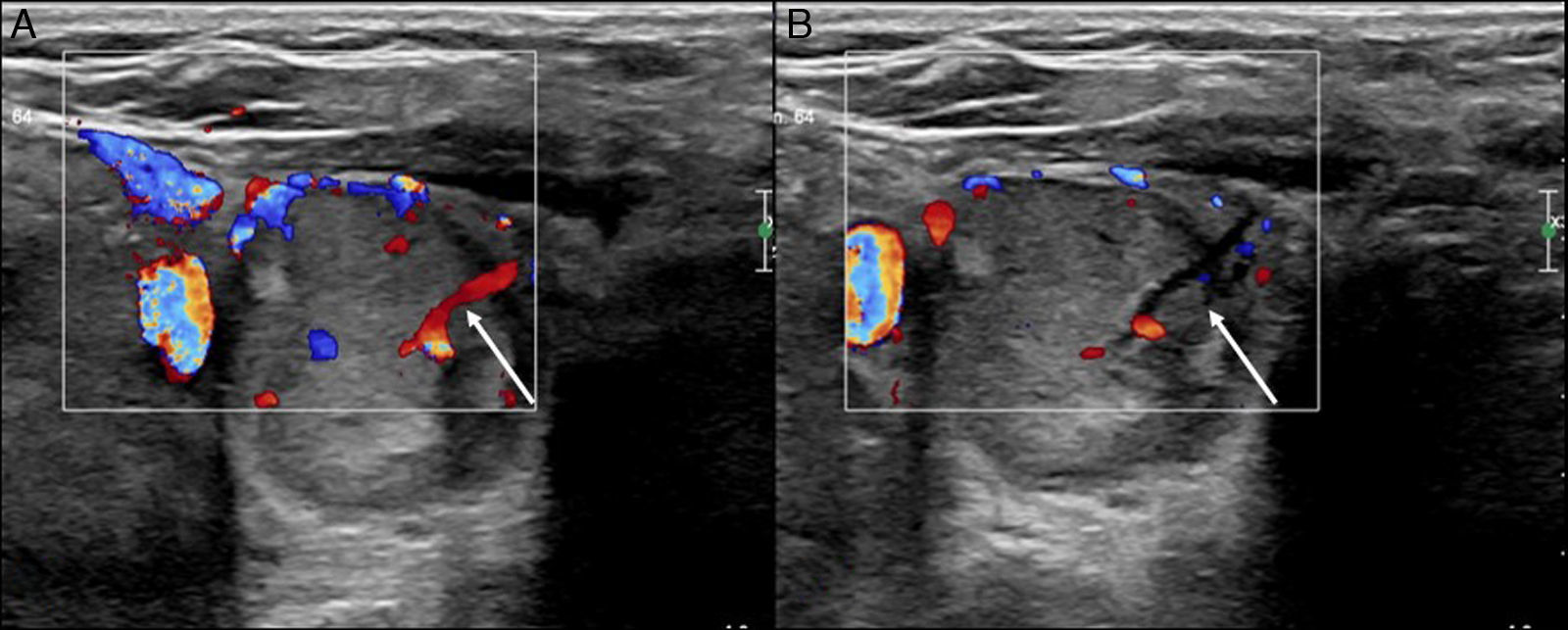
Debido a las limitaciones anatómicas del cuello, muchas de las adenopatías están en íntima relación con los vasos o estructuras vitales. Un truco útil es que, al introducir el anestésico local, si se hace mediante guía ecográfica, puede usarse para separar estructuras que podrían ser dañadas durante el procedimiento (fig. 4).
Otra opción que permiten las adenopatías, por ser móviles y normalmente no adheridas a planos profundos, es la posibilidad de sujetarlas con la aguja de biopsia (en caso de utilizar agujas de corte frontal) y redireccionarlas de manera que, cuando se haga el disparo, el avance de la aguja no lesione estructuras vitales.
Otras masas cervicales- •
Indicaciones:
- –
Lesiones de estirpe neural: los neurofibromas y los schwannomas son los tumores de estirpe neural más frecuentes en el cuello. Con las técnicas de imagen son indistinguibles, por lo que es necesario un análisis histológico ya que su manejo es diferente. La biopsia de estas lesiones es muy dolorosa. Por ello, en estos casos debe localizarse el nervio del que depende la lesión y realizar una anestesia peri-epineural del nervio proximal para conseguir un bloqueo anestésico.
- –
Lesiones de estirpe lipomatosa-mixoide: los lipomas son muy frecuentes en la región cervical y normalmente son benignos. A veces, debido a su tamaño o su densidad heterogénea, es imprescindible obtener una muestra para descartar malignidad. En las lesiones de consistencia elástica o predominio graso es necesario utilizar agujas de calibre más grueso (14G) y corte lateral.
- –
Lesiones de localización profunda: es ampliamente conocido el papel de la TC y la RM como guía de imagen para la biopsia de lesiones profundas de la región cervical. Aunque se ha descrito la aproximación transoral para la realización de biopsias en el espacio retrofaríngeo, parotídeo profundo y parafaríngeo, muchas de las lesiones son alcanzables mediante el abordaje retromaxilar17 (fig. 5).
Figura 5.Biopsia de adenopatía parafaríngea mediante abordaje retromaxilar en paciente con antecedente de carcinoma epidermoide de laringe. A) Corte axial con contraste a nivel cervical en el que se visualiza una adenopatía con centro necrótico en la región parafaríngea derecha (flecha). B) Correlación ecográfica de la adenopatía. C) Aguja de biopsia (puntas de flecha) atravesando la lesión. El diagnóstico anatomopatológico fue de metástasis de carcinoma epidermoide.
(0,15MB). - –
Tumores otorrinolaringológicos (laringe, faringe, suelo de la boca): en ocasiones la ecografía puede utilizarse como guía para la biopsia de lesiones en el suelo de la boca (base de la lengua), tumores supraglóticos y de hipofaringe con extensión fundamentalmente submucosa, y en pacientes con limitaciones para realizar una laringoscopia.
- –
- •
Complicaciones:
A pesar de haber diversas guías de actuación ante un nódulo tiroideo, su manejo es controvertido. Aunque la gran mayoría son lesiones benignas y el cáncer tiroideo tiene muy buen pronóstico, el diagnóstico precoz de este último disminuye la morbimortalidad18.
La PAAF se ha considerado la técnica de elección en el nódulo tiroideo19. Sin embargo, en nuestra experiencia, la BAG permite disminuir las punciones no diagnósticas al 1,3%, frente al 15-26% de las PAAF. Por otro lado, mediante BAG se ha conseguido un mayor número de diagnósticos de malignidad9.
- •
Indicaciones:
La ecografía es la técnica de imagen de elección para valorar un nódulo tiroideo18. Sin embargo, aunque algunos signos son muy específicos, no existen signos de alta sensibilidad para malignidad. Tras la detección de un nódulo tiroideo, el siguiente paso es valorar si está indicada la biopsia. Existen varias guías de actuación: las de la Society of Radiologists in Ultrasound, la American Association of Clinical Endocrinologist, la American Thyroid Association, los criterios de Kim y la clasificación TIRADS (tabla 1)18. En nuestra unidad se biopsian todos los nódulos que tienen algún signo ecográfico de sospecha, independientemente del tamaño, y también aquellos casos de riesgo valorando la clínica y los antecedentes del paciente. También se puncionan las adenopatías cervicales que presentan algún dato de sospecha9,18.
Tabla 1.Guías de actuación ante un nódulo tiroideo
SRU Nódulo sólido o con Ca>1,5 cm
Nódulo mixto>2 cm
Nódulo>1 cm con adenopatía sospechosaTamaño AACE Nódulo hipoecoico>1 cm
Nódulo <1 cm si es hipoecoico y sospechosoSens: 79%
Esp: 91%C Kim Todo nódulo con un solo datos de sospecha Sens: 93%
Esp: 81%ATA Nódulo sólido>1 cm con datos de sospecha
Nódulo<1 cm con datos de sospecha y con historia de alto riesgoCriterios clínicos y de imagen TIRADS Nivel de sospecha de 1 al 5
No valora riesgo clínicoBasurto Todo nódulo con datos de sospecha
Adenopatías sospechosas
Nódulos sospechosos para el clínicoAACE: American Association of Clinical Endocrinologist; ATA: American Thyroid Association; C Kim: criterios de Kim; SRU: Society of Radiologists in Ultrasound; TIRADS: Thyroid Imaging Reporting and Data System.
- •
Técnica:
Nosotros empleamos para la BAG una aguja de corte frontal, de 18G, con la longitud de avance variable9. Utilizamos la PAAF en lesiones con componente quístico. La entrada con más frecuencia usada es a través del istmo, ya que la aguja se mantiene más fácilmente fija con los movimientos de deglución del paciente y se evita entrar en el triángulo graso paratraqueal, donde se encuentra el nervio recurrente laríngeo (fig. 6).
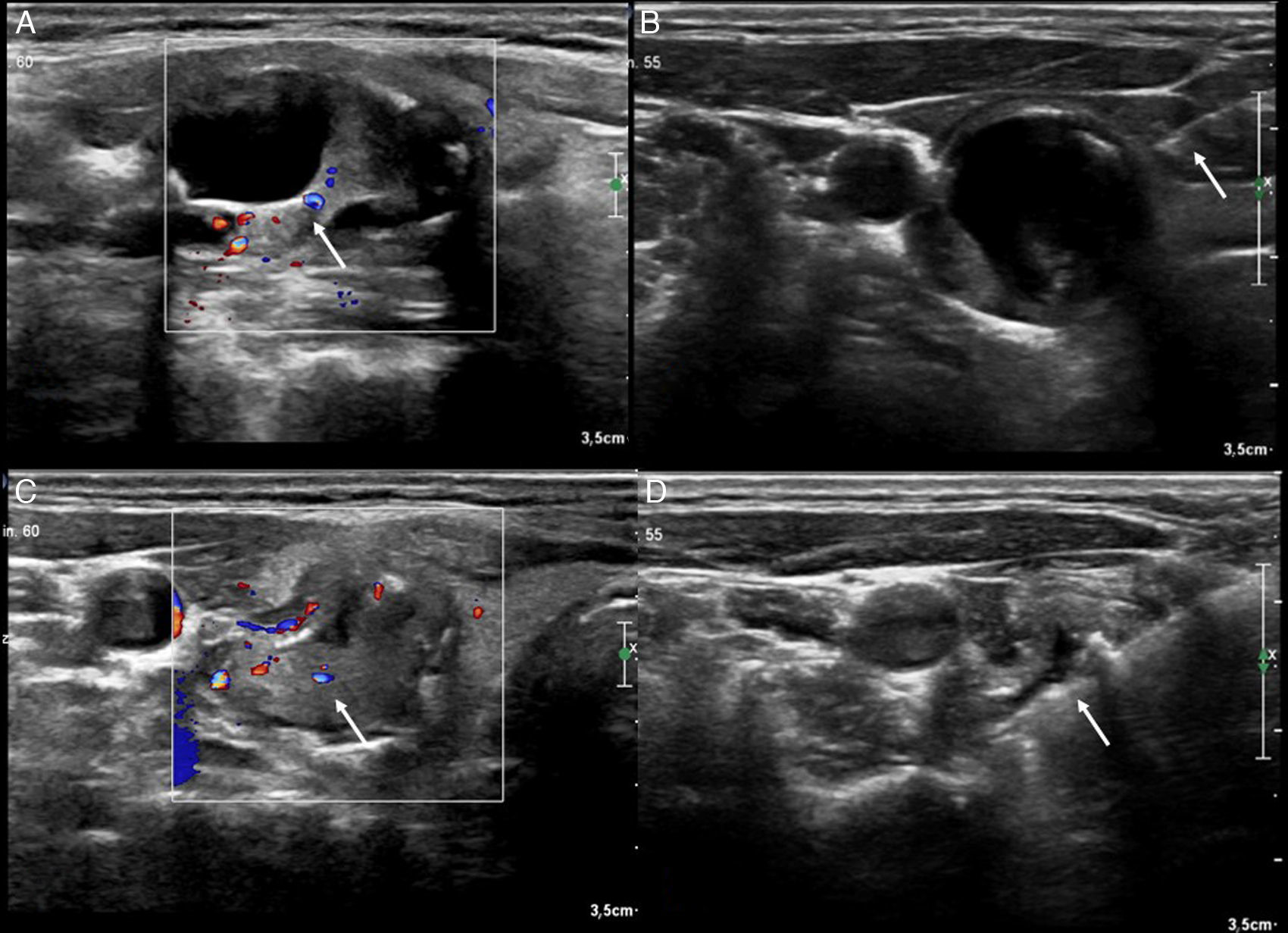
El muestreo debe dirigirse al componente sólido del nódulo, eligiendo especialmente las áreas que presenten calcificaciones asociadas. En las lesiones quísticas, es preferible biopsiar la pared del quiste si está engrosada o el componente sólido intraquístico, y realizar además aspiración del componente quístico para su análisis citológico (fig. 7). En caso de evidenciar sangrado tras la punción, se realiza compresión local con el mismo transductor o se aplica frío local en el punto de biopsia durante al menos 5 minutos, o ambas medidas (fig. 8)9.
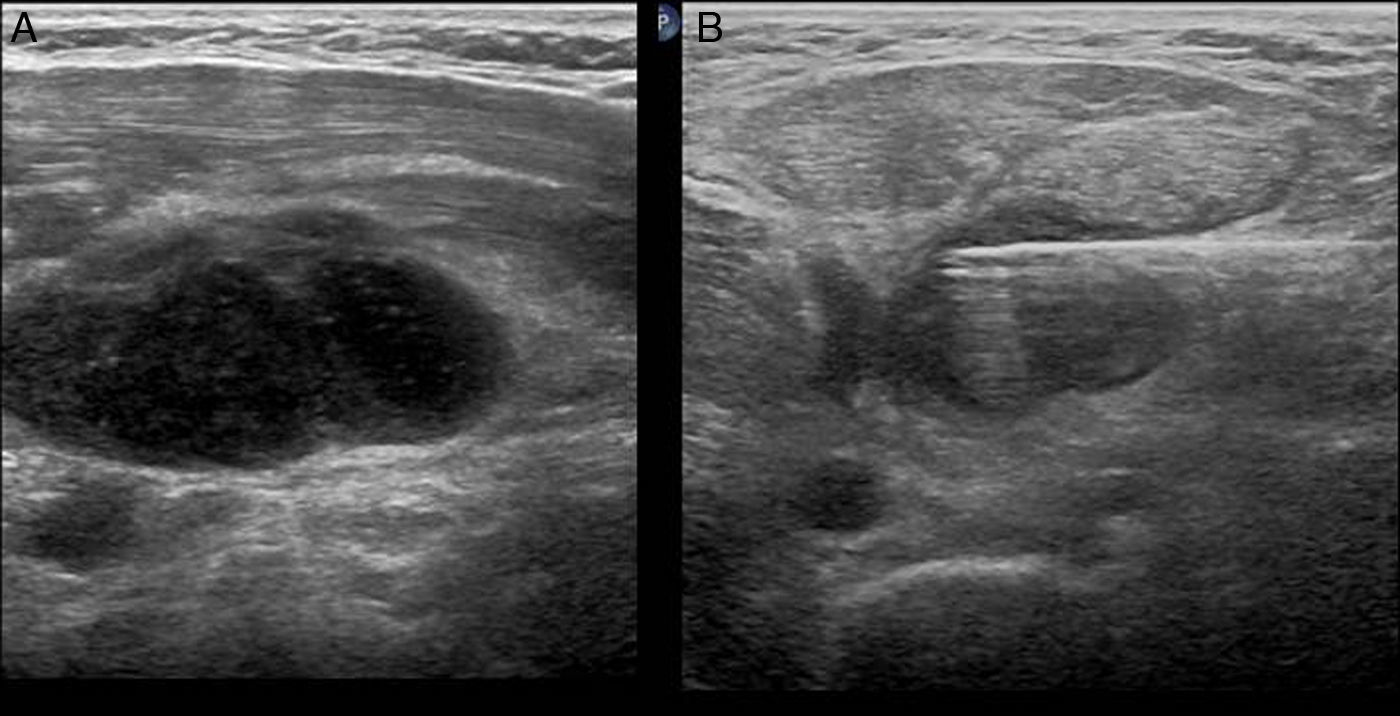
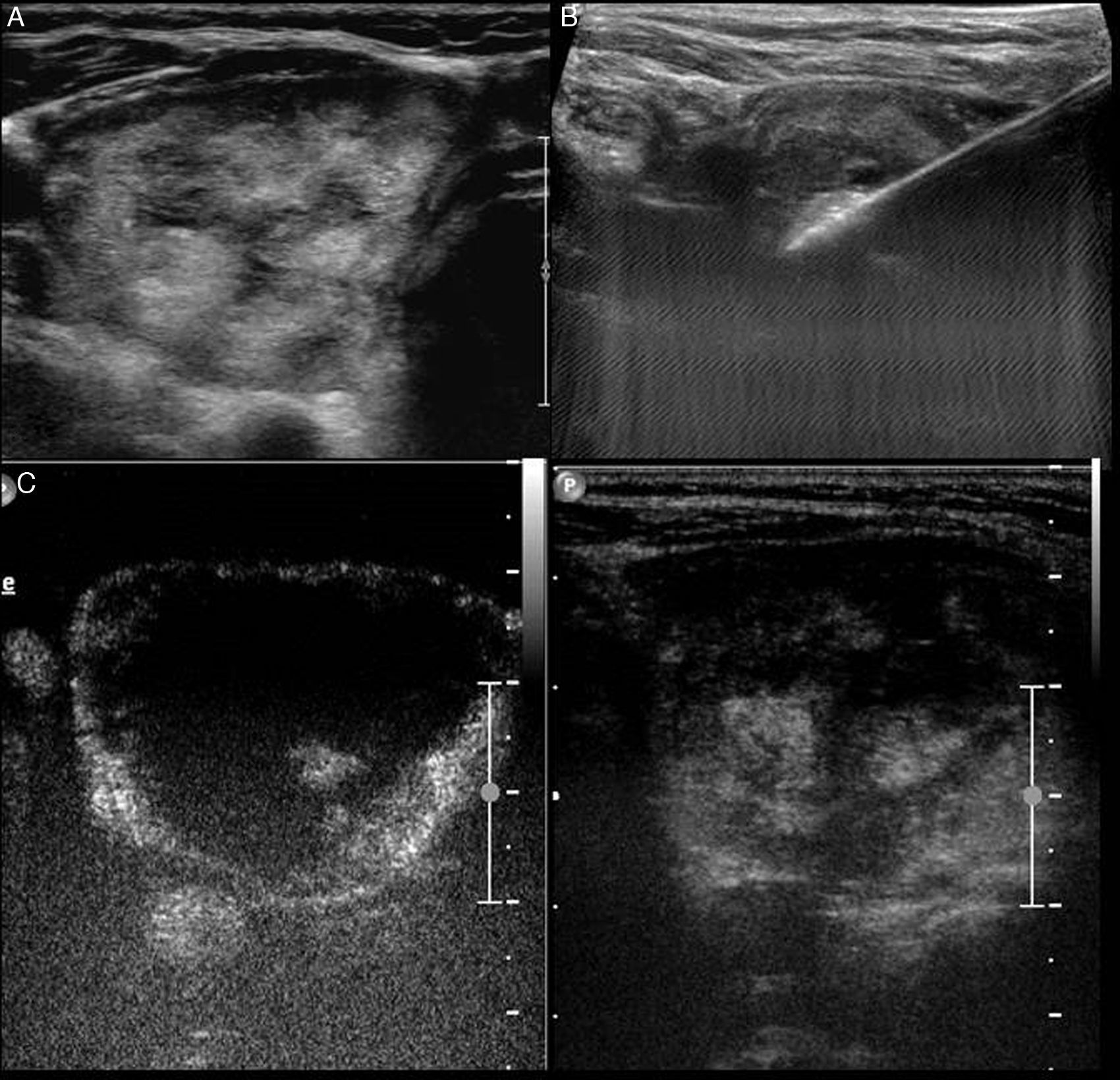
Figura 7.Biopsia de nódulo mixto. A) Nódulo mixto con vascularización del componente sólido mediante Doppler (flecha). B) Punción-aspiración con aguja fina del componente líquido (las flechas indican la entrada de la aguja de 20G). C) Remanente sólido vascularizado (flecha). D) Biopsia con aguja gruesa del componente sólido; se muestra la toma de biopsia del componente sólido vascularizado (flecha). El diagnóstico anatomopatológico fue de nódulo hiperplásico.
(0,25MB).En pacientes con tiroidectomía por carcinoma papilar de tiroides, a veces se observan adenopatías con datos ecográficos de sospecha, como microcalcificaciones o zonas quísticas. En estos casos realizamos PAAF para determinar, en el lavado de la aguja, los valores de tiroglobulina, que está aumentada en las metástasis de carcinoma papilar de tiroides (fig. 9)20.
Figura 9.Punción de adenopatía para determinar los valores de tiroglobulina. Paciente diagnosticado de carcinoma papilar de tiroides. A) Adenopatía patológica con pérdida del hilio y focos de microcalcificaciones. B) Patrón de vascularización alterado mediante Doppler (flecha). C) Punción-aspiración con aguja fina para evaluar la tiroglobulina. Se visualiza la aguja en el ganglio (flechas).
(0,12MB). - •
Complicaciones:
Infrecuentes y similares a las que pueden producirse con la PAAF:
- –
Sangrado en el trayecto de punción.
- –
Presencia de molestias al tragar en los días posteriores a la biopsia.
- –
Lesión de estructuras nerviosas, como el nervio recurrente, si no se tiene en cuenta su recorrido.
- –
El fracaso del tratamiento antibiótico en las infecciones de cuello requería un abordaje quirúrgico hasta la generalización del uso de los procedimientos de drenaje percutáneo guiados por imagen. El drenaje percutáneo es, en la actualidad, el tratamiento de primera elección en toda colección líquida sintomática si no hay indicación de cirugía inmediata, al ser más sencillo, rápido, seguro y económico que la cirugía2,21.
IndicacionesEl drenaje percutáneo de colecciones líquidas tiene dos objetivos principales: obtener una muestra para el diagnóstico microbiológico y tratar la infección del paciente. En ocasiones, el drenaje puede tener una función diagnóstica al confirmar la existencia de una colección líquida infectada22.
- •
Adenopatías abscesificadas:
Ante la sospecha de adenitis bacteriana que no responde de manera adecuada al tratamiento antibiótico, se recomienda realizar punción y drenaje de las adenopatías21,22.
- •
Abscesos cervicales:
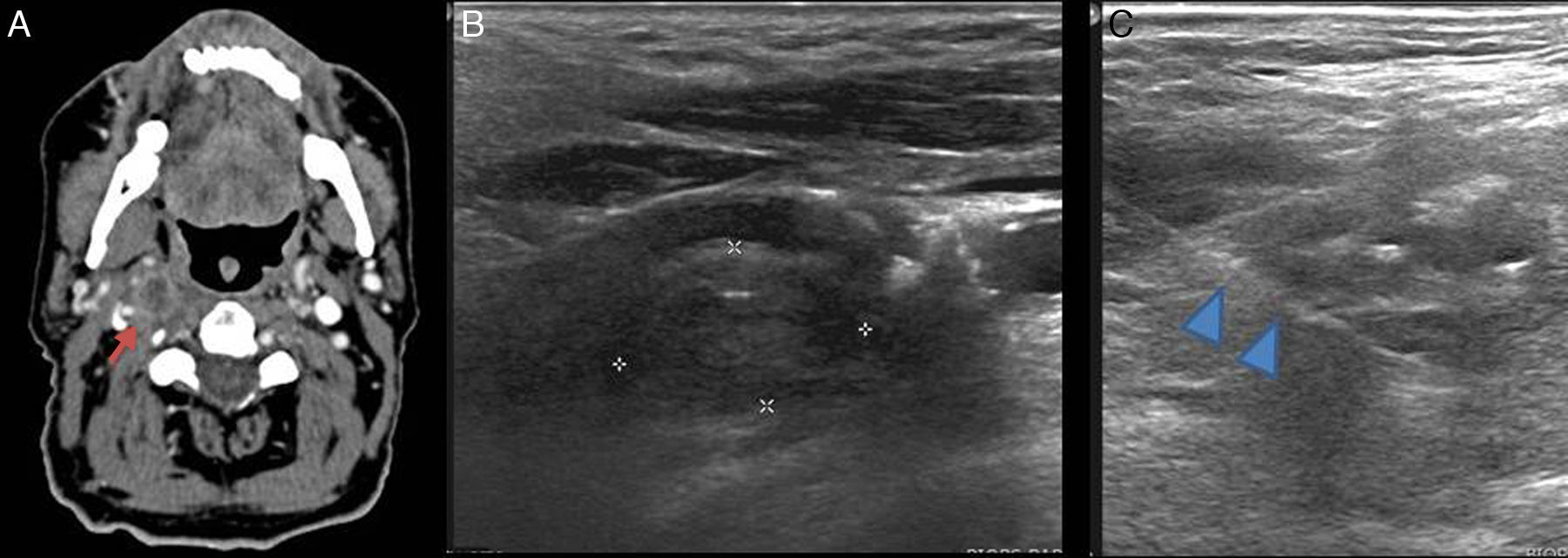
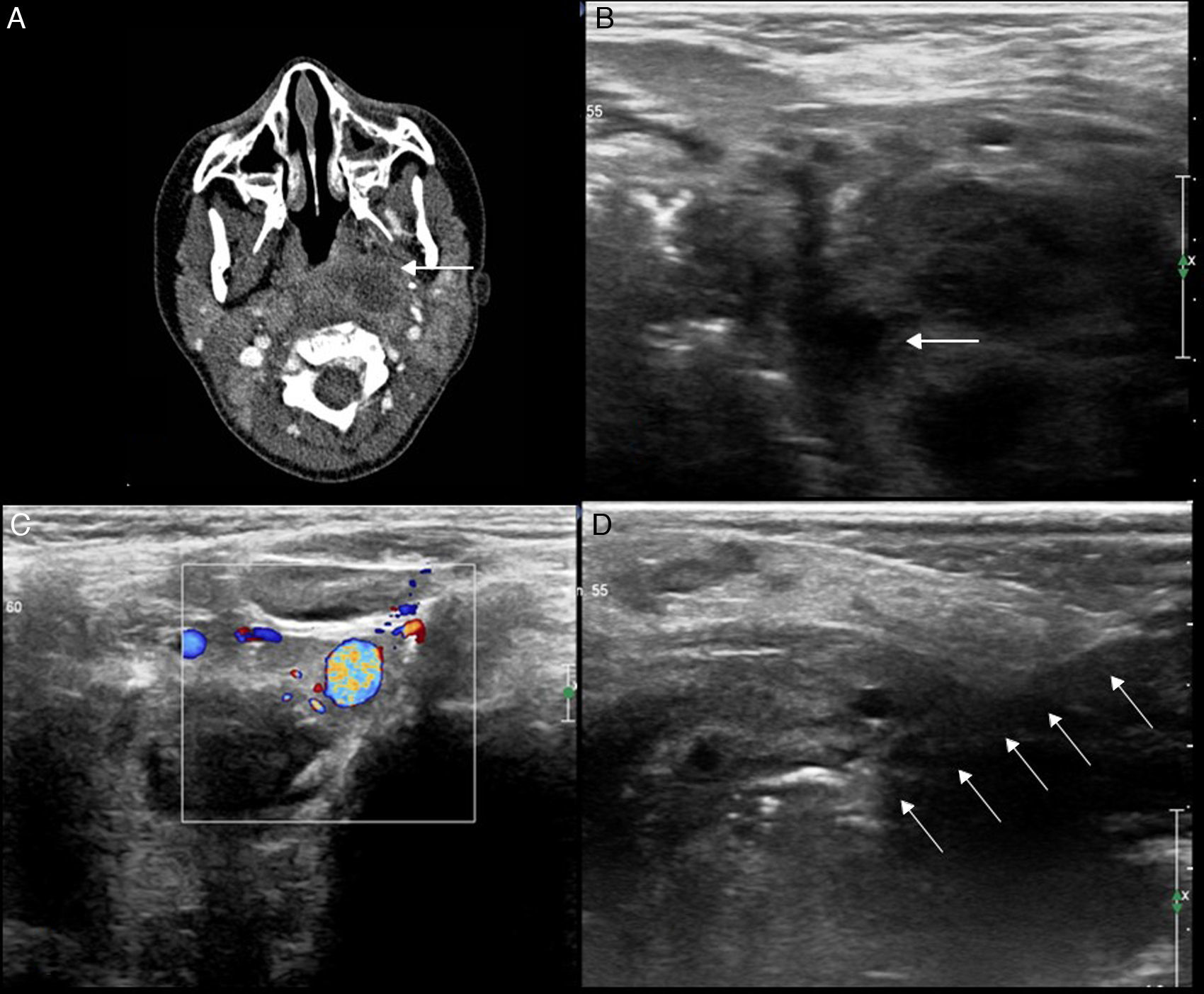
La patología infecciosa cervical tiene una alta morbimortalidad, y en la mayoría de los casos requiere un manejo urgente. Tradicionalmente, la cirugía y el drenaje eran el tratamiento de elección. Sin embargo, el drenaje con control por la imagen de estos abscesos es una alternativa efectiva y menos invasiva, con una disminución en el tiempo de ingreso y en el coste del tratamiento frente a la técnica quirúrgica tradicional (fig. 10)21,22.
Figura 10.Absceso parafaríngeo en un niño. A) Tomografía computarizada que muestra una colección parafaríngea izquierda (flecha). B) Se confirma que la colección es visible con ecografía (flecha). C) Control del acceso con Doppler. D) Colocación de drenaje; se visualiza la entrada del trocar de drenaje en la colección (flechas).
(0,26MB). - •
Infecciones de glándulas salivares:
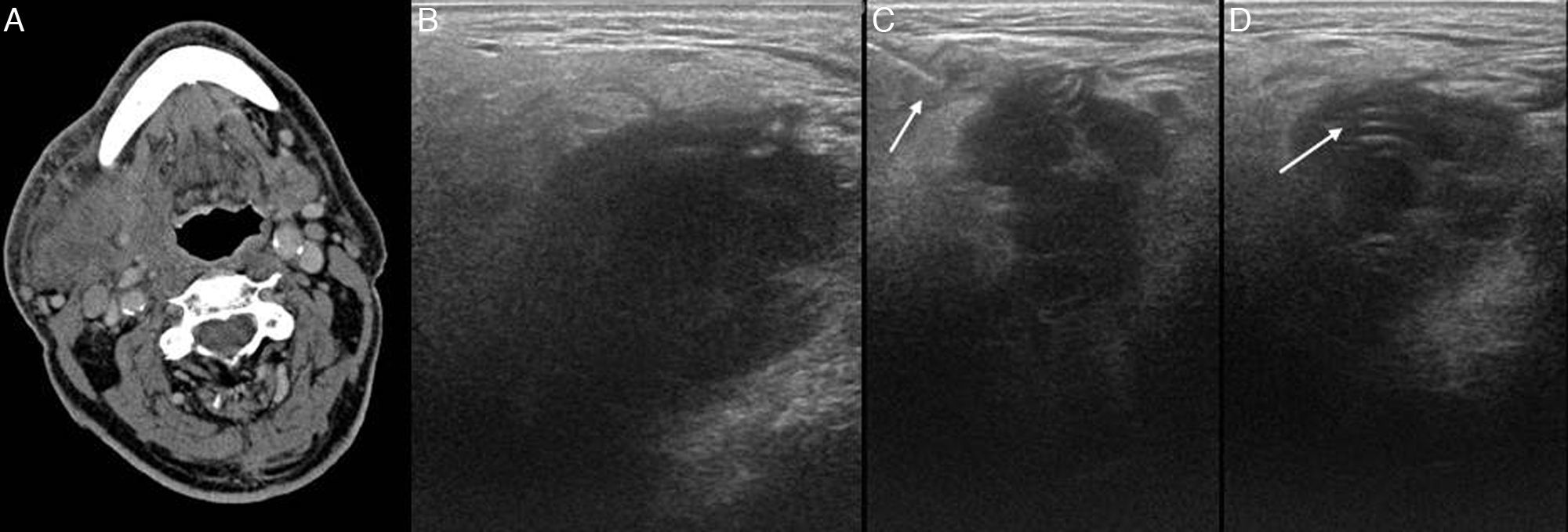
La parotiditis aguda supurada es la enfermedad de esta localización anatómica que puede llegar a desarrollar colecciones abscesificadas. La ecografía suele ser el primer estudio a realizar y determina la heterogeneidad de la glándula y la presencia o no de abscesos. Los abscesos pueden ser drenados de manera percutánea con guía ecográfica (fig. 11)23.
Absceso en la región laterocervical derecha. A) Tomografía computarizada que muestra una colección adyacente a la glándula submandibular derecha. B) En el estudio ecográfico se identifica la colección hipoecogénica. C) Entrada del catéter de drenaje pig-tail 8F en la colección (flecha). D) Se identifica el catéter pig-tail una vez drenado el absceso (flecha).
Con la colocación de drenajes en las colecciones abscesificadas casi siempre se consigue evitar la cirugía. Incluso en colecciones secundarias a fistulas posquirúrgicas se logra, con el drenaje mantenido en el tiempo, su cierre.
TécnicaEl hecho de que la ecografía sea rápida, barata, de gran accesibilidad y que no emite radiaciones ionizantes la convierte en la técnica de elección. Además, puede realizarse a la cabecera de la cama del paciente y permite el control de la aguja o el catéter en tiempo real.
Si se usa TC, debe hacerse con contraste intravenoso para el estudio vascular. Generalmente, las vías de acceso más frecuentes son la transpterigoidea para acceder a colecciones próximas a la línea media y la retrocarotídea cuando la colección es posterior22.
- •
Métodos de drenaje:
- –
Aspiración con aguja: las colecciones de pequeño tamaño pueden aspirarse mediante punción directa con una aguja de calibre grueso (14-18G). Resultan muy útiles las agujas con catéter de acceso vascular externo, ya que pueden fijarse en la piel con un apósito y dejarlas durante 24-48 horas hasta resolver por completo la colección.
- –
Colocación de catéteres de drenaje: son tubos de plástico con varios agujeros en su porción distal que permiten la salida de líquido a través de ellos. Los calibres más útiles son de 7-10F, pero su elección dependerá de la viscosidad del líquido que se espera drenar. En general, en esta localización se emplean dos técnicas de colocación de catéteres de drenaje2. La técnica de Seldinger consiste en la punción de la colección con una aguja a través de la cual se pasa una guía metálica y sobre ella se introduce el catéter en la cavidad. En la técnica trocar, el catéter viene montado sobre una guía rígida metálica hueca, por cuyo interior se introduce un estilete. El trocar, cuando está montado, aparece como un catéter puntiagudo rígido. Se introduce en la colección por punción directa desde la piel y, al llegar a la colección, se retira el estilete y se desliza el catéter sobre la guía metálica hasta colocar su parte distal en el interior de la colección. Permite realizar el drenaje en un solo acto. Como en la mayoría de los procedimientos percutáneos de partes blandas, la colocación de drenajes se realiza bajo anestesia local. Para ello, la lidocaína al 1% es idónea por tratarse de un anestésico de rápida acción.
- –
- •
Manejo del drenaje:
Una vez aspirado el contenido, se envía al laboratorio para su análisis. Tras vaciar la colección, es conveniente realizar lavados con solución salina fisiológica para fluidificar y arrastrar restos purulentos que pudiesen persistir. El catéter debe ser controlado periódicamente para comprobar su correcta colocación y que no esté obstruido, detectar posibles complicaciones y realizar aspiración y lavado de la colección con solución salina fisiológica2.
Para su retirada deben cumplirse tres requisitos:
- 1)
El paciente debe estar afebril, sin fórmula sanguínea infecciosa.
- 2)
El débito por el drenaje debe ser de aspecto seroso o serohemático, en ningún caso purulento, y de menos de 10 cc/día durante 3 días consecutivos.
- 3)
Debe confirmarse con ecografía la resolución de la colección.
En caso contrario, se recomienda mantener el drenaje más tiempo.
Complicaciones- •
Daño de estructuras: como el conducto parotídeo, el plexo venoso pterigoideo, la arteria maxilar interna o diferentes nervios que atraviesan la región cervical.
- •
Infección: es imprescindible que el drenaje se acompañe de tratamiento antibiótico asociado.
- •
Sangrado.
- •
Lesiones cervicales congénitas:
- –
Quistes del conducto tirogloso: constituyen la lesión cervical congénita más frecuente en los niños. En ocasiones pueden infectarse y se aprecia un contenido ecogénico, por comunicación persistente con la base de la lengua. El tratamiento establecido es el quirúrgico, con extracción del centro del hueso hioides para evitar la recidiva. Sin embargo, también puede realizarse esclerosis mediante técnica percutánea24.
- –
Anomalías de los arcos branquiales: se originan por defecto de cierre y reabsorción de cualquiera de los cuatro arcos y hendiduras branquiales primitivas, lo que se manifiesta en forma de quistes (75%), a veces sobreinfectados24. El drenaje y el estudio citológico y microbiológico permiten diagnosticarlos, y en caso de lesiones grandes o cuadros repetidos de sobreinfección, el drenaje y la esclerosis son una alternativa sencilla y con buenos resultados.
- –
Malformaciones linfáticas: las malformaciones linfáticas o linfangiomas se producen por un desarrollo anómalo del sistema linfático cervicofacial. A diferencia del hemangioma infantil, no involucionan espontáneamente. El tratamiento de elección ha sido el quirúrgico, pero este presenta una tasa de recidiva del 12-52%. Por ello, como alternativa es posible realizar la escleroterapia mediante agentes como el etanol, la doxiciclina o el picibanil (OK-432) (25). La tasa de éxito es significativamente mayor en la variedad macroquística.
- –
- •
Otras lesiones quísticas:
- –
Quistes epidermoides, dermoides o teratoides: se localizan en la línea media o paramediana, en el suelo de la boca, en la región submandibular, en la encrucijada cervicotorácica... Son lesiones quísticas uniloculares con contenido homogéneo, ligeramente ecogénico25. Se trata de lesiones de contenido espeso, lo que hace difícil su drenaje y tratamiento percutáneo.
- –
Quistes de glándulas salivares (quistes linfoepiteliales de parótida): representan una respuesta reactiva de los ganglios intraglandulares. Pueden ser múltiples y bilaterales, en general de paredes finas y bien delimitadas, con contenido homogéneo. Su clínica es principalmente estética y el tratamiento es la escisión quirúrgica o la esclerosis por técnica percutánea, siendo esta la indicada dada la multiplicidad y la bilateralidad de la patología.
- –
Quistes tiroideos: su presencia es frecuente; el 15-25% de los nódulos tiroideos solitarios son quísticos o predominantemente quísticos. El tratamiento de elección es la punción-aspiración, pero la recurrencia es alta, hasta del 80%26. Por ello, se proponen técnicas de esclerosis o técnicas combinadas de esclerosis y ablación, dependiendo de su composición, para evitar cirugías cuando son sintomáticos.
- –
Linfoceles.
- –
El drenaje de las lesiones quísticas simples del cuello es sencillo, mínimamente invasivo y casi exento de complicaciones. La técnica es similar a la del drenaje de colecciones sobreinfectadas. El control por imagen se realizará con ecografía, ya que permite una adecuada valoración de la lesión y una visión en tiempo real de la aguja2. En caso de lesiones de tiroides, se recomienda el abordaje transístmico.
Pueden usarse agujas-catéter de acceso vascular cuando sean necesarios la manipulación y los lavados de la lesión, ya que la vaina de plástico externa permite, tras retirada del fiador punzante metálico, la manipulación sin riesgo de que se lesionen estructuras vecinas2.
EsclerosisAl realizar el drenaje simple de cualquier lesión quística es muy frecuente la recidiva. Por ello, es recomendable la esclerosis tras el drenaje26.
- •
Técnica:
Nosotros mantenemos la sustancia esclerosante durante al menos 1 hora dentro de la cavidad, y pasado este tiempo se aspira por completo. Otros autores mantienen el etanol sólo unos minutos26,27. Si se utiliza alcohol, la cantidad de esclerosante a utilizar suele ser entre la tercera parte y la mitad del volumen total extraído en el drenaje de la lesión.
Las sustancias habitualmente empleadas son26:
- –
Alcohol absoluto: resulta un buen esclerosante y de rápida acción, por lo que es el más usado. Actúa provocando la deshidratación de las células endoteliales y la desnaturalización proteica, y el resultado es una denudación completa del endotelio.
- –
Povidona yodada: se utiliza sobre todo en linfoceles.
- –
Tetraciclinas: en concreto, la doxiciclina.
- –
Bleomicina.
- –
Picibanil (OK-432).
- –
- •
Complicaciones:
La complicación más frecuente con el uso del alcohol es el dolor o la irritación en la zona, por lo que se recomienda la inyección lenta y cesar cuando el paciente refiera molestias (fig. 12)26,27.
Quiste linfoepitelial en la glándula parótida derecha de un paciente con infección por el virus de la inmunodeficiencia humana. A) Lesión quística en la parótida derecha. B) Drenaje con catéter de acceso venoso de 18G. C) Esclerosis mediante inyección de etanol, que se manifiesta como burbujas ecogénicas.
En 1980 empezó a utilizarse la inyección intramuscular de toxina botulínica para el tratamiento de trastornos de la tonicidad muscular. La toxina provoca una parálisis muscular flácida que requiere 2-6 meses para su recuperación. Se trata de una alternativa a la cirugía, sencilla y segura, que puede emplearse en el tratamiento de sialorreas, bruxismos, distonías faciales, espasmos faciales, etc.
Para ello se emplean agujas finas (22G). La toxina se inyecta dentro del músculo para el tratamiento de espasmos, distonías y bruxismos, y es intraglandular en el caso de sialorreas, inyectando en las glándulas parótidas y submaxilares.
Extracción de implantes facialesCada vez es más frecuente el uso de implantes cosméticos en la cara, que pueden ser de dos tipos: permanentes y reabsorbibles (ácido hialurónico). Debido a razones estéticas, como el desplazamiento de los implantes o alergias e intolerancia, en el caso del ácido hialurónico puede ser necesaria su extracción28. Para ello pueden usarse agujas gruesas (14G) y, con control ecográfico, aspirar el contenido (fig. 13). También puede inyectarse hialuronidasa con control ecográfico en los implantes de ácido hialurónico. Los implantes siliconados, que se manifiestan ecográficamente como una imagen «en tormenta de nieve» no pueden extraerse.
Alcoholización y ablación de lesiones en la cabeza y el cuelloInyección intratumoral de sustancias. AlcoholizaciónDe manera percutánea también es posible inyectar sustancias en lesiones tumorales con el objetivo de destruirlas. La sustancia más empleada es el etanol al 95%, que produce una necrosis coagulativa del tumor por desnaturalización de las proteínas y trombosis de los vasos tumorales.
Suele emplearse en lesiones pequeñas, no accesibles o difíciles de tratar mediante ablación, como son las adenopatías tumorales pequeñas en casos seleccionados.
AblaciónPueden usarse técnicas mínimamente invasivas para la destrucción local de neoplasias, en especial en pacientes no candidatos a intervención quirúrgica o que la rechazan.
La ablación percutánea ha demostrado su eficacia en diversas neoplasias. Aunque existen varias técnicas, la más empleada para tratar lesiones en el cuello es la ablación por radiofrecuencia29, que consiste en producir una lesión térmica local en el tejido mediante la energía liberada desde el extremo distal del electrodo, que produce calentamiento y necrosis por coagulación del tejido tratado29.
- •
Indicaciones:
La Sociedad Coreana de Radiología Tiroidea30 estableció en 2011 las siguientes indicaciones:
- –
Nódulos tiroideos benignos: sintomáticos, afectación estética, nódulos tiroideos hiperfuncionantes con tirotoxicosis.
- –
Recurrencia de cáncer tiroideo: tanto en el lecho quirúrgico como adenopatías metastásicas, en pacientes con alto riesgo quirúrgico.
- –
- •
Técnica:
Para la colocación del electrodo se emplea la entrada transístmica, posicionándolo en la zona más profunda a tratar, y desde esta posición se va retirando proximalmente. Se emplea la técnica del disparo móvil creando pequeños focos de ablación hasta cubrir todo el nódulo, sin exponer al calor al nervio laríngeo recurrente y al esófago (fig. 14)31,32.
Figura 14.Ablación de nódulo hiperplásico tiroideo. A) Nódulo tiroideo derecho, sólido, que capta contraste en el estudio ecográfico. B) Aguja de ablación localizada en el interior de la lesión durante el procedimiento. C) Control mediante ecografía con contraste en el que se aprecia la ausencia de captación del nódulo.
(0,32MB). - •
Complicaciones:
- –
Dolor local durante la ablación.
- –
Lesión en el nervio recurrente laríngeo.
- –
Hematomas.
- –
Sangrado intranodular por el tratamiento, que se maneja también de forma conservadora31,32.
- –
Las técnicas de imagen han demostrado ser una excelente guía en la realización de cada vez más procedimientos intervencionistas en la región cervical.
La diversidad de procedimientos percutáneos es muy amplia y han demostrado su efectividad, seguridad y bajo coste, por lo que se están convirtiendo en las técnicas de elección para el diagnóstico y el tratamiento.
La región cervical es un área muy accesible al estudio por las diferentes técnicas, siendo la ecografía la predilecta para planificar y realizar actuaciones percutáneas, debido a su accesibilidad, ausencia de radiación, versatilidad y monitorización en tiempo real.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.