En este artículo revisamos los puntos clave indispensables para realizar una correcta estadificación del cáncer de cérvix mediante resonancia magnética.
ConclusiónLa resonancia magnética es el método de elección para la estadificación locorregional del cáncer de cérvix. Una correcta valoración de sus factores pronósticos, como el tamaño tumoral, la invasión de estructuras adyacentes y la presencia de metástasis ganglionares, resulta fundamental para decidir un adecuado manejo terapéutico.
To review the key points that are essential for the correct staging of cervical cancer by magnetic resonance imaging.
ConclusionMagnetic resonance imaging is the method of choice for locoregional staging of cervical cancer. Thorough evaluation of prognostic factors such as tumor size, invasion of adjacent structures, and the presence of lymph node metastases is fundamental for planning appropriate treatment.
Aunque el carcinoma de cuello uterino es la tercera neoplasia del aparato genital femenino más común en Europa1, sigue siendo la neoplasia genital femenina más frecuente en todo el mundo2.
El sistema de estadificación más frecuentemente empleado en el cáncer de cérvix es el de la International Federation of Gynecology and Obstetrics (FIGO)3 (tabla 1), que se realiza basándose en la exploración clínica, lo que permite uniformidad en todo el mundo. Sin embargo, dada la existencia de grandes discrepancias entre tumores estadificados clínicamente (según el sistema de la FIGO) y los estudiados quirúrgicamente4, desde el año 2009 la FIGO recomienda, siempre que sea posible, una valoración con resonancia magnética (RM) en pacientes con estadio clínico IB o superiores3,5–7. La RM es el mejor método diagnóstico en la estadificación locorregional del cáncer de cérvix8, ya que permite evaluar con precisión factores pronósticos como el tamaño tumoral, la invasión de los parametrios, de la pared pélvica, de la vejiga y del recto, así como la presencia de metástasis ganglionares5,6,9. En este artículo revisamos los puntos clave indispensables para realizar una correcta estadificación mediante RM del cáncer de cérvix.
Clasificación de la FIGO para el cáncer de cérvix uterino
| Estadio de la FIGO | Descripción |
|---|---|
| I | Tumores confinados al cérvix uterino |
| IA | Carcinoma solo diagnosticable con ayuda del microscopio, con una invasión estromal en profundidad ≤ 5mm y una extensión horizontal máxima ≤ 7mm |
| IA1 | Invasión estromal en profundidad ≤ 3mm y una extensión horizontal ≤ 7mm |
| IA2 | Invasión estromal en profundidad entre >3mm y 5mm, con una extensión horizontal ≤ 7mm |
| IB | Tumores clínicamente visibles limitados al cuello uterino o tumores preclínicos mayores que IA |
| IB1 | Tumores con un diámetro mayor ≤ 4cm |
| IB2 | Tumores con un diámetro mayor>4cm |
| II | Tumores que invaden más allá del útero pero no la pared pélvica ni el tercio inferior vaginal |
| IIA | Sin invasión parametrial |
| IIA1 | Tumores con diámetro mayor ≤ 4cm |
| IIA2 | Tumores con diámetro mayor>4cm |
| IIB | Invasión parametrial |
| III | Tumores con afectación del tercio inferior vaginal y/o pared pélvica y/o hidronefrosis |
| IIIA | Invasión del tercio inferior vaginal |
| IIIB | Invasión de la pared pélvica y/o hidronefrosis o riñón no funcionante |
| IV | Tumores con invasión de la mucosa vesical o rectal, o con metástasis a distancia |
| IVA | Invasión de la mucosa vesical o rectal |
| IVB | Metástasis a distancia |
FIGO: International Federation of Gynecology and Obstetrics.
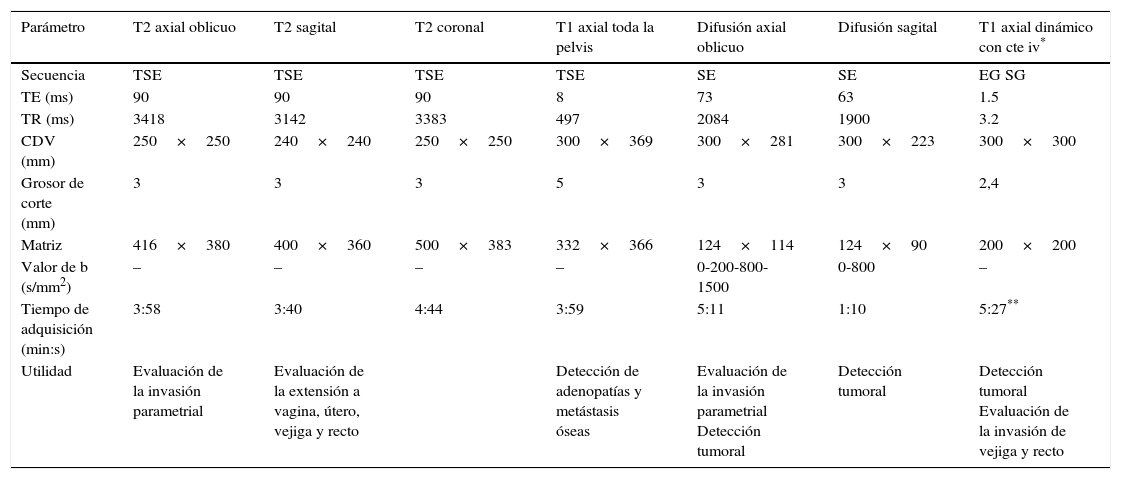
La preparación del paciente incluye la necesidad de ayuno y medicación antiperistáltica para reducir los artefactos por movimiento de las asas intestinales10. El protocolo realizado en nuestro centro se recoge en la tabla 2. Las secuencias dinámicas con contraste son opcionales y se realizan cuando se sospecha infiltración vesical o rectal, y el gel endovaginal no se emplea de forma rutinaria9–11.
Protocolo de resonancia magnética para la estadificación del cáncer de cérvix uterino
| Parámetro | T2 axial oblicuo | T2 sagital | T2 coronal | T1 axial toda la pelvis | Difusión axial oblicuo | Difusión sagital | T1 axial dinámico con cte iv* |
|---|---|---|---|---|---|---|---|
| Secuencia | TSE | TSE | TSE | TSE | SE | SE | EG SG |
| TE (ms) | 90 | 90 | 90 | 8 | 73 | 63 | 1.5 |
| TR (ms) | 3418 | 3142 | 3383 | 497 | 2084 | 1900 | 3.2 |
| CDV (mm) | 250×250 | 240×240 | 250×250 | 300×369 | 300×281 | 300×223 | 300×300 |
| Grosor de corte (mm) | 3 | 3 | 3 | 5 | 3 | 3 | 2,4 |
| Matriz | 416×380 | 400×360 | 500×383 | 332×366 | 124×114 | 124×90 | 200×200 |
| Valor de b (s/mm2) | – | – | – | – | 0-200-800-1500 | 0-800 | – |
| Tiempo de adquisición (min:s) | 3:58 | 3:40 | 4:44 | 3:59 | 5:11 | 1:10 | 5:27** |
| Utilidad | Evaluación de la invasión parametrial | Evaluación de la extensión a vagina, útero, vejiga y recto | Detección de adenopatías y metástasis óseas | Evaluación de la invasión parametrial Detección tumoral | Detección tumoral | Detección tumoral Evaluación de la invasión de vejiga y recto |
CDV: campo de visión; cte iv: contraste intravenoso; EG: eco de gradiente; SG: supresión grasa; TE: tiempo de eco; TR: tiempo de repetición; TSE: turbo espín eco.
Trataremos a continuación el papel de la imagen funcional en el cáncer de cérvix.
DifusiónLas secuencias de difusión permiten diferenciar el tejido normal del tumoral (alta señal en difusión y valores bajos en los mapas de ADC)12. Así, en pacientes con tumores isointensos en secuencias T2, difusamente infiltrantes o en estadio precoz si se plantea cirugía preservadora de la fertilidad, la difusión cobra importancia en la detección tumoral y en la estadificación, ya que las secuencias T2 pueden no ser óptimas para delimitar la lesión11,13–17. En este sentido, estudios recientes han demostrado su utilidad en la valoración de la invasión parametrial18. Por otra parte, está en investigación la capacidad de la difusión para distinguir el tipo de histología tumoral, y en la literatura se describen valores de ADC inferiores en carcinomas escamosos que en adenocarcinomas13.
Múltiples autores defienden el potencial de la difusión en la predicción de la respuesta al tratamiento con quimiorradioterapia (QR): lesiones con valores de ADC bajos (que reflejan la hipercelularidad del tumor) muestran mejores respuestas que las lesiones necróticas o hipocelulares (con valores de ADC relativamente altos)13,19,20. Además, también resultaría útil en la monitorización de la respuesta a dicho tratamiento. En diversos estudios se ha descrito su capacidad para la detección precoz de la respuesta a la terapia13,14,19–21 y para la detección de la recurrencia tumoral, ya que facilita la diferenciación entre fibrosis postratamiento (baja señal en difusión y en ADC) y recurrencia tumoral (restricción de la difusión)19.
Resonancia magnética dinámicaLos estudios dinámicos con contraste intravenoso mejoran la detección de tumores pequeños, que presentan realce temprano8, y pueden resultar de ayuda para valorar la invasión de la vejiga y del recto10,22. Por otra parte, se investiga el papel de la perfusión mediante RM en la identificación de pacientes con riesgo de fracaso del tratamiento QR23.
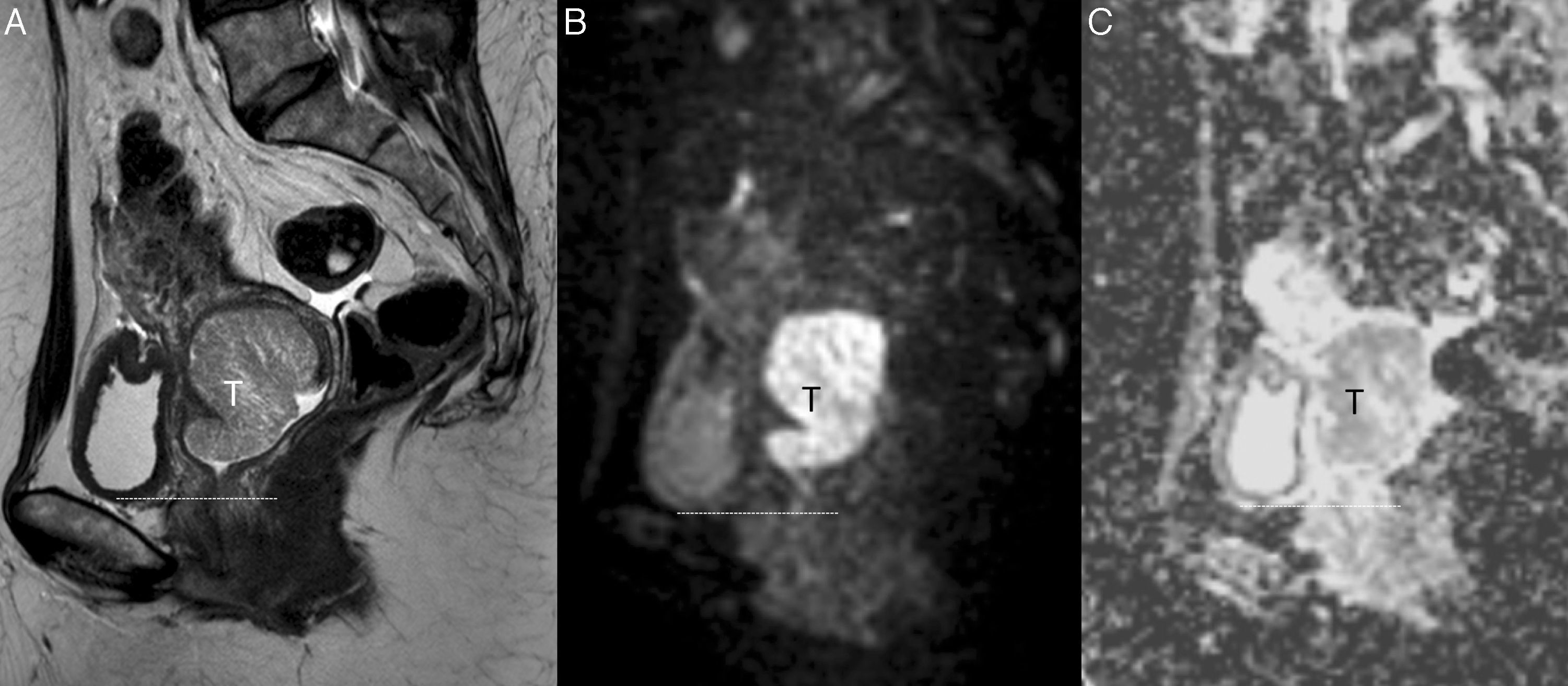
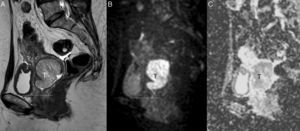
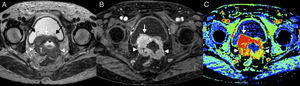
Puntos clave en la estadificación y planificación del tratamientoTamaño tumoralLa valoración del diámetro mayor del tumor tiene un gran impacto en el estadio tumoral del cáncer de cérvix y en su manejo terapéutico. El tamaño modifica el estadio tumoral creando una subcategoría tanto en el estadio IB como en el IIA (tabla 1); en ambos casos, los tumores de 4cm o menos (estadio IB1 y IIA1) optarían a tratamiento quirúrgico, mientras que con un tamaño tumoral mayor de 4cm (estadio IB2 y IIA2) (fig. 1) la opción terapéutica de elección es la QR, aunque podría realizarse también cirugía, pero con un menor nivel de evidencia24.
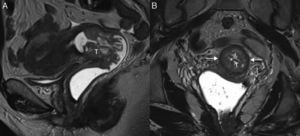
Cáncer de cérvix uterino con un tamaño superior a 4cm (estadio FIGO IIA2) en una mujer de 48 años. En la secuencia turbo espín eco T2 sagital se muestra una masa (T) de señal intermedia, mayor de 4cm y que protruye en la región superior vaginal, que muestra hiperseñal en la secuencia de difusión de alto valor de b (b=800 s/mm2) (B) con restricción de la difusión en el mapa de coeficiente de difusión aparente (C). La línea discontinua muestra la división entre los dos tercios superiores de la vagina y el tercio inferior. El tamaño superior a 4cm impidió un tratamiento quirúrgico.
La evaluación clínica del tamaño tumoral es inexacta; se describe una precisión de aproximadamente un 60%5,11,25. En contraposición, la RM muestra una precisión de hasta el 93% a la hora de determinar sus dimensiones6.
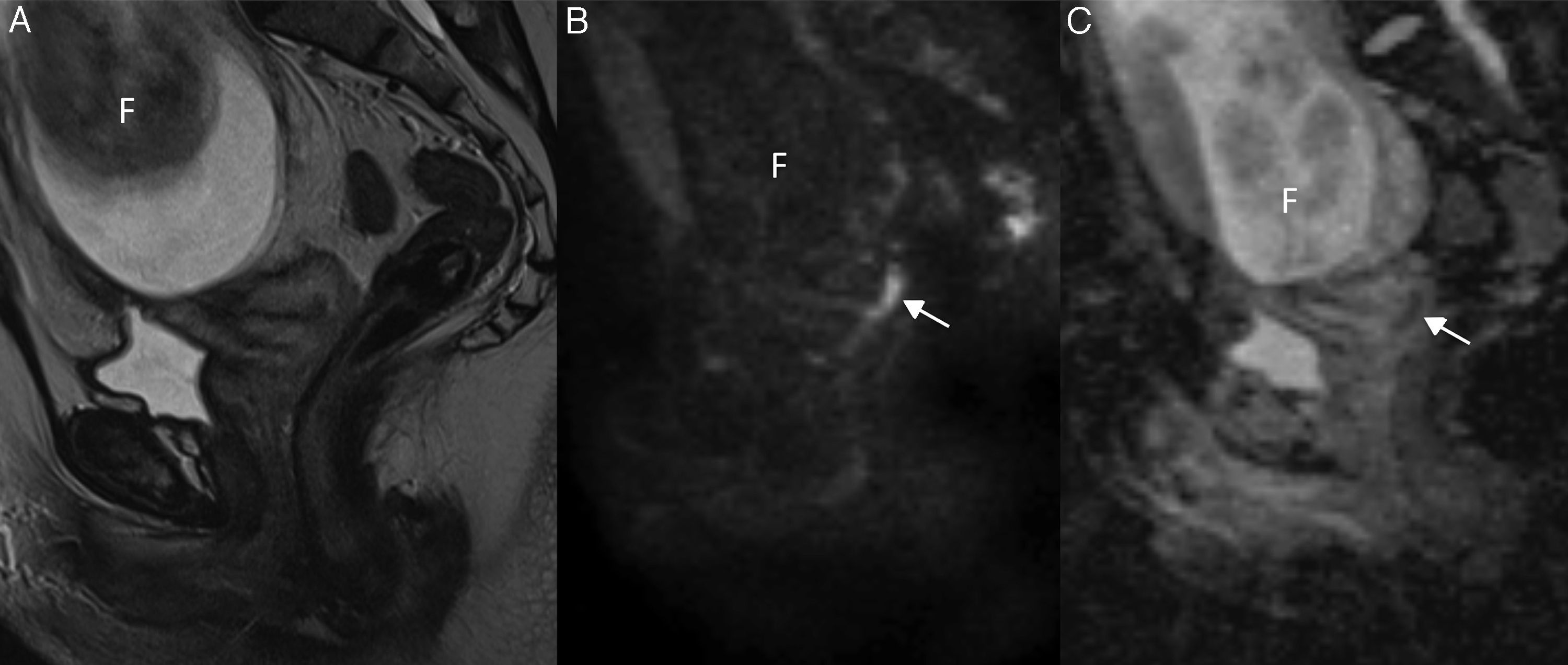
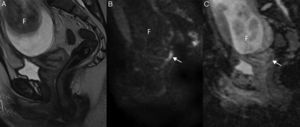
La secuencia clave para delimitar el tumor con mayor precisión es la secuencia T2 de alta resolución. En ella el tumor se visualiza como una masa de señal intermedia fácilmente distinguible del estroma cervical de baja señal. Sin embargo, tal y como ya se ha mencionado, en determinados pacientes dichas secuencias pueden no ser óptimas para la delimitación del tumor13,14,19,21. Por otra parte, el tamaño de la lesión puede ser sobrestimado en estas secuencias debido a la presencia de cambios inflamatorios y edema. Por este motivo, en estudios recientes, se ha sugerido el uso de las secuencias de difusión con el fin de diferenciar el tumor de los tejidos vecinos normales, definir los límites tumorales11,13–17, y reducir la sobrestimación de las secuencias T213 (fig. 2).
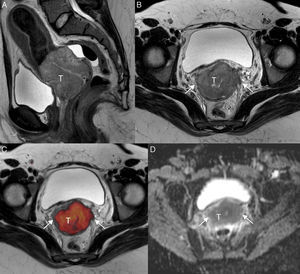
Cáncer de cérvix confinado al cuello uterino (estadio FIGO IB1) en una mujer de 26 años embarazada de 21 semanas. En la secuencia turbo espín eco T2 sagital no se define claramente el tumor, y en la secuencia de difusión de alto valor de b (b=1000 s/mm2) (B) se visualiza un área hiperintensa de 15mm en el labio posterior del cérvix uterino (flecha) con la correspondiente restricción de la difusión en el mapa de coeficiente de difusión aparente (C). Dichos hallazgos permitieron continuar con la gestación. F: feto.
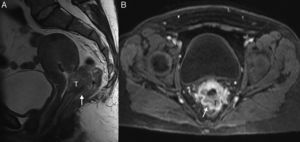
A pesar de que su afectación no cambia el estadio, resulta importante incluir este hallazgo en nuestro informe en pacientes con estadios precoces (IIA1 y IB1) candidatas a tratamiento quirúrgico (traquelectomía o histerectomía radical) (fig. 3). Esto se debe a que en pacientes jóvenes en las que el tumor está confinado al cérvix se puede optar por una cirugía preservadora de la fertilidad o traquelectomía. Los requisitos para esta cirugía se evalúan con RM y son los siguientes: la presencia de un tamaño tumoral menor de 2cm, un cérvix mayor de 2cm y una distancia al orificio cervical interno mayor de 1 cm5,6,26,27.
VaginaLa precisión de la RM en la valoración de la invasión vaginal es alta, de un 86-93%8, pero disminuye en tumores voluminosos debido a que el abombamiento de los fondos de saco vaginales puede sugerir infiltración tumoral, aunque estos no estén afectados8. Sin embargo, en estos casos, la pared vaginal de baja señal permanece intacta.
Es un signo de invasión vaginal la disrupción de la pared vaginal hipointensa normal por una lesión de señal intermedia en secuencias T2 en plano sagital, que realza en caso de la administración de contraste intravenoso.
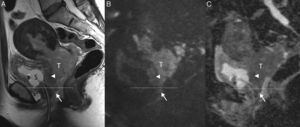
La valoración de la invasión vaginal es importante para establecer un correcto tratamiento, ya que si el tumor no invade el tercio inferior de la vagina se considera estadio FIGO IIA, y su tratamiento será quirúrgico, mientras que si lo invade su estadio sería IIIA, y se optaría por la QR5,6,8 (fig. 4). A la hora de evaluar las imágenes, resulta de ayuda considerar que las lesiones que se extienden más allá de la base de la vejiga afectan al tercio inferior de la vagina5.
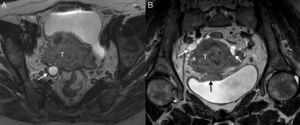
Cáncer de cérvix uterino que invade el tercio inferior de la vagina y la pared vesical posterior (estadio FIGO IV) en una mujer de 51 años. En las secuencias turbo espín eco T2 sagital (A), difusión de alto valor de b sagital (b=1000 s/mm2) (B) y mapa de coeficiente de difusión aparente sagital (C), se observa una gran masa infiltrante (T) que invade el tercio inferior de la vagina (flecha), así como la pared vesical posterior (punta de flecha) y la pared pélvica (este último hallazgo no visualizado en las imágenes). La línea discontinua muestra la división entre los dos tercios superiores de la vagina y el tercio inferior. S: sonda vesical.
La valoración de la invasión parametrial constituye un reto en la exploración clínica y su precisión varía entre un 29% y un 53% dependiendo del grado de invasión y de la experiencia del clínico28. Por el contrario, la RM no es solo capaz de detectar la invasión parametrial con una precisión de hasta el 97%7, sino que además excluye dicha invasión con un valor predictivo negativo del 94% al 100%, lo que permite la selección de pacientes candidatas a cirugía radical26.
En imagen, la invasión parametrial se diagnostica por la presencia de una disrupción del anillo estromal hipointenso en las secuencias T2 en plano axial oblicuo por tejido tumoral de señal intermedia5,6,11. Además, existen otros signos adicionales que nos ayudan a realizar este diagnóstico, como una interfase tumor-parametrio espiculada, la extensión de señal de partes blandas al parametrio y el encajonamiento de los vasos periuterinos5,6,8.
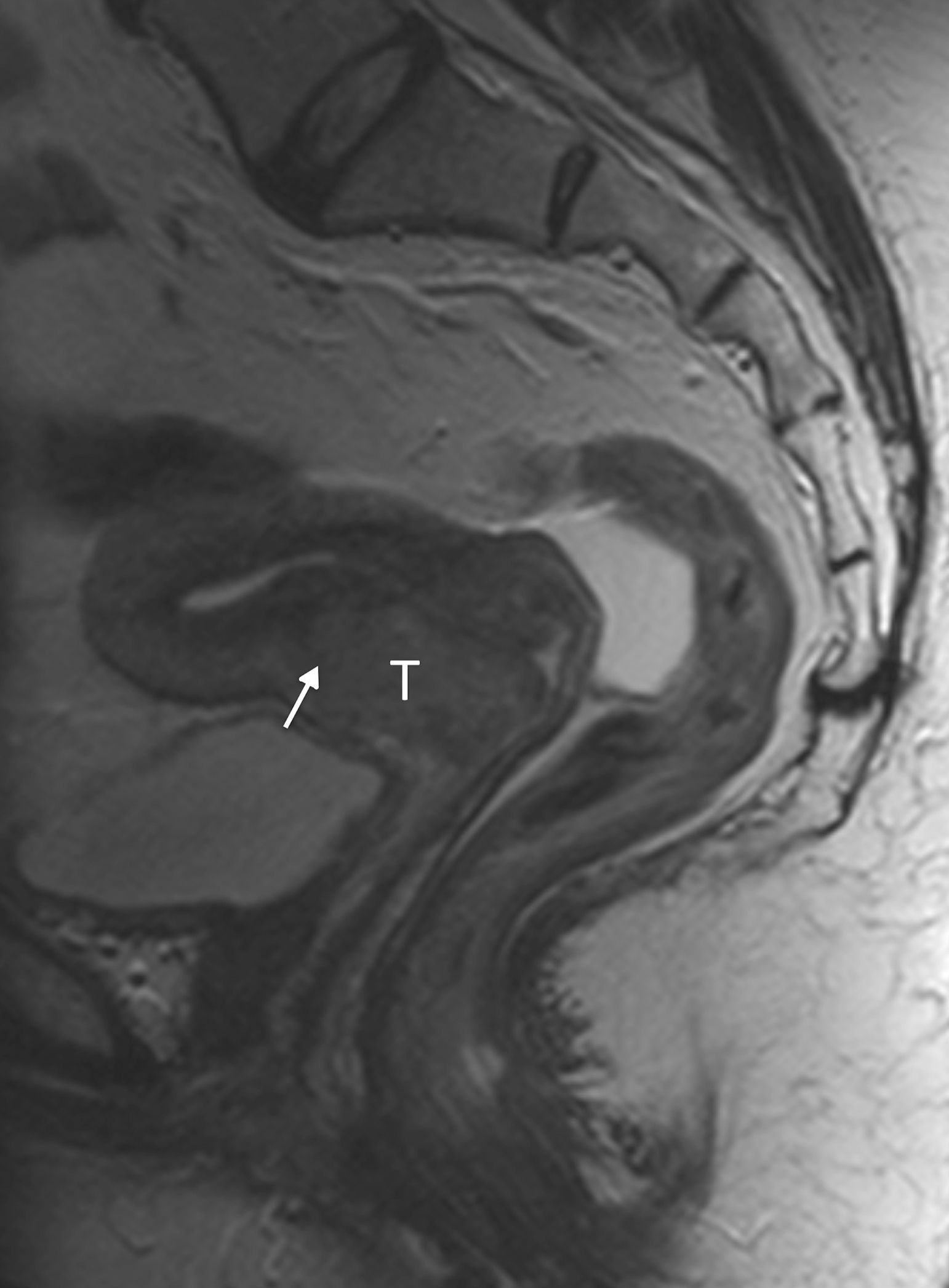
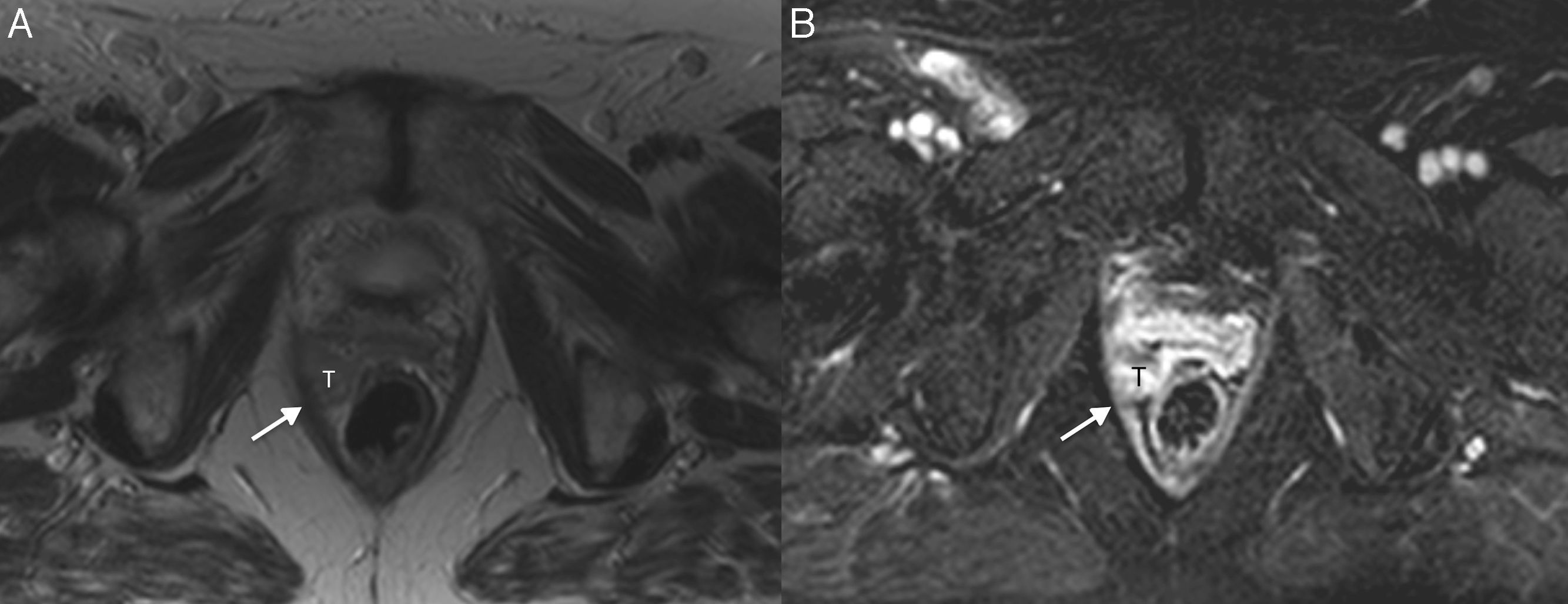
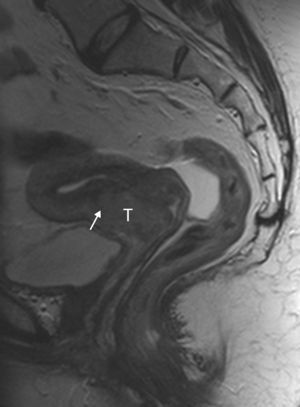
Por otra parte, la invasión parametrial puede ser excluida con una especificidad de hasta el 99% si está presente el signo del «anillo hipointenso»28, que consiste en la presencia de un anillo estromal de grosor superior a 3mm en toda su circunferencia (fig. 5).
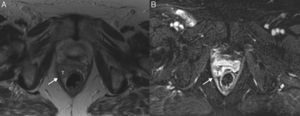
Cáncer de cérvix sin signos de invasión parametrial (estadio FIGO IB1) en una mujer de 46 años. En las secuencias turbo espín eco T2 axial (A) y sagital (B) se observa un tumor de señal intermedia (T) rodeado por un halo hipointenso que representa el estroma cervical normal (flechas). Se administró gel vaginal previa realización del estudio.
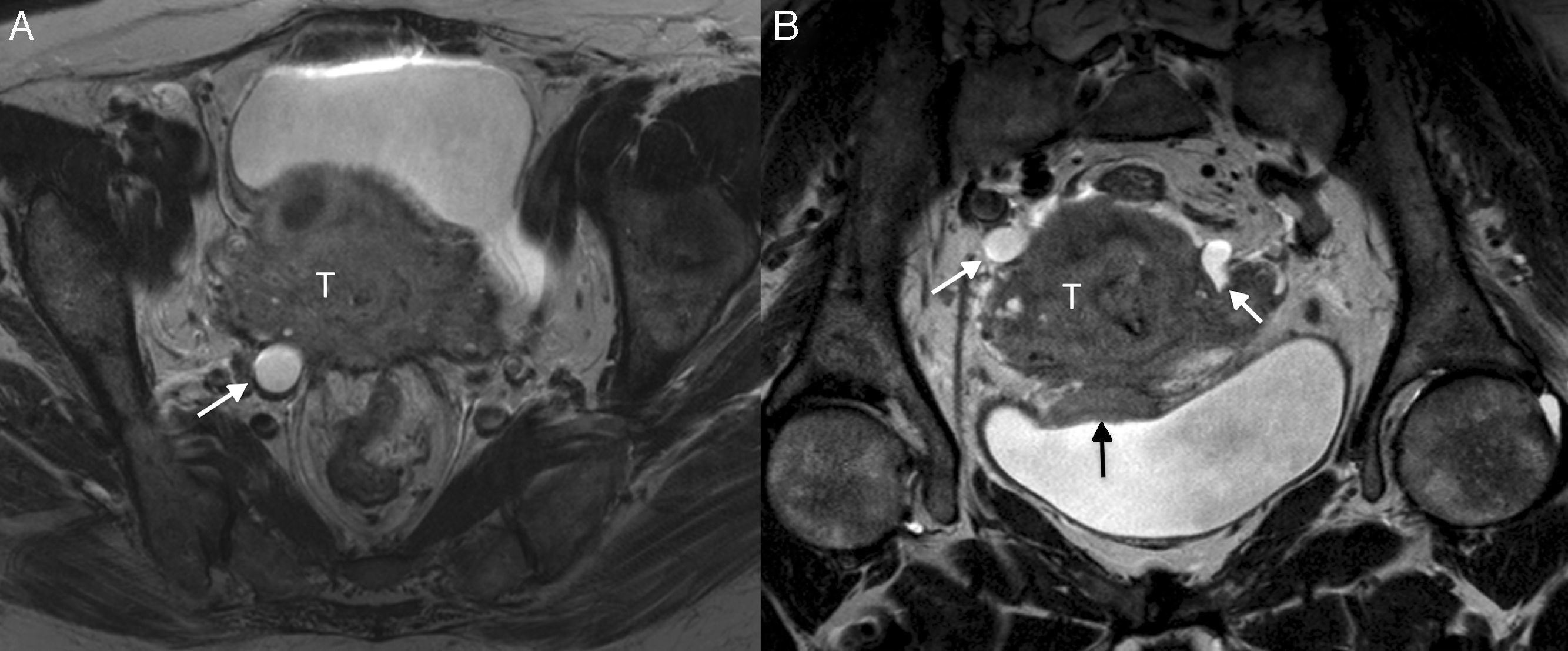
La precisión de la RM en la valoración de la infiltración parametrial varía de acuerdo con el tamaño tumoral, y alcanza una precisión del 96% en los tumores pequeños y de un 70% en los grandes tumores29. Cuando el tumor es suficientemente grande como para afectar al espesor completo del estroma cervical, puede ser difícil determinar la presencia o ausencia de invasión parametrial, y la precisión de las secuencias T2 se limita al 80%7. Esto se debe al edema y a la inflamación peritumoral, que muestran una señal similar al tumor e impiden discriminar correctamente los márgenes tumorales8,28. Por este motivo algunos autores abogan por la fusión de secuencias T2 con secuencias de difusión con altos valores de b, que permiten una mayor precisión en la valoración de la invasión parametrial que las imágenes morfológicas por separado, al reducir dicha sobrestimación18 (fig. 6).
Cáncer de cérvix con invasión parametrial bilateral (estadio FIGO IIB) en una mujer de 34 años. En las secuencias turbo espín eco T2 sagital (A) y axial (B) se observa una gran masa (T) con invasión parametrial bilateral (flechas), que se confirma en la fusión de la secuencia de difusión de alto valor de b (b=1500 s/mm2) con la secuencia TSE T2 axial (C), y en el mapa de coeficiente de difusión aparente (D).
Otra limitación de las secuencias morfológicas reside en que la hemorragia posterior a la biopsia puede causar estriación periestromal8,28. En estos casos, la difusión puede ayudar a determinar el verdadero alcance del tumor.
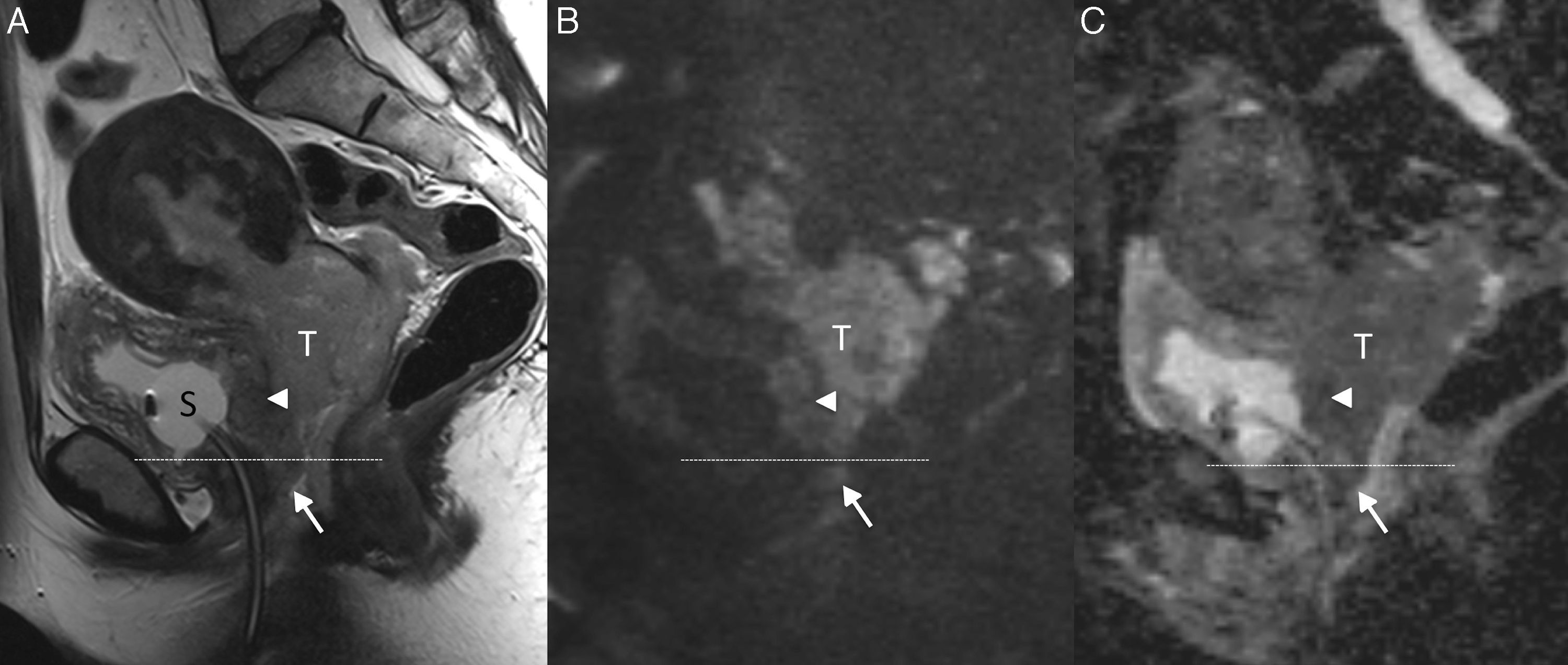
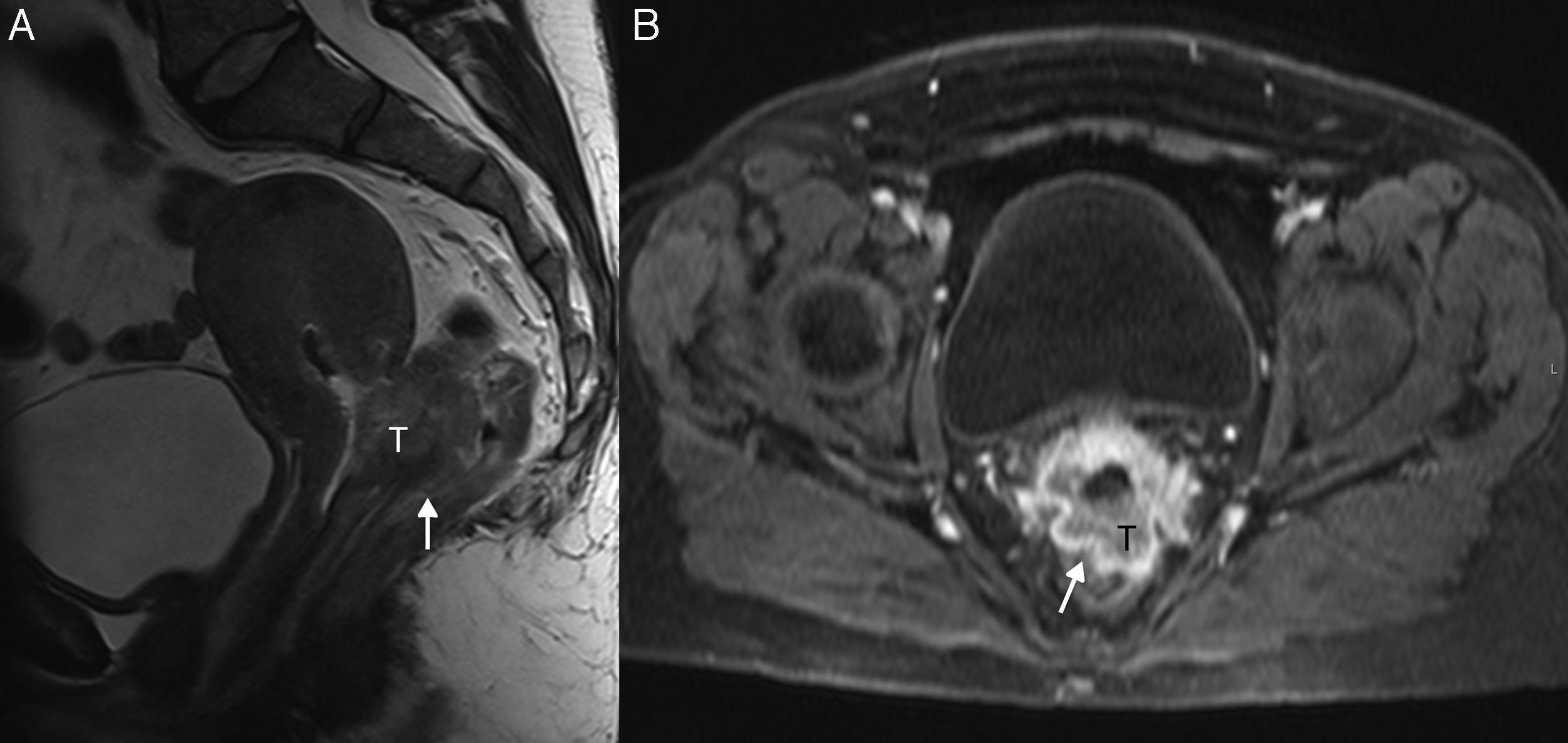
Pared pélvica e hidronefrosisCuando el tumor se extiende a la pared pélvica o causa hidronefrosis se considera estadio IIIB (figs. 7 y 8) y se trata con QR. La evaluación clínica de la invasión de la pared pélvica tiene una precisión de solo el 29-53%28, por lo que la RM tiene un papel fundamental para valorar dichos hallazgos. En imagen se sospecha cuando se visualiza tumor a menos de 3mm del músculo obturador interno, músculo elevador del ano, músculo piriforme o de los vasos ilíacos6,8,11,28.
Cáncer de cérvix con infiltración ureteral y de la pared vesical (estadio FIGO IVA) en una mujer de 65 años. En las secuencias turbo espín eco T2 axial (A) y coronal (B) se observa una gran masa (T) que presenta invasión parametrial bilateral que engloba ambos uréteres (flechas blancas) y provoca importante uropatía obstructiva. Se visualiza también invasión de la pared posterior de la vejiga (flecha negra).
Cáncer de cérvix uterino con invasión de la pared pélvica (estadio FIGO IIIB) en una mujer de 73 años. En las secuencias turbo espín eco T2 axial (A) y T1 axial con contraste y supresión grasa (con un tiempo de retardo de 1min) (B) se observa una masa cervical (T) que alcanza lateralmente al mu¿sculo elevador del ano del lado derecho (flecha), con el que pierde los planos de clivaje.
La infiltración de la mucosa vesical se considera estadio FIGO IVA y se trata con QR. Los criterios de afectación incluyen disrupción focal de la pared hipointensa normal, nodularidad e irregularidad de la pared, alta intensidad de señal a lo largo de la cara anterior de la pared posterior de la vejiga en T2 y, en casos avanzados, masas nodulares que se proyectan en la vejiga o fístulas vesicovaginales8 (figs. 4, 7 y fig. 9).
Cáncer de cérvix con invasión vesical (estadio FIGO IVA) en una mujer de 58 años. En la secuencia turbo espín eco T2 axial (A) se observa una gran masa (T) que invade ambos parametrios (puntas de flecha) y la pared vesical posterior (flecha blanca). Se visualiza el extremo inferior de los catéteres doble J (flecha negra) implantados por la ureterohidronefrosis que presentaba la paciente, ya que la lesión invadía ambas desembocaduras ureterovesicales. En un corte discretamente caudal al anterior se observa un intenso realce en el tumor y en la cara posterior de la pared vesical en la secuenciaT1 axial con contraste y supresión grasa (con un tiempo de retardo de 3min) (B), así como aumento de los valores a dicho nivel en el mapa paramétrico de perfusión correspondiente al área bajo la curva a 90 segundos (C).
El valor predictivo positivo del aumento de señal en las imágenes potenciadas en T2 en la pared posterior de la vejiga es bajo. Esto se debe a que una respuesta edematosa en estas estructuras, el llamado signo del «edema bulloso», puede imitar la infiltración tumoral6–8. Esta limitación ha conducido a la evaluación del papel de la RM dinámica con contraste que, según nuestra experiencia, mejora la precisión de la valoración de la afectación vesical en comparación con las secuencias T222.
RectoLa infiltración de la mucosa rectal también representaría un estadio FIGO IVA, cuyo tratamiento es la QR. La invasión rectal normalmente sigue el camino de los ligamentos uterosacros, porque la reflexión peritoneal actúa como barrera a la invasión directa desde el fórnix posterior5,6,28. En secuencias T2 se visualizará como una disrupción de la capa muscular hipointensa por la presencia del tumor de señal intermedia (fig. 10). La RM dinámica mejora la precisión de la valoración de dicha invasión en comparación con las secuencias T211.
Cáncer de cérvix con invasión rectal (estadio FIGO IVA) en una mujer de 44 años. En las secuencias turbo espín eco T2 sagital (A) y T1 con contraste y supresión grasa axial (con un tiempo de retardo de 1min) (B) se observa una masa (T) que se extiende posteriormente infiltrando la reflexión peritoneal, la grasa mesorrectal y la pared anterior del recto medio (flechas).
La RM es el método de elección para la estadificación locorregional del cáncer de cérvix. Una correcta valoración de sus factores pronósticos, como el tamaño tumoral, la invasión de estructuras adyacentes y la presencia de metástasis ganglionares, resulta fundamental para decidir un adecuado manejo terapéutico.
Autoría- 1.
Responsable de la integridad del estudio: ALC, SBG y RGF.
- 2.
Concepción del estudio: ALC, SBG, RGF, IOE y CVM.
- 3.
Diseño del estudio: ALC y SBG.
- 4.
Obtención de los datos: ALC, SBG, RGF y CVM.
- 5.
Análisis e interpretación de los datos: ALC, SBG, RGF y CVM.
- 6.
Tratamiento estadístico: No procede.
- 7.
Búsqueda bibliográfica: ALC, SBG e IOE.
- 8.
Redacción del trabajo: ALC, SBG e IOE.
- 9.
Revisión crítica del manuscrito con aportaciones intelectualmente relevantes: ALC, SBG, RGF, IOE y CVM.
- 10.
Aprobación de la versión final: ALC, SBG, RGF, IOE y CVM.
Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.