Los principales avances en el campo de las técnicas convencionales de imagen diagnóstica se habían centrado tanto en mejorar la resolución espacial y la velocidad de adquisición de los datos como en la introducción de nuevos medios de contraste. Sin embargo, los tumores representan modelos biológicos tremendamente complejos, existiendo una serie de características (hipoxia, metabolismo, celularidad, angiogénesis o funcionalismo de los ganglios linfáticos) de gran importancia en el campo de la oncología y que no pueden ser estudiadas adecuadamente con estos métodos diagnósticos. En este trabajo se presenta la posible aportación de distintas técnicas de imagen funcional basadas en el uso de la TC, la RM o la PET para obtener información de características y procesos biológicamente muy importantes para el diagnóstico, estadificación, planificación terapéutica, valoración de respuesta o seguimiento evolutivo de los pacientes oncológicos; así como para el desarrollo de nuevos fármacos.
Most advances in conventional diagnostic imaging techniques have focused on improving the spatial resolution and speed of acquisition of images or on new contrast agents. However, tumors are extremely complex biological models with a series of characteristics like hypoxia, metabolism, cellularity, angiogenesis, and functionality of the lymph nodes that are very important in oncology but cannot be adequately studied with these diagnostic imaging methods. In this article, we discuss the possible contributions of different functional imaging techniques based on computed tomography, magnetic resonance imaging, or positron emission tomography to obtain information about different biological processes and characteristics that are very important for diagnosing, staging, planning treatment, evaluating the response to treatment, and monitoring the evolution of cancer patients, as well as for the development of new drugs.
Hasta el momento actual, los principales avances en el campo de la imagen diagnóstica se habían centrado tanto en mejorar la resolución espacial y la velocidad de adquisición de los datos como en la introducción de nuevas técnicas y medios de contraste. Los radiólogos han conseguido de este modo una excelente resolución anatómica y de contraste, elementos muy importantes en el estudio mediante técnicas de imagen de los tumores.
Sin embargo, los tumores representan modelos biológicos tremendamente complejos. Los recientes progresos en la biología celular y molecular y en la genética nos han permitido profundizar en la comprensión biológica de las bases del cáncer. Y es por ello que, pese a los mencionados avances en la imagen, las dos principales causas de fracaso terapéutico en pacientes oncológicos continúan siendo las mismas: una estadificación tumoral inicial errónea y la existencia de características tumorales (hipoxia, celularidad, angiogénesis, etc.) no estudiadas adecuadamente con las técnicas de imagen convencionales1.
Además, la revolución terapéutica en la oncología actual, con tratamientos de radioterapia guiados por la imagen que permiten definir sub-volúmenes diana2,3 o la introducción de nuevos fármacos, crea la necesidad de una valoración diferente de los tumores y de la respuesta de los mismos a los tratamientos4.
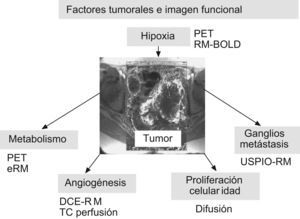
Por todo ello, en los últimos tiempos han ganado importancia las técnicas de imagen funcionales, que son capaces de estudiar in vivo procesos fisiológicos de los tejidos y de los tumores. Existe toda una serie de técnicas emergentes que nos permiten el estudio con TC o RM de la perfusión tumoral (angiogénesis), del metabolismo tumoral con las técnicas de PET o espectroscopia por RM, de la difusión de las moléculas de agua mediante las secuencias de difusión (celularidad), de la función de los ganglios linfáticos o de la hipoxia. Todas estas técnicas permiten obtener información de características y procesos biológicamente muy importantes del micro-entorno tumoral, incluyendo niveles de oxigenación, proliferación celular o vascularización tumoral, que van más allá de las técnicas convencionales y abren una dimensión diferente en la imagen tumoral a lo largo de todo el proceso de estudio de los pacientes: diagnóstico, estadificación, planificación terapéutica, valoración de respuesta o seguimiento evolutivo5–7 (fig. 1).
En este primer artículo abordaremos un repaso de la aportación de las técnicas funcionales al estudio de la angiogénesis y de la celularidad tumorales.
AngiogénesisLa angiogénesis, la formación de una red de nuevos capilares, es un componente esencial en múltiples procesos fisiológicos del organismo (ciclo menstrual, curación de heridas, etc.) y en procesos patológicos tumorales y no tumorales (como la artritis reumatoide o la degeneración macular). La angiogénesis es también un elemento clave en el desarrollo y diseminación metastásica de un tumor maligno8,9. Cuando un tumor crece más allá de 1–2mm3 requiere aporte vascular y el estímulo primario para la formación de nuevos vasos parece ser la hipoxia. Se conocen al menos 15 factores celulares con función pro-angiogénica, pero el factor de crecimiento del endotelio vascular (VEGF) parece desempeñar un papel clave en la misma9. Diferentes tipos tumorales usan distintos mecanismos genéticos para desencadenar el proceso angiogénico.
Los vasos tumorales suelen conformar una red anárquica e ineficaz de vasos finos, frágiles y tortuosos que muestran una permeabilidad aumentada y un flujo inestable e intermitente9,10. La distribución de los vasos en el seno del tumor es también muy variable, con áreas de alta y baja densidad de vasos. En una serie de distintas neoplasias se ha demostrado que la densidad de microvasos es un factor pronóstico para la supervivencia del paciente11. Al margen de la densidad de vasos, otro factor muy importante es el funcionalismo de los mismos (hecho que las pruebas histológicas no valoran), ya que se ha visto que el porcentaje de vasos perfundidos en un área en un momento dado, varía entre el 20–85%9.
Todas estas características antes citadas de los vasos tumorales determinan un aumento de la permeabilidad capilar, de la presión intersticial y de la perfusión tumoral que pueden ayudarnos a caracterizarlos mediante técnicas de imagen. La imagen clásica ha venido estudiando características del realce de los tumores desde un punto de vista morfológico (tamaño) y cualitativo (grado de realce). Sin embargo, recientemente han surgido nuevas técnicas de imagen funcional que permiten un análisis cuantitativo y de imagen molecular de dianas específicas en los vasos11–15. Diferentes modalidades de imagen, incluyendo TC, RM, ultrasonidos o PET pueden usarse para evaluar de modo no invasivo la vasculatura tumoral pero la TC y la RM son las principales (tabla 1).
Principales Técnicas de Imagen en el estudio de la Angiogénesis
| Técnica de imagen funcional | Propiedades biológicas en las que se basa la imagen | Parámetros cuantitativos obtenidos | Correlación fisiopatológica |
| Perfusión TC | Atenuación de los Rayos X por el medio de contraste |
| Densidad de vasosPermeabilidad vascularPerfusiónVolumen de plasma |
| Se valoran los espacios vascular y extravascular | |||
| RM Dinámica GRE-T1 (DCE-MRI) | Porcentaje de captación de medio de contraste en los tejidos |
| Densidad de vasos |
| Se valoran los espacios vascular y extravascular | Permeabilidad vascular | ||
| Depende de: | Perfusión | ||
| Volumen de plasma | ||
| RM Dinámica de susceptibilidad con contraste (T2*) (Dynamic susceptibility contrast MRI-DSC-MRI) | Efectos sobre el campo magnético del medio de contraste, que dependen del volumen y flujo sanguíneo |
| Densidad vascularFlujo sanguíneoGrado tumoral |
| Se valora el espacio vascular | |||
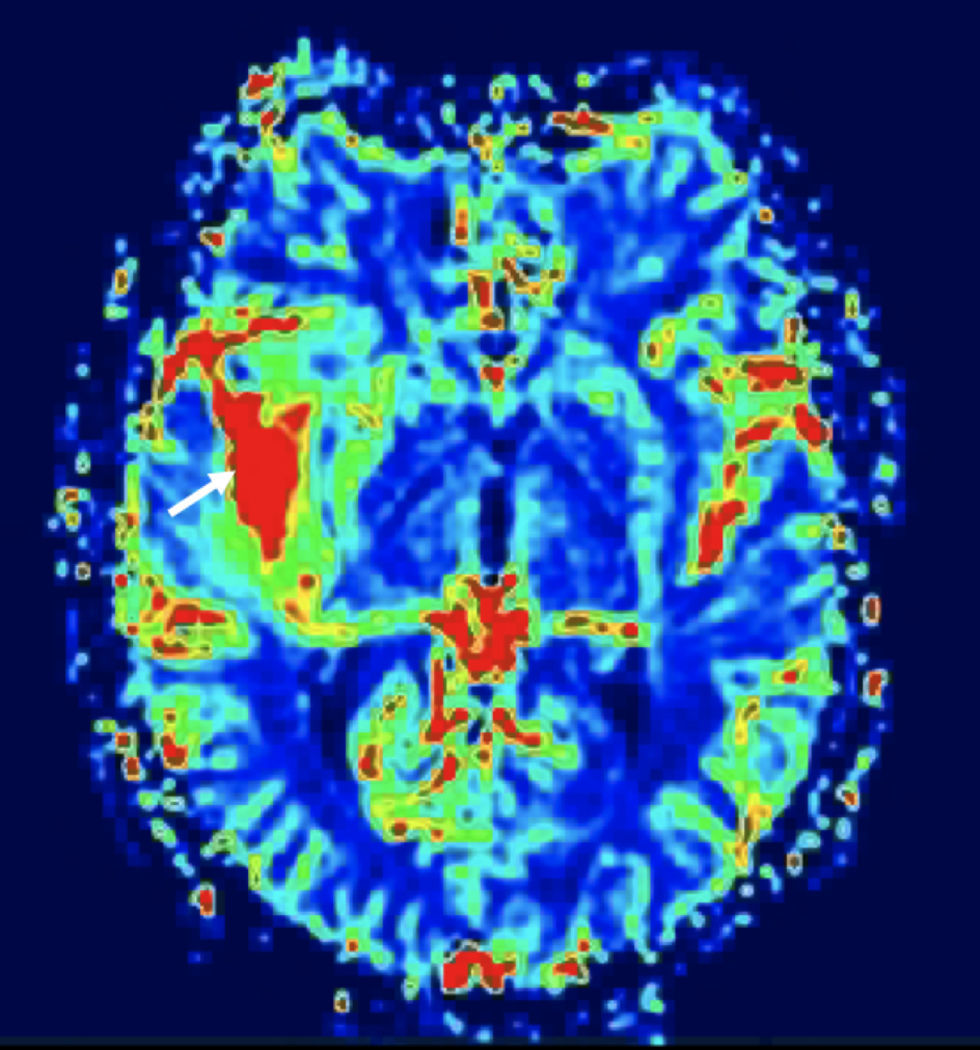
| RM BOLD (Blood oxygenation level dependent MRI) | La deoxihemoglobina es paramagnética y muestra mayor relaxitividad que la oxihemoglobina |
| Propiedades ferromagnéticas de los tejidos |
| Nivel de oxigenación tisular | |||
| Las medidas también reflejan volumen de sangre, perfusión y composición intrínseca de los tejidos |
La angiogénesis tumoral puede ser estudiada con técnicas de RM sin el uso de medios de contraste mediante técnicas BOLD o IVIM y utilizando técnicas de TC perfusión y RM-dinámica con distintos medios de contraste.
TC-perfusiónLa TC-perfusión se basa en el cambio temporal de la atenuación de los tejidos tras la administración de contraste iodado endovenoso. En su estudio podemos distinguir dos fases. Una primera, que dura entre 40–60s, en la que el realce es fundamentalmente debido a la distribución del contraste en el espacio intravascular y a su paso rápido al espacio extravascular extracelular y en la que la que se precisa alta resolución temporal (una adquisición por segundo). Y una segunda, en la que el realce depende de la distribución del agente de contraste entre los compartimentos intra y extravascular y en la que la adquisición en más espaciada y dura entre 2–5min9,12–15 (fig. 2).
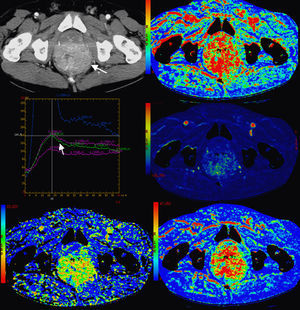
Esta técnica funcional puede ser usada para medir una serie de parámetros vasculares que dependen del modelo de máquina que usemos e incluyen flujo sanguíneo, volumen sanguíneo, tiempo de tránsito medio, pico de realce, tiempo al pico de realce y permeabilidad capilar (fig. 3). La TC-perfusión se ha usado en una amplia variedad de órganos y tumores16–18. Existen diversos estudios que validan los datos de la TC funcional como biomarcador de angiogénesis9,16,17,19–23. Existe un interés creciente sobre el uso de la TC-perfusión en oncología con múltiples aplicaciones en las que puede ser útil: diagnóstico diferencial entre lesiones benignas y malignas, identificación de neoplasias ocultas (con alteración de la perfusión en hígados con enfermedad metastásica oculta), definición de pronóstico (con mejor respuesta en tumores con más perfusión), monitorización de respuesta al tratamiento y desarrollo de nuevos fármacos14,15. La técnica se está aplicando en múltiples tipos tumorales: cabeza y cuello, pulmón (fig. 4), hígado, páncreas, cáncer colorrectal, linfoma o próstata. Un repaso amplio de estas aplicaciones puede encontrarlo el lector en el artículo de Kambadakone et al14.
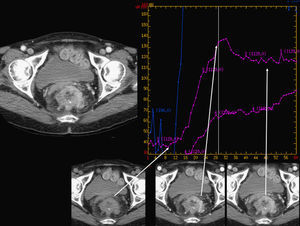
Estudio de TC-perfusión pélvico. Neoplasia rectal. De izquierda derecha y de arriba abajo: imagen de adquisición mostrando el tumor (flecha), mapa paramétrico de volumen sanguíneo, gráfica de captación y mapas paramétricos de flujo sanguíneo, tiempo de tránsito medio y superficie de permeabilidad. Los mapas parámetros muestran marcada vascularización y alteración de la permeabildad tumoral.
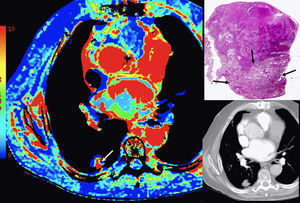
Estudio de TC-perfusión torácico. Neoplasia pulmonar. Mapa paramétrico del volumen sanguíneo (izquierda), espécimen patológico (tinción hematoxilina-eosina, micro-macro) e imagen de adquisición (abajo derecha) mostrando un área del nódulo (flecha blanca) con altos valores de BV que se correlaciona con la zona tumoral viable (flechas negras). El resto del nódulo muestra necrosis.
Los estudios dinámicos de RM los podríamos clasificar según el tipo de medio de contraste usado en: técnicas no específicas que usan agentes de contraste de bajo peso molecular (<1.000Da), técnicas que usan agentes macromoleculares (>30.000Da) que son retenidos de modo prolongado en el espacio intravascular y métodos basados en el uso de agentes que se acumulan en lugares de alta concentración de moléculas mediadoras de la angiogénesis8,9,15. La RM dinámica con uso de medios de contraste de bajo peso molecular que difunden al espacio extracelular es la técnica actualmente más empleada8,10,12,13.
Contrastes de bajo peso molecular.
Los agentes de contraste de bajo peso molecular difunden libremente entre el espacio intravascular y el extravascular extracelular. Los factores que van a determinar su comportamiento son el flujo sanguíneo, la permeabilidad vascular y la difusión al intersticio. Dependiendo de si existen limitaciones de flujo o de permeabilidad la cinética del contraste cambiará. En los tumores, de modo general, el flujo es limitado y la permeabilidad alta por lo que la perfusión es el factor clave9. Las técnica de RM-dinámica con agentes de contraste de bajo peso molecular se pueden clasificar según el tipo de secuencias usadas: T2* o T1. Estas técnicas presentan diferencias en sus indicaciones y en la información que se obtiene con ellas.
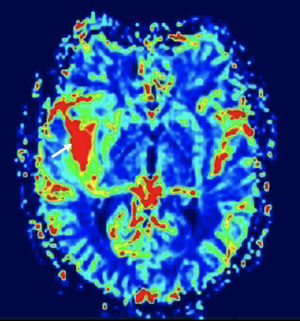
Secuencias T2*Las técnicas T2* utilizan el efecto de susceptibilidad magnética que causa el agente de contraste a nivel capilar cuando se alcanza una alta concentración de gadolinio y que produce una caída de señal de los tejidos (fig. 5). Estas técnicas reflejan principalmente perfusión tisular a nivel capilar y volumen sanguíneo24 y su uso es básicamente en el cerebro. Las técnicas T2* no valoran la alteración de la barrera hematoencefálica y, de hecho, si hay rotura de barrera puede haber problemas de interpretación.
Secuencias eco de gradiente potenciadas en T1 (GRE-T1)Las técnicas GRE-T1 se basan en que tras un bolo de medio de contraste se produce el paso del mismo a través de la red capilar (primer paso) y de un modo rápido difunde al espacio extravascular extracelular y provocan un acortamiento del tiempo de relajación T1 de los tejidos. En esta segunda fase de la llegada de contraste, el incremento de señal se debe a la presencia de contraste tanto en el espacio vascular como en el intersticial. Posteriormente se produce la vuelta del contraste al espacio vascular y su excreción. Estas técnicas de imagen representan mejor la alteración de la permeabilidad y la fuga al espacio extravascular y se usan principalmente en estudios fuera del cerebro.
En ambos tipos de técnicas, el análisis de los datos obtenidos puede ser cualitativo (perfil de la curva), semicuantitativo (cambios en la intensidad de señal) o cuantitativo (fig. 6). Las medidas cualitativas pueden ser útiles y, en cáncer de mama, el tipo de perfil de curva se asocia a probabilidad de malignidad, así el tipo III (subida rápida y lavado) se asocia a malignidad en el 89% de los casos25. Las medidas semicuantitativas como la intensidad de señal relativa (la relación entre la mayor intensidad de señal poscontraste y la señal precontraste) o la pendiente de la curva intensidad tiempo (que refleja la velocidad del realce) o el área bajo la curva intensidad de señal/tiempo son simples de obtener, pero no son comparables entre distintas máquinas. La obtención de parámetros cuantitativos es compleja puesto que en RM no existe, como en la TC, una relación lineal entre la concentración de contraste y la señal del tejido. Por ello se usan modelos farmacocinéticos que permiten cuantificar diversos parámetros. En el caso de las técnicas T2*, el volumen, el flujo sanguíneo y el tiempo de tránsito medio, y con secuencias T1, ktrans (paso de contraste a través del endotelio desde el compartimento vascular al intersticio), kep (vuelta al espacio vascular) y Ve (fracción del espacio extracelular del tumor)24,26–28. Además, con dichos datos es posible construir mapas paramétricos que representen la heterogeneidad intratumoral de la distribución espacial de los mismos14,15,24, lo que es muy importante a la hora de planificar el tratamiento en función de la imagen al definir sub-volúmenes tumorales2,3. Debemos, sin embargo, considerar la complejidad que existe detrás de estos parámetros. Así, en áreas en donde el tumor tiene una alta permeabilidad vascular (como en la periferia del anillo de intensa captación periférico), los valores de ktrans van a depender principalmente del flujo; mientras que en el centro del tumor (en donde el factor limitante es la permeabilidad), dependerá de la superficie de permeabilidad24.
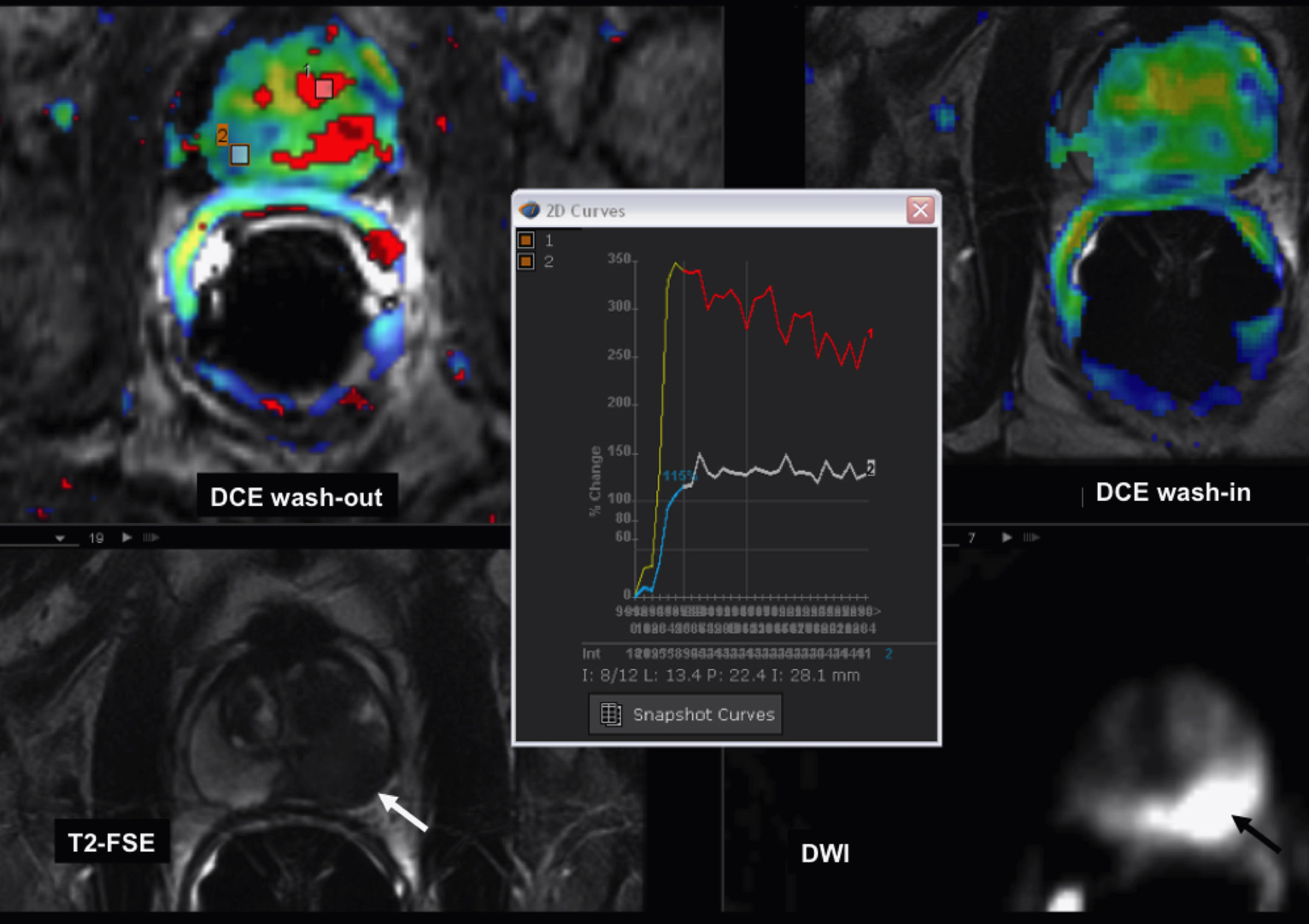
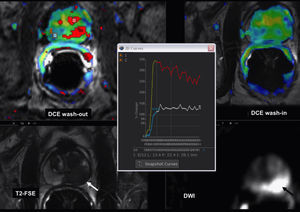
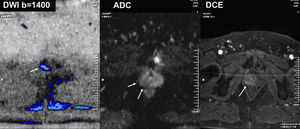
Estudio de RM prostática. Cáncer de próstata. Mapas paramétricos de entrada de contraste «wash-in» y de lavado del mismo «wash-out» con alteración de los mismos en la zona tumoral en comparación con la zona periférica prostática contralateral, gráfica de variación de la señal a lo largo del tiempo del tumor «curva 1» con patrón de captación rápida e intensa y lavado precoz, imagen axial FSE-T2 que muestra el tumor como hiposeñal en la porción izquierda de la glándula periférica «flecha blanca» e imagen de difusión con marcada restricción de la misma «flecha negra».
Múltiples estudios han intentado demostrar la correlación entre las medidas obtenidas mediante RM dinámica y diversos factores pronósticos como el grado tumoral, la densidad de microvasos, el grado de expresión de VEGF, la recurrencia, la supervivencia o la hipoxia27. Los resultados son muy variables según los autores y en los diferentes tipos tumorales, pero se ha visto relación entre estos factores en mama, próstata, hígado, cérvix uterino o tumores de partes blandas9,27,29–32. La RM dinámica se ha demostrado útil a la hora de caracterizar como benignas o malignas lesiones en mama y musculo-esquelético, en la estadificación de tumores ginecológicos, de vejiga y próstata y en la predicción y valoración de posible respuesta a diferentes terapias (quimioterapia, radioterapia, crioterapia, etc.) en distintos tipos tumorales28–32.
Respecto al uso de la perfusión como un biomarcador de hipoxia tumoral, este papel ha sido validado en neoplasias escamosas de cabeza y cuello y en cáncer de cérvix33,34, pero no en otros tumores como, por ejemplo, el recto35, por lo que este hecho podría estar en directa relación con el tipo histológico del tumor.
La perfusión con RM ha demostrado también utilidad a la hora de predecir y valorar respuesta terapéutica. Así, en cáncer de cérvix, se ha demostrado una mayor respuesta a la radioterapia en tumores mejor perfundidos. Sin embargo, un realce intenso después de radioterapia se asocia a peor control local y una menor supervivencia en distintos tipos tumorales34,36.
Nuevos medios de contraste y otras técnicas para el estudio de la angiogénesisDado que tanto los tejidos inflamatorios como los tumores tienen vasos con la permeabilidad aumentada, la imagen con contrastes de bajo peso molecular es un tanto inespecífica. Sin embargo, generalmente los vasos de tejidos inflamatorios tienen poros de menor tamaño que los tumorales, por lo que los medios de contraste macromoleculares (partículas férricas, albúmina-gadolinio, etc.) podrían ser más selectivos, al fugar más en tumores10. Estos agentes de contraste pueden ser empleados tanto con TC como con RM, pero actualmente tan solo los usados con RM tienen licencia de uso clínico16.
Otra vía muy prometedora para el estudio futuro de la angiogénesis vendría de la mano de compuestos dirigidos contra moléculas selectivamente expresadas por los vasos neoangiogénicos: VEGF, integrinas y metaloproteinasas de la matriz. La ventajas de estas técnicas de imagen molecular serían su especificidad y el que permitirían caracterizar mejor el estado del endotelio en el tumor10.
Por último, la obtención de información sobre perfusión mediante técnicas de difusión basadas en el IVIM se explica por el hecho de que la señal de difusión está influenciada por dos tipos de movimientos de las moléculas: la difusión propiamente dicha (secundaria al movimiento browniano de las moléculas) y la perfusión (debida al movimiento a través de los microcapilares)37. La separación de estos dos componentes y el cálculo de la fracción de perfusión (f) parece que podría tener utilidad a la hora de diferenciar lesiones benignas y malignas38.
¿TC-perfusión o RM-dinámica?Comparando entre sí, las técnicas de TC o RM presentan ventajas e inconvenientes. La TC presenta la ventaja de su mayor disponibilidad, mientras que el problema de la dosis de radiación, su menor resolución de contraste, la escasa cobertura anatómica (4cm en los TC de 64 filas de detectores) son limitaciones a considerar. Sin embargo, el uso de protocolos de baja dosis o de adquisiciones que permitan una cobertura total del tumor, aunque con menor resolución temporal, y la mayor cobertura anatómica de los nuevos equipos de TC podrían ayudar a superarlas14,15,39. Por su parte, la RM-dinámica es una técnica que muestra una mejor relación señal ruido y que puede ser repetida frecuentemente al carecer de radiación; sin embargo en ciertas áreas, como en el tórax y en el abdomen superior, su utilidad es más limitada debido a los artefactos de movimiento13.
De un modo general, debemos considerar que la TC funcional proporciona información principalmente sobre el primer paso del bolo de contraste aportando datos sobre la perfusión absoluta y el volumen sanguíneo, mientras que la RM dinámica estudia el volumen tumoral menos frecuentemente pero durante más tiempo, permitiendo por ello extraer información que refleja mejor la perfusión de microvasos, la permeabilidad y el espacio extracelular de fuga.
DifusiónLos tejidos humanos están constituidos por una gran cantidad de moléculas de agua. Estas moléculas muestran un movimiento aleatorio a escala microscópica que se denomina movimiento browniano. Las diferentes moléculas de agua cambian tanto de velocidad como de dirección cuando una molécula choca contra otra y dependiendo de su interacción con las membranas celulares, las organelas celulares y otras macromoléculas. La medida de este desplazamiento que realizan las moléculas se denomina coeficiente de difusión D y expresa el desplazamiento neto por unidad de tiempo (mm2/s) y el uso de la RM para demostrar este desplazamiento es lo que denominamos imagen de difusión, diffusion-weighted imaging o DWI. La difusión, al estar centrada en lo molecular (tres órdenes de magnitud menos que la resolución de las clásicas secuencias de RM), es muy sensible a pequeños y precoces cambios biofísicos en los tejidos40–43.
Durante mucho tiempo las técnicas de difusión se emplearon únicamente en patología intracraneal, pero posteriormente, el desarrollo técnico con las secuencias ecoplanares y las técnicas de adquisición en paralelo permitieron su aplicación en otras áreas anatómicas como el abdomen y la pelvis. La técnica es rápida (entre 1–5min) y no precisa de la administración de ningún contraste exógeno. La imagen en difusión se basa en que, inmediatamente después de un pulso de excitación, las moléculas de un volumen se encuentran en la misma fase. Cuando a ese volumen le aplicamos un gradiente, las moléculas se desfasan en diferente grado dependiendo de donde se encuentran. Si entonces se aplica otro gradiente opuesto de la misma magnitud tan solo volverán a la fase aquellos protones que se encuentren en la misma posición (difusión restringida) y aparecerán brillantes en las secuencias de difusión. Es decir, la baja movilidad de las moléculas se refleja como alta señal en las imágenes en imagen de difusión y, por el contrario, las moléculas que tienen gran movilidad no recuperarán su fase completamente tras la aplicación del segundo gradiente, lo que producirá una pérdida de señal en el volumen del que se han desplazado las moléculas más móviles.
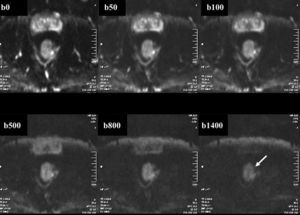
A la hora de obtener una imagen en difusión usaremos distintos valores de sensibilidad a la difusión (valores «b»). Generalmente se obtienen al menos imágenes con tres valores de «b». Conforme aumentamos el valor «b» se va produciendo la caída de señal de distintos tejidos, empezando por la sangre circulante y siguiendo consecutivamente con las áreas glandulares, las áreas necróticas y, por último, los tumores. Es decir con valores de sensibilidad a la difusión altos casi solo brillarán los tumores (fig. 7). El usar distintos valores de «b» también va a ser importante sobre todo a la hora de calcular el valor del coeficiente de difusión aparente (ADC). El ADC permite un cálculo cuantitativo de la difusión. La importancia del ADC viene dada porque a la hora de obtener las imágenes de difusión, existe un componente aportado por la señal de los tejidos con un tiempo de relajación T2 muy prolongado. Es decir, una lesión puede brillar en secuencia de difusión porque exista verdadera restricción de la misma y/o porque tenga un T2 muy acentuado (edema o fluido debido a su alta densidad de protones), fenómeno denominado T2 shine-through. Las lesiones con verdadera restricción de la difusión aparecerán con baja señal en las secuencias de ADC40–43.
El valor del ADC puede ser medido y usado como un parámetro cuantitativo. No existe un valor de ADC claro que distinga cáncer y no cáncer excepto en útero y cérvix, pero aunque las diferencias entre distintos tipos tumorales puede ser amplia, cifras en torno a 1–1,2×10−3mm2/s representan un umbral bastante significativo (siendo el valor aproximado del coeficiente de difusión del agua libre 3×10−3mm2/s). Además, la alteración de la difusión se ha demostrado, en ciertos tipos de tumores, que es proporcional al grado de los mismos40,43.
Para evitar errores de interpretación de las imágenes de difusión resulta necesario valorar conjuntamente las imágenes anátomicas, las de difusión y los mapas de ADC (tabla 2), dado que tenemos que tener en cuenta que los tumores bien diferenciados y los de alto grado con necrosis van a presentar valores altos de ADC y que, por el contrario, ciertos tejidos normales (bazo, pared intestinal, médula espinal, cerebro o ganglios linfáticos), tumores benignos (miomas) y la fibrosis pueden presentar valores bajos de ADC44.
Interpretación conjunta de las imágenes potenciadas en T2 y en difusión y del ADC
| T2 | B800−100 | ADC | Interpretación |
| Señal alta o intermedia | Alta señal | Baja señal | Alta celularidad |
| Tumor | |||
| Raro: absceso, necrosis coagulativa | |||
| Alta señal | Alta señal | Alta señal | Proteinaceo |
| Señal baja o intermedia | Baja señal | Baja señal | Fibrosis |
| Alta señal | Baja señal | Alta señal | Líquido |
| Baja celularidad | |||
| Necrosis licuefactiva | |||
| Glándulas |
La difusión nos va a aportar información morfofuncional de los tejidos, incluyendo la densidad celular de los mismos, la tortuosidad del espacio extracelular, la integridad de las membranas celulares y el grado de organización glandular. Todos estos datos tienen una amplia translación a la imagen en Oncología. Las neoplasias suelen presentar marcada celularidad que restringe el movimiento libre de las moléculas de agua. La difusión puede tener utilidad en la detección de lesiones, en la caracterización de las mismas, en la predicción de respuesta al tratamiento y en la evaluación de la respuesta40–44.
La utilidad de la difusión ha quedado claramente establecida en ciertos tumores como la próstata (fig. 8), el cáncer colorrectal, la mama, el páncreas, los tumores uterinos, o la vejiga y en enfermedad metastásica ósea, hepática o peritoneal45–51; mientras que en otros como el hepatocarcinoma52 o el cáncer de pulmón53, la difusión presenta un papel mucho más limitado.
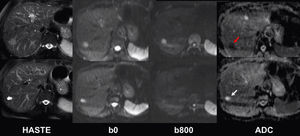
RM pélvica. Cáncer de próstata. Radioterapia 7 años antes. Actualmente recaída bioquímica. Imágenes de difusión (b=1.400), mapa de ADC y estudio dinámico tras la administración de contraste. El estudio de difusión muestra una clara zona de restricción de la misma en la zona periférica derecha (flechas blancas, izquierda y centro). El estudio dinámico (derecha) y las imágenes potenciadas en T2 no mostraban hallazgos sugestivos de neoplasia. La biopsia confirmó la recidiva tumoral.
En la detección de lesiones se ha visto la utilidad de la difusión a la hora de detectar lesiones primarias (como los cánceres colorrectales o de mama)45,48 o en la detección de metástasis mediante las técnicas de RM de cuerpo completo54,55.
En el estudio del hígado, se ha publicado que el uso de valores «b» bajos es útil para suprimir la señal de los vasos hepáticos y poder detectar mejor lesiones focales. Un análisis cualitativo puede ser útil a la hora de distinguir quistes de lesiones sólidas hepáticas y el análisis cuantitativo de las mismas ha demostrado que las lesiones benignas hepáticas muestran unos valores mayores de ADC que las malignas50 (fig. 9). Sin embargo, debemos tener en cuenta el problema diagnóstico que representan las metástasis tratadas o las que muestran cambios necróticos o quísticos, lo que disminuye la fiabilidad de la difusión40. En la evaluación de los ganglios linfáticos los resultados de las distintas series son muy variables56.
ConclusionesLa angiogénesis y la celularidad tumoral son dos de los factores más críticos para la determinación de la evolución de las neoplasias. Así, se ha demostrado que la angiogénesis es un elemento clave en el desarrollo de los tumores y en la diseminación de los mismos. Distintas técnicas de imagen permiten un estudio no invasivo de las mismas, lo que puede ser muy útil en el diagnóstico, estadificación y establecimiento del pronóstico de los pacientes oncológicos, así como para la valoración de la respuesta tumoral a distintas terapias.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.