Para el seguimiento de la evolución del daño pulmonar en los pacientes con fibrosis quística (FQ) se han desarrollado distintos sistemas de clasificación o puntuación mediante la radiografía de tórax y la tomografía computarizada de alta resolución (TCAR). La TCAR es una técnica más sensible que la radiografía de tórax para evaluar la anatomía, sin embargo, en pacientes pediátricos el uso de la tomografía computarizada (TC) debe reducirse al mínimo necesario y utilizar sistemas de protección radiológica y reducción de dosis.
Uno de los sistemas de clasificación mediante TCAR más empleados es el propuesto por Bhalla en 1991, que facilita la evaluación de la gravedad y la evolución de estos pacientes en función de los distintos hallazgos radiológicos. Presentamos diferentes ejemplos de estos criterios para la TCAR, observados al revisar los estudios de un grupo de 48 pacientes.
To monitor the course of lung damage in patients with cystic fibrosis (CF) using the different chest X-ray and high resolution computed tomography (HRCT) scoring systems that have been developed. The HRCT technique is more sensitive than chest radiography to evaluate the anatomy. However, in paediatric patients, the use of CT should be kept to a minimum, and guidelines for radiation protection and dose reduction should be applied.
One of the most used classification systems for HRCT is the one proposed by Bhalla in 1991, which helps in the assessment of the severity and course of the disease in these patients depending on the different imaging findings.
We present various examples of these criteria for HRCT, observed while reviewing a group of 48 paediatric patients.
La afectación pulmonar es la principal causa de morbimortalidad en los pacientes con fibrosis quística (FQ). La obstrucción de las vías respiratorias bajas por secreciones espesas y las subsiguientes infecciones de repetición, conlleva a un daño del parénquima pulmonar que con el tiempo es irreversible. Se hace imprescindible un diagnóstico precoz de estas alteraciones pulmonares para instaurar un tratamiento adecuado que evite la progresión de la enfermedad pulmonar.
Nuestro objetivo con este artículo es intentar facilitar el aprendizaje del sistema de clasificación de gravedad para tomografía computarizada de alta resolución (TCAR) en la FQ propuesto por «Bhalla» mediante el uso de ejemplos prácticos.
Sistemas de puntuaciónLos estudios de imagen son fundamentales en la evaluación y seguimiento de estos enfermos, de manera que en los controles anuales se recomienda realizar una radiografía de tórax para determinar el estado anatómico del parénquima pulmonar, como complemento a las pruebas funcionales o espirométricas1.
Existen distintos sistemas de puntuación de la radiografía de tórax: Chrispin y Norman, Wisconsin y Brasfield entre otros2,3, con buena relación con las pruebas funcionales y escasa variabilidad intra e interobservador4.
Existen también distintos sistemas de clasificación para TCAR con el fin de evaluar el grado de afectación pulmonar en estos pacientes, uno de los cuales es el sistema propuesto por Bhalla5, y que nosotros hemos empleado en nuestros pacientes.
Estos sistemas permiten comparar las imágenes en diferentes momentos de la enfermedad de una forma objetiva, para poder cuantificar la evolución de la afectación estructural pulmonar en un paciente, o compararla entre los pacientes sometidos a distintos tratamientos o con distinta evolución clínica.
Sistemas de valoración de la imagen radiológica y pruebas de función pulmonarDiferentes estudios basados en hallazgos obtenidos mediante lavado broncoalveolar han demostrado que la enfermedad pulmonar comienza incluso antes de la instauración de los síntomas respiratorios5,6, por lo que la relación entre la evolución de la enfermedad y el empeoramiento de las pruebas funcionales podría no ser tan exacta como cabría esperar. Este motivo justifica la presencia de las pruebas de imagen en los estudios diagnósticos y en las revisiones de estos pacientes.
La relación entre los estudios de radiología simple, las pruebas respiratorias funcionales y la afectación clínica es variable, con resultados desiguales según autores y estudios. Algunos trabajos encuentran una buena relación entre pruebas de función y estos estudios de imagen7–9, al contrario que otros investigadores2,10.
Respecto a la TCAR algunos estudios demuestran cómo los sistemas de puntuación tienen buena relación con las pruebas funcionales11–15, mientras que otros16,17 concluyen que la tomografía computarizada (TC) es más sensible y puede detectar cambios precoces y progresión de la enfermedad, por lo que podría ser la prueba de referencia para el seguimiento de estos pacientes.
Tomografía computarizada de alta resolución y radiografía simpleEn los últimos años se han publicado diferentes artículos que abogan por el uso de la TCAR en la evaluación de la FQ como técnica más sensible que la radiografía de tórax para detectar lesiones anatómicas pulmonares11,12,15.
En contra de esta afirmación, algunos estudios18 han demostrado una buena correlación entre las escalas utilizadas en la radiografía y la TC, por lo que habría que determinar la idoneidad de realizar TCAR de forma sistemática a estos pacientes jóvenes con FQ15 y considerar los efectos nocivos de las radiaciones ionizantes19,20.
La mayor capacidad de la TCAR en la valoración anatómica pulmonar hace que se pueda aceptar como un marcador más sensible y precoz de las alteraciones estructurales5,15,21. Por todo ello, algunos centros utilizan la TCAR anual o bianual como parte del estudio sistemático de estos pacientes22,23.
Tomografía computarizada de baja dosisLa mayor dosis de radiación debida a la TCAR en relación con la radiografía simple supone un aumento del riesgo para padecer enfermedades tumorales, sobre todo en determinados órganos más radiosensibles como son la mama y el tiroides19,20. Especialmente se debe tener en cuenta en pacientes pediátricos crónicos que precisarán exploraciones repetidas14. Por este motivo se recomienda emplear técnicas de reducción de dosis de radiación y utilizar sistemas de protección, con el fin de minimizar en lo posible los efectos adversos, manteniendo estudios de calidad suficiente para el diagnóstico19,20,24–26.
Siguiendo el principio ALARA25 se intenta minimizar las dosis recibidas por los pacientes. Para ello se puede limitar la intensidad a 34-50mAs24 y utilizar protectores de bismuto, que absorben parte de las radiaciones manteniendo la calidad de las imágenes27. Un reciente estudio26 analizó la reducción de dosis en TCAR en pacientes con FQ, su utilidad, algunos de los medios y parámetros de adquisición que se pueden utilizar para tal fin y la rentabilidad clínica de las imágenes obtenidas mediante estas técnicas. Este estudio concluyó que el TCAR de baja dosis es una técnica adecuada para la evaluación de bronquiectasias en pacientes pediátricos, y que aporta los datos necesarios acerca del parénquima pulmonar y las estructuras broncovasculares para la valoración de pacientes con FQ. Se puede realizar, por tanto, TC con una dosis efectiva relativamente baja disminuyendo así el riesgo de efectos radioinducidos.
La FQ progresa con la edad, por lo que los pacientes obtienen peores puntuaciones radiológicas y resultados en las pruebas funcionales con la evolución de la enfermedad. Sería interesante el desarrollo de estudios seriados que valorasen la capacidad de la TCAR para medir la evolución de estos pacientes en un período continuado de tiempo tal y como propugnan algunos autores23,28. En nuestra opinión14, una recomendación justificada sería la realización de una TCAR en el momento inicial del diagnóstico con el fin de conocer el daño anatómico exacto. Será preciso establecer la periodicidad con la que se debería repetir esta exploración valorando el riesgo-beneficio. En este mismo sentido se dirigen los más recientes estudios sobre la utilidad de la TCAR en los pacientes con FQ29,30.
Sistema de clasificación de BhallaEl sistema de Bhalla permite valorar el grado de afectación pulmonar y la evolución de los daños pulmonares provocados por la enfermedad en función de distintos hallazgos radiológicos. Los apartados que valora el sistema de Bhalla5 se resumen en la tabla 1.
Plantilla para cálculo según el sistema de puntuación de Bhalla
| Score | 0 | 1 | 2 | 3 |
| SEVERIDAD BRONQUIECTASIAS | AUSENTE | MEDIA (diámetroluz discretamente mayor que arteria adyacente) | MODERADA (luz 2-3 veces mayor que diametro arteria) | GRAVE (luz>3 que diametro arteria] |
| ENGROSAMIENTO PERIBRONQUIAL | AUSENTE | MEDIO (engrosamiento pared igual al diametro vaso adyacente] | MODERADO (engrosamiento pared 1-2 veces diametro vaso) | GRAVE (engrosamiento >2 veces el diametro vaso] |
| EXTENSIÓN BRONQUIECTASIAS (N° SEGMENTOS) | AUSENTE | 1 a 5 | 6 a 9 | >9 |
| EXTENSION TAPONES MUCOSOS (N° SEGMENTOS) | AUSENTE | 1 a 5 | 6 a 9 | >9 |
| SACULACIONESo ABSCESOS (N° SEGMENTOS) | AUSENTE | 1 a 5 | 6 a 9 | >9 |
| GENERACIONESde DIVISIONES BRONQUIALES IMPLICADAS (bronquiectasias/tapones) | AUSENTE | >4aGE | >5aGE | >6° GE |
| NÚMERO de BULLAS | AUSENTE | UNILATERAL (<4) | BILATERAL (<4) | >4 |
| ENFISEMA (N° SEGMENTOS) | AUSENTE | 1 a 5 | >5 | |
| ATELECTASIAS/ CONSOLIDACIONES | AUSENTE | SUBSEGMENTARIAS | SEGMENTARIAS/ LOBARES |
GE:generación. Modificado de Bhalla, M., Turcios, N., Aponte, V., Jenkins, M., Leitman, B. S., McCauley, D. l.,et al. Cystic fibrosis: scoring system with thin-section CT. Radiology. 1991; 179: 7S3-8.
La puntuación global se obtiene restando a una puntuación máxima de 25, que correspondería a la mejor situación radiológica posible, la suma de los puntos obtenidos en cada uno de los apartados del sistema de Bhalla (tabla 1) de modo que se obtiene una cifra neta que permite valorar la situación pulmonar de un mismo paciente a lo largo de la evolución de su enfermedad o comparar distintos pacientes entre sí en estudios epidemiológicos.
Cuando una variable es normal se le otorga una puntuación de 0. En cada uno de los apartados se puede asignar la cifra de 1, 2 o 3 puntos, de menor a mayor gravedad o extensión de la variable evaluada en dicha categoría. Existe una excepción en los dos últimos apartados, que se puntúan tan solo con 1 o 2 puntos (tabla 1). En algunos centros se añade a la puntuación obtenida las iniciales T («thickening») o P («plugs») en relación con la existencia o no de engrosamiento peribronquial o de tapones mucosos en las imágenes estudiadas. Según Bhalla5: «el engrosamiento peribronquial refleja la presencia de infección crónica y recurrente, y los tapones mucosos juegan un papel crucial en la patogénesis de la enfermedad, por lo que son datos a resaltar en el escala final».
Fiabilidad, precisión y dificultades para el radiólogo con la escala de BhallaNuestro grupo de trabajo realizó un estudio para valorar la aplicación y fiabilidad del sistema de clasificación de Bhalla en una muestra de 48 pacientes pediátricos. En este trabajo se demostraron coeficientes de correlación intraclase (CCI) de 0,89 y 0,87, intra e interobservador respectivamente (p<0,001) para dos observadores independientes14. Se respaldan así estudios previos5,13,15 con elevados grados de concordancia intra- e interobservador para dicho sistema de puntuación de la TCAR, dando así muestra de su fiabilidad y precisión.
Algunas de las alteraciones que se describen en la TCAR son sencillas de evaluar, mientras que otras de las manifestaciones pueden resultar más confusas para el radiólogo no habituado a esta afección, o a estas clasificaciones. De esta forma, al estudiar las diferentes categorías que se valoran en el sistema de Bhalla se encuentra que la mayor concordancia entre los observadores se muestra al evaluar la extensión y la gravedad de las bronquiectasias y del grosor de las paredes bronquiales. El apartado con menor grado de concordancia se da con las generaciones de divisiones bronquiales implicadas, alteraciones que creemos son más subjetivas de evaluar.
El grado de concordancia entre los lectores para la extensión de las bullas y las atelectasias aportaron datos no concluyentes debido al escaso número de pacientes con estos hallazgos en nuestra muestra, formada por pacientes pediátricos con buena situación clínica.
De acuerdo con nuestros resultados y nuestra experiencia, consideramos que los apartados más sencillos de estudiar son: la extensión y la gravedad de las bronquiectasias, el engrosamiento peribronquial y la extensión de los tapones mucosos; con una curva de aprendizaje relativamente corta. En el otro extremo, la valoración de las generaciones bronquiales implicadas sería el apartado más difícil de evaluar.
Para facilitar el aprendizaje de este sistema de puntuación mostramos diversos hallazgos observados con la TCAR en nuestros 48 pacientes con FQ.
- 1.
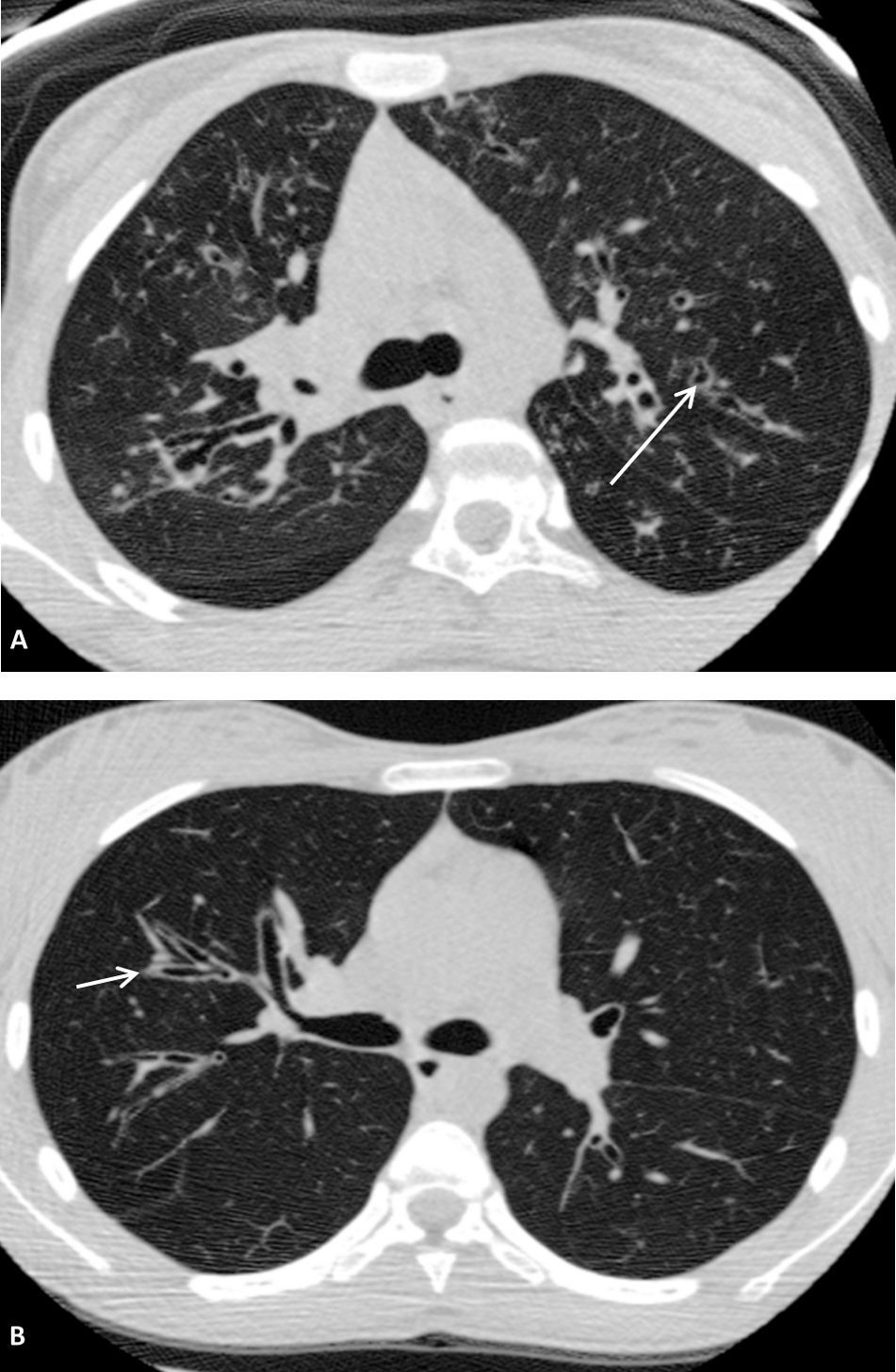
Gravedad de las bronquiectasias: (fig. 1)
Grado 1: Leve. Diámetro luminal ligeramente mayor que el de los vasos adyacentes.
Grado 2: Moderado. Luz entre 2 y 3 veces el diámetro de los vasos adyacentes.
Grado 3: Grave. Luz mayor a 3 veces el diámetro del vaso adyacente.
- 2.
Engrosamiento peribronquial: (fig. 2)
Grado 1: Medio. Grosor de la pared similar al de los vasos circundantes.
Grado 2: Moderado. Grosor de pared mayor pero menos del doble del diámetro de los vasos adyacentes.
Grado 3: Grave. Grosor mayor del doble de los vasos adyacentes.
- 3.
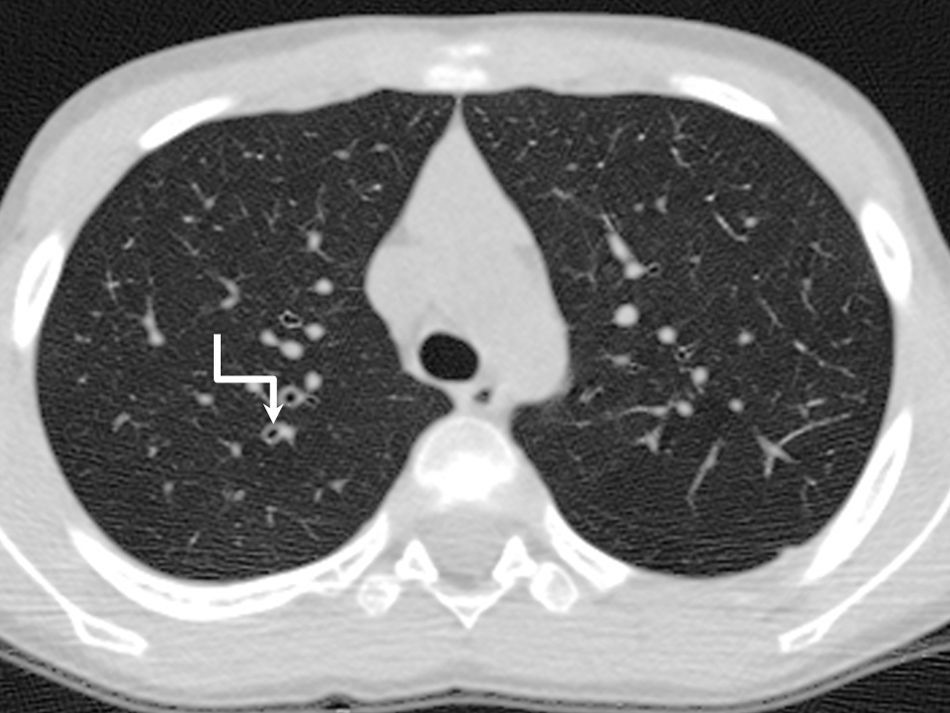
Extensión de las bronquiectasias: (figs. 3 y 4)
Grado 1: Afectación de 1 a 5 segmentos.
Grado 2: Afectación de 6 a 9 segmentos.
Grado 3: Afectación de 9 segmentos.
- 4.
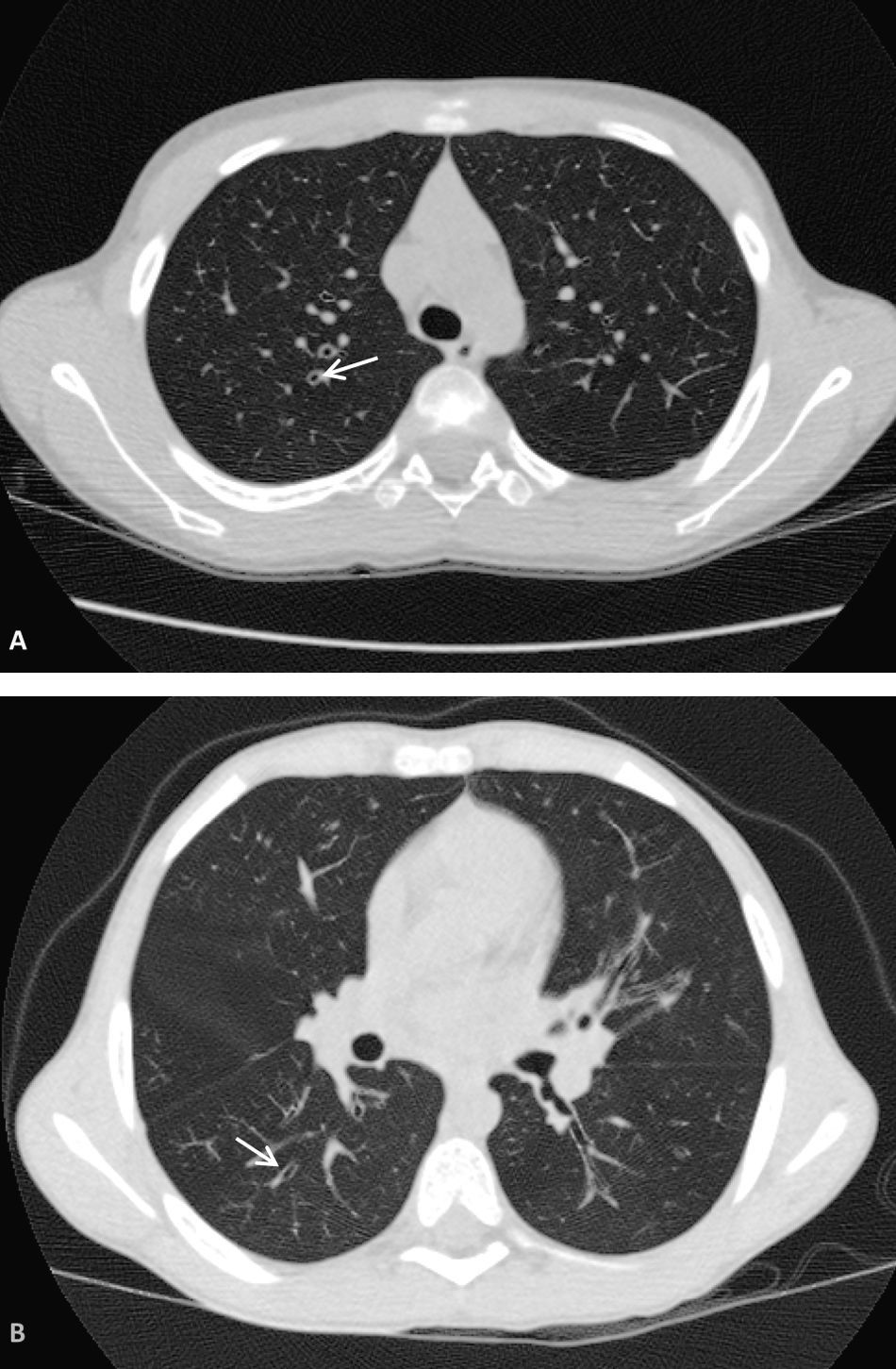
Extensión de los tapones mucosos: (figs. 5 y 6)
Grado 1: Afectación de 1 a 5 segmentos.
Grado 2: Afectación de 6 a 9 segmentos.
Grado 3: Afectación de 9 segmentos.
Figura 6.A y B) Valoración de la extensión de los tapones mucosos. Ambas imágenes pertenecen a un mismo paciente con afectación muy extensa en ambos pulmones. Se pueden observar tapones mucosos en la mayor parte de los segmentos mostrados (cabezas de flecha), totalizando un número superior a 9 (3 puntos Bhalla).
(0,22MB). - 5.
Extensión de las saculaciones o abscesos:
Grado 1: Afectación de 1 a 5 segmentos.
Grado 2: Afectación de 6 a 9 segmentos.
Grado 3: Afectación de 9 segmentos.
- 6.
Generaciones bronquiales afectas por las bronquiectasias: (figs. 7–10)
Grado 1: Afectación hasta la cuarta generación.
Grado 2: Afectación hasta la quinta generación.
Grado 3: Afectación hasta la sexta generación o más distal.
Figura 7.A y B) Valoración de las generaciones bronquiales implicadas. Pequeñas bronquiectasias que no llegan a alcanzar la quinta generación bronquial. La disposición más o menos periférica de las lesiones puede ser de ayuda para valorar la extensión cuando resulta difícil seguir todas las ramificaciones bronquiales. Se indican mediante flechas las bronquiectasias más distales. En este caso corresponden a 2 puntos Bhalla.
(0,21MB).Figura 8.A) Valoración de las generaciones bronquiales implicadas. Bronquiectasias y tapones más allá de la sexta generación bronquial (flechas). B) Comparando con la imagen previa se observa la localización de bronquiectasias y tapones mucosos (flechas) mucho más periférica indicativo de una afectación más distal del árbol bronquial. En este caso corresponden a 3 puntos Bhalla.
(0,24MB).Figura 9.Valoración de las generaciones bronquiales implicadas. Bronquiectasias más allá de la sexta generación bronquial. Obsérvense los tapones mucosos (puntas de flecha) en el segmento lateral del lóbulo medio y del segmento latero basal del lóbulo inferior izquierdo. Se indican mediante flecha las bronquiectasias más distales. Las generaciones bronquiales afectadas corresponden a 3 puntos Bhalla.
(0,14MB). - 7.
Bullas: (fig. 11)
Grado 1: Unilateral (no mayor de 4).
Grado 2: Bilateral (no mayor de 4).
Grado 3: Mayor de 4.
Figura 11.Presencia de bullas. Bulla unilateral situada en el vértice pulmonar derecho (flecha gruesa). Se aprecia la existencia de bronquiectasias (flecha fina) en el pulmón contralateral. Se trata de una única bulla unilateral, por tanto se le asignará al paciente un punto Bhalla debido a este hallazgo.
(0,1MB). - 8.
Enfisema: (fig. 12)
Grado 1: Afectación de 1 a 5 segmentos.
Grado 2: Afectación de más de 5 segmentos.
Figura 12.Extensión del enfisema. A) Áreas de enfisema que afectan a 4 segmentos pulmonares de forma bilateral (flechas rotas). B) Áreas de hipoatenuación en relación con enfisema que afectan a más de 5 segmentos en ambos pulmones. Algunos de los segmentos afectos se indican mediante flechas rotas. Los hallazgos corresponderían a 1 y 2 puntos respectivamente.
(0,17MB). - 9.
Colapso/consolidación: (fig. 13)
Grado 1: Subsegmentario.
Grado 2: Segmentario-lobar.
Figura 13.Áreas de colapso/consolidación. En la língula se detecta una consolidación triangular con pérdida de volumen (flecha rota). Se identifican también bronquiectasias (flecha fina), engrosamiento de paredes bronquiales (flecha gruesa) y áreas de atrapamiento aéreo. Dicha consolidación por ser subsegmentaria supone 1 punto en la escala Bhalla.
(0,12MB). - 10
Póngase a prueba, trate de identificar las lesiones que aparecen en la imagen (fig. 14) y su gravedad (para calcular la extensión de las lesiones imaginaremos que no aparecen en ningún área pulmonar no representada en la imagen). Trasládelo a la escala de Bhalla utilizando la Tabla 1 y compruebe su resultado en la imagen (fig. 15).
Figura 14.Póngase a prueba, trate de identificar las lesiones que aparecen en la imagen y su gravedad (para calcular la extensión de las lesiones imaginaremos que no aparecen en ningún área pulmonar no representada en la imagen). Trasládelo a la escala de Bhalla utilizando la Tabla 1 y compruebe su resultado en la siguiente imagen.
(0,14MB).Figura 15.Se identifican bronquiectasias mayores a tres veces el tamaño de los vasos adyacentes (flecha gruesa: 3puntos); engrosamiento peribronquial de diámetro similar al del vaso adyacente (flecha curva: 1 punto); extensión de las bronquiectasias a 6 segmentos (ejemplos indicados mediante flechas rotas: 2 puntos); extensión de tapones mucosos a 4 segmentos (ejemplos indicados mediante puntas de flecha: 1 punto); no se aprecia la existencia de abscesos; la afectación por bronquiectasias supera la sexta generación bronquial (flecha fina: 3 puntos); no se observan bullas; existen 4 segmentos con imágenes sugerentes de afectación enfisematosa (1 punto); no se observan áreas de atelectasia ni consolidación. Si sumamos las puntuaciones parciales obtendríamos una cifra total de 11 puntos, que, restados a la puntuación máxima (25), darían un resultado final de 14 puntos en la escala de Bhalla.
(0,15MB).
Según nuestra experiencia, el sistema de puntuación de Bhalla para la TCAR es un método que permite detectar de forma fiable las alteraciones anatómicas que se producen en el parénquima pulmonar de pacientes pediátricos con FQ.
Creemos que es una forma de evaluación del daño pulmonar que requiere un aprendizaje y entrenamiento previos, quizá mayor que el necesario para el sistema de Brasfield empleado en la radiografía simple. Debido a los avances en el diagnóstico y el tratamiento de la FQ, así como al aumento de la esperanza de vida de estos pacientes, creemos que, como radiólogos, especialistas o no en el área pediátrica, debemos conocer los sistemas de evaluación del daño pulmonar mediante técnicas de imagen, siendo el propuesto por Bhalla el más extendido para la valoración de los estudios de TCAR.
AutoríaResponsable de la integridad del estudio: GA, JCRA, PC
Concepción del estudio: GA, JCRA, PC
Diseño del estudio: GA, JCRA, PC
Obtención de los datos: GA, JCRA, PC, PR, EGE
Análisis e interpretación de los datos: GA, JCRA, PC, PR, EGE
Búsqueda bibliográfica: GA, PC, JCRA, PR
Redacción del trabajo: GA, JCRA, PC
Revisión crítica del manuscrito con aportaciones intelectualmente relevantes: GA, PC
Aprobación de la versión final: GA, JCRA, PC, PR, EGE
Los autores declaran no tener ningún conflicto de intereses.