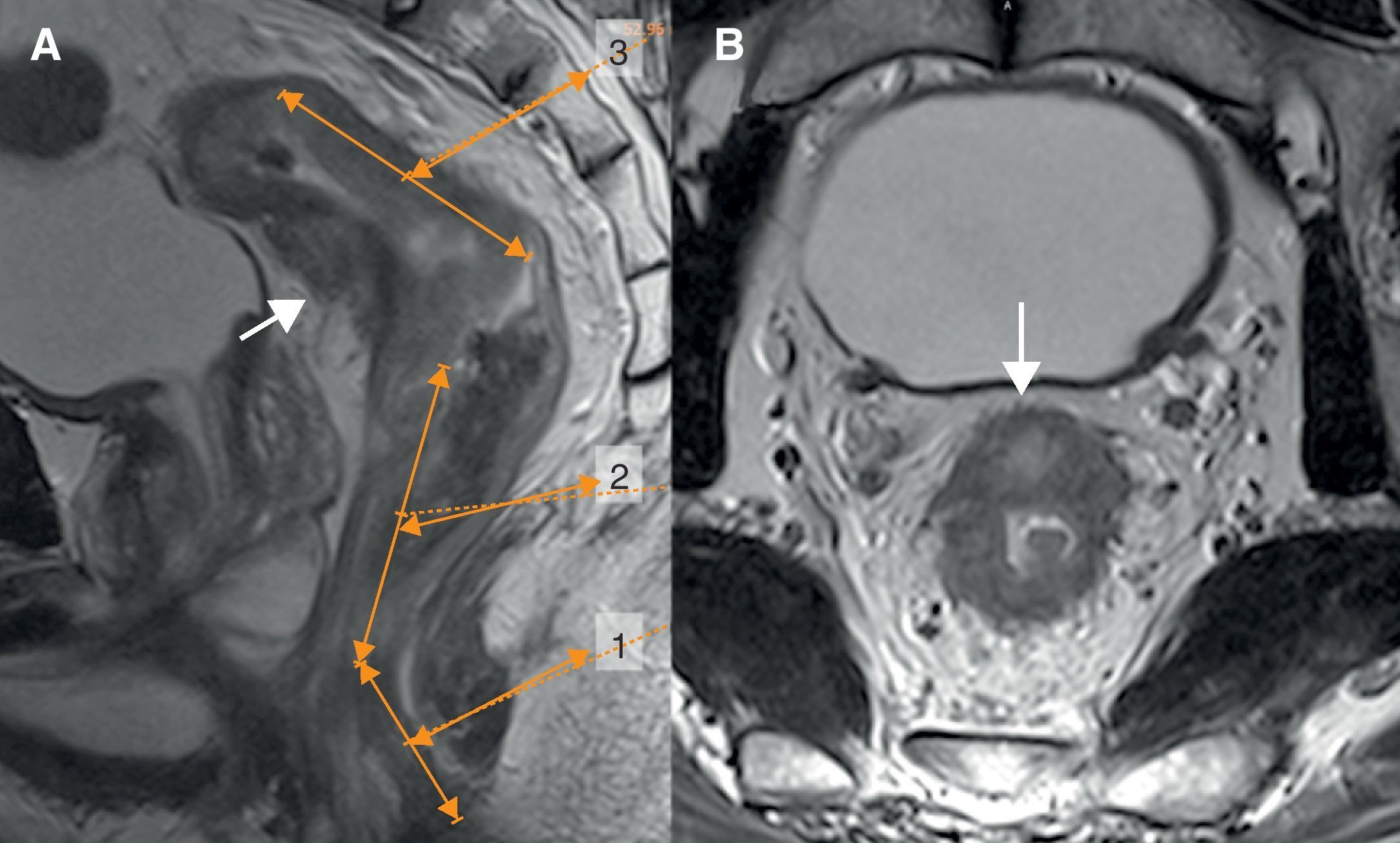
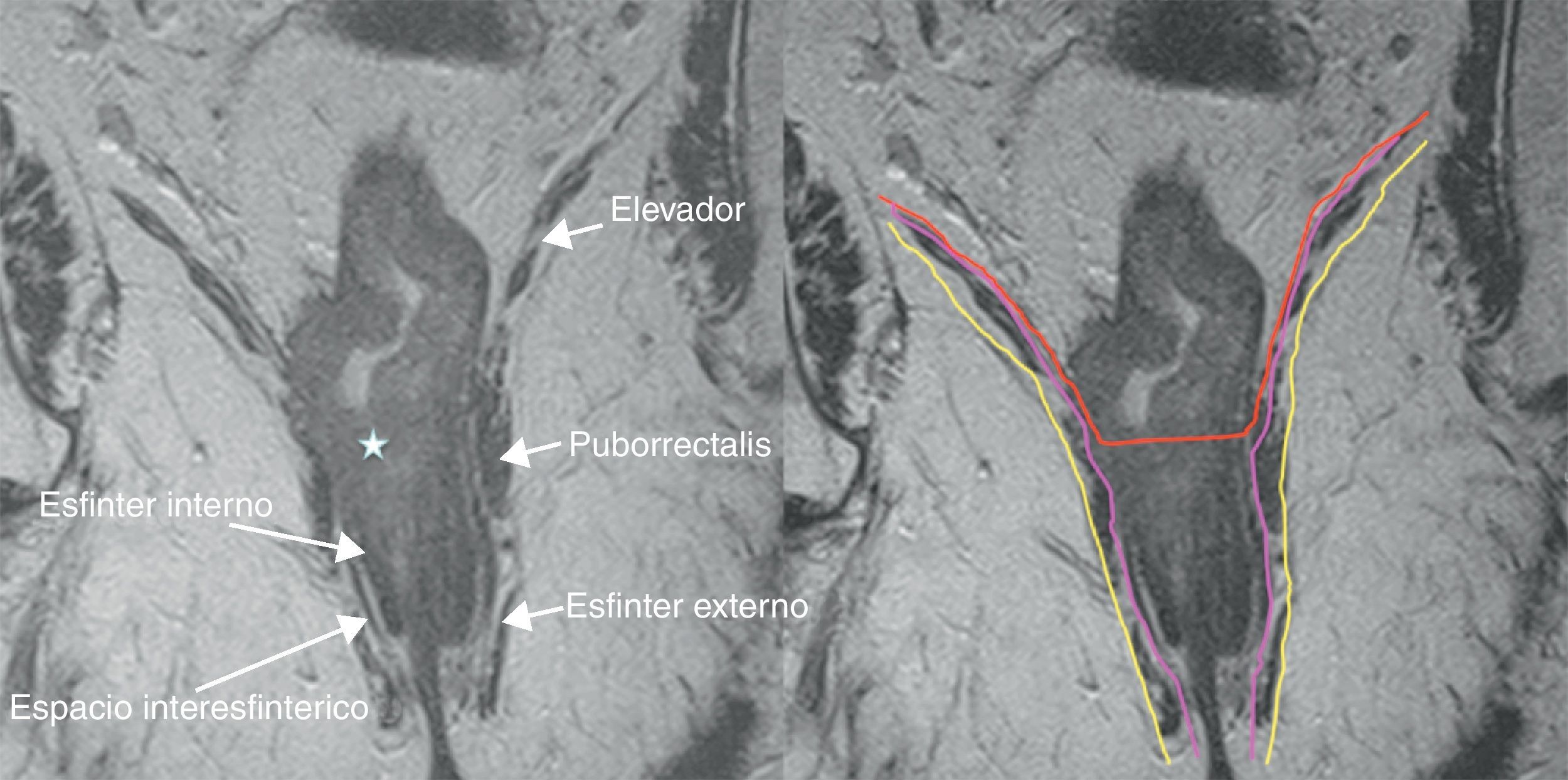
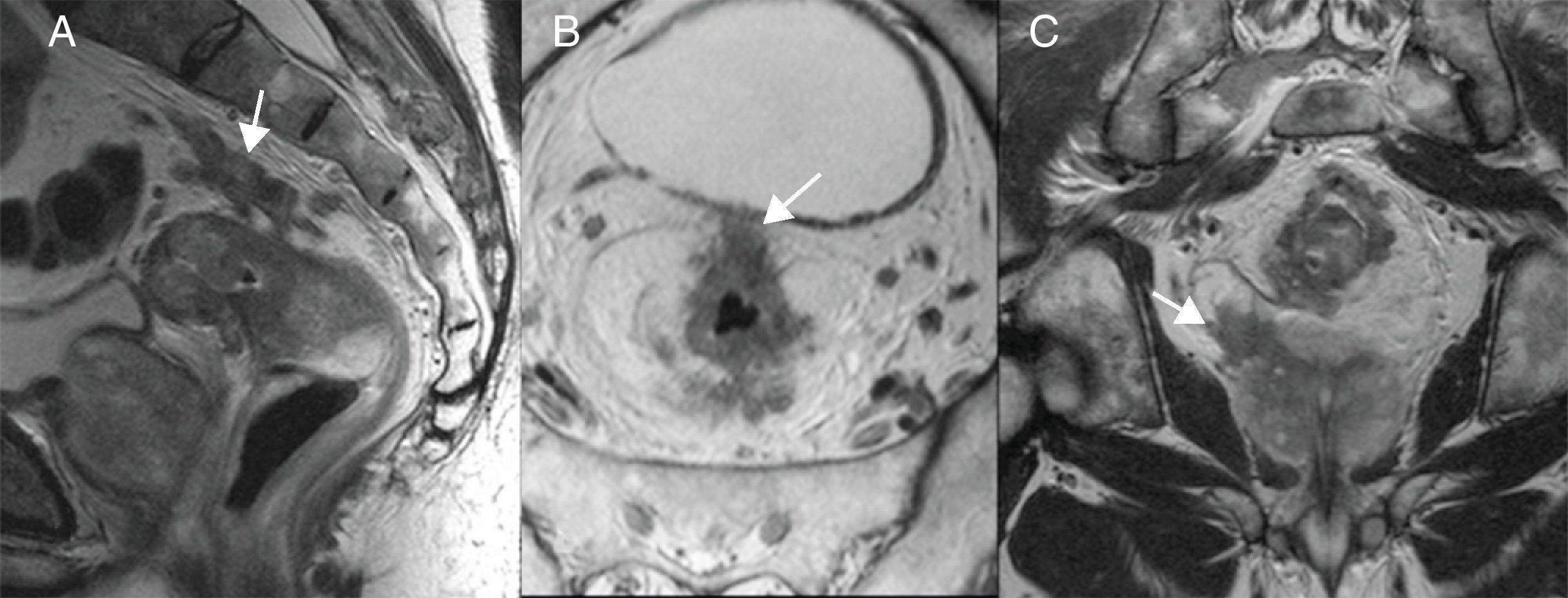
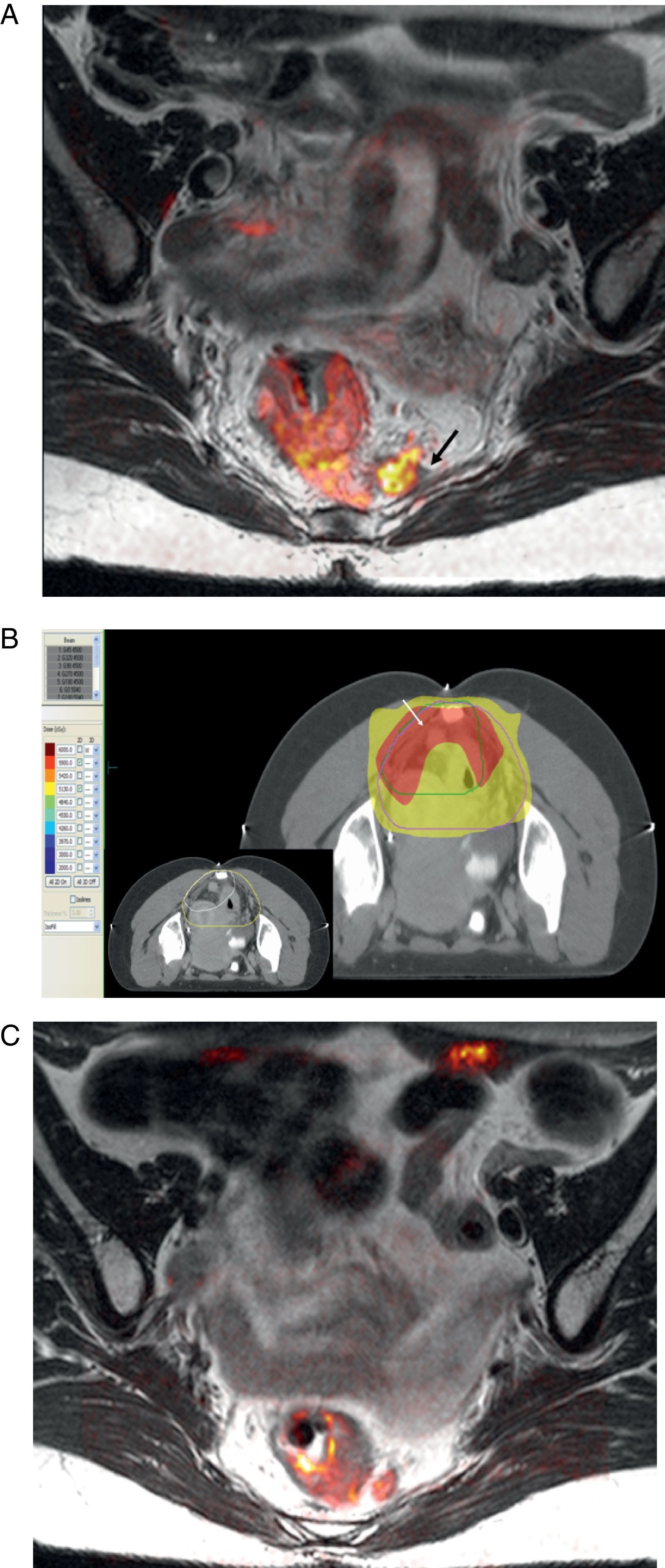
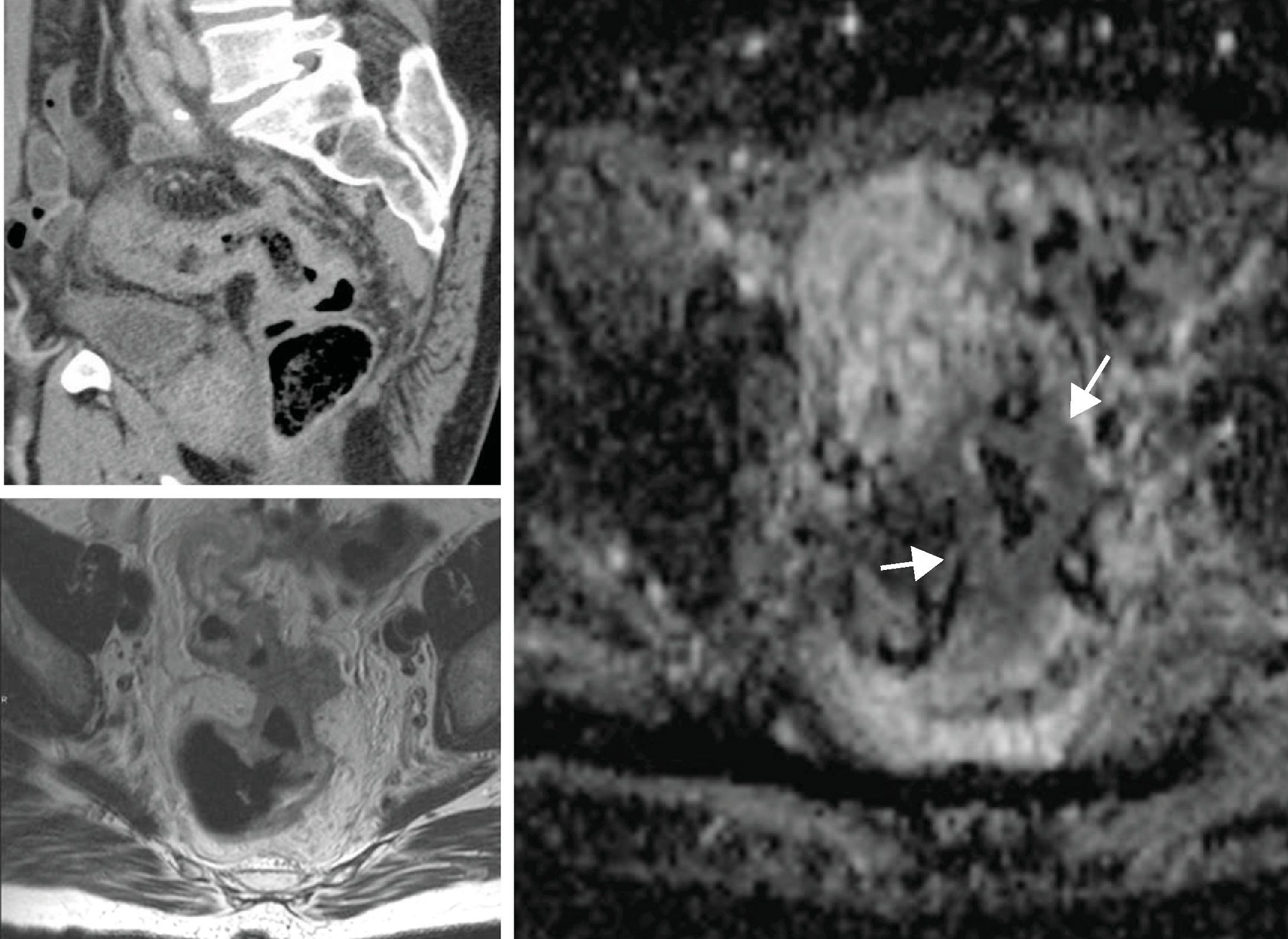
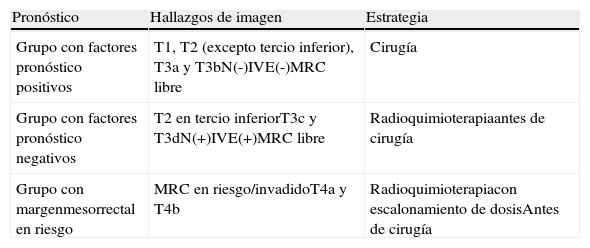
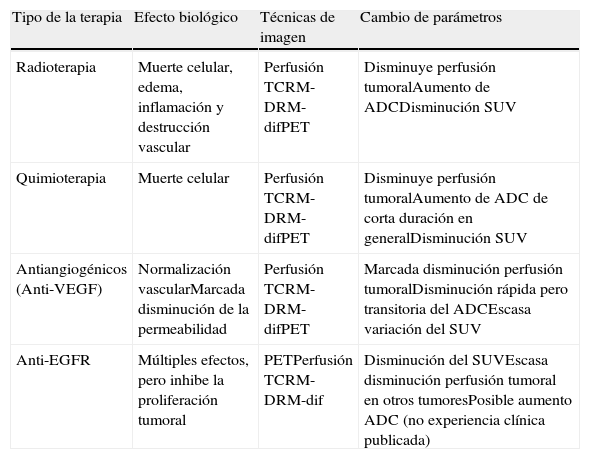
La evolución del tratamiento de cáncer de recto durante los últimos años ha estado condicionada por diversos avances en el campo de la cirugía y terapias oncológicas neoadyuvantes. La introducción por Heald en 1982 del concepto del mesorrecto como unidad anatómica (escisión mesorrectal total) y la generalización de la radioquimioterapia preoperatoria, han determinado una mejoría del pronóstico en un número significativo de pacientes. Debido a estos avances, ha surgido la necesidad de que la imagen defina una serie de factores pronósticos del tumor, tanto antes como después del tratamiento neoadyuvante, que permitan individualizar el manejo del paciente con neoplasia de recto.
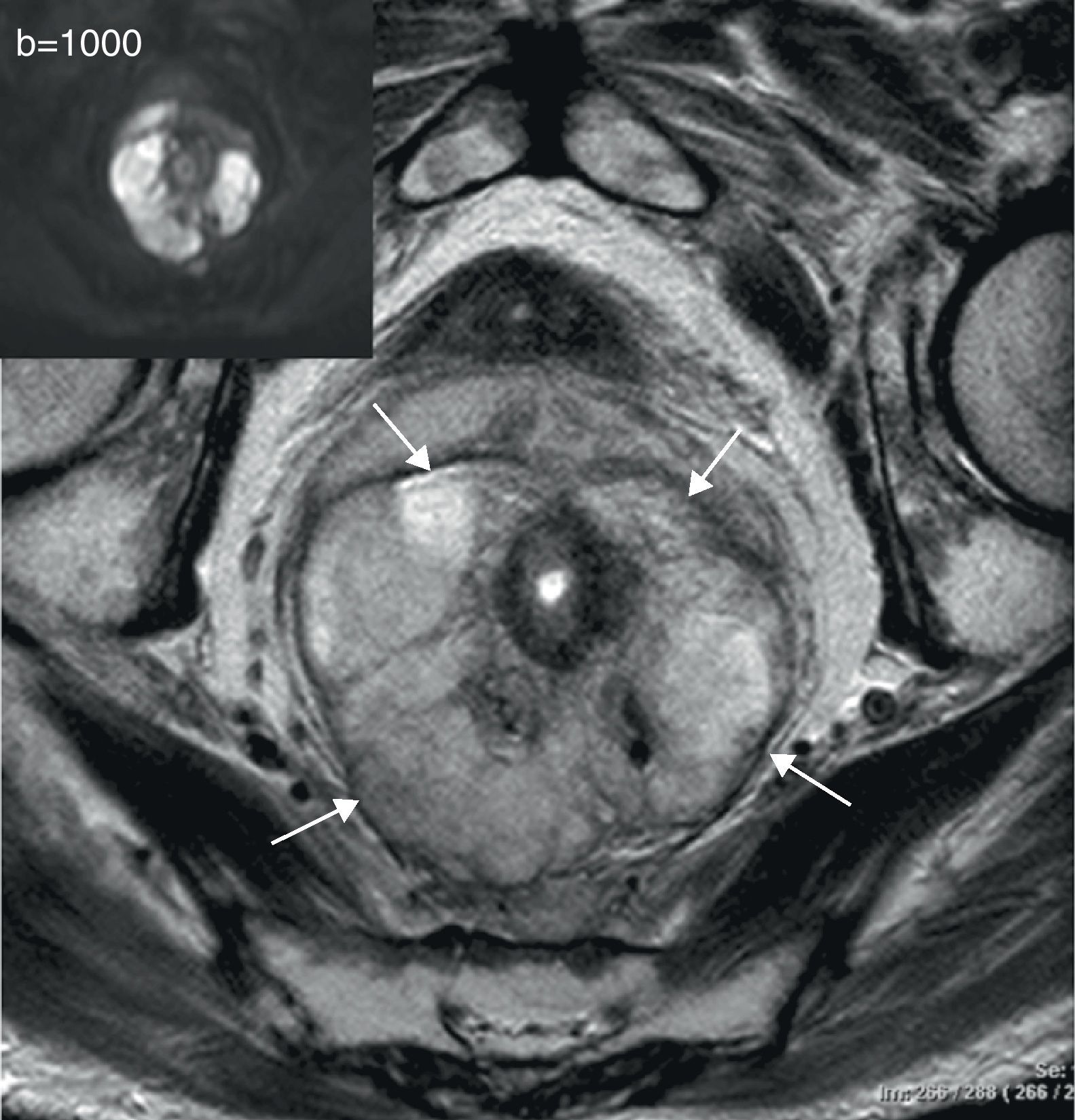
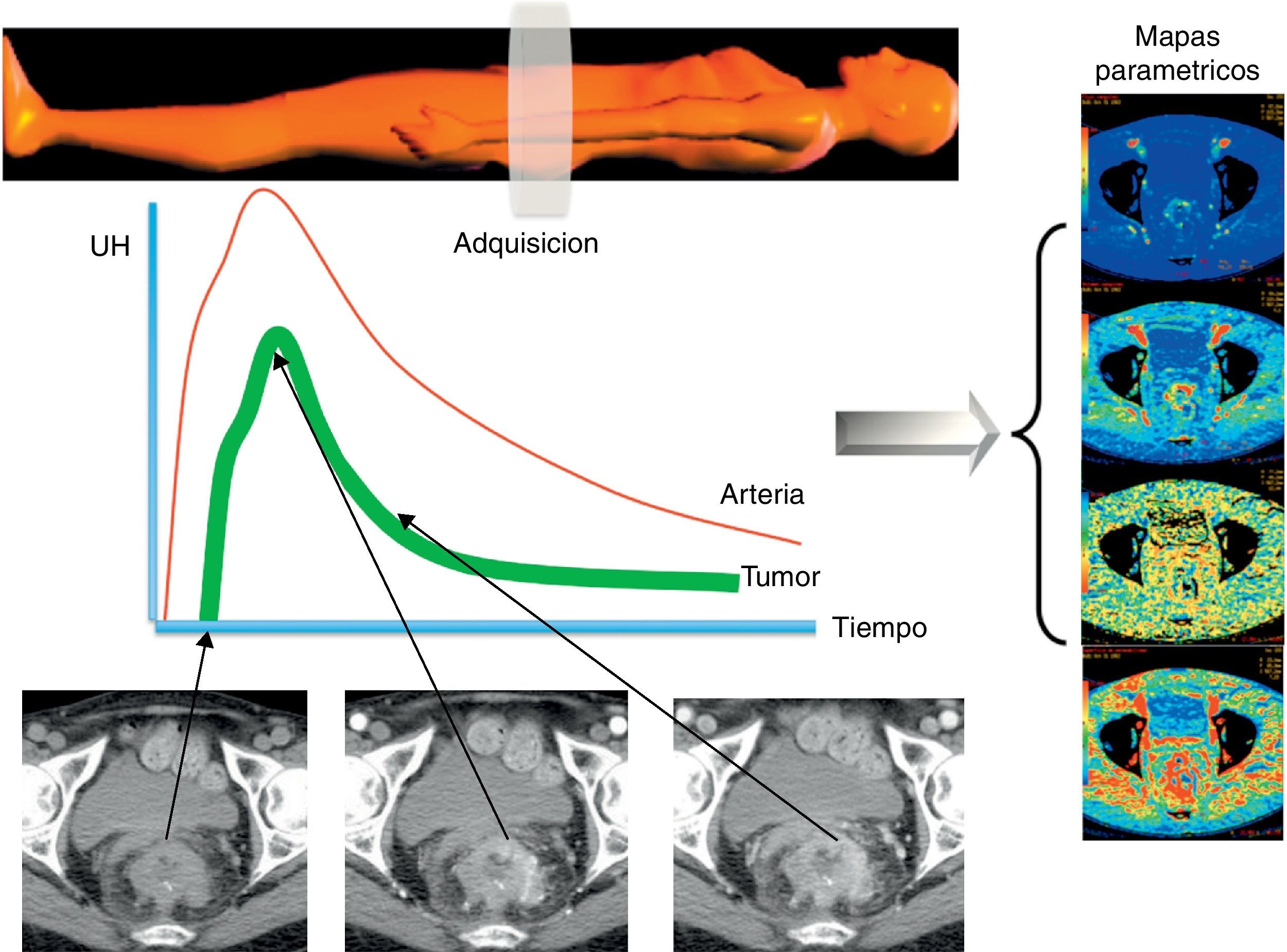
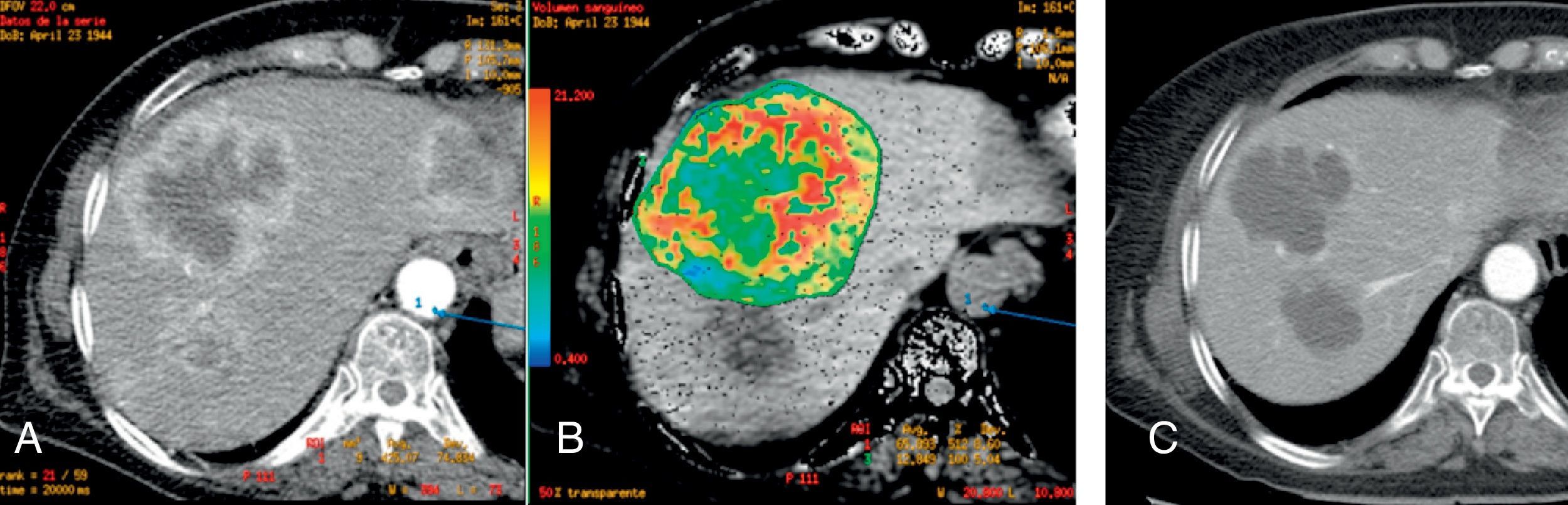
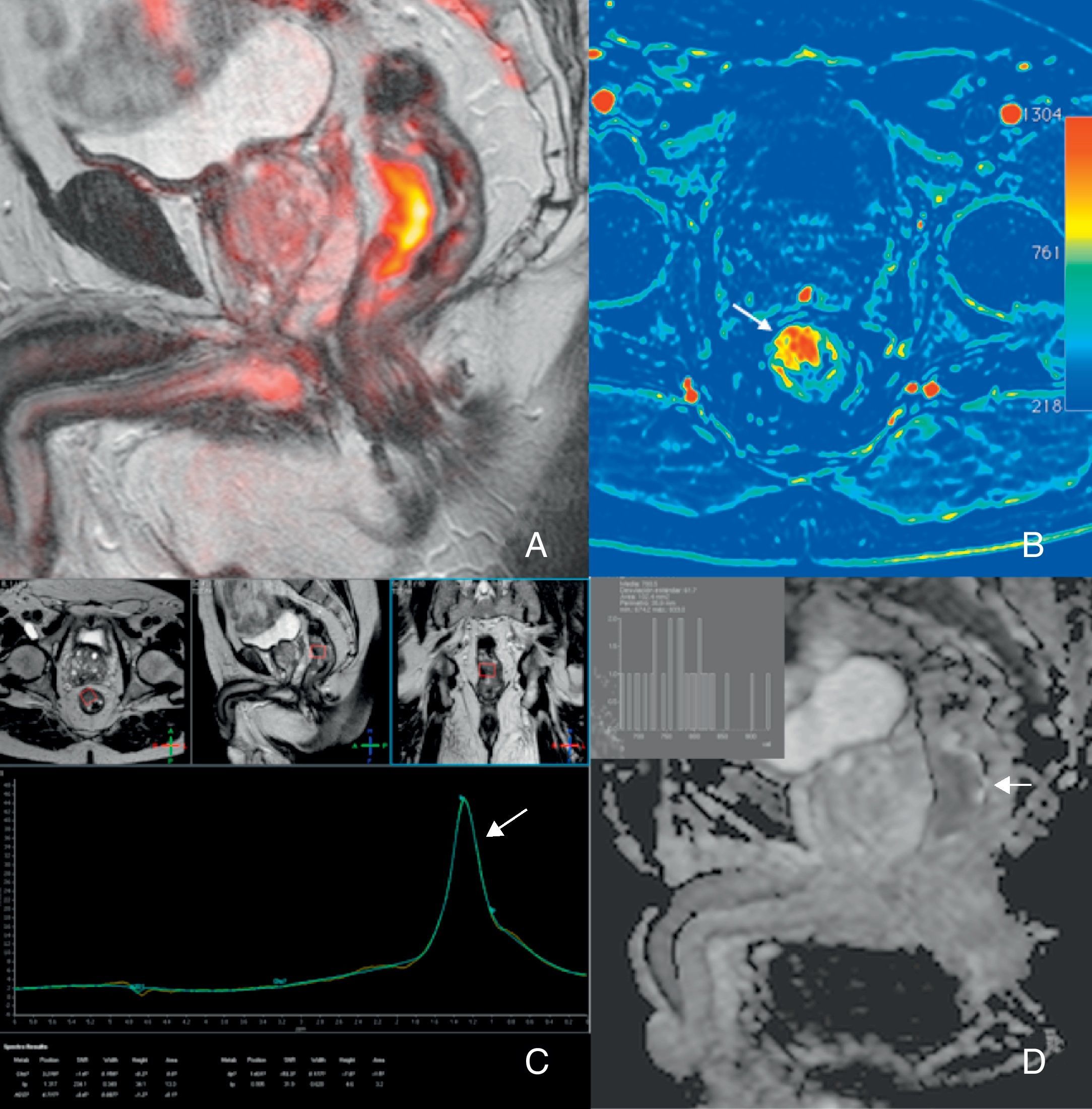
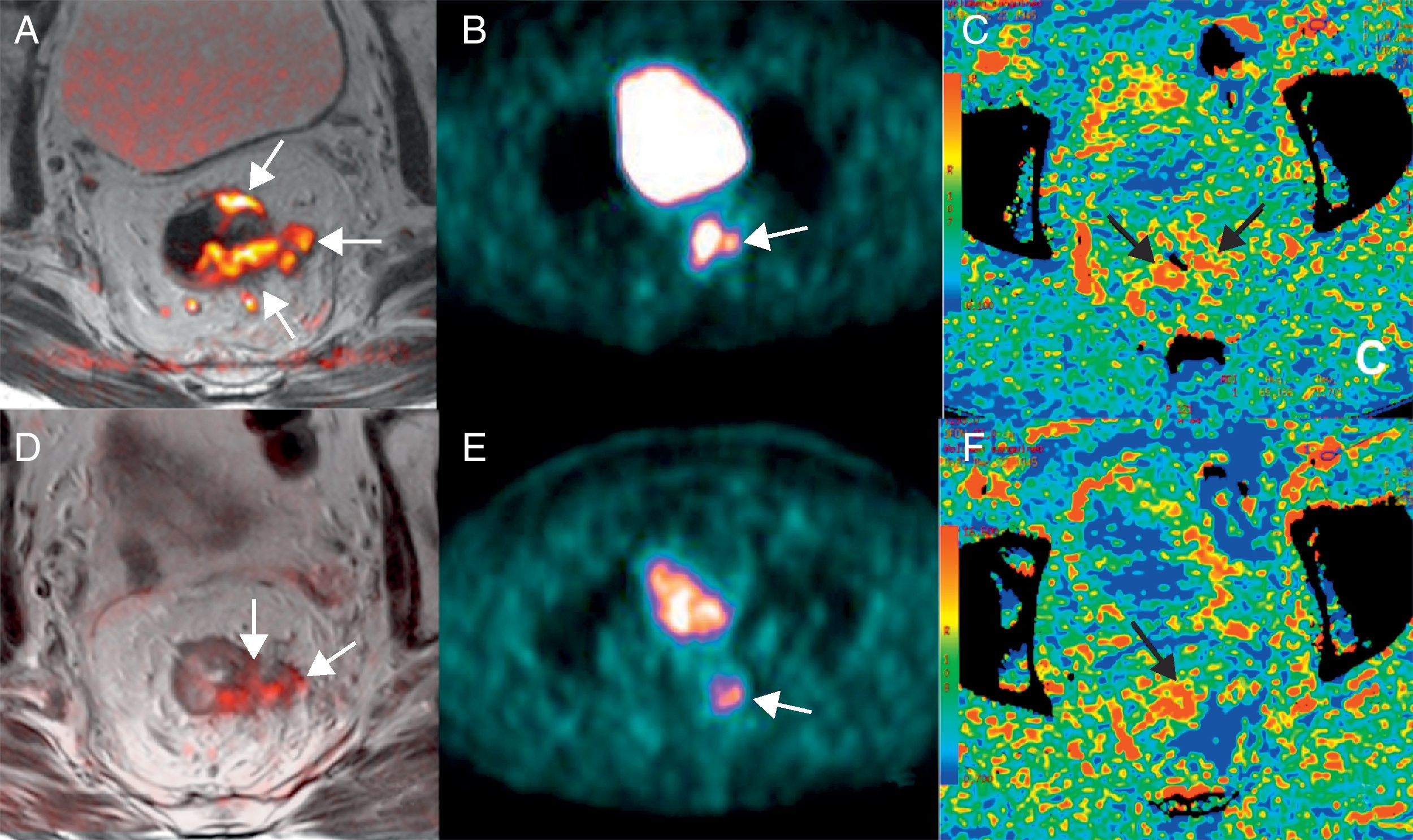
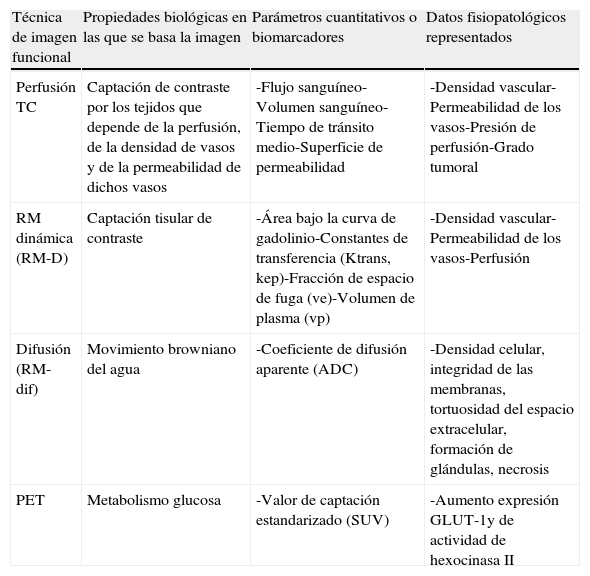
Por otra parte, la irrupción de las técnicas de imagen funcional y molecular permite abrir una vía de estudio in vivo de una serie de características tumorales distintivas como la angiogénesis, el metabolismo o la celularidad en las neoplasias de recto con una aportación creciente en la determinación del pronóstico, la estadificación, la planificación terapéutica y la evaluación de la respuesta al tratamiento en pacientes con cáncer de recto.
The outcome of treatment for rectal cancer in recent years has been improved by diverse advances in the field of surgery and in neoadjuvant oncologic therapies. Heald's introduction of the concept of the mesorectum as an anatomical unit (total mesorectal excision) in 1982 and the generalization of preoperative radiochemotherapy have improved the prognosis in a significant number of patients. Owing to these advances, it has become necessary for imaging studies to define a series of prognostic factors for tumors, both before and after neoadjuvant treatment, to make it possible to tailor treatment for individual patients with rectal tumors.
On the other hand, the advent of functional and molecular imaging techniques has provided a way to study a series of distinctive tumor characteristics in vivo, including the angiogenesis, metabolism, or cellularity of rectal tumors, and these techniques are making a growing contribution to the prognosis, staging, treatment planning, and evaluation of the response to therapy in patients with rectal cancer.
Artículo
Comprando el artículo el PDF del mismo podrá ser descargado
Precio 19,34 €
Comprar ahora