Determinar el grado de necrosis tumoral en la pieza quirúrgica de hepatocarcinomas tratados con microesferas precargadas con doxorrubicina (QETA-DEB) y su relación con factores morfológicos y biomarcadores de imagen.
Material y Métodos21 pacientes a quienes se realizó quimioembolización arterial selectiva con partículas DC-Beads (Biocompatibles, UK) fueron posteriormente trasplantados y analizados los hígados histológicamente.
ResultadosSe detectaron por diferentes técnicas de imagen 43 nódulos con un tamaño medio de 25 mm. Angiográficamente eran 25 nódulos hipervascularizados, 12 discretamente vascularizados y 6 avasculares. En la pieza se encontraron 81 HCCs con un tamaño medio de 15 mm.; dos presentaron infiltración vascular y otros dos infiltración capsular. La necrosis media conseguida tras QETA-DEB fue del 39% siendo >60% en 28 HCCs y <60% en 52. Encontramos correlación estadística entre el índice de necrosis conseguida con el tiempo que transcurre desde la última QETA-DEB hasta el trasplante (siendo significativamente menor la necrosis conforme aumenta el tiempo), con el número de nódulos encontrados en la pieza y con la infiltración capsular. Asimismo, podemos predecir que cuando por técnicas de imagen detectamos 1 ò 2 nódulos tendremos más probabilidad de conseguir de manera significativa índices de necrosis > 90%. Sin embargo, ni el tamaño de los nódulos detectados por técnicas de imagen, ni el patrón de realce post-contraste ni el número de QETA-DEBs realizadas influye significativamente en la necrosis conseguida.
ConclusiónLa necrosis producida depende del tiempo en lista de espera, del número de nódulos en la pieza y de la infiltración capsular del tumor.
To determine the degree of tumor necrosis in surgical specimens of hepatocellular carcinomas treated with microspheres preloaded with doxorubicin and to analyze the relationship between the degree of necrosis and a) morphologic factors and b) imaging biomarkers.
Material and methodsWe studied the livers of 21 patients who had undergone selective arterial chemoembolization with DC beads (Biocompatibles, UK) before receiving liver transplants.
ResultsImaging techniques detected 43 nodules (mean size, 25mm). Angiography showed 25 hypervascularized nodules, 12 slightly vascularized nodules, and 6 avascular nodules. A total of 81 hepatocellular carcinomas (mean size, 15mm) were detected in the specimens: two were capsular and two had vascular infiltration. The mean degree of necrosis after chemoembolization was 39%; necrosis was greater than 60% in 28 hepatocellular carcinomas and less than 60% in 52. The degree of necrosis correlated significantly with the time elapsed between the last chemoembolization treatment and liver transplantation (the degree of necrosis decreased as time increased), with the number of nodules in the specimen, and with capsular infiltration. When imaging techniques detected 1 or 2 nodules, there was a greater probability of achieving greater than 90% necrosis. No relation with the degree of necrosis achieved was found for the size of the nodules detected at imaging, the enhancement pattern, or the number of chemoembolization treatments.
ConclusionThe degree of necrosis achieved depends on the time spent on the waiting list, on the number of nodules in the specimen, and on whether capsular infiltration is present.
La quimiembolización transarterial (QETA) es un tratamiento paliativo para pacientes con un hepatocarcinoma (HC) asintomático, función hepática compensada y sin diseminación extrahepática ni invasión vascular (estadio intermedio –B– del Barcelona Clinic Liver Diseases –BCLC–). Las indicaciones se están ampliando a pacientes con HC en estadio precoz (Barcelona Clinic Liver Diseases -A) sin indicación quirúrgica ni de terapias ablativas locales, a pacientes en espera de trasplante hepático (THO) (con el fin de conseguir un control local mientras tanto) o para disminuir el estadio del tumor en pacientes que exceden los criterios de THO1,2.
Desde hace pocos años la QETA se viene realizando habitualmente con microesferas de hidrogel precargadas con doxorrubicina (QETA-DEB) que se toleran mejor que la QETA convencional (QETAc) con lipiodol+fármaco quimioterápico+partículas embolizantes (gelfoam o alcohol de polivinilo) porque liberan el fármaco en el torrente sanguíneo hepático más lenta y continuamente a la vez que reducen su paso a la circulación sistémica (a pesar de aumentar sus dosis)3,4. Asimismo, es más eficaz que la QETAc en pacientes con enfermedad recurrente y bilobar aunque no está demostrado que mejore la supervivencia ni disminuya la recurrencia local5,6. Sin embargo, sí que mejora la respuesta local respecto a la embolización blanda (solo con partículas embolizantes)7.
El efecto de la QETA en el HC es la necrosis, que se evalúa mediante los criterios de imagen de la European Association for the Study of the Liver8–10. Se ha observado una correlación anatomopatológica aceptable11–14 en los estudios realizados en hígados trasplantados tras QETAc15–17. Sin embargo, los estudios de correlación anatomopatológica del efecto antitumoral de la QETA-DEB18 y de los factores que lo condicionan son muy escasos.
Nuestro objetivo es valorar el grado de necrosis tumoral real producido por la QETA-DEB y los factores con los que posiblemente se correlacione, basándonos en el estudio anatomopatológico de los hígados explantados en el THO.
Material y métodosPacientesDesde 2008 hasta abril de 2012 realizamos QETA-DEB en 120 pacientes cirróticos con HC de los que 21 fueron posteriormente trasplantados y que constituyeron la muestra de este estudio retrospectivo, aprobado por el comité de ética del hospital, con la firma del consentimiento informado para el procedimiento. Como para el THO se siguieron habitualmente los criterios de Milán1, para la QETA-DEB se incluyeron: 1) tumor único ≤5cm que no pueden tratarse con terapias ablativas locales; 2) hasta tres tumores, ninguno mayor de 3cm; 3) ausencia de invasión vascular o diseminación extrahepática por métodos de imagen; 4) función hepática compensada (Child A-B); 5) estado aceptable de la coagulación (actividad protrombina>55%; plaquetas>60.000/mm3); 6) función renal adecuada (creatinina<1,5mg/dl); y 7) pacientes que, excediendo los criterios de Milán (n=6), no fueron inicialmente candidatos a THO pero se les realizó QETA-DEB que consiguió la regresión tumoral o disminuir el estadio, por lo que fueron incluidos en la lista de espera.
Los criterios de exclusión fueron: 1) trombosis portal (total o parcial); 2) flujo portal marcadamente hepatófugo en la angiografía; 3) contraindicación de la doxorrubicina; y 4) obstrucción biliar.
El diagnóstico de HC se realizó con diferentes técnicas de imagen y equipos (debido a la procedencia heterogénea de nuestros pacientes) y siguiendo las guías clínicas de la American Association for the Study of the Liver Diseases8,19 por lo que no se biopsiaron los nódulos, aunque hubo seis con comportamiento radiológico atípico que fueron considerados como HC y luego se confirmaron anatomopatológicamente.
Procedimiento angiográficoSe canalizó la arteria femoral derecha, después de anestesiar localmente la región y con el paciente sedado. (1 cc de fentanilo y 2 cc de midazolam), para colocar un introductor estándar (5F y 10cm. de longitud). Cateterizamos selectivamente el tronco celíaco y la arteria mesentérica superior con catéteres tipo cobra o multipropósito (4-5F), y tras analizar las variantes anatómicas arteriales y verificar la permeabilidad portal y su flujo preferencial hepatópeto, se cateterizaron supraselectivamente las ramas segmentarias de cada uno de los tumores con microcatéteres (Progreat. Terumo, Leuven o Rapid Transit. Cordis, Miami) para inyectar las microesferas de hidrogel (DC Bead. Biocompatibles, UK) mezcladas con contraste yodado en proporción 1:1. Estas microesferas fueron precargadas con doxorrubicina (75mg por cada vial) 12 horas antes del procedimiento en el Servicio de Farmacia.
Consideramos que la QETA-DEB fue adecuada cuando empezamos a ver fluoroscópicamente el reflujo del material de embolización (aunque no hubiésemos administrado toda la carga de partículas disponible). Por ello, siempre comenzamos el procedimiento con un vial de 300-500 mμ seguido por otro de 500-700mμ y, si la devascularización tumoral no era todavía adecuada, lo completamos con microesferas de 400-500 mμ (Embozene. Celonova Biosciences. Newman, USA).
Cuando la enfermedad era bilobar el procedimiento supraselectivo se hizo en una única sesión.
No se administraron antibióticos ni antiinflamatorios de manera profiláctica rutinaria y el síndrome postembolización (dolor abdominal, febrícula, vómitos, astenia, etc.) se trató de manera sintomática e individual.
Seguimiento clínico-radiológicoSe realizó un estricto control clínico y analítico (hemograma y test de función hepatorrenal: transaminasas, bilirrubina, fosfatasa alcalina, gamma-GT, creatinina, urea) durante la primera semana, y una primera TC hepática dinámica al mes de la QETA-DEB con una TC multidetector de 64 coronas VCT Light Speed, (GE Health Care, Milwaukee, Wi, USA). Las imágenes se interpretaron por consenso entre los radiólogos implicados en el estudio, midiendo el eje mayor de los nódulos detectados y el realce intratumoral. A los nódulos detectados en el hígado explantado y no detectados por imagen antes del THO se les consideró de «nueva aparición». Aplicando los criterios European Association for the Study of the Liver8,10 no realizamos una nueva sesión de QETA-DEB cuando la respuesta fue completa y sí cuando fue parcial. Cuando la enfermedad progresaba, el paciente salió de la lista de espera de THO y se valoró individualmente realizar nueva sesión o administrar Sorafenib.
Tras este primer control, y dado el carácter retrospectivo de nuestro estudio, el seguimiento de los pacientes en la lista de espera fue muy variable e inconstante (con diferentes técnicas de imagen y equipos, debido a la procedencia de diferentes hospitales) y en varios de ellos no disponíamos de ninguna técnica de imagen tras la TC inicial al mes de la QETA-DEB, pero no se perdió ningún paciente durante el seguimiento.
Estudio anatomopatológicoUna vez realizado el THO, el anatomopatólogo realizó cortes coronales y, posteriormente transversales del hígado explantado de 3-5mm de grosor y fijó las secciones con formaldehído al 4% (tamponado a pH 7 y estabilizado en metanol). Una hepatopatóloga con más de 20 años de experiencia seleccionó secciones de 2,2-0,3cm y los nódulos para procesarlos, incluirlos en parafina, cortar y teñir. En su informe recogió datos macroscópicos de la pieza explantada (número y tamaño de los nódulos, tipo anatomopatológico e infiltración capsular o vascular). También hizo el estudio microscópico de cada HC valorando subjetivamente el porcentaje de necrosis en cada uno. Basándose en estudios previos, se separaron tres grupos en función de este porcentaje (>90%, del 60-90% y<60%)13,16.
Análisis estadísticoPara el análisis estadístico se utilizó el programa IBM, PASW Statistics 18 (versión en español) y se realizó una descripción de variables cuantitativas y cualitativas. Comparamos las variables cuantitativas (tamaño de los nódulos pre- y pos-QETA-DEB, número de nódulos pre- y pos-QETA-DEB y tiempo transcurrido desde la última quimioembolización hasta el THO) con el test de Kruskall-Wallis y U de Mann-Whitney, y las variables cualitativas (patrón angiográfico, número de QETA-DEB e infiltración capsular/vascular de los HC) mediante la prueba Chi cuadrado. La relación entre los nódulos detectados en imagen y los encontrados en la pieza se estableció con el coeficiente de correlación de Spearman. Se consideraron valores estadísticamente significativos aquellos cuyo nivel de confianza fue superior al 95% (p<0,05).
ResultadosDe los 21 pacientes estudiados, 18 fueron varones con una mediana de edad de 56 años (41-65 años). La causa de la cirrosis fue alcohólica (38%), el virus de la hepatitis C (48%) o ambos (14%). La función hepática estaba en estadio Child A (57%) y Child B (43%). Se realizó una sesión de QETA-DEB en 16 pacientes, dos sesiones en 3 pacientes y tres sesiones en dos pacientes (media:1,3 sesiones/paciente). El tiempo medio desde la última sesión hasta el THO fue de 6 meses (0,5-10,5 meses) (tabla 1).
Características demográficas de los pacientes
| Número de pacientes | 21 |
| Edad (años) | 59 (41-65) |
| Etiología de la cirrosis | |
| Alcohol | 8 (38%) |
| VHC | 10 (48%) |
| VHC+alcohol | 3 (14%) |
| Función hepática | |
| Child A | 12 (57%) |
| Child B | 9 (43%) |
| Nódulos en imagen | 43 |
| 1-2 nódulos | 14 pacientes |
| 3-4 nódulos | 7 pacientes |
| >4 nódulos | 0 pacientes |
| Tamaño nódulos en imagen | 25mm (8-55 mm) |
| ≤20mm | 22 nódulos |
| 21-30mm | 10 nódulos |
| 31-40mm | 6 nódulos |
| >40mm | 5 nódulos |
| Patrón angiográfico nódulos | |
| Hipervasculares | 25 |
| Hipovasculares | 12 |
| Avasculares | 6 |
| t QETA-DEB → THO | 6 meses (0,5-10,5) |
| ≤3 meses | 5 pacientes |
| 4-6 meses | 5 pacientes |
| >6 meses | 11 pacientes |
t QETA-DEB →THO: tiempo (en meses) desde la última sesión de quimioembolización transarterial selectiva con microesferas de hidrogel precargadas con doxorrubicina (QETA-DEB) hasta el trasplante hepático (THO).
VHC: virus hepatitis C
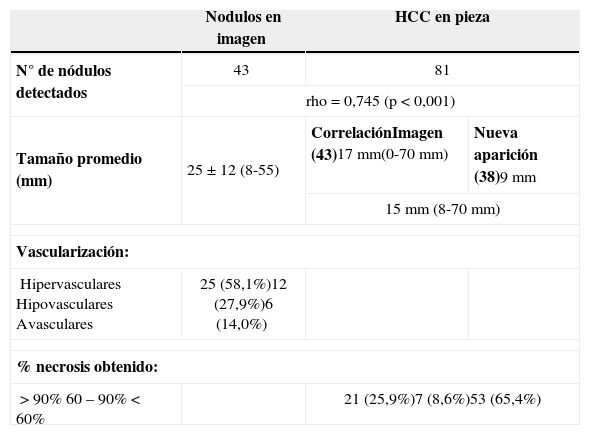
Detectamos (con un mínimo de 2 técnicas de imagen coincidentes) y tratamos 43 nódulos con un tamaño medio de 25mm (8-55mm). De ellos, 25 se clasificaron subjetivamente como hipervascularizados por técnicas de imagen, 12 eran discretamente vascularizados y 6 eran avasculares (tabla 2). En la pieza se encontraron 81 HC que disminuyeron significativamente de tamaño tras la QETA-DEB (tabla 2), con un tamaño medio global de 15mm (8-70mm) (p<0,001), 17mm para los 43 detectados por técnicas de imagen y de 9mm para los 38 HC de nueva aparición. Desaparecieron 3 de los nódulos. Dos presentaron infiltración vascular y otros dos, infiltración capsular. La necrosis media conseguida tras QETA-DEB fue del 39%,>90% en 21 HC, del 60-90% en 7 y<60% en los 53 restantes (tabla 3).
Descripción de los nódulos estudiados por imagen (n=43) y en la pieza operatoria (n=81)
| Nodulos en imagen | HCC en pieza | ||
|---|---|---|---|
| N° de nódulos detectados | 43 | 81 | |
| rho=0,745 (p<0,001) | |||
| Tamaño promedio (mm) | 25±12 (8-55) | CorrelaciónImagen (43)17 mm(0-70 mm) | Nueva aparición (38)9 mm |
| 15mm (8-70 mm) | |||
| Vascularización: | |||
| HipervascularesHipovascularesAvasculares | 25 (58,1%)12 (27,9%)6 (14,0%) | ||
| % necrosis obtenido: | |||
| >90%60–90%<60% | 21 (25,9%)7 (8,6%)53 (65,4%) | ||
Posibles factores asociados al porcentaje de necrosis obtenido en los nódulos tras QETA-DEB
| >90% (n=21) | 90–60% (n=7) | <60% (n=53) | Chi2 p | |
|---|---|---|---|---|
| Patrón angiográfico (n=43) | ||||
| Hipervascular | 11 (61%) | 6 (86%) | 8 (44%) | 0,387 |
| Avascular | 3 (17%) | 0 (0%) | 3 (17%) | |
| Infiltración capsular | 0 (0%) | 0 (0%) | 12 (100%) | 0,024 |
| Infiltración vascular | 1 (5%) | 0 (0%) | 11 (21%) | 0,112 |
| N° de QETA-DEB | ||||
| Una | 16 (76%) | 7 (100%) | 37 (70%) | |
| Dos | 4 (19%) | 0 (0%) | 5 (9%) | 0,158 |
| Tres | 1 (5%) | 0 (0%) | 11 (21%) | |
| Mediana | Mediana | Mediana | K-Wallis p | |
|---|---|---|---|---|
| Tiempo QETA-DEB a THO (meses) | 5 | 6 | 8 | <0,001 |
| N.° nódulos en imagen (n) | 2 | 3 | 3 | <0,001 |
| Tamaño pre-QETA-DEB (mm) | 28,17 | 22,71 | 22,67 | 0,285 |
| N.° nódulos en pieza (n) | 3 | 5 | 7 | <0,001 |
| Tamaño pos-QETA-DEB (mm) | 15,76 | 18,86 | 13,96 | 0,029 |
QETA-DEB: quimioembolización transarterial selectiva con microesferas de hidrogel precargadas con doxorrubicina.
En 31 HC de 7 pacientes de la pieza explantada la necrosis fue nula. Su tamaño medio era de 11mm, con una media de 5 tumores/paciente y un tiempo medio desde la última sesión hasta el THO de 7,7 meses. De los 28 HC de 16 pacientes donde la necrosis fue>60%, el tamaño medio de los tumores fue de 20,5mm con una media de 3,6 tumores/paciente y un tiempo medio desde la última sesión hasta el THO de 5,7 meses.
La correlación estadística entre el índice de necrosis y el tiempo desde la última QETA-DEB hasta el THO fue elevada (p<0,001), y se hacía significativamente menor conforme aumentaba el tiempo. Este factor estaba relacionado con el número de nódulos encontrados en la pieza, que también condicionaba la necrosis de manera que cuanto mayor era el número de tumores menor era la necrosis (p<0,001), (tabla 3). En 13 pacientes con ≤4 HC en la pieza (23 nódulos, 1,7 tumores/paciente) la necrosis media fue del 78%, mientras que en ocho con>5 HC (56 tumores, 6,6 tumores/paciente) solo fue del 20%. Cuando detectamos uno o 2 nódulos por técnicas de imagen, la probabilidad de conseguir de manera significativa índices de necrosis>90% fue mayor (tabla 3).
Ni el tamaño de los nódulos antes de la QETA-DEB (p=0,285) ni el número de procedimientos realizados (p=0,158) influyeron significativamente en la necrosis (tabla 3), (figs. 1 y 2).
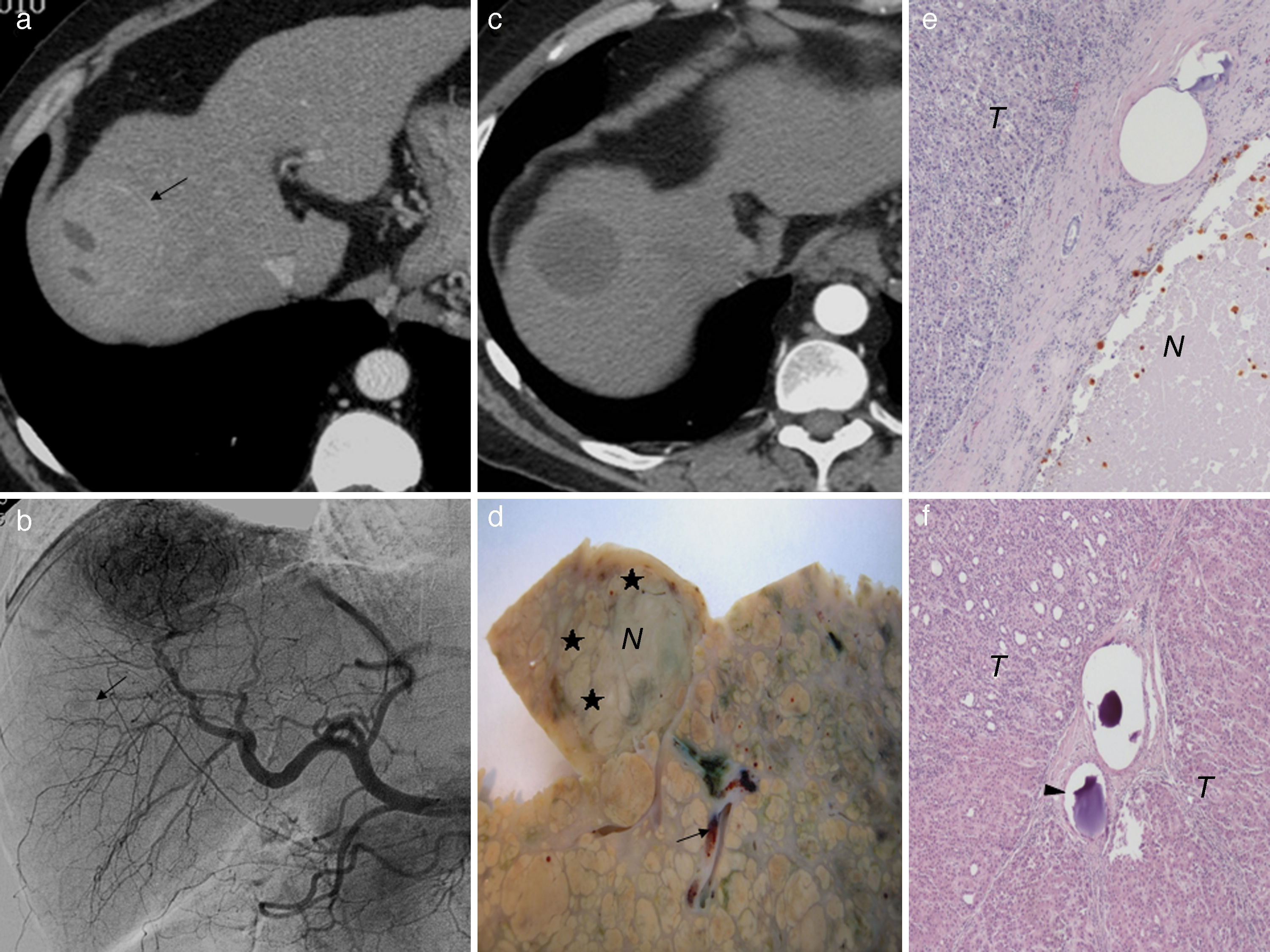
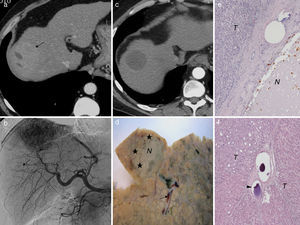
a) Imagen axial de TC hepático en fase arterial. Hepatocarcinoma en el segmento 8, de 50mm y áreas de necrosis (flecha). b) Angiografía hepática que confirma el tumor hipervascularizado y otro adyacente hipovascular de 9mm (flecha), no detectado con la TC. c) Tras dos sesiones de quimioembolización transarterial selectiva con microesferas de hidrogel precargadas con doxorrubicina (QETA-DEB) selectiva la respuesta del tumor es completa. d) Hígado explantado a los 9 meses de la última sesión de QETA-DEB. Solo se observa necrosis parcial (30%) del tumor (N) con áreas periféricas de tumor viable (★). Obsérvense las microesferas (flecha) en la proximidad del tumor. e) Imagen microscópica (H&E 10x) del tumor de mayor tamaño en la que se aprecian áreas de necrosis (N) y de viabilidad tumoral (T). f) Imagen microscópica del tumor hipovascular de menor tamaño (H&E 10x). Viabilidad tumoral completa (T) a pesar de que hay microesferas en el lecho tumoral (cabeza de flecha).
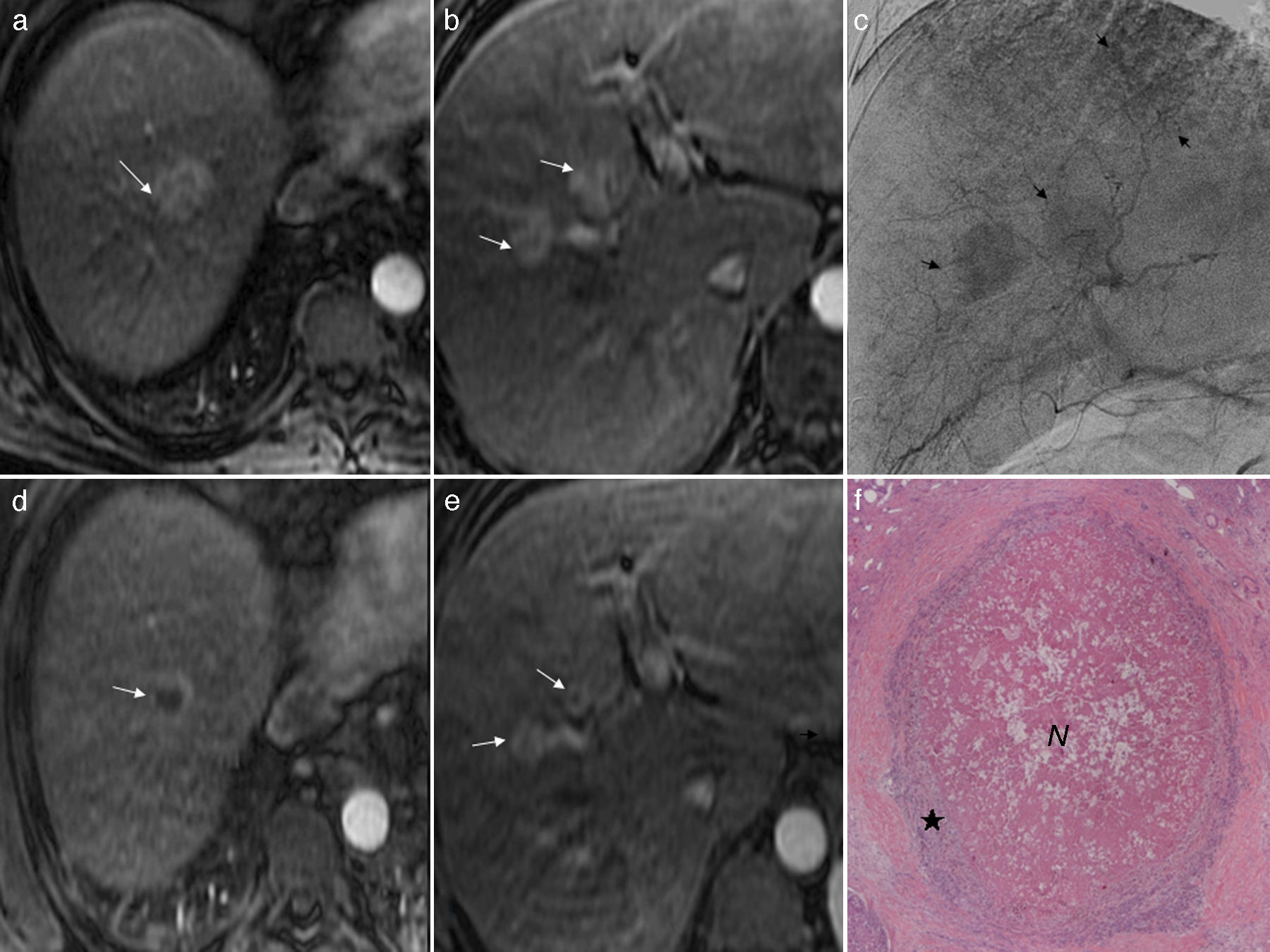
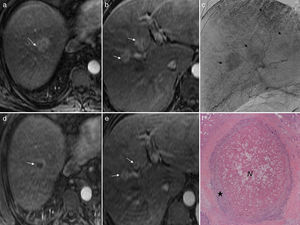
a y b) Imágenes axiales de RM potenciada en T1 tras inyectar gadolinio (fase arterial). Se observan 3 hepatocacinomas de 30, 20 y 20mm (flechas). c) Angiografía hepática (fase tardía) en la que se observan los tumores (flechas). d y e) Imágenes axiales de RM potenciada en T1 tras inyectar gadolinio (fase arterial). Respuesta parcial tras una sesión de quimioembolización transarterial selectiva con microesferas de hidrogel precargadas con doxorrubicina (QETA-DEB) en los 3 hepatocarcinomas (flechas), que han disminuido de tamaño pero realzan periféricamente. f) Imagen microscópica (H&E 10x) de uno de esos tumores, a los 10 meses de la QETA-DEB. Necrosis central (N) del 70% con un halo periférico de viabilidad tumoral (★).
En los 25 nódulos hipervascularizados (tamaño medio 25,6mm) la necrosis media fue del 70%, en los 12 tumores hipovascularizados (tamaño medio 25,9mm) del 46%, y en los 6 tumores avasculares (tamaño medio 20,3mm) del 50%, diferencias que no eran significativas (p=0,387) (tabla 3), (figs. 1 y 2).
En un paciente hubo infiltración capsular y vascular en alguno de los nódulos, en otro solo vascular y en otro solo capsular, con una media de 7,3 HC/paciente. En los dos primeros la necrosis media fue nula y en el tercero del 33%. Mientras que la infiltración vascular tumoral no influyó significativamente en la necrosis (p=0,112), la infiltración capsular sí (p=0,024), (fig. 3), si bien estos datos están sesgados por el número de HC que mostraron la infiltración.
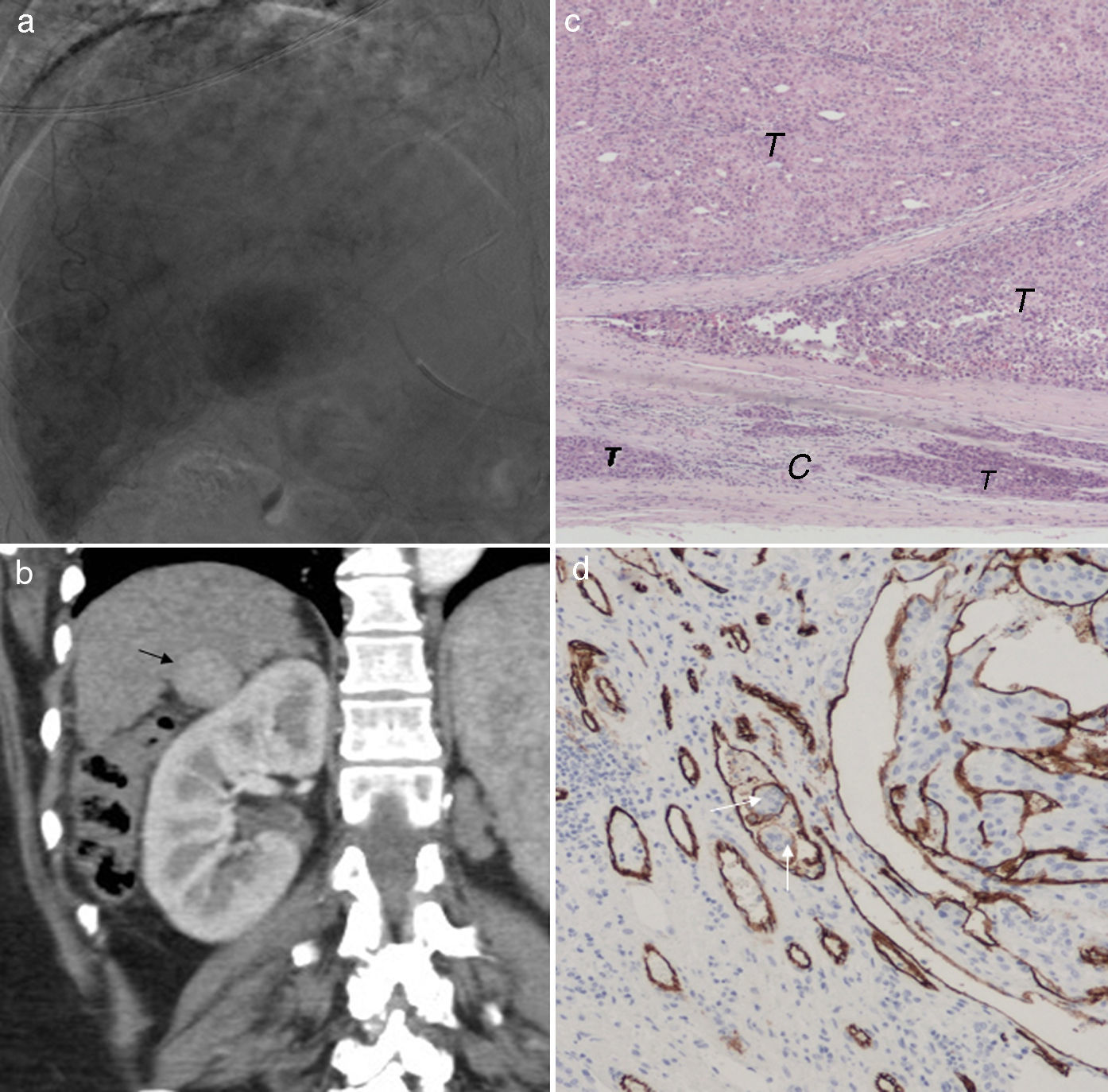
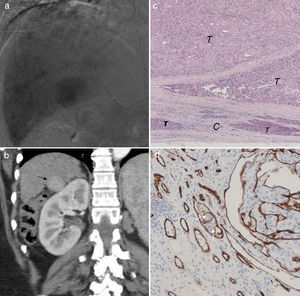
a) Angiografía hepática (fase tardía). Tumor hipervascularizado de 30mm en el segmento 6. b) Imagen coronal de TC hepático en fase arterial tras 3 sesiones de quimioembolización transarterial selectiva con microesferas de hidrogel precargadas con doxorrubicina. El efecto ha sido nulo y persiste la hipervascularización completa del tumor (flecha). c) Imagen microscópica (H&E 10x) del tumor a los 13 meses de la última sesión de quimioembolización. Viabilidad tumoral completa (T) con infiltración tumoral de la cápsula (C). d) Imagen microscópica (tinción cd 10x que tiñe específicamente de marrón la pared vascular). Células tumorales en el interior de un vaso (flechas). En este hígado apareció además otro hepatocarcinoma de 10mm.
En este estudio hemos analizado el efecto en el HC de la QETA-DEB con microesferas de hidrogel impregnadas con 75mg de doxorrubicina por vial y observamos que la necrosis depende del tiempo hasta el trasplante hepático, del número de nódulos en la pieza y de la infiltración capsular del tumor. La importancia de estos resultados radica en que solo hay un estudio similar publicado18 a pesar de que en numerosos centros la quimioembolización con partículas precargadas ha sustituido a la embolización blanda (por su mejor respuesta local) y a la quimioembolización convencional (por su mejor tolerancia y respuesta en la enfermedad avanzada)3,7.
Habitualmente la respuesta local (grado de necrosis) a la quimioembolización en pacientes con HC se analiza según criterios radiológicos (fundamentalmente de la European Association for the Study of the Liver). Con la QETAc la correlación radiopatológica de la necrosis tumoral ha sido variable, con algo más de sensibilidad de la RM que la TC11,12, pero no está muy estudiada con la QETA-DEB. En nuestro estudio no podemos correlacionar la respuesta local de esta técnica con las técnicas de imagen porque no disponemos de ellas en fechas próximas al trasplante en muchos pacientes. Sin embargo, sí podemos analizar factores que posiblemente pueden condicionar la necrosis producida por las partículas. En nuestro caso, uno de los factores que más influyeron en la necrosis fue el tiempo transcurrido desde el último tratamiento hasta el THO, que está relacionado con el tiempo en lista de espera. Cuanto mayor fue el tiempo, menor el índice de necrosis. Como se ha descrito con la QETAc, también se relacionó con la discordancia entre el número de tumores en la pieza y los que se detectaron por imagen y se trataron supraselectivamente12,15,20. Probablemente se deba a que nuestros pacientes en lista de espera para THO no se siguen protocolizadamente después de la primera TC hepática (con el fin de detectar tumores no tratados de nueva aparición), por lo que, además de un seguimiento estricto por técnicas de imagen, pensamos que se debe valorar la quimioembolización repetida protocolizada (independientemente de la respuesta por imagen) o de manera lobar (en vez de supraselectiva) con el fin de actuar sobre estos tumores de nueva aparición que alteran el efecto antitumoral deseado. Asimismo, y al igual que con la QETAc15,21, cuanto menor sea el número de nódulos detectados por técnicas de imagen, mayor será la necrosis global en la pieza.
La relación entre el grado de necrosis conseguido con la QETAc y el tamaño tumoral ha sido dispar. Para algunos autores, los HC menores de 2-3cm tienen mejores índices de respuesta completa12,22, pero otros resultados han indicado lo contrario23,24 y algunos incluso defienden el beneficio de la técnica para disminuir el estadio de tumores mayores a 5cm25. Todavía hay pocos datos con la QETA-DEB aunque los nuestros indican que el tamaño del tumor (considerado de manera aislada) influye poco en la necrosis, la cual está más condicionada por los demás factores analizados.
La hipervascularización ha sido en algunos casos un factor independiente de necrosis tumoral cuando se tratan con QETAc12,15,26, pero no en otros27. Aunque no hemos encontrado relación estadística significativa sí que hay una clara tendencia en nuestros casos.
Finalmente, la infiltración vascular y capsular del tumor se relacionan negativamente con la necrosis en HC tratados con QETAc y son factores de mal pronóstico conocidos12,15. Nuestros resultados con QETA-DEB confirman que la necrosis en los casos con infiltración capsular es poca (al estar muy relacionados con la multiplicidad tumoral) y la tendencia es similar para la infiltración vascular, que no alcanza significación estadística probablemente por los pocos tumores que la presentan.
Este estudio tiene limitaciones, fundamentalmente derivadas de su carácter retrospectivo y del escaso número de pacientes. Asimismo, el seguimiento de los pacientes por técnicas de imagen ha sido irregular e inconstante (no protocolizado) debido a la procedencia diferente y dispersa de nuestros pacientes, lo que ha impedido la correlación radiopatológica. A diferencia de otros autores28 tampoco ha sido objetivo de este trabajo analizar la supervivencia y los factores que la determinan.
En conclusión, el tiempo transcurrido desde la última sesión de QETA-DEB hasta el THO, el número y tamaño de tumores encontrados en la pieza y la infiltración capsular se relacionan con el grado de necrosis, pero ni el patrón de vascularización tumoral ni el número de sesiones de quimioembolización, ni el tamaño de los tumores antes del procedimiento influyeron significativamente. Cuando se detecten uno o dos HC por técnicas de imagen, la posibilidad de necrosarlos será mayor. Asimismo, la QETA-DEB consigue disminuir significativamente el tamaño (y el estadio) de los HC.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Autoría- 1.
Responsable de la integridad del estudio: Z LJ, CM, MJL.
- 2.
Concepción del estudio: Z LJ, E JJ, CM, MJL.
- 3.
Diseño del estudio: Z LJ, E JJ, CM, MJL,MMC.
- 4.
Obtención de los datos: ZLJ, EJJ, LS, CM, MJL.
- 5.
Análisis e interpretación de los datos: ZLJ, EJJ, LS, MT, MMC.
- 6.
Tratamiento estadístico: ZLJ, MT.
- 7.
Búsqueda bibliográfica: ZLJ, EJJ, LS, MT, CM, MJL.
- 8.
Redacción del trabajo: Z LJ, EJJ, LS, MMC.
- 9.
Revisión crítica del manuscrito con aportaciones intelectualmente relevantes: Z LJ, EJJ, LS, MT, CM, MJL, MMC.
- 10.
Aprobación de la versión final: ZLJ, EJJ, LS, MT, CM, MJL, MMC.
Los autores declaran no tener ningún conflicto de intereses.