Conocer las enfermedades de las trompas de Falopio es esencial para valorar la pelvis ginecológica. Las alteraciones primarias y secundarias de las trompas, cursen o no con alteraciones ováricas asociadas, son muy variadas. Pese a que la ecografía, por su gran sensibilidad y disponibilidad, es la técnica inicial para estudiar las alteraciones anexiales, la RM es muy útil en el diagnóstico de las enfermedades tubáricas porque su elevada resolución tisular y el detalle anatómico que proporciona le confieren una mayor especificidad. Los hallazgos morfológicos y las características del contenido tubárico con la RM posibilitan un diagnóstico más preciso o limitan el diagnóstico diferencial y permiten orientar el tratamiento más adecuado en cada caso.
Knowledge about fallopian tube disease is essential in the assessment of the pelvis in female patients. Primary and secondary changes in the tubes vary widely, regardless of whether associated changes in the ovaries are present. Ultrasonography is the initial technique in the study of adnexal disease because it is very sensitive and widely available; however, MRI is also very useful in this context because its high tissue resolution and anatomic detail make it more specific. The morphologic findings and the characteristics of the contents of the tubes on MRI enable a more accurate diagnosis or limit the differential diagnosis, helping to ensure that the most appropriate treatment is provided in each case.
Existen muchas alteraciones de las trompas de Falopio, agudas y crónicas, primarias y secundarias, cuyo conocimiento resulta esencial para valorar la pelvis ginecológica. La ecografía es la la técnica de elección inicial para abordar el estudio de las enfermedades ginecológicas1, aunque en muchas ocasiones la tomografía computarizada (TC) puede ser la primera prueba realizada por su gran disponibilidad, por haberse realizado por una sospecha clínica inicial no ginecológica o bien en un contexto clínico urgente1. Sin embargo, la especificidad de estas 2 modalidades diagnósticas es baja. En el caso de las alteraciones tubáricas complejas con una presentación clínica atípica, o cuando se asocia una alteración ovárica formando una masa anexial compleja, la resonancia magnética (RM) es la técnica indicada por su mayor sensibilidad y especificidad1–5.
La RM permite caracterizar mejor las alteraciones anexiales porque, en muchos casos, distingue la afección tubárica simple (en la que solo participan las trompas) de la compleja (si coexiste afectación de otros órganos, normalmente el ovario). Asimismo, caracteriza mejor que la ecografía y la TC el contenido tubárico gracias a su intensidad de señal en las distintas secuencias3. Además de conseguir diagnósticos más precisos, lo hace en estadios más tempranos que la ecografía, lo que evita la demora del seguimiento ecográfico3. En definitiva, en muchos casos el diagnóstico con la RM permitirá instaurar tratamientos conservadores en caso de enfermedad benigna, o más agresivos cuando se sospeche de enfermedad neoplásica3.
En este trabajo describimos tanto la sistemática de estudio como los hallazgos en RM de la afección de las trompas que permiten limitar el diagnóstico diferencial y en muchas ocasiones, hacer un diagnóstico certero.
Anatomía de las trompas de FalopioLas trompas de Falopio derivan del extremo craneal de los conductos paramesonéfricos o de Müller5. Se incluyen en las 2 hojas del margen superior del ligamento ancho y se extienden lateralmente desde el margen súpero-lateral del útero hasta el ovario ispilateral5. Cada trompa se ancla en su cara inferior mediante una doble hoja de peritoneo llamada mesosálpinx y se abre a la cavidad peritoneal6.
Durante el periodo fértil de la vida, la trompa normal mide aproximadamente unos 10cm de largo y de 1 a 4mm de ancho1,7. Tiene 4 segmentos anatómicos, que de medial a lateral se conocen como «segmento intersticial o intramural», que se continúa con la cavidad endometrial y queda incluido en el miometrio; «istmo», es el segmento más estrecho, de unos 2-3cm de longitud; «segmento ampular», es mayor y más ancho y supone más de la mitad de la longitud de la trompa; e «infundíbulo». Las fimbrias son un conjunto de proyecciones digitiformes del infundíbulo que quedan suspendidas sobre el ovario, se abren a la cavidad peritoneal y capturan el óvulo1,5,7,8.
La pared de las trompas se compone de capas mucosa, muscular y serosa externa. Es compleja, con pliegues orientados longitudinalmente y pliegues mucosos, llamados plicas, ambos en número y tamaño creciente desde el extremo medial al lateral7,8. En la porción intramural existen unos 5 o 6 pliegues; en el istmo, aumentan a 12, se hacen más altos y ocupan prácticamente toda la luz; y en el segmento ampular e infundibular son más frondosos y tienen ramas secundarias y terciarias8. La superficie mucosa contiene células ciliadas que permiten el desplazamiento del óvulo8. El aporte vascular procede de las arterias uterina y ovárica5. Las trompas sanas no suelen ser visibles en la RM salvo cuando están rodeadas de líquido libre1,7,8. En estos casos aparecen como estructuras tubulares yuxtauterinas finas, que se extienden anterior o posteriormente1,8.
Resonancia magnética de la pelvis femeninaPara estudiar la pelvis femenina mediante RM se le pide a la paciente que guarde unas 6h de ayuno. Se coloca en decúbito supino en sentido pies-cabeza, y habitualmente se administra un espasmolítico por vía subcutánea para reducir los artefactos provocados por los movimientos peristálticos intestinales7. El protocolo estándar para estudiar la pelvis femenina es también aplicable para las trompas y se usan antenas de superficie multifase7. En nuestro centro, el protocolo incluye secuencias basales de alta resolución potenciadas en T2-TSE en los 3 planos, y secuencias potenciadas en T1-TSE en el plano axial sin y con saturación de la grasa. Estas secuencias permiten identificar alteraciones en la pelvis y ver la relación que guardan las trompas con los órganos y estructuras adyacentes. También facilitan una primera clasificación de las lesiones en sólidas, quísticas, con contenido graso, hemorrágico, proteico, mucoso o fibroso5.
En el caso de que los hallazgos morfológicos no sean concluyentes, y se sospeche enfermedad tumoral maligna o infecciosa, se administra gadolinio intravenoso5,7. Para la valoración de las secuencias con contraste es muy útil obtener imágenes de sustracción de la secuencia con y sin contraste para resaltar pequeños focos de captación, sobre todo cuando este foco ya sea hiperintenso sin contraste.
Se ha estudiado la posibilidad de utilizar la RM para estudiar la permeabilidad tubárica mediante inyección intracavitaria de gadolinio y con técnicas 3D, para sustituir a la histerosalpingografía convencional (HSG)9.
Hallazgos generales en las enfermedades tubáricasLa mayor parte de enfermedades que afectan a las trompas pueden ser bilaterales, por lo tanto, siempre se debe descartar la afectación contralateral1.
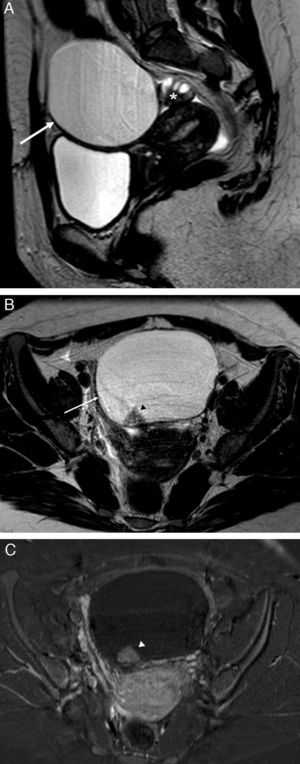
Una forma común de presentación de la trompa anormal es la dilatación8, que ocurre cuando su extremo distal se ocluye, normalmente al nivel de las fimbrias, y secundariamente se rellena de líquido. El tipo de líquido dependerá de la causa de la oclusión8. La trompa dilatada se muestra como una estructura tubular, separada del ovario ipsilateral, con forma de «C» o «S» y con septos incompletos. Estos septos corresponden a los pliegues mucosos de la pared tubárica parcialmente borrados por la distensión (fig. 1)5,7,8,10,11. Por el contrario, los septos visibles en las neoplasias quísticas ováricas son completos y cruzan toda la lesión3,8. Los septos incompletos son un signo muy específico de que la estructura tubular corresponde a la trompa dilatada3,5,8. Suelen ser septos finos con una señal baja en las imágenes de RM potenciadas en T28,12. Si los pliegues están muy borrados o fibrosados, pueden aparecer unos nódulos murales bien definidos e hipointensos en T2, que no realzan con contraste5. En ocasiones, si existe gran distensión tubárica, los septos pueden borrarse completamente8, lo que dificulta la diferenciación de la trompa con masas quísticas ováricas u otras estructuras, como uréteres dilatados o asas intestinales, se hace difícil. En esos casos se debe reconocer la trompa por su forma tubular y su localización entre útero y ovarios, además de identificar a los ovarios como órganos separados y sin alteraciones1,4,8.
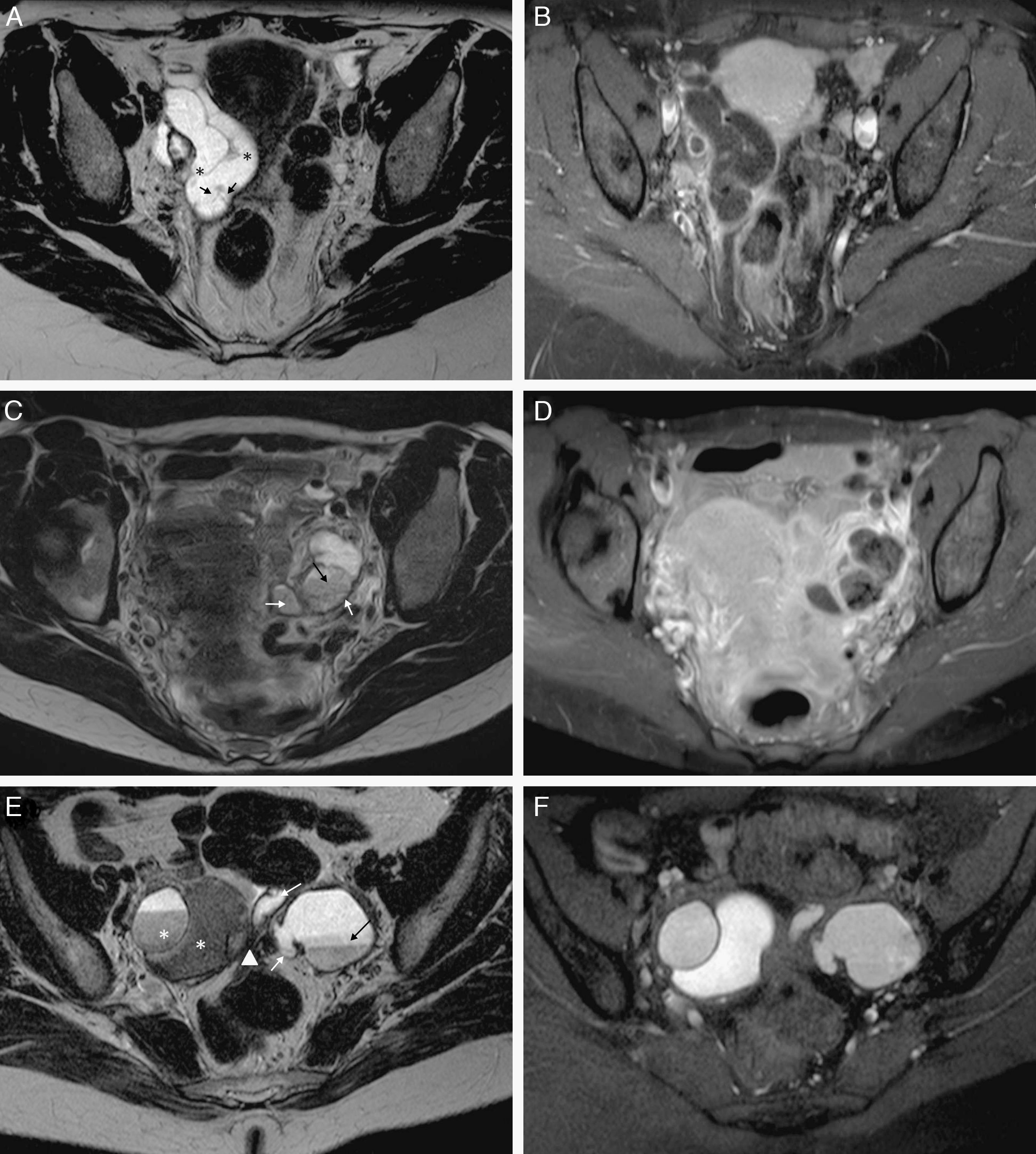
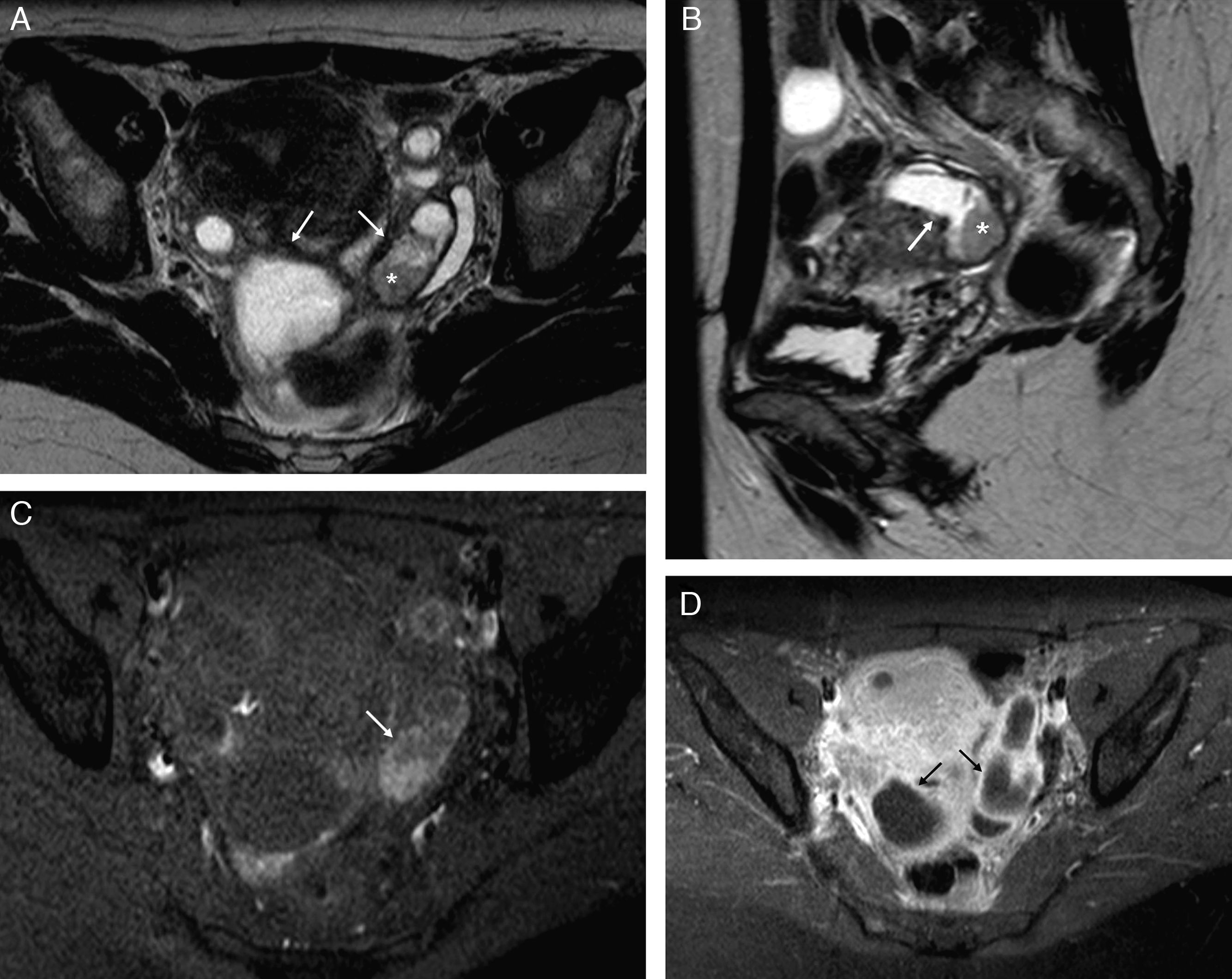
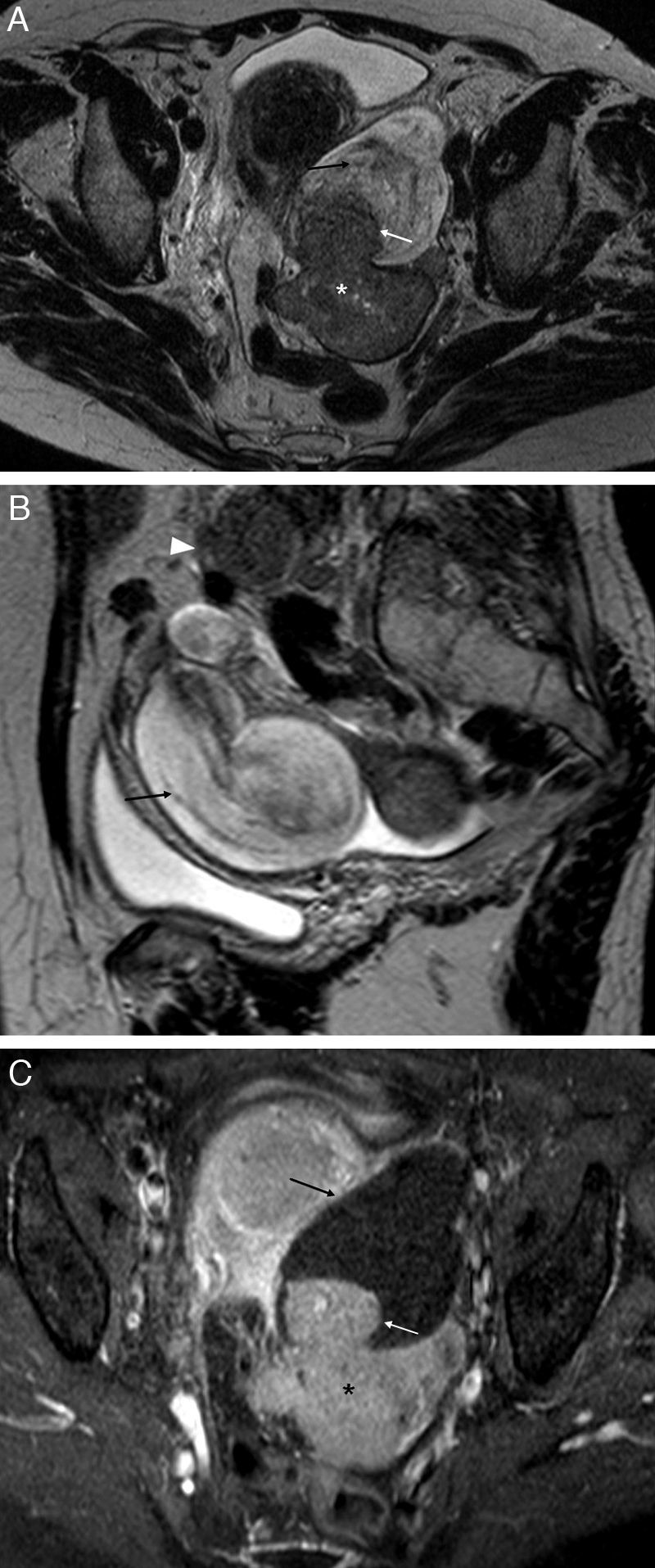
Obstrucción y dilatación tubárica. Hidrosálpinx: A) T2 TSE axial. Trompa derecha dilatada con contenido líquido hiperintenso, de señal agua. Contiene septos incompletos hipointensos (flechas) y áreas de estrechamiento focal –signo de la cintura– (*); B) T1 TSE axial con saturación grasa (SG) y contraste iv. Contenido líquido muy hipointenso, con paredes finas con captación leve y regular. Piosálpinx: C) T2 TSE axial. Trompa izquierda dilatada con contenido líquido heterogéneo con niveles líquido-detritos (flecha negra) y paredes engrosadas. Obsérvese la presencia de sinequias intraluminares (flechas blancas); D) T1 TSE axial SG y contraste iv, que muestra contenido hipointenso con señal mayor que el agua y paredes difusamente engrosadas e hipercaptantes. Hematosálpinx en endometriosis, y E) T2 TSE axial. Trompa izquierda dilatada con forma de S (flechas blancas) con niveles líquido-líquido, hiper e hipointenso, con caída de señal en capas (flecha negra). Endometriomas derechos (*) e implante endometriósico pélvico profundo (cabeza de flecha); F) T1 TSE SG axial sin contraste iv. El contenido de la trompa izquierda es hiperintenso de forma homogénea, aunque con señal menor que el agua.
La dilatación tubárica puede ser irregular, con estrechamientos focales y luz tortuosa, dando lugar al signo del «pico», al formarse un ángulo agudo en el contorno externo de la trompa al replegarse sobre sí misma. El signo de la «cintura» se produce al formarse una indentación diametral, que estrecha focalmente la luz (fig. 1)3,5,11,13.
Las sinequias se identifican como líneas finas endoluminales, hipointensas en todas las secuencias, que no se realzan con contraste y que son secundarias a procesos inflamatorios5.
Una de las primeras consideraciones que tener en cuenta es la valoración de las posibles anomalías congénitas o las malformaciones. La agenesia o hipoplasia del tracto genital femenino puede afectar a las trompas1. Algunas anomalías congénitas como el himen imperforado pueden causar obstrucción y dar lugar a hematómetra y hematosálpinx14.
Si la lesión tubárica no se puede separar claramente de los ovarios, se debe incluir en el diagnóstico diferencial las masas anexiales complejas.
Caracterización del contenido tubáricoEl estudio del contenido tubárico orienta hacia el tipo de lesión tubárica y permite acotar el diagnóstico diferencial.
Cuando la trompa se rellena de líquido seroso se forma un hidrosálpinx, y el líquido tendrá la señal en RM típica del agua, muy hipointensa en T1 y muy hiperintensa en T2 (fig. 1)8.
La dilatación tubárica con contenido purulento se conoce como piosálpinx. En T1, la señal del contenido es variable, más frecuentemente de baja a intermedia, aunque puede ser parecido o indistinguible del líquido del hidrosálpinx. En T2, la señal es heterogénea, y pueden aparecer niveles líquido-detritos formando capas amorfas de aspecto geográfico o niveles líquido-líquido (fig. 1)1,5. También resultan útiles las secuencias con saturación grasa y contraste paramagnético iv que pongan de manifiesto otros hallazgos relacionados con la infección tubárica1,5.
El hematosálpinx o dilatación tubárica con contenido hemático tiene una señal alta en T1, más evidente en las imágenes con saturación grasa. En T2, la señal puede ser alta si el sangrado es agudo, e intermedia-baja cuando es subagudo-crónico, debido a la degradación de la hemosiderina5. Esta caída de señal puede ser uniforme o en capas (fig. 1)5. El hematosálpinx puede deberse a una endometriosis, en cuyo caso el contenido suele ser más heterogéneo y puede ser además el único hallazgo en estas pacientes5,10. También puede ser secundario a torsión anexial, embarazo ectópico, neoplasias tubáricas o bien estar asociado a anomalías del conducto de Müller5,15.
Una tumoración de «partes blandas endoluminal» obliga a descartar una neoplasia5,8,12. Para ello es muy útil inyectar contraste iv que muestre los focos sólidos que realzan3–5,16. Una masa sólida que capte contraste, única o múltiple, unilateral o bilateral, debe hacernos sospechar de una neoplasia tubárica si es un hallazgo aislado. Lo más frecuente, sin embargo, es que se trate de metástasis de un tumor ginecológico y, por lo tanto, asociará otros hallazgos patológicos correspondientes al tumor primario17. Otro tipo de lesión intraluminal que se muestra como un nódulo parietal es el pólipo endometrial tubárico18.
Aunque es extremadamente raro, la RM puede ser precisa para diagnosticar un «embarazo ectópico». En el contexto clínico apropiado, el diagnóstico por RM se realiza ante una trompa dilatada con engrosamiento parietal y un hematoma agudo o con estructuras propias del saco gestacional en su interior5,8.
Enfermedades de las trompasObstrucción tubáricaSe conoce como hidrosálpinx a la trompa obstruida y dilatada, pero el uso de este término debe limitarse a los casos en que el líquido contenido sea seroso. En el caso de que se rellene de sangre o pus se debe denominar hematosálpinx y piosálpinx respectivamente7,8,13.
Puede ser un hallazgo aislado, uni o bilateral, o bien asociar afectación ovárica formando una masa anexial compleja8. Como hallazgo aislado puede estar causado por endometriosis pélvica profunda o enfermedad inflamatoria pélvica (EIP) en fase crónica, o bien deberse a adherencias pélvicas en el caso de cirugía previa, ligadura tubárica o histerectomía simple8,12. Cuando existe una masa anexial compleja en la que se incluye tanto la trompa como el ovario, los diagnósticos más probables son la endometriosis, la EIP o las lesiones tumorales anexiales, habitualmente malignas8.
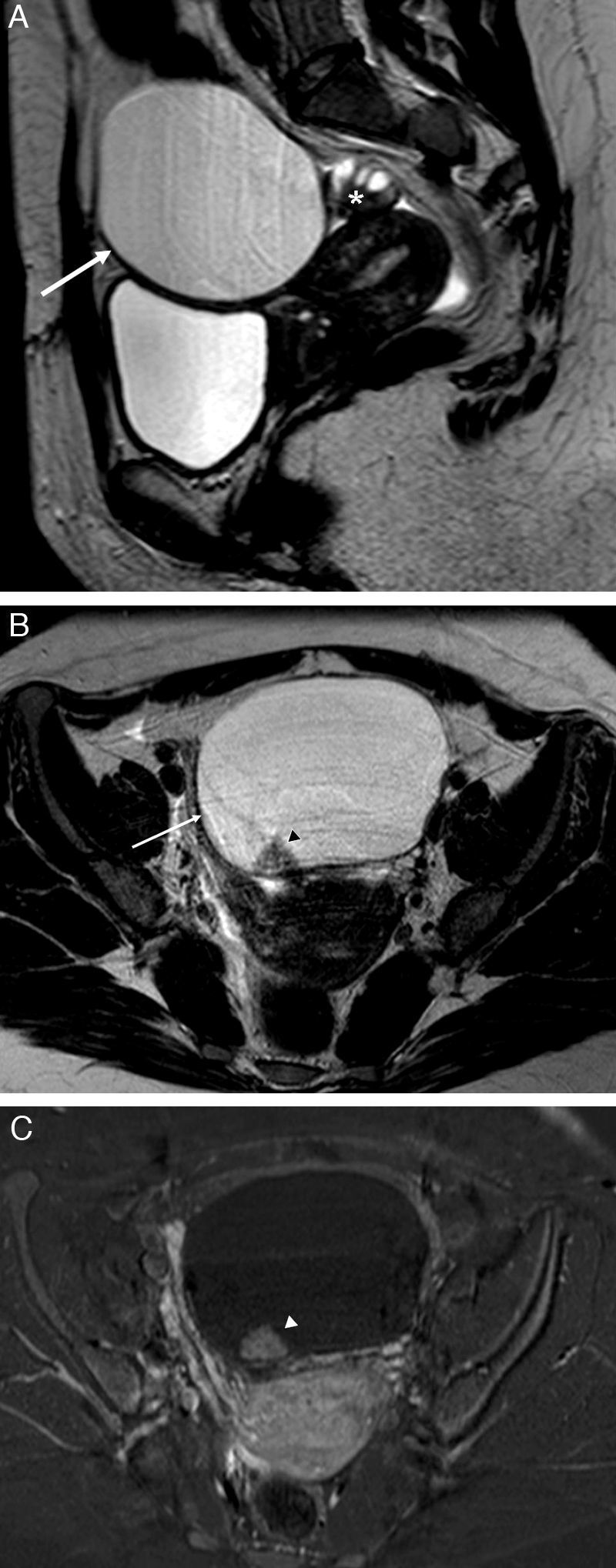
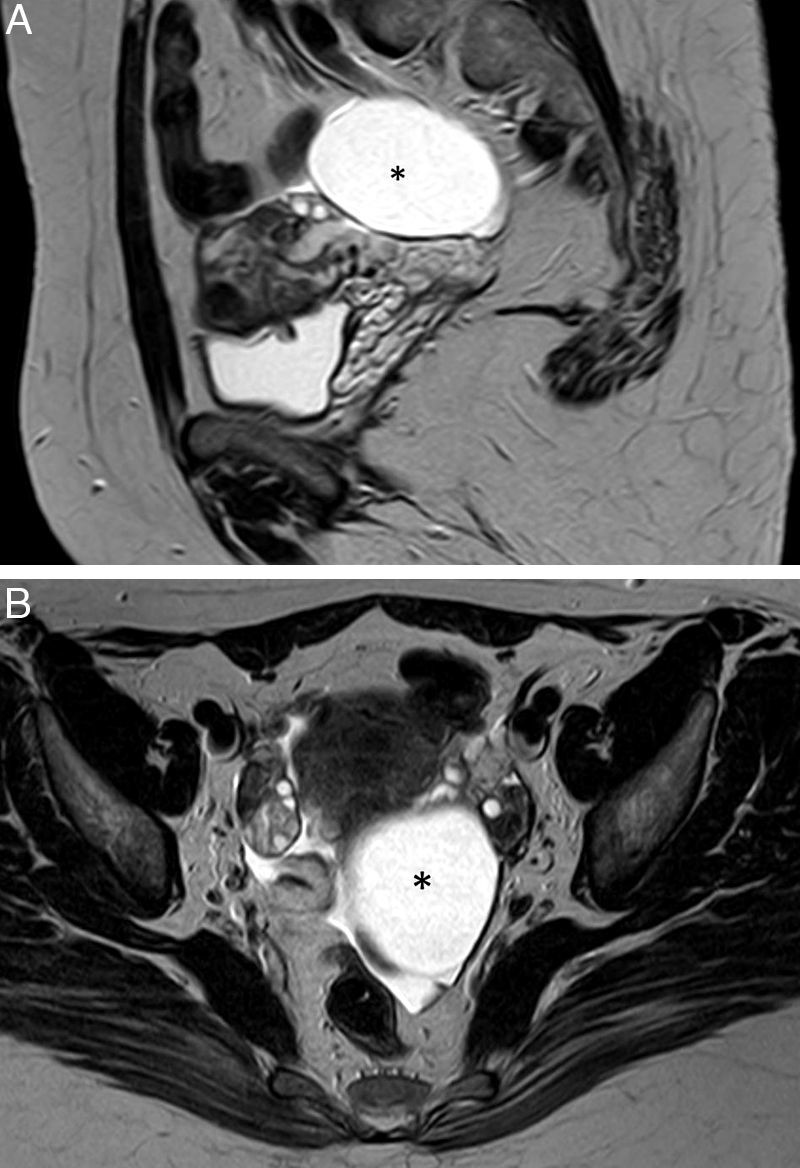
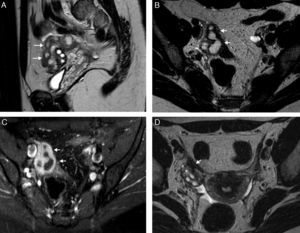
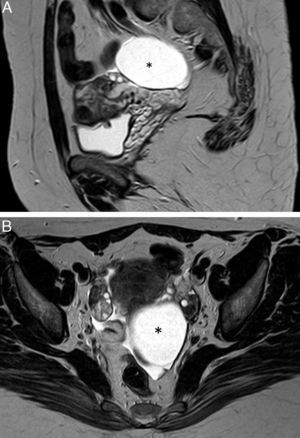
Cuando el diámetro de la trompa dilatada es mayor de 10cm puede simular un tumor ovárico multiloculado como por ejemplo un cistoadenoma o cistoadenocarcinoma (fig. 2)8,12.
Neoplasia de trompa. A) T2 TSE sagital; B) T2 TSE axial, y C) imagen de sustracción de T1 TSE con y sin contraste iv. Lesión quística redonda –no tubular– (flecha), mayor de 10cm, adyacente al ovario (* en A), pero que no depende de él. Polo sólido de aspecto papilar (cabeza de flecha) dependiente de la pared, hipercaptante que corresponde a un tumor seroso proliferativo atípico de la trompa.
Es una de las causas más frecuentes de la enfermedad tubárica12. Se trata de una enfermedad de transmisión sexual que afecta al aparato genital femenino, incluyendo al endometrio, las trompas y lo ovarios, uni o bilateralmente. Los agentes más frecuentes son Neisseria gonorrhoeae (N. gonorrhoeae) y Chlamydia trachomatis (C. trachomatis), aunque hasta un 30-40% de los casos es polimicrobiana1,12,19. La infección por Actinomyces y Mycobacterium tuberculosis (M. tuberculosis) es una causa rara de EIP, pero en caso de producirse es más frecuente que dé lugar a abscesos tubo-ováricos, que a una enfermedad tubárica simple5,12.
La afectación tubárica por estas infecciones puede causar infertilidad, dolor pélvico o peritonitis, y aumenta el riesgo de embarazo ectópico1,20,21.
Cuando la presentación de la EIP es aguda y típica, el diagnóstico clínico, analítico y mediante ecografía endovaginal suele ser suficiente1,8. La TC es útil para valorar signos inflamatorios y abscesos asociados, y si es necesario drenarlos, fundamentalmente en un contexto clínico de urgencia1,12,19. Sin embargo, en caso de presentación atípica, casos asintomáticos, presentación en estadios subagudos-crónicos, cuando se sospechen complicaciones por falta de respuesta al tratamiento o en presencia de masas anexiales complejas, la RM es muy útil para el diagnóstico1,20. Es fundamental diagnosticar y tratar a tiempo la EIP dado el potencial riesgo de afectación irreversible para las trompas19,21.
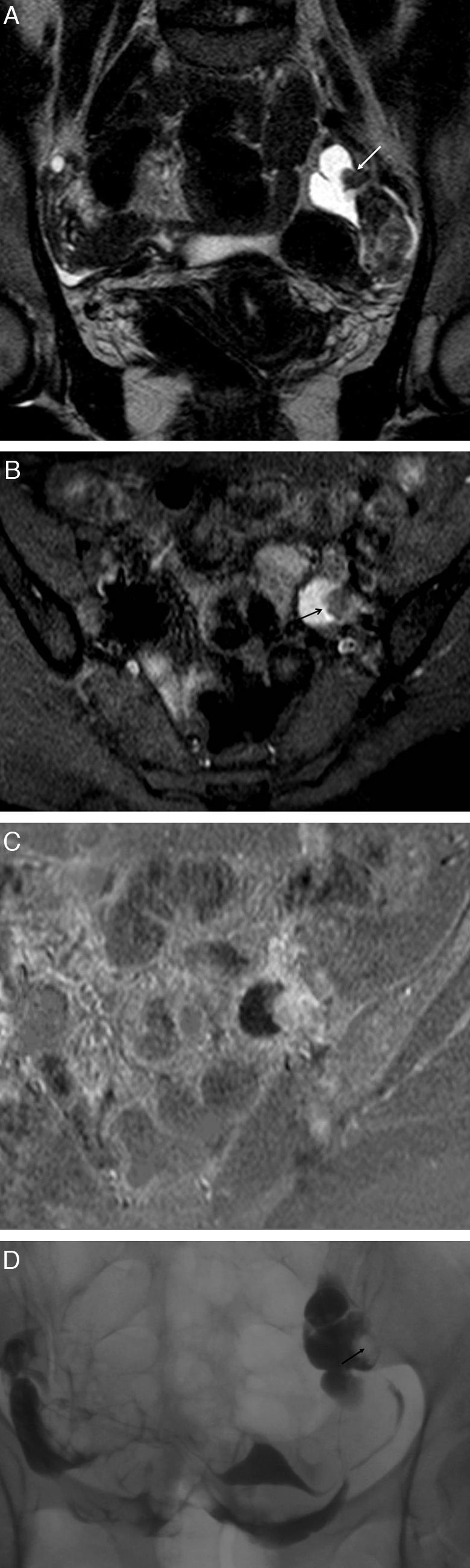
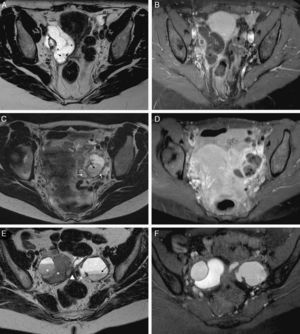
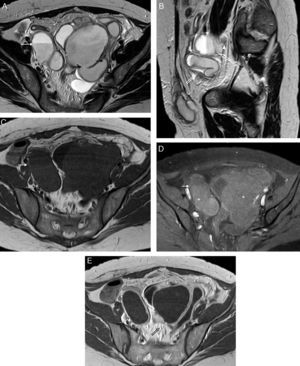
En estadios iniciales, en fase de «salpingitis», las paredes y pliegues de las trompas están inflamados, edematosos y congestivos. La RM las muestra con un grado de dilatación variable y con paredes gruesas que realzan de moderada a intensamente con contraste iv1,5. Los ovarios permanecen normales y separados de ellas (fig. 3).
Enfermedad inflamatoria pélvica, salpingitis unilateral: A) T2 TSE sagital; B) T2 TSE axial, y C) T1 TSE axial con saturación grasa (SG) y contraste iv. Mujer de 25 años asintomática diagnosticada de masa anexial derecha con ecografía transvaginal. CA 125 elevado. En la RM se observa una dilatación de la trompa derecha (flechas) con pared engrosada de forma irregular que realza con el contraste. El contenido tubárico es líquido con señal menor que el agua en T2, y mayor en T1 con SG, compatible con piosálpinx. Trompa izquierda y ambos ovarios normales (*) –el izquierdo, no se muestra–. Control tras el tratamiento antibiótico: D) T2 TSE axial. Resolución del proceso con trompas de aspecto normal (flecha). El CA 125 también se normalizó.
Si la enfermedad progresa, se forman adherencias alrededor de las fimbrias que obstruyen la trompa. El pus se acumula en la luz produciendo un piosálpinx con inflamación peritubárica y/u ovárica1,8. En este estadio supurativo, además de identificar el piosálpinx, la RM puede mostrar ingurgitación del pedículo vascular y estriaciones de la grasa, que forman una red, y engrosamiento y realce del peritoneo pélvico (fig. 4)5.
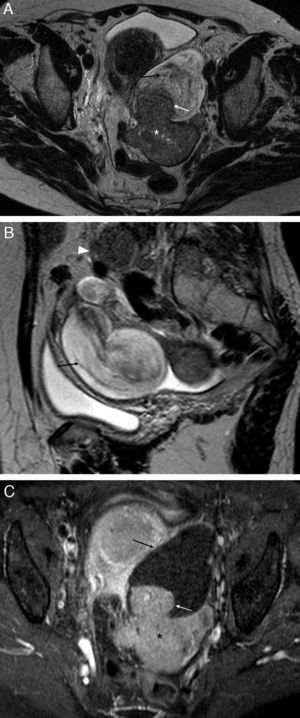
Enfermedad inflamatoria pélvica, piosálpinx con absceso tubo-ovárico bilateral. Mujer de 41 años con dolor pélvico de inicio súbito, náuseas, vómitos y fiebre, con leucocitosis y marcadores tumorales normales. Antecedente de endometriosis intervenida. A) T2 TSE axial; B) T2 TSE sagital; C) T1 TSE axial; D) T1 TSE axial con supresión grasa (SG), y E) T1 TSE axial, con contraste iv. Masas anexiales bilaterales con contenido líquido con niveles (flechas blancas), que corresponden a las trompas dilatadas y adheridas a ambos ovarios. Los ovarios han perdido su anatomía normal y forman parte de las masas anexiales. La señal del contenido tubárico es intermedia en T2 y está aumentada en T1 con SG respecto al agua (* en D). Las paredes de las trompas que están engrosadas y los ovarios realzan con contraste (E). La grasa pélvica está inflamada (flechas huecas) con adenopatías reactivas (cabeza de flecha en B). Obsérvese el signo de la cintura y el pico (flechas negras en A).
Cuando la infección alcanza el ovario, en un primer momento tanto trompa como ovario pueden mostrar cambios inflamatorios, pero permanecen separados. Este estadio se conoce como «salpingo-ooforitis»8. A partir de este momento los ovarios se van inflamando, aumentan su tamaño y desdibujan sus contornos19. Conforme se van destruyendo los tejidos se va organizando una masa anexial compleja, en la que participan ambos órganos. Si el proceso evoluciona aún más se formará un «absceso tubo-ovárico» (fig. 4)8. La RM distinguirá una masa anexial compleja de paredes gruesas, contornos internos irregulares, contenido líquido heterogéneo, con un número variable de septos internos y gas o niveles líquido-líquido1. Este líquido puede ser proteico o hemorrágico, con señal elevada en T1 y señal heterogénea en T2, normalmente alta, dependiendo de la viscosidad y el contenido proteico1. Esta masa suele rodearse de un área mal definida, de señal alta en T2, por edema y exudados20. Se ha descrito un anillo en la porción más interna de la masa, que capta contraste de forma intensa, que puede corresponder a tejido de granulación junto con restos hemorrágicos20,22,23. Es posible también la implicación en la masa de otros órganos no ginecológicos, como las asas de intestino delgado, los uréteres o la vejiga20.
Hasta un 20% de los abscesos tubo-ováricos pueden presentarse sin síntomas o signos clínicos, lo que plantea el diagnóstico diferencial con neoplasias anexiales benignas y malignas20. La RM es útil para diagnosticar, seguir y monitorizar la involución de los hallazgos tras el tratamiento (fig. 3)19. Es importante establecer el tratamiento correcto puesto que una ruptura de un absceso tubo-ovárico puede provocar una peritonitis grave1.
Otras causas poco frecuentes de abscesos tubo-ováricos son la actinomicosis, normalmente crónica, la tuberculosis (TBC) pélvica y la inflamación xantogranulomatosa anexial. Estas 3 variantes son más difíciles de diferenciar de las neoplasias ováricas, pero dado que se pueden manejar con tratamiento únicamente médico, es muy importante reconocerlas23.
La infección crónica por Actinomyces israelii (A. israelii) se asocia al uso crónico de dispositivos anticonceptivos intrauterinos, y se trata eficazmente con altas dosis de penicilina7,23,24. Los abscesos que forman contienen mucho tejido de granulación y fibrosis, por lo que la parte sólida del absceso en las secuencias potenciadas en T2 es hipointensa, con leve captación de contraste23. Pueden desarrollar tractos fibrosos que invaden tejidos adyacentes como los uréteres y el colon, formar fístulas, y son difíciles de diferenciar de los procesos neoplásicos pélvicos. En otras ocasiones, en cambio, no son distinguibles de un absceso tubo-ovárico común23.
La afectación del tracto genital femenino por M. tuberculosis tiene lugar en un porcentaje muy bajo de los pacientes infectados23. Se disemina a la pelvis por cualquier vía, hematógena, linfática o peritoneal23. Suele ser asintomática, o presentar manifestaciones clínicas muy vagas e inespecíficas. En ocasiones, se diagnostica durante la evaluación de una infertilidad1. El absceso tubo-ovárico causado por TBC se presenta, tanto clínica como radiológicamente, de forma parecida a la carcinomatosis peritoneal secundaria a una neoplasia ovárica, lo que, junto a una elevación de CA-125 en ambos casos, hace difícil distinguirlas1,25. En RM se ven masas sólidas o sólido-quísticas, normalmente bilaterales, con nódulos parietales en las porciones quísticas, captación de las pociones sólidas, ascitis e infiltración de la grasa pélvica y engrosamiento peritoneal23. En estadios avanzados de la enfermedad la fibrosis causa adherencias con los tejidos adyacentes, como por ejemplo el útero25. También pueden existir adenopatías, con o sin centro necrótico23 y colecciones líquidas con septos internos en el fondo de saco de Douglas u otras localizaciones intraperitoneales25.
Torsión tubárica aisladaLa torsión tubárica aislada, es decir, aquella que no se asocia a una anomalía ovárica, es una causa poco frecuente de dolor pélvico agudo, que muy rara vez precisa de la RM para su diagnóstico. El diagnóstico rápido con una cirugía precoz puede prevenir un daño vascular irreversible en la trompa26. En casos dudosos la RM queda relegada para diferenciarla de algunas neoplasias1.
Es más frecuente en mujeres jóvenes en edad fértil, y se asocia a un mesosálpinx largo o congestionado, antecedente de EIP o ligadura tubárica, hipermovilidad de la trompa o trauma1. También se han descrito algunos casos en niñas27. Es más frecuente en el lado derecho, debido a que el izquierdo está más fijo a la pelvis1. Además de poder diferenciar un ovario normal, por RM se identificará una trompa dilatada, de paredes engrosadas, y con una configuración en espiral1,28, o incluso áreas de infarto parietal, sin captación de contraste27 y contenido hemorrágico intraluminal26.
EndometriosisHasta en un 30% de las mujeres con endometriosis en la laparoscopia se encuentran anomalías tubáricas asociadas29. Las pacientes pueden estar asintomáticas o bien aquejar dolor pélvico crónico, infertilidad o dispareunia30.
La afectación tubárica por endometriosis se presenta como un hallazgo aislado, en forma de hidro o hematosálpinx, o como parte de una masa pélvica compleja en caso de que existan quistes y/o implantes endometriósicos pélvicos profundos, que afecten tanto a las trompas como a los ovarios29,30. Según dónde se localicen los implantes, existen 2 formas principales de afectación tubárica: serosa-suberosa e intraluminal1,8.
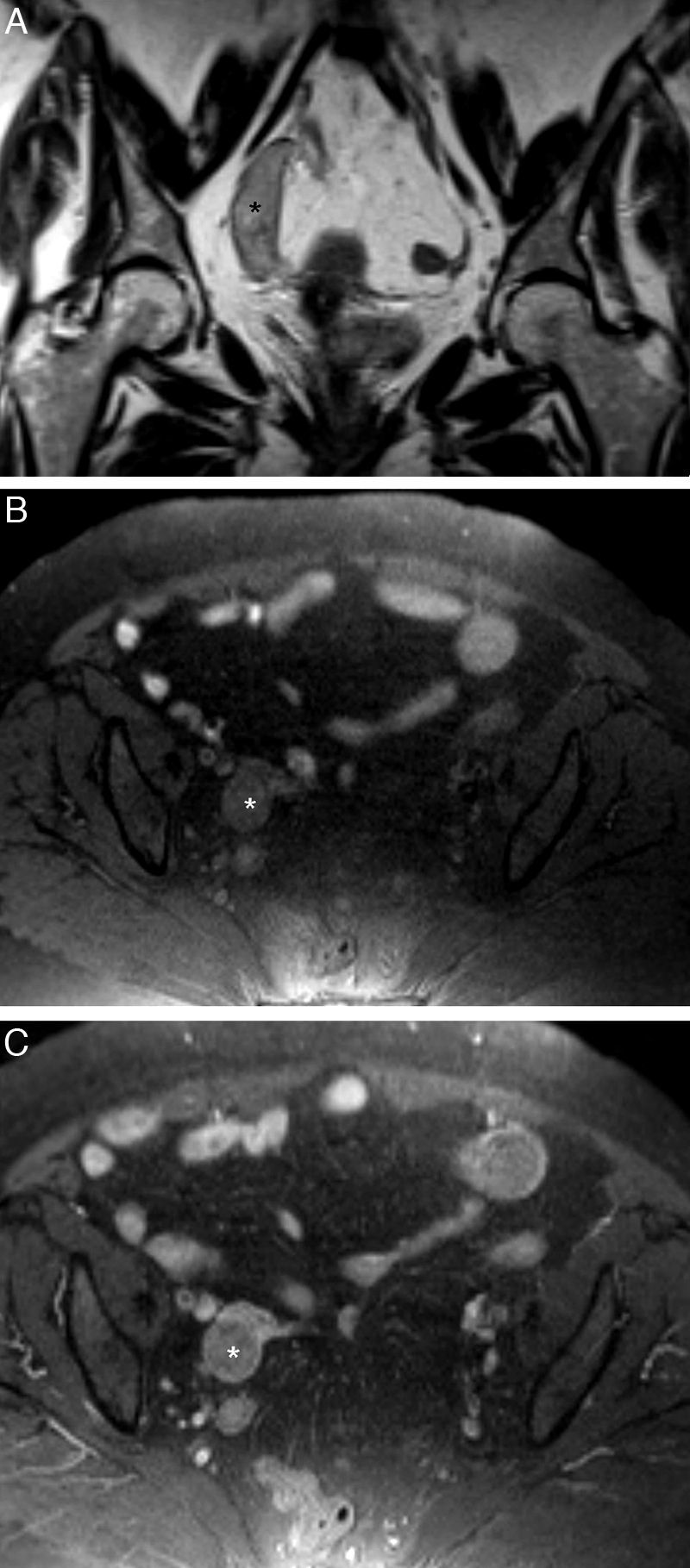
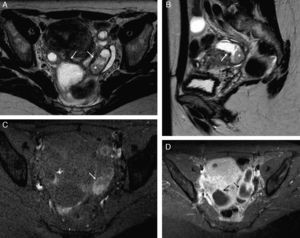
La endometriosis serosa y subserosa se produce por la implantación de focos de tejido endometriósico funcionante en la superficie peritoneal de la trompa1. Los implantes causan hemorragias intraluminales repetidas que ocasionalmente dan lugar a la formación de tejido fibroso, y secundariamente a adherencias peritubáricas que provocan obstrucción tubárica (hidrosálpinx y/o hematosálpinx)1,8 (fig. 1). El hematosálpinx aislado puede ser el único hallazgo en algunas pacientes sin antecedentes conocidos10,29, pero más frecuentemente hay otros signos de endometriosis en la pelvis. El contenido de la trompa afectada tiene una señal en T1 muy alta, pero no siempre tiene el efecto de disminución de señal en T2 (T2 shading) característico de los endometriomas8. En ocasiones se identifican detritos en la porción dependiente de la trompa o restos hemorrágicos que solo tapizan las paredes29 (fig. 5).
Endometriosis tubárica bilateral: hematosálpinx bilateral. Mujer de 50 años posmenopáusica con dolor abdominal y elevación de CA-125. A) T2 TSE axial; B) T2 TSE sagital; C) T1 TSE axial con supresión grasa (SG), y D) T1 TSE axial SG con contraste iv. Dilatación de las trompas (flechas) con engrosamiento parietal irregular y niveles líquido-líquido. En las secuencias T2 el contenido en áreas declives es hipointenso (*), y en T1 SG tanto este foco como las paredes de ambas trompas son hiperintensas. Con contraste, las paredes realzan de forma intensa.
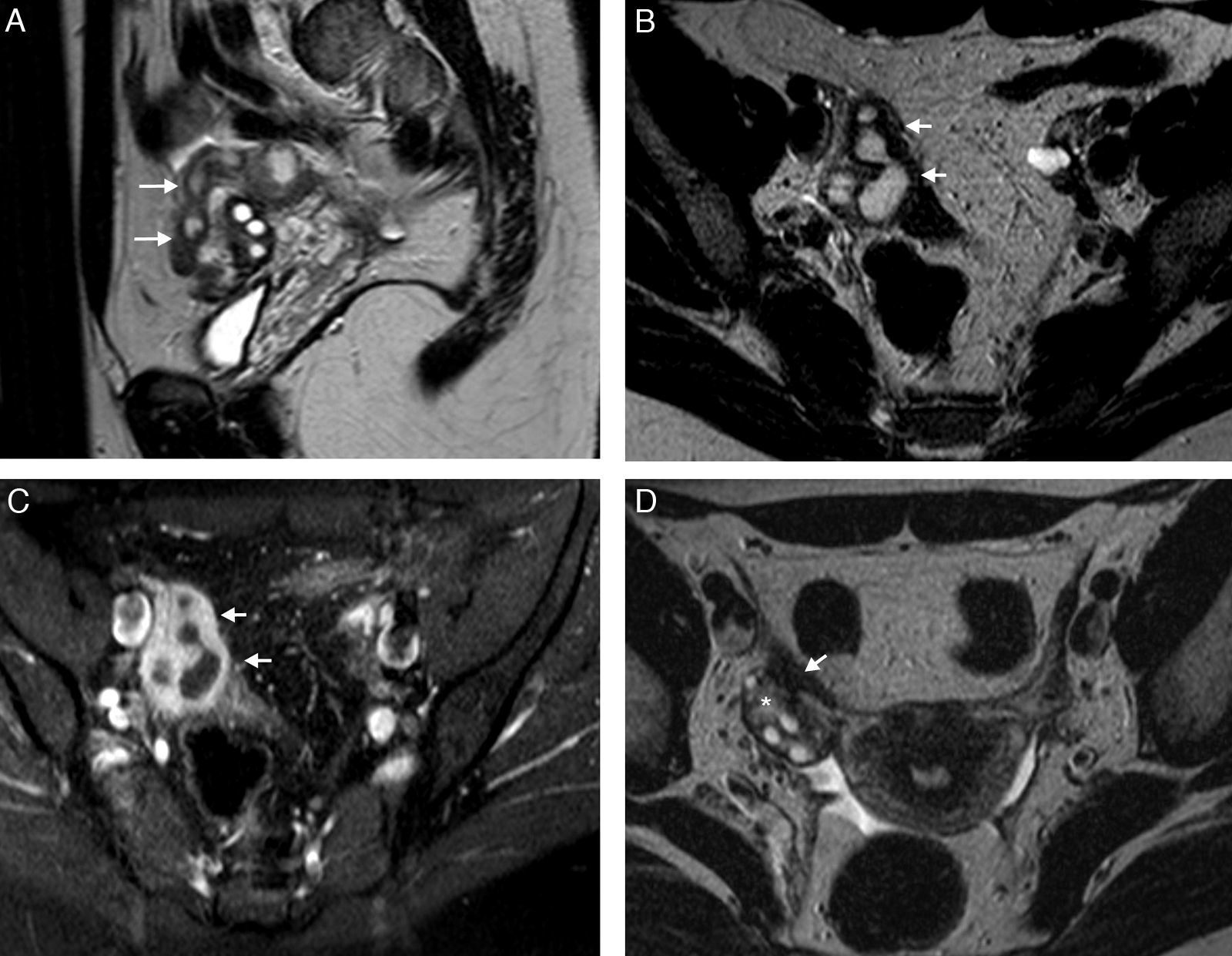
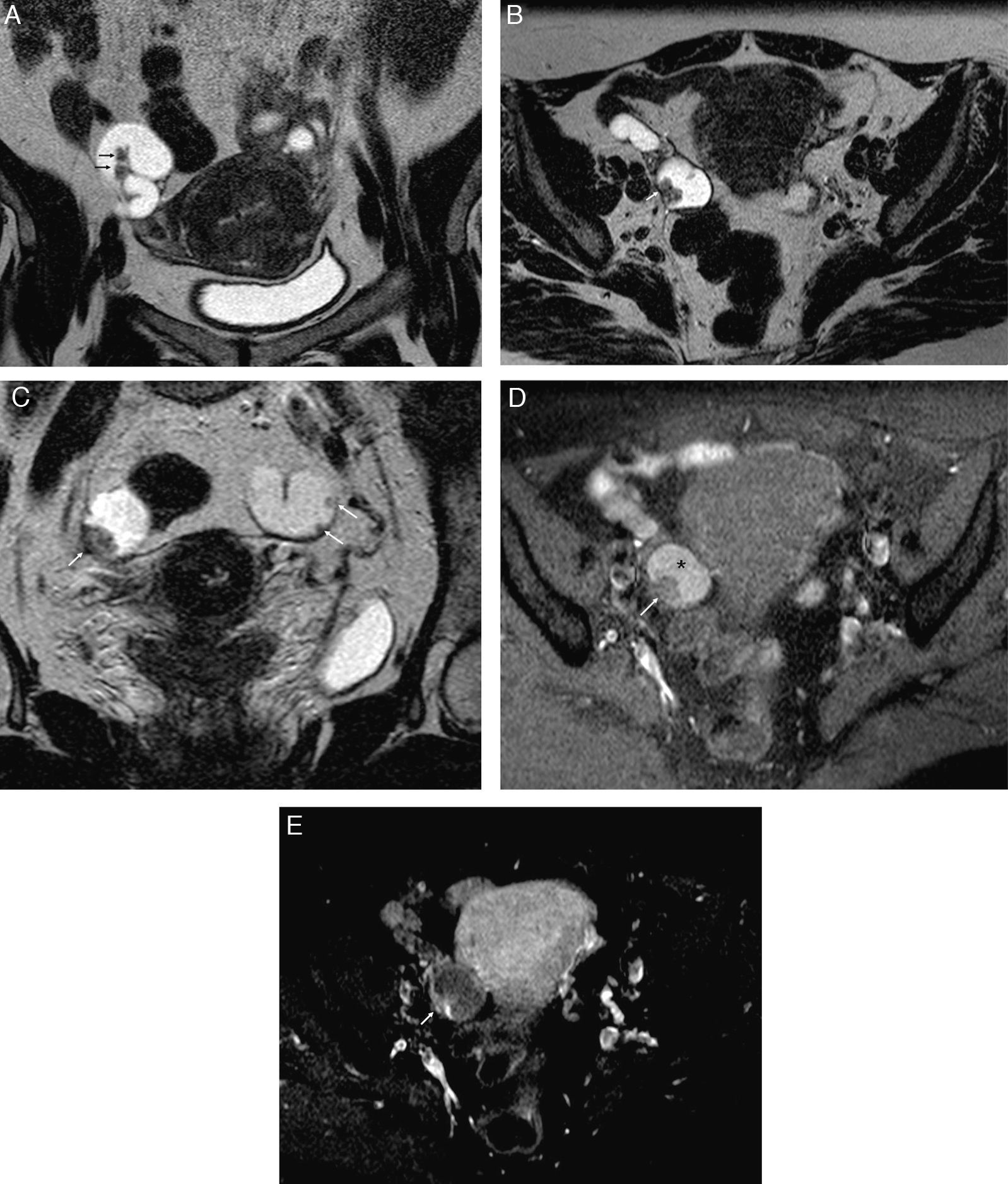
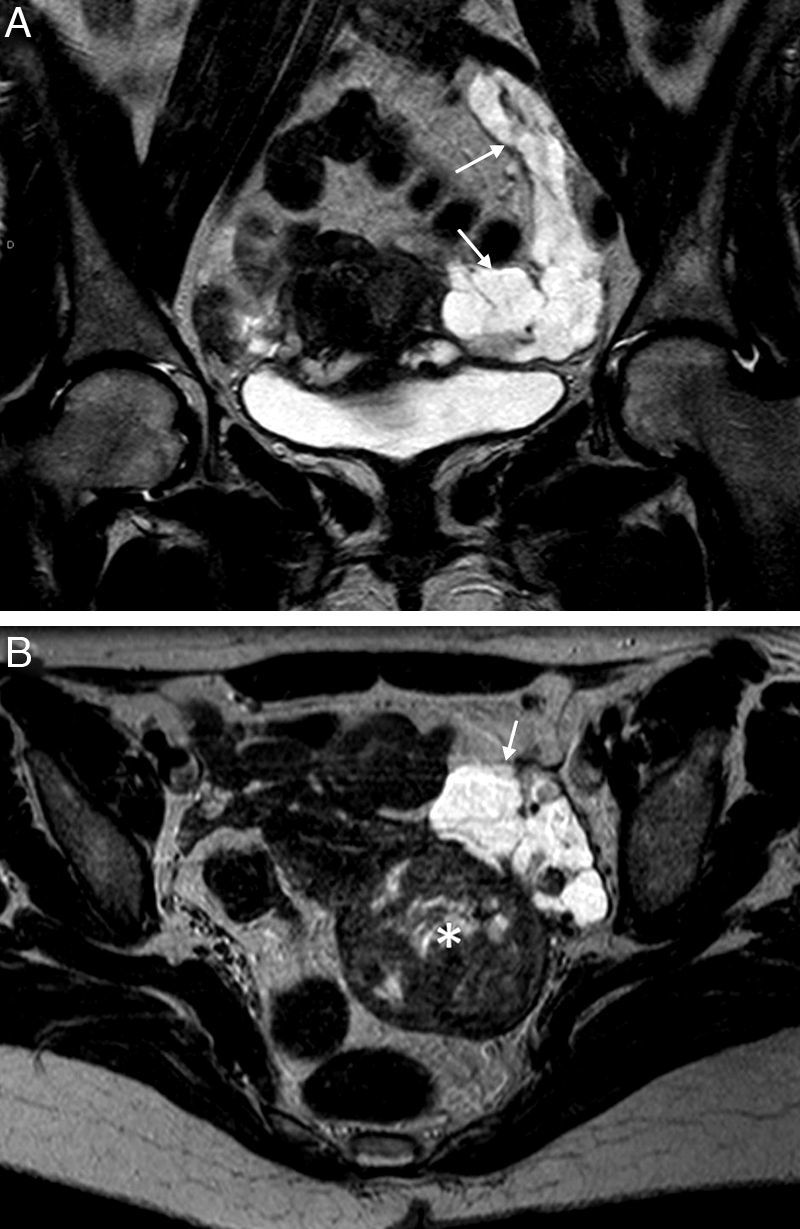
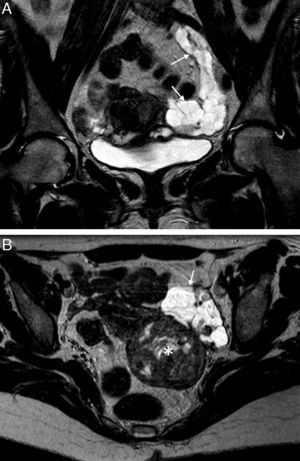
La endometriosis endoluminal es mucho menos frecuente. Se produce cuando se localiza tejido endometrial en la superficie mucosa, normalmente de la porción intersticial de la trompa1. Este tejido endometrial está compuesto por glándulas endometriales y estroma, y no invade la capa muscular lisa31. Los implantes forman pequeños nódulos polipoides intraluminales, normalmente menores de 1cm, que no suelen ser visibles en la RM. Es más frecuente encontrarlos como defectos de repleción redondos bien delimitados en las HSG18. Sin embargo, en algunos casos puede verse un nódulo parietal en la RM (fig. 6). En caso de duda sobre su localización intraluminal es útil realizar una HSG. La forma endoluminal no suele asociar oclusión o dilatación tubárica si se presenta como un hallazgo aislado, aunque sí puede producirla por hemorragia intraluminal repetida1. Además, también puede asociar otros signos de endometriosis pélvica. Al igual que el tipo seroso-subseroso puede ser uni o bilateral, pero por el contrario, no suele provocar síntomas ni infertilidad18.
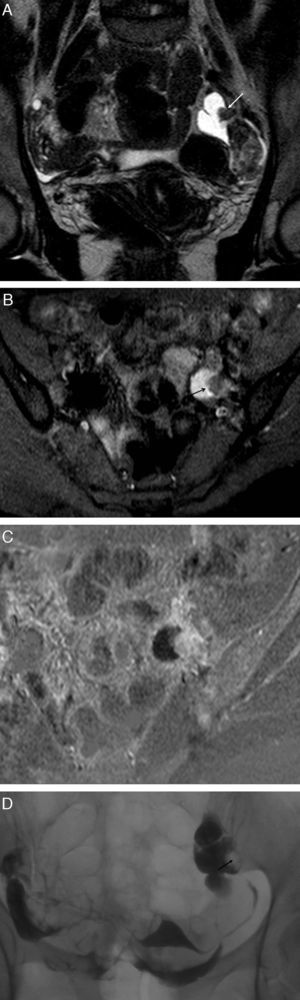
Endometriosis endoluminal. Mujer de 28 años asintomática. A) T2 TSE coronal; B) T1 TSE axial con saturación grasa (SG); C) sustracción de T1 con y sin contraste iv, y D) histerosalpingografía (HSG). Trompa izquierda dilatada con contenido hemorrágico agudo, hiperintenso en T1 y T2, con una lesión nodular endoluminal dependiente de la pared, que se realza (flechas). La HSG confirmó la localización endoluminal de la lesión nodular y la permeabilidad de la trompa afectada. La anatomía patológica confirmó el origen endometriósico de la lesión polipoide.
La neoplasia primaria maligna de las trompas es muy poco frecuente, descrita entre el 0,14 y 1,8% de todos los cánceres ginecológicos17,32–34. No obstante, su incidencia puede estar muy subestimada debido a la dificultad de diferenciar histológicamente los tumores primarios de las trompas de los carcinomas ováricos epiteliales, puesto que ambos son idénticos, especialmente en estadios avanzados1,32–34. Es más habitual en las mujeres posmenopáusicas, entre la cuarta y la sexta década, con un pico de incidencia a los 55 años32,34. La mayoría son adenocarcinomas, más frecuentemente el tipo seroso papilar, normalmente unilaterales, aunque hasta el 20% de casos son bilaterales1,17.
Aunque es inespecífico para el diagnóstico, hasta en un 80% de los casos el CA-125 sérico está elevado. Se trata de un marcador pronóstico independiente y útil, tanto para valorar la respuesta clínica al tratamiento como para detectar la recurrencia antes de que esta tenga representación clínica o radiológica33,35,36.
Desde estadios iniciales pueden ser asintomáticas o cursar con síntomas inespecíficos como dolor por distensión tubárica y leucorrea o sangrado vaginal. En ocasiones puede presentarse como una masa palpable1,17. Estas manifestaciones hacen que la paciente busque asistencia médica antes, por lo que el cáncer tubárico se suele detectar en un estadio más precoz que el ovárico, en el que las manifestaciones suelen tardar más en aparecer1,15,16,33. No obstante, dado su pequeño tamaño al inicio y la poca frecuencia con la que se presentan, el diagnóstico clínico y ecográfico suele ser muy difícil, y la RM de pelvis con contraste iv es entonces muy útil3,8.
El patrón de crecimiento tumoral puede ser nodular, papilar, infiltrativo o invasivo1. Habitualmente se originan en la región ampular y crecen hacia la luz tubárica8. Dependiendo de las secreciones que produzcan causan dilatación tubárica o no, pero lo más frecuente es que segreguen gran cantidad de líquido seroso1.
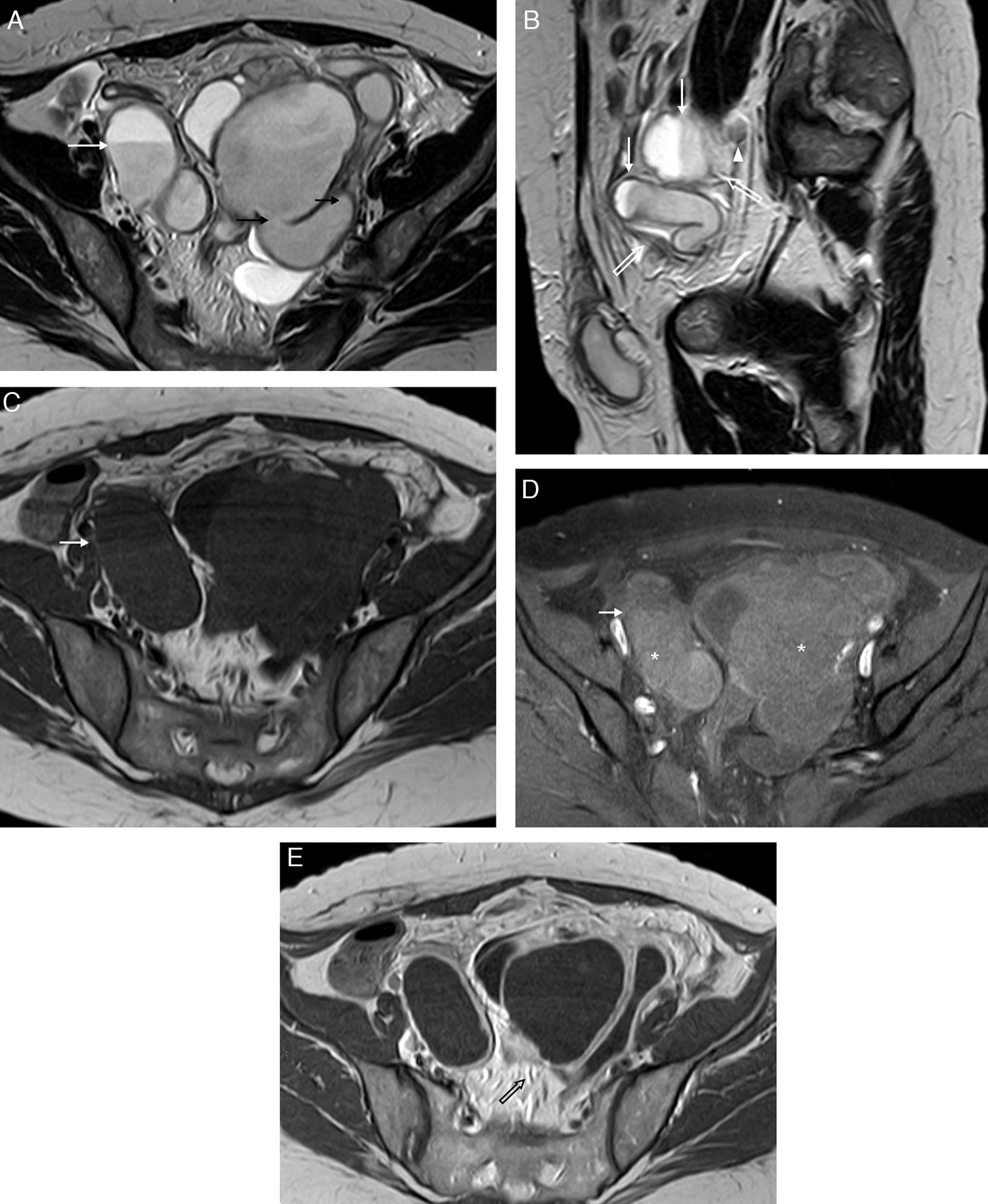
Si no causan hidrosálpinx se identifican como pequeñas masas lobuladas que captan contraste y pueden contener áreas quísticas por necrosis o hemorragia (fig. 7)16. En el caso de que el tumor produzca secreciones líquidas, y las fimbrias estén obstruidas, se produce un hidrosálpinx. En estos casos la lesión se muestra como una masa sólido-quística tubular y tortuosa17. Esta configuración tubular es la clave diagnóstica, y lo que debe hacer sospechar que el tumor se origina en la trompa y no en el ovario1,17. Ocasionalmente, se presenta con nódulos o papilas únicas o múltiples en la luz de una trompa dilatada (fig. 8)15. También se puede manifestar como una estructura quística multilocular con aspecto de rueda dentada, como resultado de un plegamiento de la trompa dilatada sobre sí misma. Este aspecto hace muy difícil reconocer la configuración tubular característica, que orientaría hacia un tumor tubárico, y lo hace radiológicamente indistinguible de uno ovárico, máxime si el ovario no se separa claramente de la masa1. Es importante tener en cuenta que los tumores ováricos pueden extenderse localmente hacia las trompas, en cuyo caso es difícil diferenciar el origen tumoral (fig. 9)7. Si las fimbrias no están obstruidas, o como resultado de descompresiones ocasionales que se acompañan de episodios de dolor, se asociará líquido intrauterino o ascitis peritumoral1,17. La diseminación intraperitoneal es parecida a la del cáncer ovárico y su diseminación ganglionar o metastásica es más frecuente que la de este15.
Neoplasia tubárica primaria derecha (adenocarcinoma endometrioide). Mujer de 73 años con pequeños sangrados (spotting) sin elevación de marcadores tumorales. A) T2 TSE coronal; B) T1 TSE axial con supresión grasa (SG), y C) T1 TSE axial SG con contraste iv. Masa sólida tubular en la región anexial derecha (*), heterogénea en las secuencias T2. En T1 TSE SG la masa muestra una señal mayor que el músculo y realza de forma moderada y heterogénea tras la inyección iv de contraste paramagnético. Ovarios atróficos.
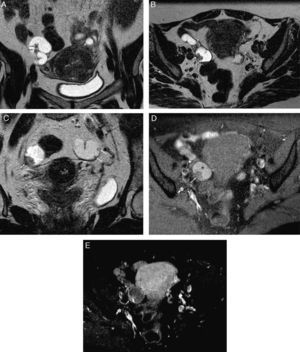
Neoplasia tubárica primaria bilateral. Mujer de 51 años asintomática. A) T2 TSE coronal; B) T2 TSE axial; C) T2 TSE coronal; D) T1 TSE axial con supresión grasa (SG), y E) T1 TSE axial SG con contraste iv. Ambas trompas están dilatadas con contenido hiperintenso en T1 (* en D, solo mostrada la derecha), con pequeños nódulos, múltiples y bilaterales, que realzan con contraste (flechas). Ovarios y útero normales sin adenopatías significativas. El estudio anatomopatológico diagnosticó un adenocarcinoma seroso primario bilateral con múltiples implantes endoluminales junto con un contenido tubárico líquido-gelatinoso y hemático.
Neoplasia ovárica izquierda con invasión secundaria de la trompa ipsilateral. Mujer de 66 años con marcadores tumorales elevados. A) T2 TSE axial; B) T2 TSE sagital, y C) T1 TSE axial con saturación grasa (SG) con contraste iv. Masa sólida anexial izquierda (*) que realza con contraste, que correspondía a un cistoadenocarcinoma seroso papilar de ovario. Se extiende a la región ampular de la trompa ipsilateral (flechas blancas) a la que obstruye y dilata (flechas negras). Se acompaña de grandes adenopatías regionales (cabeza de flecha).
El componente sólido tumoral se presenta en RM tanto con aspecto homogéneo como heterogéneo, normalmente iso o hiperintenso en T2 e hipointenso en T1, con una clara captación del contraste1,16. El líquido asociado será claro, hiperintenso en T2, o hemorrágico, hiperintenso en T11. La RM también es útil para hacer una estadificación local prequirúrgica, cuyos límites determinantes, según la Federación Internacional de Ginecología y Obstetricia (FIGO), son la afectación exclusiva de una o de las 2 trompas, y la extensión a la serosa o afectación peritoneal, además de la presencia de metástasis1,34.
El diagnóstico diferencial incluye los tumores ováricos primarios, con o sin extensión hacia la trompa, y las metástasis, mayoritariamente las debidas a extensión directa de otros tumores ginecológicos7,17.
Cuando se sospeche afectación neoplásica tubárica, siempre hay que descartar otro tumor primario de origen ginecológico (endometrial y ovárico), dada la alta frecuencia de estos tumores17. En el caso de afectación bilateral, suele resultar muy complejo diferenciar entre un primario bilateral y un primario unilateral que asocie metástasis contralaterales17.
En muy raras ocasiones una masa tubárica es debida a un mioma primario de la trompa. En tal caso se identificará una masa fusiforme, pequeña, bien definida, única y localizada entre el ovario y el útero, pero separada de ambos con el mismo comportamiento en RM que los miomas uterinos1,37.
Excluir otras alteraciones pélvicasLas alteraciones pélvicas en las mujeres no son exclusivamente ginecológicas. En el diagnóstico diferencial se deben incluir otras enfermedades cuando se identifican los ovarios normales. Las enfermedades tubáricas se deben diferenciar de otras entidades que causan lesiones paraováricas con contenido líquido, como los quistes paraováricos (fig. 10), los quistes de inclusión peritoneal, los linfangiomas (fig. 11), los linfoceles y los mucoceles apendiculares, entre otros5,13.
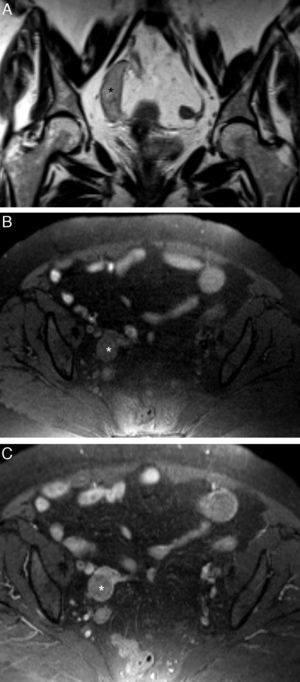
Quiste paraovárico. A) T2 TSE sagital, y B) T2 TSE axial. Mujer con sangrado uterino anormal. Ambos ovarios son normales, pero existe una lesión quística paraovárica (*), que no tiene una estructura tubular ni plicas, ni septos en su interior, por lo tanto compatible con un quiste paraovárico.
Linfangioma quístico. Mujer de 47 años diagnosticada por ecografía transvaginal de masa quística anexial izquierda. A) T2 TSE coronal, y B) T2 TSE axial. Masa en la región anexial izquierda, multiquística, seudotubular, con septos completos en su interior, que rodea a los vasos ilíacos (flecha). En el plano coronal se muestra la extensión craneal de la masa. El diagnóstico se confirmó con la cirugía. Mioma uterino en la pared posterior (*).
La RM es una técnica muy precisa para diagnosticar las enfermedades de las trompas de Falopio, con unos valores de especificidad y sensibilidad superiores a la ecografía y la TC, lo cual la hace especialmente útil en las alteraciones tubáricas con presentación atípica o compleja. El conocimiento de la patología tubárica y sus hallazgos por RM hace que el radiólogo tenga un importante papel en el algoritmo diagnóstico de las enfermedades tubáricas, bien para hacer un diagnóstico preciso o bien acotando al máximo el diagnóstico diferencial.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Autorías- 1.
Responsable de la integridad del estudio: CLC.
- 2.
Concepción del estudio: CLC, RMF, MFN y JCG.
- 3.
Diseño del estudio: CLC y RMF.
- 4.
Obtención de los datos: CLC, MFN y JCG.
- 5.
Análisis e interpretación de los datos: CLC, MFN y JCG.
- 6.
Tratamiento estadístico: no procede.
- 7.
Búsqueda bibliográfica: CLC, RMF, MFN y JCG.
- 8.
Redacción del trabajo: CLC y RMF.
- 9.
Revisión crítica del manuscrito con aportaciones intelectualmente relevantes: RMF, MFN y JCG.
- 10.
Aprobación de la versión final: CLC, RMF, MFN y JCG.
Los autores declaran no tener ningún conflicto de intereses.