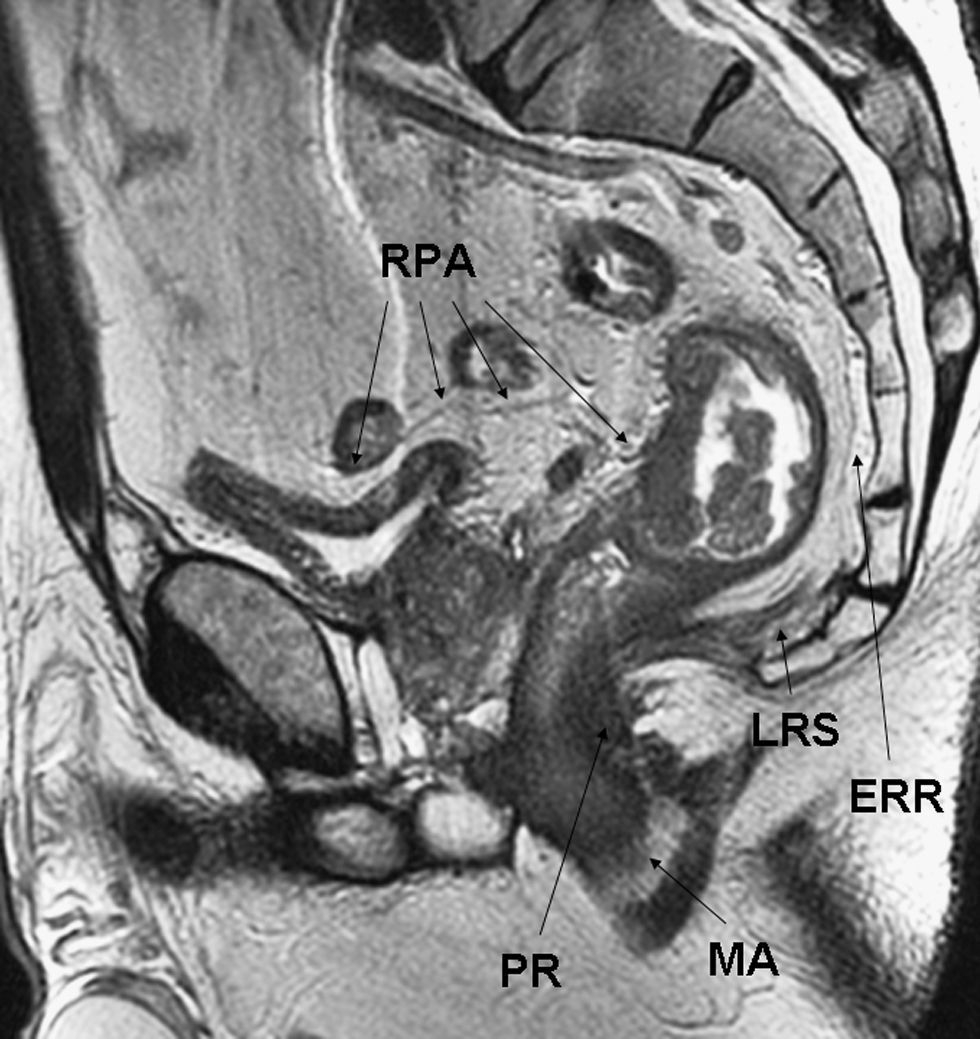
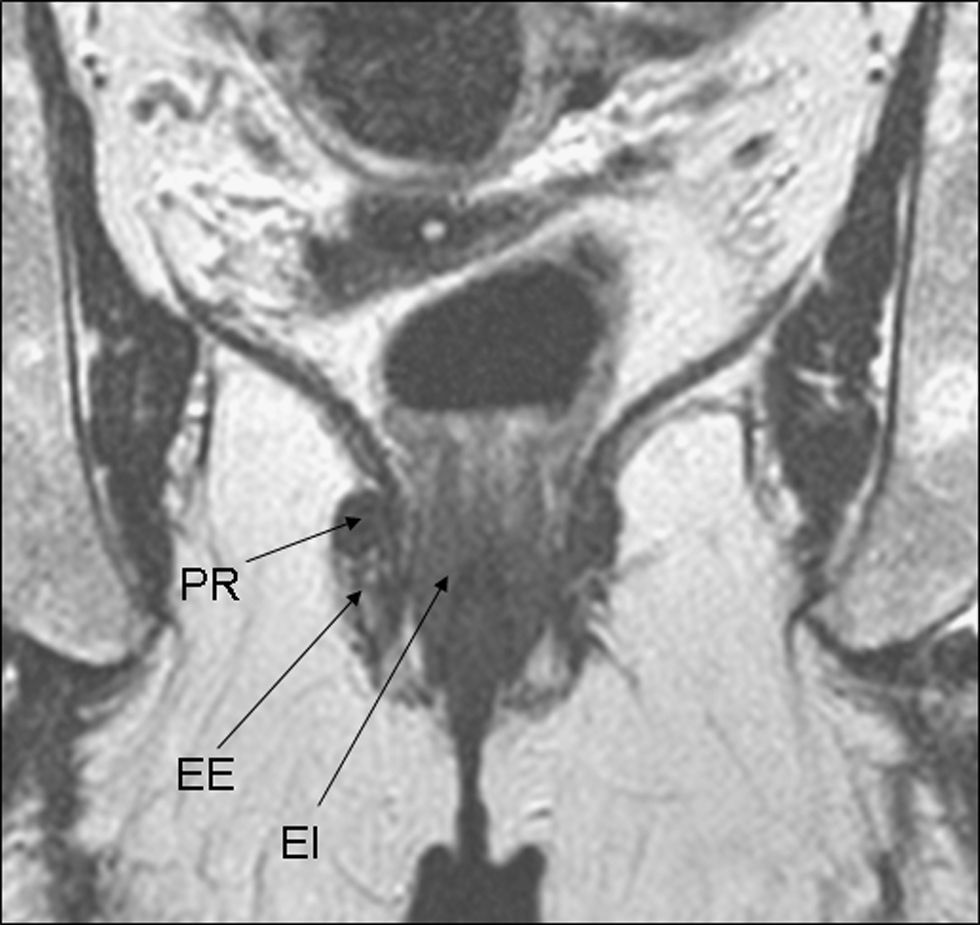
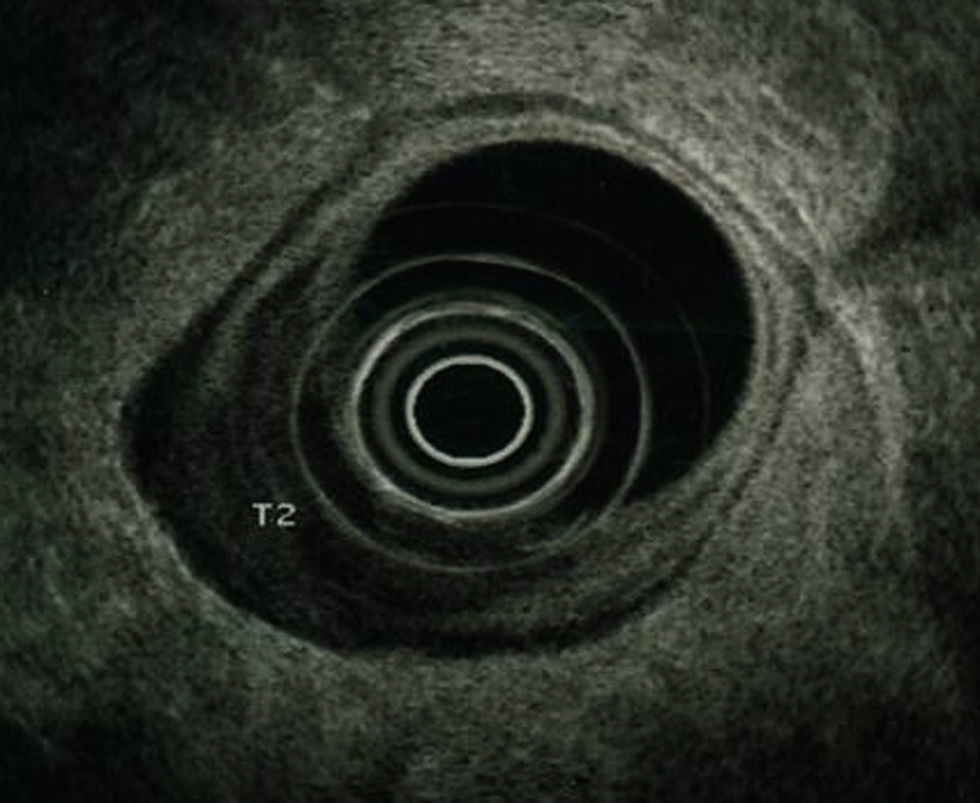
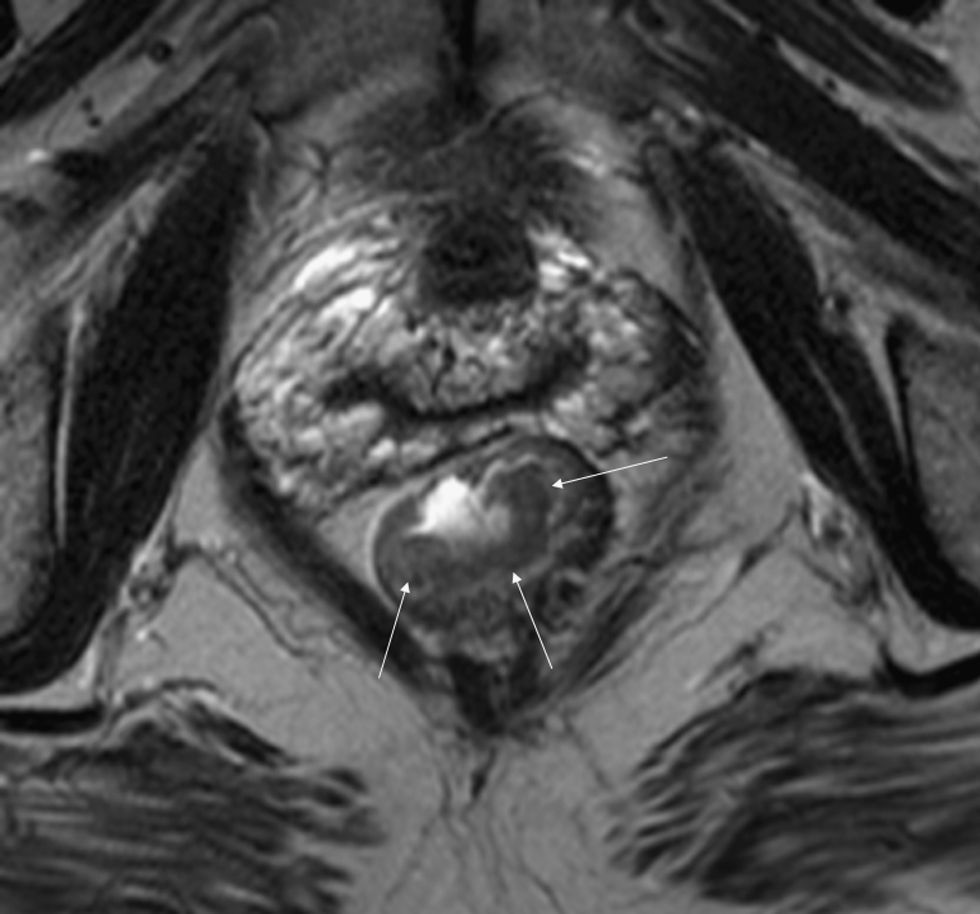
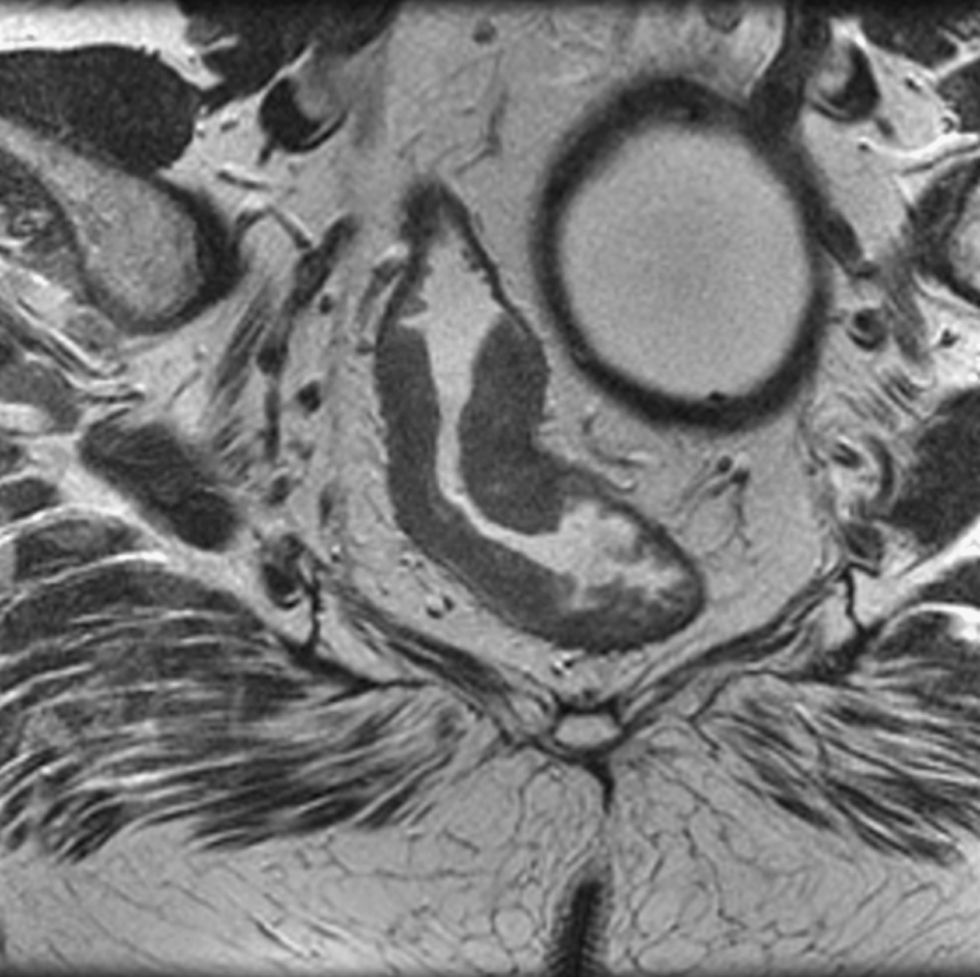
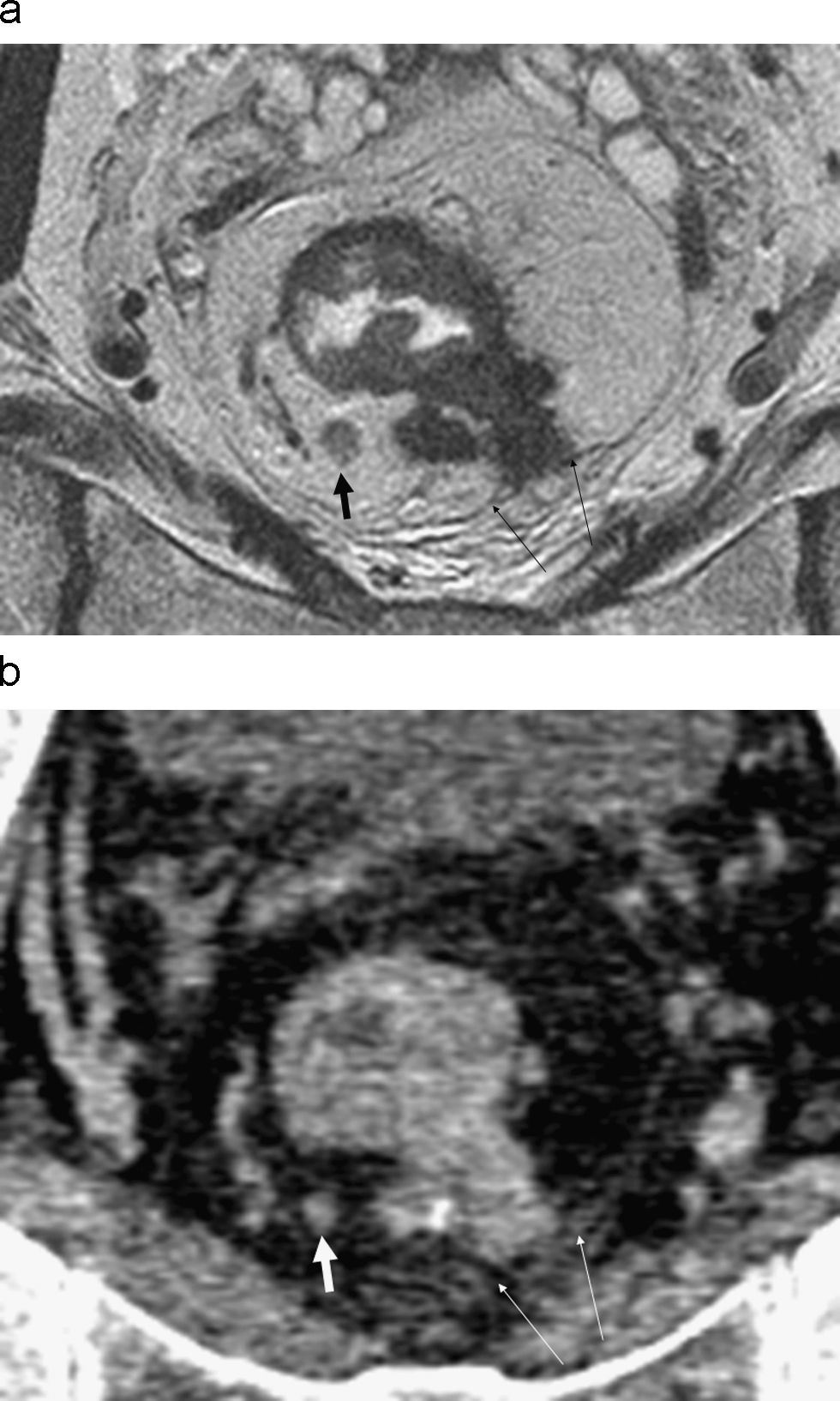
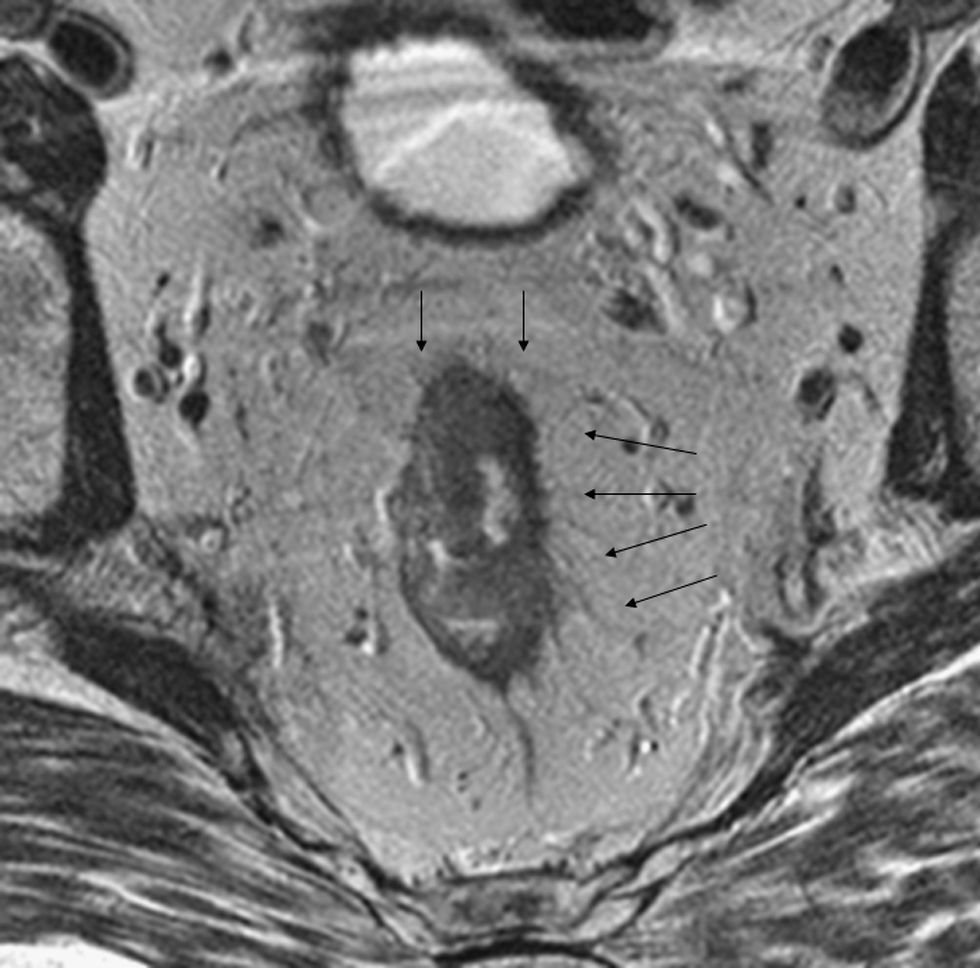
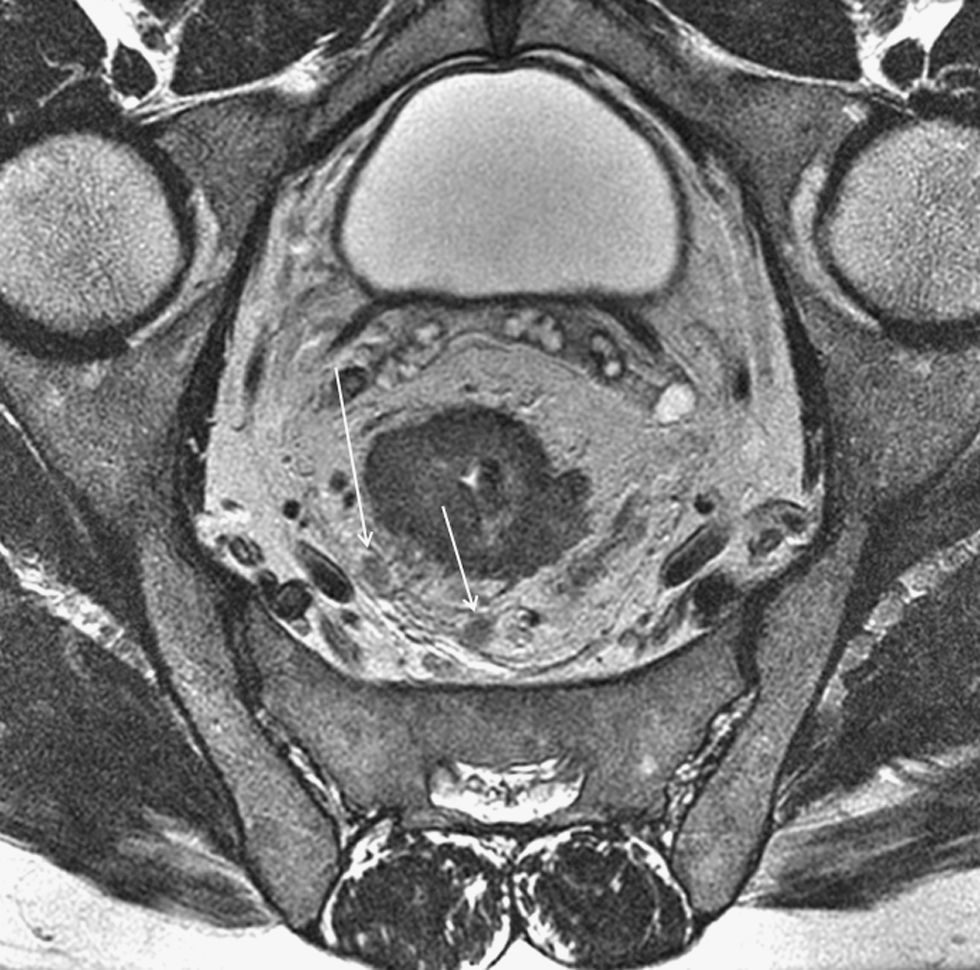
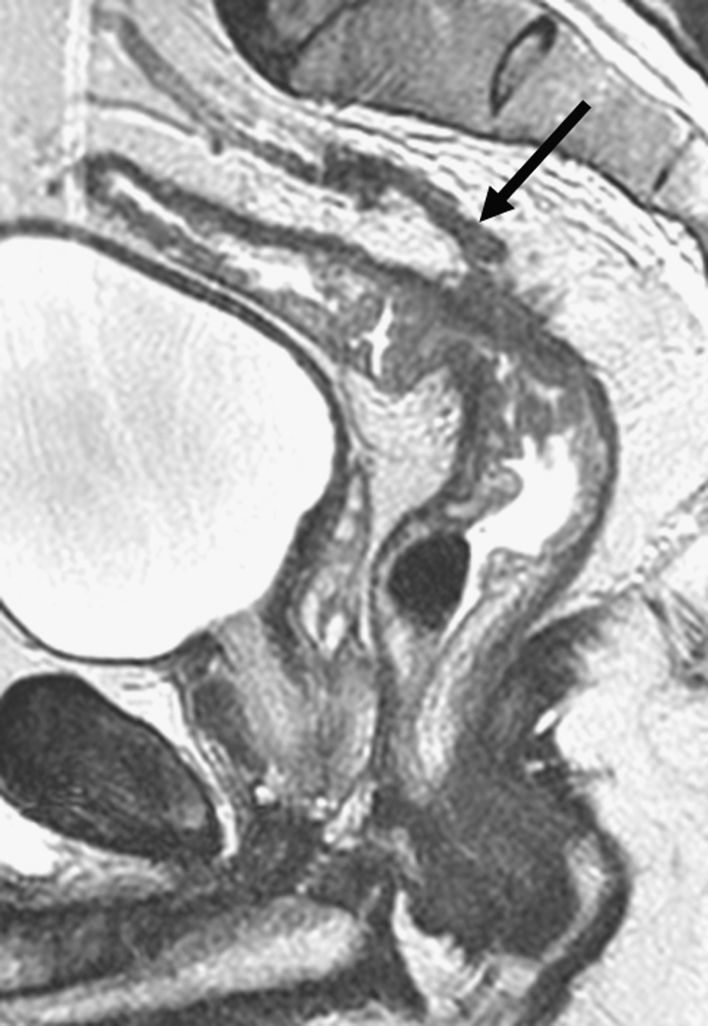
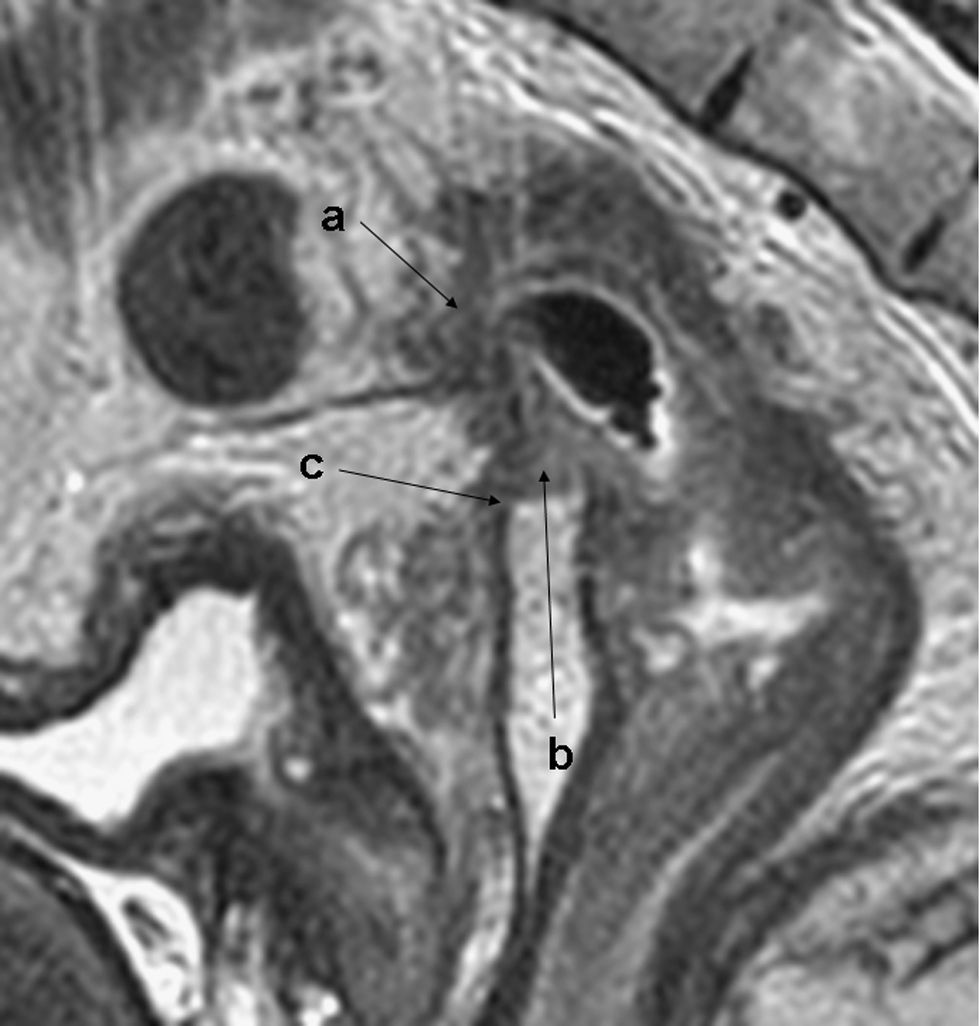
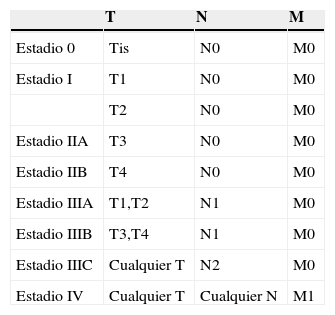
El cáncer de recto es una neoplasia con elevada incidencia en nuestro medio. Las distintas opciones terapéuticas que podrán aplicarse en cada caso van a depender fundamentalmente de la extensión que presente el tumor en el momento del diagnóstico. Por esto, los radiólogos tenemos un papel central en su tratamiento. En el presente texto se discuten la técnica radiológica óptima, algunos aspectos anatómicos fundamentales y la semiología aceptada en la interpretación de los distintos estudios de imagen que se realizan a estos pacientes, además de su rendimiento, y una visión general del pronóstico y de las distintas opciones terapéuticas. Su conocimiento es muy útil para participar en equipos formados por diferentes especialistas y comprender la trascendencia de la información aportada por la interpretación de los estudios que realizamos a estos pacientes.
Rectal cancer has a high incidence in our area. The different treatment options that can be used in each case depend fundamentally on the extension of the tumor at the time of diagnosis. Thus, radiologists have a central role in the management of this disease. We discuss the optimum imaging technique for staging rectal cancer, some fundamental histological aspects, and the accepted semiology in the interpretation of different imaging studies carried out in these patients, as well as the diagnostic performance of each technique. We provide a general overview of the prognosis and different treatment options. This knowledge is very useful for radiologists participating in multidisciplinary teams and for understanding the transcendence of the information provided by image interpretation in these patients.
Artículo
Comprando el artículo el PDF del mismo podrá ser descargado
Precio 19,34 €
Comprar ahora