En las exploraciones radiológicas abdominales, algunas anomalías del desarrollo, como el bazo accesorio periesplénico, son fácilmente reconocibles debido a su elevada incidencia. Sin embargo, otras menos frecuentes, como el bazo accesorio intrapancreático, la fusión esplenopancreática o esplenogonadal, la heterotaxia y el bazo errante, así como anomalías adquiridas como la esplenosis, pueden plantear dificultades diagnósticas. El propósito de nuestra revisión es mostrar los hallazgos radiológicos y el diagnóstico diferencial de dichas anomalías esplénicas poco habituales.
In imaging studies, some developmental anomalies such as perisplenic accessory spleen are easily recognizable due to their high incidence. However, other, less common anomalies such as intrapancreatic accessory spleen, splenopancreatic fusion, splenogonadal fusion, heterotaxy, and wandering spleen, as well as acquired conditions such as splenosis, can pose diagnostic difficulties. This aim of this review is to show the imaging diagnosis and differential diagnoses of these uncommon splenic anomalies.
Para entender las anomalías congénitas esplénicas conviene hacer un breve recuerdo de su desarrollo embrionario, que comienza en la 5.a semana de gestación. El bazo se origina a partir del mesodermo esplácnico como un brote único o múltiple de mesénquima embrionario que posteriormente se fusiona en el interior del mesogastrio dorsal. La rotación del estómago hacia la 6.a-7.a semana desplaza el bazo desde la línea media hacia la izquierda de la cavidad abdominal. Al comienzo del 2.o mes, el mesogastrio dorsal –que evolucionará a omento mayor– se separa, lo que da lugar a los ligamentos peritoneales. Durante ese proceso el bazo continúa creciendo y permanece unido al mesogastrio dorsal mediante dichos ligamentos, que lo fijan en la primitiva cavidad abdominal y lo mantienen en su posición habitual1,2. Los ligamentos gastroesplénico, esplenorrenal y esplenocólico suelen estar presentes, excepto en el bazo errante, mientras que el esplenoomental y el esplenofrénico son inconstantes1–3. Durante el periodo fetal, el bazo a menudo tiene una superficie lobulada que desaparece a lo largo del desarrollo embrionario. Dependiendo del momento del desarrollo en que se originan las anomalías darán lugar al bazo accesorio, la heterotaxia esplácnica (situs ambiguous), la fusión esplenopancreática o esplenogonadal y el bazo errante o ectópico1–5 (tabla 1). Por el contrario, la esplenosis se trata de una anomalía adquirida y tiene su origen en un autotrasplante de tejido esplénico tras traumatismo o cirugía.
Clasificación de las anomalías esplénicas según su factor causal, tamaño, localización, número y forma
| Anomalía | Factor causal | Tamaño | Localización | Número | Forma |
|---|---|---|---|---|---|
| Bazo accesorio | Fallo de fusión de primordios esplénicos en el mesogastrio dorsal | 1-3cm, puede hipertrofiarse tras esplenectomía | Más frecuente periesplénico 2.ª localización intrapancreático Muy infrecuente: a cualquier nivel en el abdomen | 1-6 | Redondeados, con hilio |
| Fusión esplenogonadal | Migración de células esplénicas al ligamento diafragmático izquierdo creado a partir del mesonefros craneal | Canal inguinal, escroto, teste | 1 | Continua: conexión del bazo y gónada por un cordón de tejido esplénico o fibroso Discontinua: tejido esplénico unido a la gónada sin conexión con el bazo visceral | |
| Fusión esplenopancreática | Fusión de la cola del páncreas al hilio esplénico. Asociado a trisomía 13 y trisomía 21 | Fusión del páncreas al hilio esplénico y/o bazo accesorio Tejido esplénico intrapancreático | 1 | Fusión del páncreas al bazo con pérdida de plano divisorio entre ambos | |
| Poliesplenia | Secundario a situs ambiguous o heterotaxia que es un fallo para establecer la asimetría izquierda-derecha | 1-6 cm | Hipocondrio derecho/izquierdo A lo largo de la curvatura mayor gástrica | 2-16 | Redondeados, de distintos tamaños |
| Bazo errante | Desarrollo anormal de partes del mesogastrio dorsal entre el bazo y la pared abdominal posterior. Laxitud ligamentaria | Posible esplenomegalia si hay torsión intermitente o aguda | Vacío izquierdo, pelvis menor | 1 | Orientación anormal en hipocondrio izquierdo Ausencia de bazo en su localización habitual Forma de coma en abdomen o pelvis |
| Esplenosis | Autotrasplante secundario a rotura esplénica por traumatismo cerrado o penetrante o a cirugía | <3 cm | Cualquier parte del abdomen | Numerosos (hasta 400) | Oval, redondeado, sésil o pedunculado, sin hilio |
El bazo accesorio (BA) es el resultado del fallo en la fusión de los brotes de mesodermo esplácnico en el interior del mesogastrio dorsal1,2,6–8.
La incidencia de BA se describe entre el 10% y el 40% de las autopsias, y entre el 45% y el 65% de los esplenectomizados6,7,9. En los estudios de imagen suele ser un hallazgo incidental. Lo más habitual es que sea solitario, aunque en el 10% de los casos es múltiple, en general en número menor de tres y excepcionalmente mayor de seis1,2,6–8. Desde el punto de vista morfológico y funcional, el BA es idéntico al bazo principal. Suele medir entre 1,5cm y 3cm de diámetro. Tienen hilio, su aporte sanguíneo generalmente es de la arteria esplénica, y su drenaje, a la vena esplénica8. Pueden hipertrofiarse tras la esplenectomía del bazo principal1,2,7,9 (fig. 1).
El bazo accesorio puede asentar a cualquier nivel en el abdomen, más frecuentemente en el hilio esplénico (75-80% de los casos), seguido de la cola pancreática (17%) y en orden decreciente en omento mayor, ligamentos gastroesplénico y esplenocólico, mesenterio, pared gástrica y de intestino delgado, suprarrenal, ovario y escroto6,9.
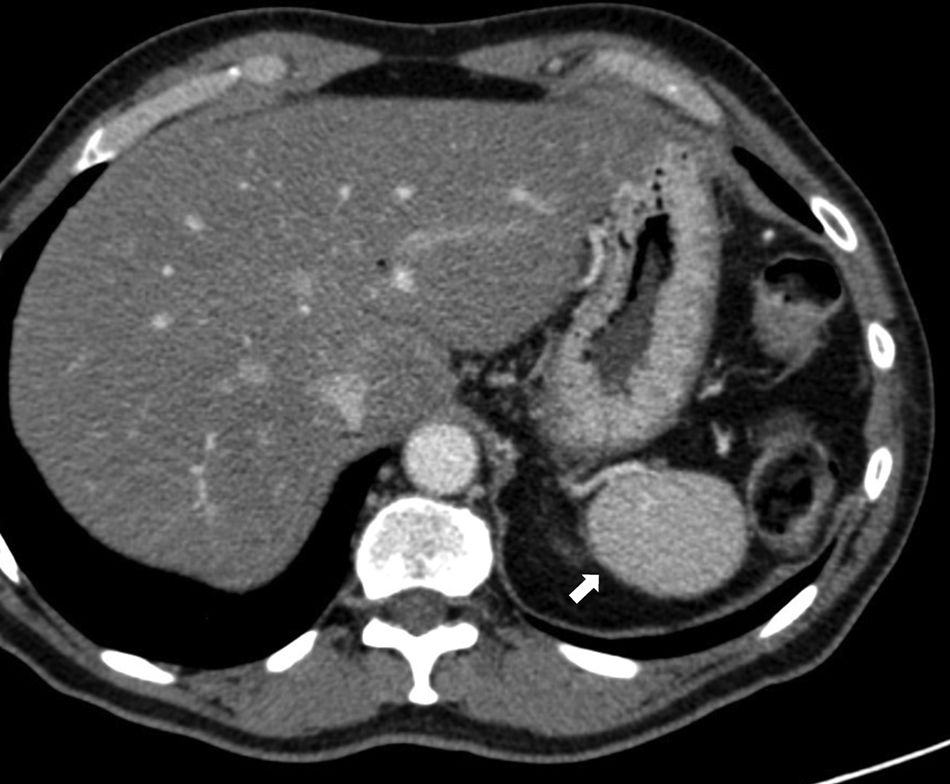
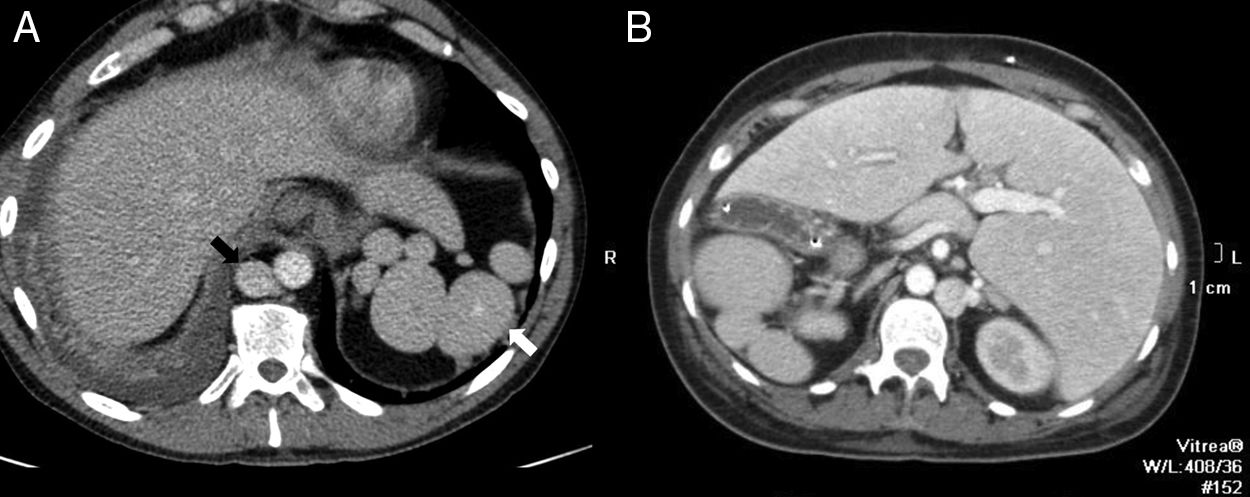
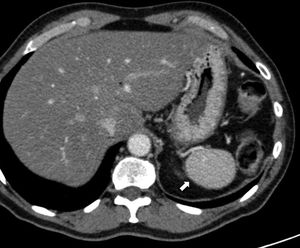
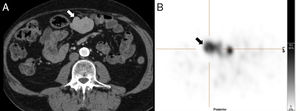
Aunque el diagnóstico del BA periesplénico no suele plantear dudas, un aneurisma de la arteria esplénica puede confundirse con un BA; sin embargo, en el aneurisma, la atenuación va a ser superponible a la de los vasos arteriales adyacentes en todas las fases (fig. 2).
Varón de 64 años en estudio por test de sangre oculta en heces positivo. Tomografía computarizada con contraste intravenoso en fase arterial (A) que muestra pequeño nódulo hipervascular anterior al margen de la cola pancreática distal. La lesión es hiperdensa con respecto al bazo en la fase mostrada. La gammagrafía con hematíes desnaturalizados marcados con tecnecio-99m (B) muestra la ausencia de captación del isótopo por parte del nódulo. Corresponde a un aneurisma de la arteria esplénica (nótese la atenuación similar a la aorta).
Debe recordarse que cuando el BA asienta en localizaciones poco habituales puede confundirse con adenopatías, metástasis hipervasculares o tumores primarios1,2,6–16.
El bazo accesorio intrapancreático (BAI), cuya detección ha aumentado por la mejor resolución de los equipos radiológicos y por el mayor número de exploraciones14, tiene especial relevancia, ya que es la segunda localización en frecuencia del BA y plantea diagnóstico diferencial con el tumor neuroendocrino y con la metástasis hipervascular.
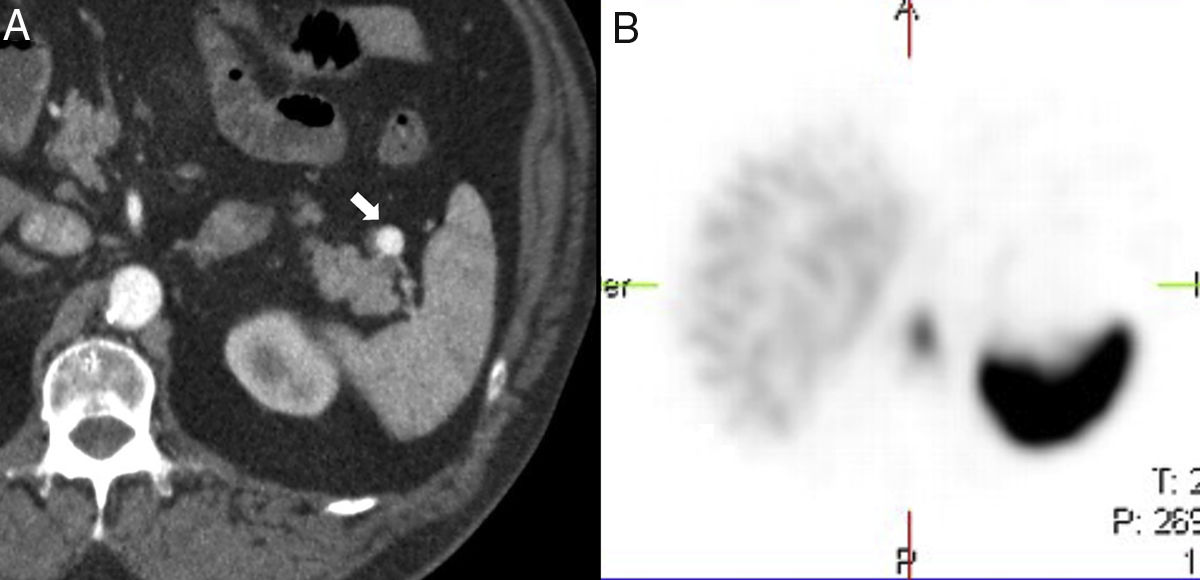
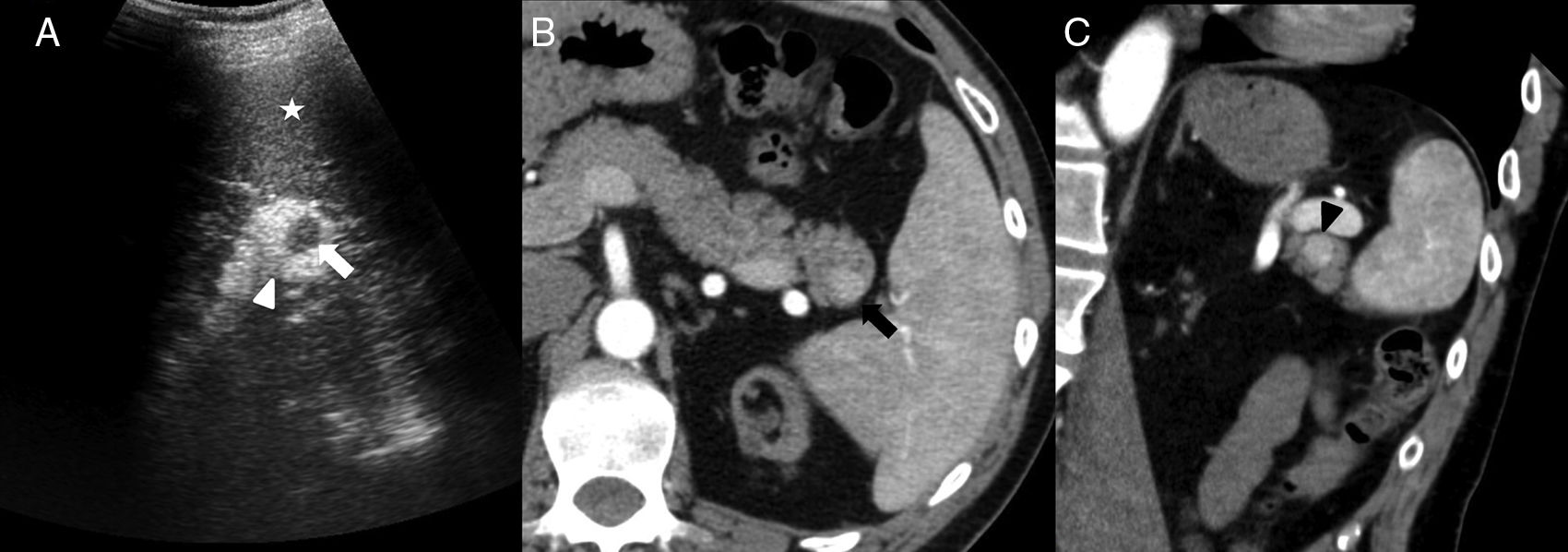
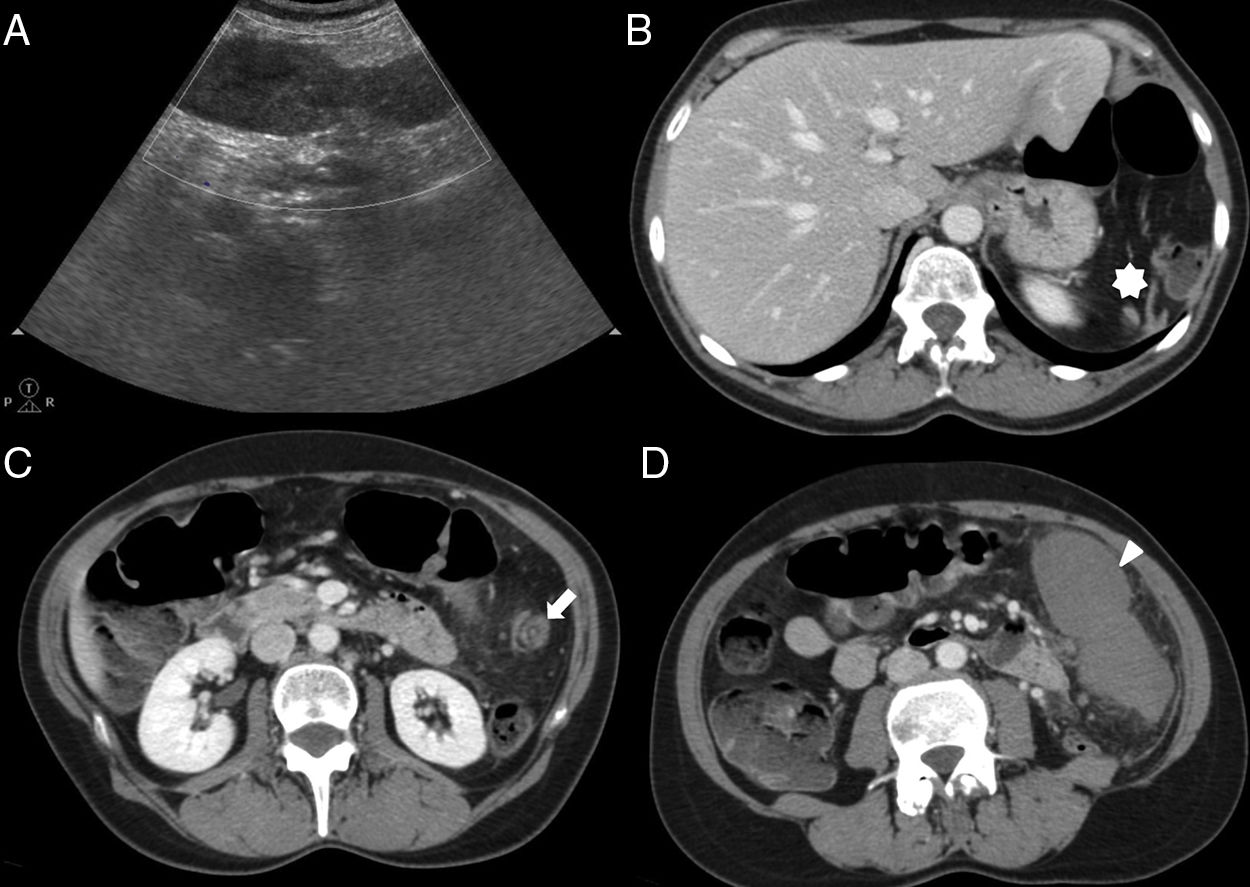
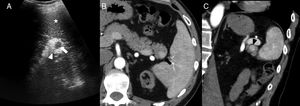
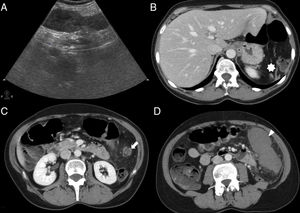
En ecografía modo B, el BAI se presenta como un nódulo redondeado homogéneo, isoecogénico al bazo (fig. 3), que puede mostrar refuerzo posterior6. Con modo Doppler, la demostración de un hilio vascular, que puede identificarse mejor en ecografía con contraste, favorece su diagnóstico6.
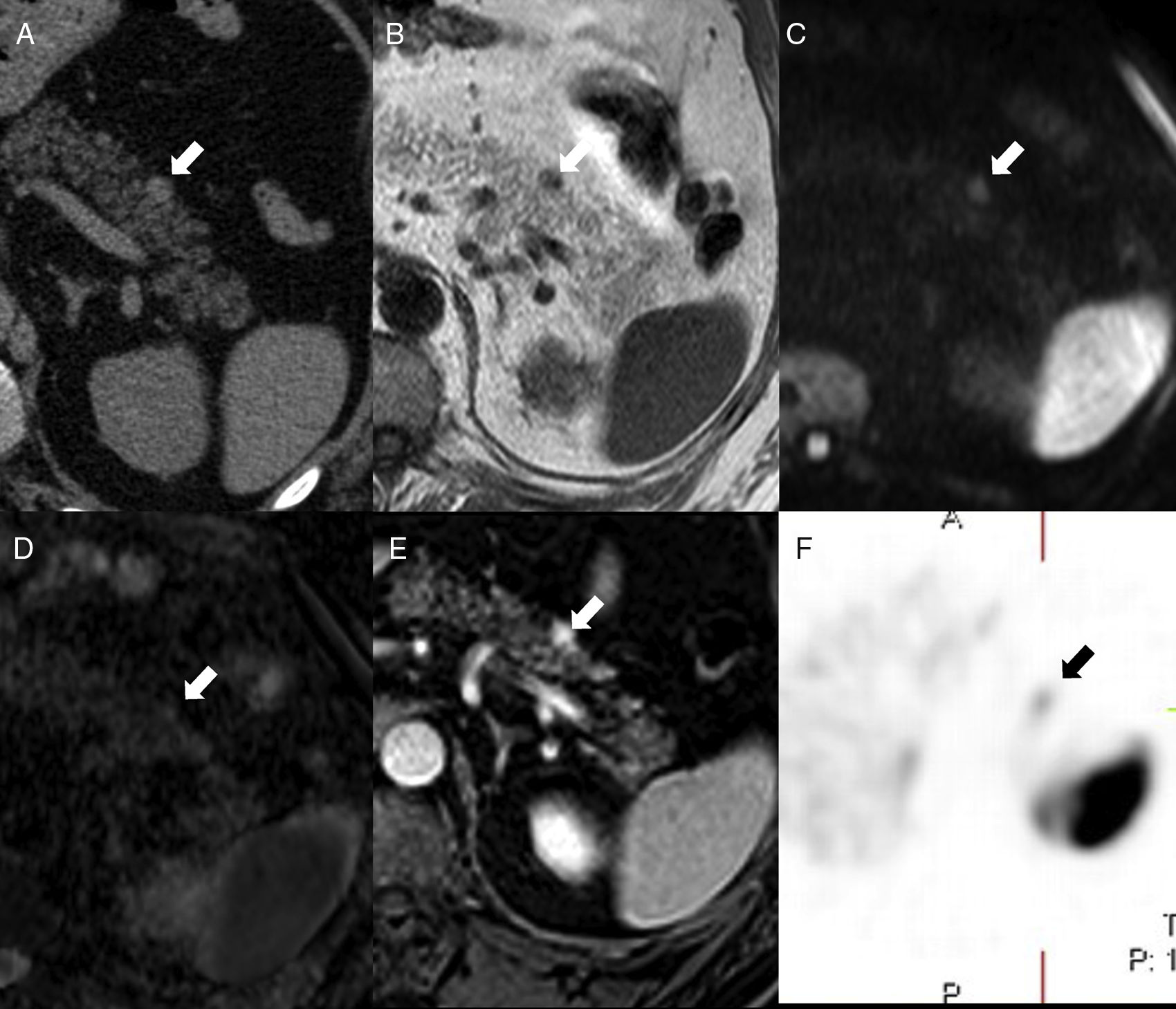
Varón de 40 años con insuficiencia renal crónica por la que se le realiza ecografía. Imagen ecográfica longitudinal (A) en hipocondrio izquierdo que muestra nódulo hipoecogénico (flecha blanca) en la cola del páncreas hiperecogénica (cabeza de flecha blanca). Obsérvese cómo el nódulo es isoecoico con respecto al bazo (asterisco). Tomografía computarizada (TC) con contraste intravenoso en fase arterial (B) que muestra un nódulo hipervascular (flecha negra) en el extremo de la cola pancreática, isodenso al bazo, concordante con bazo accesorio intrapancreático. Reconstrucción coronal oblicua de TC (C) con contraste en fase arterial que muestra un patrón de realce arciforme en el bazo accesorio intrapancreático (cabeza de flecha negra) similar al del bazo.
En tomografía computarizada (TC) con contraste, la atenuación del BAI en todas las fases es igual a la del bazo principal y mayor que la del páncreas (fig. 3). Esta característica ayuda en el diagnóstico diferencial con el tumor neuroendocrino pancreático, que a menudo es isoatenuante o incluso lava el contraste con respecto al páncreas durante la fase venosa del estudio6. No obstante, en casos en que el realce esplénico está retrasado –como en la cirrosis hepática– la atenuación del BAI puede ser menor que la del páncreas durante las fases arterial y pancreatográfica6.
El realce arciforme esplénico en fase arterial (fig. 3) también puede presentarse en el BAI, lo que facilita diferenciarlo del tumor neuroendocrino pancreático. No obstante, el tamaño a veces excesivamente pequeño de la lesión limita la identificación de dicho realce característico. También puede dificultar la comparación de atenuación entre el BAI y el bazo principal.
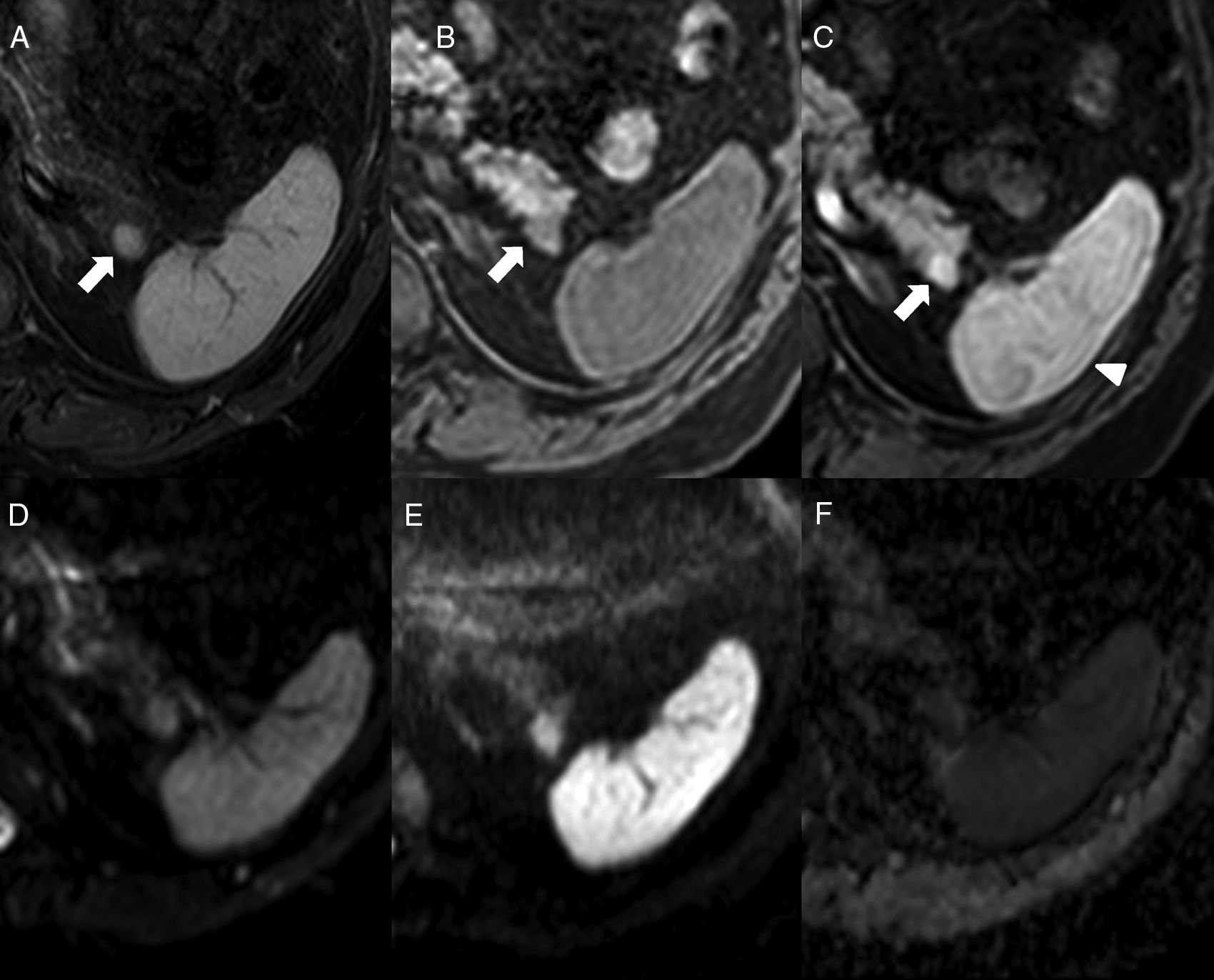
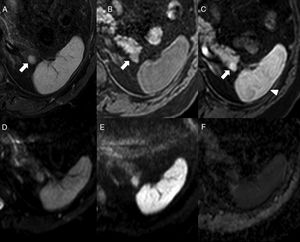
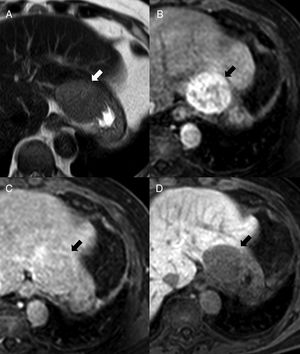
En resonancia magnética (RM), el BAI es hipointenso respecto al parénquima pancreático circundante en T1 e hiperintenso en T2, con una intensidad de señal superponible a la del bazo principal en todas las secuencias de RM6,9 (fig. 4), que resulta clave para su diagnóstico. Sin embargo, puede haber excepciones: ocasionalmente el BAI puede ser hiperintenso con respecto al bazo principal en FSE-T2, lo que se debe a que la pulpa blanca, que es la que aporta mayor intensidad de señal en T2 por la acumulación de agua en los folículos linfoides, posee en el BAI una ratio con la pulpa roja a menudo superior que en el bazo principal. Se ha descrito que el tumor seudopapilar y sólido puede mostrar una intensidad de señal en todos los valores de b en difusión y en el mapa ADC, indistinguibles de los del bazo principal, aunque con distinto comportamiento en el estudio dinámico9. Por otra parte, el tumor neuroendocrino pancreático tiene valores de ADC significativamente mayores que el BAI, lo que resulta de utilidad en el diagnóstico diferencial entre ambos17.
Varón de 64 años con espondilitis anquilosante. Resonancia magnética abdominal que muestra nódulo isointenso al bazo en STIR (A), en secuencia T1-THRIVE previa a la administración de contraste (B) y en estudio poscontraste en la fase arterial (C) (obsérvese el realce arciforme del bazo, cabeza de flecha). En las secuencias de difusión (D: b0, E: b1000 y F: mapa ADC), la intensidad del nódulo es paralela a la del bazo. Corresponde a un bazo accesorio intrapancreático.
Debe recordarse que la intensidad de señal del BAI respecto a la del bazo principal es superponible en todas las secuencias de RM, incluyendo el estudio dinámico6,9 (fig. 5).
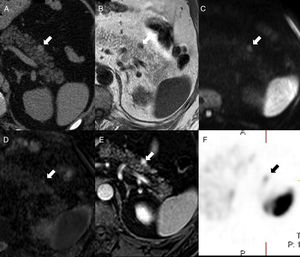
Varón de 52 años con antecedentes de artritis gotosa. La tomografía computarizada sin contraste (A) muestra un pequeño nódulo (flecha) en la cara anterior de la cola del páncreas, hiperdenso en comparación con el parénquima pancreático e isodenso con el bazo. En la resonancia magnética, el nódulo es isointenso al bazo en T1 (B), difusión (b1000, C) y mapa ADC (D). T1-THRIVE posgadolinio en fase de equilibrio (E) que exhibe la pequeña lesión de la cola pancreática con mayor realce que el bazo. In-111-pentreotide (Octreoscan) (F) muestra una captación focal débil en el lugar de la lesión, lo que la hace compatible con tumor neuroendocrino.
El BAI se localiza con más frecuencia en la cola del páncreas, sobre todo a nivel distal y dorsal, por lo que una lesión pancreática en otras localizaciones es poco probable que se trate de un bazo accesorio8 (fig. 5).
Ante la sospecha de BAI o esplenosis pueden ser útiles otras pruebas como la gammagrafía/tomografía por emisión de fotón único con hematíes desnaturalizados o con sulfuro coloide, ambos marcados con Tc-99m6,10,13. Estas técnicas aprovechan la acción del sistema reticuloendotelial al destruir el coloide o los hematíes dañados, de igual forma que el bazo se deshace fisiológicamente de los hematíes defectuosos. La limitación de esta técnica es la mala definición que muestra la captación en las imágenes planares y una menor resolución espacial que los estudios radiológicos, por lo que se utilizan en combinación6,10.
Por el contrario, las técnicas basadas en los receptores o los análogos de la somatostatina son menos fiables, dado que estos receptores están en la superficie tanto de las células tumorales como de los linfocitos esplénicos11,13,15,16.
Cuando los estudios no invasivos no son suficientes para alcanzar el diagnóstico, se puede realizar punción aspirativa con aguja fina guiada por ecoendoscopia o por TC. Sin embargo, el tamaño o la localización de la lesión pueden impedir que esta sea accesible al procedimiento12,14.
HeterotaxiaLa heterotaxia esplácnica consiste en una alteración en la disposición de las vísceras y las estructuras vasculares, a diferencia de la situación ordinaria de los órganos propia del situs solitus o la localización en imagen especular del situs inversus1. Se debe a un fallo en el desarrollo embriológico para establecer la normal asimetría izquierda-derecha. Se desconocen sus causas, aunque se supone que están implicadas ciertas mutaciones genéticas1,2.
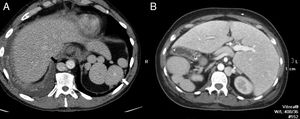
Debe recordarse que la heterotaxia asocia dos tipos de anomalía esplénica: la asplenia y la poliesplenia. La asplenia, también conocida como síndrome de Ivemark, en la que las pruebas de imagen mostrarán ausencia del bazo, y la poliesplenia1, una entidad infrecuente en la que se encuentran múltiples bazos pequeños. Se pueden contabilizar hasta 16 bazos, habitualmente localizados en la curvatura mayor gástrica2. En el contexto de los síndromes de heterotaxia, la poliesplenia suele asociarse a otras anomalías congénitas como agenesia o hipoplasia de la vena cava inferior, malrotación intestinal o agenesia del páncreas dorsal2 (fig. 6).
Varón de 51 años en estudio por masa pulmonar. Tomografía computarizada con contraste intravenoso (A) que muestra hallazgos del síndrome de heterotaxia: poliesplenia en hipocondrio izquierdo (flecha blanca) y ausencia del segmento intrahepático de la vena cava inferior, suplida por la vena ácigos (flecha negra). Mujer de 37 años en estudio por cuadro suboclusivo (B) con síndrome de heterotaxia más situs inversus, con imagen en espejo en la localización de poliesplenia y vena ácigos hipertrofiada respecto al caso A.
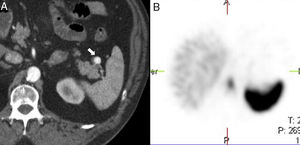
La esplenosis es una entidad benigna, que se debe al autotrasplante de tejido esplénico ectópico sobre las superficies vascularizadas intra y extraperitoneales tras una lesión esplénica por traumatismo cerrado, herida por arma blanca o de fuego, o tras esplenectomía7 (fig. 7). El tiempo promedio entre el traumatismo y la aparición de esplenosis abdominal es de 10 años, con un rango entre 5 meses y 32 años7. Los focos de esplenosis, a diferencia del BA, carecen de hilio, tienen una arquitectura más distorsionada y una cápsula menos formada, y su vascularización es a expensas de arterias locales que penetran su cápsula2,18. Mayoritariamente, la siembra de tejido esplénico se hace por contigüidad siguiendo rutas anatómicas naturales o artificiales causadas por el propio trauma19. En una minoría, la diseminación es hematógena como en el caso de la esplenosis hepática o cerebral, esta última excepcional19.
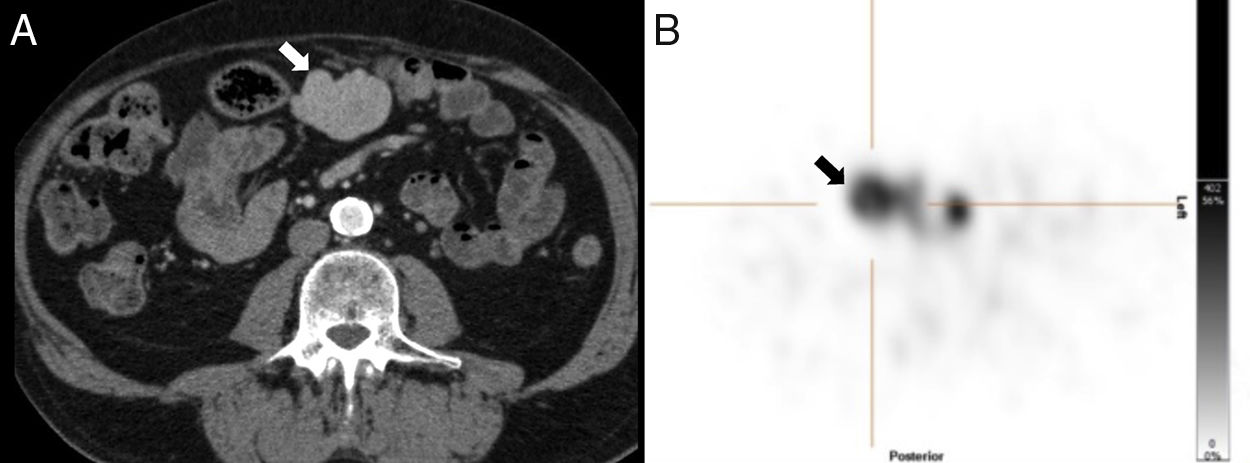
Varón de 70 años con antecedente de esplenectomía 20 años antes. En ecografía (no mostrada) se detecta un nódulo mesentérico sólido, homogéneo, de 4,7cm. La tomografía computarizada con contraste (A) realizada para caracterizar dicho nódulo muestra una lesión mesentérica centroabdominal con realce homogéneo. La gammagrafía con hematíes desnaturalizados marcados con tecnecio-99m (B) muestra una captación intensa de la lesión. Tras resección se confirmó el diagnóstico de esplenosis.
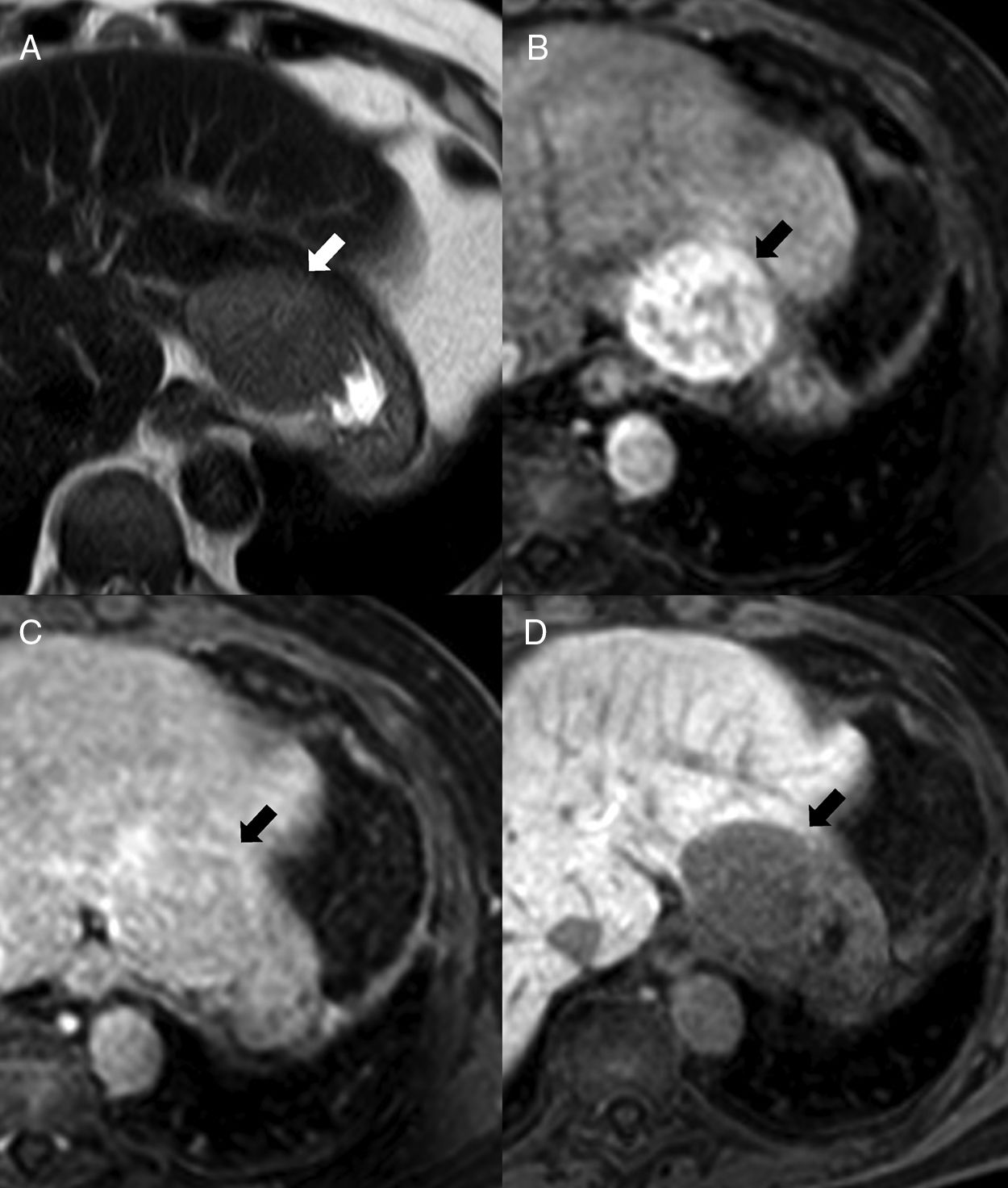
Habitualmente se limita a la cavidad abdominopélvica, y la mayor parte de los implantes asientan en el cuadrante superior izquierdo del abdomen. Sus localizaciones más comunes en orden decreciente son: superficie serosa del intestino delgado, omento mayor, peritoneo parietal, superficie serosa del colon, mesenterio y diafragma. La esplenosis hepática es muy infrecuente y si se presenta en hígado cirrótico plantea diagnóstico diferencial con hepatocarcinoma por sus características de realce poscontraste7,20–22 (fig. 8). Otras localizaciones poco comunes son el eje celíaco, la gotiera parietocólica derecha, páncreas, estómago, vesícula biliar, apéndice, riñones, uréteres, omento menor, útero, vejiga o trompas uterinas. En casos de traumatismo toracoabdominal con rotura diafragmática puede existir esplenosis torácica, incluso con afectación del pericardio, acompañando a la esplenosis abdominal7. Es muy infrecuente la esplenosis cutánea, que puede deberse a heridas penetrantes19. Existe un caso descrito de esplenosis cerebral en lóbulo occipital19.
Varón de 55 años con cirrosis hepática y esplenectomía. En ecografía de cribado de hepatocarcinoma por su enfermedad (imágenes no mostradas) se identifica una masa de 5cm en el lóbulo hepático izquierdo. En resonancia magnética, la lesión, medial al estómago, es hiperintensa en T2 (A), hipervascular heterogénea en fase arterial después de la administración de gadolinio intravenoso (B) y discretamente hipointensa en fase de equilibrio (C) parcialmente rodeada por una cápsula delgada. La lesión se muestra hipointensa en la fase hepatocelular después de la administración de ácido gadoxético (D). La sospecha diagnóstica preoperatoria era de hepatocarcinoma, pero después de la resección se confirmó que se trataba de una esplenosis intrahepática.
Aunque la esplenosis abdominal frecuentemente es asintomática, también puede presentarse con hemorragia, dolor por infarto o torsión y obstrucción del tracto intestinal o urinario. Igual que sucede con el BA, puede confundirse con enfermedad tumoral primaria o mestastásica, linfoma y endometriosis20. El diagnóstico de esplenosis requiere un alto índice de sospecha, por lo que es importante recoger en la anamnesis cualquier antecedente de lesión esplénica7,20.
Debe recordarse que la batería de pruebas diagnósticas utilizada para detectar la esplenosis es la misma que en el caso del BA, y ambas entidades son distinguibles por la historia clínica del paciente, la localización, el número, tamaño, forma y patrón de vascularización.
Bazo erranteEl bazo errante o ectópico es una rara variante que resulta de la ausencia o de una anómala laxitud de los ligamentos que sujetan el bazo en su posición normal. Esta alteración puede ser tanto adquirida como congénita, y en este ũltimo supuesto asocia un largo pedículo vascular, que puede favorecer la torsión e infarto4.
Cuando no existe complicación aguda, se cree que hasta el 50% de los casos pueden permanecer no diagnosticados2.
En ecografía y TC, los hallazgos incluyen un bazo en localización ectópica o con una orientación anormal en el cuadrante superior izquierdo. A menudo se identifica como una masa abdominal con forma de “coma”, en ausencia de bazo en el cuadrante superior izquierdo (fig. 9).
Mujer de 55 años con dolor abdominal intenso y fiebre. El corte de ecografía longitudinal a través del flanco izquierdo (A) muestra una estructura sólida, discretamente heterogénea y sin señal Doppler color en su interior. Tomografías computarizadas con contraste axial (B, C y D) que muestran la torsión de un bazo errante. Hay ausencia del bazo en el hipocondrio izquierdo (asterisco en B), los vasos esplénicos (no rellenos de contraste) forman un “remolino” en el flanco izquierdo (flecha blanca en C) y el bazo no captante se desplaza caudalmente (cabeza de flecha en D). La esplenectomía confirmó la torsión del pedículo vascular de un bazo errante asociado a un infarto hemorrágico del órgano.
Debe recordarse que la torsión del pedículo vascular puede conducir tanto al infarto esplénico como a la trombosis venosa o a ambos. Estos se manifiestan como un remolino vascular con ingurgitación, hiporrealce del parénquima o de los vasos, ascitis o hemoperitoneo y estriación de la grasa periesplénica3–5.
El tratamiento es esplenectomía en los pacientes sintomáticos en los que hay infarto esplénico, mientras que en los asintomáticos y en aquellos con torsión del pedículo vascular sin infarto asociado se realiza esplenopexia3–5.
Fusión esplenovisceralLa fusión esplenogonadal es una rara anomalía congénita consistente en la fusión entre una porción del bazo y una gónada. Predomina en varones y puede ser continua (conexión anatómica directa entre el bazo y la gónada por el cordón esplénico) o discontinua (sin conexión entre el bazo y la gónada, pero con tejido esplénico ectópico encapsulado en el interior de esta)1.
La fusión esplenopancreática se asocia en la mayoría de los casos a trisomía de los cromosomas 13 y 21. Se caracteriza por la fusión de la cola del páncreas al hilio esplénico y/o a un bazo accesorio con pérdida de plano divisorio entre estas estructuras1.
ConclusiónLas anomalías esplénicas del desarrollo menos habituales, y otras adquiridas como la esplenosis, pueden plantear dificultades diagnósticas o confundirse con otras entidades, lo que puede inducir a procedimientos terapéuticos innecesarios. Para su diagnóstico es de utilidad recordar el desarrollo embriológico del bazo. En el caso del bazo accesorio es útil comparar su comportamiento en las distintas técnicas de imagen con el del bazo principal, ya que habitualmente se comportan de forma similar. Valorar la posibilidad de esplenosis ante antecedentes de traumatismo cerrado o laceración esplénica. Conocer estas entidades es clave para evitar errores diagnósticos.
Autoría- 1.
Responsables de la integridad del estudio: BVS, MJP y DRV.
- 2.
Concepción del estudio: BVS, DRV y MJP.
- 3.
Diseño del estudio: BVS, DRV y MJP.
- 4.
Obtención de los datos: BVS, MJP y DRV.
- 5.
Análisis e interpretación de los datos: BVS, MJP y DRV.
- 6.
Tratamiento estadístico: No aplicable.
- 7.
Búsqueda bibliográfica: BVS, MJP y DRV.
- 8.
Redacción del trabajo: DRV, BVS y MJP.
- 9.
Revisión crítica del manuscrito con aportaciones intelectualmente relevantes: BVS, MJP y DRV.
- 10.
Aprobación de la versión final: MJP, BVS y DRV.
Los autores declaran no tener ningún conflicto de intereses.