Las células madre se caracterizan por su capacidad de renovarse, dar origen a nuevas células en tejidos específicos, y mantener esta capacidad a lo largo de toda la vida del anfitrión. Las células madre son pluripotenciales y mantienen una producción continua de neuronas, astrocitos y oligodendrocitos. Las células madre en los tumores cerebrales también proliferan, se renuevan y dan origen a otras células pobremente diferenciadas. La diferencia entre células madre no tumorales y tumorales reside en que estas últimas carecen de los mecanismos normales que regulan la proliferación y diferenciación, resultando en una producción incontrolada y en una diferenciación incompleta de células tumorales. Descubrir el papel que juegan las células madre tumorales en el cerebro nos ha proporcionado una nueva perspectiva con respecto a las vías de señal moleculares y a la oncogénesis en el sistema nervioso central, y puede ayudarnos a explicar el alto número de recurrencias en algunos tumores y la naturaleza difusa de los glioblastomas; idealmente, puede esperarse que esta perspectiva conduzca a mejores tratamientos.
Este artículo revisa las características de las células madre no tumorales y tumorales, con énfasis en la importancia que las células madre tumorales cerebrales tienen en la patogénesis de neoplasias cerebrales comunes.
Stem cells are characterized by their capacity for self-renewal, for giving rise to new cells in specific tissues, and for maintaining this capacity throughout the entire life of their host. Stem cells are pluripotent and maintain continuous production of neurons, astrocytes, and oligodendrocytes. Stem cells in brain tumors also proliferate, undergo self-renewal, and give rise to other poorly differentiated cells. Unlike non-tumor stem cells, tumor stem cells lack the normal mechanisms that regulate proliferation and differentiation, resulting in uncontrolled production and incomplete differentiation of tumor cells. Discovering the role of tumor stem cells in the brain has given us a new perspective about the molecular pathways involved in signaling and about oncogenesis in the central nervous system; it can also help us explain the high rate of recurrence of some tumors and the diffuse nature of glioblastomas. Ideally, this perspective can be expected to lead to better treatments.
This article reviews the characteristics of non-tumor and tumor stem cells, emphasizing the importance of brain tumor stem cells in the pathogenesis of common brain tumors.
En el ser humano adulto se han aislado células madre que gracias a su poder de autorrenovación y diferenciación mantienen la producción continua de células diferenciadas en diferentes tejidos y órganos. Existen también células madre tumorales, con una capacidad exagerada de proliferación y diferenciación incompleta que están implicadas en la oncogénesis y quimiorresistencia de diversos tumores como los tumores cerebrales. Es por ello necesario el conocimiento de estos conceptos y mecanismos para su aplicación en métodos diagnósticos innovadores y nuevas estrategias terapéuticas.
Células madreLa célula es la unidad estructural, morfológica y funcional del ser vivo. Debido a que los organismos viven más que sus células diferenciadas, es necesaria la regeneración de sus tejidos y órganos. Las células madre reemplazan esta pérdida celular con nuevas células gracias a su poder de autorrenovación, y son una fuente constante de precursores primitivos de los tejidos y órganos.
Las células madre se definen por el órgano del que se derivan o por el lugar donde se observan en vivo.
La definición de célula madre incluye tres características1,2:
- –
Autorrenovación.
- –
Capacidad de producción de todos los tipos de células en un determinado tejido.
- –
Capacidad de mantener la producción durante un largo período de la vida del anfitrión.
Las células madre pueden ser totipotentes, pluripotentes, multipotentes, oligopotentes y unipotentes3. Las células totipotentes son capaces de formar un organismo completo. La totipotencia se ve en el cigoto y en sus primeras divisiones y en las células de meristemas de algunas plantas. Las células pluripotentes son capaces de formar todos los linajes de células del cuerpo, pero no pueden formar un organismo completo. La mayoría de células madre entran en esta categoría. Un ejemplo son las células madre embrionarias, que se encuentran en la masa celular interna del blastocisto y existen durante un corto tiempo en el desarrollo embrionario. Las células hematopoyéticas son células multipotentes, lo cual significa que pueden formar linajes múltiples que constituyen todo un tejido o tejidos. Las células oligopotentes son capaces de formar dos o más linajes dentro de un tejido, como una célula madre neural, que puede crear un subconjunto de neuronas y las células unipotentes que forman un único linaje como las espermatogonias. Las células madre se encuentran en el huevo fertilizado, en el blastocisto, en el trofoblasto placentario, en células embrionarias, y en tejidos como el tejido hematológico y ciertas áreas del sistema nervioso central (SNC) adulto.
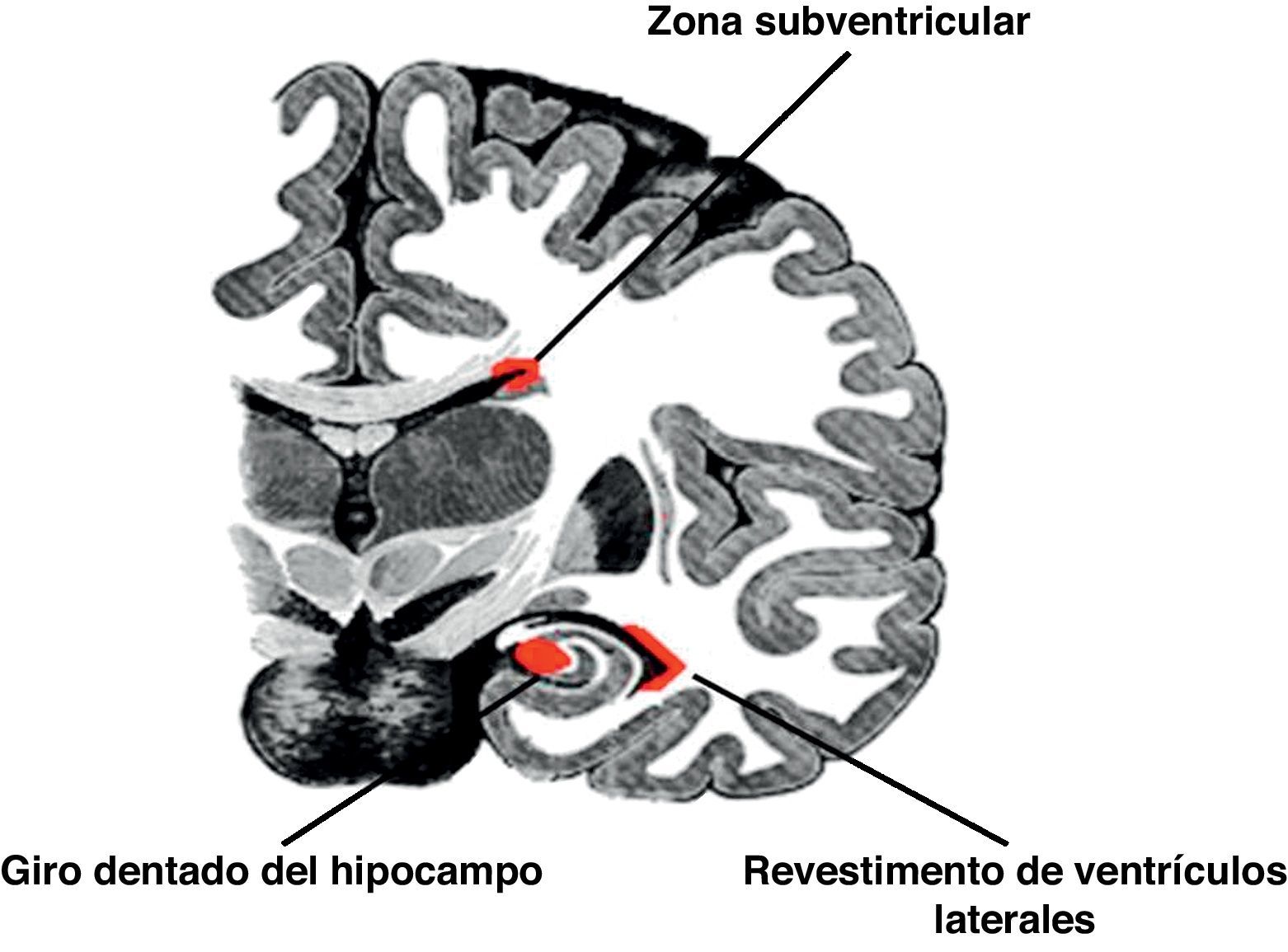
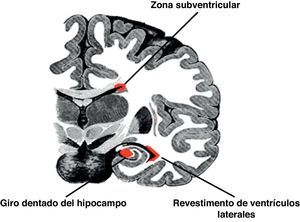
Células madre neuralesLas células madre neurales poseen el poder de autorrenovación, son multipotentes, y mantienen una producción continua de neuronas, astrocitos y oligodendrocitos en el sistema nervioso4. Se supone que la neurogénesis es una actividad constante a lo largo de la vida, por lo que la teoría tradicional de que «no se generan neuronas nuevas» es obsoleta. Curiosamente, la neurogénesis continúa en el cerebro adulto en zonas discretas, como la región anterior de la zona subventricular (ZSV), la zona subependimal, el revestimiento de los ventrículos laterales, la zona cerebelosa periventricular, la zona subgranular (ZSG) del giro dentado del hipocampo, y la sustancia blanca subcortical5 (fig. 1). La ZSV está localizada entre el ventrículo lateral y en el cuerpo estriado. Ésta es una fuente importante de células madre neuronales, de rápida proliferación, lo que puede llevar a errores genéticos. Por tanto se cree que la ZSG puede ser una fuente de células que inicia los glioblastomas y los ependimomas.
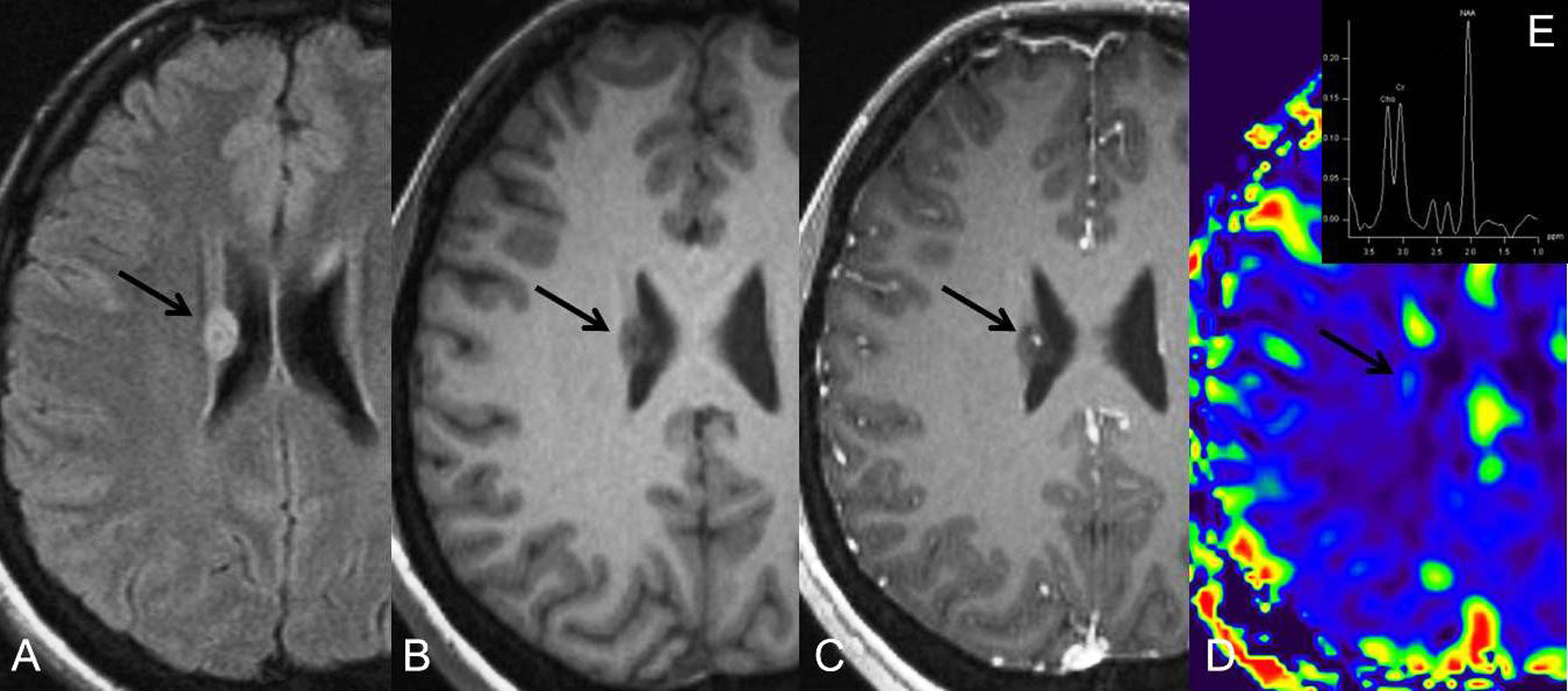
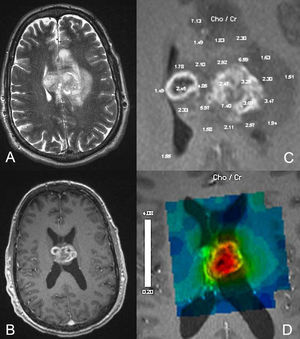
La migración y proliferación de neuroblastos de la ZSV están relacionadas con la expresión de EphB-efrina. La interferencia con la función de la EphB-efrina en la ZSV interrumpe la migración neuroblástica resultando en la proliferación y formación de pólipos. A estos pólipos, que son usualmente detectados en la RM cerebral como protuberancias de tejido de señal de intensidad normal rodeando las paredes de los ventrículos laterales, se les ha denominado pólipos hiperplásicos astrocíticos6 (fig. 2).
RM cerebral con secuencias FLAIR (A), T1 pre-contraste (B), T1 postcontraste (C), perfusión con gadolinio (D) y espectroscopia de protón por RM (E) de una lesión (flecha) adyacente al ventrículo lateral derecho con alta señal en FLAIR, sin realce postcontraste, bajo volumen sanguíneo cerebral y niveles normales de Cho/Cr and NAA/Cr, compatible con un pólipo hiperplásico astrocítico. En estos pólipos, las células madres permanecen en la zona subventricular y no migran hacia la periferia del cerebro.
Se han desarrollado diferentes métodos para aislar células madre neuronales en fetos y en adultos humanos así como en roedores7. Estas técnicas permiten obtener, manipular y transplantar células madre a seres humanos. Uchida et al. lograron aislar células madre en tejidos cerebrales frescos de fetos humanos utilizando anticuerpos contra marcadores de superficie y activación por fluorescencia. Estas células madre se identificaron por la presencia de los siguientes marcadores8: CD133+, 5E12+, CD34−, CD45−, CD24−/lo.
Las células madre neurales pueden crecer en monocapas, pero generalmente lo hacen formando pequeños cúmulos celulares (in vitro e in vivo) denominados neuroesferas. Estas neuroesferas transplantadas a animales pueden generar tanto neuronas como células gliales.
Células madre cancerígenasLas células madre normales son fenotípicamente similares a las células madre cancerígenas y comparten su habilidad de proliferar, de autorrenovarse y de proporcionar células diferenciadas. En las células madre no tumorales existen varios mecanismos que regulan su proliferación y diferenciación; sin embargo, en las células madre tumorales estos mecanismos no funcionan adecuadamente, resultando en una proliferación tumoral incontrolada y en una diferenciación incompleta.
Las células madre se regeneran generalmente a través de una división celular asimétrica en la que se genera una célula hija destinada a ser madre y otra a ser diferenciada, impidiendo así que las células madre se multipliquen. Sin embargo, las células madre pueden tener divisiones simétricas, lo que genera dos células hijas con el mismo destino9.
La capacidad de regeneración y de multiplicación es conferida por la autorrenovación simétrica, aunque ésta también implica un riesgo inherente de cáncer. La teoría según la cual la división simétrica puede conducir a un mayor riesgo de cáncer está corroborada por estudios genéticos con células madre espermatogoniales de la Drosophila10. Para la división asimétrica de estas células se requiere un gen de la poliposis adenomatosa coli, y este gen es conocido por ser un supresor tumoral. Por tanto, se cree que la división asimétrica confiere cierta protección contra el cáncer. Se han observado algunos productos genéticos que inducen la división celular simétrica y funcionan como oncogenes en células de mamíferos; este tipo de autorrenovación puede conducir a la aneuplodía, que también incrementa el riesgo de cáncer9.
Las neoplasias están constituídas por células tumorales y de estroma no tumoral. Las células madre cancerígenas (CMC) se aislaron por primera vez en cánceres hematológicos en seres humanos con solo una pequeña cantidad de células tumorales que mostraban una capacidad de autorrenovación ilimitada. El aislamiento de células madre primitivas hematológicas identificadas por marcadores clonales, proporcionó la primera evidencia convincente de la existencia de CMC en la leucemia mieloide aguda. Más recientemente se descubrieron CMC en otros tumores sólidos, incluyendo los cánceres del SNC (glioblastomas, meduloblastomas y ependimomas).
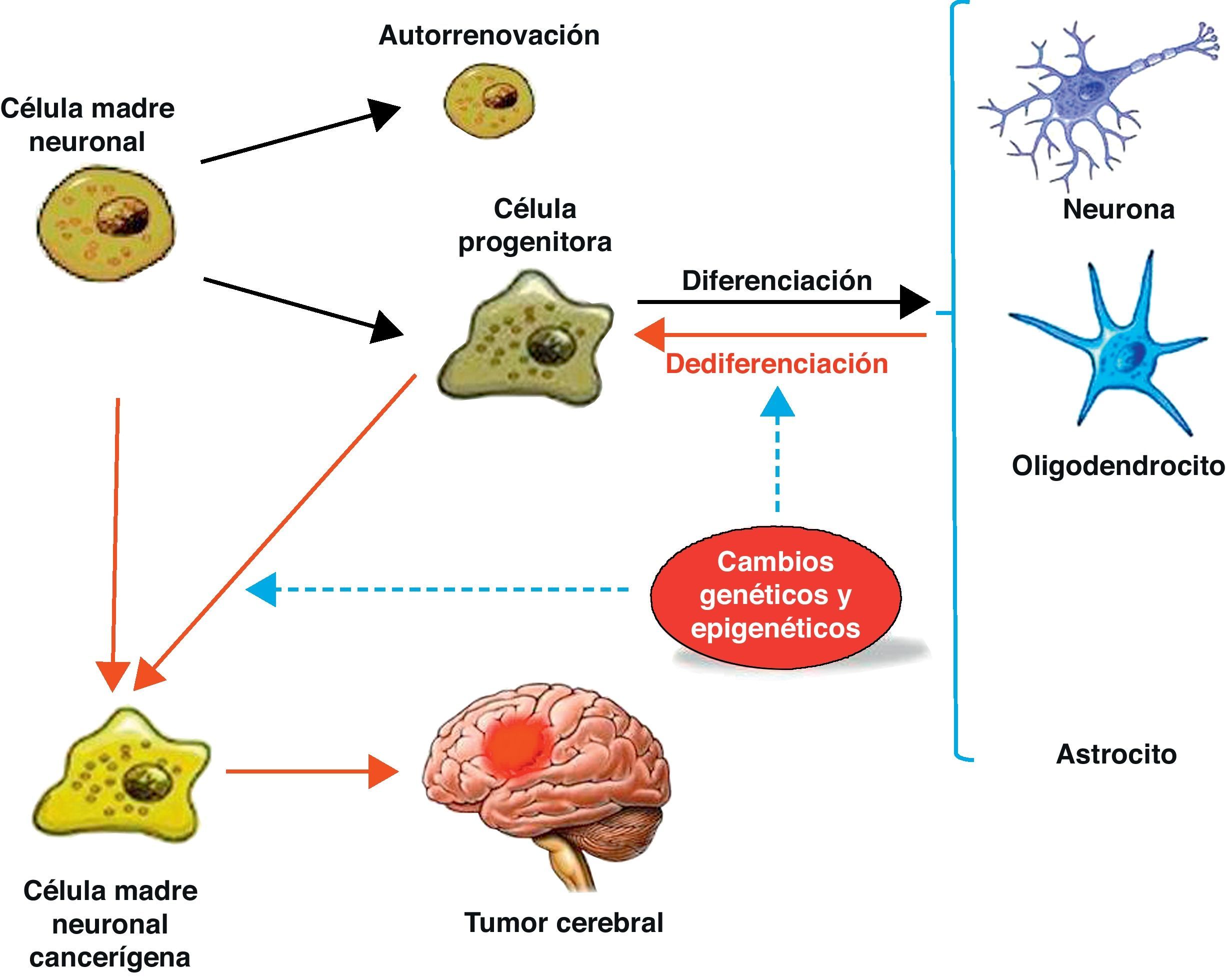
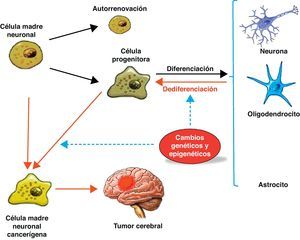
Células madre de tumores cerebralesLas células madre neurales, cuando proliferan, dan origen a las células progenitoras. Estas células progenitoras se transforman en células diferenciadas como las neuronas, astrocitos y oligodendrocitos. Las células madre y las células progenitoras pueden convertirse en células tumorales por alteraciones epigenéticas y genéticas, las cuales pueden transformar células diferenciadas en células más primitivas, y de esta forma en células tumorales11 (fig. 3).
Normalmente, las células madre neuronales, a través de una división asimétrica, originan una célula madre neuronal (autorrenovación) y una célula progenitora que se diferencia en neuronas, oligodendrocitos y astrocitos. Cambios genéticos y epigenéticos pueden conducir a las células madres neuronales y a las células progenitoras a generar células madre cancerígenas y también a la desdiferenciación de célula neuronales diferenciadas.
Las células madre cerebrales cancerígenas o tumorales se definen por su capacidad de autorrenovación, por su capacidad de iniciar tumores cerebrales en la implantación ortotópica en xenoinjertos, multipotencia, y por su capacidad de diferenciarse en células con fenotipos neuronal, astrocítico u oligodendroglial. Las células madre de los tumores cerebrales necesitan generalmente de 4 a 7 mutaciones para degenerar y dar lugar a tumores fenotípicamente diferentes.
El descubrimiento de CMC en los tumores cerebrales ha proporcionado una nueva perspectiva sobre las vías moleculares y mecanismos de la carcinogénesis en el cerebro, y sirve como una explicación para el alto porcentaje de recidivas asociadas especialmente con el glioblastoma. La población de CMC es resistente a los fármacos convencionales debido a propiedades que incluyen recambio lento, alta expresión de proteínas exportadoras de fármacos, aumento de las proteínas de reparación del ADN, alteraciones de las vías de señalización de la muerte celular, y la falta de expresión de las oncoproteínas sensibles a quimioterapia.
Los primeros experimentos que trataron de probar que los progenitores neurales pueden ser transformados en tumores cerebrales se realizaron en cerebros de ratones12,13. Estos estudios demostraron que las células del cerebro de ratón con marcadores progenitores neuronales son más propensas a la transformación oncogénica que las células cerebrales diferenciadas. Singh et al.14, en un estudio que analizaba los tumores del cerebro humano, aislaron células tumorales que expresan CD133. El CD133, también denominado Proemin 1, es una glicoproteína de superficie transmembrana celular, descubierta en células madre hematopoyéticas. Algunas otras células también expresan este marcador, como las células madre neurales embrionarias, las células madre ependimarias adultas, las células precursoras del endotelio funcional y las células madre del cáncer colónico15. Las células madre de los tumores cerebrales humanos demuestran una mayor capacidad de proliferación, de autorrenovación y de diferenciación. Las células CD133+ tienden a reparar sus daños de ADN antes y mejor que las células CD133; de esta forma presentan mayor resistencia a los agentes quimioterapéuticos y a la radiación.
Tumores cerebralesGlioblastomaEl glioblastoma (GB) es un tumor de grado IV, según la clasificación WHO (World Health Organization) con diferenciación astrocítica. Es el tumor cerebral primario más frecuente, y representa el 12-15% de todas las neoplasias intracraneales16. Afecta más a los adultos que a los niños, con una incidencia máxima entre los 45 y 75 años17. Los GB están frecuentemente localizados en la sustancia blanca subcortical de los hemisferios cerebrales. Estos tumores son hipervasculares, altamente celulares, y resistentes a la radio y quimioterapia18. El pronóstico de los pacientes con GB es infausto, a pesar de los progresos realizados en las diferentes modalidades de tratamiento. La tasa de supervivencia media es de aproximadamente 12 meses después del diagnóstico17.
El GB exhibe una heterogeneidad histológica y puede ser clasificado como primario o secundario en base a su presentación clínica. El GB primario, que representa más del 90% de los GBs, no presenta evidencia de una lesión preexistente, se desarrolla rápidamente y se presenta en pacientes de edad avanzada (edad media de 62 años). El GB secundario que progresa desde un astrocitoma difuso (grado II OMS) o desde un astrocitoma anaplásico (grado III OMS), representa menos del 10% de todos los GBs y ocurre en pacientes con una edad media de 45 años17.
En la actualidad, diferentes vías de señalización que conducen al GB han sido asociadas a diferentes subtipos de estos tumores con características genéticas individuales. Estas alteraciones genéticas son debidas a diferentes mutaciones de TP53, a la pérdida de heterocigotos en cromosomas 10y17q, y a la ampliación del receptor del factor de crecimiento epidérmico (EGFR). El EGFR es el gen más frecuente de ampliación y esta correlacionado con su sobreexpresión. El 40% de los GBs primarios19,20 tienen ampliación del EGFR, lo cual raramente ocurre en los secundarios.
El gen PTEN (homólogo de la fosfatasa y tensina), que inhibe la proliferación celular, está mutado casi exclusivamente en los GBs primarios (en el 15-49% de ellos21,22). Alteraciones del gen TP53, por otro lado, ocurren más a menudo en los GBs secundarios que en los primarios (en el 65% de los secundarios y en el 28% de los primarios16).
Las células madre cerebrales anormales son responsables del origen del GB. No es de extrañar que, después de la identificación del CD133 como un marcador de célula madre en los tejidos del SNC, las células CD133+ fueran aisladas en los GBs humanos. Estas células tienen características de células madre cancerígenas23 y migran a través del cerebro, convirtiendo al GB en una enfermedad difusa. Una diferencia en la capacidad oncogénica entre las células GB CD133+ y negativas ha sido demostrada en estudios recientes, en los cuales la expresión de CD133 se asocia a un pronóstico adverso, contribuyendo a la radioquimioresistencia y agresividad del tumor24.
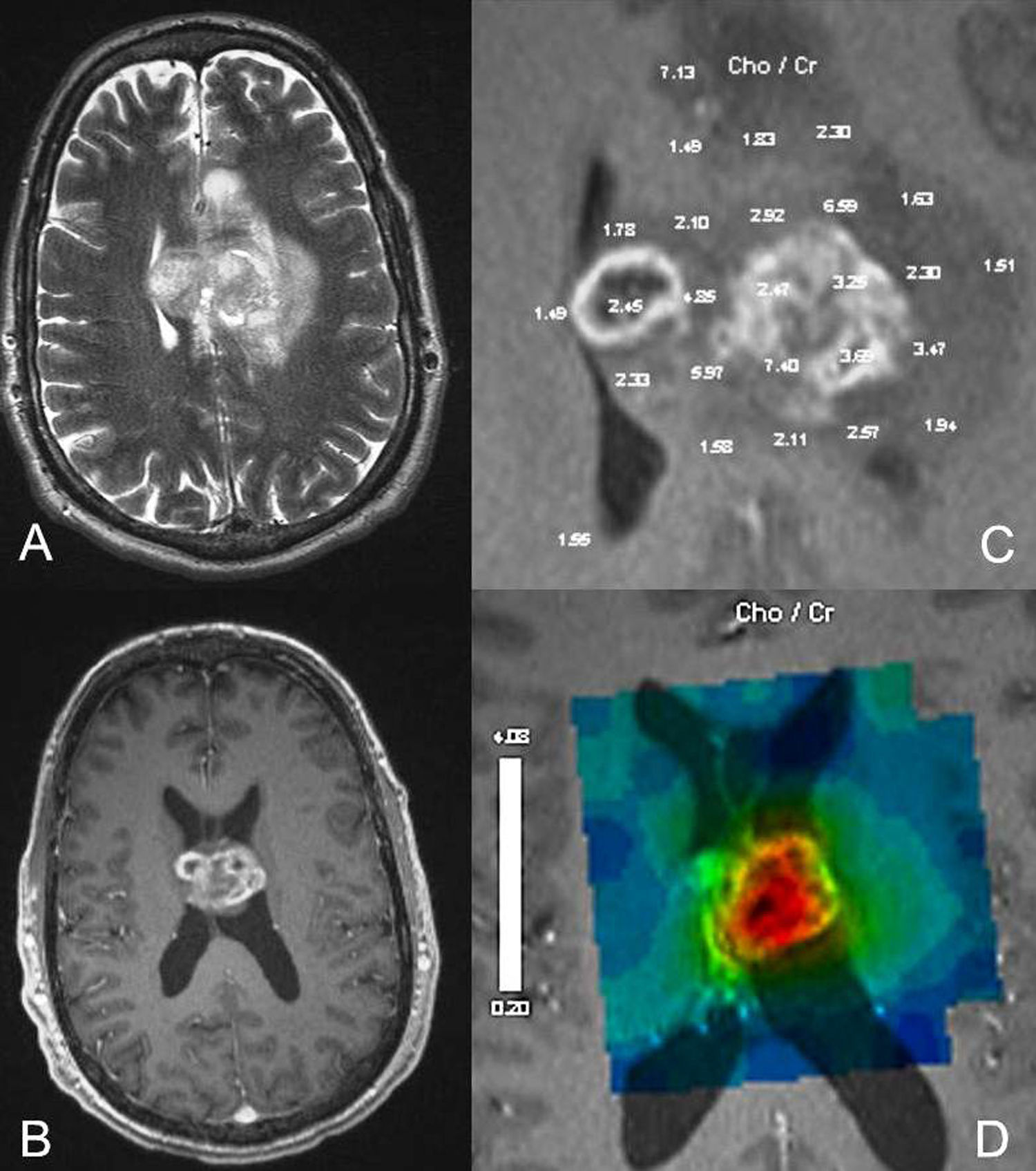
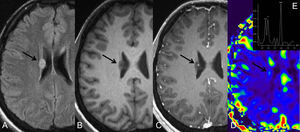
Un estudio realizado por Cohen et al.25 utilizando espectroscopía de protón por RM de todo el cerebro resalta la idea de que los tumores gliales, principalmente los tumores de alto grado, son enfermedades difusas, comprometiendo otras regiones cerebrales además de las que son visibles en la RM convencional (fig. 4). Los autores encontraron una reducción significativa de niveles de N-acetil-aspartato (NAA) en el cerebro de todos los pacientes con tumores gliales al compararlos con el grupo control. Esa reducción se ha observado no solo en exámenes prequirúrgicos, sino también en los postquirúrgicos, corroborando la hipótesis de que existe invasión difusa del SNC por células tumorales.
Imágenes axiales ponderadas en T2 (A) y T1 postcontraste (B) en un glioblastoma muestran una masa con realce que cruza el cuerpo calloso. La espectroscopia de protón (C y D) muestra aumento de la Cho/Cr dentro del tumor y fuera de él apoyando el concepto de que estos tumores son procesos difusos.
No todas las células CD133+ están relacionadas con células madre tumorales. En tumores recurrentes las células CD133+ pueden llevar a una migración celular diferente a las células madre cancerígenas. Pallini et al.26 estudiaron 37 pacientes con GB confirmados que fueron reintervenidos por recurrencia del tumor después de radioquimioterapia. Estos investigadores encontraron un aumento del número de células CD133+ en comparación con otros GBs. También describieron que el aumento de la expresión CD133 se asocia a menudo con una mayor supervivencia, en lugar de un peor pronóstico tal como se esperaría en presencia de células madre tumorales cerebrales.
MeduloblastomaEl meduloblastoma es un tumor de grado IV17, considerado como un tumor neuroepitelial altamente maligno de la fosa posterior, más frecuente en niños que en adultos27, siendo el tumor más común del SNC en este grupo de edad y la segunda neoplasia cerebral infantil después del astrocitoma. También se observa en adultos entre los 20 y los 40 años. Según Roberts et al., un 94,4% de meduloblastomas se localizan en el cerebelo y más de un 75% en el vermis cerebeloso, observándose tumores en los hemisferios cerebelosos, con más frecuencia en adultos que en niños28. Histológicamente, según la clasificación de la OMS, existen cinco variantes: a) clásica, b) desmoplásico/nodular, c) extensivamente nodular, d) anaplásica, y e) de células grandes. Existen otros subtipos menos comunes como el melanocítico y el medulomioblastoma.
Existen varias vías de señalización implicadas en el desarrollo de los meduloblastomas y entre ellas se encuentran las de Wnt, Sonic Hedgehog y Notch. La activación de Wnt se observa en el meduloblastoma clásico, y en estudios de imágenes y quirúrgicos se aprecia infiltración del encéfalo dorsal, mientras que los tumores que activan la vía de Sonic Hedgehog (SHH) están localizados en los hemisferios cerebelosos y han sido relacionados con los tipos desmoplásico/nodular y extensivamente nodular.
La activación de la vía de señalización del SHH juega un rol importante en la formación de meduloblastomas29,30. El receptor Patched (Ptc) es un antagonista de esta vía y mutaciones del Ptc activan la vía SHH31,32. Las mutaciones en el receptor Ptc han sido observadas en meduloblastomas esporádicos y hereditarios (como los que ocurren en el síndrome de Gorlin)33. Yang et al. demostraron que los meduloblastomas pueden ser iniciados por la supresión del Ptc en precursores neuronales granulares o en células madre neurales34. Romer et al. lograron eliminar meduloblastomas en ratones con mutación del Ptc1 al bloquear la vía de señalización del SHH35.
Estudios recientes36 han mostrado que los meduloblastomas pueden dividirse en cuatro subgrupos que tienen diferentes variantes moleculares (Wnt, SHH, grupo C y grupo D). Estos subgrupos tienen diferente prevalencia de edad y sexo, diferentes hallazgos clínicos y pronóstico, por lo que representan enfermedades distintas. El subgrupo Wnt está relacionado con la monosomía del cromosoma 6, tiene una prevalencia similar en todas las edades, es tres veces más común en mujeres que en varones y tiene mejor pronóstico. El subgrupo SHH está asociado con la pérdida de 9q, es más común en niños (menores de tres años) y en adultos (mayores de 16 años), tiene un mejor pronóstico, y es el más relacionado con el meduloblastoma desmoplásico. Los grupos C y D son más comunes en niños de entre 4 y 15 años, se asocian generalmente con enfermedades metastásicas y tienen el peor pronóstico, independientemente de la presencia de metástasis. El meduloblastoma anaplásico se encuentra únicamente en los subgrupos SHH, C y D.
En el síndrome de Turcot, caracterizado por poliposis colónica, GB y meduloblastomas, se aprecia una mutación del gen APC29,33. El APC es un componente de la vía Wingless, que coordina una amplia gama de procesos de desarrollo, incluyendo la proliferación y destino de células progenitoras neurales. Mutaciones en el gen APC, axin y Bcatenin han sido asociadas con meduloblastomas.
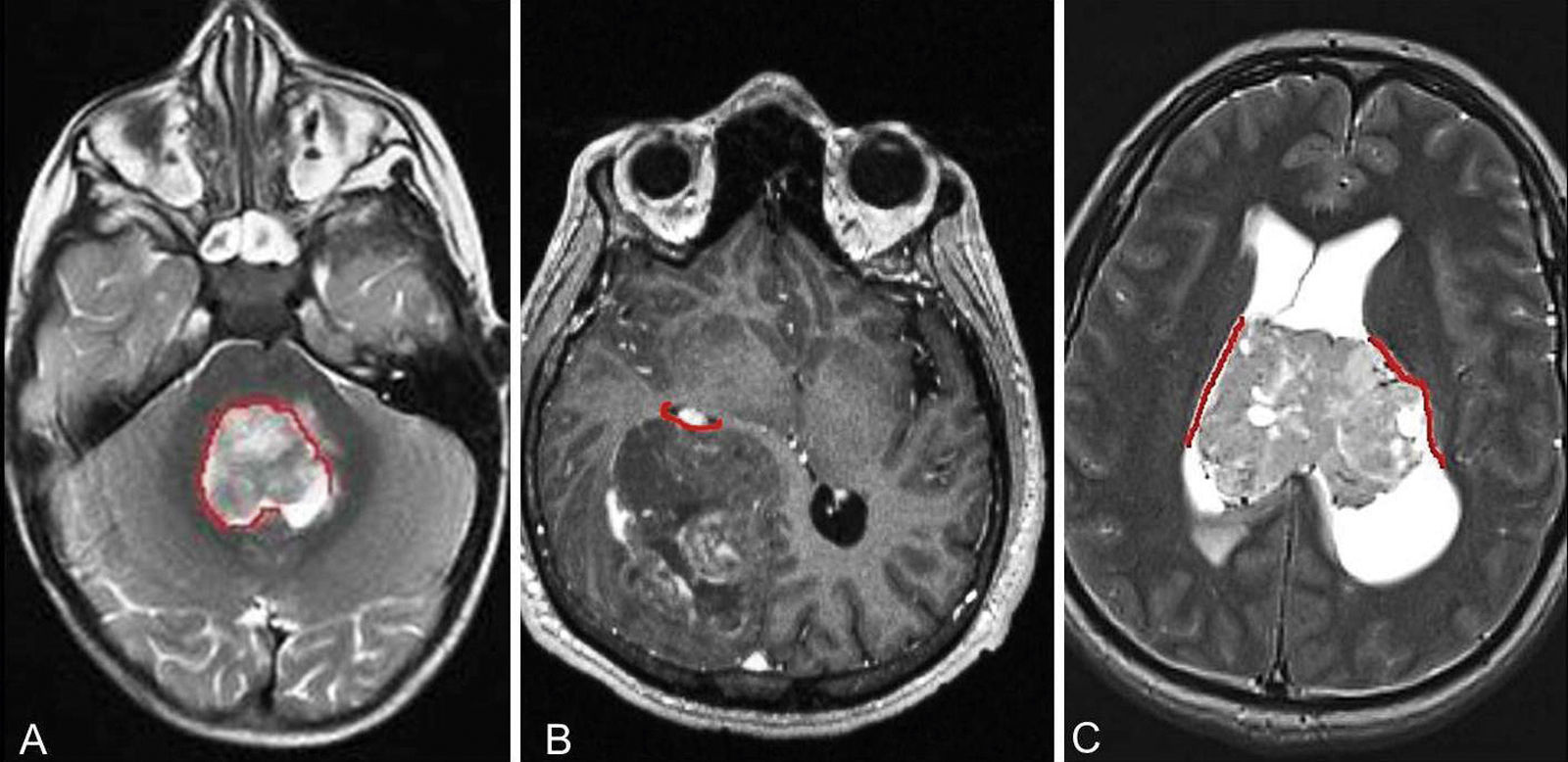
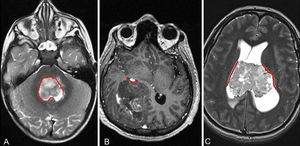
EpendimomaEl ependimoma es un tumor de grado II de crecimiento lento. Puede aparecer en cualquier lugar del sistema ventricular y en el canal espinal (cavidades ependimarias alineadas) (fig. 5). Existen tres tipos de ependimomas según su localización: supratentorial, cerebeloso o infratentorial y medular. Los ependimomas se presentan en todas las edades, aunque la incidencia depende de su ubicación y tipo histológico. McGuire et al., en un análisis retrospectivo de 1.402 pacientes con ependimomas, mostraron que la localización de estos tumores varía según la edad en los niños, pero no en adultos37. Los ependimomas infratentoriales son más comunes en niños más pequeños, y los supratentoriales y los medulares son más comunes en niños mayores y preadolescentes. Son también más prevalentes en varones que en mujeres.
RM cerebral con imágenes axiales ponderadas en T2 (A y C) y T1 postcontraste (B). Los ependimomas se localizan a lo largo de las cavidades revestidas por células ependimarias (líneas rojas) y generalmente en la medula espinal y en el interior del cuarto ventrículo (A) aunque también pueden localizarse en el compartimento supratentorial tanto en los hemisferios cerebrales (B) como intraventricular (C). Los ependimomas supratentoriales tienden a originarse en regiones vecinas a la zona subventricular.
Los patrones histológicos del ependimoma incluyen el celular, papilar, de células claras y tanicítico. A pesar de que todas estas variantes pueden ocurrir en cualquier lugar, algunas de ellas son más comunes en determinados sitios. Los ependimomas celulares se sitúan preferentemente en zonas extraventriculares, mientras que los ependimomas de células claras son más comunes en el compartimento supratentorial y en pacientes jóvenes, y los del tipo tanicítico se encuentran predominantemente en la médula espinal.
Los ependimomas pueden mostrar comportamientos clínicos38 y anomalías cromosómicas diferentes39, según su lugar de origen, aunque histológicamente son indistinguibles y por tanto es posible que representen enfermedades diferentes. Los ependimomas de la fosa posterior y de los hemisferios cerebrales pueden ser anaplásicos, mientras que los tumores de la medula espinal nunca lo son.
Taylor et al.6 plantean la hipótesis de que los ependimomas supratentoriales, infratentoriales y del conducto espinal presentan diferentes hallazgos clínicos debido a que surgen de diferentes poblaciones de células progenitoras neurales. Estos autores también demostraron que algunos genes de los ependimomas supratentoriales (que se encuentran casi siempre en los hemisferios cerebelosos pero adyacentes a los ventrículos laterales), se expresan en la pared de los ventrículos y en la ZSV anterior de los embriones. Algunos genes de los ependimomas espinales se expresan en la pared del canal espinal en desarrollo y en la médula espinal ventrolateral. Se cree que los ependimomas supratentoriales y espinales derivan de células gliales radiales embrionarias. Las células gliales radiales expresan marcadores gliales de superficie, como el transportador de glutamato astrocito específico (GLAST), la proteína de unión lípidica cerebral (BLBP), y también marcadores de superficie de células neurales progenitoras, incluyendo CD133 y Nestin6. Además, las células gliales radiales tienen la característica de autorrenovación y la capacidad de diferenciarse en líneas divergentes neuronales exactamente como lo hacen las células madre. Los ependimomas de la fosa posterior expresan el gen aquaporina 1 y siempre surgen en la ZSV, proyectándose dentro o fuera del cuarto ventrículo.
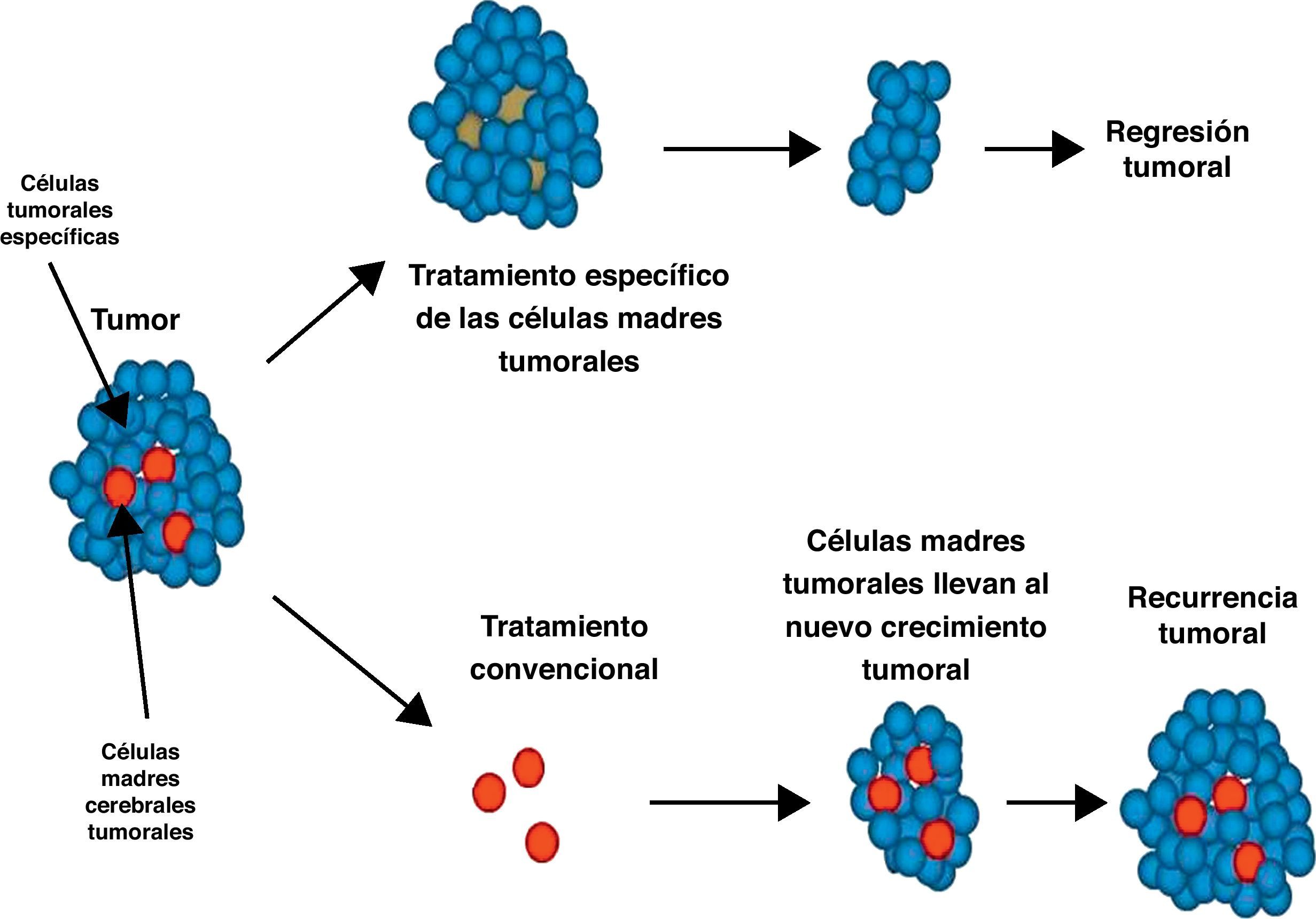
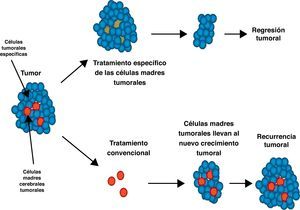
ImplicacionesLa identificación de células madre cancerígenas cerebrales ayuda a comprender los mecanismos moleculares de la oncogénesis cerebral. La idea de que las células madre cancerígenas están relacionadas con la resistencia tumoral a las terapias convencionales tiene importantes implicaciones para nuevas estrategias terapéuticas40. Las terapias convencionales tienen como objetivo destruir las células no tumorales y tumorales pero no las células madre tumorales cerebrales, que finalmente regeneran el tumor (fig. 6). Los tratamientos complementarios para los tumores cerebrales pueden basarse en la jerarquía de la célula madre, tratando de mejorar la eficacia terapéutica y disminuir la recurrencia tumoral. Sin embargo, puesto que no hay evidencia de que la eliminación de las células madre cancerígenas por sí misma pueda conducir a la cura definitiva del cáncer, el objetivo terapéutico debe incluir la eliminación de todas las células tumorales. La presencia de diferentes compartimentos en un tumor puede requerir distintos tratamientos para las células madre cancerígenas y para las otras células tumorales.
Tratamiento convencional versus tratamiento específico de las células madre tumorales. En el tratamiento convencional las células madre cancerígenas cerebrales (CMCC) no son eliminadas, y regeneran una nueva masa tumoral. Si las CMCC son eliminadas con un tratamiento específico, el tumor se reduce. El tratamiento debe atacar ambas líneas celulares.
Las células madre neurales están siendo utilizadas para el tratamiento de algunos procesos como los traumatismos cráneo-encefálicos, y las enfermedades cerebrovasculares y neurodegenerativas. Sin embargo, existe cierta preocupación sobre las consecuencias de estos tratamientos, especialmente con los relacionados con el potencial de las células madre para originar tumores. Recientemente se ha descrito un caso de tumor multifocal derivado de las células madre neurales previamente transplantado como tratamiento para ataxia telangiectasia41, lo que corrobora el origen del tumor cerebral de la célula madre neural.
Desafíos de la imagenLa detección de células madre neurales utilizando estudios de imagen es objeto de innumerables debates. Se han realizado experimentos con métodos de imagen para localizar células madre tumorales cerebrales utilizadas para tratamientos, para rastrear células madre exógenas, y para evaluar el efecto del tratamiento en células madre tumorales y sus efectos en la masa tumoral.
Manganas et al.42, utilizando espectroscopía por RM de protones, encontraron un pico en 1,28ppm en cerebros de ratones embriónicos que se correlacionó con la presencia de células madre neurales. Este pico fue también detectado en el hipocampo de cerebros humanos. Sin embargo, existen varios estudios que no han podido reproducir estos resultados y se han manifestado varias críticas sobre su validez43–47. Se utilizó la descomposición de un valor singular en lugar de la transformación de Fourier como una forma de mejorar la detección de este pico, que tiene una baja relación señal/ruido. Otras preocupaciones acerca de la validez y fiabilidad de esta técnica están relacionadas con el solapamiento espectral, la ampliación de la línea espectral, la distorsión, y la presencia de superposición de líneas de base inherentes de los espectros.
Los métodos de imagen también han sido utilizados para rastrear la migración de células madre implantadas48–50. La RM convencional permite detectar células madre previamente marcadas con partículas férricas magnéticas. Se han observado áreas hipointensas en imágenes ponderadas en T2 en tumores cerebrales y en regiones cerebrales y espinales con lesión previa después de la inyección local o remota de células madre marcadas.
En conclusión, las células madre tienen las características de autorrenovación y diferenciación a lo largo de toda la vida del ser humano, manteniendo una producción continua de células diferenciadas que en el caso de las células madre neurales sería de neuronas, astrocitos y oligodendrocitos. La diferencia principal con las células madre cancerígenas es que en estas últimas se produce una proliferación incontrolada y diferenciación incompleta, que mantiene el crecimiento tumoral. Las células madre y progenitoras por alteraciones epigenéticas y genéticas pueden generar células tumorales y así el cáncer. Por ejemplo en el glioblastoma se han encontrado mutaciones del TP53 o expresión del CD 133+, mientras en el meduloblastoma se ha identificado alteraciones en las vías de señalización Wnt, Sonic Hedgehog y Noth. Los recientes estudios de detección de células madre tumorales y el rastreo de células madre exógenas mediante pruebas de imagen como la espectroscopia nos permitirá evaluar estos tumores, el efecto de tratamientos específicos contra células madre y su efecto en estos tumores.
Autoría- 1.
Responsable de la integridad del estudio: IAMR, DB, MC
- 2.
Concepción del estudio: MC
- 3.
Búsqueda bibliográfica: IAMR, DB, MC
- 4.
Redacción del trabajo: IAMR, DB
- 5.
Revisión crítica del manuscrito con aportaciones intelectualmente relevantes: MC
- 6.
Aprobación de la versión final: MC, IAMR, DB
Los autores declaran no tener ningún conflicto de intereses.